ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
Detta protokoll beskriver isolering av satellitceller från branchiomeric huvudet musklerna i en 9 veckor gammal råtta. Musklerna har sitt ursprung från olika brankiala valv. Därefter satellitcellerna odlas på en plats beläggning av millimeterstorlek för att studera deras differentiering. Detta tillvägagångssätt undviker expansion och passage av satellitceller.
Introduction
Om 1: 500 till 1: 1000 nyfödda uppvisar en klyfta omfattar läppen och / eller gomspalt (CLP); varför detta är den vanligaste medfödda missbildningar hos människor 1. Musklerna i mjuka gommen är kritiska för driften av den mjuka gommen under tal, svälja och suga. Om en kluven av den mjuka gommen är närvarande, är dessa muskler onormalt insatt i den bakre änden av den palatala benet.
Den mjuka gommen rör sig upp och ned under tal, vilket förhindrar luft att strömma ut genom näsan. Barn med en klyfta i gommen har inte denna kontrollfunktion som resulterar i ett fenomen som kallas velopharyngeal dysfunktion 2,3. Även om behandlingsprotokoll är rörlig, tar kirurgisk reparation av mjuka gommen plats i den tidiga barndomen (6-36 månader) 4. De onormalt insatta musklerna i mjuka gommen kan kirurgiskt korrigeras 5-7, dock kvarstår velopharyngeal dysfunktion hos 7% till 30%av patienterna 2,3,8-10.
Förmågan hos skelettmuskel att regenerera genom verkan av satellit celler (SCS) är väl etablerad 11,12. Vid muskelskada är SCS aktiveras och migrera till platsen för skadan. De sedan föröka sig, differentiera och smälta för att bilda nya myofibers eller reparera skadade de 13. Inaktiva SCS uttrycker transkriptionsfaktor Pax7 14,15, medan deras avkomma, de förökar myoblasts dessutom uttrycka myogenic bestämningsfaktor 1 (MyoD) 16. Skilja myoblaster börjar uttrycka myogenin (MyoG) 17. Den terminala differentieringen av myoblaster markeras genom bildning av myofibers, och uttrycket av muskelspecifika proteiner, såsom myosin tung kedja (MyHC) 16,18.
På senare tid har flera strategier använts i regenerativ medicin för att förbättra muskelregenerering av lem muskler 19-23. Specifika studierbranchiomeric huvudet muskler är också viktigt eftersom det var nyligen visat att de skiljer sig från andra muskler i flera avseenden 24. I motsats till lem muskler, har det föreslagits att branchiomeric huvudet muskler innehåller färre SCS 25, regenererar långsammare, och mer fibrös bindväv bildas efter skada 26 Dessutom prolifererande SC från branchiomeric huvudet muskler också uttrycka andra transkriptionsfaktorer. Till exempel är Tcf21, en transkriptionsfaktor för kraniofaciala muskelbildning uttrycks starkt i regenererande huvudet muskler men knappast i regenere lem muskler 25. Musklerna i mjuka gommen av CLP patienter är oftast mindre och mindre välorganiserade jämfört med normala palatinala muskler 27,28. Långsamma och snabba fibrer båda är närvarande i den mjuka gommen muskler men de långsamma fibrerna är mer riklig. Däremot kluven muskler innehålla en högre andel snabba fibrer och även en minskad kapillär tillförseljämfört med normala mjuka gommen muskler 29-31. Snabba fibrer är mer benägna att kontraktion-inducerade skador 31-33. Den medföljande dålig kapillär utbudet kan också främja fibros 34,35. Alla dessa aspekter kan bidra till de fattiga förnyelse av mjuka gommen muskler efter kirurgisk kluven stängning 36. Mot bakgrund av detta är av avgörande betydelse ett protokoll för isolering och karaktärisering av branchiomeric huvudet muskler kaster. Detta ger möjlighet att studera SC biologi branchiomeric huvudet muskler. Dessutom kan nya behandlingsmetoder baserade på vävnadsteknik utvecklas för att främja muskel återhämtning efter kirurgi i CLP och andra villkor komprometterande den kraniofaciala området.
I allmänhet kan SCS erhållas efter dissociation av muskelvävnad 14. Malning, enzymatisk uppslutning, och rivning i allmänhet krävs för att frigöra kaster från sin nisch. SC kan renas genom pre-plating på obelagda rätter 14,37,38, fractionation på Percoll 39,40, eller fluorescent- eller magnetisk cellsortering 41-43. Här presenterar vi en ny ekonomisk och snabb protokoll för isolering av satellitceller från branchiomeric huvudet musklerna i unga vuxna råttor. Detta protokoll är baserad på en tidigare manuskript 14 och speciellt anpassad för små vävnadsprover. Isoleringen av kaster från representativa muskler härrör från den 1: a, 2: a och 4: e brankiala valv beskrivs. Efter isolering, lågt antal satellitceller odlas på extracellulära matris gel fläckar av millimeterstorlek för att studera deras differentiering. Detta tillvägagångssätt undviker kravet på expansion och passage av kaster.
Protocol
Alla experiment som beskrivs häri har godkänts av den lokala styrelsen för djurförsök från Radboud University Nijmegen i enlighet med holländska lagar och förordningar (RU-dec 2013 till 205).
1. Extracellulär Matrix Gel Ställen
- Utför följande steg en dag före isolering:
- Tina en alikvot extracellulär matrisgel (100 | il) vid 4 ° C under minst 1,5 h. Späd 1:10 i Dulbeccos modifierade Eagles medium; med 4500 mg / I glukos, 4 mM L-glutamin, och 110 mg / ml natriumpyruvat (DMEM). Håll den extracellulära matrisen gel vid 4 ° C vid alla tidpunkter. Obs: Plötsliga temperaturförändringar kommer att resultera i ojämn beläggning och kristallbildning.
- Håll den utspädda extracellulär matris gellösningen på is under 15 minuter.
- Pre-chill en 20 pl mikropipett under 10 minuter.
- Put 8-brunnars kammarobjektglas i en 100 mm petriskål och flytta över skålen på en kall yta (t.ex. en kylklamp) under 10 min.
- Använd pre-kylda mikropipett att sätta en droppe av 10 pl extracellulärmatrix gel i varje brunn. Håll petriskål på den kalla ytan i minst ytterligare 7 minuter (Figur 1A).
- Helt ta bort den återstående extracellulära matrisgel (Figur 1B), och torka brunnarna vid 37 ° C över natten.
2. Dissektion av Head Muscles (tugg, Digastric och Levator Veli Palatini)
- Före dissektion, förbereda 50 ml fosfatbuffrad saltlösning (PBS) kompletterad med 2% penicillin-streptomycin (P / S). Håll på is.
- Efter avlivning av en ung vuxen råtta (9 veckor) med CO2 / O2, halshugga huvudet och ta bort huden från huvudet. Överför huvudet till iskall PBS kompletterat med 2% P / S i ett 50 ml rör.
- Tuggmuskel (som härrör från den 1: a brankiala bågen)
- Placera huvudet med ena sidan upp på en silikon pad och fixa med injektions needles (Figur 2A).
- Identifiera öronspottkörteln och ansiktsnerven (Figur 2A). Exponera den djupa fascia täcker körteln. Skär fascia och ta bort genomföringen med dissektion sax. Identifiera den yttre hörselgången. Spåra ansiktsnerven från stylomastoid foramen och försiktigt bort tids, zygomatic och buckala grenar med en skalpell blad nr 15.
- Frigör den ytliga chef för tuggmuskel genom att ta bort fascia. Identifiera både ytliga och djupa cheferna för tuggmuskel. Spåra ytliga huvudet tills dess tjocka tendinöst aponeurosis in i zygomatic process av överkäken.
- Separera senan från sitt ursprung på zygomatic process med en rak pincett. Skär det med ett skalpellblad nr 15 eller dissektion sax och försiktigt liv det (Figur 2B).
- Dissekera ytliga chef för tugg tills dess införande i vinkel och sämre halvan av than sidoyta ramus av underkäken med ett skalpellblad nr 15 (figur 2C). Nu, helt ta bort muskeln.
- Posterior buk digastric muskeln (härledd från 2: a brankiala bågen)
- Placera huvudet i ryggläge på silikon pad och fixa med kanyler (Figur 3A).
- Ta bort underhudsfett liggande både sublingual och submandibular körtlar. Ta sedan bort den ytliga fascian och körtlar som använder dissektion sax. Exponera digastric muskeln (främre och bakre mage).
- Håll den främre senan av den bakre magen med en rak pincett, skära, och dissekera den försiktigt tills sitt ursprung i trum bulla (Figur 3B). Gör samma sak på den kontralaterala sidan.
- Levator veli palatini muskel (härledd från den 4: e brankiala bågen)
- Efter dissektion av den bakre magen av digastric muskeln, Lokalisera stylohyoid muskler, dra den i sidled, och försiktigt bort det (Figur 4A).
- Lokalisera senan av levator veli palatini som infogar vid trum bulla (Figur 4A). Dissekera försiktigt och skär den på båda sidor.
- Leta efter luftstrupen och matstrupen som körs bakom den. Lyft matstrupen, och exponera svalget, struphuvudet och mjuka gommen.
- Lokalisera det område av den mjuka gommen där levator Veli palatini sätts in och skär loss (Figur 4B).
Obs: Direkt efter dissektion, försiktigt bort senor och bindväv från varje muskel under lupp. Sänk alla prover snabbt i etanol 70%, och överföra dem till iskall PBS kompletterad 2% P / S i ett 15 ml rör.
3. Isolering av satellit celler
- Utför följande framställningsstegen för SC isolering från 3 muskelgrupper:
- Bered 7,5 ml av 0,1% pronas i DMEM. Filtrera lösningen genom ett 0,22 pm filter. Pre-värma lösningen vid 37 ° C i ett vattenbad under 10 minuter före isolering.
- Bered 35 ml DMEM kompletterat med 10% hästserum (HS) och ett% P / S. Även pre varm vid 37 ° C i ett vattenbad.
- Bered 15 ml odlingsmedium, som består av DMEM kompletterat med 20% fetalt bovint serum (FBS), 10% HS, 1% P / S och 1% kycklingembryo extrakt (CEE). Pre-varm vid 37 ° C i ett vattenbad.
- Pre-coat sex plastpipetter (10 ml) med HS och torra i minst 10 minuter före användning.
- I kulturen huv, överföra varje muskel i en brunn i en 6-brunnsplatta. Använda dissektion sax, klippa muskel i små bitar av ca 2 mm. Var noga med att inte finhacka vävnaden för mycket.
- Tillsätt försiktigt 2,5 ml av 0,1% pronas lösning till varje brunn och inkubera vid 37 ° C under 60 minuter. Skaka försiktigt plattan efter 20, 40 och 60 minuter. Obs: Den exakta duration av inkuberingen beror på faktorer som ålder och stam av djuren.
- Övervaka under mikroskop. Kontrollera muskelfragment och stoppa den enzymatiska nedbrytning när fibrerna buntar får en lossade utseende (Figur 5).
- Lägg 2,5 ml DMEM kompletterad med 10% HS och 1% P / S. Överför till en 15 ml rör och centrifugera rören vid 400 xg under 5 minuter. Kasta bort supernatanten genom dekantering.
- Tillsätt 5 ml DMEM kompletterat med 10% HS och 1% P / S. Pipet lösningen upp och ner med en 10 ml plastpipett (rivning) under minst 20 gånger för att homogenisera vävnaden.
- Centrifugera rören vid 200 xg under 4 minuter. Samla upp supernatanten och överför till en 15 ml tub.
- Tillsätt 5 ml DMEM kompletterat med 10% HS och 1% P / S. Pipettera igen med en 10 ml plastpipett tills vävnadsfragment passerar lätt genom pipetten.
- Centrifugera rören vid 200 xg under 4 min och samla supernatanten i en 15 ml tub.
- Put en cell sil (40 um) på en 50 ml rör och överför supernatanten innehållande de dissocierade celler på filtret. Tvätta med 1 ml DMEM för maximal cellåterhämtning.
- Centrifugera rören vid 1000 x g under 10 min och häll bort supernatanten med en pipett.
- Återsuspendera pelleten i 300 | il odlingsmedium och räkna cellerna i en hemocytometer.
4. Differentiering av satellitceller på Extracellulär matrisgel Ställen
- Späd cellsuspensionen för att erhålla 1,5 x 10 3-celler i 10 | il odlingsmedium.
- Säkra locken av kamrarna glider med tejp och markera fläckarna med en svart markering på undersidan av objektet glas.
- Med hjälp av en mikropipett, placera en droppe av 10 pl cellsuspension på den extracellulära matrisgel plats. Kontrollera under mikroskop huruvida droppe cellsuspensionen har placerats korrekt på plats. Inkubera under sex timmar vid 37 ° C.
- Försiktigly lägga 400 pl odlingsmedium (DMEM kompletterat med 20% FBS, 10% HS, 1% P / S och 1% CEE) och inkubera under tre dagar vid 37 ° C.
Notera: Vid denna punkt, är nyligen isolerade SC utsätts för massiv trauma (enzymatisk Digest och hårda rivning) och de måste återhämta sig. Stör inte cellerna under de första tre dagarna 37. Därefter kan odlingsmediet ändras beroende på vilken typ av experiment.
Den extracellulära matrisen gel fläckar kan ympas med en hög celltäthet (1,5-2,5 x 10 3/20 il) för differentieringsanalys. Odlingsmedium (DMEM kompletterat med 20% FBS, 10% HS, 1% P / S och 1% kycklingembryo extrakt) kan bytas var tredje dag. - Alternativt, om expansion och passerar önskas följande steg:
- Tina en alikvot extracellulär matrisgel (500 | il) vid 4 ° C under minst 1,5 h. Späd 1:10 i DMEM och följa rekommendationerna i punkt 1.1.1.
- Förhands kyla en 10 ml pipett under 10 min vid 4 &# 176; C.
- Överför tre T75-kolvar på en kall yta (t.ex. en kylklamp) under 10 min.
- Använd pre-kylda pipett att sätta 1 ml extracellulära matrisgel i varje kolv. Kontrollera att ytan täcks helt. Håll kolvarna på den kalla ytan i minst ytterligare 7 minuter (Figur 1A).
- Helt ta bort den återstående extracellulära matrisen gel med en 10 ml pipett, och torka brunnarna vid 37 ° C under 1 timme.
- Efter att ha räknat, resuspendera nyisolerade kaster i 10 ml odlingsmedium (DMEM kompletterat med 20% FBS, 10% HS, 1% P / S och 1% kycklingembryo extrakt) och utsäde i förväg belagda T75-kolvar.
- Efter tre dagar, ändra mediet (och var tredje dag) tills 80% konfluens uppnåtts. För passage, tvätta T75-kolvar tre gånger med PBS. Nästa tillsätt 1 ml 0,25% trypsin-lösning och inkubera under tre minuter vid 37 ° C. Resuspendera i 9 ml odlingsmedium (DMEM kompletterat med 20% FBS, 10% HS, 1% P / Soch en% kycklingembryoextrakt) och centrifugera vid 200 xg under 5 minuter. Kasta bort supernatanten. Efter att ha räknat, resuspendera 1 x 10 6 celler av 1000 il odlingsmedium och frysa cellerna.
Representative Results
Med hjälp av detta protokoll, tuggmuskel (en sida) ger 0,8-1 x 10 6 celler, digastric muskeln (bakre mage) ger 1,5-2 x 10 5 celler, och levator Veli palatini muskel ger 1-1,5 x 10 5 celler. Cellutbyten beror på muskeltypen, stam, och ålder av djuret. För jämförelse mellan de tre muskelgrupper, var nyligen isolerade kaster såddes vid samma celltäthet (1,5 x 10 3/10 il). Direkt efter isolering, mer än 90% av de nyligen isolerade cellerna uttrycker Pax7 (Figur 6).
Dag 4, 7 och 10 kulturerna färgades med antikroppar mot Pax7, MyoD, MyoG och MyHC immunofärgning. Fem godtyckliga fält räknades per kultur med hjälp av en 20X mål. Vid dag 4 Pax 7 och Myo D uttrycks i alla muskelgrupper (figurerna 6 och 7 och 8), men avkomma SatCs från tugg och digastric muskler börjar Expressjunger myogenin tidigare än levator Veli palatini muskel (Figur 9). Vid dag 10, är uttrycket av MyoG kraftigt reduceras i alla grupper (figur 9). Några dagar efter ympning på den extracellulära matrisen gel fläckar, de prolifererande cellerna börjar att smälta och bilda multikärnförsedda myotuber som uttrycker myosin-tung kedja. Små myotuber syns tydligt vid dag 7 (Figur 10). Vid dag 10, kan observeras ryckningar i myotuber (Video 1).

Figur 1:. Extracellulära matris gel fläckar i en kammarobjektglas (A) för enkel hantering, placera 8-brunnars kammarobjektglas i ett 100 mm petriskål. Pipet 10 il extracellulärmatrix gel i varje kammare och lägga den på en kall yta (7 min). (B) avdelningen glida efter överskottet extracellulärmatrix gel avlägsnas.

Figur 2:. Dissekering av tuggmuskel (A) chef för djuret i en sidovy. Ear (E), öronspottkörteln (P) och ansiktsnerven (VII). (B) tendinöst aponeurosis (Te) i ytliga chef för tuggmuskel (MS) och temporal muskel (T). Separera senan från dess införande med en tång. (C) dissekera försiktigt muskeln tills dess införande vid ramus av underkäken. E: öra, P: öronspottkörteln, VII: ansiktsnerven, T: Temporal muskel, MS: ytlig chef för tuggmuskel, Te: senan, Mp: djup chef för tuggmuskel.

Figur 3: Dissekering av den bakre magen av digastric muskeln (.A) chef för djuret i ryggläge. Lokalisera submandibular körteln (SG), tuggmuskel (M), ansiktsnerven (VII) och sternocleidomastoideus (SCM). Ta bort submandibulära körteln. (B) Lokalisera digastric muskel främre (AD) och bakre mage (PD). Med en rak pincett, ta den främre senan av den bakre buken, skär den och dissekera den försiktigt tills sitt ursprung i trum bulla (ty). E: öra, Sg: submandibular körteln, VII: ansiktsnerven, M: tuggmuskeln, SMC: sternocleidomastoideus, AD: anterior mage digastric muskel, PD: bakre mage digastric muskel, Ty: Tympanic bulla.

Figur 4:. Dissekering av levator Veli palatini muskel (A) Generalen beskådar efter dissektion av digastric muskeln (bakre magen). Stylohyoid muskel (St) och sena i levatorveli palatini kan lokaliseras. Notera luftstrupen (T) och esofagus (Es) som löper bakom den. (B) Efter att lyfta luftstrupen och matstrupen svalget (P) är utsatt. Insättningen av levator veli palatini i den mjuka gommen är nu synlig. Pilen indikerar dissekerade mjuka gommen med levator Veli palatini musklerna vid båda sidor. E: öra, St: stylohyoid muskel, VII: ansiktsnerven, M: tuggmuskeln, AD: anterior mage digastric muskel, PD: bakre mage digastric muskel, T: luftstrupe, Es: matstrupen, P: svalg, * levator veli palatini muskel .

Figur 5: Utseende av muskelvävnad (A) före och (B) efter enzymatisk uppslutning med pronas. Lägg märke till att muskelknippen verkar lossas efter enzymatisk spjälkning.
Figur 6: Pax 7 immunofärgning Nyligen isolerade SCS, som tillämpas på extracellulär matrix gel vid slutet av isoleringen (ca 6 timmar efter den första vävnads spjälkning).. Fem godtyckliga fält räknades med hjälp av en 10X mål med ett genomsnitt på 210 celler per fält. Cirka 90% av cellerna är Pax 7 positiva. DAPI: blå, Pax7: rött. Skalstreck, 100 | j, m.

Figur 7:. Pax 7, MyoD immunofärgning Dag 4, 7 och 10 kulturerna färgades med antikroppar mot Pax7 och MyoD immunfärgning. (A - C) och (D - F) Representativa mikrofotografier av dag 4 och 7 kulturer från tuggmuskel. (G och H + och MyoD + kärnor per mikroskopiska fält räknades och uttryckt i procent av det totala antalet kärnor (DAPI). DAPI: blå, Pax7: rött, och MyoD: grön. Vågar bar, 100 nm. Klicka här för att se en större version av denna siffra.

Figur 8:. Fördelning av Pax7 ± / MyoD ± i kulturer från mononukleära celler i odlingar från tugg, digastric och levator Veli palatine muskel (A - C) Dag 4, 7 och 10 kulturer färgades med antikroppar mot Pax7 och MyoD immun. Det totala antalet celler är baserad på av det totala antalet kärnor (DAPI). (D) Data kvantifiering av Pax7 ± / MyoD ± cells. Klicka här för att se en större version av denna siffra.

Figur 9:. Myogenin immunfärgning Dag 4, 7 och 10 kulturerna färgades med antikroppar mot myogenin. (A - D) Representativa mikrofotografier av dag 4 och 7 kulturer från levator Veli palatine muskler. (E) Antalet MyoG + kärnor per mikroskopiskt fält räknades och uttrycktes som en procentandel av det totala antalet kärnor (DAPI). (F) Data kvantifiering av MyoG + celler. DAPI: blå, myogenin: grön. Vågar bar, 100 nm. Klicka här för att se en större version av denna figure.

Figur 10:. Myosin tung kedja immunfärgning Dag 4, 7 och 10 kulturerna färgades med antikroppar mot myosin tung kedja (MyHC). Representativa mikrofotografier av dag 4, 7 och 10 kulturer från den digastric (DIG) muskel. Vid dag 7, små myotuber finns samtidigt dag 10 långa och väl organiserade myotuber är uppenbara. Vågar bar, 200 nm. Klicka här för att se en större version av denna siffra.
Video 1:.. Myotube ryckningar Exempel på två representativa fält med ryckningar myotuber visas för dagen 10 kulturer från digastric muskel Klicka här för att se filmen.
Discussion
SC från olika branchiomeric huvudet muskler isolerades från en 9 veckor gammal Wistar-råtta och odlades direkt på extracellulär matrix gel fläckar utan föregående expansion och passaging. Efter isolering räknades cellerna och såddes vid samma celltäthet. För den parallella isolering av tre olika muskler, tar denna metod ca 4 h. För att undvika kontaminering kultur, är ett kritiskt steg i snabb tvättning i alkohol 70% efter dissektion av musklerna.
Under SC isolering är det viktigt att skära muskelvävnaden i små bitar (ca 2 mm) men undvika för mycket mals eftersom detta kommer att resultera i en liten cellutbyte på grund av cellskada. Dessutom måste varaktigheten av den enzymatiska digere kontrolleras noggrant under mikroskop för att undvika ytterligare skador. Syftet med matsmältning är att dissociera myofibers. Eftersom mer än 90% av de isolerade cellerna uttrycker Pax7, behövs ingen ytterligare rening behövs (figurerna 6-8).Detta undviker extra reningssteg i andra metoder såsom pre-plating på obelagda rätter 14,37,38, fraktionering på Percoll 39,40, eller fluorescent- eller magnetisk cellsortering 41,43. För finfördelning är det viktigt att inducera skjuvning mellan vävnadsfragment och öppnandet av pipettspetsen eftersom detta tillåter den mekaniska frikopplingen av kaster. Om finfördelning med en 10 ml pipett (innerdiameter tips: 1 mm) är svårt, en 5 ml (innerdiameter spets: 2 mm) kan pipett användas först. Alternativt kan glas Pasteur pipetter skäras vid önskad diameter och användas. Denna metod är enkel, effektiv och tillåter samtidig isolering av SC från olika muskelprover.
Odlingsplattorna för SCS kan också beläggas med gelatin eller kollagen, men våra tidigare studier visar att extracellulär matris gel är mycket bättre för underhåll av den myogena potential än kollagen 38. De extracellulära matris gel fläckar avmillimeterstorlek (10 | j, l / O 2 mm eller 20 | j, l / O 4 mm) möjliggör studiet av proliferation och differentiering av SCS med begränsade mängder celler. För differentiering analysen omkring 8 till 20 gånger färre celler erfordras jämfört med en 24-brunnsplatta (Ø 15,6 mm), och ca 80 till 200 gånger färre jämfört med 35 mm Petri-skålar (ø 35 mm) 14,38.
Eftersom extracellulär matrisgel är dyrt, är denna metod också mer kostnadseffektiva. Dessutom kan de kammare diabilder ersättas av plasttäckglas för att ytterligare minska kostnaderna. För framställning av den extracellulära matrisen gelén fläckar torkning över natten av kammarobjektglasen är viktigt. Eftersom den extracellulära matrisen gel fläckar är transparenta, är det nödvändigt att märka de fläckar vid bottensidan med hjälp av bakgrundsbelysning. Kamrarna glasen fixeras i en petriskål för enkel hantering. Ytterligare expansion cellodling är inte nödvändigt, vilket ger möjlighet att studera kaster av smalLer muskler eller små muskelprover. Alternativt, t.ex. PCR eller muskel konstruktioner om fler celler behövs, kan de nyisolerade kaster först utökas i T75-kolvar som anges ovan.
SC isoleras med hjälp av detta protokoll är inte lämpliga för ytterligare rening med flödescytometri omedelbart efter isolering. Uppslutningen med pronas orsakar omfattande nedbrytning av ytan antigener 14. Hästserum och fetalt bovinserum som används för cellodling måste först vara ordentligt karakteriseras före isolering, såsom olika partinummer differentiellt påverkas myoblaster proliferation och differentiering.
Under de senaste åren, finns det ett växande intresse för musklerna som härrör från brankiala valv och huvudet mesoderm (t.ex. de extraokulära muskler) 24. Det har tydligt visat att huvud och lem muskler har mycket olika egenskaper. Tuggmuskel från gamla djur tycks återTain deras förnyelseförmåga i jämförelse med lem muskler 25,26. SC från extraokulära muskler har en robust tillväxt och differentiering kapacitet jämförbar med kaster från huvudet muskler, och visar en större inympning potential än lem muskel SCS 24.
Fördelningen och myosin fibertyp sammansättning varierar mellan muskelgrupper och även mellan olika arter. Muskler som härrör från den första brankiala bågen hos människa innehåller både långsamma och snabba fibrer (subtyper IIA och IIx), neonatal myosiner och myosiner typiska för att utveckla hjärtmuskeln. Hos gnagare dessa muskler innehåller ca 95% snabba fibrer myosin IIA och IIb) 44-46. Studier på fågel muskler visar att kaster från olika muskelfibertyper varierar i differentieringskapacitet. SC från snabba fibrer bara differentiera till snabba muskelfibrer, medan kaster från långsamma fibrer kan differentiera till både fibertyper 47. Dessutom har andelen SC i snabb muskelfibrer är lägre än i långsam muskelfibrerna 48,49. Detta tyder på att fördelningen fibertypen måste tas hänsyn till studier på muskler i kraniofacial området. I likhet med gomspalt muskler, det bilproduktionen i gnagare innehåller nästan uteslutande snabba fibrer 50. Av den anledningen, kaster från LVP är lämpliga för prekliniska studier inom gomspalt.
Detta protokoll ger nya möjligheter att studera kaster härrör från branchiomeric huvudet muskler eller andra mindre muskler eller mindre muskler prover. Detta kommer att underlätta utvecklingen av nya behandlingsmetoder för att förbättra regenerering av muskler i maxillofacial område under förhållanden som gomspalt, utan även i andra förhållanden som påverkar mindre muskler.
Materials
| Name | Company | Catalog Number | Comments |
| Hypodermic Needle 25 G 0.5 x 25 m | BD Microlance | 300400 | |
| Dissecting scissors | Braun | BC154R | |
| Micro forceps straight | Braun | BD330R | |
| Surgical Scalpel Blade No. 15 | Swann-Morton | 0205 | |
| Alcohol 70% | Denteck | 2,010,005 | |
| Permanox Slide, 8 Chamber | Thermo Scientific | 177445 | |
| 6 well cell culture plate | Greiner bio-one | 657160 | |
| Cell Culture Dishes (100 x 20 mm) | Greiner bio-one | 664160 | |
| 15 ml sterile conical centrifuge tube | BD Biosciences | 352097 | |
| 50 ml sterile conical centrifuge tube | BD Biosciences | 352098 | |
| Cell strainer (40 μm) | Gibco | 431750 | |
| 10 ml serological pipette | Greiner bio-one | 607180 | |
| 20 µl FT20 | Greiner bio-one | 774288 | |
| Matrigel, Phenol-Red Free | BD Biosciences | 356237 | 10 ml |
| Pronase | Calbiochem | 53702 | 10 KU |
| Phosphate Buffered Saline | Gibco | 14190-144 | 500 ml |
| Dulbecco's Modified Eagle Medium, high glucose, GlutaMAX Supplement, pyruvate | Gibco | 10569-010 | 500 ml |
| Fetal Bovine Serum | Fisher Scientific | 3600511 | 500 ml |
| Horse Serum | Gibco | 26050088 | 500 ml |
| Penicillin-Streptomycin (10,000 U/ml) | Gibco | 15140-122 | 100 ml |
| Chicken Embryo Extract | MP Biomedicals | 2850145 | 20 ml |
References
- Gritli-Linde, A. Molecular control of secondary palate development. Developmental Biology. 301, 309-326 (2007).
- Marrinan, E. M., LaBrie, R. A., Mulliken, J. B. Velopharyngeal function in nonsyndromic cleft palate: relevance of surgical technique, age at repair, and cleft type. The Cleft Palate-Craniofacial Journal. 35, 95-100 (1998).
- Morris, H. L. Velopharyngeal competence and primary cleft palate surgery, 1960-1971: a critical review. The Cleft Palate Journal. 10, 62-71 (1973).
- Mossey, P. A., Little, J., Munger, R. G., Dixon, M. J., Shaw, W. C. Cleft lip and palate. Lancet. 374, 1773-1785 (2009).
- Boorman, J. G., Sommerlad, B. C. Musculus uvulae and levator palati: their anatomical and functional relationship in velopharyngeal closure. British Journal of Plastic Surgery. 38, 333-338 (1985).
- Bae, Y. C., Kim, J. H., Lee, J., Hwang, S. M., Kim, S. S. Comparative study of the extent of palatal lengthening by different methods. Annals of Plastic Surgery. 48, 359-362 (2002).
- Braithwaite, F., Maurice, D. G. The importance of the levator palati muscle in cleft palate closure. British Journal of Plastic Surgery. 21, 60-62 (1968).
- Inman, D. S., Thomas, P., Hodgkinson, P. D., Reid, C. A. Oro-nasal fistula development and velopharyngeal insufficiency following primary cleft palate surgery--an audit of 148 children born between 1985 and 1997. British Journal of Plastic Surgery. 58, 1051-1054 (2005).
- Phua, Y. S., de Chalain, T. Incidence of oronasal fistulae and velopharyngeal insufficiency after cleft palate repair: an audit of 211 children born between 1990 and 2004. The Cleft Palate-Craniofacial Journal. 45, 172-178 (1990).
- Kirschner, R. E., et al. Cleft-palate repair by modified Furlow double-opposing Z-plasty: the Children's Hospital of Philadelphia experience. Plastic and Reconstructive Surgery. 104, 1998-2010 (1999).
- Mauro, A. Satellite cell of skeletal muscle fibers. The Journal of Biophysical and Biochemical Cytology. 9, 493-495 (1961).
- Yablonka-Reuveni, Z. The skeletal muscle satellite cell: still young and fascinating at 50. The Journal of Histochemistry and Cytochemistry. 59, 1041-1059 (2011).
- Ten Broek, R. W., Grefte, S., Von den Hoff, J. W. Regulatory factors and cell populations involved in skeletal muscle regeneration. Journal of Cellular Physiology. 224, 7-16 (2010).
- Danoviz, M. E., Yablonka-Reuveni, Z. Skeletal muscle satellite cells: background and methods for isolation and analysis in a primary culture system. Methods in Molecular Biology. 798, 21-52 (2012).
- Seale, P., et al. Pax7 is required for the specification of myogenic satellite cells. Cell. 102, 777-786 (2000).
- Yablonka-Reuveni, Z., et al. The transition from proliferation to differentiation is delayed in satellite cells from mice lacking MyoD. Developmental Biology. 210, 440-455 (1999).
- Zammit, P. S., Partridge, T. A., Yablonka-Reuveni, Z. The skeletal muscle satellite cell: the stem cell that came in from the cold. The Journal of Histochemistry And Cytochemistry. 54, 1177-1191 (2006).
- Andres, V., Walsh, K. Myogenin expression, cell cycle withdrawal, and phenotypic differentiation are temporally separable events that precede cell fusion upon myogenesis. The Journal of Cell Biology. 132, 657-666 (1996).
- Fukushima, K., et al. The use of an antifibrosis agent to improve muscle recovery after laceration. The American Journal of Sports Medicine. 29, 394-402 (2001).
- Grefte, S., Kuijpers-Jagtman, A. M., Torensma, R., Von den Hoff, J. W. Skeletal muscle fibrosis: the effect of stromal-derived factor-1α-loaded collagen scaffolds. Regenerative Medicine. 5, 737-747 (2010).
- Jackson, W. M., Nesti, L. J., Tuan, R. S. Potential therapeutic applications of muscle-derived mesenchymal stem and progenitor cells. Expert Opinion on Biological Therapy. 10, 505-517 (2010).
- Sato, K., et al. Improvement of muscle healing through enhancement of muscle regeneration and prevention of fibrosis. Muscle, & Nerve. 28, 365-372 (2003).
- Tatsumi, R., Anderson, J. E., Nevoret, C. J., Halevy, O., Allen, R. E. HGF/SF is present in normal adult skeletal muscle and is capable of activating satellite cells. Developmental Biology. 194, 114-128 (1998).
- Stuelsatz, P., et al. Extraocular muscle satellite cells are high performance myo-engines retaining efficient regenerative capacity in dystrophin deficiency. Developmental biology. , (2014).
- Ono, Y., Boldrin, L., Knopp, P., Morgan, J. E., Zammit, P. S. Muscle satellite cells are a functionally heterogeneous population in both somite-derived and branchiomeric muscles. Developmental Biology. 337, 29-41 (2010).
- Pavlath, G. K., et al. Heterogeneity among muscle precursor cells in adult skeletal muscles with differing regenerative capacities. Developmental Dynamics. 212, 495-508 (1998).
- Koo, S. H., Cunningham, M. C., Arabshahi, B., Gruss, J. S., Grant, J. H. 3rd The transforming growth factor-beta 3 knock-out mouse: an animal model for cleft palate. Plastic and Reconstructive Surgery. 108, 938-948 (2001).
- Fara, M., Brousilova, M. Experiences with early closure of velum and later closure of hard palate. Plastic and Reconstructive Surgery. 44, 134-141 (1969).
- Lindman, R., Paulin, G., Stal, P. S. Morphological characterization of the levator veli palatini muscle in children born with cleft palates. The Cleft Palate-Craniofacial Journal. 38, 438-448 (2001).
- Hanes, M. C., et al. Contractile properties of single permeabilized muscle fibers from congenital cleft palates and normal palates of Spanish goats. Plastic and Reconstructive Surgery. 119, 1685-1694 (2007).
- Rader, E. P., et al. Contraction-induced injury to single permeabilized muscle fibers from normal and congenitally-clefted goat palates. The Cleft Palate-Craniofacial Journal. 44, 216-222 (2007).
- Rader, E. P., et al. Effect of cleft palate repair on the susceptibility to contraction-induced injury of single permeabilized muscle fibers from congenitally-clefted goat palates. The Cleft Palate-Craniofacial Journal. 45, 113-120 (2008).
- Macpherson, P. C., Dennis, R. G., Faulkner, J. A. Sarcomere dynamics and contraction-induced injury to maximally activated single muscle fibres from soleus muscles of rats. The Journal of Physiology. 500 (Pt 2), 523-533 (1997).
- Koch, K. H., Grzonka, M. A., Koch, J. The pathology of the velopharyngeal musculature in cleft palates). Annals of Anatomy. 181, 123-126 (1999).
- Fara, M., Dvorak, J. Abnormal anatomy of the muscles of palatopharyngeal closure in cleft palates: anatomical and surgical considerations based on the autopsies of 18 unoperated cleft palates. Plastic and Reconstructive Surgery. 46, 488-497 (1970).
- Carvajal Monroy, P. L., Grefte, S., Kuijpers-Jagtman, A. M., Wagener, F. A., Von den Hoff, J. W. Strategies to Improve Regeneration of the Soft Palate Muscles After Cleft Palate Repair. Tissue Engineering. Part B, Reviews. , (2012).
- Grefte, S., Kuijpers, M. A., Kuijpers-Jagtman, A. M., Torensma, R., Von den Hoff, J. W. Myogenic capacity of muscle progenitor cells from head and limb muscles. European Journal of Oral Sciences. 120, 38-45 (2012).
- Grefte, S., Vullinghs, S., Kuijpers-Jagtman, A. M., Torensma, R., Von den Hoff, J. W. Matrigel but not collagen I, maintains the differentiation capacity of muscle derived cells in vitro. Biomedical Materials. 7, 055004 (2012).
- Kastner, S., Elias, M. C., Rivera, A. J., Yablonka-Reuveni, Z. Gene expression patterns of the fibroblast growth factors and their receptors during myogenesis of rat satellite cells. The Journal of Histochemistry and Cytochemistry. 48, 1079-1096 (2000).
- Yablonka-Reuveni, Z., Quinn, L. S., Nameroff, M. Isolation and clonal analysis of satellite cells from chicken pectoralis muscle. Developmental Biology. 119, 252-259 (1987).
- Sherwood, R. I., et al. Isolation of adult mouse myogenic progenitors: functional heterogeneity of cells within and engrafting skeletal muscle. Cell. 119, 543-554 (2004).
- Gilbert, P. M., et al. Substrate elasticity regulates skeletal muscle stem cell self-renewal in culture. Science. 329, 1078-1081 (2010).
- Motohashi, N., Asakura, Y., Asakura, A. Isolation culture, and transplantation of muscle satellite cells. Journal of Visualized Experiments. , (2014).
- Sciote, J. J., Horton, M. J., Rowlerson, A. M., Link, J. Specialized cranial muscles: how different are they from limb and abdominal muscles. Cells, Tissues, Organs. 174, 73-86 (2003).
- Rowlerson, A., Mascarello, F., Veggetti, A., Carpene, E. The fibre-type composition of the first branchial arch muscles in Carnivora and Primates. Journal of Muscle Research and Cell Motility. 4, 443-472 (1983).
- Muller, J., et al. Comparative evolution of muscular dystrophy in diaphragm, gastrocnemius and masseter muscles from old male mdx mice. Journal of Muscle Research and Cell Motility. 22, 133-139 (2001).
- Feldman, J. L., Stockdale, F. E. Skeletal muscle satellite cell diversity: satellite cells form fibers of different types in cell culture. Developmental Biology. 143, 320-334 (1991).
- Schmalbruch, H., Hellhammer, U. The number of nuclei in adult rat muscles with special reference to satellite cells. The Anatomical Record. 189, 169-175 (1977).
- Gibson, M. C., Schultz, E. The distribution of satellite cells and their relationship to specific fiber types in soleus and extensor digitorum longus muscles. The Anatomical Record. 202, 329-337 (1982).
- Carvajal Monroy, P. L., et al. A rat model for muscle regeneration in the soft palate. PloS One. 8, e59193 (2013).
Tags
Utvecklingsbiologi Head muskler levator veli palatini muskel digastric muskler tuggmuskel satellitceller isolering galvaniska element gomspalt regenerativ medicin vävnadsteknik stamceller differentiering myofibersErratum
Formal Correction: Erratum: Isolation and Characterization of Satellite Cells from Rat Head Branchiomeric Muscles
Posted by JoVE Editors on 10/01/2015.
Citeable Link.
An erratum was issue for Isolation and Characterization of Satellite Cells from Rat Head Branchiomeric Muscles. The fourth figure was updated to explain the isolation of the LVP better.
Steps 2.5.3 and 2.5.4 were updated from:
2.5.3. Look for the trachea and the esophagus that runs behind it. Lift the esophagus, and expose the pharynx, larynx and the soft palate.
2.5.4. Localize the area of the soft palate where the levator veli palatini is inserted and cut it loose (Figure 4B).
to
2.5.3. Look for the trachea and the esophagus that runs behind it. Lift the esophagus, and expose the pharynx and the larynx.
2.5.4 Localize and dissect the area of the superior pharyngeal constrictor muscle. Identify the levator veli palatini and cut it at both sides (Figure 4B).
Figure 4 and its legend were updated from:
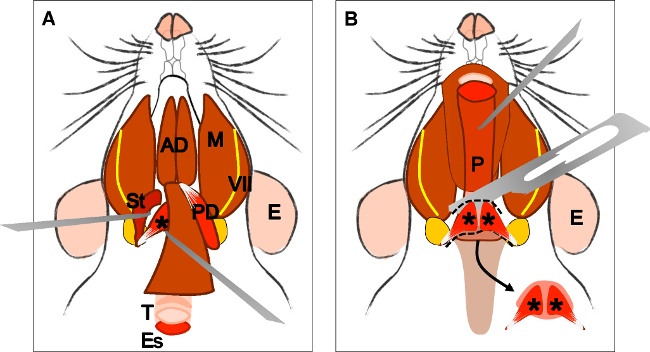
Figure 4: Dissection of the levator veli palatini muscle. (A) General view after dissection of the digastric muscle (posterior belly). Stylohyoid muscle (St) and tendon of the levator veli palatini can be localized. Note the trachea (T) and esophagus (Es) running behind it. (B) After lifting the trachea and the esophagus the pharynx (P) is exposed. The insertion of the levator veli palatini into the soft palate is now visible. The arrow indicates the dissected soft palate with the levator veli palatini muscles at both sides. E: ear, St: stylohyoid muscle, VII: facial nerve, M: masseter muscle, AD: anterior belly digastric muscle, PD: posterior belly digastric muscle, T: trachea, Es: esophagus, P: Pharynx, *levator veli palatini muscle.
to
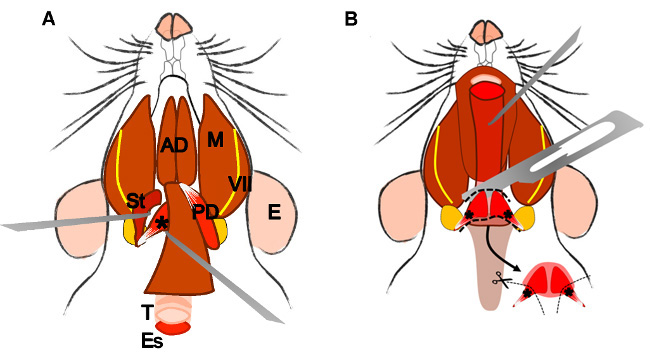
Figure 4: Dissection of the levator veli palatini muscle. (A) General view after dissection of the digastric muscle (posterior belly). Stylohyoid muscle (St) and tendon of the levator veli palatini can be localized. Note the trachea (T) and esophagus (Es) running behind it. (B) After lifting the trachea and the esophagus the pharynx (P) is exposed. The levator veli palatini that runs laterally towards the soft palate is now visible. The arrow indicates the dissected superior pharyngeal constrictor muscle; note the levator veli palatini muscles at both sides. E: ear, St: stylohyoid muscle, VII: facial nerve, M: masseter muscle, AD: anterior belly digastric muscle, PD: posterior belly digastric muscle, T: trachea, Es: esophagus, P: Pharynx, *levator veli palatini muscle.



