ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
Denne protokollen beskriver isolering av satellittceller fra branchiomeric hode musklene i en 9 uker gamle rotter. Musklene kommer fra forskjellige branchial buer. Deretter satellitt dyrkes cellene på en flekk belegg av millimeterstørrelse for å studere deres differensiering. Denne tilnærmingen unngår ekspansjon og passaging av satellitten celler.
Introduction
Om 1: 500 til 1: 1000 nyfødte utviser en kløft som involverer leppe og / eller ganespalte (CLP); dermed er dette den vanligste medfødte misdannelser hos mennesker en. Musklene i den bløte ganen er kritiske for driften av den bløte ganen under tale, svelge, og suger. Hvis en kløft av den myke ganen er til stede, er disse musklene unormalt innsatt i den bakre enden av palatinal benet.
Den myke ganen beveger seg opp og ned i løpet av tale, hindrer luft å slippe gjennom nesen. Barn med en kløft i gane har ikke denne kontrollfunksjon som resulterer i et fenomen som er kjent som velopharyngeal dysfunksjon 2,3. Selv om behandlingsprotokoller er variable, tar kirurgisk reparasjon av den bløte ganen sted i tidlig barndom (6-36 måneders alder) 4. De unormalt innsatte musklene i den bløte ganen kan korrigeres kirurgisk 5-7, men vedvarer velopharyngeal dysfunksjon hos 7% til 30%av pasientene 2,3,8-10.
Evnen til skjelettmuskel for å regenerere ved virkningen av satellittceller (SCS) er vel etablert 11,12. Ved muskelskader, er SC'er aktivert og migrere til skadestedet. De deretter spre seg, skille, og smelte til å danne nye myofibers eller reparere skadet seg 13. Stillestående SC'er uttrykke transkripsjonsfaktor Pax7 14,15, mens deres avkom, prolifererende myoblaster, i tillegg uttrykke myogenisk fastsettelse faktor 1 (myod) 16. Skille myoblaster begynne å uttrykke myogenin (MyoG) 17. Den terminale differensiering av myoblaster er preget av dannelsen av myofibers, og ekspresjonen av muskel-spesifikke proteiner som myosin tung kjede (MyHC) 16,18.
Nylig har flere strategier blitt brukt i regenerativ medisin for å forbedre muskel regenerering av lem muskler 19-23. Spesifikke studier påbranchiomeric hode muskler er også viktig fordi det ble nylig demonstrert at de skiller seg fra andre muskler i flere aspekter 24. I motsetning til lem muskler, har det blitt foreslått at branchiomeric hode muskler inneholder mindre SC'er 25, regenerere langsommere, og mer fibrøst bindevev er dannet etter skade 26 I tillegg prolifererende SC'er fra branchiomeric hode muskler uttrykker også andre transkripsjonsfaktorer. For eksempel er Tcf21, en transkripsjonsfaktor for craniofacial muskeldannelse sterkt uttrykt i regenererende hode muskler, men neppe i regenererende lem muskler 25. Musklene i den bløte ganen av CLP pasienter er vanligvis mindre og mindre godt organisert i forhold til normal palatal muskler 27,28. Langsomme og raske fibre er begge til stede i den bløte ganen muskler, men de langsomme fibrene er mer rikelig. I motsetning til dette, hare muskler inneholder en høyere andel av raske fibre og også en redusert kapillær tilførselsammenlignet med vanlige myke ganen muskler 29-31. Raske fibre er mer utsatt for sammentrekning-indusert skade 31-33. Den medfølgende dårlig kapillær forsyningen kan også gi fibrose 34,35. Alle disse aspektene kan bidra til dårlig regenerering av bløte gane muskler etter kirurgisk kløft nedleggelse 36. I lys av dette, er en protokoll for isolering og karakterisering av branchiomeric hode muskel SC'er avgjørende. Dette gir mulighet til å studere SC biologi branchiomeric hode muskler. I tillegg kan nye behandlingsformer basert på tissue engineering utvikles for å fremme muskel regenerasjon etter operasjonen i CLP og andre forhold kompromitterende kraniofaciale området.
Generelt kan SC'er oppnås etter dissosiasjon av muskelvev 14. Hakking, enzymatisk fordøyelse, og maling er vanligvis nødvendig for å frigjøre SC'er fra sin nisje. SC'er kan renses ved pre-plating på ubestrøket retter 14,37,38, fractionation på Percoll 39,40, eller fluorescent- eller magnetisk celle sortering 41-43. Her presenterer vi en ny økonomisk og hurtig protokoll for isolering av satellittceller fra branchiomeric hode musklene i unge voksne rotter. Denne protokollen er basert på en tidligere manuskript 14 og spesielt tilpasset for små vevsprøver. Isolering av SC'er fra representative muskler som stammer fra den 1., 2., og 4. branchial buer er beskrevet. Etter isolering, lavt antall satellitt celler dyrkes på ekstracellulære matrise gel flekker av millimeter størrelse for å studere deres differensiering. Denne tilnærmingen unngår behovet for utvidelse og passaging av SC'er.
Protocol
Alle forsøkene beskrevet her ble godkjent av det lokale styret for dyreforsøk fra Radboud University Nijmegen i samsvar med nederlandske lover og forskrifter (RU-desember 2013-205).
1. Ekstracellulær Matrix Gel Spots
- Utfør følgende trinn én dag før isolering:
- Tine en delmengde ekstracellulær matriks gel (100 pl) ved 4 ° C i minst 1,5 timer. Fortynn 1:10 i Dulbeccos modifiserte Eagles medium; med 4,500 mg / l glukose, 4 mM L-glutamin, og 110 mg / ml natriumpyruvat (DMEM). Hold den ekstracellulære matriks gel ved 4 ° C til alle tider. Merk: Brå temperaturendringer vil føre til ujevn belegg og krystalldannelse.
- Hold den fortynnede ekstracellulære matriks geloppløsning på is i 15 min.
- Pre-chill en mikropipette 20 ul i 10 min.
- Sett 8-brønners kammerobjektglass i en 100 mm petriskål og overføre fatet på en kald overflate (for eksempel fryseelementer) i 10 minutter.
- Bruk pre-kjølt mikropipette å sette en dråpe av 10 pl ekstracellulære matrise gel i hver brønn. Hold petriskål på den kalde overflaten i minst 7 min (figur 1A).
- Fullstendig å fjerne det gjenværende ekstracellulære matriks-gel (figur 1B), og tørk brønnene ved 37 ° C over natten.
2. Dissection av hodet Muskler (masseter, digastric, og Levator Veli Palatini)
- Før disseksjon, fremstille 50 ml fosfat-bufret saltvann (PBS) supplert med 2% penicillin-streptomycin (P / S). Hold på is.
- Etter avliving av en ung voksen rotte (9 uker) med CO 2 / O 2, halshogge hodet og fjerne huden fra hodet. Overfør hodet til is-kald PBS supplert med 2% P / S i et 50 ml rør.
- Tyggemuskelen (avledet fra det første branchial arch)
- Plasser hodet med den ene siden opp på en silikonmatte og fest med sprøyte needles (Figur 2A).
- Identifiser parotidkjertelen og ansikts nerve (Figur 2A). Utsett dype fascia dekker kjertelen. Skjær fascia og fjerne kjertelen bruker disseksjon saks. Identifisere ytre øregangen. Spore ansikts nerve fra stylomastoid foramen og forsiktig fjerne time, kinnbens, og bukale greiner med en skalpell blad nr 15.
- Frigjøre overfladisk leder av tyggemuskelen ved å fjerne fascia. Identifisere både overfladiske og dype hoder av tyggemuskelen. Spore den overfladiske hodet til sin tykke sene aponeurosis satt inn i zygomatic ferd med maxilla.
- Separer senen fra sin opprinnelse på zygomatic prosessen med en rett pinsett. Klippe det med en skalpell blad nr 15 eller disseksjon saks og forsiktig liv det (figur 2B).
- Dissekere overfladisk hodet på tygge før innsetting i vinkelen og dårligere halvdel av tHan sideflate av ramus av kjeven med et skalpellblad nr 15 (figur 2C). Nå fjerne muskelen.
- Posterior magen av digastric- (avledet fra 2 nd branchial arch)
- Plasser hodet i liggende stilling på silikon pad og fikse med sprøyte nåler (figur 3A).
- Ta av underhudsfett som ligger over både sublingual og submandibular kjertler. Deretter fjerner den overfladiske fascia og kjertler som bruker disseksjon saks. Utsett digastric- (fremre og bakre buk).
- Hold fremre sene av bakre magen med en rett pinsett, klippe det, og dissekere den nøye før sin opprinnelse i tromme bulla (figur 3B). Gjør det samme på motsatt side.
- Levator veli palatini muskel (avledet fra 4. branchial arch)
- Etter disseksjon av bakre buk digastric-, Lokalisere stylohyoid-, dra den sidelengs, og forsiktig fjerne det (Figur 4A).
- Lokalisere sene av levator veli palatini som setter på tromme bulla (Figur 4A). Dissekere den nøye og klippe det på begge sider.
- Se etter luftrøret og spiserøret som går bak den. Løft spiserøret, og utsett svelg, strupehodet og den bløte ganen.
- Lokalisere området av den bløte ganen der levator veli palatini er satt inn og klippe den løs (4B).
Merk: Rett etter disseksjon, fjerne sener og bindevev nøye fra hver muskel under stereomikroskop. Senk alle prøver raskt i etanol 70%, og overføre dem til iskald PBS supplert 2% P / S i en 15 ml tube.
3. Isolering av satellitten celler
- Utfør følgende forberedelsestrinnene for SC isolasjon fra tre grupper av muskler:
- Forberede 7,5 ml 0,1% pronase i DMEM. Filtrer løsningen gjennom et 0,22 um filter. Pre-varme oppløsningen ved 37 ° C i et vannbad i 10 minutter før isolering.
- Forbered 35 ml av DMEM supplert med 10% hesteserum (HS), og 1% P / S. Også forhånds varm ved 37 ° C i et vannbad.
- Forbered 15 ml kulturmedium som består av DMEM supplert med 20% føtalt bovint serum (FBS), 10% HS, 1% P / S og 1% kyllingembryo ekstrakt (CEE). Pre-varm ved 37 ° C i et vannbad.
- Pre-frakk seks plastpipetter (10 ml) med HS og tørke i minst 10 min før bruk.
- I hetten kultur, overføres hver muskel i en brønn i en 6-brønns plate. Ved hjelp av disseksjon saks, klippe muskelen i små biter av ca 2 mm. Vær forsiktig med å hakke vevet for mye.
- Tilsett forsiktig 2,5 ml 0,1% pronase-løsning til hver brønn og inkuber ved 37 ° C i 60 min. Rist platen etter 20, 40, og 60 min. Merk: Den nøyaktige duratioN av inkubasjonen er avhengig av faktorer som alder og belastning av dyrene.
- Overvåk under mikroskopet. Kontroller muskelfragmenter og stoppe den enzymatiske fordøyelse Når fibrene buntene får løsnet utseende (figur 5).
- Legg 2,5 ml DMEM supplert med 10% HS og 1% P / S. Overfør til et 15 ml rør og sentrifuger rørene ved 400 xg i 5 minutter. Kast supernatanten ved dekantering.
- Tilsett 5 ml DMEM supplert med 10% HS og 1% P / S. Pipettere løsningen opp og ned med en 10 ml plast pipette (finmaling) i minst 20 ganger for å homogenisere vevet.
- Sentrifuger rørene ved 200 xg i 4 min. Samle supernatanten og overføre til en 15 ml tube.
- Tilsett 5 ml DMEM supplert med 10% HS og 1% P / S. Pipetten på nytt med en 10 ml plast pipette inntil vevfragmenter passerer lett gjennom pipetten.
- Sentrifuger rørene ved 200 xg i 4 min, og samle supernatanten i et 15 ml rør.
- Putca et cellefilter (40 um) på et 50 ml rør og overføre supernatanten inneholdende de dissosierte cellene på filteret. Vask med 1 ml DMEM for maksimal celle utvinning.
- Sentrifuger rørene ved 1000 xg i 10 min, og supernatanten kastes med en pipette.
- Resuspender pelleten i 300 ul kulturmedium og tell cellene i et hemocytometer.
4. Differensiering av satellitten celler på Ekstracellulær Matrix Gel Spots
- Fortynn cellesuspensjonen for å oppnå 1,5 x 10 3-celler i 10 pl dyrkingsmedium.
- Fest dekslene av kamrene lysbilder med tape og markere flekker med en svart markør på undersiden av objektet glass.
- Ved hjelp av en mikropipette, sette en dråpe 10 mL cellesuspensjon på ekstracellulære matrise gel spot. Sjekk under mikroskopet om slipp av cellesuspensjonen er plassert riktig på plass. Inkuber i seks timer ved 37 ° C.
- Forsiktigly Tilsett 400 ul dyrkningsmedium (DMEM supplert med 20% FBS, 10% HS, 1% P / S og 1% CEE) og inkuberes i tre dager ved 37 ° C.
Merk: På dette punktet, er nylig isolert SC utsatt for massive traumer (enzymatisk fordøye og hard gniing) og de trenger å komme seg. Ikke forstyrre cellene i løpet av de tre første dagene 37. Deretter kan dyrkningsmediet endres avhengig av type eksperiment.
Den ekstracellulære matriks gel flekker kan sådd med en høy celletetthet (1,5 til 2,5 x 10 3/20 ul) for differensiering assay. Dyrkningsmedium (DMEM supplert med 20% FBS, 10% HS, 1% P / S og 1% kyllingembryo ekstrakt) kan skiftes ut hver tredje dag. - Alternativt, hvis ekspansjon og bestått ønskes følg de neste trinnene:
- Tine en delmengde ekstracellulær matriks gel (500 pl) ved 4 ° C i minst 1,5 timer. Fortynnet 1:10 i DMEM og følger anbefalingene i punkt 1.1.1.
- Pre-chill en 10 ml pipette i 10 minutter ved 4 &# 176; C.
- Overfør tre T75-kolber på en kald overflate (for eksempel fryseelementer) i 10 minutter.
- Bruk pre-kjølt pipette til å sette en ml ekstracellulære matrise gel i hver kolbe. Kontroller at overflaten blir dekket fullstendig. Hold flaskene på den kalde overflaten i minst 7 min (figur 1A).
- Fullstendig å fjerne det gjenværende ekstracellulære matriks-gel med en 10 ml pipette, og tørk brønnene ved 37 ° C i 1 time.
- Etter telling, resuspender nyisolerte SC'er i 10 ml dyrkningsmedium (DMEM supplert med 20% FBS, 10% HS, 1% P / S og 1% kylling embryo ekstrakt) og frø i pre-belagt T75 kolber.
- Etter tre dager endrer medium (og hver tredje dag) til 80% konfluens er nådd. For aging, vaske T75 kolber tre ganger med PBS. Deretter tilsettes 1 ml 0,25% trypsin-løsning og inkuberes i tre minutter ved 37 ° C. Resuspender i 9 ml dyrkningsmedium (DMEM supplert med 20% FBS, 10% HS, 1% P / Sog 1% kyllingembryo ekstrakt) og sentrifuger ved 200 xg i 5 min. Kast supernatanten. Etter telling, suspendere en x 10 6 celler i 1000 mL av kulturmedium og fryse cellene.
Representative Results
Ved hjelp av denne protokollen, tyggemuskelen (én side) gir 0,8-1 x 10 6 celler, digastric- (posterior magen) gir 1,5-2 x 10 5 celler, og levator Veli palatini muskel avkastning 1-1,5 x 10 5 celler. Celleutbytter avhenger av muskeltypen, stamme, og alder på dyret. For sammenligning mellom de tre muskelgruppene, ble nylig isolerte SC'er sådd med den samme celletetthet (1,5 x 10 3/10 ul). Direkte etter isolering, mer enn 90% av de nyisolerte celler uttrykker Pax7 (figur 6).
Dag 4, 7 og 10 kulturer ble farget med antistoffer mot Pax7, myod, MyoG og MyHC immunofarging. Fem vilkårlige felt ble telt per kultur ved hjelp av en 20X objektiv. På dag 4 Pax 7 og Myo D er uttrykt i alle muskelgrupper (figur 6 og 7 og 8), men avkommet av SatCs fra tygge og digastric musklene begynner expressynge myogenin tidligere enn levator veli palatini muskelen (figur 9). På dag 10, er et uttrykk for MyoG sterkt redusert i alle grupper (figur 9). Et par dager etter såing på ekstracellulære matrise gel flekker, prolifererende celler begynner å smelte og danne flerkjerneholdige myotubes som uttrykker myosin tung kjede. Små myotubes er klart synlige på dag 7 (figur 10). På dag 10, kan rykninger i myotubes holdes (Video 1).

Figur 1:. Ekstracellulære matriks gel flekker i et kammer lysbilde (A) For enkel manipulasjon, plasser åtte-brønns kammer lysbilde i en 100 mm petriskål. Pipette 10 mL ekstracellulære matrise gel i hvert kammer og sette den på en kald overflate (7 min). (B) Chamber lysbilde etter det overskytende ekstracellulære matrise gel er fjernet.

Figur 2:. Disseksjon av tyggemuskelen (A) Leder av dyret i en sidevisning. Ear (E), parotidkjertelen (P) og ansikts nerve (VII). (B) tendinous aponeurosis (Te) av overfladiske hodet på tyggemuskelen (Ms) og tidsmessige muskel (T). Separer senen fra sin innsetting med en tang. (C) dissekere muskelen forsiktig opp til sitt innsetting på ramus av kjeven. E: øre, P: parotidkjertelen, VII: ansikts nerve, T: Temporal muskel, Ms: overfladisk leder av tyggemuskelen, Te: sene, Mp: deep leder av tyggemuskelen.

Figur 3: Dissection av bakre buk digastric- (.A) Leder av dyret i liggende stilling. Lokalisere submandibularis (SG), tyggemuskelen (M), ansikts nerve (VII) og sternocleidomastoideus (SCM). Fjern submandibularis. (B) Lokaliser den digastric- anterior (AD) og posterior magen (PD). Med rett pinsett, ta anterior sene av bakre buk, klippe det og dissekere den nøye før sin opprinnelse i tromme bulla (ty). E: øre, Sg: submandibularis, VII: ansikts nerve, M: tyggemuskelen, SMC: sternocleidomastoideus, AD: anterior magen digastric-, PD: posterior magen digastric-, Ty: Tromme bulla.

Figur 4:. Disseksjon av levator Veli palatini muskel (A) General view etter disseksjon av digastric- (posterior magen). Stylohyoid- (St) og sene i levatorveli palatini kan lokaliseres. Legg merke til luftrøret (T) og spiserør (Es) som kjører bak. (B) etter løfting av luftrøret og spiserøret svelget (P) blir blottlagt. Innsetting av levator Veli palatini i den bløte ganen er nå synlig. Pilen indikerer dissekert bløte ganen med levator Veli palatini musklene på begge sider. E: øre, St: stylohyoid-, VII: ansikts nerve, M: tyggemuskelen, AD: anterior magen digastric-, PD: posterior magen digastric-, T: luftrør, Es: spiserør, P: svelg, * levator veli palatini muskel .

Figur 5: Utseende av muskelvev (a) før og (b) etter enzymatisk spaltning med pronase. Legg merke til at muskelbunter synes å løsnes etter enzymatisk oppslutning.
Figur 6: Pax 7 immunofarging nyisolerte SCS anvendt på ekstracellulær matriks gel ved slutten av isoleringen (ca. 6 timer etter innledende vev spaltning).. Fem vilkårlig felt ble telt ved bruk av et 10X objektiv med et gjennomsnitt på 210 celler per felt. Omtrent 90% av cellene er positive Pax 7. DAPI: blå, Pax7: rødt. Scale bar, 100 mikrometer.

Figur 7:. Pax 7, myod immunofarging Dag 4, 7 og 10 kulturer ble farget med antistoffer mot Pax7 og myod farging. (A - C) og (D - F) Representative photomicrographs av dag 4 og 7 kulturer fra tyggemuskelen. (G og H + og myod + kjerner pr mikroskopisk felt ble talt og uttrykt som en prosentandel av det totale antall kjerner (DAPI). DAPI: blå, Pax7: rød, og myod: green. Scales bar, 100 mikrometer. Klikk her for å se en større versjon av dette tallet.

Figur 8:. Fordeling av Pax7 ± / myod ± i kulturer fra mononukleærerte celler i kulturer fra tygge, digastric og levator Veli Palatine muskel (A - C) Dag 4, 7 og 10 kulturer ble farget med antistoffer mot Pax7 og myod farging. Det totale antall celler er basert på for det totale antall kjerner (DAPI). (D) data kvantifisering av Pax7 ± / myod ± cells. Klikk her for å se en større versjon av dette tallet.

Figur 9:. Myogenin immunofarging Dag 4, 7 og 10 kulturer ble farget med antistoffer mot Myogenin. (A - D) Representative photomicrographs av dag 4 og 7 kulturer fra levator veli palatine muskel. (E) Antallet MyoG + kjerner pr mikroskopisk felt ble talt og uttrykt som en prosentandel av det totale antall kjerner (DAPI). (F) data kvantifisering av MyoG + celler. DAPI: blå, Myogenin: green. Scales bar, 100 mikrometer. Klikk her for å se en større versjon av denne figure.

Fig. 10: Myosin tung kjede immunofarging dag 4, 7 og 10 kulturer ble farget med antistoffer mot myosin tung kjede (MyHC). Representative photomicrographs av dag 4, 7 og 10 kulturer fra digastric (DIG) muskler. På dag 7 små myotubes er til stede, mens på dag 10 lange og velorganiserte myotubes er tydelig. Scales bar, 200 mikrometer. Klikk her for å se en større versjon av dette tallet.
Video 1:.. Myotube rykninger Eksempler på to representative felt med rykninger myotubes vises for dagen 10 kulturer fra digastric- Vennligst klikk her for å se denne videoen.
Discussion
SC'er fra forskjellige branchiomeric hode muskler ble isolert fra en 9 uker gamle Wistar-rotte, og dyrket direkte på ekstracellulær matriks gel flekker uten forutgående ekspansjon og aging. Etter isolering ble cellene tellet og podet på samme celletetthet. For parallell isolering av tre forskjellige muskler, tar denne fremgangsmåte omtrent 4 timer. For å unngå forurensning kultur, er et kritisk trinn rask vasking i alkohol 70% etter disseksjon av musklene.
Under SC isolasjon er det viktig å skjære muskelvev i små biter (ca. 2 mm), men unngå for mye hakking, da dette vil resultere i en liten celle utbytte på grunn av celleskade. Dessuten må varigheten av den enzymatiske fordøyelse kontrolleres nøye under mikroskopet for å unngå ytterligere skade. Formålet med fordøyelsen er å dissosiere myofibers. Siden mer enn 90% av de isolerte celler uttrykker Pax7, er ingen ytterligere rensning er nødvendig (figurene 6-8).Dette unngår ekstra rensetrinn i andre metoder som pre-plating på ubestrøket retter 14,37,38, fraksjonering på Percoll® 39,40, eller fluorescent- eller magnetisk celle sortering 41,43. For finfordeling er det viktig å indusere skjær mellom vevfragmenter og åpningen av pipettespissen da dette gjør den mekaniske frigjøring av SCS. Dersom triturering med en 10 ml pipette (innvendig diameter tip: 1 mm) er vanskelig, en 5 ml (indre diameter: 2 mm spiss) kan pipette brukes først. Alternativt kan glass Pasteur pipetter kappes i ønsket diameter og benyttes. Denne metoden er enkel, effektiv og tillater samtidig isolering av SC fra forskjellige muskelprøver.
Kulturplatene for SC'er kan også være belagt med gelatin eller kollagen, men våre tidligere studier viser at ekstracellulære matriks gel er langt bedre for vedlikehold av myogenisk potensial enn 38 kollagen. Den ekstracellulære matrise gel flekker avmillimeter størrelse (10 ul / Ø 2 mm eller 20 ul / o 4 mm) tillater studiet av proliferasjon og differensiering av SC'er med et begrenset antall celler. For differensiering analysen omtrent 8 til 20 ganger færre celler er nødvendige i forhold til en 24-brønns plate (Ø 15,6 mm), og 80 til 200 ganger mindre sammenlignet med 35 mm petriskåler (35 mm) 14,38.
Siden ekstracellulære matrise gel er dyrt, er denne metoden også mer kostnadseffektiv. I tillegg kan kammers objektglass erstattes av plastdekkglass for å redusere omkostningene ytterligere. For fremstilling av den ekstracellulære matriks gelen ble over natten tørking av kammers objektglass er viktig. Som de ekstracellulære matrise gel flekker er gjennomsiktig, er det nødvendig å markere flekker på undersiden ved hjelp av bakgrunnsbelysning. Kamrene lysbildene er løst i en petriskål for enkel manipulasjon. Videre cellekultur utvidelse ikke er nødvendig, som tilbyr muligheten til å studere SC'er av smalLER muskler eller små muskelprøver. Alternativt, f.eks PCR eller muskel-konstruksjonene hvis flere celler er nødvendig, kan den nylig isolerte SC'er først ekspanderes i T75-kolber som angitt ovenfor.
SC'er isolert ved anvendelse av denne protokollen er ikke egnet for ytterligere rensing med flowcytometri umiddelbart etter isolering. Nedbrytning med pronase forårsaker omfattende oppslutning av overflateantigener 14. Hesteserum og føtalt bovint serum som blir benyttet for cellekultur, må først være riktig karakteriseres før isolasjon, som forskjellige partinummer differensielt påvirkes myoblaster proliferasjon og differensiering.
I de senere årene, er det en økende interesse i musklene avledet fra branchial buer og hodet mesoderm (f.eks extraocular muskler) 24. Det har blitt tydelig demonstrert at hode og lem muskler har svært forskjellige egenskaper. Tyggemuskelen fra gamle dyr ser ut til å reholde sin evne til reproduksjon i sammenligning med lem muskler 25,26. SC'er fra extraocular musklene har en robust spredning og differensiering kapasitet sammenlignes SC'er fra hode muskler, og viser en større engraftment potensial enn lem muskel SC'er 24.
The fiber type fordeling og myosin sammensetning varierer mellom muskelgrupper og også mellom arter. Muskler som stammer fra den første branchial arch hos mennesker inneholde både langsomme og raske fibre (subtyper IIA og IIx), neonatale myosins og myosins typiske for utvikling av hjertemuskelen. I gnagere disse musklene inneholder ca 95% raske fibre myosin IIA og IIB) 44-46. Studier på avian muskler viser at SC'er fra ulike muskelfibertyper varierer i differensiering kapasitet. SC'er fra raske fibre bare differensiere til raske muskelfibre, mens SC'er fra langsomme fibre kan differensiere i begge fibertyper 47. I tillegg er den prosentandel av SC'er i fast muskelFibrene er lavere enn i langsomme muskelfibrene 48,49. Dette indikerer at fibertypen fordelingen må tas i betraktning for studier av muskler i kraniofaciale området. I likhet med ganespalte muskler, LVP hos gnagere inneholder nesten utelukkende raske fibre 50. Av den grunn SC'er fra LVP er egnet for pre-kliniske studier innen ganespalte.
Denne protokollen gir nye muligheter for å studere SC'er avledet fra branchiomeric hode muskler eller andre mindre muskler eller mindre muskler prøver. Dette vil lette utviklingen av nye behandlingsformer for å bedre regenerering av muskler i kjeveområdet i forhold som ganespalte, men også i andre forhold som påvirker mindre muskler.
Materials
| Name | Company | Catalog Number | Comments |
| Hypodermic Needle 25 G 0.5 x 25 m | BD Microlance | 300400 | |
| Dissecting scissors | Braun | BC154R | |
| Micro forceps straight | Braun | BD330R | |
| Surgical Scalpel Blade No. 15 | Swann-Morton | 0205 | |
| Alcohol 70% | Denteck | 2,010,005 | |
| Permanox Slide, 8 Chamber | Thermo Scientific | 177445 | |
| 6 well cell culture plate | Greiner bio-one | 657160 | |
| Cell Culture Dishes (100 x 20 mm) | Greiner bio-one | 664160 | |
| 15 ml sterile conical centrifuge tube | BD Biosciences | 352097 | |
| 50 ml sterile conical centrifuge tube | BD Biosciences | 352098 | |
| Cell strainer (40 μm) | Gibco | 431750 | |
| 10 ml serological pipette | Greiner bio-one | 607180 | |
| 20 µl FT20 | Greiner bio-one | 774288 | |
| Matrigel, Phenol-Red Free | BD Biosciences | 356237 | 10 ml |
| Pronase | Calbiochem | 53702 | 10 KU |
| Phosphate Buffered Saline | Gibco | 14190-144 | 500 ml |
| Dulbecco's Modified Eagle Medium, high glucose, GlutaMAX Supplement, pyruvate | Gibco | 10569-010 | 500 ml |
| Fetal Bovine Serum | Fisher Scientific | 3600511 | 500 ml |
| Horse Serum | Gibco | 26050088 | 500 ml |
| Penicillin-Streptomycin (10,000 U/ml) | Gibco | 15140-122 | 100 ml |
| Chicken Embryo Extract | MP Biomedicals | 2850145 | 20 ml |
References
- Gritli-Linde, A. Molecular control of secondary palate development. Developmental Biology. 301, 309-326 (2007).
- Marrinan, E. M., LaBrie, R. A., Mulliken, J. B. Velopharyngeal function in nonsyndromic cleft palate: relevance of surgical technique, age at repair, and cleft type. The Cleft Palate-Craniofacial Journal. 35, 95-100 (1998).
- Morris, H. L. Velopharyngeal competence and primary cleft palate surgery, 1960-1971: a critical review. The Cleft Palate Journal. 10, 62-71 (1973).
- Mossey, P. A., Little, J., Munger, R. G., Dixon, M. J., Shaw, W. C. Cleft lip and palate. Lancet. 374, 1773-1785 (2009).
- Boorman, J. G., Sommerlad, B. C. Musculus uvulae and levator palati: their anatomical and functional relationship in velopharyngeal closure. British Journal of Plastic Surgery. 38, 333-338 (1985).
- Bae, Y. C., Kim, J. H., Lee, J., Hwang, S. M., Kim, S. S. Comparative study of the extent of palatal lengthening by different methods. Annals of Plastic Surgery. 48, 359-362 (2002).
- Braithwaite, F., Maurice, D. G. The importance of the levator palati muscle in cleft palate closure. British Journal of Plastic Surgery. 21, 60-62 (1968).
- Inman, D. S., Thomas, P., Hodgkinson, P. D., Reid, C. A. Oro-nasal fistula development and velopharyngeal insufficiency following primary cleft palate surgery--an audit of 148 children born between 1985 and 1997. British Journal of Plastic Surgery. 58, 1051-1054 (2005).
- Phua, Y. S., de Chalain, T. Incidence of oronasal fistulae and velopharyngeal insufficiency after cleft palate repair: an audit of 211 children born between 1990 and 2004. The Cleft Palate-Craniofacial Journal. 45, 172-178 (1990).
- Kirschner, R. E., et al. Cleft-palate repair by modified Furlow double-opposing Z-plasty: the Children's Hospital of Philadelphia experience. Plastic and Reconstructive Surgery. 104, 1998-2010 (1999).
- Mauro, A. Satellite cell of skeletal muscle fibers. The Journal of Biophysical and Biochemical Cytology. 9, 493-495 (1961).
- Yablonka-Reuveni, Z. The skeletal muscle satellite cell: still young and fascinating at 50. The Journal of Histochemistry and Cytochemistry. 59, 1041-1059 (2011).
- Ten Broek, R. W., Grefte, S., Von den Hoff, J. W. Regulatory factors and cell populations involved in skeletal muscle regeneration. Journal of Cellular Physiology. 224, 7-16 (2010).
- Danoviz, M. E., Yablonka-Reuveni, Z. Skeletal muscle satellite cells: background and methods for isolation and analysis in a primary culture system. Methods in Molecular Biology. 798, 21-52 (2012).
- Seale, P., et al. Pax7 is required for the specification of myogenic satellite cells. Cell. 102, 777-786 (2000).
- Yablonka-Reuveni, Z., et al. The transition from proliferation to differentiation is delayed in satellite cells from mice lacking MyoD. Developmental Biology. 210, 440-455 (1999).
- Zammit, P. S., Partridge, T. A., Yablonka-Reuveni, Z. The skeletal muscle satellite cell: the stem cell that came in from the cold. The Journal of Histochemistry And Cytochemistry. 54, 1177-1191 (2006).
- Andres, V., Walsh, K. Myogenin expression, cell cycle withdrawal, and phenotypic differentiation are temporally separable events that precede cell fusion upon myogenesis. The Journal of Cell Biology. 132, 657-666 (1996).
- Fukushima, K., et al. The use of an antifibrosis agent to improve muscle recovery after laceration. The American Journal of Sports Medicine. 29, 394-402 (2001).
- Grefte, S., Kuijpers-Jagtman, A. M., Torensma, R., Von den Hoff, J. W. Skeletal muscle fibrosis: the effect of stromal-derived factor-1α-loaded collagen scaffolds. Regenerative Medicine. 5, 737-747 (2010).
- Jackson, W. M., Nesti, L. J., Tuan, R. S. Potential therapeutic applications of muscle-derived mesenchymal stem and progenitor cells. Expert Opinion on Biological Therapy. 10, 505-517 (2010).
- Sato, K., et al. Improvement of muscle healing through enhancement of muscle regeneration and prevention of fibrosis. Muscle, & Nerve. 28, 365-372 (2003).
- Tatsumi, R., Anderson, J. E., Nevoret, C. J., Halevy, O., Allen, R. E. HGF/SF is present in normal adult skeletal muscle and is capable of activating satellite cells. Developmental Biology. 194, 114-128 (1998).
- Stuelsatz, P., et al. Extraocular muscle satellite cells are high performance myo-engines retaining efficient regenerative capacity in dystrophin deficiency. Developmental biology. , (2014).
- Ono, Y., Boldrin, L., Knopp, P., Morgan, J. E., Zammit, P. S. Muscle satellite cells are a functionally heterogeneous population in both somite-derived and branchiomeric muscles. Developmental Biology. 337, 29-41 (2010).
- Pavlath, G. K., et al. Heterogeneity among muscle precursor cells in adult skeletal muscles with differing regenerative capacities. Developmental Dynamics. 212, 495-508 (1998).
- Koo, S. H., Cunningham, M. C., Arabshahi, B., Gruss, J. S., Grant, J. H. 3rd The transforming growth factor-beta 3 knock-out mouse: an animal model for cleft palate. Plastic and Reconstructive Surgery. 108, 938-948 (2001).
- Fara, M., Brousilova, M. Experiences with early closure of velum and later closure of hard palate. Plastic and Reconstructive Surgery. 44, 134-141 (1969).
- Lindman, R., Paulin, G., Stal, P. S. Morphological characterization of the levator veli palatini muscle in children born with cleft palates. The Cleft Palate-Craniofacial Journal. 38, 438-448 (2001).
- Hanes, M. C., et al. Contractile properties of single permeabilized muscle fibers from congenital cleft palates and normal palates of Spanish goats. Plastic and Reconstructive Surgery. 119, 1685-1694 (2007).
- Rader, E. P., et al. Contraction-induced injury to single permeabilized muscle fibers from normal and congenitally-clefted goat palates. The Cleft Palate-Craniofacial Journal. 44, 216-222 (2007).
- Rader, E. P., et al. Effect of cleft palate repair on the susceptibility to contraction-induced injury of single permeabilized muscle fibers from congenitally-clefted goat palates. The Cleft Palate-Craniofacial Journal. 45, 113-120 (2008).
- Macpherson, P. C., Dennis, R. G., Faulkner, J. A. Sarcomere dynamics and contraction-induced injury to maximally activated single muscle fibres from soleus muscles of rats. The Journal of Physiology. 500 (Pt 2), 523-533 (1997).
- Koch, K. H., Grzonka, M. A., Koch, J. The pathology of the velopharyngeal musculature in cleft palates). Annals of Anatomy. 181, 123-126 (1999).
- Fara, M., Dvorak, J. Abnormal anatomy of the muscles of palatopharyngeal closure in cleft palates: anatomical and surgical considerations based on the autopsies of 18 unoperated cleft palates. Plastic and Reconstructive Surgery. 46, 488-497 (1970).
- Carvajal Monroy, P. L., Grefte, S., Kuijpers-Jagtman, A. M., Wagener, F. A., Von den Hoff, J. W. Strategies to Improve Regeneration of the Soft Palate Muscles After Cleft Palate Repair. Tissue Engineering. Part B, Reviews. , (2012).
- Grefte, S., Kuijpers, M. A., Kuijpers-Jagtman, A. M., Torensma, R., Von den Hoff, J. W. Myogenic capacity of muscle progenitor cells from head and limb muscles. European Journal of Oral Sciences. 120, 38-45 (2012).
- Grefte, S., Vullinghs, S., Kuijpers-Jagtman, A. M., Torensma, R., Von den Hoff, J. W. Matrigel but not collagen I, maintains the differentiation capacity of muscle derived cells in vitro. Biomedical Materials. 7, 055004 (2012).
- Kastner, S., Elias, M. C., Rivera, A. J., Yablonka-Reuveni, Z. Gene expression patterns of the fibroblast growth factors and their receptors during myogenesis of rat satellite cells. The Journal of Histochemistry and Cytochemistry. 48, 1079-1096 (2000).
- Yablonka-Reuveni, Z., Quinn, L. S., Nameroff, M. Isolation and clonal analysis of satellite cells from chicken pectoralis muscle. Developmental Biology. 119, 252-259 (1987).
- Sherwood, R. I., et al. Isolation of adult mouse myogenic progenitors: functional heterogeneity of cells within and engrafting skeletal muscle. Cell. 119, 543-554 (2004).
- Gilbert, P. M., et al. Substrate elasticity regulates skeletal muscle stem cell self-renewal in culture. Science. 329, 1078-1081 (2010).
- Motohashi, N., Asakura, Y., Asakura, A. Isolation culture, and transplantation of muscle satellite cells. Journal of Visualized Experiments. , (2014).
- Sciote, J. J., Horton, M. J., Rowlerson, A. M., Link, J. Specialized cranial muscles: how different are they from limb and abdominal muscles. Cells, Tissues, Organs. 174, 73-86 (2003).
- Rowlerson, A., Mascarello, F., Veggetti, A., Carpene, E. The fibre-type composition of the first branchial arch muscles in Carnivora and Primates. Journal of Muscle Research and Cell Motility. 4, 443-472 (1983).
- Muller, J., et al. Comparative evolution of muscular dystrophy in diaphragm, gastrocnemius and masseter muscles from old male mdx mice. Journal of Muscle Research and Cell Motility. 22, 133-139 (2001).
- Feldman, J. L., Stockdale, F. E. Skeletal muscle satellite cell diversity: satellite cells form fibers of different types in cell culture. Developmental Biology. 143, 320-334 (1991).
- Schmalbruch, H., Hellhammer, U. The number of nuclei in adult rat muscles with special reference to satellite cells. The Anatomical Record. 189, 169-175 (1977).
- Gibson, M. C., Schultz, E. The distribution of satellite cells and their relationship to specific fiber types in soleus and extensor digitorum longus muscles. The Anatomical Record. 202, 329-337 (1982).
- Carvajal Monroy, P. L., et al. A rat model for muscle regeneration in the soft palate. PloS One. 8, e59193 (2013).
Tags
Developmental Biology Hode muskler levator Veli palatini muskel digastric- tyggemuskelen satellitt celler isolasjon primære celler ganespalte regenerativ medisin tissue engineering stamceller differensiering myofibersErratum
Formal Correction: Erratum: Isolation and Characterization of Satellite Cells from Rat Head Branchiomeric Muscles
Posted by JoVE Editors on 10/01/2015.
Citeable Link.
An erratum was issue for Isolation and Characterization of Satellite Cells from Rat Head Branchiomeric Muscles. The fourth figure was updated to explain the isolation of the LVP better.
Steps 2.5.3 and 2.5.4 were updated from:
2.5.3. Look for the trachea and the esophagus that runs behind it. Lift the esophagus, and expose the pharynx, larynx and the soft palate.
2.5.4. Localize the area of the soft palate where the levator veli palatini is inserted and cut it loose (Figure 4B).
to
2.5.3. Look for the trachea and the esophagus that runs behind it. Lift the esophagus, and expose the pharynx and the larynx.
2.5.4 Localize and dissect the area of the superior pharyngeal constrictor muscle. Identify the levator veli palatini and cut it at both sides (Figure 4B).
Figure 4 and its legend were updated from:
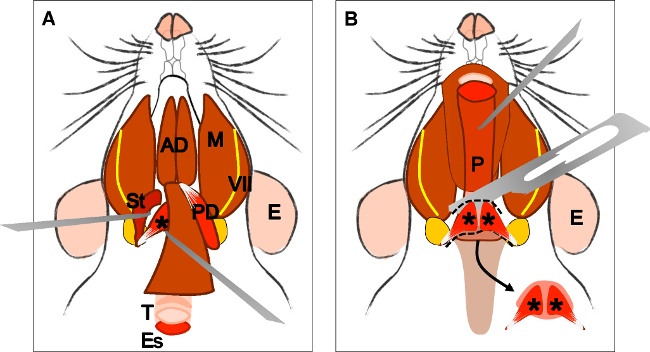
Figure 4: Dissection of the levator veli palatini muscle. (A) General view after dissection of the digastric muscle (posterior belly). Stylohyoid muscle (St) and tendon of the levator veli palatini can be localized. Note the trachea (T) and esophagus (Es) running behind it. (B) After lifting the trachea and the esophagus the pharynx (P) is exposed. The insertion of the levator veli palatini into the soft palate is now visible. The arrow indicates the dissected soft palate with the levator veli palatini muscles at both sides. E: ear, St: stylohyoid muscle, VII: facial nerve, M: masseter muscle, AD: anterior belly digastric muscle, PD: posterior belly digastric muscle, T: trachea, Es: esophagus, P: Pharynx, *levator veli palatini muscle.
to
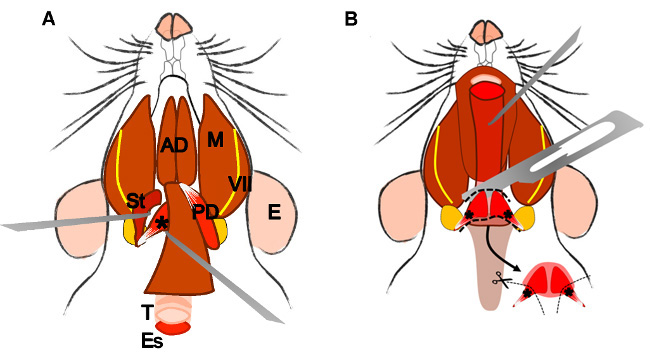
Figure 4: Dissection of the levator veli palatini muscle. (A) General view after dissection of the digastric muscle (posterior belly). Stylohyoid muscle (St) and tendon of the levator veli palatini can be localized. Note the trachea (T) and esophagus (Es) running behind it. (B) After lifting the trachea and the esophagus the pharynx (P) is exposed. The levator veli palatini that runs laterally towards the soft palate is now visible. The arrow indicates the dissected superior pharyngeal constrictor muscle; note the levator veli palatini muscles at both sides. E: ear, St: stylohyoid muscle, VII: facial nerve, M: masseter muscle, AD: anterior belly digastric muscle, PD: posterior belly digastric muscle, T: trachea, Es: esophagus, P: Pharynx, *levator veli palatini muscle.



