ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
Dieses Protokoll beschreibt die Isolierung von Satellitenzellen aus branchiomeric Kopf Muskeln über ein 9 Wochen alten Ratte. Die Muskeln aus unterschiedlichen Kiemenbögen. Anschließend werden die Satellitenzellen auf einem Spotlackierung von Millimetergröße, um ihre Differenzierung zu untersuchen kultiviert. Dieser Ansatz vermeidet die Expansion und Passagieren von Satellitenzellen.
Introduction
Etwa 1: 500 bis 1: 1000 Neugeborene weisen eine Spalte, die die Lippe und / oder Gaumen (CLP); somit ist dies die häufigste angeborene Fehlbildung bei Menschen 1. Die Muskeln des weichen Gaumens sind entscheidend für das Funktionieren des weichen Gaumens beim Sprechen, Schlucken und Saugen. Wenn eine Spalte des weichen Gaumens vorhanden ist, werden diese Muskeln abnorm in das hintere Ende der Gaumenknochen eingesetzt.
Der weiche Gaumen auf und ab bewegt beim Sprechen, Luft verhindert, durch die Nase zu entkommen. Kinder mit einer Spalte im Gaumen nicht über diese Steuerungsfunktion, was zu einem Phänomen, das als velopharyngeale Dysfunktion 2,3 bekannt. Obwohl die Behandlungsprotokolle sind variabel, chirurgische Reparatur des weichen Gaumens erfolgt im frühen Kindesalter (6-36 Monate alt) 4. Die abnorm eingefügt Muskeln des weichen Gaumens können chirurgisch korrigiert 5-7 werden jedoch weiterhin besteht velopharyngeale Dysfunktion bei 7% bis 30%der Patienten 2,3,8-10.
Die Fähigkeit der Skelettmuskeln durch die Einwirkung von Satellitenzellen (SC) zu regenerieren ist gut etabliert, 11,12. Bei Muskelverletzung, SCs aktiviert und wandern zu der Stelle der Verletzung. Dann vermehren, differenzieren und zu verschmelzen, um neue Muskelfasern oder Reparatur beschädigten 13 zu bilden. Ruhe SCs Ausdruck der Transkriptionsfaktor Pax7 14,15, während ihre Nachkommen, die proliferierenden Myoblasten, zusätzlich die Bestimmung myogenen Faktor 1 (MyoD) 16 zum Ausdruck bringen. Differenzieren Myoblasten starten, um auszudrücken, Myogenin (MYOG) 17. Die terminale Differenzierung von Myoblasten durch die Bildung von Muskelfasern und der Expression muskelspezifischer Proteine wie Myosin schwere Kette (MyHC) 16,18 gekennzeichnet.
In letzter Zeit wurden mehrere Strategien in der regenerativen Medizin verwendet worden, um die Muskelregeneration von Beinmuskeln 19-23 verbessern. Spezifische Studien überbranchiomeric Hauptmuskeln sind auch wichtig, weil es wurde kürzlich gezeigt, dass sie von anderen Muskeln in mehreren Aspekten von 24 abweichen. Im Gegensatz zu den Beinmuskeln, wurde vorgeschlagen, dass branchiomeric Kopf Muskeln enthalten weniger VZ 25, regeneriert langsamer, und Bindegewebe wird nach der Verletzung 26 Darüber hinaus gebildet, wuchernden SCs aus branchiomeric Kopfmuskeln auch andere Transkriptionsfaktoren zum Ausdruck bringen. Beispielsweise wird Tcf21, ein Transkriptionsfaktor für kraniofazialen Muskelbildung stark Regenerieren Hauptmuskeln, aber kaum bei der Regeneration Beinmuskeln 25 ausgedrückt. Die Muskeln in den weichen Gaumen der CLP-Patienten sind in der Regel kleiner und weniger gut organisiert im Vergleich zu normalen Gaumenmuskulatur 27,28. Langsame und schnelle Fasern sind sowohl in den weichen Gaumen Muskeln vorhanden, aber die langsamen Fasern sind reichlich vorhanden. Im Gegensatz dazu enthalten Spalt Muskeln einen höheren Anteil an schnellen Fasern und auch eine reduzierte Kapillarzuführungim Vergleich zu normalen Gaumenmuskulatur 29-31. Schnellen Fasern sind anfälliger für Kontraktion induzierte Schädigung 31-33. Die begleitende schlechte kapillare Versorgung kann auch zu fördern Fibrose 34,35. All diese Aspekte können für die Armen Regeneration des weichen Gaumens Muskeln nach dem chirurgischen Verschluss Spalt 36 bei. Im Hinblick darauf ist ein Protokoll für die Isolierung und Charakterisierung von branchiomeric Kopf Muskel SCs entscheidend. Dies bietet die Möglichkeit, SC Biologie branchiomeric Kopf Muskeln zu studieren. Darüber hinaus können neue Therapien auf Basis von Tissue Engineering entwickelt, um die Muskelregeneration nach der Operation in CLP und andere Bedingungen zu riskieren, kraniofazialen Bereich zu fördern.
Im Allgemeinen kann SCs nach Dissoziation von Muskelgewebe 14 erhalten werden. Mincing, enzymatische Verdauung, und Verreiben in der Regel erforderlich, um SCs aus ihrer Nische zu lösen. SCs können durch Pre-Plattierung auf unbeschichteten Gerichte 14,37,38 gereinigt werden, fractionation auf Percoll 39,40 oder Fluoreszenz- oder magnetischen Zellsortierung 41-43. Hier präsentieren wir eine neue wirtschaftliche und schnelle Protokoll zur Isolierung von Satellitenzellen aus branchiomeric Kopfmuskeln der jungen erwachsenen Ratten. Dieses Protokoll basiert auf einer früheren Manuskript 14 und speziell für kleine Gewebeproben angepasst basiert. Die Isolierung von SCs aus repräsentativen Muskeln aus der 1., 2., und 4. Kiemenbögen Ursprung beschrieben. Nach der Isolierung sind geringe Zahl von Satelliten-Zellen auf extrazelluläre Matrix-Gel-Spots von Millimetergröße, um ihre Differenzierung zu untersuchen kultiviert. Dieser Ansatz vermeidet die Anforderung für den Ausbau und die Passage des SCs.
Protocol
Alle hierin beschriebenen Experimente wurden von den lokalen Vorstand für Tierversuche von der Radboud Universität Nijmegen in Übereinstimmung mit niederländischen Gesetzen und Vorschriften (RU-DEC 2013-205) zugelassen.
1. extrazellulären Matrix-Gel-Spots
- Die folgenden Schritte werden einen Tag vor der Trennung:
- Auftauen eines Aliquots der extrazellulären Matrix-Gel (100 ul) bei 4 ° C für mindestens 1,5 Std. 1:10 verdünnen in Dulbeccos modifiziertem Eagle-Medium; 4.500 mg / l Glucose, 4 mM L-Glutamin und 110 mg / ml Natriumpyruvat (DMEM). Halten die extrazelluläre Matrix-Gel bei 4 ° C zu allen Zeiten. Hinweis: Plötzliche Temperaturänderungen werden in ungleichmäßigen Beschichtung und Kristallbildung führen.
- Halten Sie das verdünnt extrazellulären Matrix-Gel-Lösung auf Eis für 15 min.
- Pre-Chillen ein 20 & mgr; l-Mikropipette für 10 min.
- Legen Sie 8-Well-Kammer-Objektträgern in eine 100 mm Petrischale und übertragen Sie die Schale auf eine kalte Oberfläche (zB ein Kühlakku) für 10 min.
- Verwenden Sie das vorgekühlte Mikropipette einen Tropfen von 10 ul der extrazellulären Matrix-Gel in jede Vertiefung setzen. Halten Sie die Petrischale auf der kalten Oberfläche für mindestens einen weiteren 7 min (Abbildung 1A).
- Vollständig zu entfernen, die verbleibenden extrazellulären Matrix-Gel (1B), und trocknen Sie die Vertiefungen bei 37 ° C über Nacht.
2. Dissection der Hauptmuskeln (Masseter, digastricus und Levator veli palatini)
- Vor ihrer Zerlegung, bereiten 50 ml phosphatgepufferter Salzlösung (PBS) mit 2% Penicillin-Streptomycin (P / S) ergänzt. Halten Sie auf dem Eis.
- Nach Euthanasie eines jungen erwachsenen Ratten (9 Wochen) mit CO 2 / O 2, enthaupten den Kopf und entfernen Sie die Haut vom Kopf. Übertragen Sie den Kopf, um eiskaltem PBS, ergänzt mit 2% P / S in ein 50 ml Röhrchen.
- M. masseter (von der 1. Kiemenbogens abgeleitet)
- Platzieren Sie den Kopf mit einer Seite auf einem Silikon-Pad und befestigen mit Injektions needles (2A).
- Identifizieren Sie die Ohrspeicheldrüse und der Gesichtsnerven (2A). Setzen Sie die tiefe Faszie Abdecken der Drüse. Schneiden Sie die Blende und entfernen Sie die Verschraubung mit Dissektion Schere. Identifizieren Sie den äußeren Gehörgang. Verfolgen Sie die Gesichtsnerven von den Foramen stylomastoideum und entfernen Sie vorsichtig die zeitlichen, Jochbein und Wangen Zweige mit einer Skalpellklinge No. 15.
- Befreie die oberflächliche Kopf des M. masseter durch Entfernen der Blende. Identifizieren sowohl oberflächliche und tiefe Köpfe des M. masseter. Verfolgen Sie die oberflächliche Kopf, bis seine dicken Sehnen Aponeurose in den Processus zygomaticus der Maxilla eingesetzt.
- Trennen Sie die Sehne von seinem Ursprung am Jochbein mit einer geraden Pinzette. Schneiden Sie es mit einer Skalpellklinge No. 15 oder Dissektion Schere und sorgfältig Leben es (2B).
- Präparieren Sie die oberflächliche Kopf der masseter, bis seine Einführung am Winkel und schlechtere Hälfte ter Mantelfläche des Ramus des Unterkiefers mit einer Skalpellklinge No. 15 (Abbildung 2C). Nun, ganz den Muskel zu entfernen.
- Hintere Bauch des M. digastricus (aus der 2. Kiemenbogen abgeleitet)
- Platzieren Sie den Kopf in Rückenlage auf dem Silikon-Pad und befestigen mit Injektionsnadeln (3A).
- Entfernen Sie das Unterhautfett, die über beide sublingual und submandibularis. Dann entfernen Sie den oberflächliche Faszie und Drüsen mit Dissektion Schere. Setzen Sie den M. digastricus (vordere und hintere Bauch).
- Halten Sie den vorderen Sehne des hinteren Bauch mit einem geraden Pinzette, schneiden Sie es, und sezieren sie vorsichtig, bis seinen Ursprung in der Bulla tympanica (3B). Wiederholen Sie den Vorgang auf der Gegenseite.
- Levator veli palatini Muskel (ab dem 4. Kiemenbogen abgeleitet)
- Nach Präparation der hintere Bauch des M. digastricus, Lokalisieren M. stylohyoideus, ziehen Sie es seitlich, und ziehen Sie sie vorsichtig (4A).
- Lokalisieren Sie die Sehne des Levator veli palatini, die an der Bulla tympanica (4A) einfügt. Sezieren sie sorgfältig und schneiden Sie es auf beiden Seiten.
- Suchen Sie nach der Luftröhre und der Speiseröhre, die dahinter läuft. Heben Sie die Speiseröhre, und setzen die Rachen, Kehlkopf und den weichen Gaumen.
- Lokalisieren Sie den Bereich des weichen Gaumens, wo die levator veli palatini eingesetzt und schneiden Sie es lose (4B).
Hinweis: Direkt nach der Sektion, entfernen Sie vorsichtig Sehnen und Bindegewebe aus jeder Muskel unter dem Stereomikroskop. Tauchen Sie alle Proben schnell in Ethanol 70%, und sie auf eiskaltem PBS ergänzt 2% P / S in einem 15-ml-Tube.
3. Isolierung von Satelliten-Zellen
- Führen Sie die folgenden Vorbereitungsschritte für SC Isolation von 3 Muskelgruppen:
- Vorbereitung 7,5 ml 0,1% Pronase in DMEM. Die Lösung wird durch ein 0,22 um-Filter. Vorwärmen der Lösung bei 37 ° C in einem Wasserbad für 10 min vor der Isolierung.
- Vorbereitung 35 ml DMEM mit 10% Pferdeserum (HS) und 1% P / S ergänzt. Auch vor, eine warme bei 37 ° C im Wasserbad.
- Vorbereitung 15 ml Kulturmedium, das aus DMEM, ergänzt mit 20% fötalem Rinderserum (FBS), 10% HS, 1% P / S und 1% Hühnerembryoextrakt (CEE). Pre-warmen bei 37 ° C im Wasserbad.
- Vorstrich sechs Plastikpipetten (10 ml) mit HS und trocken für mindestens 10 min vor dem Gebrauch.
- In der Kultur Haube, übertragen jeden Muskel in eine Vertiefung einer 6-Well-Platte. Mit Hilfe der Dissektion Schere, schnitt die Muskeln in kleine Stücke von etwa 2 mm. Achten Sie darauf, um das Gewebe zu viel Blatt vor den Mund.
- 2,5 ml 0,1% Pronase-Lösung sorgfältig auf jede weitere gut und bei 37 ° C für 60 min. Die Platte Schütteln Sie nach 20, 40 und 60 min. Hinweis: Die genaue duration der Inkubation ist abhängig von Faktoren wie Alter und Belastung der Tiere.
- Überwachung unter dem Mikroskop. Überprüfen Sie die Muskelfragmente und stoppen die enzymatische Verdauung, wenn die Fasern Bündel einen gelockerten Aussehen (Abbildung 5).
- Hinzuzufügen 2,5 ml DMEM, ergänzt mit 10% HS und 1% P / S. Transfer in ein 15 ml Zentrifugenrohr und die Rohre bei 400 xg für 5 min. Entsorgen Sie den Überstand durch Dekantieren.
- 5 ml DMEM mit 10% HS und 1% P / S ergänzt. Pipettieren der Lösung nach oben und unten mit einer 10 ml Kunststoffpipette (Verreibung) für mindestens 20 Mal, um das Gewebe zu homogenisieren.
- Zentrifugieren der Röhren bei 200 g für 4 min. Sammeln Sie den Überstand und Überführung in eine 15-ml-Tube.
- 5 ml DMEM mit 10% HS und 1% P / S ergänzt. Pipette wieder mit einer 10 ml Kunststoffpipette bis die Gewebefragmente verläuft leicht durch die Pipette.
- Zentrifugieren der Röhren bei 200 g für 4 min und sammle den Überstand in ein 15 ml Röhrchen.
- Put eine Zelle Sieb (40 & mgr; m) auf ein 50-ml-Tube und den Überstand, der die dissoziierten Zellen auf den Filter. Mit 1 ml DMEM für maximale Erholung der Zellen zu waschen.
- Zentrifugieren Sie die Röhrchen bei 1.000 × g für 10 min und den Überstand verwerfen mit einer Pipette.
- Das Pellet in 300 ul Kulturmedium und zähle die Zellen in einem Hämocytometer.
4. Differenzierung von Satellitenzellen auf extrazellulären Matrix-Gel-Spots
- Verdünne die Zellsuspension auf 1.5 x 10 3 Zellen in 10 ul Kulturmedium zu erhalten.
- Die Abdeckungen der Kammern Folien mit Klebeband und markieren Sie die Stellen mit einem schwarzen Marker auf der Unterseite des Objektglas.
- Mit einer Mikropipette, einen Tropfen von 10 ul Zellsuspension auf die extrazelluläre Matrix-Gel vor Ort. Überprüfen Sie unter dem Mikroskop, ob die Tropfen Zellsuspension korrekt auf der Stelle platziert. Inkubieren für 6 Stunden bei 37 ° C.
- Vorsichtigly werden 400 ul Kulturmedium (DMEM mit 20% FBS, 10% HS, 1% P / S und 1% CEE) und Inkubation für drei Tage bei 37 ° C.
Hinweis: An dieser Stelle werden frisch isolierten SC zu massiven Trauma (enzymatischer Verdau und harte Verreiben) unterzogen und sie wiederherstellen müssen. Während der ersten drei Tage 37. Weiter die Zellen nicht stören, kann das Kulturmedium in Abhängigkeit von der Art des Experiments geändert werden.
Die extrazelluläre Matrix Gelflecken mit hoher Zelldichte (1,5-2,5 x 10 3/20 ul) für die Differenzierung Assay ausgesät werden. Kulturmedium (DMEM, ergänzt mit 20% FBS, 10% HS, 1% P / S und 1% Hühnerembryoextrakt) kann alle drei Tage ausgetauscht werden. - Alternativ, wenn Erweiterung und Weitergabe ist erwünscht, befolgen Sie bitte folgende Schritte:
- Auftauen eines Aliquots der extrazellulären Matrix-Gel (500 ul) bei 4 ° C für mindestens 1,5 Std. Verdünnen 1:10 in DMEM und folgen Sie den Empfehlungen in Ziffer 1.1.1.
- Pre-Chill eine 10 ml Pipette für 10 Minuten bei 4 &# 176; C.
- Bringen Sie drei T75-Kolben auf eine kalte Oberfläche (zB ein Kühlakku) für 10 min.
- Verwenden Sie das vorgekühlte Pipette 1 ml extrazellulären Matrix Gel in jedem Kolben gegeben. Überprüfen Sie, dass die Oberfläche vollständig bedeckt ist. Halten Sie die Flaschen auf der kalten Oberfläche für mindestens einen weiteren 7 min (Abbildung 1A).
- Vollständig zu entfernen, die verbleibenden extrazellulären Matrix-Gel mit einer 10 ml Pipette, und trocknen Sie die Vertiefungen bei 37 ° C für 1 Stunde.
- Nach dem Zählen resuspendieren frisch isolierten SCs in 10 ml Kulturmedium (DMEM mit 20% FBS, 10% HS, 1% P / S und 1% Hühnerembryoextrakt) ergänzt und in den Samen vorbeschichtet T75-Flaschen.
- Nach drei Tagen, ändern Sie das Medium (und jeden dritten Tag), bis 80% Konfluenz erreicht ist. Für Passagieren, waschen Sie die T75-Kolben dreimal mit PBS. Next 1 ml 0,25% Trypsin-Lösung und Inkubation für drei Minuten bei 37 ° C. Resuspendieren in 9 ml Kulturmedium (DMEM, supplementiert mit 20% FBS, 10% HS, 1% P / Sund 1% Hühnerembryoextrakt) und zentrifugiert bei 200 g für 5 min. Überstand verwerfen. Nach dem Zählen resuspendieren 1 x 10 6 Zellen in 1000 ul des Kulturmediums und Einfrieren der Zellen.
Representative Results
Mit diesem Protokoll, das M. masseter (eine Seite) ergibt 0,8-1 × 10 6 Zellen der M. digastricus (Venter posterior) ergibt 1,5-2 x 10 5 Zellen und levator veli palatini Muskel Erträge 1-1,5 x 10 5 Zellen. Zellausbeuten hängen von der Muskeltyp-Stamm und dem Alter des Tieres. Zum Vergleich zwischen den drei Muskelgruppen wurden frisch isolierte SCs gleichzeitig Zelldichte (1,5 x 10 3/10 ul) geimpft. Direkt nach der Isolierung von mehr als 90% der frisch isolierten Zellen exprimieren Pax7 (Abbildung 6).
Tag 4, 7 und 10 Kulturen wurden mit Antikörpern gegen Pax7, MyoD, MYOG und MyHC Immunfärbung gefärbt. Fünf willkürliche Felder wurden pro Kultur mit einem 20x-Objektiv gezählt. Am Tag 4 Pax 7 und Myo D wird in allen Muskelgruppen zum Ausdruck (6 und 7 und 8), aber die Nachkommen SatCs vom masseter und M. digastricus Muskeln beginnen expressingen Myogenin früher als die levator veli palatini Muskel (Abbildung 9). Am Tag 10 wird die Expression MYOG stark in allen Gruppen reduziert werden (Abbildung 9). Ein paar Tage nach der Aussaat auf den extrazellulären Matrix-Gel-Spots, beginnen die wuchernden Zellen zu verschmelzen und bilden mehrkernigen Myotuben, die Myosin schwere Kette zum Ausdruck bringen. Kleine Myotuben sind am Tag 7 (Figur 10) sichtbar. Am Tag 10 kann Zucken der Myotuben zu beachten (Video 1).

Abb. 1: extrazelluläre Matrix-Gel-Spots in einer Kammer Schieber (A) für die einfache Handhabung, platzieren Sie den 8-Well-Kammerobjektträger in eine 100 mm Petrischale. Pipettieren Sie 10 ul der extrazellulären Matrix-Gel in jeder Kammer und legte sie auf einer kalten Oberfläche (7 min). (B) Kammer Folie, nach der überschüssige extrazelluläre Matrix gel wird entfernt.

Abb. 2: Präparation des M. masseter (A) Kopf des Tieres in einer Seitenansicht. Ohr (E), Ohrspeicheldrüse (P) und Gesichtsnerv (VII). (B) Sehnen Aponeurose (Te) der oberflächlichen Kopf des M. masseter (Ms) und Schläfenmuskel (T). Trennen Sie die Sehne von seinem Ansatz mit einer Pinzette. (C) vorsichtig die Muskeln zu zerlegen, bis sein Einsetzen in den Ramus des Unterkiefers. E: Ohr, P: Ohrspeicheldrüse, VII: Gesichtsnerv, T: Schläfenmuskel, Ms: oberflächliche Kopf des M. masseter, Te: Sehnen, Mp: deep Kopf des M. masseter.

Abbildung 3: Dissektion der hintere Bauch des M. digastricus (.A) Kopf des Tieres in Rückenlage. Lokalisieren Sie den Unterkieferspeicheldrüse (Sg), M. masseter (M), Gesichtsnerv (VII) und M. sternocleidomastoideus (SCM). Entfernen Sie den Unterkieferspeicheldrüse. (B) Lokalisieren Sie den M. digastricus vorderen (AD) und hintere Bauch (PD). Mit einer geraden Zange nehmen Sie die vordere Sehne des hinteren Bauch, schneiden Sie es und sezieren sie vorsichtig, bis seinen Ursprung in der Bulla tympanica (ty). E: Ohr, Sg: Unterkieferspeicheldrüse, VII: Gesichtsnerv, M: M. masseter, SMC: M. sternocleidomastoideus, AD: vordere Bauch M. digastricus, PD: hintere Bauch M. digastricus, Ty: Bulla tympanica.

Abb. 4: Dissektion der levator veli palatini Muskel (A) Allgemeine Ansicht nach Präparation des M. digastricus (Venter posterior). M. stylohyoideus (St) und Sehne des Levatorveli palatini lokalisiert werden. Beachten Sie die Luftröhre (T) und der Speiseröhre (Es) dahinter läuft. (B) Nach dem Anheben der Luftröhre und die Speiseröhre des Rachens (P) ausgesetzt ist. Das Einsetzen des levator veli palatini in den weichen Gaumen ist jetzt sichtbar. Der Pfeil zeigt die seziert weichen Gaumens mit den levator veli palatini Muskeln auf beiden Seiten. E: Ohr, St: M. stylohyoideus, VII: Gesichtsnerv, M: M. masseter, AD: vordere Bauch M. digastricus, PD: hintere Bauch M. digastricus, T: Luftröhre, Es: Speiseröhre, P: Rachen, * levator veli palatini Muskel .

Abbildung 5: Darstellung des Muskelgewebes (A) vor und (B) nach der enzymatischen Digestion mit Pronase. Beachten Sie, dass Muskelbündel scheinen nach dem enzymatischen Abbau gelöst werden.
Abbildung 6: Pax 7 Immunofärbung Frisch isolierte SCs, an extrazelluläre Matrix Gel am Ende der Isolierung aufgebracht (ungefähr 6 Stunden nach der ersten Gewebe Verdauung).. Fünf beliebige Körper wurden unter Verwendung eines 10X-Objektiv mit einem Durchschnitt von 210 Zellen pro Feld gezählt. Etwa 90% der Zellen sind Pax 7 positiv. DAPI: blau, Pax7: rot. Maßstabsbalken, 100 um.

Fig. 7: Pax 7, MyoD Immunofärbung Tag 4, 7 und 10 Kulturen wurden mit Antikörpern gegen Pax7 und MyoD Immunfärbung gefärbt. (A - C) und (D - F) Repräsentative Mikrophotographien von Tag 4 und 7 Kulturen von M. masseter. (G und H + und MyoD + Kerne pro mikroskopischen Feld wurde gezählt und als Prozentsatz der Gesamtzahl von Kernen (DAPI) ausgedrückt. DAPI: blau, Pax7: rot, und MyoD: grün. Scales bar, 100 & mgr; m. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abb. 8: Verteilung der Pax7 ± / MyoD ± in Kulturen von mononukleären Zellen in Kulturen aus masseter, M. digastricus und levator veli Gaumenmuskel (A - C) Tag 4, 7 und 10 Kulturen wurden mit Antikörpern gegen Pax7 und MyoD Immunfärbung gefärbt. Die Gesamtzahl der Zellen an der Gesamtzahl von Kernen (DAPI) basiert. (D) Daten Quantifizierung Pax7 ± / MyoD ± cells. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Fig. 9: Myogenin Immunofärbung Tag 4, 7 und 10 Kulturen wurden mit Antikörpern gegen Myogenin gefärbt. (A - D) Repräsentative Mikrophotographien von Tag 4 und 7 Kulturen aus dem levator veli Gaumenmuskel. (E) Die Anzahl der Kerne pro MYOG + mikroskopischen Feld wurde gezählt und als Prozentsatz der Gesamtzahl von Kernen (DAPI) ausgedrückt. (F) Daten Quantifizierung MYOG + Zellen. DAPI: blau, Myogenin: grün. Scales bar, 100 & mgr; m. Bitte klicken Sie hier, um eine größere Version dieses figur ansehene.

Abb. 10: Myosin Heavy Chain Immunfärbung Tag 4, 7 und 10 Kulturen wurden mit Antikörpern gegen Myosin schwere Kette (MyHC) gefärbt. Repräsentative Mikrophotographien von Tag 4, 7 und 10 Kulturen vom digastric (DIG) Muskel. Am Tag 7 vorhanden sind kleine Myotuben, während am Tag 10 lange und gut organisierte Myotuben sind offensichtlich. Scales bar, 200 & mgr; m. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Video 1:.. Myotube Zucken Beispiele für zwei repräsentative Felder mit zuck Myotuben für Tag 10 Kulturen von M. digastricus gezeigt Bitte klicken Sie hier, um dieses Video anzusehen.
Discussion
SCs aus verschiedenen branchiomeric Kopf Muskeln wurden von einer 9 Wochen alten Wistar-Ratte und kultiviert direkt auf der extrazellulären Matrix-Gel-Spots ohne vorherige Expansion und Passagieren isoliert. Nach der Isolierung wurden die Zellen gezählt und ausgesät gleichzeitig Zelldichte. Für die parallele Isolierung von drei verschiedenen Muskeln, nimmt diese Methode etwa 4 Stunden. Kultur Kontamination zu vermeiden, ist ein entscheidender Schritt der schnellen Waschen in Alkohol 70% nach der Sektion der Muskeln.
Während SC Isolierung ist es wichtig, die Muskeln in kleine Stücke (ca. 2 mm) geschnitten, aber vermeiden Sie zu viel Fleischwolf, da dies in einem kleinen Zellausbeute wegen der Zellschäden führen. Außerdem muß die Dauer der enzymatischen Verdauung genau unter dem Mikroskop überprüft werden, um weitere Schäden zu vermeiden. Das Ziel der Verdauung ist es, die Muskelfasern zu trennen. Da mehr als 90% der isolierten Zellen exprimieren Pax7, ist keine weitere Reinigung erforderlich ist (Figuren 6-8).Dies vermeidet zusätzliche Reinigungsschritte in anderen Verfahren wie Vorgalvanisierung auf unbeschichtetem Schalen 14,37,38, Fraktionierung auf Percoll 39,40 oder Fluoreszenz- oder magnetische Zellsortierung 41,43. Zum Zerreiben ist es wesentlich, Scherung zwischen den Gewebefragmente und die Öffnung der Pipettenspitze zu induzieren, weil damit die mechanische Freisetzung des SCs. Wenn das Verreiben mit einer 10 ml Pipette (Innendurchmesser-Tipp: 1 mm) ist es schwierig, ein 5 ml (Innendurchmesser Spitze: 2 mm) kann Pipette zuerst verwendet werden. Alternativ können Glaspasteurpipetten beim gewünschten Durchmesser geschnitten werden und verwendet werden. Dieses Verfahren ist einfach, effizient und ermöglicht die gleichzeitige Isolierung von SC aus verschiedenen Muskelproben.
Die Kulturplatten für SCs können mit Gelatine oder Kollagen überzogen sein, aber unsere früheren Studien zeigen, dass die extrazelluläre Matrix-Gel ist viel besser für die Aufrechterhaltung der myogenen Potential als Kollagen 38. Die extrazelluläre Matrix Gel FleckenMillimeter (10 ul / Ø 2 mm oder 20 & mgr; l / Ø 4 mm) ermöglicht die Untersuchung der Proliferation und Differenzierung von SCs mit begrenzter Anzahl von Zellen. Zur Differenzierung Assay etwa 8 bis 20 mal weniger Zellen benötigt werden, verglichen mit einem 24-Well-Platte (Ø 15,6 mm) und etwa 80 bis 200 Mal weniger, verglichen mit 35 mm Petrischalen (Ø 35 mm) 14,38.
Da extrazelluläre Matrix Gel teuer ist, ist dieses Verfahren auch kostengünstiger. Darüber hinaus kann die Kammer-Objektträgern von Plastikabdeckung ersetzt werden gleitet, um die Kosten weiter zu reduzieren. Zur Herstellung der extrazellulären Matrix Gelflecken Nacht Trocknen der Kammer gleitet wesentlich. Da die extrazelluläre Matrix Gelflecken transparent sind, ist es notwendig, die Punkte auf der Unterseite wieder mit Licht markieren. Die Kammern Träger werden in einer Petrischale für die einfache Manipulation fixiert. Weitere Zellkultur Erweiterung ist nicht erforderlich, was die Möglichkeit, die SCs von smal Studie bietetler Muskeln oder kleine Muskelproben. Alternativ können zB für PCR oder Muskel-Konstrukte, wenn mehr Zellen benötigt werden, können die frisch isolierten SCs ersten in T75-Flaschen erweitert werden, wie oben angegeben.
SCs isoliert unter Verwendung dieses Protokolls sind nicht geeignet für die weitere Reinigung mit Durchflusszytometrie unmittelbar nach der Isolierung. Der Verdau mit Pronase bewirkt umfangreichen Verdauung der Oberflächenantigene 14. Pferdeserum und fötalem Rinderserum, das für die Zellkultur verwendet werden, müssen zuerst ordnungsgemäß vor der Isolierung gekennzeichnet werden, wie unterschiedlichen Chargennummern Myoblasten Proliferation und Differenzierung unterschiedlich betroffen.
In den letzten Jahren gibt es ein wachsendes Interesse an den Muskeln der Kiemenbögen und Kopfmesoderm (zB die Augenmuskeln) 24 abgeleitet. Es hat sich deutlich gezeigt, dass Kopf- und Beinmuskeln sehr unterschiedliche Eigenschaften besitzen. M. masseter von alten Tieren scheint neuTain ihre Regenerationsfähigkeit im Vergleich zu den Beinmuskeln 25,26. SCs aus den Augenmuskeln besitzen eine robuste Proliferation und Differenzierung Kapazität vergleichbar mit SCs von Kopf Muskeln und zeigen ein größeres Potential als engraftment Extremität Muskel SCS 24.
Der Fasertyp Verteilung und Myosin Zusammensetzung variiert zwischen den Muskelgruppen und auch zwischen den Arten. Muskeln Ursprung aus dem ersten Kiemenbogen im Menschen enthalten sowohl langsame als auch schnelle Fasern (Subtypen IIA und IIX), neonatalen Myosine und Myosine typisch für die Entwicklung von Herzmuskel. Bei Nagetieren diese Muskeln enthalten etwa 95% schneller Fasern Myosin IIa und IIb) 44-46. Untersuchungen an Hühner Muskeln zeigen, dass SCs aus verschiedenen Muskelfasertypen variieren in Differenzierungskapazität. SCs von schnellen Fasern nur in schnellen Muskelfasern zu differenzieren, während VZ von langsamen Fasern können in beide Fasertypen 47 zu differenzieren. Darüber hinaus ist der Anteil der SCs in schnellen MuskelFasern niedriger ist als in langsamen Muskelfasern 48,49. Dies zeigt an, dass der Fasertyp Verteilung zu berücksichtigen, für Studien über Muskeln im Gesichtsschädelbereich genommen werden. Ähnlich wie Gaumenspalte Muskeln, die LVP bei Nagern enthält fast ausschließlich schnellen Fasern 50. Aus diesem Grund sind SCs aus der LVP für präklinische Studien im Bereich der Gaumenspalte.
Dieses Protokoll bietet neue Möglichkeiten, um SCs aus branchiomeric Kopf Muskeln oder andere kleinere Muskeln oder kleineren Muskeln Proben abgeleitet studieren. Dadurch wird die Entwicklung neuer Therapien erleichtern, um die Regeneration von Muskeln in der Kiefer- und Gesichtsbereich bei Zuständen wie Gaumenspalte, sondern auch in anderer Erkrankungen kleineren Muskeln zu verbessern.
Materials
| Name | Company | Catalog Number | Comments |
| Hypodermic Needle 25 G 0.5 x 25 m | BD Microlance | 300400 | |
| Dissecting scissors | Braun | BC154R | |
| Micro forceps straight | Braun | BD330R | |
| Surgical Scalpel Blade No. 15 | Swann-Morton | 0205 | |
| Alcohol 70% | Denteck | 2,010,005 | |
| Permanox Slide, 8 Chamber | Thermo Scientific | 177445 | |
| 6 well cell culture plate | Greiner bio-one | 657160 | |
| Cell Culture Dishes (100 x 20 mm) | Greiner bio-one | 664160 | |
| 15 ml sterile conical centrifuge tube | BD Biosciences | 352097 | |
| 50 ml sterile conical centrifuge tube | BD Biosciences | 352098 | |
| Cell strainer (40 μm) | Gibco | 431750 | |
| 10 ml serological pipette | Greiner bio-one | 607180 | |
| 20 µl FT20 | Greiner bio-one | 774288 | |
| Matrigel, Phenol-Red Free | BD Biosciences | 356237 | 10 ml |
| Pronase | Calbiochem | 53702 | 10 KU |
| Phosphate Buffered Saline | Gibco | 14190-144 | 500 ml |
| Dulbecco's Modified Eagle Medium, high glucose, GlutaMAX Supplement, pyruvate | Gibco | 10569-010 | 500 ml |
| Fetal Bovine Serum | Fisher Scientific | 3600511 | 500 ml |
| Horse Serum | Gibco | 26050088 | 500 ml |
| Penicillin-Streptomycin (10,000 U/ml) | Gibco | 15140-122 | 100 ml |
| Chicken Embryo Extract | MP Biomedicals | 2850145 | 20 ml |
References
- Gritli-Linde, A. Molecular control of secondary palate development. Developmental Biology. 301, 309-326 (2007).
- Marrinan, E. M., LaBrie, R. A., Mulliken, J. B. Velopharyngeal function in nonsyndromic cleft palate: relevance of surgical technique, age at repair, and cleft type. The Cleft Palate-Craniofacial Journal. 35, 95-100 (1998).
- Morris, H. L. Velopharyngeal competence and primary cleft palate surgery, 1960-1971: a critical review. The Cleft Palate Journal. 10, 62-71 (1973).
- Mossey, P. A., Little, J., Munger, R. G., Dixon, M. J., Shaw, W. C. Cleft lip and palate. Lancet. 374, 1773-1785 (2009).
- Boorman, J. G., Sommerlad, B. C. Musculus uvulae and levator palati: their anatomical and functional relationship in velopharyngeal closure. British Journal of Plastic Surgery. 38, 333-338 (1985).
- Bae, Y. C., Kim, J. H., Lee, J., Hwang, S. M., Kim, S. S. Comparative study of the extent of palatal lengthening by different methods. Annals of Plastic Surgery. 48, 359-362 (2002).
- Braithwaite, F., Maurice, D. G. The importance of the levator palati muscle in cleft palate closure. British Journal of Plastic Surgery. 21, 60-62 (1968).
- Inman, D. S., Thomas, P., Hodgkinson, P. D., Reid, C. A. Oro-nasal fistula development and velopharyngeal insufficiency following primary cleft palate surgery--an audit of 148 children born between 1985 and 1997. British Journal of Plastic Surgery. 58, 1051-1054 (2005).
- Phua, Y. S., de Chalain, T. Incidence of oronasal fistulae and velopharyngeal insufficiency after cleft palate repair: an audit of 211 children born between 1990 and 2004. The Cleft Palate-Craniofacial Journal. 45, 172-178 (1990).
- Kirschner, R. E., et al. Cleft-palate repair by modified Furlow double-opposing Z-plasty: the Children's Hospital of Philadelphia experience. Plastic and Reconstructive Surgery. 104, 1998-2010 (1999).
- Mauro, A. Satellite cell of skeletal muscle fibers. The Journal of Biophysical and Biochemical Cytology. 9, 493-495 (1961).
- Yablonka-Reuveni, Z. The skeletal muscle satellite cell: still young and fascinating at 50. The Journal of Histochemistry and Cytochemistry. 59, 1041-1059 (2011).
- Ten Broek, R. W., Grefte, S., Von den Hoff, J. W. Regulatory factors and cell populations involved in skeletal muscle regeneration. Journal of Cellular Physiology. 224, 7-16 (2010).
- Danoviz, M. E., Yablonka-Reuveni, Z. Skeletal muscle satellite cells: background and methods for isolation and analysis in a primary culture system. Methods in Molecular Biology. 798, 21-52 (2012).
- Seale, P., et al. Pax7 is required for the specification of myogenic satellite cells. Cell. 102, 777-786 (2000).
- Yablonka-Reuveni, Z., et al. The transition from proliferation to differentiation is delayed in satellite cells from mice lacking MyoD. Developmental Biology. 210, 440-455 (1999).
- Zammit, P. S., Partridge, T. A., Yablonka-Reuveni, Z. The skeletal muscle satellite cell: the stem cell that came in from the cold. The Journal of Histochemistry And Cytochemistry. 54, 1177-1191 (2006).
- Andres, V., Walsh, K. Myogenin expression, cell cycle withdrawal, and phenotypic differentiation are temporally separable events that precede cell fusion upon myogenesis. The Journal of Cell Biology. 132, 657-666 (1996).
- Fukushima, K., et al. The use of an antifibrosis agent to improve muscle recovery after laceration. The American Journal of Sports Medicine. 29, 394-402 (2001).
- Grefte, S., Kuijpers-Jagtman, A. M., Torensma, R., Von den Hoff, J. W. Skeletal muscle fibrosis: the effect of stromal-derived factor-1α-loaded collagen scaffolds. Regenerative Medicine. 5, 737-747 (2010).
- Jackson, W. M., Nesti, L. J., Tuan, R. S. Potential therapeutic applications of muscle-derived mesenchymal stem and progenitor cells. Expert Opinion on Biological Therapy. 10, 505-517 (2010).
- Sato, K., et al. Improvement of muscle healing through enhancement of muscle regeneration and prevention of fibrosis. Muscle, & Nerve. 28, 365-372 (2003).
- Tatsumi, R., Anderson, J. E., Nevoret, C. J., Halevy, O., Allen, R. E. HGF/SF is present in normal adult skeletal muscle and is capable of activating satellite cells. Developmental Biology. 194, 114-128 (1998).
- Stuelsatz, P., et al. Extraocular muscle satellite cells are high performance myo-engines retaining efficient regenerative capacity in dystrophin deficiency. Developmental biology. , (2014).
- Ono, Y., Boldrin, L., Knopp, P., Morgan, J. E., Zammit, P. S. Muscle satellite cells are a functionally heterogeneous population in both somite-derived and branchiomeric muscles. Developmental Biology. 337, 29-41 (2010).
- Pavlath, G. K., et al. Heterogeneity among muscle precursor cells in adult skeletal muscles with differing regenerative capacities. Developmental Dynamics. 212, 495-508 (1998).
- Koo, S. H., Cunningham, M. C., Arabshahi, B., Gruss, J. S., Grant, J. H. 3rd The transforming growth factor-beta 3 knock-out mouse: an animal model for cleft palate. Plastic and Reconstructive Surgery. 108, 938-948 (2001).
- Fara, M., Brousilova, M. Experiences with early closure of velum and later closure of hard palate. Plastic and Reconstructive Surgery. 44, 134-141 (1969).
- Lindman, R., Paulin, G., Stal, P. S. Morphological characterization of the levator veli palatini muscle in children born with cleft palates. The Cleft Palate-Craniofacial Journal. 38, 438-448 (2001).
- Hanes, M. C., et al. Contractile properties of single permeabilized muscle fibers from congenital cleft palates and normal palates of Spanish goats. Plastic and Reconstructive Surgery. 119, 1685-1694 (2007).
- Rader, E. P., et al. Contraction-induced injury to single permeabilized muscle fibers from normal and congenitally-clefted goat palates. The Cleft Palate-Craniofacial Journal. 44, 216-222 (2007).
- Rader, E. P., et al. Effect of cleft palate repair on the susceptibility to contraction-induced injury of single permeabilized muscle fibers from congenitally-clefted goat palates. The Cleft Palate-Craniofacial Journal. 45, 113-120 (2008).
- Macpherson, P. C., Dennis, R. G., Faulkner, J. A. Sarcomere dynamics and contraction-induced injury to maximally activated single muscle fibres from soleus muscles of rats. The Journal of Physiology. 500 (Pt 2), 523-533 (1997).
- Koch, K. H., Grzonka, M. A., Koch, J. The pathology of the velopharyngeal musculature in cleft palates). Annals of Anatomy. 181, 123-126 (1999).
- Fara, M., Dvorak, J. Abnormal anatomy of the muscles of palatopharyngeal closure in cleft palates: anatomical and surgical considerations based on the autopsies of 18 unoperated cleft palates. Plastic and Reconstructive Surgery. 46, 488-497 (1970).
- Carvajal Monroy, P. L., Grefte, S., Kuijpers-Jagtman, A. M., Wagener, F. A., Von den Hoff, J. W. Strategies to Improve Regeneration of the Soft Palate Muscles After Cleft Palate Repair. Tissue Engineering. Part B, Reviews. , (2012).
- Grefte, S., Kuijpers, M. A., Kuijpers-Jagtman, A. M., Torensma, R., Von den Hoff, J. W. Myogenic capacity of muscle progenitor cells from head and limb muscles. European Journal of Oral Sciences. 120, 38-45 (2012).
- Grefte, S., Vullinghs, S., Kuijpers-Jagtman, A. M., Torensma, R., Von den Hoff, J. W. Matrigel but not collagen I, maintains the differentiation capacity of muscle derived cells in vitro. Biomedical Materials. 7, 055004 (2012).
- Kastner, S., Elias, M. C., Rivera, A. J., Yablonka-Reuveni, Z. Gene expression patterns of the fibroblast growth factors and their receptors during myogenesis of rat satellite cells. The Journal of Histochemistry and Cytochemistry. 48, 1079-1096 (2000).
- Yablonka-Reuveni, Z., Quinn, L. S., Nameroff, M. Isolation and clonal analysis of satellite cells from chicken pectoralis muscle. Developmental Biology. 119, 252-259 (1987).
- Sherwood, R. I., et al. Isolation of adult mouse myogenic progenitors: functional heterogeneity of cells within and engrafting skeletal muscle. Cell. 119, 543-554 (2004).
- Gilbert, P. M., et al. Substrate elasticity regulates skeletal muscle stem cell self-renewal in culture. Science. 329, 1078-1081 (2010).
- Motohashi, N., Asakura, Y., Asakura, A. Isolation culture, and transplantation of muscle satellite cells. Journal of Visualized Experiments. , (2014).
- Sciote, J. J., Horton, M. J., Rowlerson, A. M., Link, J. Specialized cranial muscles: how different are they from limb and abdominal muscles. Cells, Tissues, Organs. 174, 73-86 (2003).
- Rowlerson, A., Mascarello, F., Veggetti, A., Carpene, E. The fibre-type composition of the first branchial arch muscles in Carnivora and Primates. Journal of Muscle Research and Cell Motility. 4, 443-472 (1983).
- Muller, J., et al. Comparative evolution of muscular dystrophy in diaphragm, gastrocnemius and masseter muscles from old male mdx mice. Journal of Muscle Research and Cell Motility. 22, 133-139 (2001).
- Feldman, J. L., Stockdale, F. E. Skeletal muscle satellite cell diversity: satellite cells form fibers of different types in cell culture. Developmental Biology. 143, 320-334 (1991).
- Schmalbruch, H., Hellhammer, U. The number of nuclei in adult rat muscles with special reference to satellite cells. The Anatomical Record. 189, 169-175 (1977).
- Gibson, M. C., Schultz, E. The distribution of satellite cells and their relationship to specific fiber types in soleus and extensor digitorum longus muscles. The Anatomical Record. 202, 329-337 (1982).
- Carvajal Monroy, P. L., et al. A rat model for muscle regeneration in the soft palate. PloS One. 8, e59193 (2013).
Tags
Developmental Biology Ausgabe 101 Kopf Muskeln levator veli palatini Muskel M. digastricus M. masseter Satellitenzellen Isolation Primärzellen Gaumenspalte regenerative Medizin Tissue Engineering Stammzellen Differenzierung MuskelfasernErratum
Formal Correction: Erratum: Isolation and Characterization of Satellite Cells from Rat Head Branchiomeric Muscles
Posted by JoVE Editors on 10/01/2015.
Citeable Link.
An erratum was issue for Isolation and Characterization of Satellite Cells from Rat Head Branchiomeric Muscles. The fourth figure was updated to explain the isolation of the LVP better.
Steps 2.5.3 and 2.5.4 were updated from:
2.5.3. Look for the trachea and the esophagus that runs behind it. Lift the esophagus, and expose the pharynx, larynx and the soft palate.
2.5.4. Localize the area of the soft palate where the levator veli palatini is inserted and cut it loose (Figure 4B).
to
2.5.3. Look for the trachea and the esophagus that runs behind it. Lift the esophagus, and expose the pharynx and the larynx.
2.5.4 Localize and dissect the area of the superior pharyngeal constrictor muscle. Identify the levator veli palatini and cut it at both sides (Figure 4B).
Figure 4 and its legend were updated from:
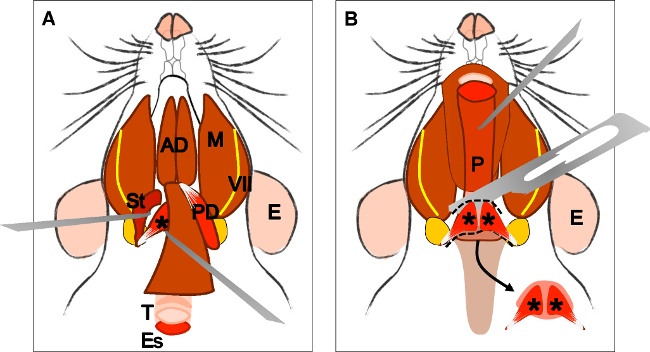
Figure 4: Dissection of the levator veli palatini muscle. (A) General view after dissection of the digastric muscle (posterior belly). Stylohyoid muscle (St) and tendon of the levator veli palatini can be localized. Note the trachea (T) and esophagus (Es) running behind it. (B) After lifting the trachea and the esophagus the pharynx (P) is exposed. The insertion of the levator veli palatini into the soft palate is now visible. The arrow indicates the dissected soft palate with the levator veli palatini muscles at both sides. E: ear, St: stylohyoid muscle, VII: facial nerve, M: masseter muscle, AD: anterior belly digastric muscle, PD: posterior belly digastric muscle, T: trachea, Es: esophagus, P: Pharynx, *levator veli palatini muscle.
to
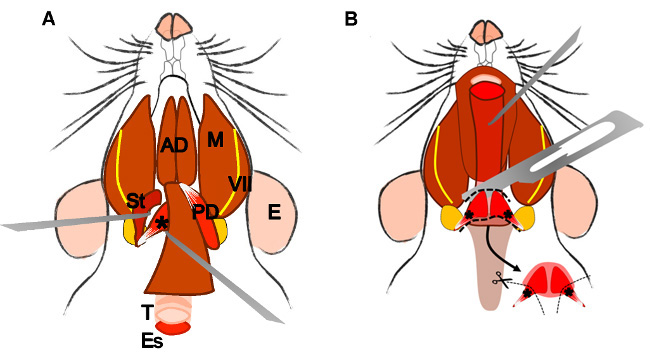
Figure 4: Dissection of the levator veli palatini muscle. (A) General view after dissection of the digastric muscle (posterior belly). Stylohyoid muscle (St) and tendon of the levator veli palatini can be localized. Note the trachea (T) and esophagus (Es) running behind it. (B) After lifting the trachea and the esophagus the pharynx (P) is exposed. The levator veli palatini that runs laterally towards the soft palate is now visible. The arrow indicates the dissected superior pharyngeal constrictor muscle; note the levator veli palatini muscles at both sides. E: ear, St: stylohyoid muscle, VII: facial nerve, M: masseter muscle, AD: anterior belly digastric muscle, PD: posterior belly digastric muscle, T: trachea, Es: esophagus, P: Pharynx, *levator veli palatini muscle.



