Introduction
믹소 바이러스 저항 (MX) 단백질은 바이러스 성 병원체에 대한 선천성 면역 방어의 중요한 부분입니다. 이 단백질은 유형 I 및 유형 III 인터페론에 의해 유도되는 큰 dynamin 같은 GTP 아제 있습니다. 대응 MX 유전자는 하나 또는 여러 복사본 거의 모든 척추 동물에 존재하고 이들 유전자 산물은 오르 쏘 믹소 바이러스과 (orthomixoviridae) (예., 인플루엔자 바이러스), Rhabdoviridae (예., 수 포성 구내염 바이러스), Bunyaviridae (예를 포함한 광범위한 바이러스를 억제한다. , 라크로스 바이러스)와 (예를 들어, 인간 면역 결핍 바이러스 1) 1-4 Retroviridae. 이 단백질은 바이러스와 같은 광범위한 인식 방법 명백한 공유 기본 순서가이 바이러스에 모티브없이 그것은 불분명하다. 잠재적으로 그들의 타겟을 갖는 MX 바이러스 단백질의 상호 작용을 분석하는 다른 숙주 세포 인자 고차 복합체를 포함하는, t 분자 메커니즘을 이해하는 데 도움이 될 것모자는 바이러스 및 호스트 사이의 군비 경쟁에 진화했다.
MX 포유류 단백질과 바이러스 표적 사이의 상호 작용은 인간 MXA 위해 가장 광범위하게 연구되어왔다. 인간의 MXA는 orthomyxoviruses 인플루엔자 A와 Thogoto 바이러스를 포함한 많은 바이러스의 복제를 억제 할 수 있습니다. MXA하여 감염 5 블록 결과 핵 항목을 방지 Thogoto 바이러스 리보 핵산 단백질 복합체 (vRNPs)를 결합한다. MXA 및 Thogoto 바이러스 vRNPs 간의 상호 작용은 공동 침전 및 공동 면역 침전 실험 6-9으로 증명되었다. MX 단백질은 인플루엔자 바이러스를 방해하는 방법이 명확하지 않을 수도 있습니다. 하나의 주요 문제는 MX 단백질 및 인플루엔자 유전자 생성물 간의 상호 작용을 보여주기 위해 간단하지 않다는 것이다. 한 보고서는 인플루엔자 바이러스에 감염된 세포 (10) 인간의 MXA 및 NP 단백질 사이의 상호 작용을 보여 주었다. 이러한 상호 작용은 공동 immunopr으로 표시 할 수있다ecipitation 세포 상호 작용이 과도 및 / 또는 약한 것을 시사 용해 전의 가교 시약 디티 오비스 (숙신 이미 딜 프로 피오 네이트)로 처리 된 경우. 보다 최근의 연구는 다른 인플루엔자 균주 차동 MX 감도 11,12 NP 단백질의 기원에 의해 결정된다는 것을 보여 주었다. 이와 라인에서, 인플루엔자 바이러스는 부분적으로 NP 단백질 (13)의 특정 잔류 물을 돌연변이에 의해 MX 컨트롤에서 탈출 할 수 있습니다. 이것은 호스트 MX 대 인플루엔자 바이러스의 주요 목표는 NP는 아마도 vRNP 착체에 조립 NP 단백질임을 시사한다. 그러나 이러한 최근의 연구 중 어느 것도 인플루엔자 NP 또는 vRNPs 및 중 인간의 MXA 또는 마우스 MX1 사이의 상호 작용을 보여 주었다 없습니다.
최근 우리가 처음으로 보여, 여기에 상세하게 설명되어 최적화 된 공동 면역 침전 프로토콜 (14)을 가진 인플루엔자 NP 및 마우스 MX1 단백질 사이의 상호 작용. 일반적으로, 공동 난에서mmunoprecipitation은 단백질 - 단백질 상호 작용을 조사하기 위해 가장 자주 사용되는 생화학 적 방법 중 하나이다. 그들의 자연 환경에서 단백질 - 단백질 상호 작용을 조사 할 수 때문에이 기술은 종종 다른 기술, 예를 들면, 효모 두 하이브리드보다 선호된다. 관심의 단백질에 대한 항체를 사용할 수있는 경우 공동 면역 침전은 내생 발현 된 단백질에서 수행 될 수있다. 대안 적으로, 관심있는 단백질은 형질 감염 또는 감염을 통해 세포 내에서 발현 될 수 있으며, 친 화성 태그가 사용될 수있다. 상술 한 이점 이외에, 설명한 공동 면역 침전 프로토콜 약한 및 / 또는 과도 단백질 상호 작용의 검출을 허용한다. 이 프로토콜의 최적화 된 주성분은 세포 용해 완충액에서 N-에틸 말레이 미드 (NEM)의 추가이다. NEM가 6.5-7.5의 pH에서, 예컨대 시스테인의 존재 자유 티올 기와 반응하여 알킬화 시약, 안정한 티오 에스테르를 형성(그림 1). 더 높은 pH에서, NEM은 아미노기와 반응하여 가수 분해를 15 겪을 수있다. NEM는 통상적으로 다이 설파이드 결합 형성을 방지 또는 효소 활성을 억제하기 위해, 자유 티올기를 차단하는 데 사용된다. 예를 들어, NEM은 종종 시스테인 프로테아제 desumoylating 효소를 차단하는 데 사용됩니다. 이 인플루엔자의 단백질은 바이러스 단백질 sumoylation (16) 사이의 상호 작용에 영향을 미칠 수있는 것으로 알려져 있었기 때문에 기재된 공동 면역 침전 프로토콜에서, NEM는 초기 용해 완충액에 포함시켰다. 예기치 않게, NEM의 첨가는 동시 면역에 의한 인플루엔자 NP MX1 및 마우스의 상호 작용을 문서화 키 것으로 판명. NEM의 첨가는 NP-MX1 상호 작용을 검출하는 것이 중요한 이유는 불분명하다. 아마도 상호 작용이 너무 과도 및 / 또는 약합니다. NEM MX1은 특정 형태의, 바이러스 단백질 또는 알 셋째 콤포넌트를 보존함으로써, 예를 들면 상호 작용을 안정화 할 수NENT. NEM 그러한 안정화 효과는 M1, 리보 뉴클레오티드 리덕 타제 억제제 및 젬시 타빈 (F2dC) (17) 사이의 상호 작용, 예를 들면, 이전에 관찰되었다. MX1과 순이익은 모두 NEM에 의해 수정 될 수있는 여러 시스테인 잔기를 포함한다. 예를 들어, 레니 외.의 최근 연구는 stalkless MXA-변형 요오도 아세트 아미드에 의해 수정 될 수있는 세 가지 용매에 노출 시스테인 잔기를 포함 보여 주었다. 세린 이러한 잔류 돌연변이은 MXA의 효소 활성에 영향을 미칠하지만, 이황화 매개 응집 (18)을 방해하지 않았다. 이들 시스테인이 MX1에 보존되기 때문에, 이것은 MX1에서 유사한 시스테인 NEM으로 이러한 영향의 형태 또는 용해도 같이 변형 될 수 있음을 시사한다. 또한,도 NEM MX1의 항 인플루엔자 활성에 필수적이다 MX1,는 GTPase의 활성에 영향을 주며 이에 MX1과 NP 사이의 상호 작용을 안정화 할 수 있습니다. 그러나,는 GTPase ACTI에 NEM의 직접적인 영향NEM 또한 인플루엔자 NP와는 GTPase MX1 단백질 돌연변이 체 (14)의 비활성 상태 사이의 상호 작용을 검출하기 위해 요구되는대로의 MX1 vity는 어렵다. 분명히, 더 많은 연구가 NP-MX1 NEM에 상호 작용의 효과를 해명하는데 필요하다.
요약하면, 상술 한 공동 면역 침전 프로토콜 MX1 바이러스 단백질 및 그 대상 바이러스, 인플루엔자 NP 단백질 사이의 상호 작용을 연구 할 수있다. 이 프로토콜은 또한 특정 단백질의 입체 형태에 의존하는 다른 안정화 약하거나 과도 상호 작용을 연구하는데 사용될 수있다. 입체 형태에 의존하는 특정 단백질 - 단백질 상호 작용은 칼 모둘 린 (19) 칼슘 결합 단백질, 예를 들면, 이전에 설명되었다. 마지막으로, NEM의 유익한 역할은 또한 공동 침전 분석법 등의 단백질 - 단백질 상호 작용을 검출하는 다른 방법에서 사용될 수있다.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
참고 : 다음 형질과 공동 면역 프로토콜 9cm 페트리 접시의 형식이 설정됩니다. 다른 포맷은 프로토콜들을 스케일링 한 후도 가능하다.
1. 시드 인간 배아 신장 (HEK) 293T 세포
- 10 % 소 태아 혈청 및 2 mM L- 글루타민, 0.4 mM의 나트륨 피루 베이트로 보충 된 둘 베코 변성 이글 배지 (DMEM) 12 ㎖ 중의 9cm 페트리 접시 당 1.2 × 106 세포에 형질 감염 전에 HEK293T 세포 하루 시드 0.1 mM 비 필수 아미노산, 100 U / ml의 페니실린, 0.1 ㎎ / ㎖ 스트렙토 마이신.
- 세포를 37 ℃에서 16 시간, 5 % CO 2를 성장.
- 시각적으로 형질 전환 전에 거꾸로 광학 현미경으로 형태 및 세포의 생존 능력을 검사합니다. 세포는 최적의 효율을위한 형질 서브 컨 플루 언트가 될 필요가있다.
HEK293T 세포 2. 칼슘 - 포스페이트 형질
주의: 사용 0.5 pCAXL-NP 또는 9cm 접시 당 pCAXL-MX1의 1-3 μg의와 함께 빈 pCAXL 플라스미드의 μg의. 모든 시료에서 총 플라스미드 DNA의 동일한 양을 사용하여; 빈 플라스미드 필요하다면 조정합니다.
- 다음 형질 버퍼를 준비합니다
- 1.0 mM 트리스 - 염산의 pH 8.0와 0.1 mM의 EDTA의 pH 8.0의 농도 트리스 EDTA (TE)를 준비합니다.
- 25 mM의 HEPES 농도와 BS / HEPES 준비 (5.96 g / L, 4- (2- 히드 록시 에틸) -1- 피페 라진 에탄 술폰산), 274 mM의 염화나트륨 (16g / L), 10 mM의 KCl을 (0.74 g / L), 1.5 mM의 NaHPO 4 · 12H 2 O (0.5 g / L) 11.1 MM의 포도당 (2g / ℓ). 7.05의 pH를 조정합니다.
- 1.25 M 염화칼슘 2 · 2H 2 O (183.8 g / L), 125 mM의 HEPES (29.79 g / L)의 농도의 염화칼슘 2 / HEPES를 준비합니다. NaOH로 7.05의 pH를 조정합니다.
- 사용 전에 37 ℃에서 형질 버퍼 따뜻한.
- TE 600 μL의 플라스미드 DNA를 플라스미드 희석하여 샘플을 준비한다.6 잘 판의 우물에서 이러한 혼합물을 준비합니다.
- 플라스미드 샘플에 적가 방식으로 염화칼슘 2 / HEPES 150 μl를 추가하고 위아래로 3 회 피펫 팅하여 혼합한다.
- (750 ㎕의 TE + DNA + 염화칼슘 2 / HEPES) 신선한 6 웰 플레이트에 제공 BS / HEPES 완충액 750 μL에 현명한 플라스미드 용액을 첨가 강하에 의한 형질 전환 솔루션을 준비합니다. 전체도 포함 BS / HEPES 버퍼 고르게 플라스미드 솔루션을 배포합니다.
- 1,000 RPM에서 90 초 동안 플레이트 진탕에 형질 전환 솔루션을 흔들어.
- 실온에서 5 분 동안 혼합물을 배양한다.
- 형질 용액 (1.5 ml)을 세포에 적가를 추가합니다. 세포에 형질 전환 솔루션을 물방울 P1000의 마이크로 피펫을 사용합니다. 전체 9cm 페트리 접시 위에 혼합물을 분산 매우 부드럽게 판을 흔들어.
- 6 시간 동안 CO (2)을 37 ° C에서 배양 한 세포를 5 %. 그런 열망으로 매체를 제거하고 즉시 위스콘신 교체12 ml의 신선한, 예열 매체 번째. 부드럽게 세포 박리를 방지하기 위해 세포에 새로운 배지를 추가한다. 이를 위해, 잘의 측면에 피펫의 끝을 잡고 부드럽게 매체를 밀어.
- 37 ℃에서 추가로 16 시간 동안 세포를 인큐베이션하고, 5 % CO 2.
3. 공동 면역 침전
참고 : 형질 전환 후 공동 면역 24 시간을 수행합니다.
- 저염 용해 완충액과 염분 세척 완충액의 제조.
- NEM의 양을 계량하고 무수 에탄올에 용해시켜 2 M-N 에틸 말레이 미드 (NEM)의 스톡 용액을 준비한다. 사용하기 전에 신선한 NEM 주식 솔루션을 준비합니다.
주의 : NEM은 매우 독성이 준비하고 흄 후드에서이 원액을 사용합니다. - 50mM 트리스 - 염산 pH를 8, 150 mM의 염화나트륨, 5 mM의 에틸렌 디아민 테트라 아세트산 (EDTA), 1 % NP40 및 프로테아제 저해제 칵테일의 농도에서 저염 용해 완충액을 제조 (표 1을 용해50 ml의 용해 완충액 t). 25 mM의 (즉, 1:80 희석)의 최종 농도 NEM을 추가합니다. 프로테아제 억제제 및 NEM을 추가 한 후 얼음에 보관하십시오.
참고 : 항상 사용 전에 갓 프로테아제 억제제 및 NEM을 추가합니다. - 50 mM 트리스 - 염산의 pH 8, 500 mM의 염화나트륨, 5 mM의 EDTA와 1 % NP40의 농도에서 높은 소금 세척 버퍼를 준비합니다. 높은 소금 세척 버퍼가 NEM을 포함하지 않습니다.
- NEM의 양을 계량하고 무수 에탄올에 용해시켜 2 M-N 에틸 말레이 미드 (NEM)의 스톡 용액을 준비한다. 사용하기 전에 신선한 NEM 주식 솔루션을 준비합니다.
- 세포 용 해물의 준비.
- 매체를 제거하고 차가운 얼음 인산염 완충 생리 식염수 2 ㎖ (PBS)와 세포를 씻으십시오. HEK293T 세포가 쉽게 분리로 아주 부드럽게 세척 버퍼를 추가합니다.
- PBS를 제거하고 9cm 페트리 접시 당 차가운 얼음 낮은 소금 용해 버퍼 600 μl를 추가합니다.
- 얼음에 20 분 동안 접시를 품어. 플레이트가 수평 유지되도록 용해 버퍼와 함께 접시 표면의 완전한 범위를 보장하기 위해, 확인하십시오. 부드럽게 5 분마다 판을 흔들.
- 1.5 ㎖의 마이크로 원심 분리에 세포 용 해물을 모아서4 ° C에서 3 분 16,000 XG 용 튜브와 원심 분리기는 불용성 부분을 펠렛.
- 신선한 1.5 ml의 마이크로 원심 튜브에 세포 용 해물 즉, 가용 분을 전송하고 얼음에 보관하십시오. 즉시 상호 작용 단백질의 분리를 방지하기 위해, 공동 면역 침전 프로토콜에 계속. 해물에서 단백질 분해 활동을 제한하기 위해 얼음에 가능한 한 많이 또는 4 ° C에서 다음의 모든 단계를 수행합니다.
- 면역 복합체의 생성.
주 :이 단계에서, 관심있는 단백질이 적절한 항체에 의해 결합된다. NP-MX1 상호 작용을 연구하기 위해, 마우스 항 NP 모노클로 날 항체를 사용한다.- 각 샘플에 대해, 항 NP 모노클로 날 항체와 2㎕의 저염 용해 완충액 (250 ㎕의 총 부피) 113 μL와 해물을 135 μL를 혼합한다. 같은 서양 모래 바닥으로 추가 분석을 위해 -20 ° C에서 나머지 해물을 저장 추측 INTERA의 발현 수준을 문서화형질 감염된 세포에서 ction의 파트너.
주 : 대안 적으로, 각각의 파쇄물을 위해, 예를 들어, 400 μg의를 (브래드 포드 (Bradford) 시약 등) 용 해물의 단백질 농도를 측정하고, 전체 단백질의 정량을 사용한다. - 4 ° C에서 회전 바퀴에 3 시간 동안 항체 해물 믹스를 품어. 이 단계는 밤새 인큐베이션로 확장 될 수있다.
- 각 샘플에 대해, 항 NP 모노클로 날 항체와 2㎕의 저염 용해 완충액 (250 ㎕의 총 부피) 113 μL와 해물을 135 μL를 혼합한다. 같은 서양 모래 바닥으로 추가 분석을 위해 -20 ° C에서 나머지 해물을 저장 추측 INTERA의 발현 수준을 문서화형질 감염된 세포에서 ction의 파트너.
- 단백질 G 비즈의 준비.
주 : 단백질 G 비드 배송 및 보존은 20 % 에탄올에 저장된다. 비드 슬러리는 일반적으로 50 %의 구슬로 구성되어 있으며이 면역 복합체를 면역 침전 사용하기 전에이 구슬을 세척 할 필요가있다.- 각 샘플에 대해, 즉 구슬, 50 μL, 비드 슬러리 100 μl를 사용합니다. 하나의 튜브에서 공동 면역 침전 분석에서 모든 샘플에 필요한 비드의 양을 씻는다. 비드 슬러리의 피펫을 완화하기 위해 1 ML의 피펫 팁의 끝을 잘라.
- 8000 X에서 단백질 G의 비드 슬러리를 원심 분리기g 30 초 동안 4 ° C. 에탄올 용액을 제거하고 낮은 소금 용해 버퍼의 동일한 볼륨을 추가합니다. 원심 분리기 단백질 G의 8000 XG에 비드 슬러리를 30 초 동안 4 ° C 조심스럽게 뜨는을 제거합니다. 이 세척 단계를 3 번 반복합니다.
주 : 프로테아제 억제제 또는 NEM을 포함 할 필요가없는 비드 세척하는데 사용 저염 용해 완충액. - 단백질 G 비드의 양을 추정하고 저염 용해 완충액 중 동일한 부피는 저염 용해 버퍼에 새로운 50 % 비드 슬러리를 만들기 위해 추가.
- 각 샘플의 경우, 신선한 1.5 ml의 microcentrifuge 관에서 비드 슬러리 100 μl를 전송하고 사용할 때까지 얼음에 저장합니다. 이 구슬 신속하게 튜브의 바닥에 침전으로, 분할하기 전에 비드 슬러리를 재현 탁주의하십시오.
- 단백질 G 비즈과 용출에 의한 면역 복합체의 면역.
- 원심 분리기 모든 튜브 30 초 8,000 XG에 4 ° C와에게 면역의 단백질 G 비즈를 사용하기 전에모든 샘플에 존재하는 비드의 동일한 양이 있는지 육안으로 확인한다. 필요한 경우 다시 샘플 및 원심 분리기의 일부에 비드의 양을 조정한다. 상층 액을 버린다. 펠렛 단백질 G 비즈를 방해하지 않도록주의하십시오.
- 간단히 면역 복합체를 원심 분리 (예., 항체, 250 μL와 해물) 8,000 XG에 30 초, 4 ° C에 대한 튜브의 하단에 전체 샘플을 수집합니다. 단백질 G 비즈 (50 μL)에 면역 복합체를 전송합니다.
- 4 ° C에서 회전 휠에 60 분을 품어. 단백질 G 비즈에 단백질의 비특이적 결합을 줄이기 위해 이러한 면역 복합체에게 구슬 이상 75 분을 배양하지 마십시오.
- 8000 XG에 30 초 (결합 된 면역 복합체와) 단백질 G 비즈를 원심 분리기 4 ° C와 상층 액을 제거합니다. 펠렛 단백질 G 비즈를 방해하지 않도록주의하십시오. 선택 사항 : -20 나중에 분석을위한 ° C ~ 41 ° C에서이 상층 액을 저장,예를 들면, 결합되지 않은 단백질의 양을 추정한다.
- 높은 소금 용해 버퍼 900 μL와 약 5 분 동안 단백질 G 비즈를 씻으십시오. 구슬이 완전히 최적의 세척 세척 완충액되어 있는지 확인합니다. 8000 XG에 30 초 동안 단백질 G 비즈를 원심 분리기 4 ° C와 상층 액을 버린다. 이 세척 단계를 4 회 반복한다. 면역 물질의 손실을 방지하기 위해 펠렛 단백질 G 비즈를 방해하지 않도록주의하십시오.
- 마지막 세척 단계 후, 비드에 배를 Laemmli 샘플 완충액 50 μL를 추가 한 (공) 면역 침전 된 단백질을 용리 95 ° C에서 10 분 동안 현탁액을 가열한다.
- 도데 실 황산나트륨 1g의 글리세롤 3.5 ㎖, 1 M 트리스 -HCl pH를 6.8 및 β 머 캅토 에탄올 420 ㎕를 3.5 ml의 6 배를 Laemmli 완충액 10 ㎖를 준비한다. 증류수를 첨가하여 10 ㎖의 전체 부피로 조정한다. 배를 Laemmli 완충액을 얻었다 증류수 3 회 희석.
주의 : &# 946; 머 캅토 에탄올은 독성이 준비하고 흄 후드에서 램 믈리 버퍼를 사용합니다.
- 도데 실 황산나트륨 1g의 글리세롤 3.5 ㎖, 1 M 트리스 -HCl pH를 6.8 및 β 머 캅토 에탄올 420 ㎕를 3.5 ml의 6 배를 Laemmli 완충액 10 ㎖를 준비한다. 증류수를 첨가하여 10 ㎖의 전체 부피로 조정한다. 배를 Laemmli 완충액을 얻었다 증류수 3 회 희석.
- 가열 후, 8000 XG에 30 초 동안 단백질 G 비즈를 원심 분리기 4 ° C (단기) 또는 -20 C (장기) °에서 샘플을 저장합니다.
4. 면역 단백질을 (공을) 분석
- SDS-PAGE (21, 22) (20) 및 웨스턴 블 롯팅에 의한 세포 용 해물과 공동 면역 침전의 용출 물에 존재하는 단백질을 시각화. 일반적으로 겔에 램 믈리 용출의 절반을로드합니다. 젤 로딩 샘플을 채취 할 때 펠렛 단백질 G 비즈를 방해하지 않도록주의하십시오. MX1과 순이익 발현은 안티 MX1 및 안티 NP 항체, 각각 14와 함께 공개했다. 밴드 계 화학 발광 HRP 및 X 선 필름 현상액으로 검출 하였다.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
N - 에틸 말레이 비가 역적 시스테인 프로테아제 (도 1)를 억제하는 예를 자유 티올기를 수정할 수있다 유기 화합물이다.
바이러스 MX1 단백질은 인플루엔자에게 바이러스의 핵 단백질과 상호 작용하여 바이러스 복제를 억제한다. 여기에 설명 된 최적화 된 공동 면역 프로토콜이 NP-MX1의 상호 작용을 연구 할 수 있습니다. HEK293T 세포는 인플루엔자 NP 단백질의 부재 또는 존재하에 MX1 바이러스 단백질 발현 벡터로 형질 감염시켰다. 다음으로, NP 단백질은 NP 특이 모노클로 날 항체로 총 세포 용 해물로부터 인출 다운이었다. 2 MX1 단백질 만 공동 면역 침전 공동 발현 NP의 존재 있음을 보여준다. NP의 부재 MX1 가능 비특이적 공동 면역 침전은 항 NP 항체에 의해 또는 MX1의 비특이적 결합함으로써 MX1 단백질의 비특이적 풀다운 두 경우에 발생단백질 G 비즈. 따라서, 항상이 비특이적 공동 면역 침전을 평가하기 대조군을 포함한다. 3 NP-MX1 상호 작용 만 NEM의 존재를 검출 할 수 있음을 보여준다. 이 실험에서, 단백질 G 비드에 MX1의 비특이적 결합을 방지 NP 항체의 부재하에 제어 공동 면역 반응을 평가 하였다.
이 프로토콜은 또한 MX1 감염된 세포로부터 단리 된 비리 온 또는 인플루엔자 NP 단백질 사이의 상호 작용을 연구하는데 사용될 수있다. 이러한 애플리케이션의 경우, 상기 프로토콜은 약간 MX1가 공동 면역 침전 프로토콜을 시작하기 전에 바이러스 NP 단백질을 함유 해물과 발현 세포의 용 해물을 결합하여 구성된 하였다.도 4를 NP와 MX1의 공동 - 면역 침전 형질 세포에 감염된 세포로부터 단리 도시 또는 비리.
결론적으로, 이들 결과는이 공동 - 면역 침전 PROT는 것을 보여ocol 단백질은 바이러스와 바이러스 표적 사이의 상호 작용을 연구하는데 사용될 수있다.
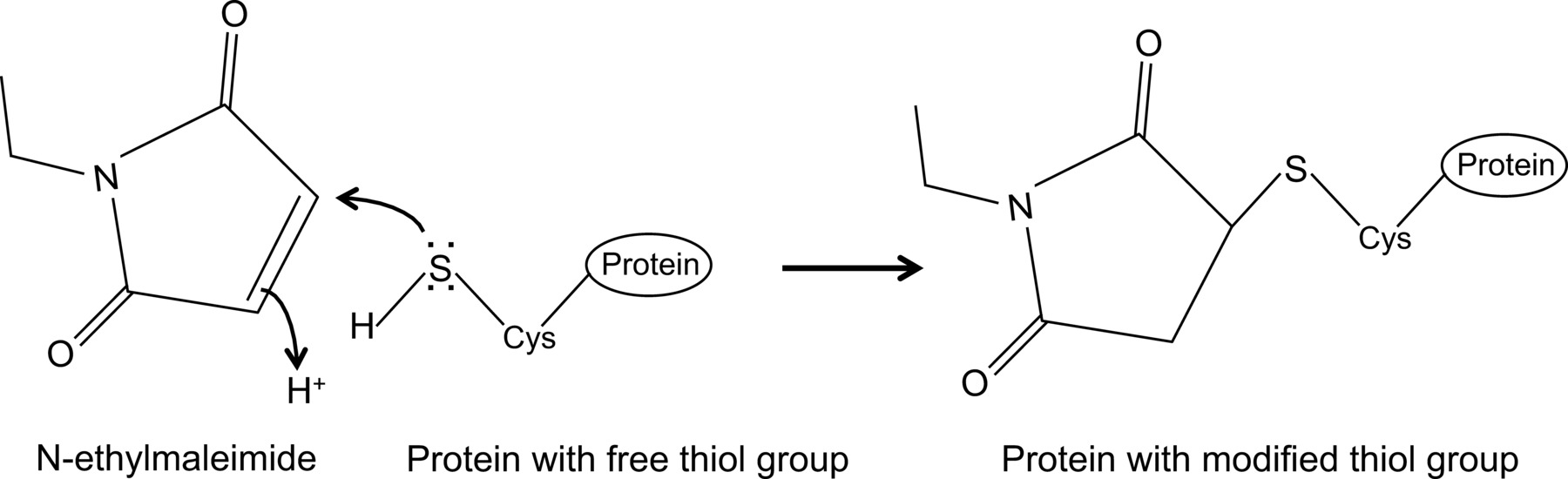
그림 1 :. N-에틸 말레이을 통해 무료 티올 그룹의 돌이킬 수없는 수정 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

MX1 및 NP가 모두 존재하는 하나 및 NP 단백질이 존재하지 않는 하나의 제어 설정 :도 2 :. 두 샘플 공동 면역 침전 실험 MX1는 NP와 상호 작용하여 웨스턴 블롯 분석. NP가 안티 NP와 NP와 MX1과 면역 된 서부 블로 팅에 의해 가시화되었다. 이 수치는 f를 수정되었습니다롬 14.

.도 3 : - MX1 상호 작용을 N-에틸 말레이 미드의 존재 또는 부재하에 수행되는 공동 면역 침전 실험의 웨스턴 블롯 분석은 에틸 말레이 미드 N-중요은 NP를 검출한다. NP가 안티 NP 및 MX1과 순이익으로 면역 된 서부 블로 팅에 의해 가시화되었다.

도 4 :. 인플루엔자 비리 온으로부터 분리 감염된 세포 또는 vRNPs로부터 vRNPs, vRNPs를 형질 제어 파쇄물 (NO vRNPs)를 : MX1 함유 NP 감염된 세포로부터 또는 비리 온으로부터 분리하여 MX1가 상호 작용 해물 다른 출처의 NP를 포함한 해물과 합하고 . 해물을 혼합, 공동 immunopre 후안티 NP와 cipitation 수행하고 MX1과 순이익은 서쪽 블로 팅에 의해 가시화되었다.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
바이러스 단백질 및 바이러스 표적 사이의 상호 작용을 연구하는 이들 단백질의 항 바이러스기구의 상세를 이해하는 것이 매우 중요하다. 이 새로운 항 바이러스 전략의 개발을위한 기초를 바이러스 및 그들의 호스트가 진화 공동 방법에 대한 새로운 통찰력을 제공 할 수 있습니다. 여기에 설명 된 최적화 공동 면역 침전 프로토콜 마우스 MX1 단백질 및 그 대상 바이러스, 인플루엔자 NP 단백질 사이의 상호 작용을 연구 할 수있다. NP-MX1 상호 작용 NEM (도 3)이 부재 인 탐지이 프로토콜의 가장 중요한 측면은, 용해 완충액에서 NEM의 추가이다. 현재까지이를 NEM의 존재가이 상호 작용을 검출하기 위해 필수적이다 이유 알려져 있지 않다. 그러나,이 프로토콜은 시스테인이 참여하고 특히, 특정 단백질의 입체의 안정화에 따라 다른 약 및 / 또는 과도 상호 작용을 연구하는 것이 유용 할 수 있습니다.
일반적으로 공동 - 면역 침전 분석법의 중요한 한계는 높은 친 화성으로 상호 작용 파트너 중 하나에 형태 적 에피토프를 인식하고 특정 고품질 항체의 가용성이다. NP-MX1의 상호 작용은 집에 방지 MX1 폴리 클로 날 항혈청 생산 우리와 함께 시연 할 수 없습니다. 이러한 항혈청은 심지어 MX1의 부재에서 인플루엔자 NP 단백질을 immunoprecipitates. 또한, 사용 된 항 NP 단일 클론 항체, A / 푸에르토 리코 / 34분의 8 인플루엔자 균주의 NP 단백질을 인식하지만 불행히도 조류 인플루엔자 바이러스 균주의 NP-풀다운하기에 적합하지 않다. 이 공동 - 면역 침전 프로토콜의 또 다른 제한은 단백질 G 비드에 MX1의 비특이적 결합이다. 후자는 세척 완충액으로 염 농도를 증가시키고, 용 해물 및 단백질 G 비드 사이의 접촉 시간을 감소시킴으로써 극복 될 수 바인딩. 또한, 비드의 양을 감소시키는 것은 각각의 면역에 사용25 μL 50 μL의 반응은 더이 구슬에 MX1의 비특이적 줄일 수 있습니다. 일반적으로, 단백질 G 비드에 비특이적 결합으로 인한 오염 단백질의 의도 풀다운은 또한 다른 전략에 의해 감소 될 수있다. 예를 들어, 이들 단백질은 이들 단백질은 항체의 부재하에 단백질 G 비드와 해물을 배양함으로써 제거하는 프리 명확한 단계 동안 제거 될 수있다. 오염 단백질은 비드와 함께 제거하고, 예비 분해물은 공동 면역 침전에 사용한다. 오염 단백질이 연구중인 단백질 (들)와 다를 경우이 전략은 유리하다. 대안 적으로, 단백질의 비특이적 결합 부위는 G 비드 BSA로 차단 될 수있다. 구슬이 처음 항체로 코팅하는 경우 BSA는 (즉, 감소 항체가 코팅 구슬에 의해 결합) 면역 복합체의 침전을 줄일 수 있습니다 그러나,이 전략은 좋습니다. 촬영함께, 상기 단백질 G 비드에 사용하거나 비특이적 항체 관심 단백질의 결합을 제외하도록 적절한 제어를 포함하는 것이 매우 중요하다.
기재된 공동 면역 침전 프로토콜에 감염된 세포 또는 정제 된 vRNPs에서 다른 환경에 존재 NP 단백질, 예 MX1과의 상호 작용을 연구하기 위해 수정 될 수있다. MX1 인플루엔자 바이러스 감염 23 일 동안, NP 포함한 바이러스 단백질의 발현을 억제한다. 따라서,이어서 형질 감염된 세포에서 MX1 NP-MX1 상호 작용을 연구하는 것은 기술적으로 매우 곤란하다. 또,이 공동 면역 침전 프로토콜은 MX1은 NP-MX1 상호 작용을 성공적으로 검출 할 수 있도록 (도 4)에 감염된 세포 및 발현 세포의 용 해물을 조합 한 후에 수행 될 수있다. NEM의 중요한 표적이 공지되지 않기 때문에, NEM 모두 세포 집단의 용해 동안 첨가 하였다. 원하는 경우의 pH용해 완충액은 변경 될 수있다. 여기에 설명 된 실험은 (투란 등. (10)에서와 같이)도 8의 pH에서 수행되지만, NP-MX1 공동 면역 침전 역시 성공적으로 pH를 7.2 완충액으로 용해 하였다. 상기 pH NEM 자유 티올 기와 반응하고,이 배타적으로 pH가 또한 MX1 단백질의 추출 수율이 증가하기 때문에 사실에서 7.2의 pH는, 바람직하다. 또한, 단백질 G 비드 사용 항체는 유도되는 숙주 종에 따라 단백질 A 비드에 의해 대체 될 수있다. 그러나, 청소기 결과는 단백질 G 비즈를 얻을 수 있습니다. 마지막으로,이 프로토콜은 또한 예 MX1 인플루엔자 및 기타 단백질, PB2 (14) 사이의 상호 작용을 연구하는데 사용될 수있다. 원칙적으로 시판 항 V5 아가 로스 친화 젤과 조합 될 수 V5 에피토프 PB2 사용한 태그이 경우,.
미래의 실험에서,이 프로토콜은 MX1에서 영역을 식별 할 수 있으며 귀중한NP-MX1의 상호 작용에 중요한 NP. 이 루프 MXA 및 Thogoto 바이러스 NP 8,9 사이의 상호 작용에 중요한 것으로 도시 된 바와 같이 하나의 이러한 MX1의 영역은 루프 L4 수 있었다. 적합한 NP-특정 항체를 사용할 수있게되면,이 프로토콜은 MX1에 대한 조류 인플루엔자 균주의 증가 감도가 MX 감도의 메커니즘을 이해하는 데 도움이 할 수있는 강력한 NP-MX1 상호 작용 여부와 상관 관계가 있는지 확인 할 수 있습니다. 또한 MX1 및 오르 쏘 믹소 바이러스과 (orthomixoviridae)보다 다른 패밀리에 속하는 바이러스 구성 요소 간의 상호 작용은,이 적응 공동 면역 침전 프로토콜에 의해 해결 될 수있다. 마지막으로, 상기 연구는 더이 특이 적 상호 작용을 이해하는 것은 매우 가치있는 것이다 NP-MX1에 NEM의 영향을 해명하고, 또한 세포 용해와 공동 - 면역 침전 실험 중이 화합물의 첨가의 광범위한 애플리케이션에 대한 통찰력을 얻기 위해.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
저자는 그들이 더 경쟁 금융 이익이 없다는 것을 선언합니다.
Acknowledgments
이 작품은 FWO - 데런, IOF 프로젝트 IOF10 / StarTT / 027 및 겐트 대학교 특별 연구비 BOF12 / GOA / 014에 의해 지원되었다.
Materials
| Name | Company | Catalog Number | Comments |
| DMEM high glucose | Gibco | 52100-047 | |
| N-Ethylmaleimide | Sigma | E-3876 | Toxic |
| Igepal CA-630 | Sigma | I-30212 | also known as NP40 |
| Protease inhibitor cocktail | Roche | 11 873 580 001 | |
| anti-NP monoclonal antibody | NIH Biodefense and Emerging Infections Research Resources Repository | NR-4282 | ascites blend of clones A1 and A3 |
| anti-RNP polyclonal serum | NIH Biodefense and Emerging Infections Research Resources Repository | NR-3133 | directed against A/Scotland/840/74 (H3N2) |
| Protein G Sepharose 4FF | GE Healthcare | 17-0618-01 | |
| Hyperfilm ECL 18 x 24 cm | GE Healthcare | 28-9068-36 | |
| ECL western blotting substrate | Pierce | 32106 |
References
- Verhelst, J., Hulpiau, P., Saelens, X. Mx proteins: antiviral gatekeepers that restrain the uninvited. Microbiol Mol Biol Rev. 77 (4), 551-566 (2013).
- Goujon, C., et al. Human MX2 is an interferon-induced post-entry inhibitor of HIV-1 infection. Nature. 502 (7472), 559-562 (2013).
- Kane, M., et al. MX2 is an interferon-induced inhibitor of HIV-1 infection. Nature. 502 (7472), 563-566 (2013).
- Liu, Z., et al. The interferon-inducible MxB protein inhibits HIV-1 infection. Cell Host Microbe. 14 (4), 398-410 (2013).
- Kochs, G., Haller, O. Interferon-induced human MxA GTPase blocks nuclear import of Thogoto virus nucleocapsids. Proc Natl Acad Sci U S A. 96 (5), 2082-2086 (1999).
- Flohr, F., Schneider-Schaulies, S., Haller, O., Kochs, G. The central interactive region of human MxA GTPase is involved in GTPase activation and interaction with viral target structures. FEBS Lett. 463 (1-2), 24-28 (1999).
- Kochs, G., Haller, O. GTP-bound human MxA protein interacts with the nucleocapsids of Thogoto virus (Orthomyxoviridae). J Biol Chem. 274 (7), 4370-4376 (1999).
- Mitchell, P. S., et al. Evolution-guided identification of antiviral specificity determinants in the broadly acting interferon-induced innate immunity factor MxA. Cell Host Microbe. 12 (4), 598-604 (2012).
- Patzina, C., Haller, O., Kochs, G. Structural requirements for the antiviral activity of the human MxA protein against Thogoto and influenza A virus. J Biol Chem. 289 (9), 6020-6027 (2014).
- Turan, K., et al. Nuclear MxA proteins form a complex with influenza virus NP and inhibit the transcription of the engineered influenza virus genome. Nucleic Acids Res. 32 (2), 643-652 (2004).
- Dittmann, J., et al. Influenza A virus strains differ in sensitivity to the antiviral action of Mx-GTPase. J Virol. 82 (7), 3624-3631 (2008).
- Zimmermann, P., Manz, B., Haller, O., Schwemmle, M., Kochs, G. The viral nucleoprotein determines Mx sensitivity of influenza A viruses. J Virol. 85 (16), 8133-8140 (2011).
- Manz, B., et al. Pandemic influenza A viruses escape from restriction by human MxA through adaptive mutations in the nucleoprotein. PLoS Pathog. 9 (3), e1003279 (2013).
- Verhelst, J., Parthoens, E., Schepens, B., Fiers, W., Saelens, X. Interferon-inducible protein Mx1 inhibits influenza virus by interfering with functional viral ribonucleoprotein complex assembly. J Virol. 86 (24), 13445-13455 (2012).
- Brewer, C. F., Riehm, J. P. Evidence for possible nonspecific reactions between N-ethylmaleimide and proteins. Anal Biochem. 18 (2), 248-255 (1967).
- Wu, C. Y., Jeng, K. S., Lai, M. M. The SUMOylation of matrix protein M1 modulates the assembly and morphogenesis of influenza A virus. J Virol. 85 (13), 6618-6628 (2011).
- Chen, Z., Zhou, J., Zhang, Y., Bepler, G. Modulation of the ribonucleotide reductase M1-gemcitabine interaction in vivo by N-ethylmaleimide. Biochem Biophys Res Commun. 413 (2), 383-388 (2011).
- Rennie, M. L., McKelvie, S. A., Bulloch, E. M., Kingston, R. L. Transient dimerization of human MxA promotes GTP hydrolysis, resulting in a mechanical power stroke. Structure. 22 (10), 1433-1445 (2014).
- Gifford, J. L., Walsh, M. P., Vogel, H. J. Structures and metal-ion-binding properties of the Ca2+-binding helix-loop-helix EF-hand motifs. Biochem J. 405 (2), 199-221 (2007).
- Separating Protein with SDS-PAGE. , JoVE. Available from: http://www.jove.com/science-education/5058/separating-protein-with-sds-page (2014).
- Gallagher, S., Chakavarti, D. Immunoblot analysis. J Vis Exp. (16), (2008).
- Eslami, A., Lujan, J. Western blotting: sample preparation to detection. J Vis Exp. (44), (2010).
- Pavlovic, J., Haller, O., Staeheli, P. Human and mouse Mx proteins inhibit different steps of the influenza virus multiplication cycle. J Virol. 66 (4), 2564-2569 (1992).



