Introduction
Myxovirus weerstand (Mx) eiwitten zijn een belangrijk onderdeel van de aangeboren afweer tegen virale ziekteverwekkers. Deze eiwitten zijn groot dynamin-achtige GTPases die worden geïnduceerd door type I en type III interferonen. De overeenkomstige Mx genen aanwezig in bijna alle gewervelde dieren in een of meerdere kopieën en hun genproducten remmen een groot aantal virussen, waaronder Orthomyxoviridae (bv., Influenzavirus), Rhabdoviridae (bijv., Vesiculaire stomatitis virus), Bunyaviridae (bijv. , La Crosse virus) en Retroviridae (bijvoorbeeld humaan immunodeficiëntievirus-1) 4/1. Het is onduidelijk hoe deze eiwitten herkennen zo'n breed scala aan virussen, zonder duidelijke gedeeld primaire sequentie motieven in deze virussen. Het analyseren van de interactie van Mx-eiwitten met hun virale doelen, mogelijk met hogere orde complexen met andere gastheercel factoren, zal helpen om de moleculaire mechanismen te begrijpen thoed zijn geëvolueerd in de wapenwedloop tussen virussen en hun gastheren.
De interactie tussen zoogdieren Mx eiwitten en virale targets is het meest uitgebreid bestudeerd voor menselijke MxA. Menselijke MxA kan de replicatie van veel virussen, waaronder de orthomyxovirussen influenza A en Thogoto virus remmen. MxA bindt Thogoto virus ribonucleoproteïne complexen (vRNPs), waardoor hun nucleaire binnenkomst, waardoor blok infectie 5 voorkomen. Deze interactie tussen MxA en Thogoto virus vRNPs aangetoond met co-sedimentatie en co-immunoprecipitatie experimenten 6-9. Hoe Mx eiwitten hinderen influenza A-virussen is minder duidelijk. Een groot probleem is dat het niet eenvoudig om een interactie tussen een eiwit en Mx een influenza genproduct tonen. Een rapport toonde een interactie tussen mens MxA en de NP-eiwit in het influenza A-virus geïnfecteerde cellen 10. Deze interactie kan alleen worden aangetoond door co-immunoprecipitation als de cellen waren behandeld met de verknopingsreagens dithiobis (succinimidylpropionaat) voor lysis, wat suggereert dat de interactie van voorbijgaande aard en / of zwak. Recentere studies hebben aangetoond dat de differentiële Mx gevoeligheid van verschillende influenza A-stammen wordt bepaald door de oorsprong van het NP-eiwit 11,12. In lijn met deze, kan influenza-A-virussen deels ontsnappen uit Mx controle door het muteren van specifieke resten in het NP eiwit 13. Dit suggereert dat de belangrijkste doelstelling van influenza A virussen gastheer Mx NP eiwit, waarschijnlijk NP geassembleerd vRNP complexen. Geen van deze recentere studies toonden een interactie tussen influenza NP of vRNPs en humaan MxA of muis Mx1.
Onlangs toonden wij voor het eerst een interactie tussen influenza NP en muis Mx1 eiwit met een geoptimaliseerde co-immunoprecipitatie protocol 14, dat hier wordt beschreven. In het algemeen co-immunoprecipitation is een van de meest gebruikte biochemische methoden om proteïne-proteïne interacties te onderzoeken. Deze techniek wordt vaak de voorkeur boven andere technieken, bijvoorbeeld gist twee hybride, aangezien het eiwit-eiwit interacties in hun natuurlijke omgeving onderzoeken. Co-immunoprecipitatie kan op endogeen tot expressie gebrachte eiwitten worden uitgevoerd als antistoffen tegen de eiwitten van belang zijn beschikbaar. Alternatief kunnen de eiwitten van belang tot expressie worden gebracht in de cel door middel van transfectie of infectie en een affiniteit tag worden gebruikt. Naast de hierboven genoemde voordelen, beschreven co-immunoprecipitatie protocol maakt de detectie van zwakke en / of transiënte eiwit interacties. Het hoofdbestanddeel van deze geoptimaliseerde protocol is de toevoeging van N-ethylmaleimide (NEM) voor cel lysis buffer. NEM is een alkylerend reagens dat reageert met vrije thiolgroepen zoals aanwezig in cysteïnen bij een pH van 6.5-7.5, een stabiele thio-ester(Figuur 1). Bij hogere pH kan NEM ook reageren met aminogroepen of ondergaat hydrolyse 15. NEM wordt typisch gebruikt om vrije thiolgroepen te blokkeren, teneinde vorming van disulfidebindingen te voorkomen of remmen enzymatische activiteit. Zo wordt NEM vaak gebruikt om desumoylating enzymen die cysteïne proteasen blokkeren. In het beschreven co-immunoprecipitatie protocol werd NEM eerst in het lysisbuffer, omdat was gemeld dat de sumoylation van influenza eiwitten interactie tussen virale eiwitten 16 kunnen beïnvloeden. Onverwacht toevoeging NEM gebleken om de interactie tussen influenza NP en muis Mx1 door co-immunoprecipitatie document. Het is onduidelijk waarom de toevoeging NEM is cruciaal voor de NP-Mx1 interactie detecteren. Mogelijk is de interactie is ook van voorbijgaande aard en / of zwak. NEM kon de interactie, bijvoorbeeld stabiliseren, door het behoud van een specifieke conformatie van Mx1, een viraal eiwit of zelfs een onbekende derde component. Een dergelijke stabiliserende effect NEM eerder is opgemerkt, bijvoorbeeld voor de interactie tussen de ribonucleotide reductase M1 en zijn inhibitor gemcitabine (F2dC) 17. MX1 en NP beide bevatten meerdere cysteïneresiduen die door NEM kan worden gewijzigd. Bijvoorbeeld, een recente studie van Rennie et al. Aangetoond dat een stalkless MxA-variant bevat drie oplosmiddel cysteine residuen die door iodoacetamide kan worden gewijzigd. Muteren deze residuen serinen heeft geen invloed op de enzymatische activiteit van MxA, maar voorkomen disulfide gemedieerde aggregatie 18. Aangezien deze cysteïnen zijn geconserveerd in Mx1, suggereert dit dat de analoge cysteïnen in Mx1 door NEM en als zodanig beïnvloeden de conformatie of oplosbaarheid kan worden gewijzigd. Bovendien kan NEM van invloed op de GTPase activiteit van Mx1, die essentieel is voor de anti-influenza werking van Mx1 en daardoor de interactie tussen Mx1 en NP stabiliseren. Echter, een direct effect van NEM op de GTPase activiteit van Mx1 onwaarschijnlijk, zoals NEM moet ook de interactie tussen influenza NP en GTPase inactieve mutanten van het Mx1 eiwit 14 te detecteren. Het is duidelijk dat er meer onderzoek nodig is om het effect van NEM op de NP-Mx1 interactie te ontrafelen.
Samengevat, de beschreven co-immunoprecipitatie protocol kan de interactie tussen de antivirale Mx1 eiwit en virale doel, het influenza NP-eiwit te bestuderen. Dit protocol kan ook worden gebruikt om andere zwakke of voorbijgaande interacties die afhankelijk zijn van de stabilisatie van specifieke eiwitten conformaties bestuderen. Eiwit-eiwit interacties die door specifieke conformaties zijn eerder beschreven, bijvoorbeeld voor calcium bindende eiwitten zoals calmoduline 19. Tenslotte, de gunstige rol NEM kan ook worden gebruikt in andere werkwijzen die eiwit-eiwit interacties, zoals co-sedimentatie assays detecteren.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Opmerking: De volgende transfectie en co-immunoprecipitatie protocol is vastgesteld voor een 9 cm Petrischaal formaat. Andere formaten zijn ook mogelijk na het schalen van het protocol.
1. Seeding de humane embryonale nier (HEK) 293T cellen
- Zaad de HEK293T cellen één dag voor transfectie 1,2 x 10 6 cellen per 9 cm petrischaal in 12 ml Dulbecco's gemodificeerd Eagle's medium (DMEM) aangevuld met 10% foetaal kalfsserum, 2 mM L-glutamine, 0,4 mM Na-pyruvaat, 0,1 mM niet-essentiële aminozuren, 100 U / ml penicilline en 0,1 mg / ml streptomycine.
- Kweek de cellen 16 uur bij 37 ° C en 5% CO2.
- Inspecteer de morfologie en de levensvatbaarheid van de cellen met een omgekeerde lichtmicroscoop voor transfectie. De cellen moeten subconfluente voor optimale transfectie efficiëntie.
2. calciumfosfaat transfectie van HEK293T cellen
Notitie: Gebruik 0,5-1 ug pCAXL-NP of lege pCAXL plasmide in combinatie met 1-3 ug pCAXL-Mx1 per 9 cm schotel. Gebruik een gelijke hoeveelheid totaal plasmide-DNA in alle monsters; aanpassen met lege plasmide indien nodig.
- Bereid de volgende transfectie buffers:
- Bereid Tris-EDTA (TE) met concentraties van 1,0 mM Tris-HCl pH 8,0 en 0,1 mM EDTA pH 8,0.
- Bereid BS / HEPES met concentraties van 25 mM HEPES (5,96 g / l, 4- (2-hydroxyethyl) -1-piperazineethaansulfonzuur), 274 mM NaCl (16 g / l), 10 mM KCI (0,74 g / l), 1,5 mM NaHPO 4 · 12H 2 O (0,5 g / l) en 11,1 mM dextrose (2 g / l). Stel de pH naar 7,05.
- Bereid CaCl2 / HEPES met concentraties van 1.25 M CaCl2 · 2H 2 O (183,8 g / L) en 125 mM HEPES (29.79 g / L). Stel de pH tot 7,05 met NaOH.
- Verwarm de transfectie buffers bij 37 ° C vóór gebruik.
- Bereid de plasmide monsters door verdunning van de plasmide-DNA in 600 ui TE.Bereid deze mengsels in de putjes van een 6-wells plaat.
- Voeg 150 ul van CaCl2 / HEPES in een druppelsgewijs wijze het plasmide monsters en meng door pipetteren 3 keer op en neer.
- Bereid de transfectie oplossing druppelsgewijs toevoegen van de plasmide-oplossing (TE + DNA + CaCl2 / HEPES; 750 pi) 750 pl BS / HEPES buffer voorzien in een nieuwe 6-wells plaat. Verdeel het plasmide oplossing gelijkmatig over het volledige putje met BS / HEPES buffer.
- Schud de transfectieoplossing op een plaat schudder gedurende 90 seconden bij 1000 rpm.
- Incubeer het mengsel gedurende 5 minuten bij kamertemperatuur.
- Voeg de transfectie oplossing (1,5 ml) druppelsgewijs aan de cellen. Gebruik een P1000 micropipet de transfectieoplossing op de cellen druppelen. De verspreiding van de mengsel over de volledige 9 cm petrischaal en schud de plaat heel voorzichtig.
- Incubeer de cellen bij 37 ° C en 5% CO2 gedurende 6 uur. Verwijder vervolgens het medium door aspiratie en onmiddellijk vervangen wiste 12 ml verse, voorverwarmde medium. Voeg voorzichtig de vers medium aan de cellen cel losraken te voorkomen. Hiervoor houdt de punt van de pipet tegen de zijkant van de put en duw het medium.
- Incubeer de cellen gedurende nog eens 16 uur bij 37 ° C en 5% CO2.
3. Co-immunoprecipitatie
Opmerking: Voer de co-immunoprecipitatie 24 uur na transfectie.
- Voorbereiding van de lage zout lysebuffer en hoge zout wasbuffer.
- Bereid een voorraad oplossing van 2 M N-ethylmaleimide (NEM) door weging van de hoeveelheid NEM en lossen in absolute ethanol. Bereid de NEM stockoplossing vers vóór gebruik.
LET OP: NEM is zeer giftig, voor te bereiden en te gebruiken deze oplossing in een zuurkast. - Bereid laag zoutgehalte lysis buffer bij concentraties van 50 mM Tris-HCl pH 8, 150 mM NaCl, 5 mM ethyleendiaminetetraazijnzuur (EDTA), 1% NP40 en een cocktail van proteaseremmers (los 1 tabelt in 50 ml lysis buffer). Voeg NEM tot een uiteindelijke concentratie van 25 mM (dwz verdund 1:80). Houden op het ijs na het toevoegen van de proteaseremmers en NEM.
Opmerking: Voeg altijd de proteaseremmers en NEM vóór gebruik vers. - Bereid een hoog zoutgehalte wasbuffer in concentraties van 50 mM Tris-HCl pH 8, 500 mM NaCl, 5 mM EDTA en 1% NP40. Merk op dat de hoge zout wasbuffer NEM bevat.
- Bereid een voorraad oplossing van 2 M N-ethylmaleimide (NEM) door weging van de hoeveelheid NEM en lossen in absolute ethanol. Bereid de NEM stockoplossing vers vóór gebruik.
- Bereiding van cellysaten.
- Verwijder het medium en spoelen van de cellen met 2 ml ijskoude fosfaat gebufferde zoutoplossing (PBS). Toe te voegen heel voorzichtig de wasbuffer, als HEK293T cellen los gemakkelijk.
- Verwijder de PBS en voeg 600 ul van ijskoude laag zout lysebuffer per 9 cm petrischaal.
- Incubeer de platen gedurende 20 min op ijs. Zorg ervoor dat de platen horizontaal worden gehouden, om een volledige dekking van de plaat oppervlak met lysebuffer verzekeren. Schud de platen om de 5 min.
- Verzamel het cellysaat in een 1,5 ml microcentrifugebuis en centrifugeer gedurende 3 min bij 4 ° C en 16.000 xg om de onoplosbare fractie te pelleteren.
- Breng de oplosbare fractie, namelijk het cellysaat een nieuwe 1,5 ml microcentrifugebuis en op ijs bewaren. Onmiddellijk verder met de co-immunoprecipitatie protocol dissociatie van de interagerende eiwitten voorkomen. Voer alle volgende stappen zoveel mogelijk op ijs of bij 4 ° C proteolytische activiteit beperken de lysaten.
- Genereren van immuuncomplexen.
Opmerking: In deze stap wordt het eiwit van belang gebonden aan het geschikte antilichaam. Om de NP-Mx1 interactie te bestuderen, maken gebruik van een muis anti-NP monoklonaal antilichaam.- Voor elk monster, meng 135 pl lysaat met 2 pl anti-NP monoklonaal antilichaam en 113 pl laag zoutgehalte lysis buffer (totaal volume 250 ui). Bewaar de overblijvende lysaat bij -20 ° C voor verdere analyse zoals western blotting, om de expressieniveaus van het vermoeden Intera documenterenctie partners in de getransfecteerde cellen.
Opmerking: Alternatief meet de eiwitconcentratie van het lysaat (bijvoorbeeld met Bradford-reagens) en gebruik van een vaste hoeveelheid totaal eiwit, bijvoorbeeld 400 ug voor elk lysaat. - Incubeer de antilichaam-lysaat mengsel 3 uur op een draaiend wiel bij 4 ° C. Deze stap kan worden uitgebreid tot een nacht incuberen.
- Voor elk monster, meng 135 pl lysaat met 2 pl anti-NP monoklonaal antilichaam en 113 pl laag zoutgehalte lysis buffer (totaal volume 250 ui). Bewaar de overblijvende lysaat bij -20 ° C voor verdere analyse zoals western blotting, om de expressieniveaus van het vermoeden Intera documenterenctie partners in de getransfecteerde cellen.
- Bereiding van het proteïne G parels.
Opmerking: De proteïne G parels worden vervoerd en opgeslagen in 20% ethanol voor bewaring. De kraal-suspensie bestaat gewoonlijk uit 50% korrels en deze kralen moeten worden gewassen voordat ze worden gebruikt om de immune complexen immunoprecipiteren.- Gebruik 50 pi kralen, dwz 100 ul kraal-suspensie voor elk monster. Was de hoeveelheid korrels nodig voor alle monsters in de co-immunoprecipitatie assay in een buis. Snij het puntje van een 1 ml pipet tip om pipetteren van de kraal-slurry te verlichten.
- Centrifugeer de proteïne G kraal-suspensie bij 8000 xg en 4 ° C gedurende 30 sec. Verwijder de ethanoloplossing en een gelijk volume laag zoutgehalte lysisbuffer. Centrifugeer de proteïne G kraal-suspensie bij 8.000 xg en 4 ° C gedurende 30 seconden en de bovenstaande vloeistof voorzichtig. Herhaal deze wasstap 3 keer.
Opmerking: De laag zoutgehalte lysis buffer gebruikt om de parels te wassen hoeft niet proteaseremmers of NEM bevat. - Schat de hoeveelheid proteïne G kralen en een gelijk volume van laag zoutgehalte lysisbuffer in nieuw 50% kraal-suspensie in laag zout lysisbuffer maken.
- Voor elk monster Breng 100 pi van de kraal-slurry in een nieuwe 1,5 ml microcentrifugebuis en opgeslagen op ijs tot gebruik. Let op de hiel-slurry mengen te splitsen, zoals deze kralen snel bezinken naar de bodem van de buis.
- Immunoprecipitatie van de immuuncomplexen door proteïne G kralen en de elutie.
- Alvorens de proteïne G kralen voor immunoprecipitatie centrifuge alle buizen 30 sec bij 8.000 xg en 4 ° C encontroleren door visuele inspectie dat er een gelijke hoeveelheid kralen in alle monsters. Pas eventueel de hoeveelheid korrels in enkele van de monsters en centrifugeer weer. Gooi de bovenstaande vloeistoffen. Wees voorzichtig dat u de afgedraaid proteïne G kralen verstoren.
- Kort Centrifugeer de immuun-complexen (bijv., Lysaten met antilichaam, 250 ul) gedurende 30 seconden bij 8000 xg en 4 ° C om het volledige monster op de bodem van de reageerbuis te verzamelen. Breng de immuuncomplexen naar de proteïne G parels (50 ui).
- Incubeer 60 min op een wiel te draaien bij 4 ° C. Niet incubeer deze immuuncomplexen langer dan 75 min met de kralen niet-specifieke binding van eiwitten te verlagen naar de proteïne G parels.
- Centrifugeer de proteïne G korrels (met gebonden immuuncomplexen) gedurende 30 seconden bij 8000 xg en 4 ° C en verwijder het supernatant. Wees voorzichtig dat u de afgedraaid proteïne G kralen verstoren. Optioneel: sla deze supernatanten bij 4 ° C of -20 ° C voor latere analyse,bijvoorbeeld het schatten van de hoeveelheid ongebonden eiwit.
- Was de proteïne G korrels ongeveer 5 min met 900 gl hoog zoutgehalte lysisbuffer. Zorg ervoor dat de kralen volledig worden opnieuw gesuspendeerd in de was buffer voor optimale wassen. Centrifugeer de proteïne G parels gedurende 30 seconden bij 8000 xg en 4 ° C en werp de bovenstaande vloeistoffen. Herhaal deze wasstap 4 keer. Wees voorzichtig dat u de afgedraaid proteïne G kralen storen aan het verlies van immunogeprecipiteerd materiaal te voorkomen.
- Na de laatste wasstap, voeg 50 ul 2x Laemmli monsterbuffer om de kralen en verwarm de suspensie gedurende 10 min bij 95 ° C om het (co) immunologisch neergeslagen eiwitten elueren.
- Bereid 10 ml 6x Laemmli buffer met 1 g natriumdodecylsulfaat, 3,5 ml glycerol, 3,5 ml 1 M Tris-HCl pH 6,8 en 420 pl β-mercaptoethanol. Stel het totale volume van 10 ml door toevoeging van gedestilleerd water. Verdunnen 3 keer in gedestilleerd water tot 2x Laemmli buffer te verkrijgen.
LET OP: &# 946; mercapto-ethanol is giftig, voor te bereiden en te gebruiken Laemmli buffer in een zuurkast.
- Bereid 10 ml 6x Laemmli buffer met 1 g natriumdodecylsulfaat, 3,5 ml glycerol, 3,5 ml 1 M Tris-HCl pH 6,8 en 420 pl β-mercaptoethanol. Stel het totale volume van 10 ml door toevoeging van gedestilleerd water. Verdunnen 3 keer in gedestilleerd water tot 2x Laemmli buffer te verkrijgen.
- Na verwarming, centrifuge de proteïne G kralen gedurende 30 seconden bij 8000 xg en bewaar de monsters bij 4 ° C (korte termijn) of -20 ° C (op lange termijn).
4. Analyseer de (co-) immunogeprecipiteerd Eiwitten
- Visualiseren aanwezig in het cellysaat en het eluaat van de co-immunoprecipitatie door SDS-PAGE 20 en Western blotting 21,22 eiwitten. Typisch laden helft van het eluaat op Laemmli gel. Wees voorzichtig dat u de afgedraaid proteïne G kralen storen bij het nemen van monsters voor gel laden. MX1 en NP expressie werden onthuld met anti-Mx1 en anti-NP-antilichaam, respectievelijk 14. De banden werden gedetecteerd met HRP-gebaseerde chemiluminescentie en een röntgenfilm ontwikkelaar.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
N-ethylmaleimide is een organische verbinding die kan worden gebruikt om irreversibel te wijzigen vrije thiolgroepen, bijvoorbeeld cysteïne proteases (Figuur 1) inhiberen.
De antivirale Mx1 eiwit influenza A virus replicatie door interactie met het virale nucleoproteïne. De geoptimaliseerde co-immunoprecipitatie hier beschreven protocol maakt het mogelijk om deze NP-Mx1 interactie te bestuderen. HEK293T-cellen werden getransfecteerd met expressievectoren voor de antivirale Mx1 eiwit in de afwezigheid of aanwezigheid van het influenza NP eiwit. Vervolgens NP eiwit omlaaggetrokken van totale cellysaten met NP-specifiek monoklonaal antilichaam. Figuur 2 toont dat de Mx1 eiwit alleen co immunologisch neergeslagen in aanwezigheid van gecoëxpresseerde NP. Mogelijke niet-specifieke co-immunoprecipitatie van Mx1 in afwezigheid van NP wordt veroorzaakt door niet-specifieke pull-down van het Mx1 eiwit door het anti-NP-antilichaam of door niet-specifieke binding van Mx1 deproteïne G parels. Daarom altijd een negatieve controle voor dit aspecifieke co-immunoprecipitatie beoordelen. Figuur 3 toont dat de NP-Mx1 interactie alleen kan worden gedetecteerd in aanwezigheid van NEM. In dit experiment werd specifieke binding van Mx1 de proteïne G korrels werd bepaald met een controle co-immunoprecipitatie reactie in de afwezigheid van anti-NP-antilichaam.
Dit protocol kan ook gebruikt worden om de interactie tussen Mx1 en het influenza NP-eiwit geïsoleerd uit geïnfecteerde cellen of virions bestuderen. Voor deze toepassing is het bovengenoemde protocol enigszins aangepast door het combineren van lysaten van Mx1 expressie brengende cellen met lysaten die het virale NP-eiwit voordat de co-immunoprecipitatie protocol. Figuur 4 toont de co-immunoprecipitatie van Mx1 met NP geïsoleerd uit getransfecteerde cellen, geïnfecteerde cellen of virusdeeltjes.
Samenvattend tonen deze resultaten dat co-immunoprecipitatie protocol kan worden gebruikt om de interactie tussen een antiviraal eiwit en het virale doel bestuderen.
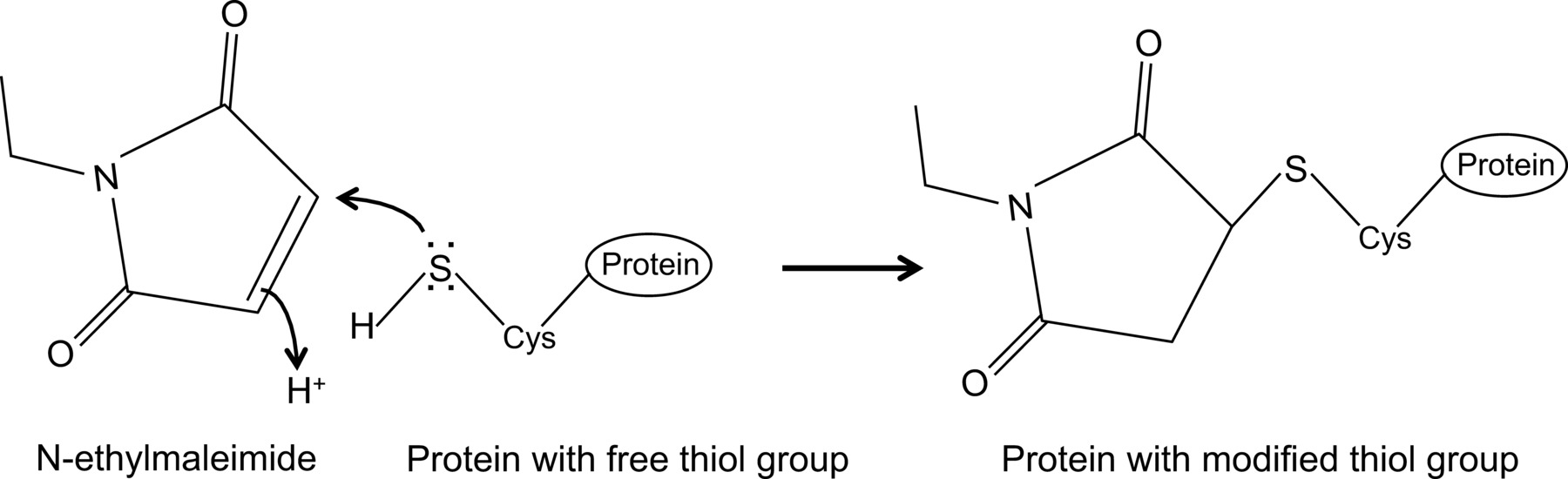
Figuur 1:. Onomkeerbare wijziging van vrije thiol groepen door N-ethylmaleimide Klik hier om een grotere versie van deze afbeelding te bekijken.

Figuur 2:. Mx1 wisselwerking met NP Western blot analyse van een co-immunoprecipitatie-experiment met twee monsters: een waarbij beide Mx1 en NP aanwezig zijn en één controle opstelling waarin de NP eiwit afwezig. NP werd geïmmunoprecipiteerd met anti-NP en NP en Mx1 werden gevisualiseerd door western blotting. Dit cijfer is gewijzigd from 14.

Figuur 3: N-ethylmaleimide is belangrijk voor detecteren NP - Mx1 interactie Western blot analyse van een co-immunoprecipitatie-experiment uitgevoerd in de aanwezigheid of afwezigheid van N-ethylmaleïmide.. NP werd immuunprecipitatie met anti-NP en NP Mx1 en werden zichtbaar gemaakt door western blotting.

Figuur 4:. Mx1 interageert met NP geïsoleerd uit geïnfecteerde cellen of uit virusdeeltjes Lysaten bevatten Mx1 werden gecombineerd met lysaten met NP uit verschillende bronnen: een controle-lysaat (geen vRNPs), getransfecteerd vRNPs, vRNPs van geïnfecteerde cellen of vRNPs geïsoleerd van influenza A virusdeeltjes . Na mengen van de lysaten, co-immunopreprecipitatie met anti-NP werd uitgevoerd en Mx1 en NP werden gevisualiseerd door Western blotting.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Het bestuderen van de interactie tussen antivirale eiwitten en hun virale targets is zeer belangrijk voor de details van de antivirale mechanisme van deze eiwitten te begrijpen. Dit kan nieuwe inzichten in hoe virussen en hun gastheren mede-geëvolueerd te geven en zijn de basis voor de ontwikkeling van nieuwe antivirale strategieën. De geoptimaliseerde co-immunoprecipitatie hier beschreven protocol laat de interactie tussen de muis Mx1 eiwit en virale doel, het influenza NP-eiwit te bestuderen. Het belangrijkste aspect van dit protocol is de toevoeging van NEM in de lysis buffer, de NP-Mx1 interactie is detecteerbaar in afwezigheid NEM (figuur 3). Tot op heden is niet bekend waarom de aanwezigheid van NEM is essentieel om deze interactie te detecteren. Echter, kan dit protocol kan andere zwakke en / of transiënte interacties die afhankelijk zijn van de stabilisatie van specifieke eiwitten conformaties bestuderen, vooral als cysteïnen zijn betrokken.
Eenbelangrijke beperking van co-immunoprecipitatie assays in het algemeen is de beschikbaarheid van specifieke en hoge kwaliteit antilichamen die conformatie-epitopen herkennen in een van de interactiepartners met hoge affiniteit. De NP-Mx1 interactie kon niet worden aangetoond met onze in-house geproduceerde anti-Mx1 polyklonale antiserum. Dit antiserum immunoprecipitaten ook het influenza NP eiwit, zelfs bij afwezigheid van Mx1. Bovendien het anti-NP monoklonaal antilichaam dat werd gebruikt, herkent het NP-eiwit van de A / Puerto Rico / 8/34 influenza-stam, maar helaas is het niet geschikt voor pull-down NP van aviaire influenza virusstammen. Een andere beperking van deze co-immunoprecipitatie protocol is de specifieke binding van Mx1 de proteïne G parels. Deze binding kan worden overwonnen door het verhogen van de zoutconcentratie in de wasbuffer en vermindering van de contacttijd tussen het lysaat en proteïne G parels. Bovendien verminderen de hoeveelheid kralen gebruikt voor elke immunoprecipitatiereactie van 50 pl tot 25 pl, verder afnemen specifieke binding van Mx1 deze kralen. In het algemeen onbedoelde pull-down van verontreinigende eiwitten, veroorzaakt door niet-specifieke binding aan het proteïne G kralen, kan ook worden verminderd door andere strategieën. Zo kunnen deze eiwitten gedurende een vooraf duidelijke stap, waarbij deze eiwitten worden verwijderd door het incuberen van het lysaat met proteïne G parels in afwezigheid van antilichaam verwijderd. De verontreinigende eiwitten worden vervolgens verwijderd samen met de kralen en de vooraf geklaard lysaat wordt gebruikt voor co-immunoprecipitatie. Deze strategie is alleen voordelig indien de verontreinigende proteïnen verschillen van het eiwit (en) in studie. Ook de niet-specifieke bindingsplaatsen op het eiwit G korrels kunnen worden geblokkeerd met BSA. Maar deze strategie alleen aanbevolen wanneer de kralen eerst worden bekleed met het antilichaam, BSA ook neerslaan van immuuncomplexen (bijvoorbeeld, verminderde antilichaambinding met de beklede korrels) kunnen verminderen. Ingenomensamen, is het zeer belangrijk om de juiste controles omvatten uitsluiten specifieke binding van de eiwitten van belang aan het proteïne G parels of de gebruikte antilichamen.
De beschreven co-immunoprecipitatie protocol kan worden gewijzigd om de interactie van Mx1 met NP eiwit in een andere omgeving, bijvoorbeeld in geïnfecteerde cellen of gezuiverde vRNPs bestuderen. Mx1 remt de expressie van virale eiwitten, waaronder NP tijdens influenzavirusinfectie 23. Daarom is het technisch zeer moeilijk om de NP-Mx1 interactie Mx1 getransfecteerde cellen die vervolgens geïnfecteerd bestuderen. Toch kan deze co-immunoprecipitatie protocol ook worden uitgevoerd na het combineren van lysaten van Mx1 expressie brengen en geïnfecteerde cellen, waardoor succesvolle detectie van de NP-Mx1 interactie (figuur 4). Als cruciale doelstelling NEM niet bekend is, is NEM tijdens de lysis van beide celpopulaties toegevoegd. Indien gewenst kan de pH vande lysis buffer kan worden veranderd. De hier beschreven experimenten worden uitgevoerd bij pH 8 (zoals in Turan et al. 10), maar de NP-Mx1 co-immunoprecipitatie werd ook met succes uitgevoerd met een pH 7,2 lysisbuffer. Eigenlijk een pH van 7,2 de voorkeur, aangezien bij deze pH NEM uitsluitend reageert met vrije thiolgroepen en deze pH verhoogt ook de opbrengst van de extractie Mx1 eiwit. Bovendien kan het proteïne G korrels worden vervangen door proteïne A kralen, afhankelijk van de gastheersoort, waaruit de gebruikte antilichamen zijn afgeleid. Echter reiniger resultaten verkregen met proteïne G parels. Tenslotte kan dit protocol worden de interacties tussen Mx1 en andere influenza eiwitten, bijvoorbeeld PB2 14 bestuderen. In dit geval wordt een V5 epitoop gemerkt PB2 gebruikt, die in principe gecombineerd kan met in de handel verkrijgbare anti-V5 agarose affiniteit gel.
In toekomstige experimenten, kan dit protocol waardevol voor de regio's in Mx1 identificeren enNP die belangrijk zijn voor de NP-Mx1 interactie zijn. Een van deze regio in Mx1 kon lus L4 zijn, aangezien deze lus is aangetoond van cruciaal belang voor de interactie tussen MxA en Thogoto virus NP 8,9 te zijn. Als geschikte NP antilichamen beschikbaar zijn, wordt dit protocol ook mogelijk om te bepalen of de verhoogde gevoeligheid van aviaire influenza A stammen voor Mx1 correleert met een sterkere NP-Mx1 interactie of niet, die kan bijdragen tot het mechanisme van Mx gevoeligheid begrijpen. Daarnaast is de interactie tussen Mx1 en onderdelen van virussen die tot andere dan de Orthomyxoviridae familie, kan ook worden aangepakt door deze aangepaste co-immunoprecipitatie protocol. Tenslotte verdere studies om het effect van NEM de NP-Mx1 ontrafelen zeer waardevol beter begrijpen specifieke interactie, maar ook om inzicht te krijgen in de bredere toepassing van de toevoeging van deze verbinding tijdens cellysis en co-immunoprecipitatie experimenten.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
De auteurs verklaren dat zij geen concurrerende financiële belangen.
Acknowledgments
Dit werk werd ondersteund door het FWO-Vlaanderen, het IOF project IOF10 / StarTT / 027 en de Universiteit Gent Special Research Grant BOF12 / GOA / 014.
Materials
| Name | Company | Catalog Number | Comments |
| DMEM high glucose | Gibco | 52100-047 | |
| N-Ethylmaleimide | Sigma | E-3876 | Toxic |
| Igepal CA-630 | Sigma | I-30212 | also known as NP40 |
| Protease inhibitor cocktail | Roche | 11 873 580 001 | |
| anti-NP monoclonal antibody | NIH Biodefense and Emerging Infections Research Resources Repository | NR-4282 | ascites blend of clones A1 and A3 |
| anti-RNP polyclonal serum | NIH Biodefense and Emerging Infections Research Resources Repository | NR-3133 | directed against A/Scotland/840/74 (H3N2) |
| Protein G Sepharose 4FF | GE Healthcare | 17-0618-01 | |
| Hyperfilm ECL 18 x 24 cm | GE Healthcare | 28-9068-36 | |
| ECL western blotting substrate | Pierce | 32106 |
References
- Verhelst, J., Hulpiau, P., Saelens, X. Mx proteins: antiviral gatekeepers that restrain the uninvited. Microbiol Mol Biol Rev. 77 (4), 551-566 (2013).
- Goujon, C., et al. Human MX2 is an interferon-induced post-entry inhibitor of HIV-1 infection. Nature. 502 (7472), 559-562 (2013).
- Kane, M., et al. MX2 is an interferon-induced inhibitor of HIV-1 infection. Nature. 502 (7472), 563-566 (2013).
- Liu, Z., et al. The interferon-inducible MxB protein inhibits HIV-1 infection. Cell Host Microbe. 14 (4), 398-410 (2013).
- Kochs, G., Haller, O. Interferon-induced human MxA GTPase blocks nuclear import of Thogoto virus nucleocapsids. Proc Natl Acad Sci U S A. 96 (5), 2082-2086 (1999).
- Flohr, F., Schneider-Schaulies, S., Haller, O., Kochs, G. The central interactive region of human MxA GTPase is involved in GTPase activation and interaction with viral target structures. FEBS Lett. 463 (1-2), 24-28 (1999).
- Kochs, G., Haller, O. GTP-bound human MxA protein interacts with the nucleocapsids of Thogoto virus (Orthomyxoviridae). J Biol Chem. 274 (7), 4370-4376 (1999).
- Mitchell, P. S., et al. Evolution-guided identification of antiviral specificity determinants in the broadly acting interferon-induced innate immunity factor MxA. Cell Host Microbe. 12 (4), 598-604 (2012).
- Patzina, C., Haller, O., Kochs, G. Structural requirements for the antiviral activity of the human MxA protein against Thogoto and influenza A virus. J Biol Chem. 289 (9), 6020-6027 (2014).
- Turan, K., et al. Nuclear MxA proteins form a complex with influenza virus NP and inhibit the transcription of the engineered influenza virus genome. Nucleic Acids Res. 32 (2), 643-652 (2004).
- Dittmann, J., et al. Influenza A virus strains differ in sensitivity to the antiviral action of Mx-GTPase. J Virol. 82 (7), 3624-3631 (2008).
- Zimmermann, P., Manz, B., Haller, O., Schwemmle, M., Kochs, G. The viral nucleoprotein determines Mx sensitivity of influenza A viruses. J Virol. 85 (16), 8133-8140 (2011).
- Manz, B., et al. Pandemic influenza A viruses escape from restriction by human MxA through adaptive mutations in the nucleoprotein. PLoS Pathog. 9 (3), e1003279 (2013).
- Verhelst, J., Parthoens, E., Schepens, B., Fiers, W., Saelens, X. Interferon-inducible protein Mx1 inhibits influenza virus by interfering with functional viral ribonucleoprotein complex assembly. J Virol. 86 (24), 13445-13455 (2012).
- Brewer, C. F., Riehm, J. P. Evidence for possible nonspecific reactions between N-ethylmaleimide and proteins. Anal Biochem. 18 (2), 248-255 (1967).
- Wu, C. Y., Jeng, K. S., Lai, M. M. The SUMOylation of matrix protein M1 modulates the assembly and morphogenesis of influenza A virus. J Virol. 85 (13), 6618-6628 (2011).
- Chen, Z., Zhou, J., Zhang, Y., Bepler, G. Modulation of the ribonucleotide reductase M1-gemcitabine interaction in vivo by N-ethylmaleimide. Biochem Biophys Res Commun. 413 (2), 383-388 (2011).
- Rennie, M. L., McKelvie, S. A., Bulloch, E. M., Kingston, R. L. Transient dimerization of human MxA promotes GTP hydrolysis, resulting in a mechanical power stroke. Structure. 22 (10), 1433-1445 (2014).
- Gifford, J. L., Walsh, M. P., Vogel, H. J. Structures and metal-ion-binding properties of the Ca2+-binding helix-loop-helix EF-hand motifs. Biochem J. 405 (2), 199-221 (2007).
- Separating Protein with SDS-PAGE. , JoVE. Available from: http://www.jove.com/science-education/5058/separating-protein-with-sds-page (2014).
- Gallagher, S., Chakavarti, D. Immunoblot analysis. J Vis Exp. (16), (2008).
- Eslami, A., Lujan, J. Western blotting: sample preparation to detection. J Vis Exp. (44), (2010).
- Pavlovic, J., Haller, O., Staeheli, P. Human and mouse Mx proteins inhibit different steps of the influenza virus multiplication cycle. J Virol. 66 (4), 2564-2569 (1992).



