Introduction
Myxovirus modstand (Mx) proteiner er en vigtig del af det medfødte immunforsvar mod virale patogener. Disse proteiner er store dynamin-lignende GTPaser, der induceres af type I og type III interferoner. De tilsvarende Mx gener er til stede i næsten alle hvirveldyr i en eller flere kopier og deres genprodukter inhibere en bred vifte af vira, herunder Orthomyxoviridae (f.eks., Influenza virus), Rhabdoviridae (f.eks., Vesikulær stomatitis virus), Bunyaviridae (f.eks. , La Crosse-virus) og Retroviridae (fx humant immundefektvirus-1) 1-4. Det er uklart, hvordan disse proteiner genkender en så bred vifte af vira, uden nogen tilsyneladende delt primære sekvens motiver i disse vira. Analyse af samspillet af Mx proteiner med deres virale mål potentielt involverer højere ordens komplekser med andre værtscelleproteiner faktorer vil hjælpe til at forstå de molekylære mekanismer that har udviklet sig i våbenkapløbet mellem vira og deres værter.
Samspillet mellem pattedyr Mx proteiner og virale mål er blevet studeret mest omfattende til human MXA. Humant MXA kan inhibere replikationen af mange vira, herunder orthomyxovira influenza A og Thogoto virus. MXA binder Thogoto virus ribonucleoprotein komplekser (vRNPs) og derved forhindre deres nukleare indrejse, hvilket resulterer i blok for infektion 5. Denne vekselvirkning mellem MXA og Thogoto virus vRNPs er blevet demonstreret med co-sedimentering og co-immunopræcipitationsforsøg 6-9. Hvordan Mx proteiner hindre influenza A-vira er mindre klar. Et stort problem er, at det er ikke ligetil at påvise en vekselvirkning mellem et Mx protein og et influenza genprodukt. En rapport viste en interaktion mellem menneske MXA og NP-proteinet i influenza A-virus inficerede celler 10. Dette samspil kan kun blive vist ved co-immunoprecipitation hvis cellerne var blevet behandlet med de tværbindingsreagens dithiobis (succinimidylpropionat) før lysis, hvilket antyder, at interaktionen er forbigående og / eller svag. Nyere undersøgelser har vist, at forskellen Mx følsomhed af forskellige influenza A stammer bestemmes af oprindelsen af NP-proteinet 11,12. I tråd med dette, kan influenza A-vira dels flygte fra Mx kontrol ved at mutere specifikke rester i NP-proteinet 13. Dette antyder, at det vigtigste mål for influenza A-vira til vært Mx er NP-proteinet, sandsynligvis NP samlet i vRNP komplekser. Men ingen af disse nyere undersøgelser påvist en interaktion mellem influenza NP eller vRNPs og enten human MXA eller mus Mx1.
For nylig viste vi for første gang, en interaktion mellem influenza NP og muse Mx1 protein med en optimeret co-immunfældning protokol 14, som er beskrevet her i detaljer. Generelt co-Immunoprecipitation er en af de mest hyppigt anvendte biokemiske fremgangsmåder til at undersøge protein-protein interaktioner. Denne teknik foretrækkes ofte i forhold til andre teknikker, fx gær to-hybrid, da det giver mulighed for at undersøge protein-protein interaktioner i deres naturlige miljø. Co-immunofældning kan udføres på endogent udtrykte proteiner, hvis antistoffer mod proteinerne af interesse er til rådighed. Alternativt kan proteinerne af interesse udtrykkes i cellen gennem transfektion eller infektion, og et affinitetsmærke kan anvendes. Ud over de ovennævnte fordele, der er beskrevet co-immunofældning protokol tillader påvisning af svage og / eller forbigående protein-interaktioner. Den vigtigste komponent i denne optimerede protokol er tilføjelsen af N-ethylmaleimid (NEM) i cellen lysisbuffer. NEM er et alkylerende reagens, som reagerer med frie thiolgrupper, såsom til stede i cysteiner, ved en pH på 6,5-7,5, for at danne en stabil thio-ester(Figur 1). Ved højere pH, kan NEM også reagere med aminogrupper eller undergå hydrolyse 15. NEM anvendes typisk til at blokere frie thiolgrupper, for at forhindre dannelse af disulfidbinding eller inhibere enzymatisk aktivitet. For eksempel er NEM ofte bruges til at blokere desumoylating enzymer, som er cysteinproteaser. I den beskrevne co-immunfældning protokol blev NEM oprindeligt indeholdt i lysepuffer, fordi det var blevet rapporteret, at sumoylation influenzainfektioner proteiner kan påvirke interaktionen mellem virale proteiner 16. Uventet tilsætning af NEM vist sig at være afgørende for at dokumentere samspillet mellem influenza NP og mus Mx1 ved co-immunofældning. Det er uklart, hvorfor tilsætningen af NEM er afgørende at detektere NP-Mx1 interaktion. Muligvis interaktionen er også forbigående og / eller svag. NEM kunne stabilisere interaktionen, fx ved at bevare en specifik konformation af Mx1, et viralt protein eller endda en ukendt tredje komponent. En sådan stabiliserende virkning af NEM er blevet observeret før, fx for interaktionen mellem ribonukleotidreduktase M1 og dets inhibitor gemcitabin (F2dC) 17. MX1 og NP både indeholde flere cysteinrester, der kunne ændres af NEM. For eksempel en nylig undersøgelse fra Rennie et al. Vist, at en stalkless MXA-variant indeholder tre opløsningsmidler eksponerede cysteinrester, der kan ændres af iodacetamid. Mutere disse rester til seriner påvirkede ikke den enzymatiske aktivitet af MXA, men forhindrede disulfid-medieret aggregering 18. Da disse cysteiner er konserveret i Mx1, tyder det, at de analoge cysteiner i Mx1 kan ændres ved NEM og som sådan indflydelse dens kropsbygning eller opløselighed. Desuden kan NEM også påvirke GTPase aktivitet Mx1, som er afgørende for anti-influenza aktivitet Mx1 den, og derved stabilisere interaktionen mellem Mx1 og NP. Men en direkte virkning af NEM på GTPase Activity af Mx1 er usandsynligt, da NEM også er forpligtet til at registrere samspillet mellem influenza NP og GTPase inaktive mutanter af MX1 protein 14. Det er klart, er der behov for mere forskning for at optrævle effekten af NEM på NP-Mx1 interaktion.
Sammenfattende beskrevne co-immunpræcipitering protokol gør det muligt at studere interaktionen mellem antivirale Mx1 protein og dets virale mål, influenza NP protein. Denne protokol kan også anvendes til at studere andre svage eller forbigående vekselvirkninger, der afhænger af stabilisering af specifikke protein konformationer. Protein-protein-interaktion, der er afhængige af specifikke konformationer er blevet beskrevet før, fx for calcium-bindende proteiner, såsom calmodulin 19. Endelig kunne den positive rolle NEM også anvendes i andre fremgangsmåder, der registrerer protein-protein interaktioner, såsom co-sedimentering assays.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Bemærk: Følgende transfektion og co-immunopræcipitering protokol er udfærdiget til en 9 cm petriskål format. Andre formater er også muligt efter skalering protokollen.
1. podning af den humane embryonale nyre (HEK) 293T-celler
- Pode HEK293T celler en dag før transfektion ved 1,2 x 10 6 celler pr 9 cm petriskål i 12 ml Dulbeccos modificerede Eagles medium (DMEM) suppleret med 10% føtalt kalveserum, 2 mM L-glutamin, 0,4 mM Na-pyruvat, 0,1 mM ikke-essentielle aminosyrer, 100 U / ml penicillin og 0,1 mg / ml streptomycin.
- Grow cellerne 16 timer ved 37 ° C og 5% CO2.
- Visuel kontrol af morfologi og levedygtigheden af cellerne med en omvendt lysmikroskop før transfektion. Cellerne skal være sub-sammenflydende for optimal transfektionseffektivitet.
2. Calcium-fosfat Transfektion af HEK293T Cells
Bemærk: Brug 0,5-1 ug pCAXL-NP eller tomme pCAXL plasmid i kombination med 1-3 ug pCAXL-Mx1 pr 9 cm skål. Brug en lige stor del af den samlede plasmid-DNA i alle prøver; justere med tomme plasmid om nødvendigt.
- Forbered følgende transfektion buffere:
- Forbered Tris-EDTA (TE) med koncentrationer på 1,0 mM Tris-HCI pH 8,0 og 0,1 mM EDTA, pH 8,0.
- Forbered BS / HEPES med koncentrationer på 25 mM HEPES (5,96 g / L, 4- (2-hydroxyethyl) -1-piperazinethansulfonsyre), 274 mM NaCl (16 g / L), 10 mM KCl (0,74 g / L), 1,5 mM NaHPO 4 · 12H 2 O (0,5 g / L) og 11,1 mM dextrose (2 g / L). Juster pH til 7,05.
- Forbered CaCl2 / HEPES med koncentrationer på 1,25 M CaCl2 · 2H 2 O (183,8 g / l) og 125 mM HEPES (29.79 g / L). Juster pH til 7,05 med NaOH.
- Varm transfektion buffere ved 37 ° C før brug.
- Forbered plasmidet prøver ved at fortynde plasmid-DNA i 600 pi TE.Fremstille disse blandinger i brønde i en 6-brønds plade.
- Tilsæt 150 pi CaCI2 / HEPES i en dråbevis måde til plasmidet prøver og blandes ved pipettering 3 gange op og ned.
- Forbered transfektion opløsning ved dråbevis tilsætning af plasmid-opløsning (TE + DNA + CaCl2 / HEPES; 750 pi) til 750 pi BS / HEPES buffer tilvejebragt i en frisk plade med 6 brønde. Fordel plasmidet løsning jævnt over hele godt indeholdende BS / HEPES buffer.
- Ryst transfektion løsning på en pladeryster i 90 sekunder ved 1.000 RPM.
- Inkuber blandingen i 5 minutter ved stuetemperatur.
- Tilsæt transfektion opløsning (1,5 ml) dråbevist til cellerne. Brug en P1000 mikropipette at dryppe transfektionen løsning på cellerne. Sprede blandingen over hele 9 cm petriskål og ryst pladen meget forsigtigt.
- Inkuberes cellerne ved 37 ° C og 5% CO 2 til 6 timer. Fjern derefter mediet ved aspiration og straks erstatte with 12 ml frisk, forvarmet medium. Tilføje forsigtigt frisk medium til cellerne for at forhindre celle løsrivelse. Til dette holde spidsen af pipetten mod siden af brønden og forsigtigt skubbe mediet.
- Inkubér cellerne i yderligere 16 timer ved 37 ° C og 5% CO2.
3. Co-immunoprecipitation
Bemærk: Udfør co-immunofældning 24 timer efter transfektion.
- Fremstilling af lavt saltindhold lysisbuffer og høj salt vaskebuffer.
- Der fremstilles en stamopløsning af 2 M N-ethylmaleimid (NEM) ved vejning af mængden af NEM og opløse det i absolut ethanol. Forbered NEM stamopløsning frisk før brug.
ADVARSEL: NEM er meget giftigt, forberede og bruge denne stamopløsning i en emhætte. - Forbered lav salt lysis buffer ved koncentrationer på 50 mM Tris-HCI pH 8, 150 mM NaCI, 5 mM ethylendiamintetraeddikesyre (EDTA), 1% NP40 og en protease-inhibitor cocktail (opløse 1 bordt i 50 ml lysisbuffer). Tilføj NEM til en slutkoncentration på 25 mM (dvs. fortyndet 1:80). Hold på is efter tilsætning af proteasehæmmere og NEM.
Bemærk: tilføj altid proteasehæmmere og NEM frisk før brugen. - Forbered en høj salt vaskebuffer ved koncentrationer på 50 mM Tris-HCI pH 8, 500 mM NaCl, 5 mM EDTA og 1% NP40. Bemærk, at den høje salt vaskebuffer ikke indeholder NEM.
- Der fremstilles en stamopløsning af 2 M N-ethylmaleimid (NEM) ved vejning af mængden af NEM og opløse det i absolut ethanol. Forbered NEM stamopløsning frisk før brug.
- Fremstilling af cellelysater.
- Fjern mediet og vask af cellerne med 2 ml iskold phosphatbufret saltvand (PBS). Meget forsigtigt tilføje vaskebuffer, som HEK293T celler løsnes nemt.
- Fjern PBS, og der tilsættes 600 pi iskold lavt saltindhold lysepuffer pr 9 cm petriskål.
- Pladerne inkuberes i 20 minutter på is. Kontroller, at pladerne holdes vandret, for at sikre fuldstændig dækning af pladens overflade med lysisbuffer. Ryst forsigtigt pladerne hver 5 min.
- Saml cellelysatet i en 1,5 ml mikrocentrifugerør og centrifugeres i 3 minutter ved 4 ° C og 16.000 xg for at pelletere den uopløselige fraktion.
- Overfør den opløselige fraktion, dvs. cellelysatet til et frisk 1,5 ml mikrocentrifugerør og holde på is. Fortsætte straks med co-immunopræcipitering protokol, for at forhindre dissociation af de interagerende proteiner. Udfør alle følgende trin så meget som muligt på is eller ved 4 ° C for at begrænse proteolytisk aktivitet i lysaterne.
- Generering af immunkomplekser.
Bemærk: I dette trin, er proteinet af interesse er bundet af passende antistof. For at undersøge NP-Mx1 interaktion, bruge en mus anti-NP monoklonalt antistof.- For hver prøve, bland 135 pi lysat med 2 pi anti-NP monoklonalt antistof og 113 pi lav salt lysis buffer (totalvolumen på 250 pi). Opbevar resterende lysat ved -20 ° C til yderligere analyse, såsom western blotting, for at dokumentere ekspressionsniveauerne af den formodede interaktion partnere i de transficerede celler.
Bemærkning: Alternativt måle proteinkoncentrationen af lysatet (f.eks med Bradford reagens) og bruge en fast mængde af det samlede proteinindhold, f.eks 400 ug, for hvert lysat. - Inkubér antistof-lysat blanding i 3 timer på et drejehjul ved 4 ° C. Dette trin kan udvides til en inkubation natten over.
- For hver prøve, bland 135 pi lysat med 2 pi anti-NP monoklonalt antistof og 113 pi lav salt lysis buffer (totalvolumen på 250 pi). Opbevar resterende lysat ved -20 ° C til yderligere analyse, såsom western blotting, for at dokumentere ekspressionsniveauerne af den formodede interaktion partnere i de transficerede celler.
- Fremstilling af protein G beads.
Bemærk: protein G Perlerne afsendt og opbevaret i 20% ethanol til konservering. Den perle-opslæmning består normalt af 50% perler og disse perler skal vaskes, før de anvendes til at immunpræcipitere de immunkomplekser.- Brug 50 pi perler, dvs. 100 pi perle-opslæmning, for hver prøve. Vask mængden af perler, der er nødvendige for alle prøver i co-immunpræcipitationsassay i et rør. Skær spidsen af en 1 ml pipettespids at lette afpipettering af den perle-opslæmning.
- Centrifugeres protein G perle-opslæmning ved 8.000 xg og 4 ° C i 30 sek. Fjern ethanol og der tilsættes et lige så stort volumen lavt saltindhold lysisbuffer. Centrifuger protein G perle-opslæmning ved 8.000 xg og 4 ° C i 30 sek og fjern supernatanten forsigtigt. Gentag dette vasketrin 3 gange.
Bemærk: Den lave salt lysis buffer anvendt til at vaske perlerne ikke behøver at indeholde proteasehæmmere eller NEM. - Skøn mængden af protein G beads og tilføj en lige så stort volumen lavt saltindhold lysepuffer at lave en ny 50% perle-opslæmning i lav salt lysis buffer.
- For hver prøve overføre 100 pi perle-opslæmning i en frisk 1,5 ml mikrocentrifugerør og opbevares på is indtil anvendelse. Være omhyggelig med at resuspendere den perle-opslæmningen før dividere, da disse perler hurtigt sedimenterer til bunden af røret.
- Immunopræcipitation af immunkomplekser med protein G perler og deres eluering.
- Før du bruger protein G beads til immunopræcipitation, centrifuge alle rør 30 sekunder ved 8.000 xg og 4 ° C ogkontrollere ved visuel inspektion, at der er en lige stor del af perler til stede i alle prøver. Hvis det er nødvendigt at justere mængden af perler i nogle af de prøver og centrifuge igen. Kassér supernatanterne. Pas på ikke at forstyrre de pelleterede protein G perler.
- Kort fortalt centrifugeres de immunkomplekser (dvs.., Lysater med antistof, 250 pi) til 30 sekunder ved 8.000 xg og 4 ° C indsamle den komplette prøve ved bunden af røret. Overfør immunkomplekser til protein G beads (50 pi).
- Der inkuberes 60 min på en drejning hjul ved 4 ° C. Ikke inkubere disse immunkomplekser længere end 75 min med perlerne for at reducere ikke-specifik binding af proteiner til protein G beads.
- Centrifuger protein G-perler (med bundne immunkomplekser) i 30 sekunder ved 8.000 xg og 4 ° C og fjerne supernatanterne. Pas på ikke at forstyrre de pelleterede protein G perler. Valgfrit: gemme denne supernatanter ved 4 ° C eller -20 ° C til senere analyse,fx at vurdere mængden af ubundet protein.
- Vask protein G beads ca. 5 min med 900 pi højsalt lysisbuffer. Kontroller, at perlerne er helt resuspenderet i vaskepufferen til optimal vask. Centrifuger protein G beads for 30 sekunder ved 8.000 xg og 4 ° C og kasseres supernatanterne. Gentag dette vasketrin 4 gange. Pas på ikke at forstyrre de pelleterede protein G beads at undgå tab af immunopræcipiteret materiale.
- Efter det sidste vasketrin, tilsættes 50 pi 2x Laemmli-prøvebuffer til perlerne og opvarme suspensionen i 10 minutter ved 95 ° C for at eluere (co) immunopræcipiterede proteiner.
- Forbered 10 ml 6x Laemmli-buffer med 1 g natriumdodecylsulfat, 3,5 ml glycerol, 3,5 ml 1 M Tris-HCI, pH 6,8 og 420 pi β-mercaptoethanol. Juster til et samlet volumen på 10 ml ved tilsætning af destilleret vand. Fortyndes 3 gange i destilleret vand for at opnå 2 x Laemmli-puffer.
ADVARSEL: &# 946; mercaptoethanol er giftigt, forberede og bruge Laemmli buffer i et stinkskab.
- Forbered 10 ml 6x Laemmli-buffer med 1 g natriumdodecylsulfat, 3,5 ml glycerol, 3,5 ml 1 M Tris-HCI, pH 6,8 og 420 pi β-mercaptoethanol. Juster til et samlet volumen på 10 ml ved tilsætning af destilleret vand. Fortyndes 3 gange i destilleret vand for at opnå 2 x Laemmli-puffer.
- Efter opvarmning centrifugeres protein G beads for 30 sekunder ved 8.000 xg og opbevare prøverne ved 4 ° C (kort tid) eller -20 ° C (lang sigt).
4. Analyser (med) immunofældet Proteins
- Pletterne af proteiner til stede i cellelysatet og eluatet af co-immunofældning ved SDS-PAGE 20 og western blotting 21,22. Typisk indlæser halvdelen af Laemmli eluatet på gel. Pas på ikke at forstyrre de pelleterede protein G perler, når du tager prøver til gel lastning. Mx1 og NP-ekspression blev afsløret med et anti-Mx1 og anti-NP antistof, henholdsvis 14. Båndene blev detekteret med HRP-baserede kemiluminescens og en X-ray film udvikler.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
N-ethylmaleimid er en organisk forbindelse, der kan anvendes til irreversibelt at ændre frie thiolgrupper, fx at inhibere cysteinproteaser (figur 1).
Den antivirale Mx1 protein inhiberer influenza A virus replikation ved at interagere med den virale nukleoprotein. Den optimerede co-immunpræcipitering protokollen beskrevet her tillader at undersøge dette NP-Mx1 interaktion. HEK293T celler blev transficeret med ekspressionsvektorer for den antivirale Mx1 protein i fravær eller nærvær af influenza NP protein. Dernæst NP-proteinet blev trukket ned fra totale cellelysater med et NP-specifikt monoklonalt antistof. Figur 2 viser, at MX1 proteinet er kun co-immunpræcipiteret i nærvær af co-udtrykte NP. Mulig specifik co-immunfældning af Mx1 i fravær af NP er forårsaget af enten specifik pull-down af MX1 protein ved hjælp af anti-NP antistof eller ved specifik binding af Mx1 tilprotein G beads. Derfor altid indeholde en negativ kontrol for at vurdere denne uspecifikke co-immunofældning. Figur 3 viser, at NP-Mx1 interaktion kun kan detekteres i nærvær af NEM. I dette forsøg blev ikke-specifik binding af Mx1 til protein G beads vurderet med kontrol co-immunfældning reaktion i fravær af anti-NP antistof.
Denne protokol kan også anvendes til at undersøge interaktionen mellem Mx1 og influenza NP protein isoleret fra inficerede celler eller fra virioner. Til denne anvendelse blev den ovennævnte protokol tilpasset lidt ved at kombinere lysater af Mx1 udtrykkende celler med lysater indeholdende NP- proteinet før start co-immunofældning protokol. Figur 4 viser co-immunfældning af Mx1 med NP isoleret fra transficerede celler, inficerede celler eller virioner.
Som konklusion viser disse resultater, at denne co-immunpræcipitering protocol kan anvendes til at undersøge interaktionen mellem et antiviralt protein og dets virale mål.
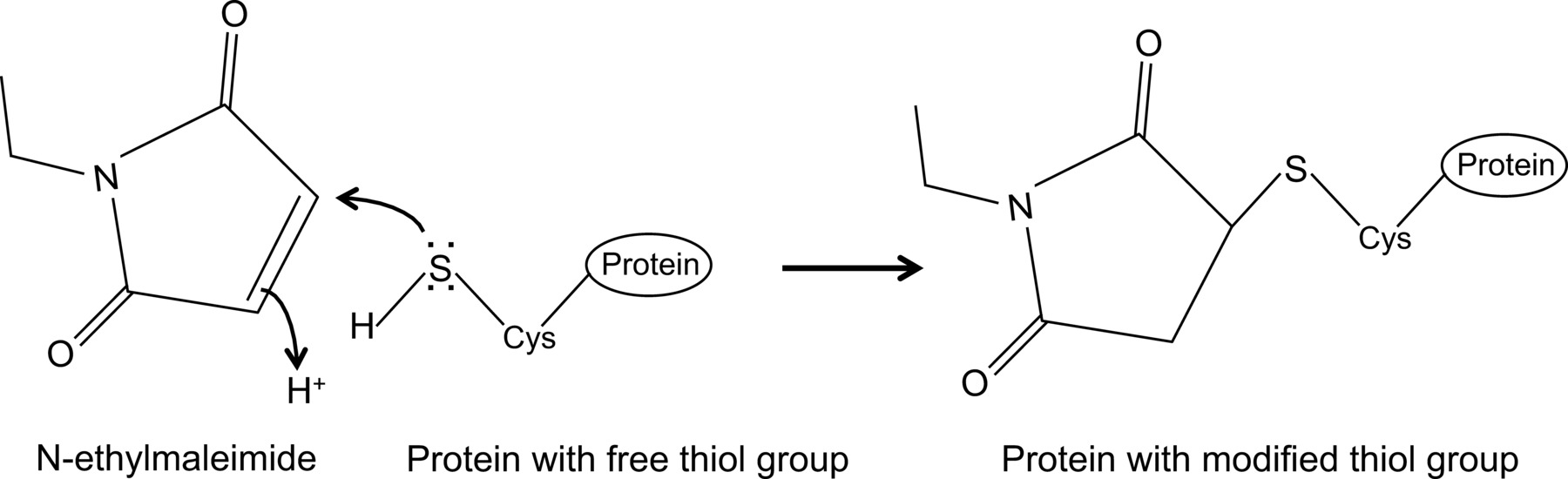
Figur 1:. Irreversible ændring af frie thiolgrupper ved N-ethylmaleimid Klik her for at se en større udgave af dette tal.

Figur 2:. Mx1 interagerer med NP Western blot analyse af en co-immunopræcipitering eksperiment med to prøver: en, hvor både Mx1 og NP er til stede og en kontrol setup, hvor NP-proteinet er fraværende. NP blev immunpræcipiteret med anti-NP og NP og Mx1 blev visualiseret ved western blotting. Dette tal er blevet ændret from 14.

Figur 3: N-ethylmaleimid er vigtigt at detektere NP - Mx1 interaktion Western blot-analyse af en co-immunfældning eksperiment udføres i nærvær eller fravær af N-ethylmaleimid.. NP blev immunpræcipiteret med anti-NP og Mx1 og NP blev visualiseret ved western blotting.

Figur 4:. Mx1 interagerer med NP isoleret fra inficerede celler eller fra virioner Lysater indeholdende Mx1 blev kombineret med lysater indeholdende NP fra forskellige kilder: en kontrol lysat (ingen vRNPs), transficeret vRNPs, vRNPs fra inficerede celler eller vRNPs isoleret fra influenza A virioner . Efter blanding lysaterne, co-immunoprenedbør med anti-NP blev udført, og Mx1 og NP blev visualiseret ved western blotting.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Studer interaktionen mellem antivirale proteiner og deres virale mål er meget vigtigt at forstå detaljerne i den antivirale mekanisme af disse proteiner. Dette kan give ny indsigt i, hvordan vira og deres værter co-udviklet og danne grundlag for udvikling af nye antivirale strategier. Den optimerede co-immunpræcipitering protokollen beskrevet her tillader at studere interaktionen mellem muse Mx1 protein og dets virale mål, influenza NP protein. Det vigtigste aspekt af denne protokol er tilsætningen af NEM i lysepuffer, som NP-Mx1 interaktion kan ikke påvises i fravær af NEM (figur 3). Til dato vides det ikke, hvorfor forekomsten af NEM er vigtigt at registrere denne interaktion. Dette kunne dog protokol bør undersøges andre svage og / eller forbigående interaktioner, som er afhængige af en stabilisering af specifikke protein konformationer, især hvis der er tale cysteiner.
Envigtig begrænsning af co-immunopræcipitationsanalyser i almindelighed er tilgængeligheden af specifikke og høj kvalitet antistoffer, der genkender konformationelle epitoper i et af interaktion partnere med høj affinitet. NP-Mx1 interaktion kunne ikke påvises med vores i hus producerede anti-Mx1 polyklonale antiserum. Dette antiserum immunpræcipiterer også influenza NP-protein, selv i fravær af Mx1. Endvidere monoklonalt anti-NP antistof, der blev anvendt, anerkender NP protein A / Puerto Rico / 8/34-influenza stammen, men desværre er ikke egnet til at pull-down NP aviær influenza-virus stammer. En anden begrænsning ved denne co-immunofældning protokollen er den uspecifikke binding af Mx1 til protein G beads. Sidstnævnte binding kan overvindes ved at forøge saltkoncentrationen i vaskepufferen og reducere kontakttiden mellem lysatet og protein G beads. Desuden reducere mængden af perler, der anvendes til hver immunopræcipitationreaktion fra 50 pi til 25 pi, kan yderligere mindske ikke-specifik binding af Mx1 til disse perler. Generelt utilsigtet pull-down af kontaminerende proteiner, forårsaget af ikke-specifik binding til protein G beads, kan også reduceres af andre strategier. For eksempel kan disse proteiner fjernes i løbet af en præ-klar trin, i hvilket disse proteiner fjernes ved at inkubere lysatet med protein G beads i fravær af antistof. De kontaminerende proteiner fjernes derefter sammen med perlerne og præ-klaret lysat anvendes til co-immunofældning. Denne strategi er kun en fordel, hvis de kontaminerende proteiner er forskellige fra proteinet (erne) under undersøgelsen. Alternativt kan de uspecifikke bindingssteder på protein G beads kunne blokeres med BSA. Imidlertid er denne strategi kun anbefales, hvis perlerne først er belagt med antistoffet, BSA kan også reducere fældning af immunkomplekser (dvs. reduceret antistofbinding af coatede perler). Tagetsammen, er det meget vigtigt at medtage passende kontroller for at udelukke ikke-specifik binding af proteiner af interesse for protein G beads eller de anvendte antistoffer.
Den beskrevne co-immunfældning protokol kan modificeres til at studere interaktionen af Mx1 med NP-protein til stede i et andet miljø, fx i inficerede celler eller i oprensede vRNPs. Mx1 inhiberer ekspression af virale proteiner, herunder NP under influenzavirusinfektion 23. Derfor er det teknisk meget vanskeligt at studere NP-Mx1 interaktion i Mx1 transficerede celler, der efterfølgende inficeret. Alligevel kan det co-immunfældning protokol også udføres efter kombination lysater af Mx1 udtrykkende celler og inficerede celler, hvilket giver succesfuld påvisning af NP-Mx1 interaktion (figur 4). Som afgørende mål NEM ikke er kendt, blev NEM tilsat under lysis af begge cellepopulationer. Hvis det ønskes, pHlysis buffer kan ændres. De her beskrevne eksperimenter udføres ved pH 8 (som i Turan et al. 10), men NP-Mx1 co-immunfældning blev også med succes udføres med en pH 7,2 lysisbuffer. Faktisk en pH på 7,2 er foretrukket, fordi der på denne pH NEM reagerer udelukkende med frie thiolgrupper, og denne pH øger også udvinding udbyttet af MX1 protein. Desuden kunne de protein G beads erstattes af protein A-perler, afhængigt af værtsarter, hvorfra de anvendte antistoffer er afledt. Imidlertid er renere resultater opnås med protein G beads. Endelig kan denne protokol også anvendes til at undersøge interaktionen mellem Mx1 og andre influenza proteiner, f.eks PB2 14. I dette tilfælde en V5 epitopmærket PB2 blev brugt, som i princippet kunne kombineres med kommercielt tilgængelige anti-V5 agarose affinitet gel.
I fremtidige forsøg, kan denne protokol være værdifuldt at identificere de regioner i Mx1 ogNP, der er vigtige for NP-Mx1 interaktion. En sådan region i Mx1 kunne loop L4, som denne løkke har vist sig at være kritisk for interaktionen mellem MXA og Thogoto virus NP 8,9. Hvis egnede NP-specifikke antistoffer bliver tilgængelige, vil denne protokol også gøre det muligt at afgøre, om den øgede følsomhed af aviær influenza A stammer til Mx1 korrelerer med en stærkere NP-Mx1 interaktion eller ej, hvilket kan hjælpe til at forstå den mekanisme af Mx følsomhed. Desuden samspillet mellem Mx1 og komponenter af virus, der tilhører andre end Orthomyxoviridae familier, kan også behandles af denne tilpassede co-immunoprecipitation protokol. Endelig yderligere undersøgelser optrævle effekten af NEM på NP-Mx1 vil være meget værdifuld for bedre at forstå dette specifik interaktion, men også for at få indsigt i de bredere anvendelser af tilsætning af denne forbindelse under cellelyse og co-immunpræcipitationseksperimenter.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Forfatterne erklærer, at de ikke har nogen konkurrerende finansielle interesser.
Acknowledgments
Dette arbejde blev støttet af FWO-Vlaanderen, IBS projektet IOF10 / StarTT / 027 og Ghent University Special Research Grant BOF12 / GOA / 014.
Materials
| Name | Company | Catalog Number | Comments |
| DMEM high glucose | Gibco | 52100-047 | |
| N-Ethylmaleimide | Sigma | E-3876 | Toxic |
| Igepal CA-630 | Sigma | I-30212 | also known as NP40 |
| Protease inhibitor cocktail | Roche | 11 873 580 001 | |
| anti-NP monoclonal antibody | NIH Biodefense and Emerging Infections Research Resources Repository | NR-4282 | ascites blend of clones A1 and A3 |
| anti-RNP polyclonal serum | NIH Biodefense and Emerging Infections Research Resources Repository | NR-3133 | directed against A/Scotland/840/74 (H3N2) |
| Protein G Sepharose 4FF | GE Healthcare | 17-0618-01 | |
| Hyperfilm ECL 18 x 24 cm | GE Healthcare | 28-9068-36 | |
| ECL western blotting substrate | Pierce | 32106 |
References
- Verhelst, J., Hulpiau, P., Saelens, X. Mx proteins: antiviral gatekeepers that restrain the uninvited. Microbiol Mol Biol Rev. 77 (4), 551-566 (2013).
- Goujon, C., et al. Human MX2 is an interferon-induced post-entry inhibitor of HIV-1 infection. Nature. 502 (7472), 559-562 (2013).
- Kane, M., et al. MX2 is an interferon-induced inhibitor of HIV-1 infection. Nature. 502 (7472), 563-566 (2013).
- Liu, Z., et al. The interferon-inducible MxB protein inhibits HIV-1 infection. Cell Host Microbe. 14 (4), 398-410 (2013).
- Kochs, G., Haller, O. Interferon-induced human MxA GTPase blocks nuclear import of Thogoto virus nucleocapsids. Proc Natl Acad Sci U S A. 96 (5), 2082-2086 (1999).
- Flohr, F., Schneider-Schaulies, S., Haller, O., Kochs, G. The central interactive region of human MxA GTPase is involved in GTPase activation and interaction with viral target structures. FEBS Lett. 463 (1-2), 24-28 (1999).
- Kochs, G., Haller, O. GTP-bound human MxA protein interacts with the nucleocapsids of Thogoto virus (Orthomyxoviridae). J Biol Chem. 274 (7), 4370-4376 (1999).
- Mitchell, P. S., et al. Evolution-guided identification of antiviral specificity determinants in the broadly acting interferon-induced innate immunity factor MxA. Cell Host Microbe. 12 (4), 598-604 (2012).
- Patzina, C., Haller, O., Kochs, G. Structural requirements for the antiviral activity of the human MxA protein against Thogoto and influenza A virus. J Biol Chem. 289 (9), 6020-6027 (2014).
- Turan, K., et al. Nuclear MxA proteins form a complex with influenza virus NP and inhibit the transcription of the engineered influenza virus genome. Nucleic Acids Res. 32 (2), 643-652 (2004).
- Dittmann, J., et al. Influenza A virus strains differ in sensitivity to the antiviral action of Mx-GTPase. J Virol. 82 (7), 3624-3631 (2008).
- Zimmermann, P., Manz, B., Haller, O., Schwemmle, M., Kochs, G. The viral nucleoprotein determines Mx sensitivity of influenza A viruses. J Virol. 85 (16), 8133-8140 (2011).
- Manz, B., et al. Pandemic influenza A viruses escape from restriction by human MxA through adaptive mutations in the nucleoprotein. PLoS Pathog. 9 (3), e1003279 (2013).
- Verhelst, J., Parthoens, E., Schepens, B., Fiers, W., Saelens, X. Interferon-inducible protein Mx1 inhibits influenza virus by interfering with functional viral ribonucleoprotein complex assembly. J Virol. 86 (24), 13445-13455 (2012).
- Brewer, C. F., Riehm, J. P. Evidence for possible nonspecific reactions between N-ethylmaleimide and proteins. Anal Biochem. 18 (2), 248-255 (1967).
- Wu, C. Y., Jeng, K. S., Lai, M. M. The SUMOylation of matrix protein M1 modulates the assembly and morphogenesis of influenza A virus. J Virol. 85 (13), 6618-6628 (2011).
- Chen, Z., Zhou, J., Zhang, Y., Bepler, G. Modulation of the ribonucleotide reductase M1-gemcitabine interaction in vivo by N-ethylmaleimide. Biochem Biophys Res Commun. 413 (2), 383-388 (2011).
- Rennie, M. L., McKelvie, S. A., Bulloch, E. M., Kingston, R. L. Transient dimerization of human MxA promotes GTP hydrolysis, resulting in a mechanical power stroke. Structure. 22 (10), 1433-1445 (2014).
- Gifford, J. L., Walsh, M. P., Vogel, H. J. Structures and metal-ion-binding properties of the Ca2+-binding helix-loop-helix EF-hand motifs. Biochem J. 405 (2), 199-221 (2007).
- Separating Protein with SDS-PAGE. , JoVE. Available from: http://www.jove.com/science-education/5058/separating-protein-with-sds-page (2014).
- Gallagher, S., Chakavarti, D. Immunoblot analysis. J Vis Exp. (16), (2008).
- Eslami, A., Lujan, J. Western blotting: sample preparation to detection. J Vis Exp. (44), (2010).
- Pavlovic, J., Haller, O., Staeheli, P. Human and mouse Mx proteins inhibit different steps of the influenza virus multiplication cycle. J Virol. 66 (4), 2564-2569 (1992).



