Introduction
粘病毒性(MX)蛋白质是抗病毒病原体的先天免疫防御的重要组成部分。这些蛋白质是由I型和III型干扰素诱导的大dynamin上样GTP酶。相应的Mx基因是存在于几乎所有的脊椎动物中的一个或多个拷贝和它们的基因产物抑制多种病毒,包括正粘病毒科 ( 例如 ,流感病毒), 弹状 ( 例如 ,水泡性口炎病毒), 布尼亚病毒科 ( 如 ,拉克罗斯病毒)和逆转录病毒 ( 例如,人免疫缺陷病毒-1)1-4。目前还不清楚这些蛋白质如何认识这种病毒浩如烟海,没有任何明显的共享主序列基序在这些病毒。的Mx蛋白的相互作用与病毒指标分析,可能涉及高阶配合其他宿主细胞的因素,将有助于了解的分子机制吨帽子进化的病毒和其宿主之间的军备竞赛。
哺乳动物的Mx蛋白和病毒靶之间的相互作用已经研究最广泛的用于人类的MxA。人类的MxA能抑制多种病毒,包括正粘病毒A型流感和Thogoto病毒的复制。 MxA蛋白结合的Thogoto病毒核蛋白复合物(vRNPs),从而防止它们的核条目,这导致感染5的块。此MxA蛋白和Thogoto病毒vRNPs之间相互作用已被证明具有共沉淀和免疫共沉淀实验6-9。怎样的Mx蛋白质阻碍A型流感病毒是不太清楚。一个主要的问题是,它不是简单的证明的MX蛋白和流感基因产物之间的相互作用。其中一份报告证实人类的MxA和NP蛋白质之间的相互作用在A型流感病毒感染的细胞10。这种相互作用可能仅通过共immunopr显示ecipitation如果细胞已用裂解之前交联试剂硫代(琥珀酰亚胺丙酸酯),这表明该相互作用是暂时和/或弱。最近的研究已经表明,不同甲型流感毒株的差分的Mx灵敏度由NP蛋白11,12的原点来确定。本着这一精神,甲型流感病毒可以从一定程度控制的Mx通过突变的具体残留在NP蛋白13逃跑。这表明,甲型流感病毒对主机的Mx的主要目标是NP蛋白质,最有可能NP组装vRNP复合物。然而,这些较近期的研究中证明了流感的NP或vRNPs,要么人类的MxA或鼠标MX1之间的相互作用。
最近我们发现,对于第一次,流感NP和鼠标MX1蛋白具有优化免疫共沉淀协议14,其在此处详细描述之间的相互作用。在一般情况下,共同-i的mmunoprecipitation是最常用的生化方法来调查蛋白质 - 蛋白质相互作用之一。这种技术通常优于其他技术, 例如,酵母双杂交,因为它允许研究蛋白质-蛋白质相互作用在其天然环境中。共免疫沉淀,可以进行上内源性表达的蛋白质,如果可用的抗体针对感兴趣的蛋白。备选地,感兴趣的蛋白质可以表达的通过转染或感染的细胞和亲和标记可被使用。除了上述的优点,所描述的共免疫沉淀协议允许弱和/或瞬态蛋白质相互作用的检测。在这个优化的协议的主要成分是添加N-乙基马来酰亚胺(NEM)的细胞裂解缓冲液中。 NEM是一种烷基化试剂,与游离硫醇基团,例如存在于半胱氨酸反应,在pH为6.5-7.5,以形成稳定的硫代酯( 图1)。在较高的pH值,NEM也可以与氨基反应或进行水解15。 NEM通常用于阻断游离硫醇基团,以防止二硫键的形成或抑制酶活性。例如,NEM常被用来阻止desumoylating酶,它们是半胱氨酸蛋白酶。在所描述的免疫共沉淀的协议,NEM最初包含在裂解缓冲液,因为它已被报道,流感蛋白的蛋白修饰可以影响病毒蛋白16之间的相互作用。出乎意料的是,在加入NEM的证明是关键文件通过共免疫沉淀流感NP和鼠标MX1之间的相互作用。目前还不清楚为什么加NEM是至关重要检测NP-MX1互动。可能的交互过瞬态和/或弱。 NEM可以稳定的相互作用, 例如,通过保留MX1的特定构象,病毒蛋白或甚至一个未知第三COMPO新界东北堆填区。 NEM这种稳定作用已被观察到之前, 例如,对于核苷酸还原酶M1和其抑制剂吉西他滨(F2dC)17之间的相互作用。 MX1和NP都含有多个半胱氨酸残基可通过NEM进行修改。例如,最近的一项研究雷尼等人证明,无茎的MxA-变种包含三个溶剂暴露半胱氨酸残基可被碘乙酰胺进行修改。突变这些残基对丝氨酸没有影响的MxA的酶活性,但阻止二硫键介导的聚集18。由于这些半胱氨酸保守MX1,这表明在MX1类似的半胱氨酸可以通过NEM并因此影响其构象或溶解性进行修改。此外,NEM还可能影响MX1,这对于MX1的抗流感活性所必需的GTP酶活性,并由此稳定MX1和NP之间的相互作用。然而,NEM上的GTP酶ACTI有直接的影响MX1的VITY是不可能的,因为NEM还需要检测流感NP和GTP酶的MX1蛋白14的无活性突变体之间的相互作用。很明显,需要更多的研究来解开NEM对NP-MX1的互动效果。
总之,所描述的共免疫沉淀协议允许研究抗病毒药MX1蛋白及其病毒靶,流感的NP蛋白质之间的相互作用。该协议也可以用来研究依赖于特定蛋白质的构象的稳定化等弱或瞬时相互作用。依赖于特定的构象的蛋白质-蛋白质相互作用之前已经描述的, 例如,对于钙结合蛋白如钙调蛋白19。最后,NEM的有益作用,也可以在该检测蛋白质 - 蛋白质相互作用,例如共沉淀测定法等方法使用。
Subscription Required. Please recommend JoVE to your librarian.
Protocol
注意:下面的转染和共免疫沉淀的协议被建立用于一个9厘米培养皿格式。其他格式也是可能的缩放协议之后。
1.播种人胚肾(HEK)293T细胞
- 转染每9厘米培养皿1.2×10 6个细胞的12ml Dulbecco改性Eagle培养基(DMEM)中的补充有10%胎牛血清,2mM的L-谷氨酰胺,0.4mM的丙酮酸钠之前种子的HEK293T细胞的一天, 0.1mM非必需氨基酸,100U / ml青霉素和0.1mg / ml链霉素。
- 生长的细胞16小时,在37℃和5%的CO 2。
- 目视检查的形态和细胞的生存力与转染前一个倒置光学显微镜。细胞需要是亚汇合以获得最佳的转染效率。
2.磷酸钙HEK293T细胞的转染
注意:使用0.5-1 pCAXL-NP或空pCAXL质粒结合1-3微克每9cm培养皿pCAXL-MX1的微克。使用在所有样品中总质粒DNA的量相等;调节用空质粒如果必要的。
- 准备转染后的缓冲区:
- 制备的Tris-EDTA(TE)为1.0毫摩尔Tris盐酸pH为8.0和0.1mM EDTA的pH为8.0的浓度。
- 制备的BS / HEPES用25mM的HEPES浓度(5.96克/升,4-(2-羟乙基)-1-哌嗪乙磺酸),274 mM氯化钠(16克/升),10毫米氯化钾(0.74克/升), 1.5mM的NaHPO 4·12H 2 O(0.5克/升)和11.1毫葡萄糖(2克/升)。调节pH至7.05。
- 制备的CaCl 2 / HEPES用1.25M的氯化钙2·2H 2 O(183.8克/ L)和125毫米的HEPES(29.79克/ L)的浓度。调节pH至7.05,用NaOH。
- 使用前暖转缓冲区在37℃。
- 通过稀释在600微升TE中的质粒DNA制备质粒样品。在6孔板的孔中制备这些混合物。
- 添加150微升的CaCl 2 / HEPES的在一个逐滴的方式向质粒样品和吹打3次上下混合。
- 准备通过逐滴加入质粒溶液的转染溶液(TE + DNA +氯化钙2 / HEPES; 750微升)以750微升的BS / HEPES缓冲液中新鲜6孔板提供的。均匀分布的质粒溶液在整个井含BS / HEPES缓冲液。
- 摇板振荡器上的转染溶液90秒以1,000rpm。
- 为5分钟,在室温下孵育该混合物。
- 加的转染溶液(1.5毫升)逐滴向细胞。使用一个微量吸P1000滴在细胞中的转染溶液。之分散在整个9厘米培养皿摇板非常轻柔。
- 孵育所述细胞在37℃和5%CO 2的6小时。然后通过抽吸去除中,立即更换无线第12毫升新鲜,预热的培养基。轻轻的新鲜培养基添加到细胞中,以防止细胞脱离。对于这一点,保持吸管的尖端靠在井的侧面,轻轻推出的介质。
- 孵育细胞另外16小时,在37℃和5%的CO 2。
3.免疫共沉淀
注:转染后执行免疫共沉淀24小时。
- 制备低盐裂解缓冲液和高盐洗涤缓冲液中。
- 通过称量NEM的量和在无水乙醇中溶解制备的2M N-乙基马来酰亚胺(NEM)的储液。准备NEM原液使用前新鲜。
注意:NEM很毒,准备和使用这种原液在通风橱中。 - 准备以50mM的Tris-HCl pH为8,150 mM氯化钠,5mM的乙二胺四乙酸(EDTA),1%NP40和蛋白酶抑制剂混合物的浓度低的盐裂解缓冲液(溶解1表吨在50ml裂解缓冲液)。添加NEM至25mM的( 即,稀释1:80)的终浓度。添加蛋白酶抑制剂和NEM后,保持在冰上。
注:请务必在使用前刚加入蛋白酶抑制剂和NEM。 - 准备以50mM的Tris-HCl pH为8,500 mM氯化钠,5mM的EDTA和1%NP40的浓度高盐洗涤缓冲液。请注意,高盐洗涤缓冲液中不包含的NEM。
- 通过称量NEM的量和在无水乙醇中溶解制备的2M N-乙基马来酰亚胺(NEM)的储液。准备NEM原液使用前新鲜。
- 配制细胞裂解液。
- 除去培养基并用2ml冰冷的磷酸盐缓冲盐水(PBS)洗细胞。轻轻地添加洗涤液,因为HEK293T细胞分离容易。
- 取出PBS和每9厘米培养皿中加入600微升冰冷的低盐裂解液。
- 孵育板20分钟在冰上。确保该板保持水平,以保证在板表面用裂解缓冲液完全覆盖。轻轻摇动板每5分钟。
- 收集细胞裂解物在一个1.5ml微量管和离心3分钟,在4℃和16000×g离心以沉淀不溶性级分。
- 传送可溶部分, 即细胞裂解物,以一个新的1.5 ml离心管,并保持在冰上。立即继续进行共免疫沉淀协议,以防止相互作用蛋白的解离。执行下列所有尽可能在冰上或在4℃下的步骤,以限制蛋白质水解活性在裂解物。
- 代的免疫复合物。
注:在这一步骤中,感兴趣的蛋白结合的合适的抗体。研究NP-MX1的互动,使用鼠标抗NP单克隆抗体。- 对于每个样品,混合135微升溶胞产物与2微升抗NP单克隆抗体和113微升低盐裂解缓冲液(250微升总体积)的。存储剩余的溶胞产物在-20℃下用于进一步分析,如免疫印迹,来记录推测INTERA的表达水平ction伙伴中的转染细胞。
注意:可替换地,测量裂解物的蛋白质浓度( 例如,使用Bradford试剂),并使用总蛋白的固定量, 例如,400微克,对于每个溶胞产物。 - 孵育在一个转向轮在4℃下将抗体溶解物混合3小时。此步骤可以扩展到一个保温过夜。
- 对于每个样品,混合135微升溶胞产物与2微升抗NP单克隆抗体和113微升低盐裂解缓冲液(250微升总体积)的。存储剩余的溶胞产物在-20℃下用于进一步分析,如免疫印迹,来记录推测INTERA的表达水平ction伙伴中的转染细胞。
- 制备的G蛋白珠。
注意:G蛋白珠运输和储存在20%乙醇中保存。胎边浆料通常由50%珠和这些珠需要洗涤它们用于免疫沉淀的免疫复合物之前。- 使用50微升珠, 即,将100μl珠浆料,每个样品。洗所需的在1管中的共免疫沉淀测定法所有的样品珠的量。切1毫升移液管尖的尖端,以缓解珠浆料移液。
- 离心G蛋白珠浆在8,000×克和4℃持续30秒。除去乙醇溶液,并添加低盐裂解缓冲液的等体积。离心机的G蛋白珠浆在8000×g离心,4℃,30秒,轻轻除去上清液。重复此洗涤步骤3次。
注意:用于洗涤珠粒不需要含有蛋白酶抑制剂或NEM的低盐裂解缓冲液。 - 估计的G蛋白珠的体积并加入低盐裂解缓冲液的等体积以使一个新的50%珠浆料在低盐裂解缓冲液。
- 对于每个样品,转移100μl的珠浆液在一个新的1.5 ml离心管,并在冰上储存直至使用。小心分割前悬浮珠浆料,因为这些珠快速沉降到管的底部。
- 免疫的免疫复合物通过G蛋白珠和其洗脱。
- 使用G蛋白珠进行免疫沉淀,离心所有管30秒,在8000×g离心,4℃和前通过目测有珠子存在所有样品中等量验证。如有必要,再次调节的珠的量在一些样品和离心机。弃上清。要小心,不要打扰沉淀的G蛋白珠。
- 短暂离心所述免疫复合物( 即 ,裂解物用抗体,250微升),30秒,在8000×g离心,4℃,收集在试管底部的完整样品。转移的免疫复合物的G蛋白珠(50微升)。
- 孵育在转向轮60分钟,在4℃。不孵育这些免疫复合物长于75分钟,用珠,以减少蛋白质的非特异性结合到所述G蛋白珠。
- 离心G蛋白珠(与结合免疫复合物),持续30秒,在8000×g离心,4℃并除去上清液。要小心,不要打扰沉淀的G蛋白珠。可选:保存这个上清在4℃或-20℃,供以后分析,例如,为了估计未结合的蛋白质的量。
- 约5分钟,900微升高盐裂解液洗的G蛋白珠。确保该珠粒在最佳洗涤的洗涤缓冲液完全重悬。离心G蛋白珠进行30秒,在8000×g离心,4℃,并丢弃上清液。重复此洗涤步骤4次。要小心,不要打扰沉淀的G蛋白珠以避免免疫沉淀的物质损失。
- 在最后一次洗涤步骤后,加入50微升2×Laemmli样品缓冲液至珠并加热该悬浮液10分钟,在95℃下洗脱(共)免疫沉淀的蛋白质。
- 制备出10毫升6×Laemmli缓冲液用1克十二烷基硫酸钠,3.5毫升甘油,3.5毫升的1M的Tris-HCl pH为6.8和420微升β巯基乙醇的。通过添加蒸馏水调节至10ml的总体积。稀释在蒸馏水的3倍,得到2×Laemmli缓冲液。
注意:#946;巯基乙醇是有毒的,准备和使用Laemmli缓冲液在通风橱中。
- 制备出10毫升6×Laemmli缓冲液用1克十二烷基硫酸钠,3.5毫升甘油,3.5毫升的1M的Tris-HCl pH为6.8和420微升β巯基乙醇的。通过添加蒸馏水调节至10ml的总体积。稀释在蒸馏水的3倍,得到2×Laemmli缓冲液。
- 加热后,离心G蛋白珠进行30秒,在8000×g离心并储存样品于4℃(短期)或-20℃(长期)。
4.分析的(共)免疫沉淀的蛋白
- 可视化存在于细胞裂解物和共免疫沉淀的洗脱物进行SDS-PAGE 20和蛋白质印迹21,22的蛋白质。通常情况下加载一半的Laemmli洗脱液的凝胶。要小心,不要采取样品进行凝胶装载时打扰沉淀的G蛋白珠。 MX1和NP表达,揭示具有抗MX1和抗NP抗体,分别为14。检测用HRP基于化学发光和X射线胶片显影的频带。
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
N-乙基马来酰亚胺是可用于不可逆地修饰的游离巯基, 例如 ,以抑制半胱氨酸蛋白酶(见图1)的有机化合物。
抗病毒MX1蛋白抑制A型流感病毒的复制与病毒核蛋白的相互作用。这里描述的优化免疫共沉淀协议允许研究这个NP-MX1互动。转染HEK293T细胞与抗病毒MX1蛋白在流感NP蛋白的存在或不存在的表达载体。接着,将NP蛋白是从总细胞裂解物被拉断用NP特异性单克隆抗体。 图2表明,该MX1蛋白是唯一的共免疫沉淀在共表达的NP的存在。在不存在的NP的可能的非特异性免疫共沉淀MX1的是造成MX1蛋白由抗NP抗体或MX1到非特异性结合或者非特异性下拉G蛋白珠。因此,总是包括阴性对照,以评估这种非特异性免疫共沉淀。 图3示出了的NP-MX1相互作用只能在NEM的存在进行检测。在该实验中,MX1到G蛋白珠的非特异性结合进行了评估与在不存在抗NP抗体的控制共免疫沉淀反应。
该协议也可以用来研究MX1和流感的NP蛋白质从感染的细胞或从病毒体中分离之间的相互作用。对于这种应用,上述协议是通过组合MX1表达细胞用含有病毒的NP蛋白原料的共免疫沉淀协议之前裂解物裂解物稍微适应。 图4示出了共免疫沉淀MX1的以NP转染细胞,感染的细胞中分离或病毒颗粒。
总之,这些结果表明,该共免疫沉淀PROTocol可用于研究抗病毒蛋白及其病毒靶标之间的相互作用。
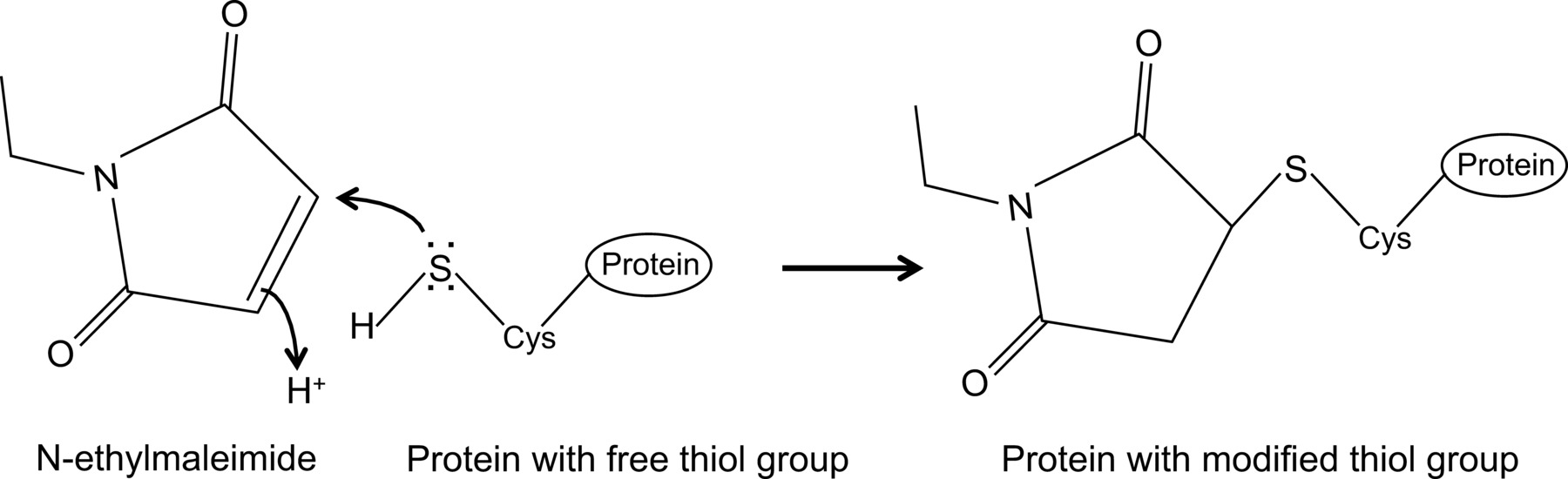
图1:游离巯基通过N-乙基马来酰亚胺改性不可逆转 请点击此处查看该图的放大版本。

其中一个既MX1和NP都存在并且一个控制设置在其中的NP蛋白质不存在: 图2:一个共免疫沉淀实验的两个样品MX1以NP相互作用 Western印迹分析。 NP是用抗NP和NP和MX1被印迹可视化。这个数字已修改的FROM 14。

图3:N-乙基马来酰亚胺是重要检测NP - MX1相互作用在N-乙基马来酰亚胺的存在下或不存在下进行的共免疫沉淀实验的Western印迹分析。 NP是用抗NP和MX1和NP是由免疫印迹可视化。

图4:含有MX1 MX1交互以NP从感染的细胞或从病毒体中分离裂解物与含有NP来自不同来源的溶胞产物:控制裂解物(无vRNPs),转染vRNPs,vRNPs从感染的细胞或vRNPs从A型流感病毒颗粒中分离。混合该裂解物,共immunopre后降水与反NP进行和MX1和NP是由免疫印迹可视化。
Subscription Required. Please recommend JoVE to your librarian.
Discussion
研究抗病毒药蛋白及其病毒靶之间的相互作用是了解这些蛋白质的抗病毒机制的细节非常重要的。这可以给新的见解如何病毒及其宿主共同进化,并依据新的抗病毒策略的发展。此处所描述的优化的共免疫沉淀协议允许研究小鼠MX1蛋白及其病毒靶,流感的NP蛋白质之间的相互作用。这个协议的最重要的方面是,在裂解缓冲液中加入NEM的,作为对NP-MX1相互作用是检测不到的,在缺少NEM( 图3)的。迄今为止,它不知道为什么NEM的存在是必要的,以检测这种相互作用。然而,该协议可以是,研究依赖于特定蛋白质的构象的稳定等弱和/或短暂的相互作用是有用的,特别是如果半胱氨酸参与。
一个在一般的共免疫沉淀实验重要的限制是,识别构象表位中的相互作用伙伴以高亲和力一个具体和高质量抗体的可用性。该NP-MX1互动不能证明我们在内部产生的抗MX1多克隆抗血清。该抗血清免疫沉淀也流感NP蛋白,甚至在没有MX1的。此外,该抗NP单克隆抗体,使用的是,认识到在A /波多黎各/ 8/34流感病毒株的NP蛋白质,但不幸的是它不适合于下拉的禽流感病毒株的NP。此共免疫沉淀协议的另一个限制是MX1到G蛋白珠的非特异性结合。后者结合可以通过增加盐浓度的洗涤缓冲液,并减少溶胞产物和G蛋白珠之间的接触时间来克服。此外,减少的珠的使用量为每免疫沉淀从50微升至25微升的反应,可以进一步降低非特异性MX1结合这些珠子。在一般情况下,污染性蛋白的非故意下拉,造成的非特异性结合到所述G蛋白珠,也可以通过其他的策略减少。例如,这些蛋白质可以在一个预澄清步骤,其中这些蛋白质是通过培养用G蛋白珠的裂解物在不存在抗体的除去被除去。的污染性蛋白,然后连同珠粒取出并预清除裂解物用于免疫共沉淀。这种策略是仅有利的是,污染性蛋白是从所研究的蛋白(多个)不同。可替代地,对蛋白质的非特异性结合位点ģ珠粒可以用BSA封闭。然而,这种策略是仅建议如果珠粒首先涂覆有抗体,如牛血清白蛋白也可减少免疫复合物( 即,降低抗体的包被珠结合)的沉淀。拍摄在一起,这是为了包括适当的控制非常重要的,以排除所感兴趣的蛋白的非特异性结合G蛋白珠或所使用的抗体。
所描述的免疫共沉淀的协议可以被修改以研究MX1与NP蛋白存在于不同的环境,例如 ,在受感染的细胞或纯化的vRNPs的相互作用。 MX1抑制病毒蛋白质,包括NP的表达,在流感病毒感染23。因此,在技术上是非常困难的,研究在随后感染MX1转染的细胞对NP-MX1相互作用。尽管如此,这个共免疫沉淀的协议,也可以结合MX1表达细胞和病毒感染的细胞,从而成功地检测到的NP-MX1相互作用( 图4)溶胞产物之后进行。作为NEM的关键目标是不知道,NEM被两个细胞群体的裂解过程中加入。如果需要的话,pH值裂解缓冲液可以改变。这里所描述的实验是在pH 8来进行(如在图兰等人 10),但也被成功地用pH 7.2的裂解缓冲液进行的NP-MX1共免疫沉淀。实际上,pH为7.2是优选的,因为在该pH NEM只发生反应的游离巯基与该pH值也增加了MX1蛋白的提取率。此外,G蛋白珠可以通过蛋白A珠被替换,这取决于从其中所用的抗体所来源的宿主物种。然而,清洁结果与G蛋白珠获得。最后,该协议也可以用来研究MX1和其他流感蛋白, 例如,PB2 14之间的相互作用。在这种情况下,一个V5表位标签的PB2被使用,这原则上可以与可商购的抗V5琼脂糖亲和凝胶相结合。
在以后的实验,这个协议可能是有价值的识别MX1的地区和NP是为NP-MX1的互动非常重要。在MX1一个这样的区域可以是弛垂部分L4,因为该环已被证明是MxA蛋白和Thogoto病毒的NP 8,9之间的相互作用的关键。如果合适的NP特异性抗体可用时,该协议也将允许确定的A型禽流感株MX1的敏感性增加相关用更强的NP-MX1相互作用与否,这可能有助于理解的Mx灵敏度的机制。此外,MX1和属于家庭比正粘病毒等病毒组分之间的相互作用,也可以通过此适于免疫共沉淀协议处理。最后,进一步研究,以解开NEM上的NP-MX1的效果将是非常有价值的,以更好地理解此特定相互作用,而且还获得在期间细胞裂解和免疫共沉淀实验中加入该化合物的更广泛的应用的洞察力。
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
作者宣称,他们有没有竞争的财务权益。
Acknowledgments
这项工作是由FWO-VLAANDEREN,在IOF项目IOF10 / StarTT / 027和根特大学特别研究基金BOF12 / GOA / 014的支持。
Materials
| Name | Company | Catalog Number | Comments |
| DMEM high glucose | Gibco | 52100-047 | |
| N-Ethylmaleimide | Sigma | E-3876 | Toxic |
| Igepal CA-630 | Sigma | I-30212 | also known as NP40 |
| Protease inhibitor cocktail | Roche | 11 873 580 001 | |
| anti-NP monoclonal antibody | NIH Biodefense and Emerging Infections Research Resources Repository | NR-4282 | ascites blend of clones A1 and A3 |
| anti-RNP polyclonal serum | NIH Biodefense and Emerging Infections Research Resources Repository | NR-3133 | directed against A/Scotland/840/74 (H3N2) |
| Protein G Sepharose 4FF | GE Healthcare | 17-0618-01 | |
| Hyperfilm ECL 18 x 24 cm | GE Healthcare | 28-9068-36 | |
| ECL western blotting substrate | Pierce | 32106 |
References
- Verhelst, J., Hulpiau, P., Saelens, X. Mx proteins: antiviral gatekeepers that restrain the uninvited. Microbiol Mol Biol Rev. 77 (4), 551-566 (2013).
- Goujon, C., et al. Human MX2 is an interferon-induced post-entry inhibitor of HIV-1 infection. Nature. 502 (7472), 559-562 (2013).
- Kane, M., et al. MX2 is an interferon-induced inhibitor of HIV-1 infection. Nature. 502 (7472), 563-566 (2013).
- Liu, Z., et al. The interferon-inducible MxB protein inhibits HIV-1 infection. Cell Host Microbe. 14 (4), 398-410 (2013).
- Kochs, G., Haller, O. Interferon-induced human MxA GTPase blocks nuclear import of Thogoto virus nucleocapsids. Proc Natl Acad Sci U S A. 96 (5), 2082-2086 (1999).
- Flohr, F., Schneider-Schaulies, S., Haller, O., Kochs, G. The central interactive region of human MxA GTPase is involved in GTPase activation and interaction with viral target structures. FEBS Lett. 463 (1-2), 24-28 (1999).
- Kochs, G., Haller, O. GTP-bound human MxA protein interacts with the nucleocapsids of Thogoto virus (Orthomyxoviridae). J Biol Chem. 274 (7), 4370-4376 (1999).
- Mitchell, P. S., et al. Evolution-guided identification of antiviral specificity determinants in the broadly acting interferon-induced innate immunity factor MxA. Cell Host Microbe. 12 (4), 598-604 (2012).
- Patzina, C., Haller, O., Kochs, G. Structural requirements for the antiviral activity of the human MxA protein against Thogoto and influenza A virus. J Biol Chem. 289 (9), 6020-6027 (2014).
- Turan, K., et al. Nuclear MxA proteins form a complex with influenza virus NP and inhibit the transcription of the engineered influenza virus genome. Nucleic Acids Res. 32 (2), 643-652 (2004).
- Dittmann, J., et al. Influenza A virus strains differ in sensitivity to the antiviral action of Mx-GTPase. J Virol. 82 (7), 3624-3631 (2008).
- Zimmermann, P., Manz, B., Haller, O., Schwemmle, M., Kochs, G. The viral nucleoprotein determines Mx sensitivity of influenza A viruses. J Virol. 85 (16), 8133-8140 (2011).
- Manz, B., et al. Pandemic influenza A viruses escape from restriction by human MxA through adaptive mutations in the nucleoprotein. PLoS Pathog. 9 (3), e1003279 (2013).
- Verhelst, J., Parthoens, E., Schepens, B., Fiers, W., Saelens, X. Interferon-inducible protein Mx1 inhibits influenza virus by interfering with functional viral ribonucleoprotein complex assembly. J Virol. 86 (24), 13445-13455 (2012).
- Brewer, C. F., Riehm, J. P. Evidence for possible nonspecific reactions between N-ethylmaleimide and proteins. Anal Biochem. 18 (2), 248-255 (1967).
- Wu, C. Y., Jeng, K. S., Lai, M. M. The SUMOylation of matrix protein M1 modulates the assembly and morphogenesis of influenza A virus. J Virol. 85 (13), 6618-6628 (2011).
- Chen, Z., Zhou, J., Zhang, Y., Bepler, G. Modulation of the ribonucleotide reductase M1-gemcitabine interaction in vivo by N-ethylmaleimide. Biochem Biophys Res Commun. 413 (2), 383-388 (2011).
- Rennie, M. L., McKelvie, S. A., Bulloch, E. M., Kingston, R. L. Transient dimerization of human MxA promotes GTP hydrolysis, resulting in a mechanical power stroke. Structure. 22 (10), 1433-1445 (2014).
- Gifford, J. L., Walsh, M. P., Vogel, H. J. Structures and metal-ion-binding properties of the Ca2+-binding helix-loop-helix EF-hand motifs. Biochem J. 405 (2), 199-221 (2007).
- Separating Protein with SDS-PAGE. , JoVE. Available from: http://www.jove.com/science-education/5058/separating-protein-with-sds-page (2014).
- Gallagher, S., Chakavarti, D. Immunoblot analysis. J Vis Exp. (16), (2008).
- Eslami, A., Lujan, J. Western blotting: sample preparation to detection. J Vis Exp. (44), (2010).
- Pavlovic, J., Haller, O., Staeheli, P. Human and mouse Mx proteins inhibit different steps of the influenza virus multiplication cycle. J Virol. 66 (4), 2564-2569 (1992).



