Introduction
ミクソウイルス抵抗(MX)タンパク質は、ウイルスの病原体に対する先天性免疫防御の重要な部分である。これらのタンパク質は、I型およびIII型インターフェロンにより誘導される大ダイナミン様GTPアーゼである。対応のMx遺伝子は、1つまたは複数のコピーのほぼすべての脊椎動物に存在し、それらの遺伝子産物は、 オルソミクソウイルス科 ( 例えば 、インフルエンザウイルス)、 ラブドウイルス科 ( 例えば 、水疱性口内炎ウイルス)、 ブニヤウイルス科 ( 例えば含む、広範囲のウイルスを阻害する。 、ラクロスウイルス)およびレトロウイルス ( 例えば、ヒト免疫不全ウイルス-1)1-4。それは、これらのタンパク質は、これらのウイルスの任意の明白な共有の一次配列モチーフのないウイルスのような幅広い配列を、認識かは不明である。潜在的に、それらのウイルス標的にはMxタンパク質の相互作用を分析する他の宿主細胞因子との高次複合体を含む、トン分子機構を理解するのに役立ちます帽子は、ウイルスとそのホスト間の軍拡競争に進化してきた。
哺乳類のMxタンパク質およびウイルス標的の間の相互作用は、ヒトMxAの最も広く研究されてきた。人間のMxAはオルトミクソウイルス、インフルエンザAおよびThogotoウイルスを含む多くのウイルスの複製を阻害することができる。のMxA、それによって感染5のブロックになりそれらの核侵入を防止、Thogotoウイルスリボ核タンパク質複合体(vRNPs)に結合する。のMxAとThogotoウイルスvRNPsとの間のこの相互作用は、共同沈降と共免疫沈降実験6-9で実証されている。 Mxのタンパク質は、インフルエンザAウイルスを妨げる方法あまり明らかではない。一つの大きな問題は、Mx蛋白質とインフルエンザ遺伝子産物間の相互作用を実証するために簡単ではないということである。一つのレポートには、インフルエンザウイルスに感染した細胞10を人間のMxAおよびNPタンパク質との間の相互作用を実証した。この相互作用は、唯一の共同immunoprによって示すことができたecipitation細胞が相互作用は一過性および/または弱であることを示唆し、溶解する前に、架橋試薬ジチオビス(スクシンイミジルプロピオネート)で処理した場合。より最近の研究は、異なるインフルエンザA株の差動Mxの感度はNPタンパク質11,12の起点によって決定されることを示した。これに伴い、A型インフルエンザウイルスは、部分的にNPタンパク質13内の特定の残基を変異させることによりMxの制御から逃れることができます。これは、ホストのA型インフルエンザウイルスの主要なターゲットはMxのはおそらくNPがvRNP複合錯体で組み立て、NPタンパク質であることを示唆している。しかし、これらのより最近の研究はいずれも、インフルエンザNPまたはvRNPsおよびヒトのMxAまたはマウスMx1のいずれかの間の相互作用を示さなかった。
最近では、初めて、インフルエンザNPおよび、ここでは詳細に説明されて最適化された共免疫沈降プロトコル14、マウスMx1のタンパク質との間の相互作用を示した。一般に、コのimmunoprecipitationは、タンパク質 - タンパク質相互作用を研究するために最も頻繁に使用される生化学的アプローチの一つである。それは、それらの天然の環境におけるタンパク質-タンパク質相互作用を調査することを可能にするので、この技術は、多くの場合、代替技術、 例えば、酵母ツーハイブリッドよりも好ましい。目的のタンパク質に対する抗体が利用可能である場合、共免疫沈降は、内因的に発現されるタンパク質に行うことができる。あるいは、目的のタンパク質は、トランスフェクションまたは感染を介して細胞内で発現させることができ、親和性タグを使用することができる。上記の利点に加えて、説明し、共免疫沈降プロトコルは、弱いおよび/または一過性タンパク質相互作用の検出を可能にする。この最適化されたプロトコルの主な成分は、細胞溶解緩衝液中にN-エチルマレイミド(NEM)の添加である。 NEMは、安定したチオエステルを形成するために、6.5〜7.5のpHで、そのようなシステイン中に存在する遊離チオール基と反応するアルキル化試薬である( 図1)。より高いpHでは、NEMは、アミノ基と反応または加水分解15を受けることができる。 NEMは、典型的には、ジスルフィド結合の形成を防止または酵素活性を阻害するために、遊離チオール基をブロックするために使用される。例えば、NEMは、多くの場合、システインプロテアーゼであるdesumoylating酵素をブロックするために使用される。それはインフルエンザタンパク質のSUMO化は、ウイルスタンパク質16との間の相互作用に影響を与えることができることが報告されていたので、記載の免疫共沈降プロトコルでは、NEMは、最初の溶解緩衝液に含まれていた。予想外に、NEMの添加は、共免疫沈降によってインフルエンザNPおよびマウスMx1の間の相互作用を文書化キーであることが判明した。 NEMの添加は、NP-Mx1の相互作用を検出することが重要である理由は不明である。おそらく相互作用があまりにも一過性および/または弱い。 NEMは、Mx1の特定のコンホメーションを保存することにより、例えば 、ウイルスタンパク質、あるいは未知の第三のコンポを相互作用を安定させることができポーネント。 NEMのこのような安定化効果は、リボヌクレオチド還元酵素M1とその阻害剤ゲムシタビン(F2dC)17との間の相互作用のために、例えば 、以前に観察されている。 Mx1のとNPの両方がNEMによって修正することができる複数のシステイン残基を含む。例えば、レニーらによる最近の研究はstalkless MxAの変異はヨードアセトアミドにより修飾することができる3つの溶媒露出したシステイン残基を含有することを実証した。セリンにこれらの残基を変異することのMxAの酵素活性に影響を与えるが、ジスルフィド媒介凝集18を妨げませんでした。これらのシステインはMx1の中で保存されているように、これはMx1の中の類似のシステインがNEMによって、そのような影響は、そのコンホメーまたは溶解度のように変形することができることを示唆している。また、NEMもMx1の抗インフルエンザ活性に必須であるMx1の、のGTPase活性に影響を与え、それによってMx1のとNPとの相互作用を安定化させるかもしれない。しかし、GTPアーゼACTI上のNEMの直接の効果NEMはまた、インフルエンザNPおよびGTPアーゼMx1のタンパク質14の非アクティブな変異体の間の相互作用を検出する必要があるとしてMx1ののVITYは、ほとんどありません。明らかに、より多くの研究がNP-Mx1の相互作用にNEMの影響を解明するために必要とされる。
要約すると、説明した共免疫沈降プロトコルは、抗ウイルスMx1のタンパク質とそのウイルス標的、インフルエンザNPタンパク質間の相互作用を研究することができます。このプロトコルは、特定のタンパク質コンフォメーションの安定化に依存する他の弱いまたは一時的な相互作用を研究するために使用することができる。特定のコンホメーションに依存する、タンパク質-タンパク質相互作用は、カルモジュリン19などのカルシウム結合タンパク質のために、例えば 、以前に記載されている。最後に、NEMの有益な役割はまた、そのような共沈降アッセイなどのタンパク質 - タンパク質相互作用を検出する他の方法で使用することができる。
Subscription Required. Please recommend JoVE to your librarian.
Protocol
注:以下のトランスフェクションおよび共免疫沈降プロトコルは9センチメートルシャーレ形式のために確立されている。他の形式のプロトコルをスケーリング後も可能である。
ヒト胚腎臓(HEK)293T細胞を播種1.
- 10%ウシ胎児血清、2mM L-グルタミン、0.4mMのピルビン酸ナトリウムを補充したダルベッコ改変イーグル培地(DMEM)12mlの9cmのペトリ皿あたり1.2×10 6細胞でのトランスフェクションの前にHEK293T細胞を一日に播種、 0.1mMの非必須アミノ酸、100 U / mlペニシリン及び0.1mg / mlのストレプトマイシン。
- 細胞を37℃で16時間、5%CO 2を成長させる。
- 視覚的にトランスフェクション前に反転光顕微鏡で細胞の形態および生存を検査。細胞は、最適なトランスフェクション効率のためのサブ集密にする必要があります。
HEK293T細胞の2リン酸カルシウムのトランスフェクション
注意:9 cmディッシュあたりpCAXL-Mx1の1-3μgのとの組み合わせでpCAXL-NPまたは空pCAXLプラスミドの使用0.5〜1μgの。全試料中の全プラスミドDNAの等量を使用する。必要に応じて、空のプラスミドで調整します。
- 以下のトランスフェクションバッファを準備します。
- 1.0 mMのトリス-HClの濃度は8.0と0.1のEDTA pH8.0でトリスEDTA(TE)を準備します。
- 、25mMのHEPES(5.96グラム/ L、4-(2-ヒドロキシエチル)-1-ピペラジンエタンスルホン酸)の濃度でBS / HEPESを準備、274 mMのNaClを(16グラム/ L)、10のKCl(0.74グラム/ L) 1.5ミリモルのNaHPO 4·12H 2 O(0.5g / Lの)、および11.1 mMのデキストロース(2g / Lの)。 7.05にpHを調整する。
- 1.25 MのCaCl 2·2H 2 O(183.8グラム/ L)と125 mMのHEPES(29.79グラム/ L)の濃度でのCaCl 2 / HEPESを準備します。 NaOHで7.05にpHを調整する。
- 使用前に37℃でのトランスフェクション緩衝液を温める。
- TEの600μlのプラスミドDNAを希釈することによって、プラスミドのサンプルを準備します。6ウェルプレートのウェル中でこれらの混合物を準備します。
- プラスミドサンプルに滴下方式でのCaCl 2 / HEPES150μlのを追加し、上下に3回ピペッティングして混ぜる。
- 新鮮な6ウェルプレートに設けBS / HEPES緩衝液の750μlに、プラスミド溶液(750μlのTE + DNA +のCaCl 2 / HEPES)を追加すること滴下することによりトランスフェクション溶液を準備します。よくBS / HEPES緩衝液を含む完全に均等にプラスミド溶液を配布します。
- 1000rpmで90秒間プレートシェーカー上トランスフェクション溶液を振る。
- 室温で5分間混合物をインキュベートする。
- トランスフェクション溶液(1.5ミリリットル)を細胞に滴下して追加します。細胞にトランスフェクション溶液を滴下するP1000のマイクロピペットを使用してください。完全な9センチメートルペトリ皿の上に混合物を分散させ、非常に静かにプレートを横に振る。
- 6時間37℃で細胞を、5%CO 2でインキュベートする。その後、吸引により培地を除去し、すぐのWiを交換12ミリリットル新鮮な、予め温めた培地番目。静かに細胞の剥離を防止するために、細胞に新鮮な培地を追加。このために、ウェルの側面にピペットの先端を保持し、静かにメディアを押し出す。
- 37℃でさらに16時間細胞をインキュベートし、5%CO 2。
3.共免疫沈降
注:トランスフェクション後に共免疫沈降24時間を実行します。
- 低塩の溶解緩衝液および高塩洗浄緩衝液を調製する。
- NEMの量を秤量し、無水エタノールに溶解することにより2 M N-エチルマレイミド(NEM)のストック溶液を調製する。使用前に新鮮なNEM原液を準備します。
注意:NEMは、ドラフト中、この原液を調製し、使用し、非常に有毒である。 - 50mMトリス - 塩酸pHが8、150mMのNaCl、5mMのエチレンジアミン四酢酸(EDTA)、1%NP40およびプロテアーゼ阻害剤カクテルの濃度で低塩溶解用緩衝液を調製する(表1を溶解するを50mlの溶解緩衝液中でt)とする。 25ミリ( すなわち、1:80に希釈)の最終濃度にNEMを追加します。プロテアーゼ阻害剤とNEMを追加した後、氷上で保管してください。
注:常に新鮮に使用前にプロテアーゼ阻害剤とNEMを追加します。 - 50mMトリス - 塩酸pHが8、500mMのNaCl、5mMのEDTA、1%NP40の濃度の高塩洗浄緩衝液を調製する。高塩洗浄バッファーはNEMが含まれていないことに注意してください。
- NEMの量を秤量し、無水エタノールに溶解することにより2 M N-エチルマレイミド(NEM)のストック溶液を調製する。使用前に新鮮なNEM原液を準備します。
- 細胞溶解物の調製。
- 培地を除去し、氷冷リン酸緩衝生理食塩水(PBS)2mlで細胞を洗浄する。 HEK293T細胞を容易に切り離すように非常に優しく、洗浄緩衝液を加える。
- PBSを除去し、9センチメートルペトリ皿当たりの氷冷低塩の溶解バッファー600μlを添加する。
- 氷上で20分間プレートをインキュベートします。溶解緩衝液でプレート表面を完全にカバーを確実にするために、プレートが水平に保たれていることを確認します。静かに5分ごとにプレートを横に振る。
- 1.5ミリリットルの微量細胞溶解物を収集不溶性画分をペレット化4℃16,000×gで3分間のチューブと遠心分離機。
- 新しい1.5 mlのマイクロ遠心チューブに細胞溶解物、 すなわち可溶性画分を移し、氷上に保つ。すぐに相互作用するタンパク質の解離を防止するために、共免疫沈降プロトコルに進みます。溶解物中のタンパク質分解活性を制限するために氷の上または4℃で可能な限りすべて、次の手順を実行します。
- 免疫複合体の生成。
注:このステップでは、目的のタンパク質を適切な抗体によって結合される。 NP-Mx1の相互作用を研究するために、マウス抗NPモノクローナル抗体を使用する。- 各サンプルについて、抗NPモノクローナル抗体の2μLと低塩溶解バッファー(250μlの総体積)の113μlの溶解物の135μLをミックス。推測されるインテラの発現レベルを文書化する、ウエスタンブロッティング等のさらなる分析のために-20℃で、残りの溶解物を保管してくださいトランスフェクトした細胞におけるctionパートナー。
注:また、各溶解物のために、( 例えば、Bradford試薬で)溶解物のタンパク質濃度を測定し、総タンパク質の一定量を使用して、 例えば、400μgの。 - 4℃で回し車で3時間のための抗体 - 溶解物ミックスをインキュベートする。このステップは、一晩のインキュベーションに拡張することができる。
- 各サンプルについて、抗NPモノクローナル抗体の2μLと低塩溶解バッファー(250μlの総体積)の113μlの溶解物の135μLをミックス。推測されるインテラの発現レベルを文書化する、ウエスタンブロッティング等のさらなる分析のために-20℃で、残りの溶解物を保管してくださいトランスフェクトした細胞におけるctionパートナー。
- プロテインGビーズの調製。
注:プロテインGビーズを出荷および保存のために20%エタノール中で保存されている。ビーズスラリーは、通常、50%のビーズで構成され、これらのビーズは、それらが免疫複合体を免疫沈降させるために使用される前に洗浄する必要がある。- 各サンプルについて、 すなわちビーズ、50μlの、ビーズスラリーの100μlのを使用してください。 1管中の共免疫沈降アッセイにおけるすべてのサンプルのために必要なビーズの量を洗ってください。ビーズスラリーのピペット操作を容易にするために1ミリリットルピペットチップの先端をカットします。
- 8000 xにおけるプロテインGビーズスラリーを遠心30秒間g及び4℃。エタノール溶液を除去し、低塩の溶解緩衝液の等容量を加える。遠心機で30秒間8000×gで4℃でプロテインGビーズスラリーと優しく上清を除去。この洗浄工程を3回繰り返します。
注:ビーズを洗浄し、低塩の溶解緩衝液は、プロテアーゼ阻害剤またはNEMを含む必要はない。 - プロテインGビーズの体積を推定し、低塩の溶解緩衝液中で新たな50%ビーズスラリーを作成する低塩の溶解緩衝液の等容量を加える。
- 各サンプルについて、新しい1.5 mlマイクロチューブにビーズスラリーの100μlのを転送し、使用するまで氷上で保存する。これらのビーズはすぐにチューブの底に沈降するように、除する前に、ビーズスラリーを再懸濁するように注意してください。
- プロテインGビーズおよびそれらの溶出による免疫複合体の免疫沈降。
- 免疫沈降のためにプロテインGビーズを使用する前に、遠心すべての管8000×gで30秒、4℃、全てのサンプル中に存在するビーズの等量があることを目視により確認する。必要に応じて、再びサンプルと遠心機のいくつかでビーズの量を調整します。上清を捨てる。ペレット化プロテインGビーズを乱さないように注意してください。
- 簡単に言えばチューブの底に完全なサンプルを収集するために8000×gで4℃で30秒間、免疫複合体( すなわち 、抗体との溶解物、250μl)を遠心する。プロテインGビーズ(50μl)を、免疫複合体を転送します。
- 4℃で回し車で60分インキュベートします。プロテインGビーズへのタンパク質の非特異的結合を減らすためにビーズと75分より長くこれらの免疫複合体をインキュベートしないでください。
- 8000×gで30秒間(結合した免疫複合体との)プロテインGビーズを遠心し、4℃、上清を取り除く。ペレット化プロテインGビーズを乱さないように注意してください。オプション:-20後の解析のためのC°4°Cで、この上清を保存し、例えば、非結合タンパク質の量を推定する。
- 高塩溶解緩衝液900μlの約5分間プロテインGビーズを洗浄する。ビーズが完全に最適な洗浄のための洗浄バッファーに再懸濁されていることを確認してください。 8000×gで30秒間プロテインGビーズを遠心し、4℃、上清を捨てる。この洗浄工程を4回繰り返します。免疫沈降材料の損失を回避するために、ペレット化プロテインGビーズを乱さないように注意してください。
- 最後の洗浄工程の後、ビーズを2×Laemmliサンプル緩衝液50μlを追加し、(共)免疫沈降したタンパク質を溶出させ、95℃で10分間、懸濁液を加熱する。
- βメルカプトエタノールの1 Mトリス塩酸pHが6.8と420μLのドデシル硫酸ナトリウムの1グラムで6倍Laemmli緩衝液の10ミリリットル、グリセロールの3.5ミリリットル、3.5ミリリットルを準備します。蒸留水を加え、10 mLの総体積に調整する。 2×Laemmli緩衝液を得るために、蒸留水で3倍に希釈する。
注意:βメルカプトエタノールは毒性があり、準備し、ドラフト内でLaemmliのバッファを使用。
- βメルカプトエタノールの1 Mトリス塩酸pHが6.8と420μLのドデシル硫酸ナトリウムの1グラムで6倍Laemmli緩衝液の10ミリリットル、グリセロールの3.5ミリリットル、3.5ミリリットルを準備します。蒸留水を加え、10 mLの総体積に調整する。 2×Laemmli緩衝液を得るために、蒸留水で3倍に希釈する。
- 加熱した後、8000×gで30秒間遠心プロテインGビーズを、4℃(短期)または-20℃(長期)でサンプルを保存する。
4.(共)免疫沈降したタンパク質を分析
- SDS-PAGE 20と21,22ウエスタンブロッティングによる細胞溶解物と共免疫沈降の溶出液中に存在するタンパク質を可視化。通常、ゲルでレムリ溶出液の半分をロードします。ゲルローディングのための試料を採取する際にペレット化プロテインGビーズを乱さないように注意してください。 Mx1のおよびNPの発現は、それぞれ14、抗Mx1の及び抗NP抗体を用いて明らかにした。バンドはHRPベースの化学発光及びX線フィルム現像液を用いて検出した。
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
N-エチルマレイミドは、システインプロテアーゼ( 図1)を阻害するために、例えば 、不可逆的に遊離のチオール基を修飾するために用いることができる有機化合物である。
抗ウイルスMx1のタンパク質は、インフルエンザAウイルスの核タンパク質と相互作用することによりウイルス複製を阻害する。ここで説明する最適化された共免疫沈降プロトコルは、このNP-Mx1の相互作用を研究することができます。 HEK293T細胞を、インフルエンザNPタンパク質の非存在下または存在下での抗ウイルスMx1のタンパク質のための発現ベクターでトランスフェクトした。次に、NPタンパク質は、NP特異的モノクローナル抗体を用いた全細胞溶解物から、プルダウンした。 図2は、Mx1のタンパク質が共発現NPの存在下で共免疫だけであることを示している。 NPの非存在下でのMx1のの可能性非特異的共免疫沈降は、抗NP抗体によるまたはにMx1のの非特異的結合によってMx1のタンパク質の非特異的なプルダウンいずれかによって引き起こされるプロテインGビーズ。したがって、常にこの非特異的免疫共沈降を評価するための陰性対照が含まれる。 図3は、NP-Mx1の相互作用のみがNEMの存在下で検出できることを示している。この実験では、プロテインGビーズにMx1のの非特異的結合は、抗NP抗体の非存在下での対照の共免疫沈降反応を評価した。
このプロトコルは、Mx1に感染した細胞またはビリオンから単離されたインフルエンザNPタンパク質との間の相互作用を研究するために使用することができる。このアプリケーションでは、上記のプロトコルは、わずかにMx1の共免疫沈降プロトコルを開始する前に、ウイルスのNPタンパク質を含む溶解物を発現する細胞の溶解物を組み合わせることによって適合させた。 図4 NPとMx1の共免疫沈降は、トランスフェクトされた細胞、感染細胞から単離さ示すまたはビリオン。
結論として、これらの結果は、この免疫共沈降protのことを示しているocolは、ウイルスタンパク質およびそのウイルスの標的との間の相互作用を研究するために使用することができる。
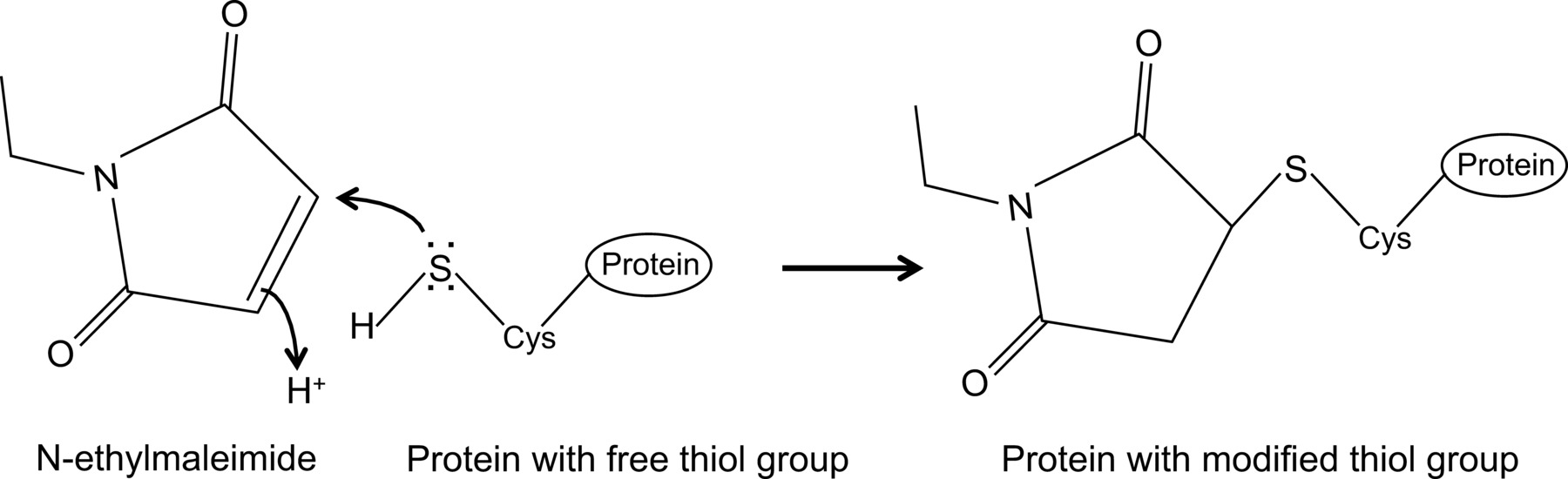
図1:N-エチルマレイミドによる遊離チオール基の不可逆的な修正は、 この図の拡大版をご覧になるにはこちらをクリックしてください。

図2:Mx1の二つのサンプルとの共免疫沈降実験のNPウェスタンブロット分析と対話 :Mx1のNPとの両方が存在する一方NPタンパク質が不在である、一つの制御設定。 NPは、抗NP及びNPおよびMx1ので免疫沈降し、ウエスタンブロッティングにより可視化した。この図は、F変更されましたROM 14。

。図3:N -エチルマレイミドの存在下または非存在下で行わ共免疫沈降実験のMx1の相互作用ウェスタンブロット分析、N-エチルマレイミドは、NPを検出することが重要である 。 NPは、抗NPおよびMx1ので免疫沈降し、NPをウエスタンブロッティングにより可視化した。

図4:Mx1には、感染した細胞から、またはビリオンから分離NPと相互作用して溶解物はMx1にを含むさまざまなソースからのNPを含む溶解物と合わせた:。コントロール溶解物(NO vRNPs)、感染細胞またはvRNPsからvRNPs、vRNPsをトランスフェクトしたA型インフルエンザウイルス粒子から分離。溶解物を混合した後、共immunopre抗NPとcipitationを行い、Mx1の及びNPは、ウエスタンブロッティングにより可視化した。
Subscription Required. Please recommend JoVE to your librarian.
Discussion
抗ウイルス性タンパク質およびそれらのウイルス標的の間の相互作用を研究することは、これらのタンパク質の抗ウイルス機構の詳細を理解することが非常に重要である。これは、ウイルスとそのホストが共同どのように進化したかに新たな洞察を与え、新たな抗ウイルス戦略の開発のための基礎となり得る。ここで説明する最適化された共免疫沈降プロトコルは、マウスMx1のタンパク質とそのウイルス標的、インフルエンザNPタンパク質間の相互作用を研究することができます。 NP-Mx1の相互作用がNEM( 図3)の非存在下では検出不可能であるように、このプロトコルの最も重要な側面は、溶解緩衝液中のNEMの添加である。今日まで、それはNEMの存在は、この相互作用を検出することが重要である理由は不明である。しかし、このプロトコルは、システインが関与している場合は特に、特定のタンパク質立体構造の安定化に依存する他の弱いおよび/または一時的な相互作用を研究するのに有用である可能性があります。
アン一般に、共免疫沈降アッセイの重要な制限は、高親和性で相互作用パートナーのいずれかの立体配座エピトープを認識する特異的かつ高品質の抗体の利用可能性である。 NP-Mx1の相互作用は、家の中で抗Mx1にポリクローナル抗血清を生産し、当社で実証することができなかった。この抗血清はまたさえMx1のが存在しない場合に、インフルエンザNPタンパク質を免疫沈降する。また、使用された抗NPモノクローナル抗体は、A /プエルトリコ/ 8/34インフルエンザ株のNPタンパク質を認識するが、残念ながら、それは、鳥インフルエンザウイルス株のNP-プルダウンするのに適していない。この共免疫沈降プロトコルの別の制限は、タンパク質GビーズにMx1のの非特異的結合である。結合後者は、洗浄緩衝液中の塩濃度を増加させ、溶解物を、プロテインGビーズとの接触時間を減少させることによって克服することができる。加えて、それぞれの免疫沈降に使用されるビーズの量を減少させる25μlに50μLの反応、さらにこれらのビーズにMx1のの非特異的結合を減少させることができます。一般に、プロテインGビーズに非特異的結合に起因する汚染タンパク質の意図しないプルダウンも、他の方法によって低減することができる。例えば、これらのタンパク質は、これらのタンパク質は、抗体の非存在下でプロテインGビーズを溶解物をインキュベートすることによって除去されるプレクリアステップの間に除去することができる。混入タンパク質は、その後ビーズと共に除去され、予備清澄化ライセートは、共免疫沈降のために使用される。混入タンパク質は、研究対象のタンパク質(単数または複数)と異なる場合、この戦略は、有利である。あるいは、タンパク質Gビーズ上の非特異的結合部位をBSAでブロックすることができた。 BSAはまた、免疫複合体(コーティングされたビーズによる結合すなわち、還元された抗体)の沈殿を減らすことができるようにビーズはまず、抗体でコーティングされている場合は、この戦略にのみ推奨されます。撮影一緒に、タンパク質Gビーズに、または使用される抗体を、目的のタンパク質の非特異的結合を排除するために適切なコントロールを含めることが非常に重要である。
記載の共免疫沈降プロトコルは、感染細胞においてまたは精製vRNPsの異なる環境に存在するNPタンパク質、 例えば、Mx1のとの相互作用を研究するために改変することができる。 Mx1には、インフルエンザウイルス感染23の間に、NPを含むウイルスタンパク質の発現を阻害する。したがって、その後に感染しているMx1にトランスフェクトした細胞におけるNP-Mx1の相互作用を研究することは技術的に極めて困難である。それでも、この共免疫沈降プロトコルは、NP-Mx1の相互作用の検出に成功した( 図4)を可能にする、細胞および感染細胞を発現Mx1の溶解物を合成した後に行うことができる。 NEMの重要な目標が知られていないように、NEM、両方の細胞集団の溶解中に添加した。所望であれば、液のpH溶解緩衝液を変更することができる。ここに記載した実験は、(トゥランら 10のように)、pH8で行われるが、NP-Mx1の共免疫沈降はまた、正常にpH7.2の溶解緩衝液を用いて行った。このpH NEMが遊離チオール基を排他的に反応し、このpHはまた、Mx1のタンパク質の抽出収量を増加させるために、実際には7.2のpHが好ましい。また、プロテインGビーズを使用した抗体が由来する宿主種に依存して、プロテインAビーズで置き換えることができる。しかし、クリーナーの結果は、タンパク質Gビーズを用いて得られる。最後に、このプロトコルは、PB2 14、例えば 、Mx1の及び他のインフルエンザタンパク質との相互作用を研究するために使用することができる。この場合、V5エピトープは、原理的には、市販の抗V5アガロース親和性ゲルと混合することができた、PB2が使用されたタグ付き。
将来の実験では、このプロトコルはMx1の内の領域を同定することが有益である可能性があり、NP-Mx1の相互作用のために重要であるNP。このループのMxAとThogotoウイルスNP 8,9間の相互作用に重要であることが示されているように、Mx1の一つのそのような領域は、ループL4であってもよい。適切なNP特異的抗体が利用可能になった場合は、このプロトコルは、Mx1にのために鳥インフルエンザA株の感受性の増加は、Mxの感度のメカニズムを理解するのに役立つ可能性が強いNP-Mx1の相互作用か、と相関するかどうかを判断できるようになります。また、Mx1の及びオルソミクソウイルス科以外の科に属するウイルスの構成要素間の相互作用は、このように適合共免疫沈降プロトコルによって対処することができる。最後に、NP-Mx1の上NEMの影響を解明するためのさらなる研究が良い、この特異的な相互作用を理解することは非常に貴重であろうが、また、細胞溶解および免疫共沈降実験中のこの化合物の添加のより広い用途での洞察を得るために。
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
著者は、彼らが競合する経済的利益を持っていないことを宣言。
Acknowledgments
この作品はFWO-ブラーンデレン、IOFプロジェクトIOF10 / STARTT / 027とゲント大学特別研究助成BOF12 / GOA / 014によってサポートされていました。
Materials
| Name | Company | Catalog Number | Comments |
| DMEM high glucose | Gibco | 52100-047 | |
| N-Ethylmaleimide | Sigma | E-3876 | Toxic |
| Igepal CA-630 | Sigma | I-30212 | also known as NP40 |
| Protease inhibitor cocktail | Roche | 11 873 580 001 | |
| anti-NP monoclonal antibody | NIH Biodefense and Emerging Infections Research Resources Repository | NR-4282 | ascites blend of clones A1 and A3 |
| anti-RNP polyclonal serum | NIH Biodefense and Emerging Infections Research Resources Repository | NR-3133 | directed against A/Scotland/840/74 (H3N2) |
| Protein G Sepharose 4FF | GE Healthcare | 17-0618-01 | |
| Hyperfilm ECL 18 x 24 cm | GE Healthcare | 28-9068-36 | |
| ECL western blotting substrate | Pierce | 32106 |
References
- Verhelst, J., Hulpiau, P., Saelens, X. Mx proteins: antiviral gatekeepers that restrain the uninvited. Microbiol Mol Biol Rev. 77 (4), 551-566 (2013).
- Goujon, C., et al. Human MX2 is an interferon-induced post-entry inhibitor of HIV-1 infection. Nature. 502 (7472), 559-562 (2013).
- Kane, M., et al. MX2 is an interferon-induced inhibitor of HIV-1 infection. Nature. 502 (7472), 563-566 (2013).
- Liu, Z., et al. The interferon-inducible MxB protein inhibits HIV-1 infection. Cell Host Microbe. 14 (4), 398-410 (2013).
- Kochs, G., Haller, O. Interferon-induced human MxA GTPase blocks nuclear import of Thogoto virus nucleocapsids. Proc Natl Acad Sci U S A. 96 (5), 2082-2086 (1999).
- Flohr, F., Schneider-Schaulies, S., Haller, O., Kochs, G. The central interactive region of human MxA GTPase is involved in GTPase activation and interaction with viral target structures. FEBS Lett. 463 (1-2), 24-28 (1999).
- Kochs, G., Haller, O. GTP-bound human MxA protein interacts with the nucleocapsids of Thogoto virus (Orthomyxoviridae). J Biol Chem. 274 (7), 4370-4376 (1999).
- Mitchell, P. S., et al. Evolution-guided identification of antiviral specificity determinants in the broadly acting interferon-induced innate immunity factor MxA. Cell Host Microbe. 12 (4), 598-604 (2012).
- Patzina, C., Haller, O., Kochs, G. Structural requirements for the antiviral activity of the human MxA protein against Thogoto and influenza A virus. J Biol Chem. 289 (9), 6020-6027 (2014).
- Turan, K., et al. Nuclear MxA proteins form a complex with influenza virus NP and inhibit the transcription of the engineered influenza virus genome. Nucleic Acids Res. 32 (2), 643-652 (2004).
- Dittmann, J., et al. Influenza A virus strains differ in sensitivity to the antiviral action of Mx-GTPase. J Virol. 82 (7), 3624-3631 (2008).
- Zimmermann, P., Manz, B., Haller, O., Schwemmle, M., Kochs, G. The viral nucleoprotein determines Mx sensitivity of influenza A viruses. J Virol. 85 (16), 8133-8140 (2011).
- Manz, B., et al. Pandemic influenza A viruses escape from restriction by human MxA through adaptive mutations in the nucleoprotein. PLoS Pathog. 9 (3), e1003279 (2013).
- Verhelst, J., Parthoens, E., Schepens, B., Fiers, W., Saelens, X. Interferon-inducible protein Mx1 inhibits influenza virus by interfering with functional viral ribonucleoprotein complex assembly. J Virol. 86 (24), 13445-13455 (2012).
- Brewer, C. F., Riehm, J. P. Evidence for possible nonspecific reactions between N-ethylmaleimide and proteins. Anal Biochem. 18 (2), 248-255 (1967).
- Wu, C. Y., Jeng, K. S., Lai, M. M. The SUMOylation of matrix protein M1 modulates the assembly and morphogenesis of influenza A virus. J Virol. 85 (13), 6618-6628 (2011).
- Chen, Z., Zhou, J., Zhang, Y., Bepler, G. Modulation of the ribonucleotide reductase M1-gemcitabine interaction in vivo by N-ethylmaleimide. Biochem Biophys Res Commun. 413 (2), 383-388 (2011).
- Rennie, M. L., McKelvie, S. A., Bulloch, E. M., Kingston, R. L. Transient dimerization of human MxA promotes GTP hydrolysis, resulting in a mechanical power stroke. Structure. 22 (10), 1433-1445 (2014).
- Gifford, J. L., Walsh, M. P., Vogel, H. J. Structures and metal-ion-binding properties of the Ca2+-binding helix-loop-helix EF-hand motifs. Biochem J. 405 (2), 199-221 (2007).
- Separating Protein with SDS-PAGE. , JoVE. Available from: http://www.jove.com/science-education/5058/separating-protein-with-sds-page (2014).
- Gallagher, S., Chakavarti, D. Immunoblot analysis. J Vis Exp. (16), (2008).
- Eslami, A., Lujan, J. Western blotting: sample preparation to detection. J Vis Exp. (44), (2010).
- Pavlovic, J., Haller, O., Staeheli, P. Human and mouse Mx proteins inhibit different steps of the influenza virus multiplication cycle. J Virol. 66 (4), 2564-2569 (1992).



