Introduction
Myxovirus motstånd (Mx) proteiner är en viktig del av det medfödda immunförsvaret mot virala patogener. Dessa proteiner är stora dynamin liknande GTPaser som induceras av typ I och typ III-interferoner. Motsvarande Mx gener är närvarande i nästan alla ryggradsdjur i en eller flera kopior och deras genprodukter inhiberar ett brett spektrum av virus, inklusive Orthomyxoviridae (t.ex.., Influensavirus), Rhabdoviridae (t ex., Vesikulärt stomatitvirus), Bunyaviridae (t.ex.. , LaCrosse virus) och Retroviridae (t.ex. humant immunbristvirus-1) 1-4. Det är oklart hur dessa proteiner erkänna ett sådant brett spektrum av virus, utan någon uppenbar delad primär sekvensmotiv i dessa virus. Analysera samspelet i Mx-proteiner med sina virus mål, potentiellt involverar högre ordningens komplex med andra värdcellsfaktorer, kommer att bidra till att förstå de molekylära mekanismerna thatt har utvecklats i kapprustningen mellan virus och deras värdar.
Samspelet mellan däggdjur Mx proteiner och virala mål har studerats mest omfattande för mänsklig MxA. Human MxA kan hämma replikation av många virus, inklusive ortomyxovirus influensa A och Thogoto virus. MxA binder Thogoto virus ribonukleoprotein komplex (vRNPs), på så sätt förhindra deras kärnvapen posten, vilket resulterar i blocket för infektion 5. Denna interaktion mellan MXA och Thogoto virus vRNPs har visats med co-sedimente och co-Immunutfällningsexperiment 6-9. Hur Mx proteiner hindrar influensa A-virus är mindre tydlig. Ett stort problem är att det inte är enkelt att visa en interaktion mellan en Mx-protein och en gen influensaprodukt. En rapport visade en interaktion mellan människa MxA och NP proteinet i influensa A-virus infekterade celler 10. Denna interaktion kan endast visas med co-immunoprecipitation om cellerna hade behandlats med tvärbindningsreagenset ditiobis (succinimidylpropionat) innan lys, vilket tyder på att interaktionen är övergående och / eller svag. Nyare studier har visat att skillnaden Mx känslighet olika influensa A-stammar bestäms av ursprunget till NP-proteinet 11,12. I linje med detta, kan influensa A-virus delvis fly från Mx-kontroll genom att mutera specifika rester i NP-proteinet 13. Detta tyder på att det främsta målet för influensa A-virus för värd Mx är NP-proteinet, troligen NP monteras i vRNP komplex. Men ingen av dessa nyare studier visat en interaktion mellan influensa NP eller vRNPs och antingen human MxA eller mus Mx1.
Nyligen visade vi, för första gången, en interaktion mellan influensa NP och musen Mx1 proteinet med en optimerad sam-immunoutfällning protokoll 14, vilket beskrivs i detalj här. I allmänhet, co-immunoprecipitation är en av de mest använda biokemiska metoder för att undersöka protein-proteininteraktioner. Denna teknik är ofta föredraget jämfört med alternativa tekniker, t.ex., jäst två-hybrid, eftersom det gör det möjligt att undersöka protein-protein-interaktioner i deras naturliga miljö. Co-immunoutfällning kan utföras på endogent uttryckta proteiner om antikroppar mot proteinerna av intresse föreligger. Alternativt kan proteinerna av intresse uttryckas i cellen genom transfektion eller infektion och en affinitetsmarkör kan användas. Förutom de ovan nämnda fördelarna, gör den beskrivna sam-immunoutfällning protokoll detektion av svaga och / eller transienta proteininteraktioner. Huvudkomponenten i denna optimerade protokoll är tillsatsen av N-etylmaleimid (NEM) i cellen lysbuffert. NEM är ett alkyleringsreagens som reagerar med fria tiolgrupper såsom närvarande i cysteiner, vid ett pH av 6,5 till 7,5, för att bilda en stabil tio-estern(Figur 1). Vid högre pH, kan NEM också reagera med aminogrupper eller genomgå hydrolys 15. NEM används typiskt för att blockera fria tiolgrupper, i syfte att förhindra bildning av disulfidbindning eller inhiberar enzymatisk aktivitet. Till exempel är NEM ofta används för att blockera desumoylating enzymer, vilka är cysteinproteaser. I den beskrivna co-immunoutfällning protokoll, blev NEM initialt ingår i lysbufferten eftersom det hade rapporterats att sumoylation av influensaproteiner kan påverka interaktionen mellan virala proteiner 16. Oväntat, tillägg av NEM visade sig vara nyckeln till att dokumentera samspelet mellan influensa NP och mus Mx1 genom co-immunoprecipitation. Det är oklart varför tillsatsen av NEM är avgörande för att detektera NP-Mx1 interaktion. Möjligen interaktionen är för övergående och / eller svag. NEM kunde stabilisera interaktion, t.ex. genom att bevara en viss konforma Mx1, ett virusprotein eller ens en okänd tredje komponent. En sådan stabiliserande effekt NEM har observerats tidigare, till exempel, för interaktionen mellan ribonukleotidreduktas M1 och dess hämmare gemcitabin (F2dC) 17. MX1 och NP båda innehåller flera cysteinrester som kan modifieras av NEM. Till exempel, en färsk undersökning från Rennie et al. Visade att en stalkless MxA-varianten innehåller tre lösningsmedels exponerade cysteinrester som kan modifieras genom jodoacetamid. Mutera dessa rester till seriner påverkade inte den enzymatiska aktiviteten hos MxA, men förhindrade disulfid-medierad aggregering 18. Eftersom dessa cysteiner bevaras i Mx1, tyder detta på att de analoga cysteiner i Mx1 kan modifieras genom NEM och som sådan påverkan dess konforma eller löslighet. Dessutom kan NEM också påverka GTPas aktivitet Mx1, vilket är väsentligt för aktiviteten hos Mx1 anti-influensa, och därigenom stabilisera interaktionen mellan Mx1 och NP. Men en direkt effekt av NEM på GTPas ACTIvitet i Mx1 är osannolikt, eftersom NEM krävs också för att detektera interaktionen mellan influensa NP och GTPase inaktiva mutanter av Mx1 proteinet 14. Klart, det behövs mer forskning för att reda ut effekten av NEM på NP-Mx1 interaktion.
Sammanfattningsvis medger det beskrivna sam-immunoutfällning protokoll för att studera interaktionen mellan den antivirala Mx1 proteinet och dess virala mål, influensa NP-proteinet. Detta protokoll kan också användas för att studera andra svaga eller transienta interaktioner som beror på stabilisering av specifika proteinkonformationer. Protein-protein-interaktion som är beroende av specifika konformationer har beskrivits tidigare, t ex för kalciumbindande proteiner såsom kalmodulin 19. Slutligen kan den gynnsamma roll NEM även användas i andra metoder som detekterar protein-proteininteraktioner, såsom sam-sedimente analyser.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Obs: Följande transfektion och co-immunoprecipitation protokoll upprättas för en 9 cm petriskål format. Andra format är också möjligt efter skalning protokollet.
1. Sådd av humana embryonala njur (HEK) 293T celler
- Seed den HEK293T celler en dag före transfektion vid 1,2 x 10 6 celler per 9 cm Petri-skål i 12 ml av Dulbeccos modifierade Eagles medium (DMEM) kompletterat med 10% fetalt kalvserum, 2 mM L-glutamin, 0,4 mM Na-pyruvat, 0,1 mM icke-essentiella aminosyror, 100 U / ml penicillin och 0,1 mg / ml streptomycin.
- Odla cellerna 16 h vid 37 ° C och 5% CO2.
- Inspektera morfologi och viabilitet av cellerna med ett inverterat ljusmikroskop före transfektion. Cellerna måste vara subkonfluent för optimal transfektionseffektivitet.
2. Kalciumfosfat Transfektion av HEK293T celler
Notera: Användning 0,5-1 pg av pCAXL-NP eller tom pCAXL plasmiden i kombination med 1-3 pg av pCAXL-Mx1 per 9 cm skål. Använd en lika stor mängd av total plasmid-DNA i alla prover; justera med tom plasmid vid behov.
- Förbered följande transfektion buffertar:
- Förbered Tris-EDTA (TE) med koncentrationer av 1,0 mM Tris-HCl pH 8,0 och 0,1 mM EDTA pH 8,0.
- Förbered BS / HEPES med koncentrationer av 25 mM HEPES (5,96 g / L, 4- (2-hydroxietyl) -1-piperazinetansulfonsyra), 274 mM NaCl (16 g / L), 10 mM KCl (0,74 g / L), 1,5 mM NaHPO 4 · 12H 2 O (0,5 g / L) och 11,1 mM dextros (2 g / L). Justera pH till 7,05.
- Förbered CaCl2 / HEPES med koncentrationer av 1,25 M CaCl 2 • 2 H2O (183,8 g / L) och 125 mM HEPES (29,79 g / L). Justera pH till 7,05 med NaOH.
- Värm transfektionen buffertar vid 37 ° C före användning.
- Förbered plasmiden prover genom spädning av plasmid-DNA i 600 pl TE.Bered dessa blandningar i brunnar i en 6-brunnsplatta.
- Lägg 150 pl av CaCl2 / HEPES i ett droppvis sätt till plasmiden proverna och blanda genom att pipettera tre gånger upp och ner.
- Förbered transfektion lösningen genom droppvis tillsats av plasmiden lösning (TE + DNA + CaCl2 / HEPES; 750 ul) till 750 pl av BS / HEPES-buffert som tillhandahålls i en färsk 6-brunnar. Fördela plasmiden lösningen jämnt över hela brunnen innehållande BS / HEPES buffert.
- Skaka transfektion lösningen på en plattskakanordning under 90 s vid 1000 rpm.
- Inkubera blandningen i 5 min vid rumstemperatur.
- Lägg transfektionslösningen (1,5 ml) droppvis till cellerna. Använd en P1000 mikropipett droppa transfektionslösningen på cellerna. Skingra blandningen över hela 9 cm petriskål och skaka plattan mycket försiktigt.
- Inkubera cellerna vid 37 ° C och 5% CO2 under 6 timmar. Ta sedan bort mediet genom aspiration och omedelbart ersätta with 12 ml färsk, förvärmda medium. Försiktigt tillsätt färskt medium till cellerna för att förhindra cell lossnar. För detta, håll spetsen på pipett mot sidan av brunnen och försiktigt trycka ut mediet.
- Inkubera cellerna under en ytterligare 16 h vid 37 ° C och 5% CO2.
3. Co-immunoprecipitation
OBS: Utför co-immunoprecipitation 24 timmar efter transfektion.
- Beredning av låga salt lysbuffert och hög salttvättbuffert.
- Bered en förrådslösning av 2 M N-etylmaleimid (NEM) genom att väga den mängd NEM och upplösning i absolut etanol. Förbered NEM stamlösning fräsch före användning.
VARNING: NEM är mycket giftigt, förbereda och använda denna stamlösning i ett dragskåp. - Förbered låg salt lysbuffert vid koncentrationer av 50 mM Tris-HCl pH 8, 150 mM NaCl, 5 mM etylendiamintetraättiksyra (EDTA), 1% NP40 och en proteasinhibitorcocktail (upplösa en tabellt i 50 ml lysbuffert). Lägg NEM till en slutlig koncentration av 25 mM (dvs, späd 1:80). Håll på is efter att ha lagt de proteashämmare och NEM.
Obs: Lägg alltid de proteashämmare och NEM nytt före varje användning. - Förbered en hög salttvättbuffert vid koncentrationer av 50 mM Tris-HCl pH 8, 500 mM NaCl, 5 mM EDTA och 1% NP40. Notera att den höga salttvättbuffert innehåller inte NEM.
- Bered en förrådslösning av 2 M N-etylmaleimid (NEM) genom att väga den mängd NEM och upplösning i absolut etanol. Förbered NEM stamlösning fräsch före användning.
- Beredning av cellysat.
- Avlägsna mediet och tvätta cellerna med 2 ml iskall fosfatbuffrad saltlösning (PBS). Mycket försiktigt lägga tvättbufferten, som HEK293T celler lossnar lätt.
- Ta bort PBS och tillsätt 600 pl iskall låg salthalt lysbuffert per 9 cm petriskål.
- Inkubera plattorna under 20 min på is. Kontrollera att plattorna hålls horisontell, för att säkerställa fullständig täckning av plåtytan med lysbuffert. Skaka försiktigt plattorna var 5 min.
- Samla cellysatet i en 1,5 ml mikrocentrifugrör och centrifugera under 3 min vid 4 ° C och 16.000 xg för att pelletera den olösliga fraktionen.
- Överför den lösliga fraktionen, dvs. cellysatet till ett färskt 1,5 ml mikrocentrifugrör och förvara på is. Fortsätt genast med co-immunoprecipitation protokoll, för att förhindra dissociation av interagerande proteiner. Utför alla följande steg så mycket som möjligt på is eller vid 4 ° C för att begränsa proteolytiska aktiviteten i lysa.
- Generering av immunkomplex.
Anmärkning: I detta steg, är proteinet av intresse bunden av den lämpliga antikroppen. För att studera NP-Mx1 interaktion, använda en mus anti-NP monoklonal antikropp.- För varje prov, blanda 135 pl av lysat med 2 | il av anti-NP-monoklonal antikropp och 113 ul av låg salt lysbuffert (total volym av 250 | il). Förvara återstående lysatet vid -20 ° C för vidare analys, såsom Western blotting, för att dokumentera expressionsnivåerna av den förmodat interaction partner i transfekterade celler.
Obs: Du kan också mäta proteinkoncentration av lysatet (t.ex. med Bradford-reagens) och använder ett fast belopp på totalt protein, t.ex., 400 mikrogram för varje lysat. - Inkubera antikropp-lysat mix för 3 tim på en vändhjul vid 4 ° C. Detta steg kan utvidgas till en inkubering över natten.
- För varje prov, blanda 135 pl av lysat med 2 | il av anti-NP-monoklonal antikropp och 113 ul av låg salt lysbuffert (total volym av 250 | il). Förvara återstående lysatet vid -20 ° C för vidare analys, såsom Western blotting, för att dokumentera expressionsnivåerna av den förmodat interaction partner i transfekterade celler.
- Framställning av protein-G-pärlor.
Obs: protein G-pärlor eller skeppas och lagras i 20% etanol för konservering. Vulsten-uppslamningen består normalt av 50% kulor och dessa kulor behöver tvättas innan de används för att immunoprecipitera de immunkomplex.- Använd 50 pl pärlor, dvs 100 pl pärla-slam, för varje prov. Tvätta mängden pärlor som krävs för alla proverna i sam-immunoutfällning analys i ett rör. Skär spetsen på en 1 ml pipettspets att lindra pipettering av vulsten-uppslamningen.
- Centrifugera Protein G vulst-uppslamningen vid 8000 xg och 4 ° C under 30 sek. Avlägsna etanollösningen och tillsätt en lika volym av låg salt lysbuffert. Centrifugera protein G pärl-uppslamningen vid 8000 xg och 4 ° C under 30 sek och avlägsna supernatanten försiktigt. Upprepa detta tvättsteg 3 gånger.
Obs: Den låga salt lysbuffert används för att tvätta pärlorna inte behöver innehålla proteasinhibitorer eller NEM. - Uppskatta volymen av protein G pärlor och tillsätt en lika volym av låg salt lysbuffert för att göra en ny 50% pärla-slurry i låg salt lysbuffert.
- För varje prov, överför 100 pl av vulst-uppslamning i en färsk 1,5 ml mikrocentrifugrör och förvara på is fram till användning. Var försiktig för att återsuspendera pärlan-uppslamningen innan dividera, eftersom dessa kulor sedimenterar snabbt till botten av röret.
- Immunoutfällning av immunkomplex av protein G pärlor och deras eluering.
- Innan du använder de protein G pärlor för immunoutfällning, centrifug alla rör 30 sek vid 8000 xg och 4 ° C ochverifiera genom visuell inspektion att det finns en lika stor mängd av pärlor i alla prover. Vid behov justera mängden pärlor i några av proverna och centrifugera igen. Kasta supernatanterna. Var noga med att inte störa de pelleterade protein G pärlor.
- Centrifugera kort de immunkomplex (dvs., Lysat med antikropp, 250 | il) till under 30 s vid 8000 xg och 4 ° C samla den kompletta provet vid botten av röret. Överför de immunkomplex till protein G-pärlor (50 pl).
- Inkubera 60 min på en vändhjul vid 4 ° C. Inte inkubera dessa immunkomplex längre än 75 min med pärlorna till att minska ospecifik bindning av proteiner till protein-G-pärlor.
- Centrifugera protein G-pärlor (med bundna immunkomplex) för 30 sek vid 8000 xg och 4 ° C och avlägsna supernatanterna. Var noga med att inte störa de pelleterade protein G pärlor. Tillval: lagra detta supernatanter vid 4 ° C eller -20 ° C för senare analys,t.ex. att uppskatta mängden obundet protein.
- Tvätta Protein G pärlorna under ca 5 min med 900 pl av hög salt lysbuffert. Se till att pärlorna är helt återsuspenderas i tvättbufferten för optimal tvättning. Centrifugera protein G pärlor för 30 sekunder vid 8000 xg och 4 ° C och kasta supernatanterna. Upprepa detta tvättsteg 4 gånger. Var noga med att inte störa de pelleterade protein G pärlor att undvika förlust av immunoutfällt material.
- Efter det sista tvättsteget, tillsätt 50 pl av 2x Laemmli-provbuffert till pärlorna och upphetta suspensionen under 10 min vid 95 ° C för att eluera (sam) immunprecipiterade proteiner.
- Bered 10 ml av 6x Laemmli-buffert med 1 g natriumdodecylsulfat, 3,5 ml glycerol, 3,5 ml 1 M Tris-HCl, pH 6,8 och 420 ul av β-merkaptoetanol. Justera till en total volym av 10 ml genom tillsats av destillerat vatten. Späd tre gånger i destillerat vatten för att erhålla 2x Laemmli-buffert.
VARNING: &# 946; merkaptoetanol är giftigt, förbereda och använda Laemmli buffert i ett dragskåp.
- Bered 10 ml av 6x Laemmli-buffert med 1 g natriumdodecylsulfat, 3,5 ml glycerol, 3,5 ml 1 M Tris-HCl, pH 6,8 och 420 ul av β-merkaptoetanol. Justera till en total volym av 10 ml genom tillsats av destillerat vatten. Späd tre gånger i destillerat vatten för att erhålla 2x Laemmli-buffert.
- Efter uppvärmning, centrifugera protein G pärlor för 30 sekunder vid 8000 xg och förvara proverna vid 4 ° C (kort sikt) eller -20 ° C (lång sikt).
4. Analysera (sam) immunprecipiterades Proteiner
- Visualisera de proteiner som är närvarande i cellysatet och eluat av sam-immunprecipitation genom SDS-PAGE 20 och Western blotting 21,22. Typiskt ladda hälften av Laemmli eluatet på gel. Var noga med att inte störa de pelleterade protein G pärlor när man tar prover för gel lastning. Mx1 och NP expression avslöjades med en anti-Mx1 och anti-NP-antikropp, respektive 14. De band detekterades med HRP-baserade kemiluminescens och en röntgenfilm utvecklare.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
N-etylmaleimid är en organisk förening som kan användas för att irreversibelt modifiera fria tiolgrupper, t.ex. för att inhibera cysteinproteaser (figur 1).
Den antivirala Mx1 proteinet inhiberar influensa A-virus-replikation genom att interagera med det virala nukleoproteinet. Den optimerade co-immunoprecipitation protokoll som beskrivs här gör det möjligt att studera denna NP-Mx1 interaktion. HEK293T-celler transfekterades med expressionsvektorer för den antivirala Mx1 proteinet i frånvaro eller närvaro av influensa NP-proteinet. Nästa, NP-proteinet var drog ner från total cellysat med ett NP-specifik monoklonal antikropp. Figur 2 visar att Mx1 proteinet är bara samar immunprecipiterade i närvaro av samuttryckt NP. Möjlig ospecifik co-immunoprecipitation av Mx1 i frånvaro av NP orsakas av antingen ospecifik rullgardins av Mx1 proteinet av anti-NP antikropp eller genom ospecifik bindning av Mx1 tillProtein G pärlor. Därför alltid inkludera en negativ kontroll för att bedöma denna ospecifika co-immunoprecipitation. Figur 3 visar att NP-Mx1 interaktion endast kan upptäckas i närvaro av NEM. I detta experiment var ospecifik bindning av Mx1 till protein G pärlor utvärderas med en styr sam-immunoutfällning reaktionen i frånvaro av anti-NP-antikropp.
Detta protokoll kan också användas för att studera interaktionen mellan Mx1 och influensa NP protein isolerat från infekterade celler eller från virioner. För denna tillämpning, var ovanstående protokoll anpassats något genom att kombinera lysat av Mx1 uttryckande celler med lysat innehåller det virala NP-proteinet innan co-immunoprecipitation protokoll. Figur 4 visar co-immunoprecipitation av Mx1 med NP isolerat från transfekterade celler, infekterade celler eller virioner.
Sammanfattningsvis visar dessa resultat att denna sam-immunoutfällning protocol kan användas för att studera interaktionen mellan ett antiviralt protein och dess virala mål.
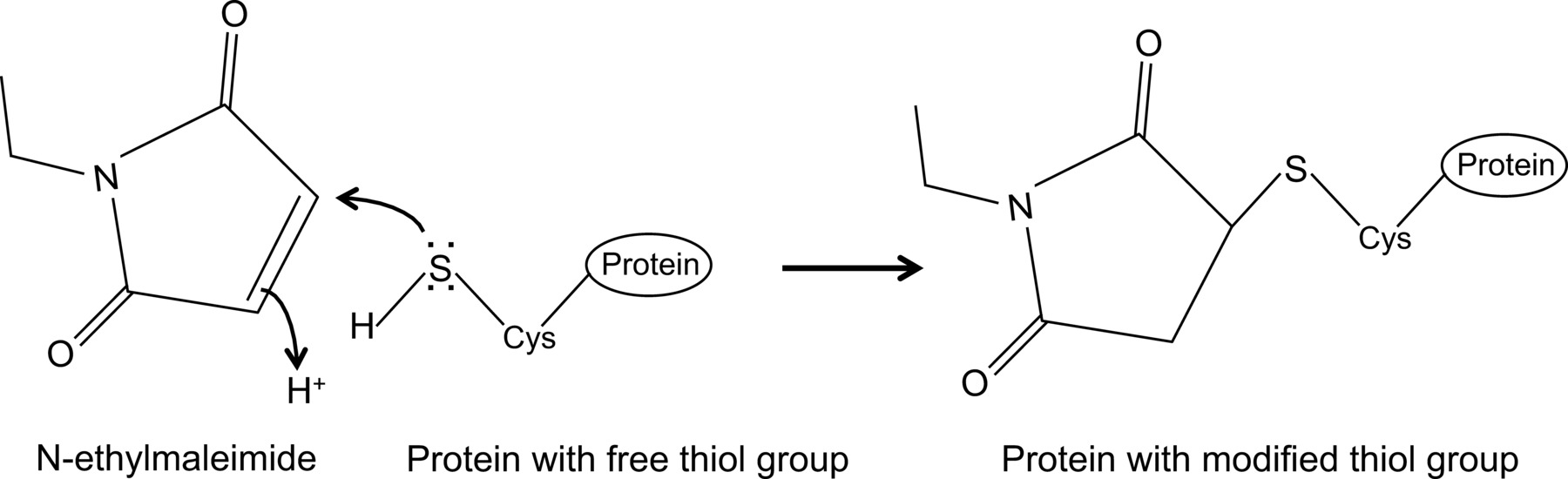
Figur 1:. Irreversible modifiering av fria tiolgrupper genom N-etylmaleimid Klicka här för att se en större version av denna siffra.

Figur 2:. Mx1 interagerar med NP Western blot-analys av en co-immunoprecipitation experiment med två prov: en där både Mx1 och NP är närvarande och en styr inställning där NP-proteinet är frånvarande. NP immunoutfälldes med anti-NP och NP och Mx1 visualiserades genom western blotting. Denna siffra har ändrats from 14.

Figur 3: N-etylmaleimid är viktigt att detektera NP - Mx1 interaktion Western blot-analys av en co-immunoprecipitation experiment utfördes i närvaro eller frånvaro av N-etylmaleimid.. NP immunoutfälldes med anti-NP och Mx1 och NP visualiserades genom western blotting.

Figur 4:. Mx1 interagerar med NP isolerats från infekterade celler eller från virioner Lysat innehåller Mx1 kombinerades med lysat innehållande NP från olika källor: en kontroll lysat (ingen vRNPs), transfekterade vRNPs, vRNPs från infekterade celler eller vRNPs isolerade från influensa A virioner . Efter blandning lysaten, sam-immunopreutfällning med anti-NP utfördes och Mx1 och NP visualiserades genom western blotting.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Studera interaktionen mellan antivirala proteiner och deras virala mål är mycket viktigt att förstå detaljerna i den antivirala mekanismen av dessa proteiner. Detta kan ge nya insikter i hur virus och deras värdar samar utvecklats och ligga till grund för utvecklingen av nya antivirala strategier. Den optimerade sam-immunoutfällning Protokollet som beskrivs här gör det möjligt att studera interaktionen mellan musen Mx1 proteinet och dess virala mål, influensa NP-proteinet. Den viktigaste aspekten av detta protokoll är tillsatsen av NEM i lysbuffert, som NP-Mx1 interaktion är odetekterbart i frånvaro av NEM (Figur 3). Hittills är det inte känt varför närvaron av NEM är nödvändigt att detektera denna interaktion. Dock kan detta protokoll vara bra att studera andra svaga och / eller transienta interaktioner som är beroende av stabilisering av specifika proteinkonformationer, särskilt om cysteiner är involverade.
Enviktig begränsning av co-immunoprecipitation analyser i allmänhet är tillgången på specifika och högkvalitativa antikroppar som känner igen konformationsepitoper på en av de interaktionspartner med hög affinitet. NP-Mx1 interaktionen kunde inte påvisas med vårt i hus producerade anti Mx1 polyklonala antiserum. Detta antiserum immunoprecipitat också influensa NP-proteinet, även i avsaknad av Mx1. Dessutom, anti-NP-monoklonal antikropp som användes, erkänner NP-proteinet av A / Puerto Rico / 8/34 influensa stam, men tyvärr är det inte lämpligt att pull-down NP av aviära stammar av influensavirus. En annan begränsning hos denna sam-immunoutfällning-protokollet är den ospecifika bindningen av Mx1 till protein G-pärlor. Den senare bindning kan övervinnas genom att öka saltkoncentrationen i tvättbufferten och minska kontakttiden mellan lysatet och protein G-pärlor. Dessutom, vilket minskar mängden av pärlor som används för varje immunoutfällningreaktion från 50 pl till 25 pl, kan ytterligare minska ospecifik bindning av Mx1 till dessa pärlor. I allmänhet oavsiktlig neddragnings av kontaminerande proteiner, som orsakas av icke-specifik bindning till protein-G-pärlor, kan också minskas genom att andra strategier. Till exempel kan dessa proteiner avlägsnas under en förut tydligt steg, i vilka dessa proteiner avlägsnas genom att inkubera lysatet med protein G pärlor i frånvaro av antikropp. De förorenande proteiner avlägsnas sedan tillsammans med pärlorna och pre-rensas lysat används för samarbete immunoprecipitation. Denna strategi är endast fördelaktigt om de kontaminerande proteinerna skiljer sig från protein (er) under studie. Alternativt kan de ospecifika bindningsställen på protein G-pärlor kunde blockeras med BSA. Emellertid är denna strategi endast rekommenderas om pärlorna först beläggs med antikroppen, eftersom BSA kan också minska utfällning av immunkomplex (dvs reducerad antikroppsbindning genom de belagda-pärlor). Takentillsammans, är det mycket viktigt att inkludera lämpliga kontroller för att utesluta icke-specifik bindning av proteiner av intresse för protein G pärlor eller på de antikroppar som används.
Den beskrivna co-immunoutfällning protokoll kan modifieras för att studera interaktionen mellan Mx1 med NP protein som finns i en annan miljö, t.ex. i infekterade celler eller renade vRNPs. Mx1 inhiberar uttrycket av virala proteiner, inklusive NP, under influensavirusinfektion 23. Därför är det tekniskt mycket svårt att studera NP-Mx1 interaktion i Mx1 transfekterade celler som sedan smittade. Ändå kan även utföras här sam-immunoutfällning protokoll efter kombinering lysat av Mx1 uttryckande celler och infekterade celler, vilket möjliggör framgångsrik detektering av NP-Mx1 interaktion (figur 4). Eftersom den avgörande målet NEM inte är känd, till NEM tillsättes under lys av båda cellpopulationer. Om så önskas kan pH-värdet förlysbufferten kan ändras. De experiment som beskrivs här utförs vid pH 8 (som i Turan et al. 10), men NP-Mx1 sam-immunoutfällning var också framgångsrikt utförts med pH 7,2 lysbuffert. Faktiskt ett pH av 7,2 är föredraget, eftersom det vid detta pH NEM reagerar uteslutande med fria tiolgrupper och detta pH ökar också extraktionsutbytet av MX1 proteinet. Dessutom kunde de protein G pärlorna ersättas av protein A-pärlor, beroende på värdarten, från vilken de använda antikropparna är härledda. Emellertid är renare resultat erhölls med protein G-pärlor. Slutligen kan detta protokoll också användas för att studera interaktionen mellan Mx1 och andra proteiner influensa, t.ex. PB2 14. I detta fall en V5 epitopmärkt PB2 användes, vilket i princip skulle kunna kombineras med kommersiellt tillgängliga anti-V5 agaros affinitetsgel.
I framtida experiment, kan detta protokoll vara värdefullt att identifiera de regioner i Mx1 ochNP som är viktiga för NP-Mx1 interaktion. En sådan region i Mx1 kan vara sling L4, eftersom denna slinga har visats vara kritisk för interaktionen mellan MxA och Thogoto virus NP 8,9. Om lämpliga NP-specifika antikroppar blir tillgängliga, kommer detta protokoll också möjligt att avgöra om den ökade känsligheten för aviär influensa stammar A för Mx1 korrelerar med ett starkare NP-Mx1 interaktion eller inte, vilket kan bidra till att förstå mekanismen för Mx känslighet. Dessutom samspelet mellan Mx1 och komponenter av virus som tillhör andra än Orthomyxoviridae familjerna, kan också tas upp i detta anpassat co-immunoprecipitation protokoll. Slutligen, för att ytterligare studier nysta effekten av NEM om NP-Mx1 kommer att vara mycket värdefull för att bättre förstå denna specifika interaktion, men också för att få insikt i den bredare tillämpningar av tillägget av denna förening under cellys och co-immunoprecipitation experiment.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Författarna förklarar att de inte har några konkurrerande ekonomiska intressen.
Acknowledgments
Detta arbete stöddes av FWO-Vlaanderen, IOF-projektet IOF10 / StarTT / 027 och Gents universitet Special Research Grant BOF12 / GOA / 014.
Materials
| Name | Company | Catalog Number | Comments |
| DMEM high glucose | Gibco | 52100-047 | |
| N-Ethylmaleimide | Sigma | E-3876 | Toxic |
| Igepal CA-630 | Sigma | I-30212 | also known as NP40 |
| Protease inhibitor cocktail | Roche | 11 873 580 001 | |
| anti-NP monoclonal antibody | NIH Biodefense and Emerging Infections Research Resources Repository | NR-4282 | ascites blend of clones A1 and A3 |
| anti-RNP polyclonal serum | NIH Biodefense and Emerging Infections Research Resources Repository | NR-3133 | directed against A/Scotland/840/74 (H3N2) |
| Protein G Sepharose 4FF | GE Healthcare | 17-0618-01 | |
| Hyperfilm ECL 18 x 24 cm | GE Healthcare | 28-9068-36 | |
| ECL western blotting substrate | Pierce | 32106 |
References
- Verhelst, J., Hulpiau, P., Saelens, X. Mx proteins: antiviral gatekeepers that restrain the uninvited. Microbiol Mol Biol Rev. 77 (4), 551-566 (2013).
- Goujon, C., et al. Human MX2 is an interferon-induced post-entry inhibitor of HIV-1 infection. Nature. 502 (7472), 559-562 (2013).
- Kane, M., et al. MX2 is an interferon-induced inhibitor of HIV-1 infection. Nature. 502 (7472), 563-566 (2013).
- Liu, Z., et al. The interferon-inducible MxB protein inhibits HIV-1 infection. Cell Host Microbe. 14 (4), 398-410 (2013).
- Kochs, G., Haller, O. Interferon-induced human MxA GTPase blocks nuclear import of Thogoto virus nucleocapsids. Proc Natl Acad Sci U S A. 96 (5), 2082-2086 (1999).
- Flohr, F., Schneider-Schaulies, S., Haller, O., Kochs, G. The central interactive region of human MxA GTPase is involved in GTPase activation and interaction with viral target structures. FEBS Lett. 463 (1-2), 24-28 (1999).
- Kochs, G., Haller, O. GTP-bound human MxA protein interacts with the nucleocapsids of Thogoto virus (Orthomyxoviridae). J Biol Chem. 274 (7), 4370-4376 (1999).
- Mitchell, P. S., et al. Evolution-guided identification of antiviral specificity determinants in the broadly acting interferon-induced innate immunity factor MxA. Cell Host Microbe. 12 (4), 598-604 (2012).
- Patzina, C., Haller, O., Kochs, G. Structural requirements for the antiviral activity of the human MxA protein against Thogoto and influenza A virus. J Biol Chem. 289 (9), 6020-6027 (2014).
- Turan, K., et al. Nuclear MxA proteins form a complex with influenza virus NP and inhibit the transcription of the engineered influenza virus genome. Nucleic Acids Res. 32 (2), 643-652 (2004).
- Dittmann, J., et al. Influenza A virus strains differ in sensitivity to the antiviral action of Mx-GTPase. J Virol. 82 (7), 3624-3631 (2008).
- Zimmermann, P., Manz, B., Haller, O., Schwemmle, M., Kochs, G. The viral nucleoprotein determines Mx sensitivity of influenza A viruses. J Virol. 85 (16), 8133-8140 (2011).
- Manz, B., et al. Pandemic influenza A viruses escape from restriction by human MxA through adaptive mutations in the nucleoprotein. PLoS Pathog. 9 (3), e1003279 (2013).
- Verhelst, J., Parthoens, E., Schepens, B., Fiers, W., Saelens, X. Interferon-inducible protein Mx1 inhibits influenza virus by interfering with functional viral ribonucleoprotein complex assembly. J Virol. 86 (24), 13445-13455 (2012).
- Brewer, C. F., Riehm, J. P. Evidence for possible nonspecific reactions between N-ethylmaleimide and proteins. Anal Biochem. 18 (2), 248-255 (1967).
- Wu, C. Y., Jeng, K. S., Lai, M. M. The SUMOylation of matrix protein M1 modulates the assembly and morphogenesis of influenza A virus. J Virol. 85 (13), 6618-6628 (2011).
- Chen, Z., Zhou, J., Zhang, Y., Bepler, G. Modulation of the ribonucleotide reductase M1-gemcitabine interaction in vivo by N-ethylmaleimide. Biochem Biophys Res Commun. 413 (2), 383-388 (2011).
- Rennie, M. L., McKelvie, S. A., Bulloch, E. M., Kingston, R. L. Transient dimerization of human MxA promotes GTP hydrolysis, resulting in a mechanical power stroke. Structure. 22 (10), 1433-1445 (2014).
- Gifford, J. L., Walsh, M. P., Vogel, H. J. Structures and metal-ion-binding properties of the Ca2+-binding helix-loop-helix EF-hand motifs. Biochem J. 405 (2), 199-221 (2007).
- Separating Protein with SDS-PAGE. , JoVE. Available from: http://www.jove.com/science-education/5058/separating-protein-with-sds-page (2014).
- Gallagher, S., Chakavarti, D. Immunoblot analysis. J Vis Exp. (16), (2008).
- Eslami, A., Lujan, J. Western blotting: sample preparation to detection. J Vis Exp. (44), (2010).
- Pavlovic, J., Haller, O., Staeheli, P. Human and mouse Mx proteins inhibit different steps of the influenza virus multiplication cycle. J Virol. 66 (4), 2564-2569 (1992).



