Abstract
Stigende efterspørgsel efter vedvarende brændstoffer har forskere undersøger mulighederne for alternative råmaterialer, såsom mikroalger. Iboende fordele omfatter høj potentielle udbytte, brug af ikke-agerjord og integration med affaldsstrømme. De næringsstoffer krav til en storstilet mikroalger produktionssystem vil kræve koblingen af dyrkningssystemer med industriaffald ressourcer, såsom kuldioxid fra røggassen og næringsstoffer fra spildevand. Uorganiske forurenende stoffer i dette affald kan potentielt føre til bioakkumulering i mikroalger biomasse negativ indflydelse produktiviteten og begrænse slutanvendelse. Denne undersøgelse fokuserer på den eksperimentelle evaluering af virkningen og skæbne 14 uorganiske forureninger (As, Cd, Co, Cr, Cu, Hg, Mn, Ni, Pb, Sb, Se, Sn, V og Zn) på Nannochloropsis salina vækst . Mikroalger blev dyrket i fotobioreaktorer belyst ved 984 pmol m -2 sek -1 og holdt ved pH 7 i en vækst media forurenet med uorganiske forureninger på niveauer forventet baseret på sammensætningen findes i kommercielle kul røggassystemer. Forurenende stoffer i biomassen og mediet ved slutningen af en 7 dages vækstperiode blev analytisk kvantificeret gennem kold damp atomabsorptionsspektrometri for Hg og gennem induktivt koblet plasma massespektrometri for As, Cd, Co, Cr, Cu, Mn, Ni, Pb, Sb, Se, Sn, V og Zn. Resultater viser N. Salina er en følsom stamme til multi-metal miljø med en statistisk fald i biomasse yieldwith indførelsen af disse forurenende stoffer. De teknikker der præsenteres her, er tilstrækkelige til at kvantificere algevækst og bestemme skæbnen for uorganiske forureninger.
Introduction
Sammenlignet med traditionelle terrestriske afgrøder har vist mikroalger for at opnå højere biomasse og lipid udbytter på grund af iboende højere sol virkningsgrader 1,2. Dyrkning af mikroalger ved høje produktivitet kræver levering af forskellige næringsstoffer, herunder en ekstern kulstofkilde. Det forventes, at store vækst faciliteter vil blive integreret med industrielle affaldsstrømme såsom industrielle røggas for at minimere produktionsomkostningerne og samtidig give udbedring af miljøskader. Industriaffald carbon er typisk i form af gasformig carbondioxid og kan indeholde forurenende stoffer, der har potentiale til at have negativ indflydelse mikroalger produktion. Specifikt vil røggas fra kul har en række forurenende stoffer, herunder men ikke begrænset til forbrændingsprodukter vand og kuldioxid, samt oxider af svovl og nitrogen, fint støv, organiske kontaminanter, såsom dioxiner og furaner, og uorganisk conforureninger såsom tungmetaller. Virkningen af de fleste af disse forurenende stoffer, herunder uorganiske med nogle af dem er kendt som tungmetaller på mikroalger produktivitet er ikke blevet undersøgt. Nogle af disse elementer kan være næringsstoffer i relevante koncentrationer, dog ved højere koncentrationer de kan producere celle dysfunktion og endda død 3.
Integrationen af mikroalger med industriel røggas har potentiale til direkte at indføre uorganiske forureninger i vækstmedier. Kulbaseret røggas har en række uorganiske elementer (f.eks, As, Cd, Co, Cr, Cu, Hg, Mn, Ni, Pb, Sb, Se, Sn, V og Zn) i forskellige koncentrationer hvoraf nogle, i lav koncentration, repræsenterer næringsstoffer for mikroalger vækst. Uorganiske forureninger har en høj affinitet til at binde til mikroalger og yderligere sorberes internt gennem næringsstoffer transportører. Nogle uorganiske forureninger (dvs., Co, Cu, Zn og Mn) er næringsstoffer, der indgår i enzymer involvererd i fotosyntese, respiration og andre funktioner 3,4. Men i overskydende metaller og metalloider kan være giftige. Andre elementer, såsom Pb, Cd, Sn, Sb, Se, som og Hg, er ikke kendt for at støtte celle funktion i enhver koncentration og repræsenterer ikke-næringsstoffer metaller, der negativt kan påvirke væksten kultur 3,5,6. Tilstedeværelsen af nogen af disse forurenende stoffer har potentialet til at producere negative effekter på mikroalger celle funktion. Endvidere samspillet af flere metaller med mikroalger komplicerer vækstdynamikken og har potentiale til at påvirke væksten.
Storstilede økonomi har været direkte forbundet med produktivitet dyrkning systemet 7-19. Endvidere medium recirkulation i mikroalger vækstsystem for enten åbne raceway damme (ORP) eller fotobioreaktorer (PBR) er kritisk, da det repræsenterer 99,9 og 99,4% af massen, henholdsvis 20. Tilstedeværelsen af uorganiske forureninger i medierne kunne i sidste ende begrænse microalgae produktivitet og genanvendelse af medier på grund af forurenende opbygge. Denne undersøgelse eksperimentelt bestemte virkningen af 14 uorganiske forureninger (As, Cd, Co, Cr, Cu, Hg, Mn, Ni, Pb, Sb, Se, Sn, V og Zn), ved koncentrationer, der forventes af integrationen af mikroalger dyrkningssystemer med kul afledt røggas, om produktivitet N. salina dyrkes i airlift PBRs. Kontaminanterne anvendt i denne undersøgelse har vist sig at ikke kun være til stede i kulbaseret røggas men kommunalt affald baseret røggas, biosolids-baserede røggas, kommunalt spildevand, produceret vand, nedsat grundvand og havvand 21-23. De anvendte koncentrationer i denne undersøgelse er baseret på, hvad der kunne forventes, hvis mikroalger vækst systemer blev integreret med et kulbaseret CO2 kilde med en optagelse effektivitet demonstreret i kommercielle PBR systemer 20. Detaljerede beregninger understøtter koncentrationerne af tungmetaller og uorganiske forureninger er præsenteret i Napanet al. 24 Analytiske teknikker blev anvendt til at forstå fordelingen af størstedelen af metallerne i biomassen, medier og miljø. De metoder, der præsenteres aktiveret vurderingen af produktiviteten potentiale mikroalger under uorganisk forurenende stress og kvantificering af deres ende skæbne.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. Vækst-system

Figur 1. mikroalger vækst system. (A) luft rotometer, (B) CO2 rotometer, (C) pH controller med magnetventil, (D) datalogger, (E) in-line luftfiltre, (F) luftfordeling header, (G) fluorescerende lys bank, (H) pH-målere, (I) kølesystem, (J) vandbad, (K) termoelement tråd, (L) luft lift fotobioreaktor, (M) varmer, (N) walk-in røg hætte, (O) lufte, (P) luft levering kapillarrør, (Q) luftfiltre, (R) prøveudtagning rør, (S) PBR silikone låg, og (T)pH godt i silikone låg. Klik her for at se en større version af dette tal.
- Byg følgende mikroalger eksperimentelle vækst (figur 1).
- Anskaf tolv lufttransportkapacitet PBRs bestående af glasrør reaktorer 4,5 cm i diameter og 80 cm i højden med en dyrkning kapacitet på 1,1 L med silikone låg. Erhverve forskårne glas kapillarrør (5 mm ydre diameter og 1 mm indre diameter) på 10 cm (3 pr PBR) og 85 cm (1 pr PBR) i længden.
- Frys silikone låg i en -80 ° C fryser. Smør et borehoved med glycerol og mens låg indefryses bore 3 huller at være vært for udluftning, prøveudtagning og gas levering kapillærrør og 1 hul med en diameter på 17 mm til at være vært for en pH-sonde.
- Indsæt de 3 kapillarrør på plads med den længste rør, der strækker 2 cm fra bunden af PBR. I det andet kapillarrør tilføje en silicium rør with et kapillarrør fæstnet til den anden ende strækker sig til en ønsket prøvetagningssted. Dæk hullet til pH-meter med en silicone prop størrelse 21D.
- Befugte luften ved at boble den gennem vand og levere den befugtede luft til luftfordelingen header. Passere gas gennem et 0,2 um filter og levere det til den alge suspensionen gennem den længste glasleveringssystem kapillarrør.
- Levere komprimeret CO2 i befugtet luft strøm for at opretholde en neutral pH på 7,0 ± 0,1 i kulturen suspensionen. Regulering af CO 2 levering med en automatiseret CO2 apotek systemet (pH controller), der åbner en magnetisk solenoide når algekulturen når pH 7,1 og lukker ved pH 6,9.
- Giver lys ved hjælp af 24 T5 lysstofrør, der resulterer i en gennemsnitlig belysning af 984 pmol m -2 sek -1 ligner toppe udendørs forhold.
- Fordybe de PBRs i et vandbad for at maintain en konstant temperatur på ca. 25 ° C. Styre temperaturen af systemet ved hjælp af en recirkulerende køler og en automatiseret varme recirkulerende vandbad enhed kontrol.
- Overvåge temperatur og pH i realtid og registrere med en datalogger.
- Sørg for, at alle komponenter i systemet mikroalger vækst velfungerende, især før høst mikroalger inokulum eller forberede uorganiske forureninger, da de ikke kan bevares.
2. Lab Ware Forberedelse
- Vask målekolber, PBRs, dunke og beholdere, med postevand og sæbe. Skyl med demineraliseret vand (DW).
- Acid skylle lab ware for at fjerne ethvert spor af uorganiske forureninger. Dette kan gøres ved en af to måder:
- Må ikke ånde dampe, kan koncentreret salpetersyre producere alvorlige brænding og giftige dampe, arbejde i et røg hoo: lab ware O / N i 10% spormetalkvalitet salpetersyre (ADVARSEL Soakd bruger nitrilhandsker, beskyttelsesbriller og kittel).
- Soak lab ware i 15 min i 50% spormetalkvalitet salpetersyre.
- Skyl lab ware med DW grundigt mindst 3 gange og sørg alle syre er fjernet. Det er afgørende, at PBRs skylles grundigt, især prøvetagningsrør og kapillarrørene. Undladelse af at gøre dette vil producere forsuring af mediet og mulig hæmning af vækst. PH i skyllevandet at efterprøve alle syre er blevet fjernet.
- Sterilisere PBRs, beholdere og kolber ved autoklavering dem ved 120 ° C og standard atmosfærisk tryk i mindst 30 min.
3. N. salina Medium Forberedelse
- Tilberedning af opløsning A: Delvist fylde en 1 L målekolbe med DW. Indsætte en magnetisk omrører og tilføje de kemikalier, der er vist i tabel 1 efter hinanden. Sikre, at hver bestanddel opløses før tilsætningen af den næste komponent. Fjern magneten og fyld the kolbe til 1 l volumen mærket.
| Komponent | Beløb for at tilføje (g) | Slutkoncentration (g / L) |
| H 3 BO 3 | 0.900 | 0.900 |
| Na 2 MoO 4 · 2H 2 O | 0,012 | 0,012 |
| MnCl2 · 4H 2 O | 0.300 | 0.300 |
| ZnSO4 · 7H 2 O | 0.060 | 0.060 |
| CuSO4 · 5H 2 O | 0,020 | 0,020 |
Tabel 1:. Løsning En opskrift Mængder er beløb, der er nødvendige til fremstilling af 1 liter koncentreret opløsning.
- Fremstilling af vitamin opløsning: I tre separate volumetric kolber tilføje de vitaminer, som vist i tabel 2. Filter hvert vitamin opløsning gennem et sterilt 0,2 um sprøjtefilter til en steril beholder. Bevare vitaminer ved -4 ° C i mørke.
| Vitaminer | Beløb (mg) | Slutvolumen (ml) | Slutkoncentration vitamin (mg / l) |
| Biotin | 12.22 | 500 | 24.43 |
| Vitamin B12 | 13.50 | 100 | 135.00 |
| Thiaminhydrochlorid | 977,63 | 500 | 1,955.27 |
Tabel 2:. Løsning Vitamin opskrift Mængder er beløb, der er nødvendige for udarbejdelsen af koncentreret Solution.
- Delvist fylde en 20 L autoklaverbar beholder med DW og indsætte en magnetisk omrører. Beholderen anbringes på toppen af en magnetomrører plade og tilføje de kemikalier, der er vist i tabel 3 (undtagen vitaminer), at tilføje dem efter hinanden og efter hvert fuldstændigt opløst. Fyld beholderen til at nå 20 L.
| Komponent | Beløb for at tilføje til medium | Enhed |
| NaCl | 350.00 | g |
| CaCl2 · 2H 2 O | 3.00 | g |
| KCI | 9.60 | g |
| Na 2 SiO 3 · 9H 2 O | 1.14 | g |
| MgSO4 · 7H 2 O | 29.60 | g |
| 20.40 | g | |
| KH 2 PO 4 | 1,36 | g |
| Ammonium ferricitrat | 0.10 | g |
| Opløsning A | 20.00 | ml |
| Biotin løsning * | 818,00 | pi |
| Vitamin B12 løsning * | 296,20 | pi |
| Thiaminhydrochlorid opløsning * | 521,60 | pi |
| * Tilføj til afkølet autoklaveret medier |
Tabel 3: N. salina medium opskrift. Mængder er beløb, der er nødvendige til fremstilling af 20 l næringsrige medium.
- Sterilisere mediet ved autoklavering i 30 minutter ved 120 ° C og atmosfærisk tryk. Lad mediet cool ned til stuetemperatur.
- Beholderen anbringes på en magnetomrører plade. Tilføj de vitaminer forberedt i trin 3.2 og lad mediet mix grundigt.
4. Uorganiske forureninger lager forberedelse
- Delvist fylde målekolber angivet i tabel 4 med DW og tilsæt den enkelte salt opført. Fyld med DW til den ønskede endelige mærket og blandes omhyggeligt. Må ikke bevare disse bestande som nogle elementer adsorbere til kolbe vægge
ADVARSEL: Flere uorganiske forureninger anvendes i denne protokol er kræftfremkaldende, teratogent og mutagene, bære en ansigtsmaske, handsker og kittel ved håndtering af salte.
| Analyt | Salt kilde | Volumen af lager til at forberede (L) | Salt at føje til kolben60; (Mg salt) | Analytkoncentration tilsat til kulturen (mg analyt / L) |
| Som | NaAsO 2 | 0,1 | 14.8 | 7.74E-02 |
| Cd | CdCI2 | 0,5 | 13.5 | 1.50E-02 |
| Co | CoCI2 .6H 2 O | 0,5 | 34,7 | 1.56E-02 |
| Cr | Na 2 Cr 2 O 7 · 2H 2 O | 0,1 | 40.6 | 1.29E-01 |
| Cu | CuCl2 .2H 2 O | 0,1 | 38.3 | 1.30E-01 |
| Hg | HgCI2 | 1.0 14.6 | 9.80E-03 | |
| Mn | MnCl2 .4H 2 O | 0,1 | 58.8 | 1.49E-01 |
| Ni | NiCl2 .6H 2 O | 0,1 | 112,0 | 2.51E-01 |
| Pb | PbCl 2 | 0,5 | 39.9 | 5.41E-02 |
| Sb | Sb 2 O 3 | 0,5 | 26.7 | 4.06E-02 |
| Se | Na 2 Seo 3 | 0,5 | 11.8 | 9.80E-03 |
| Sn | SnCl2 .2H 2 O | 0,5 | 3.9 | 3.76E-03 |
| V | V 2 O 5 | 0,1 | 22.2 | 1.13E-01 |
| Zn | ZnCl2 | 0,1 | 99,9 | 4.36E-01 |
Tabel 4:. Koncentreret uorganiske forureninger lager forberedelse Tilsætning af 1 ml af denne koncentrerede bestand til 1,1 L PBR medium producerer den endelige koncentration vist i den sidste kolonne.
- Sterilisere uorganiske forurenende lagre ved at lede opløsningen gennem et sterilt 0,2 um sprøjte filter, og filtratet opsamles i et sterilt rør.
5. N. salina Inoculum Production
- I en 500 ml Erlenmeyer-kolbe tilsættes 200 ml medium fremstillet i trin 3, og derefter tilsættes 3 g agar. Dæk kolben med folie og autoklave aluminium i 20 minutter ved 120 ° C. Hæld opløsningen i sterile petriskåle og lad den køle indtil det størkner. Dette bør være afsluttet være en steril hætte eller i det mindste i nærheden af en flamme i et rent miljø for at mindske risikoen for forurening.
- Streak N. salina celler i sterile Petri-disHES fremstillet i trin 5.1 under anvendelse af en steril seeding sløjfe. Placer petriskål kulturer på et bord belyst med T12 lys holdes ved stuetemperatur. Lad mikroalger vokse, indtil kolonier er synlige.
- Overfør kolonier til sterile forvirret Erlenmeyer-kolber indeholdende 200 ml af næringsrige medium forberedt i trin 3, og holde dem på en belyst rystebord (1.000 RPM). Lad kulturen vokse, indtil mediet bliver grøn.
- Overfør mikroalger til en 1,1 l sterilt PBR. Placer PBR i et inokulum vandbad belyst ved 200 pmol m -2 sek-1 med T8 lysstofrør og holdt ved 23 ° C ved en recirkulerende køler og en automatiseret varme recirkulerende vandbad kontrol. Juster luft og CO 2 rotometers til 2,5 L min -1 og 25 cc min -1 hhv.
- Efter en uge i vækst split biomasse til nye 1 .1 L PBRs indeholder nye medie og lad det vokse, indtil alt mindst 28 g tørvægt biomasseopnået mellem de to reaktorer, som kan bestemmes via optisk tæthed.
- Høst inoculum biomassen ved centrifugering ved 2.054 x g i 15 minutter ved 10 ° C ved anvendelse sterile centrifugeflasker og sterile teknikker til at undgå forurening. Bortskaffe supernatanten og fortsætte cellekoncentrationen efter behov.
- Når al biomasse centrifugeres, resuspender cellerne i 300 ml frisk sterilt medium.
- Fortynd 0,1 ml af mikroalger kultur i 3 ml DW og fortynd derefter 0,1 ml af denne nye opløsning i 3 ml DW. Sørg prøven blandes grundigt. Mål den optiske densitet (OD) af den mikroalger koncentratet ved 750 nm () umiddelbart anvendelse af et spektrofotometer.
- Brug ligning (1) at bestemme mængden af biomasse i koncentratet.
Bemærk: Ligning (1) blev opnået fra den lineære regression mellem versus total suspenderet stof (ig / l -1) til N. Salina (R2 = 0,9995). Ligning 1 blev udviklet til spectrophotometer model i Materials Table, generere en ny kalibrering, hvis du bruger en anden spektrofotometer model.- Ved hjælp af ligning (2) beregne mængden af mikroalger koncentrat (i L) nødvendig for at opnå en 4 g / l -1 kultur densitet i en PBR på 1,1 L mængde (i liter).
- Under anvendelse af sterile teknikker, tilsættes mængden af mikroalger koncentrat findes i trin 5.9 til en autoklaveret PBR at nå en indledende kultur densitet på 4 g / l -1. Fyld PBR med medium til 1,1 L. Gentag dette trin, indtil 6 PBRs podes. Placer PBRs i inokulum vandbad.
- Lad mikroalger i PBRs vokse i 8 dage og derefter høste biomasse (ved gentagelse af trin 5,6-5,7). Gentag trin 5.8 til at beregne den oprindeligeinokulum volumen for en indledende kultur massefylde på 1 g / l -1.
6. Eksperimentelle Reaktorer
- Ved anvendelse af sterile teknikker tilføje ca. 1 liter medium fremstillet i trin 3 til hver af de 12 syre-skyllet sterile PBRs. Placer PBRs i vandbad på det eksperimentelle vækst systemet. Slå sprøjterør luft på ved 1,5 L min -1.
- Sterilisere en kalibreret pH-meter ved at rense den med 70% ethanol. PH måles af mediet i PBR og sikre pH er ca. 7,0; hvis ikke, skal du gentage trin 2 fjerne syre udvaskes fra syren skylning trin.
- Kalibrere hver pH controller ved hjælp af pH 7, desinficere sonderne hjælp ethanol (70%) og derefter indsætte dem i PBRs låg.
- Til hver PBR (undtagen kontrol- PBRs) tilsættes 1 ml af hver af de sterile uorganiske forureninger lagre fremstillet i trin 4. Lad forureningerne blandes grundigt i PBR. Slutkoncentrationen af de uorganiske forureninger i PBRs er shown i den sidste kolonne i tabel 4, og de estimerede maksimale koncentrationer forventes fra et kulfyret integration kraftværk.
- Tilføj 14 ml sterilt DW til kontrol- PBRs.
- Tilsæt koncentreret mikroalger inokulum opnået i trin 5.11 til de eksperimentelle PBRs for at opnå en indledende kultur densitet på 1 g / l -1. Lad biomasse mix grundigt.
- Drej høj lysintensitet lys (af 984 pmol m -2 sek -1) og pH-controllere på og justere CO 2 til 30 cc min 1. Øg CO 2 strømmen til 50 cc min -1 fra dag 3 bagefter. Initial lav CO2 strømningshastighed er afgørende for at undgå store ændringer i pH på grund af forsinkelser i gas / væske-overførsel og pH-måling.
- Måle og udtage prøver efter behov. Sørg for at markere vandstanden efter prøveudtagningen. (ADVARSEL: nogle uorganiske forureninger i PBR er kræftfremkaldende, teratogent og mutagene, brug handsker og CAPPed containere ved håndtering prøver).
- Tilføj steril DW dagligt til de PBRs for at kompensere for tab som følge af fordampning.
- Efter 7 dages vækst, høst biomassen ved centrifugering ved 9936 x g og bevare både, biomasse og supernatant medium ved -80 ° C.
- Frys tørre biomassen på 0,1 mbar og -50 ° CO / N. Pulver biomassen (brug en spatel til pulver biomasse inde i centrifugeglas). Bevare frysetørret biomasse ved -80 ° C.
7. Mikroovn Assisted Fordøjelse af prøver
Fordøjelsen af biomassen prøver kræves som en præ-behandlingstrin for ICP-MS-analyse.
Bemærk: Disse trin bruger en lukket beholder mikrobølgeovn fordøjelse systemet med kontrolleret trykaflastning. (ADVARSEL: Høj pres udvikle sig i løbet syre fordøjelse, inspicere fysiske integritet fordøjelsen fartøjer og skjolde, og omforme lågene mikrobølge fordøjelse fartøj før hver brug).
- Wash Teflon mikroovn fordøjelse fartøjer med sæbe og vand, skyl med DW og lad fartøjer lufttørre. At fjerne spor metal forurening i fartøjerne fordøje syre som beskrevet i de følgende trin.
- Omforme mikrobølgeovn fordøjelsen fartøj låg, og luk glassene tæt.
- Der tilsættes 10 ml salpetersyre til hver.
- Indføre skibet i sikkerhed skjold. Sikre, at ingen biomasse, vand eller reagenserne er tilbage på væggene i sikkerhedsskærmen eller i de ydre vægge af fordøjelsen fartøjer for at undgå beskadigelse af sikkerhedsskærmen. Cap sikkerhed skjold med sikkerhedsventilen og sørg fjederen i hætteglasset flugter. Find skjoldet på rotoren med hætten ventilationskanaler peger udad i den ydre række og indad i den inderste række.
- Indsæt på skib nummer et, den keramiske termokilde og temperaturføler. Dette termometer overvåger den faktiske indre temperatur i hætteglasset og fungerer som styrende parameter for at udføre fordøjelsen program. Sørg for, at hætteglas nummer et indeholder de samme prøve og reagens beløb som de andre hætteglas.
- Input fordøjelsen parametre vist i tabel 5 og begynde fordøjelsen. Når programmet er færdigt, luft afkøles hætteglassene, indtil de når RT.
| Step | Hætteglas skylning | Sample fordøjelse | ||||
| (° C) | Tid (min) | Max. (W) | (° C) | Tid (min) | Max. (W) | |
| 1 | RT til 190 | 25 | 1.000 | RT til 180 | 15 | 1.000 |
| 2 | 190 | 10 | 1.000 | 180 | 15 | 1.000 |
| - | 20 | - | - | 20 | - |
Tabel 5: Parametre, der anvendes i mikrobølgeovnen fordøjelsen programmet.
- Inde i en stinkskab, indsætte trykaflastning værktøj på skjoldet cap med hætten ventilationskanaler peger væk fra dig. Når trykket er frigivet åben hætten (ADVARSEL: Altid åbne fordøjede hætteglas inde stinkskab siden biomasse fordøjelse ved hjælp af syre producerer giftige dampe).
- Bortskaf syren. Skyl Teflon skibe med DW 3 gange. Lad hætteglas lufttørre.
- At fordøje biomasse, tilsættes 50 mg frysetørret biomasse til mikroovn fordøjelse fartøjer. Til kvalitetskontrol (QC) forberede følgende hætteglas: i to forskellige hætteglas tilføje enten 5 ml Level 7 ICPMS eller 5 ml Level 7 Hg CVAAS standard forberedt i trin 9.1 og 10.1 (den fordøjede løsning fra denne hætteglasset kaldes laboratorium befæstede blank (LFB)), skal du lade en anden hætteglas tom (den fordøjede løsningfra dette hætteglas kaldes laboratorium reagensblank (LRB)).
- At fordøje medium, tilsættes 10 ml supernatant medium tørre syre skylles mikrobølge fordøjelse fartøjer. Til kvalitetskontrol (QC) forberede følgende hætteglas: I to forskellige hætteglas tilsættes 5 ml Level 7 ICPMS eller CVAAS metal standard forberedt i trin 9.1 og 10.1 (den fordøjede løsning fra denne hætteglasset kaldes LFB), til en anden hætteglas tilføje 10 ml DW (den fordøjede opløsning fra dette hætteglas kaldes LRB).
- Omforme mikrobølgeovn fordøjelsen fartøj låg, og luk glassene tæt.
- Tilsættes 7 ml koncentreret spormetalkvalitet salpetersyre og 3 ml hydrogenperoxid til hvert hætteglas. Homogeniseres indholdet ved forsigtigt hvirvlende løsningen. Fordøje indholdet af hætteglassene ved at gentage trin 7,4-7,7 (brug mikrobølge fordøjelsen parametre for prøve fordøjelse i tabel 5).
- Tilføj fordøjet prøve til en 25 ml målekolbe, skylning af fartøjer med DW for øget nyttiggørelse. Fyld målekolben med DWtil mærket.
- Overførsel fordøjet prøver til et udjævnet beholder. Bevare prøver ved 4 ° C indtil analyse kan gennemføres. Til denne undersøgelse analyse sker samme dag for Hg og inden for tre dage for de andre elementer.
8. Kvalitetskontrol (QC) Prøver
Bemærk: Analyser QC prøver for at sikre pålideligheden af resultaterne fra eksperimentelle prøver.
- Delvist udfylde en syre skyllet 1 L målekolbe med DW. Tilføj 280 ml koncentreret spormetalkvalitet salpetersyre og bland grundigt (denne løsning kaldes også den tomme opløsning) (ADVARSEL: altid syre i vand, aldrig tilsæt vand til syre som den exoterme reaktion kan være voldsom). Lad opløsningen afkøles til stuetemperatur.
- Ud over QC prøver fremstillet i trin 7.9 og 7.10, forberede følgende QC prøver.
- Til verifikation fortsatte kalibrering (CCV): Fyld en polystyrenrør med kalibrering standard (til forberedelse setrin 9.2 og 10.1). Sæt Hg standard løsning på CVAAS rack og de ICPMS standard løsning i ICPMS autosampleren.
- For den fortsatte kalibrering blank (CCB): Fyld to polystyrenrør (16 ml) med blindprøven (opløsning fremstillet i trin 8.1). Placer en prøve i CVAAS rack og den anden prøve i ICPMS autosampleren.
- For laboratoriet-berigede matrix (LFM): Tilfældigt vælge 1 prøve af hver 12 prøver for hver type prøve (dvs. biomasse eller medium) og bruge den til at forberede en LFM. For ICPMS, tilsættes 0,5 ml ICPMS standard Level 7 og 3 ml fordøjet eksperimentel prøve (fra enten biomasse eller medium) til et polystyrenrør.
- Bland indholdet og placere hætteglassene på ICPMS autosampleren. For CVAAS, tilsættes 2 ml Hg standard Level 7 og 6 ml fordøjet eksperimentel prøve (fra enten biomasse eller medium) til et polystyrenrør. Bland indhold og placere hætteglas på CVAAS rack.
- For de dobbelte prøver: Tilfældigt vælge 1 prøve af stadigy 12 prøver for hver type matrix (f.eks, biomasse, medium, LFM eller fortyndet matrix) og duplikere hætteglasset. Placer de gentagne hætteglas i ICPMS autosampleren eller CVAAS rack.
- For de dobbelte prøver: Tilfældigt vælge 1 prøve af hver 12 prøver for hver type matrix (f.eks, biomasse, medium, LFM eller fortyndet matrix) og duplikere hætteglasset. Placer de gentagne hætteglas i ICPMS autosampleren eller CVAAS rack.
- Definer de data, kvalitetskriterier for undersøgelsen. For nærværende undersøgelse duplikere de kvalitetskriterier, der er fastsat af Eaton, Clesceri, Ris og Greenberg 25. Parametrene er fastlagt for QC er: procent forskel (% D) for CCV inden for ± 10% 25 (med undtagelse af Pb og Sb, se diskussionen), LFB procent recovery (% R) inden for ± 70 til 130% 25, LFM procent nyttiggørelse (% R) inden 75-125% 25, og relativ procent forskel (RPD) inden for ± 20% 25, og en fortsat calibration blank (CCB) under grænsen metode rapportering (MRL) 25. Se beregning ligninger i trin 9.7.
9. Kvantificering af induktivt koblet plasma massespektrometri (ICPMS)
- På dagen for analysen, overføres ca. 5 ml afgasset prøve til polystyrenrør og placere dem i ICPMS autosampleren. Der tilsættes ca. 15 ml fordøjede prøver polystyrenrør og placere dem i CVAAS rack.
- Samme dag i analysen forberede kalibreringsstandarderne. Tilføj købt ICPMS standardløsning og fyld med blank (opløsning fremstillet i trin 8.1) som beskrevet i tabel 6 (se standard løsning beskrivelsen i Material tabel) til syre-skyllet målekolber.
| Parameter | Level 1 | Niveau 2 | Niveau 3 | Niveau 4 | Level 5 | Niveau 6 | Level 7 |
| Købt standard der skal tilføjes (ml) | - | - | - | - | - | - | 10,0 |
| Level 7 skal tilføjes (ml) | 0,0 | 1.0 | 2.5 | 5.0 | 20,0 | 25,0 | - |
| Slutvolumen * (ml) | - | 50,0 | 50,0 | 50,0 | 100,0 | 50,0 | 100,0 |
| Slutkoncentration (ug / L) | |||||||
| 75 Som | 0,0 | 2,0 | 5.0 | 10,0 | 20,0 | 50,0 | 1000,0 |
| 111 Cd | 0,0 | 1.0 | 2.5 | 5.0 | 10,0 | 25,0 | 50,0 |
| 59 Co | 0,0 | 10,0 | 25,0 | 50,0 | 100,0 | 250,0 | 500,0 |
| 52 Cr | 0,0 | 2,0 | 5.0 | 10,0 | 20,0 | 50,0 | 100,0 |
| 63 Cu | 0,0 | 5.0 | 12.5 | 25,0 | 50,0 | 125,0 | 250,0 |
| 55 Mn | 0,0 | 3.0 | 7.5 | 15,0 | 30,0 | 75.0 | 150,0 |
| 60 Ni | 0,0 | 8,0 | 20,0 | 40,0 | 80,0 | 200,0 | 400,0 |
| 208 Pb | 0,0 | 1.0 | 2.5 | 5.0 | 10,0 | 25,0 | 50,0 |
| 121 Sb | 0,0 | 12.0 | 30,0 | 60,0 | 120,0 | 300,0 | 600,0 |
| 51 V | 0,0 | 10,0 | 25,0 | 50,0 | 100,0 | 250,0 | 500,0 |
| 66 Zn | 4.0 | 10,0 | 20,0 | 40,0 | 100,0 | 200,0 | |
| * Opnå denne mængde ved at tilføje opløsning fremstillet i trin 8.1 | |||||||
Tabel 6: Koncentration af kalibreringsstandarder Niveauer 1 til 7..
- Tag kegler fra ICPMS og sonikeres dem i 1 min i DW. Tør kegler og sætte dem tilbage i instrumentet.
- Tænd for vandkøler, gasser (Ar, H 2, He), det ICPMS, plug linjer til intern standard, og fyld auto-sampler skyl containere (DW, 10% salpetersyre, 1% salpetersyre + 0,5% saltsyre) .
- Åbn Masshunter Workstation-softwaren, og tænd for plasma, tune ICPMS og indlæse metoden til parametre i tabel 7.
| Parametre Værdier | |||||||||
| Interne standarder | 72 Ge, 115 | ||||||||
| Rf magt | 1.500 W | ||||||||
| Plasma gasstrømningshastighed | 14,98 | ||||||||
| Nebulizer gasstrømningshastighed | 1,1 l / min (carrier og fortynding gas kombineret - 0,6 + 0,5 L / min) | ||||||||
| Sampling kegle | Nikkel for x linse | ||||||||
| Skimmer kegle | Nikkel | ||||||||
| Sample optagelseshastighed | 0,3 rps | ||||||||
| Nebulizer pumpe | 0,1 rps | ||||||||
| S / C temperatur | 2 ° C | ||||||||
| Scanning tilstand | Opholdstid 1 sek, antal gentagelse 3 | ||||||||
| H2-gas flow | N / A | ||||||||
| Han gasstrøm | 4,3 ml / min | ||||||||
| Parameter | Level 1 | Niveau 2 | Niveau 3 | Niveau 4 | Level 5 | Niveau 6 |
| L7 Hg standard der skal tilføjes (ml) | 0 | 1 | 2.5 | 5 | 20 | 25 |
| Slutvolumen * (ml) | - | 50 | 50 | 50 | 100 | 50 |
| Slutkoncentration (ug / L) | 0 | 0,5 | 1.25 | 2.5 | 5 | 12.5 |
| * Opnå denne mængde ved at tilføje opløsning fremstillet i trin 8.1 | ||||||
Tabel 8: Koncentration af Hg kalibreringsstandard Niveauer 1 til 6..
- Åbn Ar gas og luftventil, tænde for Atomic sugertion spektrofotometer og Flow Injection Atomic spektroskopi (FIAS). Åbn CVAAS Winlab software, tænde for Hg-lampe og lad den varme op, indtil softwarens energi parameter når 79. Indlæs programmet for Hg-analyse med parametrene i tabel 9. Juster strålegangen i instrumentet til at give den maksimale transmittans.
| Parametre | Værdier |
| Bæregas | Argon, 100 ml / min |
| Lampe | Hg elektrodefrit udledning lampe, opsætning på 185 mA |
| Bølgelængde | 253,7 nm |
| Slit | 0,7 nm |
| Celletemperatur | 100 ° C |
| Prøvevolumen | 500 pi |
| Carrier | 3% HCI, 9,23 ml / min |
| Reduktionsmiddel | 10% SnCl2, 5,31 ml / min |
| Måling | Tophøjde |
| Læs gentagelser | 3 |
Tabel 9: CVAAS driftsbetingelser.
- Sæt linjen til transportøren løsning lavet af 3% spormetalkvalitet saltsyre.
- Sæt telefonkablet til reduktionsmidlet opløsning fremstillet af 10% stannochlorid (velegnet til Hg analyse) i 3% spormetalkvalitet saltsyre. Forbered denne løsning den samme dag i analyse som det er udsat for atmosfærisk oxidation (ADVARSEL: Stannochlorid er meget farligt, brug beskyttende slid, når der arbejdes med det Saml CVAAS affald i farligt inddæmning og korrekt bortskaffelse.).
- Placer Hg standarder, QC prøver og eksperimentelle prøver i CVAAS rack og input sekvensen i CVAAS Winlab software. Køre standarder og generere kalibreringsligningen.
- Kør QC samcipper og eksperimentelle prøver. Den CVAAS trækker ca. 5 ml prøve ind i instrumentet, reducerer Hg til stede i prøven til elementært Hg (Hg 0) gas og renser gassen fra opløsningen med en bæregas (Ar) i et lukket system. Hg damp passerer gennem en celle i Hg-lampe strålegangen. En detektor bestemmer den absorberede ved 253,7 nm lys og korrelerer det til koncentration. (ADVARSEL: Hg damp er giftig, sikre instrument emhætte er på plads).
- Beregn% R,% D og RPD i trin 9.7 under analyse og sammenligne resultaterne til datakvalitetskriterier projektet.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Biomasse udbytter
Produktion af N. salina i PBR system, der anvendes i denne undersøgelse voksede fra 1 g / l -1 til 8,5 ± 0,19 g / l -1 (N = 12) til kontrol reaktorer og 4,0 ± 0,3 g / l -1 (N = 12) for den multi-metal forurenet i 7 dage. Forsøgene produceret gentagelige data på tværs tredobbelte reaktorer og flere partier. Figur 2A viser den gennemsnitlige kultur tæthed med meget lille standardafvigelse baseret på stikprøver fra tre uafhængige PBRs. For at sikre dette resultat ikke var en isoleret resultat blev yderligere tre batcher dyrket med lignende resultater. De kombinerede resultater for alle fire batcher er vist i figur 2B. Selv biologisk variation eksisterer, denne undersøgelse viser, at der er en konsekvent negativ effekt af uorganiske forureninger til N. salina produktion. De biomasse udbytter i de forurenende eksponerede PBRs var statistisk forskellige til kontrol PBRs fradag 2 og fremefter (ANOVA, p <0,05).
Kvalitetskontrol vurdering af uorganisk forurenende kvantificering
Tolv af de fjorten elementer analyserede var fuldt inddrives efter fordøjelse som det fremgår af LFB% R med% R nær 100%, hvilket indikerer ingen tab, ingen gevinster og ingen krydskontaminering af analytter under fordøjelsen (tabel 10). Under blev overvåget kvantitativ analyse af prøver% D og RPD gennem alle analyser og gennemsnittet af resultaterne er vist i tabel 10. As, Cd, Co, Cr, Cu, Hg, Mn, Ni, Pb, Sb, V og Zn øjeblikkeligt Den% D og RPD dog% D for Pb og Sb gradvist faldt under analysen. Den% D for disse elementer er forbedret efter kegle rengøring dog konstant kegle rengøring er upraktisk, og derfor datakvalitetsmålsætningerne for Pb og Sb blev sænket. CCB for alle analytter var også under MRL. Matrix effekter blev vurderet ved at analysere LFM prøver og opnå% R. While Co, Hg, V og Sb bestået data kriterier QC, det var ikke forbi As, Cd, Cr, Cu, Mn, Ni, Pb og Zn, når fordøjet biomasse prøver blev analyseret, hvilket resulterede i% R under QC mål. Matrix fortynding i DW til et forhold på 1: 3 (opløst stof: opløsningsmiddel) resulterede i% R, der passerede datakvalitetskriterier. Matrix effekter blev også observeret under analysen af det fordøjede supernatant og blev behandlet af den samme fortyndingsforhold (tabel 10) og sørg fortyndingen ikke kompromittere grænsen af instrumentet afsløring. Problemer med påvisning af Se og Sn blev observeret baseret på ustabile aflæsninger og et problem forurening hhv. De ustabile aflæsninger for Se tilskrives salte i matricen 27. Sn forurening blev sporet tilbage til en syre, der anvendes i fordøjelsen trin.
| Analyt | R | CCV | LFB | LFM for biomasse prøver | LFM for supernatantprøver | ||||
| % D | % R | Fortyndingsforhold | % R | RPD | Fortyndingsforhold | % R | RPD | ||
| QC begrænser 25 | 0,9950 | ± 10 | 70-130 | - | 75-125 | ± 20 | - | 75-125 | ± 20 |
| Som | 0,9998 | 1.8 | 101,0 | 1: 3 | 100,4 | 5.2 | 1: 3 | 92,5 | -0.5 |
| Cd | 1.0000 | 1.4 | 102,6 | 1: 3 | 103,5 | 4.6 | Ingen | 92,3 | 0,6 |
| Co | 0,9997 | 1.7 | 98,8 | Ingen | 95,2 | -1,4 | Ingen | 96,5 | -1.5 |
| Cr | 0,9999 | 1.5 | 99,8 | 1: 3 | 96,5 | 1.8 | 1: 3 | 90.1 | -0,8 |
| Cu | 0,9999 | 2.9 | 98,2 | 1: 3 | 101,4 | 4.8 | 1: 3 | 94.4 | -0.5 |
| Hg | 0,9983 | -1,7 | 103,0 | Ingen | 98,7 | 1.5 | Ingen | 98,0 | 0,3 |
| Mn | 0,9998 | 2.9 | 97.6 | 1: 3 | 83.2 | 1.8 | 1: 3 | 95.4 | -1,7 |
| Ni | 0,9999 | 103,5 | 1: 3 | 98,5 | 2.1 | Ingen | 93.3 | -0,9 | |
| V | 0,9998 | 2.5 | 97,2 | Ingen | 95.5 | -1.5 | Ingen | 101,2 | -1,9 |
| Pb | 0,9998 | 12.6 | 105,2 | 1: 3 | 88,9 | 0,0 | Ingen | 93,5 | -0.5 |
| Sb | 0,9998 | 1.1 | 105,7 | Ingen | 101,8 | -9,6 | Ingen | 90,8 | -1,2 |
| Zn | 0,9997 | 5.2 | 120,8 | 1: 3 | 90,7 | 1.4 | Ingen | 89,2 | -1,9 |
Tabel 10: Sammenfatning af resultaterne af kvaliteten kontrolprøver. R = correlation koefficient,% D: procent forskel,% R: procent nyttiggørelse, RPD = relativ procent forskel, fortyndingsforhold refererer til opløst stof: forholdet opløsningsmiddel.
Uorganiske forureningskoncentrationer
Heavy metal og uorganiske forureninger blev fundet i både biomasse og supernatant medium. De fundne koncentrationer i biomassen for de 12 elementer analyseres, er vist i figur 3. Koncentrationer i biomassen høstes fra tredobbelte PBRs (N = 3) i batch # 1 viser en meget lille standardfejl (figur 3A). Kombinere data fra tredobbelte PBRs fra 4 batcher konsekvent viser, at uorganiske forureninger er til stede i biomassen (N = 12). De koncentrationer, der findes i supernatanten medium er vist i figur 4. Resultaterne viser tredobbelte PBRs (N = 3) for batch # 1 har også små standardfejl (figur 4A) og viser, at de fleste forureninger fortrinsvis var placeret i biomassen leading til meget lave koncentrationer i supernatanten med flere prøvekoncentrationer tæt på MRL af instrumentet. Resultater fra alle fire portioner er vist i figur 4B.
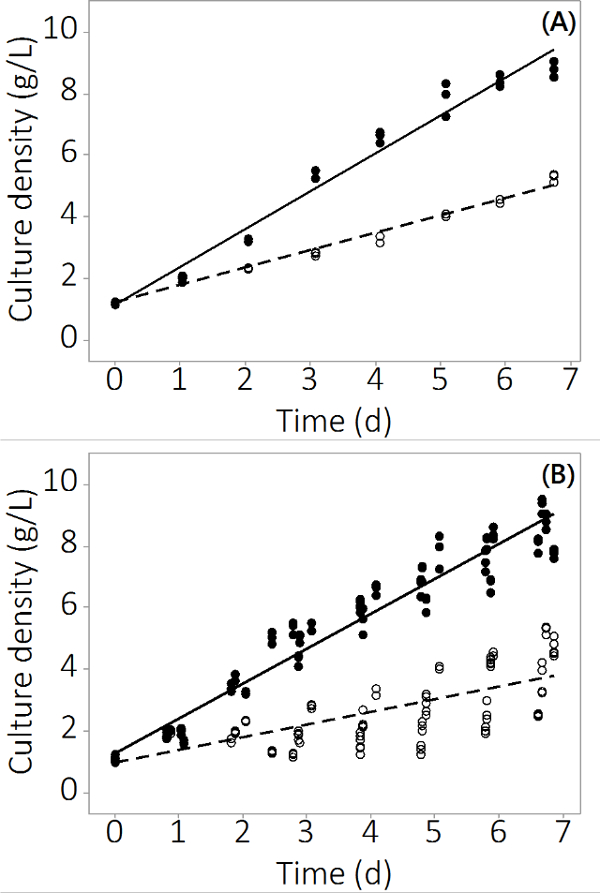
Figur 2. C ULTUR koncentration i dyrkning periode forurenede og kontrol PBRs. (A) Kultur tæthed i batch # 1, resultater fra N = 3 PBRs. (B) Kultur tæthed i 4 partier, resultater fra N = 12 PBRs. Tomme cirkler repræsenterer forurenet biomasse, repræsenterer fyldte cirkler kontrollen.
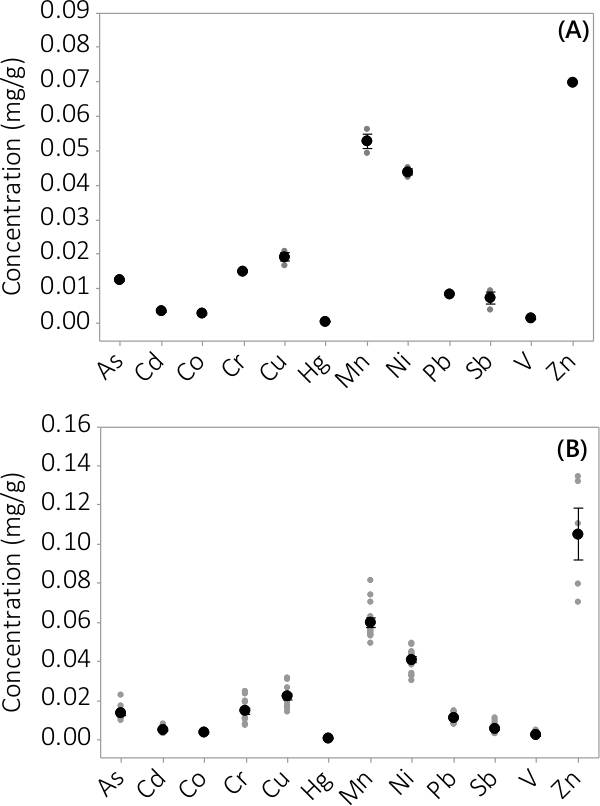
Figur 3. Koncentration af uorganiske forurenende stoffer i biomassen. (A) Koncentration i batch #1, resultater fra N = 1 PBR for Zn og N = 3 PBRs for alle de andre analytter, (B) Koncentration fra 4 partier, resultater fra N = 4 PBRs for Zn og N = 12 PBRs for alle de andre analytter. Middelkoncentrationer er repræsenteret ved sorte fyldte cirkler, er individuelle datapunkter repræsenteret ved grå fyldte cirkler. Fejlsøjler repræsenterer ± én standardafvigelse fra middelværdien.
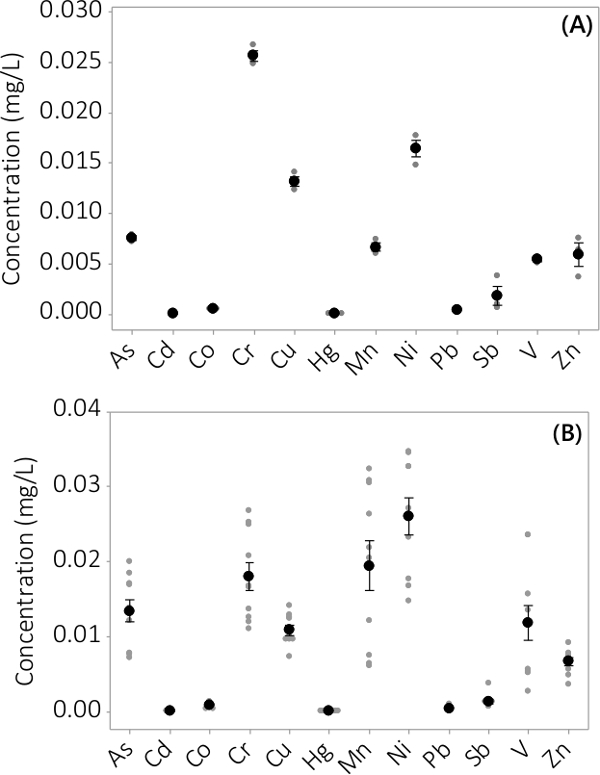
Figur 4. Koncentration af uorganiske kontaminanter i supernatanten. (A) Koncentration i batch # 1, følger af N = 3 PBRs, (B) Koncentration fra 4 batcher, resultater fra n = 12 PBRs. Middelkoncentrationer er repræsenteret ved sorte fyldte cirkler, er individuelle datapunkter repræsenteret ved grå fyldte cirkler. Fejlsøjler repræsenterer ± én standardafvigelse fra middelværdien.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Saline mikroalger N. salina kan dyrkes med succes i designet vækst-system med reproducerbare resultater og høje biomasse udbytter. Airlift blanding tilladt for en velblandet suspenderet kultur med minimal bundfældning eller biologisk forurening i perioderne 7 dage vækst. Den minimale lys variation på tværs af fluorescerende lys bank er også vist at ikke producere mærkbare forskelle i vækst.
Undersøgelsen viser heavy metal forurenede medier ved koncentrationer er repræsentative for integration med kul røggas negativt påvirkninger biomasse vækst. Repeterbarhed i undersøgelsen fremhæver virkningen multi-metal-systemet har på produktiviteten. Forskellige trin i processen kan potentielt negativ indflydelse vækst og forurene systemet kræver flittige eksperimenterende forberedelse. Bestemmelse af pH i mediet, før du starter eksperimentet er et QC skridt, der giver mulighed for kontrol af, at mediet ikke er syrnet (f.eks resulting af forkert PBR skylning efter syre iblødsætning). Syrnet medium vil påvirke algevækst og ændre næringsstof biotilgængelighed (f.eks ændringer i uorganisk kulstof artsdannelse og metal artsdannelse) dermed påvirker samspillet mellem alger bindende sites, næringsstoffer og metaller. Den omhyggelige forberedelse af laboratorieudstyr til disse undersøgelser var påkrævet, således at en nøjagtig massebalance af de indførte metaller kan udføres. Andre trin i processen har potentiale til at indføre forsvundet metaller understreger behovet for anvendelse af passende kvalitet opløsningsmidler og kemikalier. Korrekt QC gennem processen effektivt kan identificere indførelsen af tungmetalurenheder.
Resultater viser indført kontaminanter er fordelt mellem biomasse (figur 3), medier (figur 4) og miljø. Uorganiske forureninger findes i høstede N. salina foreslår, at dette mikroalger vil incorporate flere af de uorganiske forurenende stoffer i røggassen. Denne assimilation kan være et resultat af adsorption på cellevægge på grund af ladede bindingssteder, absorption inde i cellen på grund af metabolisk aktivitet, og udfældning af komplekser dannet med elementer til stede i mediet 28. Visuelt reaktorer med uorganiske forureninger efter et par dage optrådte gul i farven i forhold til mørkegrøn af kontrol- reaktorer. Forurenet høstede biomasse ikke var visuelt forskellig fra den kontaminant-fri biomasse efter pelletdannelse efter høst ved centrifugering. Den visuelle farveforskel før høst tilskrives en lavere biomasse tæthed og stressede mikroalger. Forurenende stoffer ikke fjernes i biomassen har potentiale til at akkumulere i medierne som illustreret i figur 4. Akkumulering i medierne udgør en potentiel at begrænse omfanget som medie genvinding betegner en nødvendighed for økonomisk levedygtighed. Begrænsningen vil blive dikteretaf tolerance over for tungmetalurenheder, som vil være artsspecifik. Resultaterne af denne undersøgelse understreger behovet for bedre at forstå de potentielle negative indvirkninger på at integrere mikroalger vækst systemer med affald kulstofkilder, specielt kul baserede røggas. Resultaterne fra dette studie understreger behovene at forstå de produktivitetsforbedringer konsekvenser af andre forurenende stoffer, der forventes at være til stede i røggassen, såsom oxider af svovl og kvælstof, fint støv, og organiske forureninger såsom polychlorerede dibenzo dioxiner og dibenzo furaner. Tidligere TEA og LCA vurderinger har antaget en problemfri integration uden at overveje konsekvenserne af forurenende stoffer såsom tungmetaller og uorganiske forureninger på produktiviteten. Generelt resultaterne fra dette arbejde fremhæve effekten af en multi-metal systemet på produktivitet og kan bruges til at forstå potentialerne i mikroalger til bioremediate kontaminanter.
Den metode præsenterede tilladt for the undersøgelse af uorganiske forureninger med gentagelige resultater for mikroalger. Nogle uorganiske forureninger, der anvendes i dette forsøg er traditionelt findes i vækst systemer ved lave koncentrationer, men de andre ikke har en kendt funktion i cellen. Som følge multi-element blanding af As, Cd, Co, Cr, Cu, Hg, Mn, Ni, Pb, Sb, Se, Sn, V og Zn ved koncentrationen vist i tabel 4 inhiberede vækst. Kvantificering af mængden af forurenende stoffer i biomassen kan blive en udfordring i multi-metal-systemer. Ofte kan prøver med højt indhold af organiske og salte producere matrix interferens, polyatomic interferens, fysiske forstyrrelser og salt opbygge i kegler, der i sidste ende fører til unøjagtige aflæsninger og tab af analytisk nøjagtighed 29,30. Kvalitet kontrolprøver køre sammen med de eksperimentelle prøver været med til at bestemme nøjagtigheden og præcisionen af målingerne. Måling af analytter ved anvendelse af de protokoller, der er udviklet til denne undersøgelse har vist at være enccurate og præcis producere acceptable inddrivelser, der er inden for det acceptable præstation for denne type undersøgelse 25,29. Fordøjelse af prøver ved mikrobølgeovn blev vist at være effektive til N. salina som fordøjede prøver var klare uden tilstedeværelsen af cellerester eller blandbare portioner. Matrixen bruges i denne eksperimenter (alge biomasse og kunstig havvand) producerede matrix interferens, der blev overvundet ved matrix fortynding. Højere biomasse prøvestørrelserne end dem, der anvendes i dette forsøg, kan imidlertid føre til matrix interferens, og derfor QC bør analyseres i hvert enkelt scenario.
Subscription Required. Please recommend JoVE to your librarian.
Materials
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| Sodium chloride | Fisher Scientific | S271-3 | |
| Calcium chloride dihydrate | Fisher Scientific | C79-500 | |
| Potassium chloride | Fisher Scientific | P217-500 | |
| Sodium meta silicate nonahydrate | Fisher Scientific | S408-500 | |
| Magnesium sulfate heptahydrate | Fisher Scientific | M63-500 | |
| Potassium nitrate | EMD Chemical | PX1520-5 | |
| Potassium phosphate monobasic | Fisher Scientific | P285-500 | |
| Ammonium ferric citrate | Fisher Scientific | I72-500 | |
| Boric acid | Fisher Scientific | A73-500 | |
| Sodium molybdate, dihydrate | EMD Chemical | SX0650-2 | |
| Manganese chloride tetrahydrate | Fisher Scientific | M87-500 | |
| Zinc sulfate heptahydrate | Fisher Scientific | Z68-500 | |
| Cupric sulfate pentahydrate | Fisher Scientific | C489-500 | |
| Biotin | Acros Organics | 230090010 | |
| Thiamine | Acros Organics | 148990100 | |
| Vitamin B12 | Acros Organics | 405920010 | |
| Copper (II) chloride dihydrate | Sigma-Aldrich | 221783-100G | Irritant, Dangerous to the Environment |
| Lead (II) chloride | Sigma-Aldrich | 268690-250G | Toxic, Dangerous to the Environment |
| Sodium dichromate dihydrate | Sigma-Aldrich | 398063-100G | Oxidizing, Highly Toxic, Dangerous to the Environment |
| Cobalt (II) chloride hexahydrate | Sigma-Aldrich | 255599-100G | Toxic, Dangerous to the Environment |
| Nickel (II) chloride hexahydrate | Sigma-Aldrich | 223387-500G | Toxic, Dangerous to the Environment |
| Sodium (meta) arsenite | Sigma-Aldrich | 71287 | Toxic, Dangerous to the Environment |
| Cadmium chloride | Sigma-Aldrich | 202908-10G | Highly Toxic, Dangerous to the Environment |
| Mercury (II) chloride | Sigma-Aldrich | 215465-100G | Toxic, Dangerous to the Environment |
| Tin (II) chloride dihydrate | Fisher Scientific | T142-500 | Corrosive. Suitable for Hg analysis. Very hazardous. |
| Manganese chloride tetrahydrate | Fisher Scientific | M87-500 | |
| Vanadium (V) oxide | Acros Organics | 206422500 | Dangerous to the Environment |
| Carbon dioxide | Air Liquide | I2301S-1 | Compressed |
| Hydrogen peroxide | H325-500 | Fisher Scientific | 30% in water |
| ICP-MS standard | ICP-MS-6020 | High Purity Standards | |
| Mercury standard | CGHG1-1 | Inorganic Ventures | 1000±6 µg/mL in 5% nitric acid |
| Argon | Air Liquide | Compressed | |
| Helium | Air Liquide | Compressed, ultra high purity | |
| Hydrogen | Air Liquide | Compressed, ultra high purity | |
| Nitric acid | Fisher Scientific | A509-P212 | 67-70% nitric acid, trace metal grade. Caution: manipulate under fume hood. |
| Hydrochloric acid | Fisher Scientific | A508-P212 | 35% hydrochloric acid, trace metal grade. Caution: manipulate under fume hood. |
| Equipment | |||
| Scientific prevacuum sterilizer | Steris | 31626A | SV-120 |
| Centrifuge | Thermo Fisher | 46910 | RC-6 Plus |
| Spectrophotometer | Shimadzu | 1867 | UV-1800 |
| pH controller | Hanna | BL981411 | X4 |
| Rotometer, X5 | Dwyer | RMA-151-SSV | T31Y |
| Rotometer, X5 | Dwyer | RMA-26-SSV | T35Y |
| Water bath circulator | Fisher Scientific | 13-873-45A | |
| Compact chiller | VWR | 13270-120 | |
| Freeze dryer | Labconco | 7752020 | |
| Stir plate | Fisher Scientific | 11-100-49S | |
| pH lab electrode | Phidgets Inc | 3550 | |
| Inductively coupled plasma mass spectrometer | Agilent Technologies | 7700 Series ICP-MS | Attached to autosampler CETAC ASX-520 |
| FIAS 100 | Perkin Elmer Instruments | B0506520 | |
| Atomic absorption spectrometer | Perkin Elmer Instruments | AAnalyst 800 | |
| Cell heater (quartz) | Perkin Elmer Instruments | B3120397 | |
| Microwave | Milestone | Programmable, maximum power 1,200 W | |
| Microwave rotor | Milestone | Rotor with 24-75 ml Teflon vessels for closed-vessel microwave assisted digestion. | |
| Materials | |||
| 0.2 μm syringe filter | Whatman | 6713-0425 | |
| 0.2 μm syringe filter | Whatman | 6713-1650 | |
| 0.45 μm syringe filter | Thermo Fisher | F2500-3 | |
| Polystyrene tubes | Evergreen | 222-2094-050 | 17 x 100 mm w/cap, 16 ml, polysteryne |
| Octogonal magnetic stir bars | Fisher scientific | 14-513-60 | Magnets encased in PTFE fluoropolymer |
References
- Dismukes, G. C., Carrieri, D., Bennette, N., Ananyev, G. M., Posewitz, M. C. Aquatic phototrophs: efficient alternatives to land-based crops for biofuels. Curr Opin Biotechnol. 19 (3), 235-240 (2008).
- Moody, J. W., McGinty, C. M., Quinn, J. C. Global evaluation of biofuel potential from microalgae. Proceedings of the National Academy of Sciences. 111 (23), 8691-8696 (2014).
- Pinto, E., et al. Heavy metal-induced oxidative stress in algae. J Phycol. 39 (6), 1008-1018 (2003).
- Gupta, A., Lutsenko, S. Evolution of copper transporting ATPases in eukaryotic organisms. Curr Genomics. 13 (2), 124-133 (2012).
- Perales-Vela, H. V., Peña-Castro, J. M., Cañizares-Villanueva, R. O. Heavy metal detoxification in eukaryotic microalgae. Chemosphere. 64 (1), 1-10 (2006).
- Sandau, E., Sandau, P., Pulz, O. Heavy metal sorption by microalgae. Acta Biotechnol. 16 (4), 227-235 (1996).
- Amer, L., Adhikari, B., Pellegrino, J. Technoeconomic analysis of five microalgae-to-biofuels processes of varying complexity. Bioresour Technol. 102 (20), 9350-9359 (2011).
- Benemann, J. R., Goebel, R. P., Weissman, J. C., Augenstein, D. C. Microalgae as a source of liquid fuels. Final Technical Report, US Department of Energy, Office of Research. , (1982).
- Benemann, J. R., Oswald, W. J. Report No. DOE/PC/93204--T5 Other: ON: DE97052880; TRN: TRN. Systems and economic analysis of microalgae ponds for conversion of CO2 to biomass. , (1996).
- Chisti, Y. Biodiesel from microalgae. Biotechnol Adv. 25 (3), 294-306 (2007).
- Davis, R., Aden, A., Pienkos, P. T. Techno-economic analysis of autotrophic microalgae for fuel production. Applied Energy. 88 (10), 3524-3531 (2011).
- Jones, S., et al. Process design and economics for the conversion of algal biomass to hydrocarbons: whole algae hydrothermal liquefaction and upgrading. U.S. Department of Energy Bioenergy Technologies Office. , (2014).
- Lundquist, T. J., Woertz, I. C., Quinn, N. W. T., Benemann, J. R. A realistic technology and engineering assessment of algae biofuel production. Energy Biosciences Institute. , Berkeley, CA. (2010).
- Nagarajan, S., Chou, S. K., Cao, S., Wu, C., Zhou, Z. An updated comprehensive techno-economic analysis of algae biodiesel. Bioresour Technol. 145, 150-156 (2011).
- Pienkos, P. T., Darzins, A. The promise and challenges of microalgal-derived biofuels. Biofuels Bioproducts & Biorefining-Biofpr. 3, 431-440 (2009).
- Richardson, J. W., Johnson, M. D., Outlaw, J. L. Economic comparison of open pond raceways to photo bio-reactors for profitable production of algae for transportation fuels in the Southwest. Algal Research. 1 (1), 93-100 (2012).
- Rogers, J. N., et al. A critical analysis of paddlewheel-driven raceway ponds for algal biofuel production at commercial scales. Algal Research. 4, 76-88 (1016).
- Sun, A., et al. Comparative cost analysis of algal oil production for biofuels. Energy. 36 (8), 5169-5179 (2011).
- Thilakaratne, R., Wright, M. M., Brown, R. C. A techno-economic analysis of microalgae remnant catalytic pyrolysis and upgrading to fuels. Fuel. 128, 104-112 (2014).
- Quinn, J. C., et al. Nannochloropsis production metrics in a scalable outdoor photobioreactor for commercial applications. Bioresour Technol. 117, 164-171 (2012).
- Borkenstein, C., Knoblechner, J., Frühwirth, H., Schagerl, M. Cultivation of Chlorella emersonii with flue gas derived from a cement plant. J Appl Phycol. 23 (1), 131-135 (2010).
- Douskova, I., et al. Simultaneous flue gas bioremediation and reduction of microalgal biomass production costs. Appl Microbiol Biotechnol. 82 (1), 179-185 (2009).
- Israel, A., Gavrieli, J., Glazer, A., Friedlander, M. Utilization of flue gas from a power plant for tank cultivation of the red seaweed Gracilaria cornea. Aquaculture. 249 (1-4), 311-316 (2012).
- Napan, K., Teng, L., Quinn, J. C., Wood, B. Impact of Heavy Metals from Flue Gas Integration with Microalgae Production. , Algal Research. (2015).
- Eaton, A. D., Clesceri, L. S., Rice, E. W., Greenberg, A. E. 3125B. Inductively coupled plasma/mass spectrometry (ICP/MS) method. Standard methods for the examination of water and wastewater. , (2005).
- Eaton, A. D., Clesceri, L. S., Rice, E. W., Greenberg, A. E. Standard methods for the examination of water and wastewater. , APHA-AWWA-WEF. (2005).
- Matrix effects in the ICP-MS analysis of selenium in saline water samples. Smith, M., Compton, J. S. Proceedings of the 2004 Water Institute of Southern Africa Biennial Conference, Cape Town, South Africa, , (2004).
- Mehta, S. K., Gaur, J. P. Use of algae for removing heavy metal ions from wastewater: progress and prospects. Crit Rev Biotechnol. 25 (3), 113-152 (2005).
- EPA, U. Method: 200.8: Determination of trace elements in waters and wastes by inductively coupled plasma - mass spectrometry. , (1994).
- Eaton, A. D., Clesceri, L. S., Rice, E. W., Greenberg, A. E. 3120B. Inductively coupled plasma (ICP) method. Standard methods for the examination of water and wastewater. , (2005).
Tags
Environmental Sciences alger tungmetaller,Get cutting-edge science videos from JoVE sent straight to your inbox every month.









