Abstract
增加了对可再生燃料的需求有研究者研究的替代原料如微藻的可行性。固有的优点包括高产量的潜力,利用非耕地和集成废物流。大规模微藻生产系统的营养需求将需要栽培系统具有工业废物资源,如二氧化碳从烟道气和从废水中养分的耦合。存在于这些废物无机污染物有可能导致生物蓄积在微藻生物生产力和限制终端使用产生负面影响。本研究着重于影响的实验评估和14无机污染物(砷,镉,钴,铬,铜,汞,锰,镍,铅,锑,硒,锡,钒和锌)的微绿球藻生长的命运。微藻分别在生长米栽培在光生物反应器照射在984微摩尔米-2秒-1,并保持在pH7EDIA污染与无机污染物的水平预期基础上,商品煤烟气系统中的组成。存在于生物质并在7天的生长周期结束的介质污染物通过冷原子吸收光谱法解析量化汞,并通过电感耦合等离子体质谱法对砷,镉,钴,铬,铜,锰,镍,铅,锑,硒,锡,钒和锌。结果显示N.藻是一个敏感的应变与生物量的统计减少yieldwith引入这些污染物的多金属环境。这里介绍的技术是足够用于量化藻类生长和确定无机污染物的命运。
Introduction
相比传统的陆地作物微藻已经示出实现由于固有较高的太阳能转换效率1,2-更高的生物量和脂质的产量。培养微藻以高的生产率,需要各种营养素,包括外部碳源的供应。据预计,大规模增长设施将与工业废物流如工业烟道气被集成,以尽量减少生产成本,并在同一时间提供环境整治。工业废弃物的碳通常以气态二氧化碳的形式,并且可以包含有潜力微藻生产产生不利影响的污染物。具体地,从煤衍生的烟道气会产生多种污染物,包括但不限于燃烧产物水和二氧化碳,以及硫和氮,细尘,有机污染物如二恶英和呋喃的氧化物和无机CON组taminants如重金属。大部分这些污染物包括无机物其中一些被称为上微藻生产率重金属的影响还没有被探讨。一些这些元素可以是营养物的适当浓度,但是在较高浓度下它们能产生细胞功能障碍,甚至死亡3。
微藻工业烟道气的集成有直接引入无机污染物进入生长介质的潜力。基于煤烟气具有多种无机元素( 如砷,镉,钴,铬,铜,汞,锰,镍,铅,锑,硒,锡,V和Zn)在不同浓度的其中一些,在低浓度,代表营养微藻生长。无机污染物有一个高亲和力结合微藻,并进一步通过养分转运内部吸附。有些无机污染物( 即钴,铜,锌和锰)是构成酶的组成部分营养素涉及d。在光合作用,呼吸作用等功能3,4。但是,在过量金属和准金属可能是有毒的。其它元素,如铅,镉,锡,锑,硒,砷,汞,不知道以支持细胞功能的任何浓度和代表非营养金属可能培养生长3,5,6负面影响。任何这些污染物的存在具有产生对微藻细胞功能的负面影响的可能性。此外,多种金属与微藻的相互作用复杂增长动力,并有可能影响增长潜力。
大规模的经济已直接关系到培养体系7-19的生产力。此外,因为它代表了99.9和99.4%质量的,分别为20在为任一开放轨道池塘(ORP),或光生物反应器的微藻生长系统(PBR)介质再循环是至关重要的。无机污染物在媒体的存在可能最终限制了米icroalgae生产力和媒体因污染物积聚的回收利用。本研究实验确定的14无机污染物的影响(如,镉,钴,铬,铜,汞,锰,镍,铅,锑,硒,锡,钒和锌)中,在从微藻培养系统的集成预期浓度与煤衍生的烟道气,在N的生产率藻生长在空运PBRS。在这项研究中所用的污染物已被证明不仅存在于煤基烟气但市政废物基烟道气,生物固体基烟道气,城市废水,产生的水,受损的地下水和海水21-23。在这项研究中使用的浓度是基于所预期如果微藻生长系统进行集成了煤基CO 2源与吸收效率在商业PBR系统20证实。详细的计算支持重金属和无机污染物的浓度在Napan呈现等人 24的分析技术被用来理解多数在生物量,媒体和环境的金属的分布。介绍的方法使微藻的生产潜力的评估下,无机污染物的压力和他们的命运结束量化。
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1.成长系统

图1.微藻生长系统。(A)空气转子流量计,(B)CO 2转子流量计,(C)与电磁pH值控制器,(D)数据记录仪,(E)在线空气过滤器,(F)空气分配头, (G)荧光灯银行(H)pH计,( 我 )冷却系统,(J)水浴,(K)热电偶丝,(L)的空气升式光,(M)加热器,(N)步入式油烟油烟机,(O)发泄,(P)空气输送毛细管(Q)空气过滤器,(R)采样管,(S)PBR硅胶盖子,(T)pH值以及有机硅盖。 请点击此处查看该图的放大版本。
- 构建以下微藻实验生长系统( 图1)。
- 获得12空运PBRS自由玻璃管式反应器直径4.5厘米和80厘米的高度为1.1升的培养能力用硅酮盖子。获得预切玻璃毛细管10厘米(每PBR 3)和85厘米(1%PBR)长管(5毫米外径和1mm内径)。
- 冻结硅盖在-80℃的冰柜。润滑钻头与甘油,虽然盖被冻结钻3个孔主办的发泄,取样和气体输送的毛细管,和1孔17毫米直径主办pH探头。
- 插入到位3细管从PBR的底部延伸2厘米最长管。在另一毛细管添加硅管的WiTH附连到延伸到一个所需的采样点的另一端的毛细管。覆盖孔的pH计用硅酮塞子尺寸21D。
- 加湿环境空气通过水起泡,并提供加湿空气的空气分配头。通过0.2微米的过滤器通过气体并通过最长玻璃输送毛细管输送到藻类悬浮液。
- 为了保持为7.0±0.1的培养悬浮液中性pH释放压缩的CO 2进入加湿空气流。控制二氧化碳交付自动化的CO 2配药系统(pH值控制器)的速度打开一个磁线圈,当藻类培养pH值达到7.1,并关闭在pH值为6.9。
- 提供使用24 T5是导致984微摩尔米-2秒-1类似峰值户外条件下的平均照明荧光灯光。
- 沉浸要想在水浴中PBRS到maintain大约25℃的恒定温度。通过使用再循环冷却器和自动加热循环水浴单元控制控制系统的温度。
- 监测温度和pH在实时和与数据记录器记录。
- 确保微藻生长系统的所有组件都正常工作,特别是收获前微藻接种或准备无机污染物,因为它们不能被保存下来。
2.实验室制备洁具
- 洗净容量瓶,PBRS,这些瓶子和任何容器,用肥皂和自来水。用去离子水冲洗(DW)。
- 酸冲洗实验室器皿,以消除无机污染物的任何痕迹。这可以通过以下两种方式之一:
- 泡实验室器皿O / N在10%痕量金属级硝酸(注意:不要呼吸油烟,浓硝酸会产生剧烈燃烧和有毒烟雾,工作在通风呼D使用丁腈手套,护目镜和白大褂)。
- 浸泡实验室器皿在50%痕量金属级硝酸15分钟。
- 冲洗该实验室器皿与DW彻底的至少3倍,确保所有的酸被去除。至关重要的是,PBRS被彻底清洗,尤其是取样管和毛细管。如果不这样做会产生增长中,可能抑制酸化。测试的冲洗水,以验证所有酸的pH值已被删除。
- 通过高压灭菌它们在120℃和标准大气压下进行至少30分钟灭菌PBRS,容器和瓶。
3. N.藻介质制备工艺
- 配制溶液A:部分补1升量瓶中,用DW。插入一个磁性搅拌棒并加入之后,另一个在表1示出一个的化学物质。确保每个成分溶解在加入下一组分之前。取下磁铁和第填写Ë瓶1升容积的标记。
| 零件 | 添加量(G) | 终浓度(g / L)的 |
| H 3 BO 3 | 0.900 | 0.900 |
| 娜2的MoO 4·2H 2 O | 0.012 | 0.012 |
| 氯化锰2·4H 2 O | 0.300 | 0.300 |
| 硫酸锌4·7H 2 O | 0.060 | 0.060 |
| 硫酸铜4·5H 2 O | 0.020 | 0.020 |
表1:溶液A配方量是需要的1升的浓缩液的制备量。
- 制备维生素解决方案:在三个独立的卷umetric烧瓶通过无菌0.2μm的注射器过滤器中添加维生素如表2所示,过滤每种维生素溶液到无菌容器中。维生素保存在-4℃,在黑暗中。
| 维生素 | 量(mg) | 最终体积(毫升) | 最终维生素浓度(mg / L)的 |
| 生物素 | 12.22 | 500 | 24.43 |
| 维生素B12 | 13.50 | 100 | 135.00 |
| 盐酸硫胺 | 977.63 | 500 | 1,955.27 |
表2:维生素液配方量是需要集中SOLU编制数额化。
- 部分填补了20升高压灭菌容器与DW,并插入一个磁力搅拌棒。放置在磁力搅拌器上板的顶部的容器,并添加表3(除维生素)中所示的化学物质,在其他以后和之后每个完全溶解逐一添加。填充容器达到20 L.
| 零件 | 量添加到介质 | 单元 |
| 氯化钠 | 350.00 | G |
| 氯化钙2·2H 2 O | 3.00 | G |
| 氯化钾 | 9.60 | G |
| 娜2的SiO 3·9H 2 O | 1.14 | G |
| 硫酸镁4·7H 2 O | 29.60 | G |
| 20.40 | G | |
| 磷酸二氢钾 | 1.36 | G |
| 柠檬酸铁铵 | 0.10 | G |
| 解决方法A | 20.00 | 毫升 |
| 生物素溶液* | 818.00 | 微升 |
| 维生素B12的解决方案* | 296.20 | 微升 |
| 盐酸硫胺液* | 521.60 | 微升 |
| *加入灭菌冷却介质 |
表3:N。藻培养基配方。量是需要的20升营养丰富培养基的制备量。
- 消毒通过高压灭菌的培养基30分钟,在120℃和大气压力。让媒体COO升至RT。
- 将容器放在磁力搅拌器上板。添加在步骤3.2准备的维生素和让媒体充分混合。
4.无机污染物备料
- 部分地填充表4所示用DW的容量瓶并添加所列的单个的盐。用DW到所需的最终体积填充调匀。不保留这些股票的一些元素吸附到墙壁烧瓶
注意:在本协议中使用的几种无机污染物具有致癌,致畸,致突变,盐处理时戴口罩,手套和白大褂。
| 分析 | 盐源 | 库存量准备(L) | 盐添加到烧瓶60; (毫克盐) | 分析物浓度加入到培养物(毫克被分析物/ L)的 |
| 如 | NaAsO 2 | 0.1 | 14.8 | 7.74E-02 |
| 光盘 | 氯化镉 | 0.5 | 13.5 | 1.50E-02 |
| 联合 | 氯化钴2·6H 2 O | 0.5 | 34.7 | 1.56E-02 |
| 铬 | 娜2的Cr 2 O 7·2H 2 O | 0.1 | 40.6 | 1.29E-01 |
| 铜 | 氯化铜2·2H 2 O | 0.1 | 38.3 | 1.30E-01 |
| 汞 | 升汞 | 1.0 14.6 | 9.80E-03 | |
| 锰 | 氯化锰2·4H 2 O | 0.1 | 58.8 | 1.49E-01 |
| 倪 | 氯化镍2·6H 2 O | 0.1 | 112.0 | 2.51E-01 |
| 铅 | PBCL 2 | 0.5 | 39.9 | 5.41E-02 |
| SB | 锑2 O 3 | 0.5 | 26.7 | 4.06E-02 |
| 硒 | 娜2 3的SeO | 0.5 | 11.8 | 9.80E-03 |
| 锡 | 氯化亚锡2·2H 2 O | 0.5 | 3.9 | 3.76E-03 |
| V | V 2 O 5 | 0.1 | 22.2 | 1.13E-01 |
| 锌 | 氯化锌 | 0.1 | 99.9 | 4.36E-01 |
表4:将浓无机污染物备料加成1ml该浓缩储到1.1升的PBR介质产生在最后一列中所示的最终浓度。
- 通过使溶液通过无菌0.2μm的注射器过滤器消毒的无机污染物股票和在无菌管收集滤液。
5. N.藻生产菌种
- 在500ml锥形瓶中加入200毫升培养基的第3步中制备,然后加入3克琼脂。用铝箔覆盖和高压釜的烧瓶20分钟,在120℃。将溶液倒入无菌培养皿,让它冷却直至固化。这应该是一个无菌罩,或者至少在一个干净的环境,减少污染的风险火焰接近完成。
- 连胜N.藻细胞在培养皿无菌-DISHES使用无菌播种循环制备步骤5.1。将培养皿培养上照射保持在RT T12灯的表。让微藻生长,直到菌落可见。
- 转移殖民地无菌莫名其妙含有200ml营养丰富的培养基的制备步骤3和保持他们在被照亮的振动台(1000 RPM)锥形瓶中。让文化发展中,直到变成绿色。
- 微藻转移到1.1升无菌PBR。将PBR中的种菌水浴通过再循环冷却器和自动加热循环水浴控制照射在200微摩尔米-2秒-1与T8荧光灯的灯光,并保持在23℃。调节空气和CO 2转子流量计到2.5升分钟-1和25毫升分钟-1。
- 一个星期的生长分裂生物质转化成含新介质新1 0.1 L PBRS后,让它生长,直到总共至少28克干重生物量在两个反应器,可以通过光密度测定之间获得。
- 使用无菌离心瓶中并无菌操作技术,以避免污染,在10℃下收获了接种物的生物质通过离心在2054×g的15分钟。处置上清液并根据需要继续细胞浓度。
- 一旦所有的生物质被离心,重新悬浮在300毫升的新鲜无菌培养基中的细胞。
- 稀0.1毫升微藻培养物在3ml的DW,然后稀释将0.1ml此新溶液在3毫升的DW。确保样品充分混合。测量微藻浓缩物的光密度(OD)为750纳米()立即使用分光光度计。
- 使用等式(1)来确定在所述浓缩生物量的量。
注意:公式(1)中由线性回归获得的相对于总悬浮固体(以g / L-1)为N.萨利纳 (R 2 = 0.9995)。公式1为SPECTR被开发ophotometer模式在材料表,如果使用其他型号的分光光度计产生一个新的校准。- 使用等式(2)计算微藻浓缩物(以L)的容积需要获得在PBR 1.1升的体积(L中)4克/升-1培养密度。
- 利用无菌操作技术,添加微藻的体积浓缩发现,在步骤5.9至高压灭菌的PBR达到4克/升-1的初始培养物密度。填写PBR中到1.1 L.重复此步骤,直到6 PBRS接种。放置在接种水浴的PBRS。
- 让在PBRS微藻生长8天,然后收获生物量(通过重复步骤5.6至5.7)。重复步骤5.8计算初始接种量为1克/升-1的初始培养物密度。
6.实验堆
- 利用无菌操作技术添加约1升,在步骤3到每个12酸漂洗无菌PBRS的制备培养基。放置PBRS在实验生长系统的水浴中。打开喷雾在空气中,在1.5升分钟-1。
- 通过用70%乙醇清洗它消毒一个校准的pH计。测量在PBR的培养基的pH,确保pH为约7.0;如果不是,重复步骤2除去酸从酸洗工序浸出。
- 校准用缓冲液pH 7各pH控制器,用乙醇(70%)消毒探针,然后在PBRS盖子插入。
- 每个PBR(除控制PBRS)加入1 ml每个准备步骤4.让污染物在PBR调匀无菌无机污染物的股票。在PBRS无机污染物的最终浓度是显示N的表4中的最后一列,并且所估计的最大浓度从燃煤电厂一体化的预期。
- ,增加14毫升无菌的DW到控制PBRS。
- 添加在步骤5.11的实验PBRS获得的浓缩微藻接种,以获得为1g / L-1的初始培养物密度。彻底让生物质混合。
- 打开高光强灯(984微摩尔米-2秒-1),pH值控制器和调整的CO 2〜30毫升分钟1。增加的CO 2流50毫升分钟-1从第3天之后。初始低的CO 2流速,以避免大的变化的pH临界由于在气/液转移和pH测量延迟。
- 测量,并根据需要采取样品。请务必标明取样后水位。 (注意:在一些PBR无机污染物具有致癌,致畸,致突变;使用手套和CAPP处理ED容器时,样品)。
- 每日添加无菌DW到PBRS以补偿由于蒸发损失。
- 经过7天生长,收获的生物质通过离心在9936×g下和保持二者,生物质和上清液介质,在-80℃下。
- 冷冻干燥的生物量在0.1毫巴和-50°CO / N。粉末的生物量(用刮刀粉末的生物质的离心管内)。保存冷冻干燥的生物质在-80℃下。
7.微波样品消解
生物质样品的消化需要作为用于ICP-MS分析的预处理步骤。
注意:这些步骤使用封闭容器微波消解系统与控制泄压。 (注意:高压酸消化过程中培养,考察的消解罐和盾牌的物理完整性,并在每次使用前重塑微波消解容器盖)。
- 洗铁氟龙微波消解罐用肥皂和水,用清水冲洗DW,让血管风干。如在以下步骤中所述以除去痕量金属污染的容器消化酸。
- 重塑微波消解罐的盖子,并关闭瓶紧紧地。
- 加入10 ml硝酸每个。
- 介绍在安全防护罩的容器中。确保没有生物质,水或任何试剂留在安全防护罩的壁或在溶出容器的外壁上,以避免损坏的安全防护罩。帽与安全阀确保在管形瓶中的弹簧是齐平的安全防护罩。定位在转子的护罩与盖喷口指向外侧的外排和向内的内部行。
- 上容器头号,插入陶瓷热电偶和温度传感器。此温度计监视在小瓶的实际内部温度,并作为控制参数执行消化PROGR是。确保小瓶头号包含相同的样品和试剂量为其他小瓶。
- 表5中所示的输入消化参数并启动消化。当程序完成后,空气冷却所述小瓶直到它们达到室温。
| 步骤 | 冲洗瓶 | 样品消解 | ||||
| 温度(℃) | 时间(min) | 最大。功率(W) | 温度(℃) | 时间(min) | 最大。功率(W) | |
| 1 | RT 190 | 25 | 1000 | RT 180 | 15 | 1000 |
| 2 | 190 | 10 | 1000 | 180 | 15 | 1000 |
| - | 20 | - | - | 20 | - |
表5:在微波消解程序使用的参数。
- 内部通风橱中,插入与盖通风口防护罩泄压工具从你远点。一旦压力被释放打开盖子(注意:通风柜内始终打开小瓶消化生物质能以来使用的消化产生的酸性有毒烟雾)。
- 处置酸。冲洗的聚四氟乙烯容器用DW 3倍。让小瓶空气干燥。
- 消化量,添加50毫克冷冻干燥的生物质微波消解罐。对于质量控制(QC)准备以下瓶:在两个不同的小瓶中添加任何5毫升7级的ICPMS或5毫升7级汞CVAAS标准步骤9.1和10.1(消化从这个小瓶溶液制备被称为强化实验室空白(LFB)),离开另一个小瓶空(消化解决方案从该小瓶被称为实验室试剂空白(LRB))。
- 消化中,加入10 mL上清液中干酸冲洗微波消解罐。对于质量控制(QC)准备以下小瓶:在两个不同的小瓶添加5毫升等级7 ICPMS或CVAAS金属标准在步骤9.1和10.1(从该管形瓶中的消化溶液称为LFB)制备的另一个小瓶中添加10毫升的DW(从该管形瓶中的消化溶液称为LRB)。
- 重塑微波消解罐的盖子,并关闭瓶紧紧地。
- 加7毫升浓痕量金属级硝酸和3ml过氧化氢向每个小瓶。通过轻轻涡旋将溶液均质化的内容。重复步骤7.4至7.7(使用表5为样品消解微波消解参数)消化小瓶的内容。
- 消化的样品添加到25毫升容量瓶中,漂洗用DW的船只回收率增加。填写量瓶中,用DW至刻度。
- 转移消化样品加盖容器中。保存的样品在4℃下直到分析就可以完成。在这项研究中分析完成当天为Hg和内为其他元素三天。
8.质量控制(QC)样品
注:为了确保从实验样品的结果的可靠性分析QC样品。
- 部分填补冲洗1升量瓶中,用DW酸。添加280毫升集中痕量金属级硝酸调匀(该解决方案也被称为空白溶液)(注意:永远加酸的水,切勿将水加入酸为放热反应可以暴)。让我们的解决方案冷却至室温。
- 除了步骤7.9和7.10准备QC样品,准备下面的QC样品。
- 对于持续的校准验证(CCV):填写与校准标准聚苯乙烯管(制法见步骤9.2和10.1)。戴上CVAAS机架和ICPMS在ICPMS自动进样器标准溶液的汞标准溶液。
- 对于连续校准空白(CCB):填充2聚苯乙烯试管(16毫升)与空白(步骤8.1制得的溶液)。放置在机架CVAAS一个样本,并在自动进样器ICPMS其他样本。
- 为实验室强化基质(LFM):随机选择每12个样品的每个类型的样品( 即,生物质或介质)的1个采样,并用它来 制备LFM。对于ICPMS,0.5毫升等离子体质谱标准7级和3ml消化实验样品(来自生物质或介质),以聚苯乙烯管。
- 混合内容并将小瓶上的ICPMS自动进样器。对于CVAAS,加入2ml汞标准7级和6ml消化实验样品(来自生物质或介质),以聚苯乙烯管。混在CVAAS机架内容和工作地点的小瓶。
- 对于重复样本:随机选择1过采样Y 12样品为每个类型的基质( 例如,生物量,介质,线性调频或任何稀释矩阵)和重复的小瓶。放置在自动进样器ICPMS或CVAAS机架反复小瓶。
- 对于重复样本:随机选择每12样本为每种类型的基质( 如生物,中,LFM或稀释矩阵)的1样品和复制的小瓶。放置在自动进样器ICPMS或CVAAS机架反复小瓶。
- 定义数据质量标准的研究。对于目前的研究复制伊顿,Clesceri,赖斯和格林伯格25所确定的质量标准。建立了质量控制的参数是:百分差(%D)用于CCV在±10%25(与异常铅,锑,见讨论)在±70-130%25,LFB回收率(%R),LFM百分之回收率(%R)的内75-125%25,和相对百分比差(RPD)在±20%25,和一个持续钙振动空白(CCB)下面的方法报告限(MRL)25。见计算公式在步骤9.7。
9.量化电感耦合等离子体质谱(ICPMS)
- 在分析当天,大约转移消化的样品5毫升聚苯乙烯管,并将其放置在自动进样器ICPMS。加入约15毫升消化样品到聚苯乙烯管,并将其放置在机架CVAAS。
- 分析当天准备的校准标准。加购ICPMS标准溶液和填充用如表6所述坯件(在步骤8.1制得的溶液)(见材料表标准溶液的描述),以酸漂洗容量瓶。
| 参数 | 等级1 | 2级 | 3级 | 4级 | 5级 | 6级 | 7级 |
| 要添加购买标准(毫升) | - | - | - | - | - | - | 10.0 |
| 级7被添加(毫升) | 0.0 | 1.0 | 2.5 | 5 | 20.0 | 25.0 | - |
| 最终体积*(毫升) | - | 50.0 | 50.0 | 50.0 | 100.0 | 50.0 | 100.0 |
| 终浓度(微克/升) | |||||||
| 75作为 | 0.0 | 2.0 | 5 | 10.0 | 20.0 | 50.0 | 1000.0 |
| 111镉 | 0.0 | 1.0 | 2.5 | 5 | 10.0 | 25.0 | 50.0 |
| 59联合 | 0.0 | 10.0 | 25.0 | 50.0 | 100.0 | 250.0 | 500.0 |
| 52铬 | 0.0 | 2.0 | 5 | 10.0 | 20.0 | 50.0 | 100.0 |
| 63铜 | 0.0 | 5 | 12.5 | 25.0 | 50.0 | 125.0 | 250.0 |
| 55锰 | 0.0 | 3.0 | 7.5 | 15.0 | 30.0 | 75.0 | 150.0 |
| 60镍 | 0.0 | 8 | 20.0 | 40.0 | 80.0 | 200.0 | 400.0 |
| 208铅 | 0.0 | 1.0 | 2.5 | 5 | 10.0 | 25.0 | 50.0 |
| 121锑 | 0.0 | 12.0 | 30.0 | 60.0 | 120.0 | 300.0 | 600.0 |
| 51V时 | 0.0 | 10.0 | 25.0 | 50.0 | 100.0 | 250.0 | 500.0 |
| 66锌 | 4 | 10.0 | 20.0 | 40.0 | 100.0 | 200.0 | |
| *通过增加在步骤8.1准备的解决方案实现此卷 | |||||||
表6:校准标准浓度 1至7。
- 从等离子体质谱取出锥体和超声处理他们在DW 1分钟。干燥筒,并把它们放回仪器。
- 放水冷却器,气体(氩,H 2,他)中,ICPMS,插头线内标,并填写自动取样漂洗容器(DW中,10%的硝酸,1%硝酸+ 0.5%盐酸) 。
- 打开MassHunter工作站软件并打开等离子,调整ICPMS和加载设置参数表7中的方法。
| 参数 值 | |||||||||
| 内部标准 | 72葛,115 | ||||||||
| 射频功率 | 1500W¯¯ | ||||||||
| 等离子体气体的流量 | 14.98 | ||||||||
| 雾化气流速 | 1.1升/分钟(载体和稀释气体相结合 - 0.6 + 0.5升/分钟) | ||||||||
| 采样锥 | 镍对于x镜头 | ||||||||
| 截取锥 | 镍 | ||||||||
| 样品提升速度 | 0.3 RPS | ||||||||
| 雾化泵 | 0.1 RPS | ||||||||
| S / C的温度 | 2℃ | ||||||||
| 扫描条件 | 停留时间1秒,重复3号 | ||||||||
| H 2气体流量 | N / A | ||||||||
| 他气体流 | 4.3毫升/分钟 | ||||||||
| 参数 | 等级1 | 2级 | 3级 | 4级 | 5级 | 6级 |
| 要添加L7汞柱标准(毫升) | 0 | 1 | 2.5 | 五 | 20 | 25 |
| 最终体积*(毫升) | - | 50 | 50 | 50 | 100 | 50 |
| 终浓度(微克/升) | 0 | 0.5 | 1.25 | 2.5 | 五 | 12.5 |
| *通过增加在步骤8.1准备的解决方案实现此卷 | ||||||
表8:汞校准标准浓度为1〜6。
- 打开氩气和空气阀,打开原子Absorp化分光光度计及流动注射原子光谱(FIAS)。打开CVAAS WINLAB软件,打开汞灯,让它热身,直到该软件的能量参数达到79.加载程序与表9的参数汞分析,调整仪器的光路给予最大的透射率。
| 参数 | 值 |
| 载气 | 氩气,以100ml /分钟 |
| 灯 | 汞无极灯,安装在185毫安 |
| 波长 | 253.7纳米 |
| 裂缝 | 0.7纳米 |
| 电池温度 | 100℃ |
| 样品量 | 500微升 |
| 支架 | 3%的HCl,9.23毫升/分钟 |
| 还原剂 | 10%的SnCl 2,5.31毫升/分钟 |
| 测量 | 峰高 |
| 重复阅读 | 3 |
表9:CVAAS操作条件。
- 插线制成的3%痕量金属级盐酸的载体溶液。
- 插线制成的10%的氯化亚锡(适合汞柱分析)在3%痕量金属级盐酸的还原剂溶液。准备这个解决方案的分析的同一天,很容易产生大气氧化(注意:氯化亚锡是非常危险的,它工作时使用防护服收集废CVAAS危险遏制和妥善处置。)。
- 放置汞标准,QC样品和实验样品中的CVAAS齿条和输入序列中的CVAAS WINLAB软件。运行标准,并生成校正公式。
- 运行QC SAM普莱斯和实验样本。所述CVAAS绘制约5 ml样品的插入仪器,降低汞存在于样品为元素汞(汞0)气体中和从在一个封闭的系统与载气(Ar)的溶液中清除的气体。的汞蒸气通过在Hg灯的光路的细胞传递。探测器确定吸收在253.7nm的光,它关联到的浓度。 (注意:汞蒸气有毒,确保仪器排气罩到位)。
- 计算%R,%D和RPD在分析过程中的步骤9.7,并比较结果到项目数据质量标准。
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
生物质产量
生产的N.藻在本研究中使用的PBR系统增长为1克/升-1至8.5±0.19克/升-1(N = 12),用于控制反应器和4.0±0.3克/升-1(N = 12)的多金属污染的7天。实验横跨一式三份反应器和多批次产生可重复的数据。 图2A示出的平均培养密度与基于来自三个独立PBRS采样非常小的标准误差。为了确保这一结果并不是一个孤立的结果,三个批次的生长有类似的结果。将合并的结果为所有四批示于图2B。虽然生物变异存在,这项研究表明,有无机污染物到N的一个一致的负面影响藻生产。在污染物暴露PBRS生物质产率有统计学差异,以从控制PBRS2日起(ANOVA,P <0.05)。
无机污染物的量化质量控制评估
分析了14种元素的十二得到充分消化后,可作为所示的LFB%R接近100%%R,表示没有损失,没有收益,分析物的消化( 表10)期间,无交叉污染。在样品%D和RPD的定量分析是通过所有分析和结果的平均值监视示于表10。砷,镉,钴,铬,铜,汞,锰,镍,铅,锑,V和Zn中传递在%D和RPD,但是%D的铅,锑在分析过程中逐渐下降。的%D为这些元素锥形清洗后得到改善,但是,恒定锥形清洗是不切实际的,因此,对于Pb和Sb的数据质量目标得以降低。建行的所有分析物也低于最高残留限量。基体效应通过分析LFM样品和获得的%R评估。 W¯¯往往微不足道有限公司,汞,V和Sb通过QC数据标准,它不是由砷,镉,铬,铜,锰,镍,铅,锌,当通过生物消化样品进行了分析,结果在下面的QC目的%R。在DW基质稀释到1:3的比例(溶质:溶剂)导致该传递的数据质量标准的%R。消化的上清液的分析过程中也观察到基质效应和由相同的稀释比率( 表10),确保稀释没有损害的仪器的检测极限被解决。与硒和锡的检测问题的基础上读数不稳定和污染问题进行观察,分别。不稳定的读数硒是由于盐中的矩阵27。的锡污染物被追溯到在消化步骤中使用的酸。
| 分析 | R | CCV | LFB | LFM生物质样品 | LFM的上清液样品 | ||||
| %D | %R | 稀释比例 | %R | RPD | 稀释比例 | %R | RPD | ||
| QC限制25 | 0.9950 | ±10 | 70-130 | - | 75-125 | ±20 | - | 75-125 | ±20 |
| 如 | 0.9998 | 1.8 | 101.0 | 1:3 | 100.4 | 5.2 | 1:3 | 92.5 | -0.5 |
| 光盘 | 1.0000 | 1.4 | 102.6 | 1:3 | 103.5 | 4.6 | 无 | 92.3 | 0.6 |
| 联合 | 0.9997 | 1.7 | 98.8 | 无 | 95.2 | -1.4 | 无 | 96.5 | -1.5 |
| 铬 | 0.9999 | 1.5 | 99.8 | 1:3 | 96.5 | 1.8 | 1:3 | 90.1 | -0.8 |
| 铜 | 0.9999 | 2.9 | 98.2 | 1:3 | 101.4 | 4.8 | 1:3 | 94.4 | -0.5 |
| 汞 | 0.9983 | -1.7 | 103.0 | 无 | 98.7 | 1.5 | 无 | 98.0 | 0.3 |
| 锰 | 0.9998 | 2.9 | 97.6 | 1:3 | 83.2 | 1.8 | 1:3 | 95.4 | -1.7 |
| 倪 | 0.9999 | 103.5 | 1:3 | 98.5 | 2.1 | 无 | 93.3 | -0.9 | |
| V | 0.9998 | 2.5 | 97.2 | 无 | 95.5 | -1.5 | 无 | 101.2 | -1.9 |
| 铅 | 0.9998 | 12.6 | 105.2 | 1:3 | 88.9 | 0.0 | 无 | 93.5 | -0.5 |
| SB | 0.9998 | 1.1 | 105.7 | 无 | 101.8 | -9.6 | 无 | 90.8 | -1.2 |
| 锌 | 0.9997 | 5.2 | 120.8 | 1:3 | 90.7 | 1.4 | 无 | 89.2 | -1.9 |
表10:质量控制样品的结果的总结 。 R = COrrelation系数,%D:差异百分比,%R:回收率,RPD =相对百分比差异,稀释比例是指溶质:溶剂比。
无机污染物浓度
重金属和无机污染物被发现在生物量和上清液中。在生物量分析了12个元素中发现的浓度示于图3。浓度的生物质从一式三份PBRS收获(N = 3)中分批#1显示了一个非常小的标准误差( 图3A)。从4批式三份PBRS结合数据一致地表明,无机污染物存在于生物量(N = 12)。在上清液介质中发现的浓度示于图4中 ,结果表明一式三份PBRS(N = 3)对于批次#1也具有小的标准误差( 图4A),并表明大多数污染物优先被设在生物质升eading到非常低的浓度在上清液与几个样品浓度接近仪器的MRL。结果来自所有四批示于图4B中 。
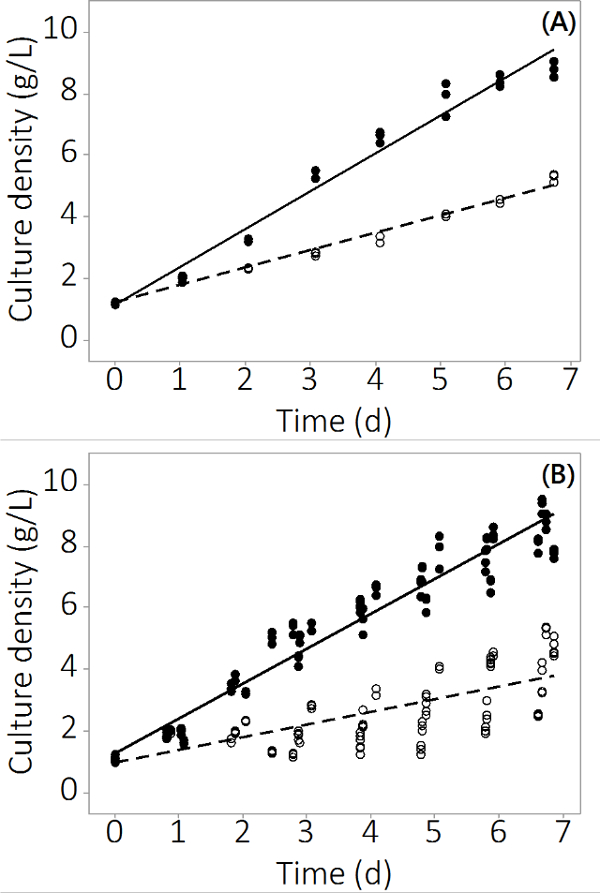
图2。çulture浓度在培养期间受污染和控制PBRS。在批次#1(A) 的培养密度,从N = 3 PBRS结果。在四批(二)文化密度,从n个结果= 12 PBRS。空圆圈代表被污染的生物质,实心圆圈代表控制。
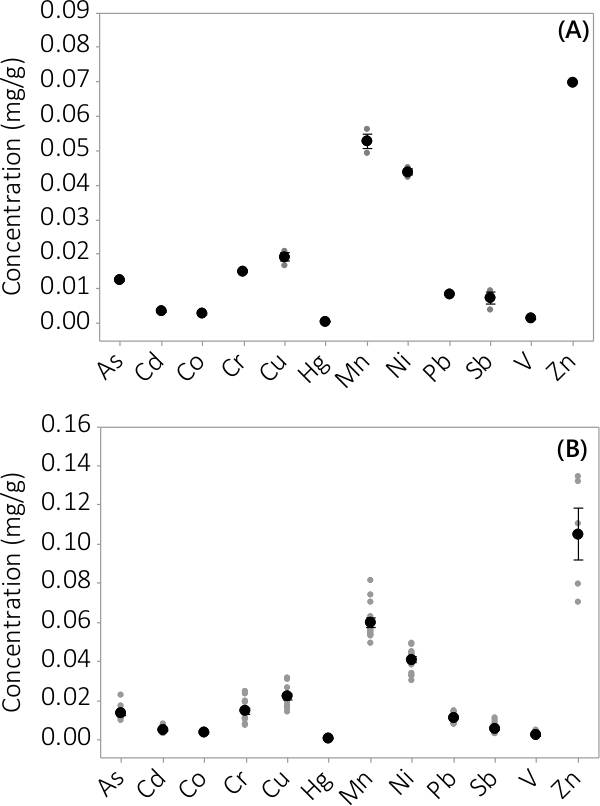
图3.集中在生物无机污染物(一 )批次中的浓度#1,结果从N = 1 PBR为锌和N = 3 PBRS所有其它分析物,(B)中从4个批次的浓度,从N = 4 PBRS为Zn和N = 12 PBRS对于所有其它分析物的结果。平均浓度由黑色实心圆表示,各个数据点是由灰色实心圆表示。误差线代表从平均值±1标准误差。
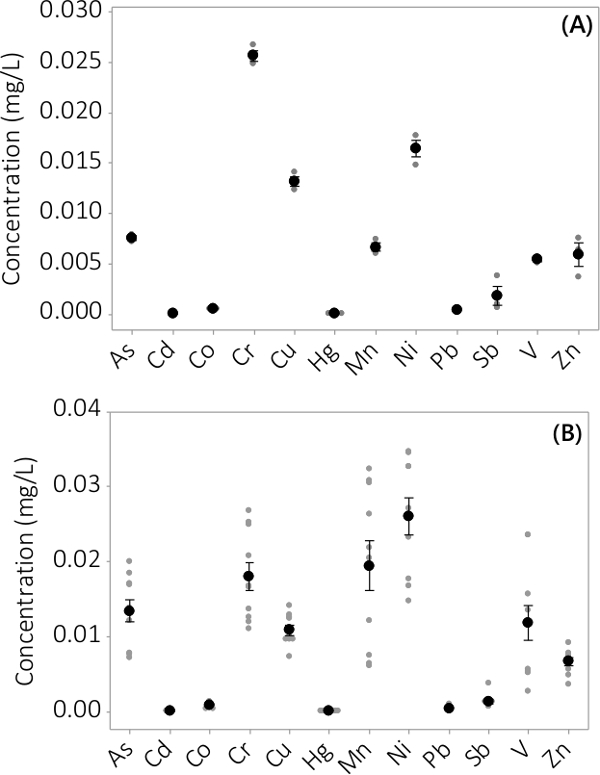
图4.浓度的上清液无机污染物。(A)的在批处理#1浓度,从N = 3 PBRS,(B)中从4个批次的浓度,从N = 12 PBRS结果的结果。平均浓度由黑色实心圆表示,各个数据点是由灰色实心圆表示。误差线代表从平均值±1标准误差。
Subscription Required. Please recommend JoVE to your librarian.
Discussion
盐水微藻N.藻可以成功地生长在设计的生长系统,可重复的结果和高生物量产量。空运混合允许以最小的沉降或生物结垢超过7天的生长周期的良好混合的悬浮培养。横跨荧光银行的最小光变性还被示为不产生在生长明显的差异。
该研究显示重金属浓度代表以煤烟气负面影响生物质生长的整合污染的介质。重复性的研究突出了多金属系统对生产力的影响。在这一过程中的各个步骤有可能产生负面影响生长和污染需要勤奋实验准备系统。在实验开始前的培养基的pH值的测定是QC步骤,允许核查该介质没有酸化( 例如,RESU不当PBR lting强酸浸泡后清洗)。酸化介质会影响藻类生长和改变营养生物利用度( 例如,在无机碳物种和金属形态的变化)从而影响藻类的结合位点,营养素和金属之间的相互作用。在实验室设备的这些研究的精心准备被要求,使得能够进行导入金属的准确质量平衡。在这个过程中的其他步骤都引入下落不明金属强调需要采用适当的级溶剂和化学品的可能性。适当的QC通过这个过程可以有效地识别引入重金属污染物。
结果表明引入的污染物分布在生物量( 图3),媒体( 图4)和环境之间。在收获N.发现无机污染物藻表明,这种微藻将incorporatê几个目前在烟气中的无机污染物。这同化可以吸附到细胞壁的结果,由于带电结合位点,吸收在细胞内由于代谢活性,并与存在于培养基中28种元素形成的络合物的沉淀。与对照相比,反应器的暗绿色视觉上后几天无机污染物反应器出现黄色。污染收获的生物质并非来自收割通过离心沉淀后形成后无污染的生物质能视觉上的不同。收获前的视觉色差是由于密度较低的生物质,并强调微藻。在生物质不除去污染物有如图4积聚在媒体的潜力。积累在媒体表示的电位,以限制标度媒体回收表示的必需品经济可行性。该限制将被决定由耐受这将是种特异性的重金属污染物。这项研究的结果强调有必要更好地理解整合微藻生长系统与废碳源潜在的负面影响,特别是煤基烟气。从本研究的结果突出了需要了解预计将存在于烟道气其它污染物的生产率的影响,如硫和氮,细小的灰尘和有机污染物的氧化物,例如多氯二苯并二恶英和二苯并呋喃。以前的TEA和LCA评估假设无缝集成,而不考虑污染物如重金属和生产率无机污染物的影响。一般从这项工作的结果强调了多金属系统对生产率的影响,并可以用来理解微藻的电位到bioremediate污染物。
该方法提出允许日无机污染物以可重复的结果微藻电子商务研究。在这个实验中使用的一些无机污染物在低浓度生长系统传统上发现,但其他人没有在细胞中的已知函数。其结果是砷,镉,钴,铬,铜,汞,锰,镍,铅,锑,硒,锡,钒和锌的浓度的多元素混合物示于表4抑制生长。量化在生物量的污染物的量可以证明在多金属系统具有挑战性。通常情况下,用有机物和盐的含量较高的样品可以产生基质干扰,多原子干扰,物理干扰和盐在锥体,最终导致不准确的读数和分析精度29,30损失积聚。质量控制样品与有助于确定读数的准确度和精密度的实验样品一起运行。使用本研究开发的协议分析物测量已证明是一个ccurate和精确的生产可接受的回收率都在为这种类型的研究25,29可接受的性能。通过微波炉样品消化,证实是有效的N.作为藻样品消化清晰,没有出现细胞碎片或不相混溶部分。在这个实验中(藻类生物量和人工海水)使用的矩阵生产的基质稀释法克服了基质干扰。然而,较高的生物样品的尺寸比在这个实验中使用的那些可能导致基质干扰,因此质量控制应为每个特定的方案进行分析。
Subscription Required. Please recommend JoVE to your librarian.
Materials
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| Sodium chloride | Fisher Scientific | S271-3 | |
| Calcium chloride dihydrate | Fisher Scientific | C79-500 | |
| Potassium chloride | Fisher Scientific | P217-500 | |
| Sodium meta silicate nonahydrate | Fisher Scientific | S408-500 | |
| Magnesium sulfate heptahydrate | Fisher Scientific | M63-500 | |
| Potassium nitrate | EMD Chemical | PX1520-5 | |
| Potassium phosphate monobasic | Fisher Scientific | P285-500 | |
| Ammonium ferric citrate | Fisher Scientific | I72-500 | |
| Boric acid | Fisher Scientific | A73-500 | |
| Sodium molybdate, dihydrate | EMD Chemical | SX0650-2 | |
| Manganese chloride tetrahydrate | Fisher Scientific | M87-500 | |
| Zinc sulfate heptahydrate | Fisher Scientific | Z68-500 | |
| Cupric sulfate pentahydrate | Fisher Scientific | C489-500 | |
| Biotin | Acros Organics | 230090010 | |
| Thiamine | Acros Organics | 148990100 | |
| Vitamin B12 | Acros Organics | 405920010 | |
| Copper (II) chloride dihydrate | Sigma-Aldrich | 221783-100G | Irritant, Dangerous to the Environment |
| Lead (II) chloride | Sigma-Aldrich | 268690-250G | Toxic, Dangerous to the Environment |
| Sodium dichromate dihydrate | Sigma-Aldrich | 398063-100G | Oxidizing, Highly Toxic, Dangerous to the Environment |
| Cobalt (II) chloride hexahydrate | Sigma-Aldrich | 255599-100G | Toxic, Dangerous to the Environment |
| Nickel (II) chloride hexahydrate | Sigma-Aldrich | 223387-500G | Toxic, Dangerous to the Environment |
| Sodium (meta) arsenite | Sigma-Aldrich | 71287 | Toxic, Dangerous to the Environment |
| Cadmium chloride | Sigma-Aldrich | 202908-10G | Highly Toxic, Dangerous to the Environment |
| Mercury (II) chloride | Sigma-Aldrich | 215465-100G | Toxic, Dangerous to the Environment |
| Tin (II) chloride dihydrate | Fisher Scientific | T142-500 | Corrosive. Suitable for Hg analysis. Very hazardous. |
| Manganese chloride tetrahydrate | Fisher Scientific | M87-500 | |
| Vanadium (V) oxide | Acros Organics | 206422500 | Dangerous to the Environment |
| Carbon dioxide | Air Liquide | I2301S-1 | Compressed |
| Hydrogen peroxide | H325-500 | Fisher Scientific | 30% in water |
| ICP-MS standard | ICP-MS-6020 | High Purity Standards | |
| Mercury standard | CGHG1-1 | Inorganic Ventures | 1000±6 µg/mL in 5% nitric acid |
| Argon | Air Liquide | Compressed | |
| Helium | Air Liquide | Compressed, ultra high purity | |
| Hydrogen | Air Liquide | Compressed, ultra high purity | |
| Nitric acid | Fisher Scientific | A509-P212 | 67-70% nitric acid, trace metal grade. Caution: manipulate under fume hood. |
| Hydrochloric acid | Fisher Scientific | A508-P212 | 35% hydrochloric acid, trace metal grade. Caution: manipulate under fume hood. |
| Equipment | |||
| Scientific prevacuum sterilizer | Steris | 31626A | SV-120 |
| Centrifuge | Thermo Fisher | 46910 | RC-6 Plus |
| Spectrophotometer | Shimadzu | 1867 | UV-1800 |
| pH controller | Hanna | BL981411 | X4 |
| Rotometer, X5 | Dwyer | RMA-151-SSV | T31Y |
| Rotometer, X5 | Dwyer | RMA-26-SSV | T35Y |
| Water bath circulator | Fisher Scientific | 13-873-45A | |
| Compact chiller | VWR | 13270-120 | |
| Freeze dryer | Labconco | 7752020 | |
| Stir plate | Fisher Scientific | 11-100-49S | |
| pH lab electrode | Phidgets Inc | 3550 | |
| Inductively coupled plasma mass spectrometer | Agilent Technologies | 7700 Series ICP-MS | Attached to autosampler CETAC ASX-520 |
| FIAS 100 | Perkin Elmer Instruments | B0506520 | |
| Atomic absorption spectrometer | Perkin Elmer Instruments | AAnalyst 800 | |
| Cell heater (quartz) | Perkin Elmer Instruments | B3120397 | |
| Microwave | Milestone | Programmable, maximum power 1,200 W | |
| Microwave rotor | Milestone | Rotor with 24-75 ml Teflon vessels for closed-vessel microwave assisted digestion. | |
| Materials | |||
| 0.2 μm syringe filter | Whatman | 6713-0425 | |
| 0.2 μm syringe filter | Whatman | 6713-1650 | |
| 0.45 μm syringe filter | Thermo Fisher | F2500-3 | |
| Polystyrene tubes | Evergreen | 222-2094-050 | 17 x 100 mm w/cap, 16 ml, polysteryne |
| Octogonal magnetic stir bars | Fisher scientific | 14-513-60 | Magnets encased in PTFE fluoropolymer |
References
- Dismukes, G. C., Carrieri, D., Bennette, N., Ananyev, G. M., Posewitz, M. C. Aquatic phototrophs: efficient alternatives to land-based crops for biofuels. Curr Opin Biotechnol. 19 (3), 235-240 (2008).
- Moody, J. W., McGinty, C. M., Quinn, J. C. Global evaluation of biofuel potential from microalgae. Proceedings of the National Academy of Sciences. 111 (23), 8691-8696 (2014).
- Pinto, E., et al. Heavy metal-induced oxidative stress in algae. J Phycol. 39 (6), 1008-1018 (2003).
- Gupta, A., Lutsenko, S. Evolution of copper transporting ATPases in eukaryotic organisms. Curr Genomics. 13 (2), 124-133 (2012).
- Perales-Vela, H. V., Peña-Castro, J. M., Cañizares-Villanueva, R. O. Heavy metal detoxification in eukaryotic microalgae. Chemosphere. 64 (1), 1-10 (2006).
- Sandau, E., Sandau, P., Pulz, O. Heavy metal sorption by microalgae. Acta Biotechnol. 16 (4), 227-235 (1996).
- Amer, L., Adhikari, B., Pellegrino, J. Technoeconomic analysis of five microalgae-to-biofuels processes of varying complexity. Bioresour Technol. 102 (20), 9350-9359 (2011).
- Benemann, J. R., Goebel, R. P., Weissman, J. C., Augenstein, D. C. Microalgae as a source of liquid fuels. Final Technical Report, US Department of Energy, Office of Research. , (1982).
- Benemann, J. R., Oswald, W. J. Report No. DOE/PC/93204--T5 Other: ON: DE97052880; TRN: TRN. Systems and economic analysis of microalgae ponds for conversion of CO2 to biomass. , (1996).
- Chisti, Y. Biodiesel from microalgae. Biotechnol Adv. 25 (3), 294-306 (2007).
- Davis, R., Aden, A., Pienkos, P. T. Techno-economic analysis of autotrophic microalgae for fuel production. Applied Energy. 88 (10), 3524-3531 (2011).
- Jones, S., et al. Process design and economics for the conversion of algal biomass to hydrocarbons: whole algae hydrothermal liquefaction and upgrading. U.S. Department of Energy Bioenergy Technologies Office. , (2014).
- Lundquist, T. J., Woertz, I. C., Quinn, N. W. T., Benemann, J. R. A realistic technology and engineering assessment of algae biofuel production. Energy Biosciences Institute. , Berkeley, CA. (2010).
- Nagarajan, S., Chou, S. K., Cao, S., Wu, C., Zhou, Z. An updated comprehensive techno-economic analysis of algae biodiesel. Bioresour Technol. 145, 150-156 (2011).
- Pienkos, P. T., Darzins, A. The promise and challenges of microalgal-derived biofuels. Biofuels Bioproducts & Biorefining-Biofpr. 3, 431-440 (2009).
- Richardson, J. W., Johnson, M. D., Outlaw, J. L. Economic comparison of open pond raceways to photo bio-reactors for profitable production of algae for transportation fuels in the Southwest. Algal Research. 1 (1), 93-100 (2012).
- Rogers, J. N., et al. A critical analysis of paddlewheel-driven raceway ponds for algal biofuel production at commercial scales. Algal Research. 4, 76-88 (1016).
- Sun, A., et al. Comparative cost analysis of algal oil production for biofuels. Energy. 36 (8), 5169-5179 (2011).
- Thilakaratne, R., Wright, M. M., Brown, R. C. A techno-economic analysis of microalgae remnant catalytic pyrolysis and upgrading to fuels. Fuel. 128, 104-112 (2014).
- Quinn, J. C., et al. Nannochloropsis production metrics in a scalable outdoor photobioreactor for commercial applications. Bioresour Technol. 117, 164-171 (2012).
- Borkenstein, C., Knoblechner, J., Frühwirth, H., Schagerl, M. Cultivation of Chlorella emersonii with flue gas derived from a cement plant. J Appl Phycol. 23 (1), 131-135 (2010).
- Douskova, I., et al. Simultaneous flue gas bioremediation and reduction of microalgal biomass production costs. Appl Microbiol Biotechnol. 82 (1), 179-185 (2009).
- Israel, A., Gavrieli, J., Glazer, A., Friedlander, M. Utilization of flue gas from a power plant for tank cultivation of the red seaweed Gracilaria cornea. Aquaculture. 249 (1-4), 311-316 (2012).
- Napan, K., Teng, L., Quinn, J. C., Wood, B. Impact of Heavy Metals from Flue Gas Integration with Microalgae Production. , Algal Research. (2015).
- Eaton, A. D., Clesceri, L. S., Rice, E. W., Greenberg, A. E. 3125B. Inductively coupled plasma/mass spectrometry (ICP/MS) method. Standard methods for the examination of water and wastewater. , (2005).
- Eaton, A. D., Clesceri, L. S., Rice, E. W., Greenberg, A. E. Standard methods for the examination of water and wastewater. , APHA-AWWA-WEF. (2005).
- Matrix effects in the ICP-MS analysis of selenium in saline water samples. Smith, M., Compton, J. S. Proceedings of the 2004 Water Institute of Southern Africa Biennial Conference, Cape Town, South Africa, , (2004).
- Mehta, S. K., Gaur, J. P. Use of algae for removing heavy metal ions from wastewater: progress and prospects. Crit Rev Biotechnol. 25 (3), 113-152 (2005).
- EPA, U. Method: 200.8: Determination of trace elements in waters and wastes by inductively coupled plasma - mass spectrometry. , (1994).
- Eaton, A. D., Clesceri, L. S., Rice, E. W., Greenberg, A. E. 3120B. Inductively coupled plasma (ICP) method. Standard methods for the examination of water and wastewater. , (2005).
Tags
环境科学,101期,藻类,重金属,Get cutting-edge science videos from JoVE sent straight to your inbox every month.









