Summary
이 문서에서 설명하는 간접 면역 형광 프로토콜 탐지 및 마우스 유방 동맥에서 단백질의 현지화 할 수 있습니다. 완전한 방법은 유선 샘플을 제조 형광 현미경에 의해 이미지, 조직 절편을 면역 조직 화학 법을 수행하고, 이미지를 재구성하기 위해 주어진다.
Abstract
간접 면역 형광을 감지하고 조직에 대한 관심의 단백질을 찾는 데 사용됩니다. 여기에 제시된 프로토콜은 단백질의 면역 검출을위한 완전하고 간단한 방법은, 유선 수유 마우스를 예로 들어 설명되고. 특히 마우스 유방 분비선 조직 정착 냉동 조직 절편의 해부에 관한 조직 샘플의 준비를위한 프로토콜은, 상세한이다. 표준 프로토콜은 선택적 항원 검색 단계를 포함하는, 간접 면역 형광을 수행하도록 또한 제공된다. 표지 된 조직 절편의 관찰뿐만 아니라, 영상 획득 및 후 처리도 언급된다. 이 절차는 세포 단백질의 위치 파악에 동물 조직의 수집으로부터의 전체 개요를 제공한다. 이러한 일반적인 방법은 다른 조직 샘플에 적용 할 수 있지만, 각 조직은 연구 / 차 항체에 결합되도록 구성되어야한다.
Introduction
유선은 누구의 주요 기능 신생아를 공급하는 우유를 생산하는 전형적인 포유류의 외분비 기관이다. 유방 조직의 발달은 주로 출생 후 발생하고 상피 세포 주위 기질이 침입하는 독특한 방법을 특징으로한다. 이 조직은 부수적으로 생식 상태의 변화 (그림 1)과, 특히 성인 생활 동안 많은 변화 (성장, 분화 및 회귀)를 겪는다. 조직의 전체적인 형태에 더하여, 다른 유형의 세포뿐만 아니라 유선 내에서의 배치의 비율은 급격히 발달 동안 변경 1-5.
배아 생활 동안, 유방 상피 세포는 배아 일 10.5 (E10.5) (그림 1A 주위의 중간 선 양쪽의 앞과 뒷다리 사이, 외배엽의 약간의 농축 및 층화에 의해 정의된다 유방 우유 라인에서 파생 ).E11.5에서 우유 선 대칭 위치에서 재생 가능한 우유 유선 라인을 따라 위치되는 개별 placodes으로 끊기는 및 주변 간엽은 응축하기 시작한다. placodes는 진피로 깊이 가라 앉기 시작하고 유방 중간 엽은 유방 버드 (E12.5-E14.5) 주위에 동심 층으로 구성합니다. E15.5로, 유방 상피 세포는 증식과 지방 패드쪽으로 유방 중간 엽을 통해 밀어 주 새싹을 형성하기 위해 연장을 시작합니다. 기본 새싹 젖꼭지 시스의 형성에 의해 표시된 피부 개구와 중공 도관을 개발한다. E18.5에서 신장 덕트는 지방 패드로 성장하고 지방 패드에 포함 작은 arborized 유관 시스템으로 분기하고있다. 개발은 본질적으로 체포하고 기본적인 유선은 사춘기까지 morphogenetically 정지 남아있다. 남성 배아에서 안드로겐 수용체의 활성화가 사라 싹의 변성에 이르게E15.5에 의해. E18로, 유방 발달은 사춘기 6-9까지 중단.
출생시, 유선이의 신장 및 분기 천천히 (아이소 메트릭 성장) 기초 도관 시스템을 항구. 사춘기에, 덕트의 선단에 위치하는 구조는 구형 말단부 싹 (TEBS)가, 캡 세포의 외부 층과 셀의 다층 내부 코어 (체세포)로 형성했다. 이러한 구조는 매우 증식하고 호르몬 큐에 응답하여 주변 간질 조직에 침투. 유관 신장에 TEBS 결과 내 확산은, 형태 형성 분기와 결합. 이 프로세스는 유두 (그림 1B, 사춘기)에서 나오는 기본 상피 arborized 네트워크의 설립으로 이어집니다. ~ 10~12주 출산 후, 상피 전체 지방 패드를 침공했을 때, 그것의 확장이 중지에서 TEBS이 사라집니다. 유관 개발은 역동적 인 변화, 즉, successi을 겪는다발정주기 (10) (그림 1B, 성인)에 따라 상피 세포의 증식과 회귀 분석을했습니다.
임신의 시작에서, 유방 조직은 수유를 준비하는 중요한 성장과 형태 학적 변화를 겪는다. 유방 상피 광범위하게 높은 분기 세뇨관 폐포 네트워크로 이어지는, 증식 및 분화. 부수적으로, 유방 상피 세포 (MEC의)는 편광 및 합성 및 우유 제품을 분비 할 수됩니다. MEC의 수축은 근 상피 세포에 의해 둘러싸여 있으며, 지방 및 결합 조직, 혈관 및 신경 말단 (도 1b, 임신)로 이루어지는 기질에 결합되어 다수의 폐포 구조 (꽈리)로 구성. 또한, MEC의의 기부 쪽은 기저막 (세포 외 기질)에 밀착되어, 이들 두 엔티티 사이의 상호 작용은 밀접하게 유방의 양 및 형태 형성 분비 기능을 조절공예 상피 11-13.
이러한 모든 과정은 가장 중요한 hormones14있는 다양한 환경 단서, 주변 분비 인자 및 세포 외 기질의 작용에 의존한다. 예를 들어, 프로게스테론은 광범위한 측면 분지 프로락틴 (PRL)와 조합하여, (15) 및 그 alveologenesis 16,17 유도를 촉진하고, 폐포의 분화를 유지한다. 스테로이드와 PRL18, 사이토 카인 및 개발과 관련된 신호 전달 경로에 추가하여 (이 Wnt 및 신호 전달 경로 노치)도 유방 계보 헌신과 개발 19-21에 참여하고 있습니다. 임신의 끝에서, MEC의 내강은 폐포의 내강에 초유로 알려진 단백질이 풍부한 우유를 생산하기 시작한다. 또한, 프로게스테론은 상피 투과성에 작용하고 단단한 접합부가 열려 있기 때문에, 초유는 모체 혈류에서 발견된다.
분만 후 mammarY 상피 (그림 2, 유방 상피) 거의 모든 유선 볼륨의 소요 높은 구성되어있다. 우유 - 생산 단위, 즉 폐포 (도 2, 폐포)는, 그 꼭대기 세포막은 루멘을 구분하여, 편광 유방 상피 세포 분비 (MESCs)의 단일 층에 의해 형성된다. 폐포는 외부 환경 (그림 2, 엽)에 우유를 배출 덕트에 연결 로브로 분류됩니다 소엽으로 자신을 준비. 수유가 발생 즉., MESCs 주로 태반 호르몬의 드롭 (주로 프로게스테론) (그림 1B, 수유)에 의해 트리거 우유의 풍부한 양을 분비하기 시작한다. 우유 단백질 유전자는 주로 유아시 방출 뇌하수체 PRL에 응답하여, 임신에서 수유 9,22,23 범위 정의 시간적 시간의 코스에 활성화된다. 부수적으로, MESCs 두 세포 외 기질 사이의 접촉은 우유 단백질 SYNT을 자극세포 인테그린 및 라미닌 (24, 25) 사이의 상호 작용을 통해 중재 및 MESCs (26, 27)에서 세포 사멸을 억제되어 신호를 통해 hesis. 이러한 신호 전달 경로는 특정의 전사 활성화 인자 (29)를 통해 우유 단백질 유전자 프로모터 (28)의 활성화를 초래한다. 세포 - 세포 접촉도 혀끝 극성의 확립 및 유제품의 vectorial 분비 포함 분화의 일부의 측면에 중요하다. 수유 MESCs의 시작 후 급속히 확대 견고 연접 미세 신생아의 영양 요구에 응답하여, 혈액뿐만 아니라 우유 성분의 합성, 수송 및 분비에서 분자의 흡수를 조율. 유아의 때에, 폐포를 둘러싸 근 상피 세포의 수축 옥시토신 응답으로 발생과 덕트를 통해 니플에 우유 토출 리드. 우유는 단백질을 포함하는 복잡한 유체 (대부분입니다카제인), 당 (주로 락토스), 예컨대 면역 글로불린 A (적 IgA), 성장 인자 및 호르몬과 같은 지질, 광물뿐만 아니라 생리 활성 분자. 카제인, 즉 분비 경로를 따라 이송 미셀을, 카제인, 초분자 구조에서 조립, 합성 한 다음 세포 외 유출에 의해 발표되는 즉, MESC의 혀끝의 세포막과 카제인 함유 분비 소포의 융합 (SV들) (그림 2).
세포 내 트래픽은 막상 구획 사이의 물질 교환에 의존하고 포함 가용성 N-에틸 말레이에 맞는 퓨전 (NSF) 부착 단백질 (SNAP) 수용체 (SNARE) 30, 31. 스네어 단백질 제품군은 대상 막에 지역화 된 소포 소포 막에 존재하는 함정 (V-덫), 및 목표 덫 (T-덫)에 세분화되어있다. 들은 꼬인 코일 도메인을 통해 완봉으로 V- 및 t-스네어가 매우 안정적인 네 나선 다발 복합체를 형성하도록 조립 함 번째로서전자 SNARE 복합체. 이 단지는 점차 근접 (30, 32)로 그 (것)들을 가져 와서 두 상대 지질 이중층의 융합을 촉진한다. 그 후, SNARE 복합체는 NSF 아데노신 triphosphatase에 의해 분해되고, 그 어댑터 단백질 SNAP과 SNARE 단백질은 기원 33의 자신의 구획에 다시 재활용됩니다. 흥미롭게도, 각 SNARE 단백질은 주로 세포 융합 이벤트 (34)의 특이성에 기여할 수있다 별개의 세포 구획과 SNARE 페어링에 있습니다. 이전의 연구는 적어도 단백질 23 (SNAP23) 및 소포 - 관련 막 단백질 8 (VAMP8), 및 syntaxins (STX)를 Synaptosomal이 관련 제안 -7과 -12 카제인 세포 외 유출 (35, 36)의 역할을한다. 이 단백질은 또한 우유의 지질 부분, 즉, 우유 지방 소 구체 (MFGs) (37)와 관련하여 발견되었다. 현재 통용 모델은 세포질의 지질 소적 (CLDs)가 중립 (L)의 퇴적에 의해 형성되는 것으로 가정한다ipids (주로 트리 아실 글리세롤과 스테롤 에스테르) 및 소포체 (ER) 막 38-41의 두 전단지 사이의 산모 식단에서 파생 된 콜레스테롤. 큰 CLDs는 MESC 혀끝 세포막에 의해 감싸여되고, 신진 의해 그들이 MFGs로 방출된다 MESCs의 선단 측 (직경 1-10 μm의)으로 이송되면서 작은 CLDs의 융합에 의해 적어도 부분적으로 형성되어있다 40-42. 새끼는 이유와 MESCs이 점진적으로 다시 사춘기 상태 (그림 1B, 퇴화)에 유방 조직의 회귀로 이어지는, 세포 사멸에 의해 사망 후 수유는 중단.
면역은 (IF)에서 연구 및 임상 진단 모두 생물학의 거의 모든 측면에 사용 된 일반적인 실험 분석 방법이다. 기술이 조직 섹션에서 수행 할 수있는 경우 (면역 조직 화학, IHC) 또는 세포 (면역 세포 화학, ICC) 샘플. 이 강력한 접근 방식은 직관 형 형광등의 사용에 의존구체적 따라서 형광 현미경을 통해 그 조직 분포의 시각화를 허용 관심 항원에 (직접 또는 간접적으로) 결합하는 표지 된 항체. 형광 신호는 대부분 시료의 품질과 농도의 항체 및 적절한 처리에 의존한다. 간단한 간접 면역 형광 (IIF) 프로토콜 우유 제품 (카제인과 MFGs)와 우유 제품 분비에 관여하는 단백질을 검출하기 위해 제공됩니다 마우스 유선 조직 (그림 3)의 동결 절편에 (butyrophilin (인 btn1), 단백질 스네어). 이 프로토콜은 조직 컬렉션에서 이미지 후 처리, 중요하고 선택적 단계뿐만 아니라 몇 가지 기술적 인 권고에 이르기까지 완벽한 IHC 개요를 제공하지만 또한 제시되고 논의된다.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
CD1 마우스는 INRA (UE0907 IERP, JOUY-KO-Josas의, 프랑스)에서 사육 하였다. 동물 보호의 모든 윤리적 측면은 농업의 프랑스 교육부에 의해 규정 된 관련 지침 및 라이센스 요구 사항을 준수. 사용 절차는 (Comethea JOUY-KO-Josas의 / AgroParisTech에서 계약 12/097) 지역 윤리위원회에 의해 승인되었다.
1. 유선 샘플 준비
- 마우스 유선의 해부
- 자궁 전위에 의해 수유의 날 (10)에 쥐를 안락사와 복부가 위를 향하도록 내려 동물을 핀.
- 에탄올로 복부 영역을 습식 및 종이 수건으로 건조.
- 집게를 사용하여 두 개의 뒷다리 사이의 복부 피부를 끌어와 날카로운 가위로 약 1cm의 (만 피부를 통해) 절개를합니다. 이 첫 번째 절개에서 시작, 다음, 마우스의 목 피부를 잘라 가위를 사용합니다. 복막 및 PI에서 피부를 당깁니다N시의 피부의 일측 아래,이 교시 연신.
- 복부와 면봉으로 피부에서 멀리 밀어 마지막으로 잡아 당기거나 멀리 복막에서이를 절단하여 사타구니 유선을 수집합니다.
주의 :이 단계에서 카민 염색은 전체 선 (43) 내에서 유선 상피 세포를 시각화하기 위해 수행 될 수있다. 이 접근 방식은 다양한 조건 (생리 발달 단계, 질환, 생체 치료법) 아래 유선의 글로벌 형태를 분석하는 것이 유용 할 수있다. - 복부의 접합과 사타구니 동맥 (44)에있는 림프절을 제거합니다.
- 유방 조직 고정
- 가능한 한 많은 우유를 제거하기 위해 (PBS) 용액의 pH 7.4, 인산 완충 식염수에있는이 조각을 씻어 바로 메스와 3mm 3 조각으로 유방 조직을 잘라.
- 신속 종이 조각을 건조수건과 얼음에 10 ~ 15 분 동안 4 % 파라 포름 알데히드 (PFA, HCHO, 32 % 포름 알데히드 용액,주의)를 포함하는 차가운 PBS 용액에 넣어.
참고 :이 IIF36에 의해 및 / 또는 현장 하이브리드 45 유방 조직 슬라이스 이후의 분석을 허용하기에 충분한 시간이다. 알데히드 고정 제는 조직 조각을 다소 느리게 침투하지만, (~ 시간은 1-3 번 ㎜), 이번에는 조직 샘플의 최적의 정착을 위해 확장 될 수있다. 또한, 정착액 솔루션 (본 연구에서 자세히 설명하지 않음) 마취 된 동물을 관류하여 생체 내에서 조직을 고정한다.
- 자당 주입
- 신속하게 차가운 PBS에서 유선 조각을 헹구고 부드러운 흔들림에서 4 ° C에서 16 시간 48 40 %의 자당 (D-사카, C12H22O11, 미스터 342.3 g / 몰)을 포함하는 차가운 PBS 용액을 담그지.
- 조직 삽입
주 :이 단계에서, 내유 단편 작은 단편 (2-3 내지 3 mm를 만들기 위해 재 절단 할 수있다) 또는 모양을 조정합니다.- 적절 플라스틱 몰드 라벨 및 RT 유지의 OCT 화합물과 몰드의 부피의 제 채운다. 금형 당 유방 조직의 한 조각 (2-3mm 3)을 놓고 10월 화합물로 커버.
- (알루미늄 또는 금속 자체를 사용하는 시트)에 액체 질소의 표면에 금형을 넣고 제품을 고정 할 수있다.
참고 : 액체 질소에 금형을 담근 전에 고체와 화이트가되어야합니다.
- 조직 섹션이 수행 될 때까지 -80 ℃에서 냉동 샘플을 저장합니다.
2. 냉동 조직의 단면
참고 : 기본적으로 냉장고 내부 마이크로톰 인 저온 유지 장치를, 냉동 조직 절편을 만들기 위해 필요합니다. 낮은 온도는 종종 처녀 유선으로 지방이나 지질이 풍부한 조직이 필요합니다.
- C ° -26에 저온 유지 장치의 온도를 조정하고 stabi을 때까지 기다리십시오하게 안정적. 전체 단면 절차 전반에 걸쳐 -26 ℃에서 냉동 조직 블록을 유지한다. 절대적 과정 중 언제든지 조직을 해동 피한다.
- 적어도 10 분 동안 저온 유지 장치에 배치하여 -26 ° C에 면도날, 절삭 지원 티롤 장치 및 브러시 쿨. 또한 단면이 만들어 짐에 따라 유리 슬라이드를 저장할 수 있도록하기 위해 내부 저온 유지 슬라이드 박스를 배치했다.
- 적절하게 RT에서 그들을 조직 절편을 수집하고 유지하기 위해 사용되는 유리 슬라이드 라벨; 그렇지 않으면 조직 절편들을 준수하지 않습니다. 저온 유지 장치 내부의 금형에서 샘플을 제거합니다.
주 : 사용 양전하 유리 슬라이드 크게 인해 높은 정전 인력을 냉동 조직 절편의 밀착성을 선호 할 것이다. - (RT 유지)의 OCT 화합물과 금속 조직 디스크의 표면을 커버하고 그 위에 고정 된 샘플을 누른다. 습식 저온 유지 장치 내부에 탑재 배치하고 공동 보자적어도 15 분 동안 OL.
- 저온 유지 장치의 디스크 홀더에 젖은 마운트를 놓습니다. 가능하면, 새로운 날카로운 칼날을 사용하거나 적어도 각 샘플 이후 일부 조직 것이다 빨리 무딘 잘라하는 데 사용되는 블레이드의 영역을 변경, 5-6 μm의 절단 두께를 조정합니다.
- 슬라이스가 균일하고 정확하게 형성되도록 부착 매체의 절개함으로써 면도날 위에 티롤 장치의 위치를 조정한다. 이상적으로, 안티 - 롤 장치는 약 1 mm 정도 면도날을 통해 단계 것입니다.
- 설정이 올바른지되면, 연속 균일 한 동작으로 휠을 돌려 조직 섹션을 수행합니다. 온도가 적합하지 않는 한, 조직 섹션, 자연, 꼬고을 시도합니다.
- 잡아 유리 슬라이드에 원하는대로 배치하기 위해 상기 스테이지에 걸쳐 부를 기동하도록 브러쉬를 사용한다. 냉동 조직 블록 및 / 또는 면도날에 가능성이 존재하는 유물을 정리 브러시를 사용합니다.
- 손잡이사용자쪽으로 조직 섹션은 저온 유지 장치의 스테이지로 눌러지지 않도록. 이 단계에 조직 절편 따라서 유리 슬라이드로 복구 할 수 없다는의 접착을 초래할 수 있으므로 저온 유지 장치의 스테이지로 조직 섹션을 눌러 마십시오.
- 섹션 위를 유지하고 조직 섹션을 터치 내려 낚시를하여 유리 슬라이드의 표면에서 그들을 선택하여 조직 섹션을 하나씩 검색합니다.
참고 : 조직 섹션 빠르게 인해 정적 인 매력에 따뜻한 유리 준수합니다. 여러 조직 섹션은 동일한 슬라이드에 배치하는 경우,이를 겹쳐과 공간에 충분한 개별적으로 소수성 원을 묶어야 할 수 있도록하지 않도록주의 (섹션 3.1.1을 참조하십시오.).
3. 간접 면역 형광
- 섹션을 찾기
- 슬라이드에 장착 된 조직 주변의 소수성 원을 그릴 소수성 장벽 펜을 사용합니다. 실온에서 약 1 분 동안 원 건조하자. T 주위에 선을 그립니다이슈 미세 검정 영구 마커 부뿐만 있지만에 조직 절편은 하나 대향 유리 슬라이드의 측면.
참고 :이 원은 발수이며, 아세톤, 알코올 불용성. 따라서 IHC 절차 중에 사용 된 수용액에 장벽을 제공하고 필요한 시약의 양을 감소시킨다. - RT에서 몇 분 동안 ~ 한 방울 PBS 250 μl를 감싸는 조직 절편을 재수. ~으로 10 ~ 15 분 동안 PBS에서 새로 제조 3 % PFA 용액 250 μl를 감싸는 조직 섹션을 수정합니다.
주 : 선택적으로,이 경우에는, 알데히드 켄칭 용액을 사용하여 (50 MM의 염화 암모늄 (NH 4 CL 씨 PBS에서 53.5 g / ㏖) 또는 0.1M 글리신 (C 2 H 5 NO 2, 씨 75.07 g / mol)의 PBS에 ) 고정 반응을 중지합니다. 간단하고 풍부한 PBS 세척 미 반응 알데히드를 제거하기 위해 일반적으로 충분하다.
- 슬라이드에 장착 된 조직 주변의 소수성 원을 그릴 소수성 장벽 펜을 사용합니다. 실온에서 약 1 분 동안 원 건조하자. T 주위에 선을 그립니다이슈 미세 검정 영구 마커 부뿐만 있지만에 조직 절편은 하나 대향 유리 슬라이드의 측면.
- 항원 검색 (선택 사항)
- 비커에 AR 용액 (100 mM 트리스 (C 4 H 11 NO 3, 미스터 121.14) 5 % 우레아 (NH 2 CONH 2, 미스터 60.06)의 pH 9.6)를 놓습니다. AR 용액의 체적은 완전히 유리 홀더에 배치 된 유리 슬라이드를 커버하기에 충분해야한다.
- 온도계의 온도를 모니터링하여 95 ° C까지 AR 솔루션을 예열 한 후 적합한 랙에 유리 슬라이드를 놓고 뜨거운 버퍼에 랙을 immerge, 덮개는 증발을 제한하고 95 ℃에서 10 분 동안 배양한다.
- 수욕에서 비커를 꺼내고 다른 버퍼 10 분간 유리 슬라이드를 떠난다.
- PBS (~ 250 μL / 섹션)로 조직 절편을 씻어 솔루션을 포화3 % 소 혈청 알부민 (BSA, ~ 250 μL / 제) 실온에서 적어도 30 분 동안 PBS에서의.
- PBS는 각 조직 섹션에 2 % BSA를 포함하는 희석 차 항체의 30 ~ 50 μl를 넣습니다.
주 :이 부피가 완전히 조직 절편을 커버 방울을 형성하기에 충분하다. - 일차 항체가없는 음성 대조군을 수행하도록 조직 절편에 혼자 희석제 (PBS, 2 %의 BSA)의 동일한 양을 놓는다.
- 체계적 IHC 각 실험에서, 음성 대조군이 포함하고 (인해 이차 항체 및 / 또는 조직에 자동 형광 비특이적 라벨링) 실험의 배경을 추정하기 위해 사용되는 각각의 이차 항체에 대해 수행한다. 양 또는 음의 제어의 다른 유형도 (설명 참조) 표지의 특이성을 확인하기 위해 수행 될 수있다.
- 4 ° C에서 / 가습 박스 O에서 N을 유리 슬라이드를 놓습니다.
참고 : 사용하는 차 항체가 마우스 단일 클론 항 cytokeratin했다8 (CK8 1:50 희석), 마우스 단일 클론 (14) (CK14 1:50 희석) 항 cytokeratin, 토끼 다 클론 항 - 마우스 카제인 (# 7781 1:50 희석, 관대 MC 네빌, 콜로라도 보건 대학 제공 과학 센터, CO, 미국), 토끼 다 클론 항 인 btn1 (1 : 관대 IH 메이, 동물 및 조류 과학과, 메릴랜드 대학, 컬리지 파크, 메릴랜드, 미국), 토끼 다 클론 항 Stx6 (가 제공하는 300 희석, 넉넉한 S. Tooze, 암 연구 영국, 런던 연구소, 런던, 영국)와 토끼 다 클론 항 VAMP4 (1시 50분 희석)에 의해 제공 1시 50분 희석. - 철저하게 RT에서 10 분 동안 PBS로 4 회 이상을 조직 절편을 씻는다.
- , PBS가 2 % BSA를 포함하는 모든 조직 섹션에이 솔루션의 30 ~ 50 μl를 배치하고 1.5 시간 동안 품어 : 적절한 이차 항체 (300 희석 로다 민 결합 염소 항 - 토끼 IgG를 (H + 1), 1) 희석 실온에서.
- 형광 색소는 빛에 민감한 분자이기 때문에,하지그들의 분석 할 때까지 빛을 조직 섹션에 노출됩니다. 세포막 낮은 라벨을 방해 할 수 녹색 형광을 자동 생성하는 경향이 있기 때문에 조직 섹션에 IIF 들어, 적색 형광체에 결합 이차 항체를 선호. 또한, 적색 형광 결합 된 이차 항체를 선택하면 중성 지질 (아래 참조)의 병용 표시 할 수 있습니다.
- 철저하게 RT에서 10 분 동안 PBS로 4 회 이상을 조직 절편을 씻는다.
- 일부 실험에서, 항원 / 항체 골격을 안정화하기 위해 RT에서 10 분 동안 PBS에서 희석 한 2 % PFA와 샘플을 배양함으로써 사후 고정을 수행한다. 그러나,이 단계는 대부분의 경우에 생략 될 수있다.
- BODIPY 3 μg의 493 / ㎖를 함유하는 PBS 용액에 30-50 ㎕의 조직 섹션을 인큐베이션하여 CLDs 및 MFGs 컬러 중성 지질을 시각화실온에서 10 분 / 503. 신속 PBS로 두 번 조직 섹션을 씻어.
- RT에서 10 분 동안 DAPI (4-6-diamidino -2- 페닐 인돌, 5 ㎎ / ㎖ 원액)의 3 μM을 함유하는 PBS 용액 30-50 μL 핵 DNA Counterstain과. 관찰 슬라이드를 장착하기 전에 PBS로 두 번 조직 섹션을 씻으십시오.
- PBS를 제거하고 각 조직 섹션에 매체를 장착 한 방울을 배치합니다.
- 공기 방울을 방지, 슬라이드 대 각도로 커버 슬립의 일측을 배치 액체 방울의 외부 에지와 접촉 한 후 서서히 저하 커버. 액체는 몇 분간 유리 슬라이드 및 커버 슬립 사이에 분산하고 종이 타월로 매체를 장착 과량을 제거 할 수있다.
- 관찰 될 때까지 빛에 노출을 방지하기 위해 4 ℃에서 매니큐어 및 저장 조직 섹션 유리 슬라이드에 커버 슬립을 밀봉.
4. 형광 관측 및 이미지 인식
주 : 화상 취득 소프트웨어에 의해 제어되는 카메라 IHC의 결과를 관찰 할 필요가 장착 형광 현미경.
- 이미지를 획득하기 전에, 표지의 강도를 확인하고 음성 대조군 보면 실험의 배경을 평가. 개별적으로 각각의 형광 표지 (컬러 채널)의 사진을 획득.
- 각 컬러 채널에 대해 동일한 조건 (노광 및 일반 설정)에 대응하는 제어 것과 포함한 모든 이미지를 획득.
- 기존의 현미경
- (63) (오일 침지, NA 1.3) 목표 및 DP50 촬상 카메라 × 20를 ×, 표준 형광 염료 용 필터 (FITC, 녹색), 로다 민 (적색) 및 DAPI (청색) 배출 구비 현미경으로 표면 형광 현미경을 수행한다.
- 공 초점 현미경
- 마이크로와 공 초점 현미경을 수행63 (오일 침수, NA 1.4) 목표와 레이저의 488-과 568-nm의 여기 파장을하는 × × 20를 사용하여 ZEN 소프트웨어가 설치된 대처.
5. 이미지 처리
참고 : 모든 이미지 후 처리는 ImageJ에 무료 소프트웨어 (http://imagej.nih.gov/ij/)를 사용하여 수행됩니다.
- 이미지를 중첩 (병합)
- (파일 / 열기) 결합 각 채널에서 획득 한 이미지를 엽니 다. 8 비트 그레이 스케일 이미지로 작업하는 경우, 룩업 테이블 (이미지 / 룩업 테이블)을 사용하여 각 채널에 인공 색 속성.
- 각 채널에 색상을 탓 후 (이미지 / 색상 / 채널을 병합) "채널을 병합"명령을 사용하여 그레이 스케일 또는 컬러 이미지의 합성 사진을 생성합니다.
- (파일 / 열기)에 결합 될 각 채널에서 획득 스택을 개방 및 채널 병합 "명령을 사용하여 이미지가 동일한 방식으로 중첩 스택 수행# 8221; 각 채널에 색상 속성에 (이미지 / 색상 / 채널을 병합). 이미지 시퀀스로 복합 스택을 저장하거나 동영상으로 (5.4 절 참조).
- 이미지 스택 Z 프로젝션
- 이미지 평면 (Z 축)에 수직 인 축을 따라 그것들을 투영하여 화상 스택의 모든 이미지의 2 차원 뷰를 제공하는 Z 투사 기능 (이미지 / 스택 / Zproject, 최대 강도) 사용. "최대 강도"옵션은 각 픽셀이 스택의 모든 이미지를 통해 최대 값을 포함하는 이미지를 만듭니다. 이는 특정 채널 또는 여러 채널의 중첩 후에 화상 전체 스택을 통해 관찰 된 모든 얼룩의 시각화를 허용하는 하나의 이미지를 생성한다.
- 화상 스택 차원 투영
- 평면 상으로 회전 볼륨의 돌기들의 시퀀스를 생성하기 위해 3 차원 투영 명령 (이미지 / 스택 / 3D 프로젝트, 밝은 점, Y 축)을 사용. 스와의 시각적 렌더링rfaces 및 내부 구조는 모두 투사 방법 (가장 가까운 점, 여기에 사용 된 밝은 점 (), 또는 평균 값)에 따라 달라집니다 및 시각화 매개 변수를 선택했습니다. 애니메이션 시퀀스의 각 프레임은 상이한 시야각으로부터 돌출 한 결과이다.
- 세 개의 직교 축 (y 축이 여기에 선정되었다)의 각각의 주위에 생성 된 3D 이미지를 회전합니다. 하나의 이미지 또는 동영상으로 제작 순서를 저장합니다.
- 동영상 변환 이미지 스택
- 이미지 스택 (파일 / 열기)을 열고 명령 "AVI"(파일 / 저장 / AVI)를 사용하여 .AVI 형식의 동영상으로 저장합니다.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
유선은 흉부와 설치류의 복부 모두의 복부 구조를 따라 위치한 피하 선이다. 임신 기간 동안 마우스의 땀샘의 다섯 쌍의 위치는 그림 4에 표시됩니다. 유선의 형태는 크게 전체 수유 (그림 1B)를 준비하는 데 필요한 기능 변경을 반영, 개발 중에 변경됩니다. 처녀 또는 미산 동물, 유선 볼 어려울 수 있습니다 얇은 지방 기질에 포함 띄엄 띄엄 분기 유관 상피 세포로 구성되어 있습니다. 보고 (그림 4)를 제거하기 위해 쉽게 될 더 큰 유선의 결과로 임신의 시작, 유방 상피 세포의 증식과 팽창,에서. 수유 동안 유방 조직 두껍다 의한 우유의 존재 하얗게 보인다. 만 복부와 사타구니 유선은 자궁 경부와 흉부 유방 GLAN 때문에 수집DS 덜 쉽게 근육과의 가까운 관계로 인해 제거됩니다. 일부 실험에서, 46, 47 새끼 MESCs 의한 우유 분비를 제한하기 위해 희생 전에 수유 여성 4-6 시간으로부터 분리 될 수있다.
유방 근 상피와 상피 세포의 식별
폐포 주위의 수축 근 상피 세포는 특히 이들 세포 유형 각각에 의해 표현 된 마커에 대한 항체를 사용함으로써 내강 MESCs 구별 될 수있다. 유선에서 사용하는 현재의 마커는 cytokeratins (CKs의가) 있습니다. CKs의 상피 조직에서 발견되는 세포 골격의 중간 필라멘트 (평균 직경이 10 나노 미터)을 형성하기 위해 중합 세포질 단백질 대가족이다. 중간 필라멘트는 매우 안정적이며, 셀 아키텍처에 대한 기계적지지를 제공하고, 세포 - 세포 부착 및 기저 세포 - 결합에 기여하는 조직으로 정리조직의 상호 작용. 상피 세포에 의해 표현 CKs의의 부분 집합은 주로 상피의 유형, 개발의 단계 및 분화 상태에 따라 달라집니다. 또한, 이것은 또한 상피 조직의 악성 대응 적용된다. 따라서, 이들 마커는 생리 학적 조건 하에서 조직 세포 집단의 특성을 간단하고 유용한 도구, 외과 병리학 48에서 종양의 진단 및 특성화를 위해 사용된다.
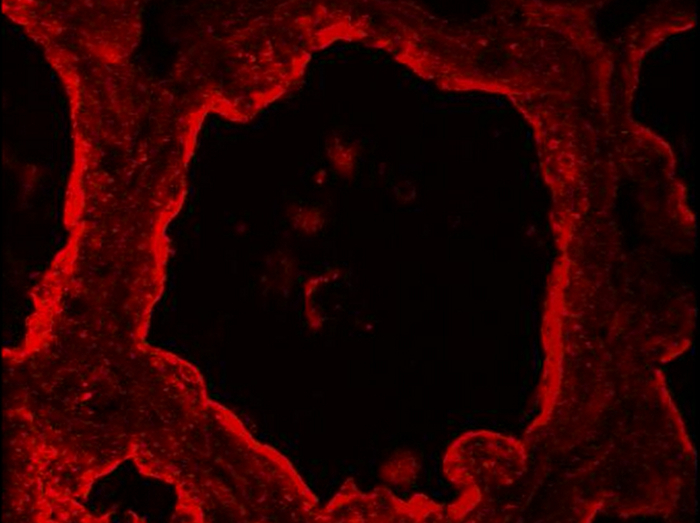
일반 유선에서, 근 상피 및 내강 MESCs 세포 CK14과 CK8, 자신의 차동 식 각각 (그림 5)를 기반으로 구별 될 수있다. 이 세포질 마커는 PFA 고정 및 AR 후 수유 쥐의 유방 절에서 검출된다. 이미지는 종래의 표면 형광 현미경으로 획득 하였다. CK8는 내강 MESCs (그림 5, CK8)의 세포질에 걸쳐 분산 될 것으로 보인다. 빨간색 배경을 관찰합니다핵의 여러 레이어 (그림 5, -Ig1, 핵)을 표시 블루 DNA 라벨에 의해 제안 일차 항체없이 음성 대조군 (그림 5, -Ig1)에 대한 D는 조직 섹션 접는에 주로 기인한다. CK14는 특히 폐포 (그림 5, CK14)의 바닥에있는 평평하고 연장 근 상피 세포에서 관찰된다. 이러한 수축 세포 (49 그림 4 참조)에 존재 - (SMA) 근 상피 세포를 식별하는 또 다른 일반적인 방법은 알파 - 평활근 액틴을 검출하는 것이다.
마우스 유제품 검출
출산 후, 완전 분화 MESCs 우유의 풍부한 양을 생성하기 시작한다. 우유의 구성 요소는 서로 다른 경로를 40, 50에 의해 분비된다. 지질은 혀끝의 PL의 신진에 의해 MFGs로 출시되는 반면 카제인 미셀은 골지 유래의 SV의 세포 외 유출에 의해 분비된다MESCs의 ASMA 막 (그림 2, 유방 상피 분비 세포). 일부 실험에서, 새끼 젖 분비 (46, 47)을 느리게하기 위해, 유선 수집 전에 여성 4-6 시간 분리된다. 이러한 조건 하에서, MESCs의 꼭대기 세포막과 루멘의 콘텐츠를 쉽게 폐포가 수축되고, 내강이 폐쇄되기 때문에 유아 중하지 않은 경우, 관찰 할 수있다. 이러한 덫으로 막 인신 매매에 관여하는 단백질을 연구 할 때 또한, 분비를 감속도 필수적이다. 실제로, 도너와 억 셉터와 그들의 세포 내 구획 사이 지역화 사이클 막 회전율이 높을 때 표지는 종종, 확산하기 때문에, 즉., 유아 중에 결정하기 어렵다 스네어. 따라서, 새끼를 제거하여 우유 분비를 감속하는 것은 T-과 v 올무가 우선적으로 기증자에 거주 할 때 덫의 세포 내 현지화를 연구하는 적절한 조건을 제공합니다및 수용체의 구획은 각각 (아래 참조).
그림 6은 새끼의 존재 수유의 날 (10)의 수유 마우스 유방 동맥의 카제인의 현지화, (그림 6, + P) 또는 부재 (그림 6, -p)를 보여줍니다. 조직 절편은 종래의 표면 형광 현미경 (오른쪽에있는 세 개의 열) 및 공 초점 현미경 (도 6, 좌측 열) 모두에 의해 관찰되었다. 유아 동안, 카제인은 주로 혀끝의 지역에서 (그림 6, + P, 화살촉)를 축적 한 것으로 나타났습니다. 공 초점 현미경, 카세인은 새끼의 존재 MESCs의 기저 측에, 비록 적은 정도, 또한 (도 6 + P, 화살표) 존재 명확 종래 현미경 (도 6, 카세인에서 관찰 할 수없는 것을 알 비교) 왼쪽과 오른쪽 패널. 실제로, 다양한 필드의 표면 형광, 형광은 샘플 (배경 fluorescen 의해 방출CE)는 여기를 통과하여 부피 (포커스 아웃 형광) 대물 초점면에서 관찰되는 객체의 해상도를 변경한다. 이 두꺼운 시편 (두꺼운보다 2 μm의)에 특히 사실이다. 필드의 깊이를 제어 할 수 있고, 배경 형광이 초점 평면에서 제외 같이 공 초점 현미경, 표면 형광 작성된 시험편에서 고품질의 화상을 얻을 수있다. 또한, 새끼 (도 6 + P)의 존재하에, 폐포의 내강이 매우 닫히고 MESCs의 정점 측,의 경우 루멘 새끼 (도 6, -p)의 부재 하에서 더 관찰 폐포 인해 우유 제품의 축적으로 팽창한다. 우유 분비가 둔화되면, 카제인은 혀끝의 세포막 (그림 6, -p, 화살촉) 아래에 축적 된 나타나며, 명확하게 MESCs (그림 6, -p, 화살표)의 기저 측면에서 관찰된다. 차 antib없이 음성 대조군ODY는 라벨 (그림 6, -Ig1)를 보이지 않았다.
우유 제품은 쉽게 카제인과 CLDs 및 MFGs (그림 7)의 중성 지질으로 대조 IHC를 결합하여 감지 된 공동 수 있습니다. 조직 섹션은 각 Z 예측 또는 3D 전망을 생산하기 위해 ImageJ에와 후 처리 하였다 공 초점 현미경으로 Z - 스택 (그림 7, 카제인, 지질) 또는 모든 색상 채널 (그림 7, 병합)으로 몇 군데 있었다. 생성 된 이미지 시퀀스는 하나의 이미지 (그림 7, 8) 또는 영화 (보충 동영상 참조)로 저장되어있다.
일부 표시가 기저 측면에서 관찰되었지만 여성이 이전에 새끼 (그림 6, + P)로부터 분리되지 않은 경우 이미 설명한 바와 같이, 카제인은 주로 MESCs의 혀끝의 측면 (그림 7, + P)에 축적되었다. CLDs는 주로 큰 비밀 반면, MESCs의 혀끝의 지역에서 지역화에드 MFGs은 폐포의 루멘에 존재한다. (그림 7 + p와 -p 비교) 카제인과 MFGs 쉽게 새끼의 부재에서 폐포의 루멘으로 시각화되어 있습니다. 카제인은 두 가지 색상 채널의 중첩은 (그림 7 사진을 병합) 노란색 라벨을 생산하지 않기 때문에 이러한 조건에서 CLDs 또는 MFGs으로-지역화 공동하지 않습니다. 그러나, 이미지 스택 후 처리는 카제인이 단백질 (사진 병합, 그림 7) MFG와 상호 작용할 수 있음을 시사 폐포의 루멘의 분비 MFGs을 둘러싸고 있음을 보여준다. (각각의 컬러 채널에 대한 3 차원 Zproj PROJ 비교,도 7)에 사용되는 각각의 후 처리에 의해 생성 된 이미지의 차이를 참고.
butyrophilin의 탐지, MFGs의 단백질 마커.
인 btn1 우유 51 MFGs과 관련된 주요 단백질 중 하나입니다. 이 막 횡단 단백질이다 mainly는 MESCs의 혀끝의 세포막에서 지역화 및 결과 (52) 신진에 의해 출시 된 이후 MFG의 표면에서 발견된다.에, 수유의 날 10, 인 btn1 주로 혀끝의 세포막에서 번역 된 것을 보여줍니다 그림 8과 낮은 정도, MESCs의 정점 지역. 인 btn1은 폐포의 루멘뿐만 아니라 혀끝 CLDs의 일부로서 (그림 8, 3 차원 PROJ 병합, 화살촉)에 존재하는 MFGs을 둘러싸고 있습니다. (그림 8, 3 차원 PROJ) 전술 한 바와 같이 결과, 획득 한 이미지의 Z - 스택 (그림 8, 이미지) 또는 ImageJ에의 3D 프로젝션 명령으로 생성 된 3D보기로 추출 된 하나의 이미지로 표시됩니다. 하나의 이미지가 단백질의 정점 분포되지만 분비 MFGs 또는 정점 CLDs에만 Z 스택의 3D 재구성 후에 관찰과 인 btn1의 공간적 관계를 관찰하기에 충분할 수 있음을 유의 (도 8 인 btn1 화상 비교 및 3D PROJ 병합 PICTURES). Z-스택은 또한 단백질의 분포의보다 나은 공간 파악할 수 있도록 동영상으로 재구성 될 수있다. 혼자 인 btn1 취득 이미지 Z - 스택 (보충 영화 1, 3) 또는 두 개의 다른 색상 채널 중첩 (병합, 보충 영화 2, 4) 예제로 표시됩니다. Z-스택 화상 전체 스택의 3 차원 돌출부 (보충 영화 1, 2) 나 회전 뷰와 (y 축 께) 위에서 아래로 화상별로 화상을 판독 할 수있다 (보조 영화 (3, 4) ).
두 SNARE 단백질의 검출 : Stx6과 VAMP4
앞서 언급 한 바와 같이, 스네어는 막 - 결합 단백질이 기증자와 수용체 세포막 사이의 순환. 그것은 공부를 할 때 유선를 수집하기 전에 새끼에서 여성을 분리하여 MESCs의 높은 분비 활동과 관련된 막 회전율 속도를 느리게하는 것이 좋다이 단백질. Stx6 및 VAMP4 모두 트랜스 - 골지 네트워크 (53, 54)과 연관되는 것으로 설명되었다. 그러나, 이들 SNARE 단백질은 또한 분비 과립 (Stx6) 55, 56와 골지체 (VAMP4) (57)로서 다른 세포 구획 수준에서 중요한 역할을 할 수있다. 이전의 연구는 SNARE 단백질은 카제인 35,36 분비에 중요한 역할을한다는 것을 제안한다. 수유하는 동안, Stx6 및 VAMP4는 MESCs의 서브 혀끝의 지역에 위치하고 있습니다. Stx6는 골지체 및 트랜스 - 골지 네트워크 (도 9, Stx6)에 대응하고 핵의 MEC의 정단 막 사이 관찰 및 정도는 덜하지만, 카제인 함유 36 SV들도 존재한다. VAMP4 또한 MESCs의 서브 혀끝의 지역에서 지역화되어 있지만, 라벨은 더 반점으로 나타나고 혀끝의 세포막 아래에 축적된다 (그림 9, VAMP4)으로 인해 CLDs과 카세인 - 접점 모두와의 연결에ining의 SV들 (36). 일차 항체가없는 음성 대조군은 라벨을 초래하지 않았다.

그림 1. 마우스 배아 및 성인 생활 동안 유선 개발. (A) 마우스 유방 동맥은 (핑크) 외배엽 (하늘색) 우유 라인에서 배아 일 10 (E10)의 주위에 개발을 시작합니다. E11.5에서 placodes는 유방 우유 라인을 따라 대칭 적으로 형성과 주변 중간 엽 (다크 블루)가 응축하기 시작합니다. placodes는 E15.5에 싹 (E12.5-E14.5)과을 형성 invaginate, 유방 상피 (핑크), 증식 및 (지방 패드쪽으로 유방 중간 엽을 통해 밀어 주 새싹을 형성하는 밝은 녹색을 연장 ). 중공 루멘의 형태와는 유두 (보라색)을 야기 할 열립니다. E18.5에서 유방 상피 rudimenta를 형성외부 접속 RY 분기 구조. 맥밀란 출판사 (주)의 허가에 의해 6에서 적응 : 자연은 사춘기 동안 유전학, 저작권 2007 년 (B)를 리뷰, 유방 상피 (보라색)은 중요한 성장 단계 (광범위한 신장, 분기 및 측면 분기)를 입력합니다. 임신, 광범위하고 빠른 확산의 시작뿐만 아니라 측면 분기에서 완전히 전체 유방 지방 패드를 침공 유방 상피의 상당한 확대로 이어지는 발생합니다. 내강 MESCs 우유 다량 분비 때 유방 상피 수유 동안 고도로 분화 된 기능 상태에 도달한다. 수유는 유선 인벌 류트를 이유 후 중단합니다. MESCs은 지방 조직으로 대체 lobulo - 폐포 구조의 소멸로 이어지는, 세포 사멸 및 식균 작용에 의해 제거된다. http://brisken-lab.epfl.ch/research의 계획 1 장 2.2에서 적응. http://tvmouse.ucdavis.edu/bcancercd/22/index.html을. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
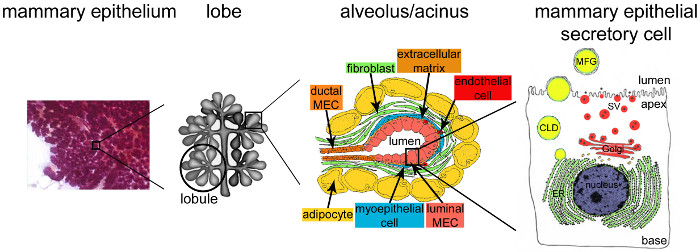
수유하는 동안 유선의 그림 2. 아키텍처. 수유하는 동안은 완전히 개발과 고도의 분기 상피 (보라색)은 유방 조직의 대다수를 차지한다. 상피 조직은 여러 종류의 세포 (섬유 아세포, 지방 세포, 평활근 세포, 혈액 및 림프관 및 신경 말단)를 함유 기질에 매립 세뇨관 폐포 구조에 의해 형성된다. MESCs는 로브를 형성 소엽에서 조립 선포 구조 또는 폐포로 구성되어 있습니다. 각 폐포 따라서 우유 거라고 수 있도록, 소엽 및 interlobular 채널 고도로 분지 된 네트워크에 접속되어 기능성 우유 - 생산 단위외부에 비가 내렸다. 각각의 폐포가 편광 MESCs의 단일 층으로 구분되어,의 정점 팀은 중앙 루멘 국경. MESCs의 기부 쪽은 세포 외 기질과 수축 근 상피 세포에 밀착된다. 우유 제품은 MESCs의 혀끝의 측면에서 해제됩니다. 지질이 MESCs의 혀끝의 세포막의 신진에 의해 우유 지방 구체 (MFGs)로 출시되는 동안 주요 우유 (카제인)은 골지 유래 분비 소포 (SV들)의 세포 외 유출에 의한 카제인 미셀 (검은 점)으로 분비된다. CLD : 세포질 지질; ER : 소포체; 멕 : 유방 상피 세포. 장 2.2에서 적응. http://tvmouse.ucdavis.edu/bcancercd/22/index.html.도. 02 www.cellbiol.net/ste/alpHERCEPTIN1.php, 그림. (58)에 26-02, 50에서. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
부근에 자리 잡고 페이지 = "항상"> 

그림 3. 실험 절차는 마우스 유방 동맥의 동결 절편에 간접 면역 형광을 수행 할 수 있습니다. 유선은 수유의 날 10 CD1 여성 마우스에서 수집됩니다. 유방 조직의 OCT 화합물에 포함 된 스냅 냉동되기 전에 파라 포름 알데히드로 고정하고 자당에 주입되는 작은 조각으로 절단한다. 유선 샘플은 각각 기본 및 형광 색소 - 복합 이차 항체 연속 배양 얇은 동결 절편으로 절단 및 IIF에 대한 처리됩니다. 설치 후, 샘플은 이후 후 처리 할 수있는 이미지의 취득을 허용, 형광 현미경으로 분석된다./53179/53179fig3large.jpg "대상 ="_ 빈 ">이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

. 그림 마우스 유방 동맥의 4 해부학 적 위치 왼쪽 : 임신 후기 단계에서 마우스 유선 시스템의 복부보기. 오른쪽 : 현지화 및 마우스에서 임신 후기 단계에서 유선의 측면. 수유하는 동안, 유선이 두꺼운 인해 폐포에서 우유의 존재에 하얀 표시합니다. http://ctrgenpath.net/static/atlas/mousehistology/Windows/femaleu/mousemammgldiagram.html 및 http://www.pathbase.net/Necropsy_of_the_Mouse/index.php?file=Chapter_3.html에서 적응. 여기를 클릭하십시오 이 그림의 더 큰 버전을 볼 수 있습니다.
-together.within 페이지 = "항상"> 
마우스 유방 동맥의 내강 상피 세포와 기저 근 상피 세포의 그림 5. 확인. 내강 MESCs 및 근 상피 세포는 CK-8과 CK-14의 발현에 따라 수유의 날 (10)에 마우스 유방 동맥에 IIF에 의해 식별된다 , 각기. 핵 DNA는 DAPI (파란색)로 염색했다. 이미지는 종래의 표면 형광 현미경으로 획득 하였다. 합성 사진은 (병합) 각각 카제인 (빨간색)과 핵에 (파란색)에 대응하는 라벨의 중첩을 보여줍니다. -Ig1, 일차 항체없이 음성 대조군. 별표는 루멘을 나타냅니다. 스케일 바 = 100 μm의. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
전자 6 "SRC ="/ 파일 / ftp_upload / 53179 / 53179fig6.jpg "/>
그림 마우스 유방 동맥의 카제인 6. 세포 현지화. 카제인은 수유의 날 (10)에 마우스 유방 동맥에 IIF에 의해 감지됩니다. 유선은 존재 (P +) 또는 새끼의 부재 (-p)의 암컷으로부터 수집 하였다. 이미지는 기존에 인수 (오른쪽 패널, 카제인, 핵 및 병합) 또는 한 공 초점 (카제인 (적색), 왼쪽 패널) 형광 현미경. 두 조건에서, 카제인 (적색) 혀끝 지역 (화살촉)와 MESCs (화살표)의 기저에서 어느 정도 검출된다. 일차 항체가없는 음성 대조군은 라벨 (-Ig1)를 표시하지 않습니다. 핵 DNA는 DAPI (파란색)로 염색한다. 합성 사진은 (병합) 각각 카제인 (빨간색)과 핵에 (파란색)에 대응하는 라벨의 중첩을 보여줍니다. 별표는 루멘을 나타냅니다. 스케일 바 표면 형광 이미지 = 100 ㎛ (오른쪽 패널, 카제인, 핵, 병합)과 = 10# 181;. 공 초점 이미지 (왼쪽 열)에 대한 M 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
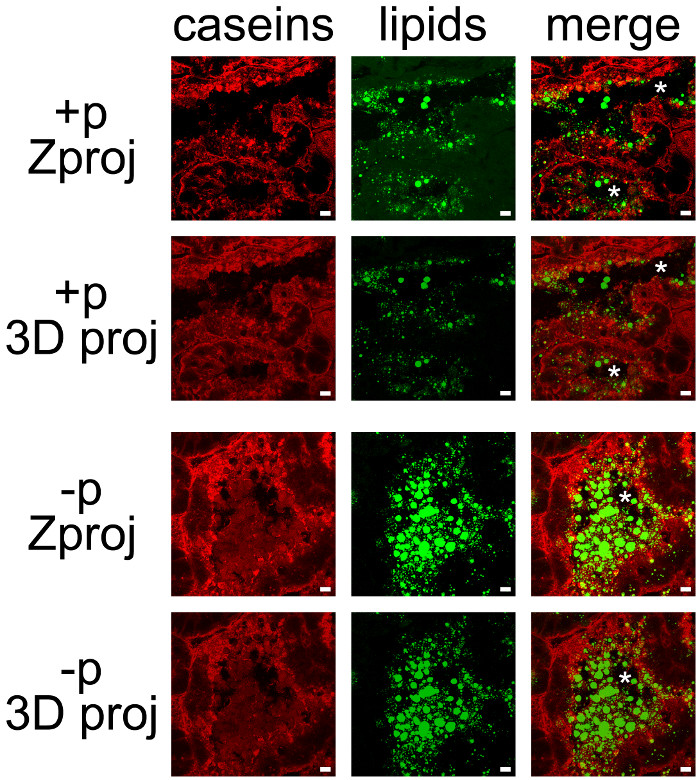
마우스 유선에서 우유 제품의 그림 7. 셀룰러 현지화. 카제인 (빨간색)이 존재 수유의 날 (10)에 마우스 유방 동맥에 IIF에 의해 감지 (+ P) 또는 새끼의 부재 (-p)에서. 중성 지질 (CLDs과 MFGs는) BODIPY 503분의 493 (녹색)으로 대조된다. 합성 사진 (병합) 두 labelings의 중첩을 보여줍니다. 이미지는 공 초점 현미경으로 Z-스택으로 인수했다. Z - 스택은 모두 각 채널 (병합)에서 Z 예측 (Zproj) 또는 전체 스택의 3D 돌기 (y 축)에 (3D PROJ)를 생성하기 위해 ImageJ에와 후 처리 하였다. 별표는 루멘을 나타냅니다. 스케일 바= 10 μm의. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

마우스 유방 선에 butyrophilin 및 지질의도 8 셀룰러 지역화. 인 btn1 (적색) 새끼의 부재 수유 10 일에 마우스 유선 IIF에 의해 검출된다. 중성 지질 (CLDs 및 MFGs)와 핵 DNA는 각각 BODIPY 503분의 493 (녹색) 및 DAPI (파란색)으로 대조된다. 이미지는 이미지 Z - 스택으로 공 초점 현미경으로 인수했다. 결과 이미지 스택으로부터 추출한 하나의 이미지로 표시 (이미지, 인 btn1, 지질, 핵 및 병합) 화상 전체 스택의 3D 뷰 (Y 축)을 생성하거나 ImageJ에있는 후 처리 후의 아르 (3 차원 PROJ, 인 btn1 , 지질, 핵,) 병합합니다. 합성 사진 (병합)를 표시세 가지 색상 채널의 중첩. -Ig1, 일차 항체없이 음성 대조군. 별표는 루멘을 나타냅니다. 스케일 바 = 10 μm의. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 마우스 유선. 신택 6 (Stx6) 및 VAMP4 (V4)의 두 SNARE 단백질의 9 셀룰러 지역화 수유의 날 (10)에 마우스 유방 동맥에 IIF에 의해 감지됩니다. 이미지는 종래의 (전환 수) 표면 형광 또는 공 초점 (LSM) 현미경으로 인수했다. 합성 사진 (병합)은 각 SNARE 단백질 (빨간색)에 대해 각각 DAPI으로 대조 핵 DNA (거짓 녹색), 관찰 라벨의 중첩을 보여줍니다. -Ig1, 일차 항체없이 음성 대조군. 별표S는 루멘을 나타냅니다. 스케일 바 공 초점 사진을 = 10 μm의 표면 형광 사진을 = 100 μm의. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.


표 1. 면역 조직 화학의 문제 해결 가이드.

보충 영화 마우스 유방 동맥에 butyrophilin 1. 현지화. 인 btn1 (빨간색)은 수유의 날 (10)에 마우스 유방 동맥에 IIF에 의해 검출된다. 이미지가 공동으로 인수했다 Z-스택과 같은 n 초점 현미경 영화를 생성하기 위해 ImageJ에 함께 게시물이 처리. Z-스택이 위에서 아래로 읽습니다. 이 비디오를 보려면 여기를 클릭하십시오.

보충 영화 마우스 유방 동맥에 butyrophilin 중성 지질 2. 현지화. 인 btn1 (빨간색)은 수유의 날 (10)에 마우스를 유선에 IIF에 의해 검출된다. 중성 지질 (CLDs 및 MFGs)와 핵 DNA는 각각 BODIPY 503분의 493 (녹색) 및 DAPI (파란색)으로 대조된다. 이미지는 각각의 컬러 채널에 대한 Z-스택으로 공 촛점 현미경으로 획득 된 상기 3 색상 채널 중첩 복합 Z 스택을 생성하기 위해 함께 ImageJ에 사후 처리 하였다 하였다. 얻어진 복합 Z-스택은 위에서 아래로 판독된다.https://www.jove.com/files/ftp_upload/53179/supvid2.mp4 "대상 ="_ 빈 ">이 비디오를 보려면 여기를 클릭하십시오.
보충 영화 마우스 유방 동맥에 butyrophilin 3. 현지화. 인 btn1 (빨간색)은 수유의 날 (10)에 마우스 유방 동맥에 IIF에 의해 검출된다. 이미지는 Z-스택 및 후 처리 ImageJ에 (3D 프로젝션)와 인 btn1 라벨의 공간 뷰를 회전 (y 축)을 생성하는 공 초점 현미경으로 인수했다. 이 비디오를 보려면 여기를 클릭하십시오.

마우스 엄마의 butyrophilin 중성 지질의 보충 영화 4. 현지화mmary 선. 인 btn1 (빨간색)은 수유의 날 (10)에 마우스 유방 동맥에 IIF에 의해 검출된다. 중성 지질 (CLDs 및 MFGs)와 핵 DNA는 각각 BODIPY 503분의 493 (녹색) 및 DAPI (파란색)으로 대조된다. 이미지는 각각의 컬러 채널에 대한 Z-스택으로 공 촛점 현미경으로 획득 된 상기 3 색상 채널 중첩 복합 Z 스택을 생성하기 위해 함께 ImageJ에 사후 처리 하였다 하였다. ImageJ에 (3D 프로젝션은) 더 복합 Z - 스택의 공간 뷰를 회전 (y 축)을 생성하는 데 사용되었다. 이 비디오를 보려면 여기를 클릭하십시오.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
IHC는 주로 특정 항원 - 항체의 상호 작용에 따라 조직 섹션에서 항원을 지역화 할 수있는 비교적 단순하고 간단 실험 방법이다. 프로토콜의 다수 IIF 의해 단백질 국산화 사용되지만,이 절차의 핵심은 거의 항상 동일하다. 그러나 강하게 결과에 영향을 미칠 수 있으므로 각 개별 IHC 연구에 최적화해야합니다 몇 가지 중요한 측면이있다. 이 방식의 가장 도전적인 양태, 즉 가장 실험 조건을 결정하는 것이다. 관심있는 항원에 대한 강한 신호를 생성하는 특정자는. 실험 설계 및 최적화를 위해 고려되어야하는 변수는 : 항원 (1)의 유형 (종, 발현 수준, 세포 내 위치); (2) 타입 에피토프 (서열, 형태, 추정 번역 후 변형); (3) 시료 전처리 (파라핀 또는 동결 절편을 위해 포함); (4) 정착 메트OD (관류 또는 침수) (5) (포름 알데히드, 알코올 또는 아세톤)를 사용 고정액; (6)에 사용되는 차단 시약 (정상 혈청, BSA 또는 무 지방 우유); (7) AR 단계; (8) 검출 방법을 (직접 또는 간접); (8) (모노클로 날 또는 폴리 클로 날) 일차 항체의 유형; (9) 이차 항체 (라벨 종); (10) 대조 염색 (핵 및 / 또는 다른 세포 구획 표시) 및 (11)에 장착 매체 (자세한 내용은 표 1 참조). 고정 및 블로킹 단계는 적어도, 이러한 농도의 pH, 온도, 배양 시간 및 희석제와 같은 부가적인 요인의 최적화를 필요로한다.
첫번째 중요한 측면 밀접 차례로 결과의 품질에 영향을 고정하는 방법에 연결되어 조직 샘플의 제조에 관한 것이다. 예를 들어, 직물 조각은 고정 될 수 있거나 또는 이전에 매립하지. 이 단계는 또한 파라핀 매립 대 즉 선택된 매립 방법,의 OCT 화합물에 의존 할 수있다어느 자체가 때때로 사용되는 일차 항체에 따라 달라집니다. 조직 고정 제는 고정 용액으로 마취 된 동물을 관류하여 생체 내에서 수행 될 수있다. 이 방법은 손상 조직을 연구 할 때 항원을 보존하는 데 유용하지만, 관심의 조직 문제를 해결하기에 충분하지 않을 수 있습니다. 이 경우, 작은 조직 조각 (NO 10mm보다 두꺼운) 고착성 용액에 침지 될 수있다. 냉동 조직은 액체 질소 또는 이소 펜탄에 조직을 침지하여 제조 및 스냅인을 동결 할 수 있습니다 높은 등의 인산화로 번역 후 변형의 결과 탐지하는 것이 좋습니다. 그러나, 파라핀 포매 조직 달리 동결 인해 세포 내 형태를 변경시킬 수 셀들 내에 얼음 결정의 형성을 조직의 장기 보존에 적합하지 않다. 절단되면, 냉동 조직 절편은 최대 1 년 -80 ° C에 저장할 수 있습니다. 어떤 경우에, 조직 샘플의 제조는 조직을 보존 간의 타협이다/ 셀룰러 아키텍처와 에피토프의 무결성을 유지.
그 조직의 화학 성분을 변화하기 때문에, (인터넷 xation 미만) 불완전 과도한 (overfixation) 인터넷 xation 모두 않도록 고정 상태를 최적화하는 것이 중요하다.
실제로, underfixation 특정 항원의 단백질 분해 분해를 촉진하여 특정 신호를 감소시킬 수있다. 한편, overfixation는 에피토프를 마스킹하거나 강한 비특이적 백그라운드를 생성함으로써, 특정 표시를 바꿀 수있다. 따라서, 고정 제 용액의 선택에 부가하여, 이러한 배양 시간과 같은 다른 매개 변수는 온도 및 pH는 조직 정착에 영향을 미칠 것이다. PFA이 IHC에 사용되는 가장 일반적인 정착액이지만, 그것은 "범용"고정액으로 고려 될 수 없다. PFA는 단백질 - 단백질 및 단백질 - 핵산 가교를 유도하고, 따라서 그 artefactually RECO 않도록 다음 에피토프 (overfixation)을 수정할 수 있고차 항체에 의한 gnition. 그러나, 상기 에피토프 AR 기술 (아래 참조)로 가면된다. 이 세포질 막에서 일부 인산화 단백질의 전좌를 유도하기 위해 도시 된 바와 같이 PFA는, 특정 항원의 검출에 부적합 할 수있다. 이러한 경우, PFA는 알콜과 같은 적합한 고정 제의 대안으로 대체되어야한다. 그들은 조직에있는 물 분자를 교체함으로써 조직 정착을 허용 이후 PFA 달리, 예를 들어 메탄올 또는 에탄올 등의 알코올은 에피토프를 마스킹하지 않는다. 이 단백질의 침전을 야기하고 구조적인 변화에 의한 항체 / 항원 상호 작용을 방지 할 수있다. 널리 알코올이 침입하지 않으며, 따라서 PFA뿐만 아니라 조직 형태를 유지하지 않는 것으로 생각된다. 아세톤은 고정되지 않은, 스냅 냉동 조직 절편 작업을 할 때 일반적으로 사용되는 또 다른 대안 정착입니다. 그러나, 아세톤 강한 탈수제과 조직 단백질의 돌이킬 수없는 침전 될 수 있습니다.
일부 항원의 경우, AR의 추가 단계는 정착액이 형태 적 변화를 유도 또는 (에피토프 마스킹) 에피토프의 정전기를 변경하는 경우, 주로, 양호한 신호를 얻는 것이 요구 될 수있다. AR 방법은 항원의 면역 반응과 차 항체와 그 이후의 상호 작용을 복원하기 위해 이러한 프로세스를 반대하는 것을 목표로하고 있습니다. AR 방법은 주로 두 가지 방법에 의존한다 : 이러한 에피토프를 마스킹 펩티드를 절단 테 K, 트립신 또는 펩신과 같은 효소 (1) 프로테아제 유발 에피토프 검색, 즉; (2) 열을 유발 에피토프 검색, 즉, 전자 레인지, 압력 밥솥, 야채 증기선, 오토 클레이브 또는 물 화장실을 사용. 이 후자의 접근 방식은 특히, 시간 - 온도 -, buffer-, pH를 구분하며 최적의 조건을 경험적으로 (예 프로토콜 섹션에서 제공됩니다) 결정되어야한다. 대안 적으로, 항원에 대한 항체의 친 화성을 향상시킬 수있다산도 또는 항체 희석제의 양이온의 농도를 변화시킴으로써.
투과성으로 단계는 때때로, 특히 항원 핵 염색을 위해, 두꺼운 조직 절편에서 세포 내 에피토프에 대해 우수한 신호를 얻을 필요가있다. 이것을 사용하여 다양한 방식으로 달성 될 수있다 : (1) 고정 제 등의 알코올 또는 아세톤; 또는 (2) 트리톤, NP-40 (PBS에서 0.1 ~ 0.2 %, 10 분), 디기 토닌, 사포닌 또는 트윈 20 세제 PFA 고정 후 (10 분 30에 대해 0.2 ~ 0.5 %). 그러나, 세제의 선택은 검출 세포 에피토프 위치에 의존한다. 사실, 세포막을 용해 등의 트리톤 - X100과 같은 가혹한 세제, 핵 항원 검출에 적합하지만, 일부 멤브레인 단백질의 추출에 변경을 신호로 이어질 수 있습니다. 온화한 세제 (사포닌 및 트윈 20)의 사용은 세포질 에피토프의 검출에보다 적합하다.
두번째 중요한 단계이다 blockin비특이적 염색 g. 목표 에피토프에 대한 항체의 결합은 분자간 힘 (예를 들어, 소수성 및 이온의 상호 작용, 수소 결합)의 적용을받습니다. 따라서, 자신의 목표 항원 이외의 단백질과 기본 및 / 또는 이차 항체의 상호 작용이 아닌 특정 얼룩의 원인이 될 수 있습니다. 이것은 관심있는 단백질의 시각화 (낮은 신호 / 잡음비)을 방지 높은 배경 형광을 발생시킨다. 시약을 차단하면 특정 항체 / 항원의 상호 작용을 손상시키지 않고 비특이적 상호 작용을 감소시킨다. 일반적인 절차는 열 불 활성화 정상 혈청 또는 BSA와 조직 절편을 배양으로 구성되어 있습니다. 정상 혈청을 사용할 때, 이차 항체의 숙주 동물의 것과 무관 또는 종으로부터의 동일한 종에서해야한다. 모든 경우에, 선택된 차단 시약은 또한 일차 및 이차 항체 희석제에 첨가되어야한다. 또한, 예컨대 트리톤 X-100, T와 같은 비이 온성 세제의 사용싸우는 20 사포닌 비특이적 상호 작용을 감소 시키는데 도움.
셋째 아마도 가장 중요한 매개 변수는 차 항체의 선택 및 최적화이다. 물론, 최선의 선택은 최소한의 교차 반응성을 가진 고품질의 항체이다. 단일 클론 항체는 일반적으로 하나의 항원에 대한 높은 친화력과 특이성을 전시, 그들은 높은 서열 동일성을 가진 단백질 가족의 특정 구성원을 구별하는 가장 좋은 도구입니다. 표적 에피토프 네이티브 구조적 상태를 잃은 경우 또는 에피토프에 대한 액세스는 다른 단백질, 번역 후 변형, 온도, pH, 정착 및 염 농도와의 상호 작용에 의해 방지된다 그러나, 항체 / 항원 상호 작용이 손상 될 수있다. 이러한 경우, 폴리 클로 날 항체가 동일한 단백질의 여러 에피토프를 인식으로 더 적합하다. 또한, 그들은 종종 pH 및 염 농도의 넓은 범위에 걸쳐 단일 클론 항체보다 더 안정하다.에 대한 경험적으로 결정해야, 배양 시간, 희석제 및 온도, 예비 연구는 적절한 배양 조건, 즉, 작업 희석 (1.7-15 ㎎ / ㎖ : 5-25 ㎎ / ㎖, 폴리 클로 날 항체 단일 클론 항체)를 정의해야 각 차 항체. 이들 파라미터는 낮은 배경 잡음 신호를 생성 최적 조건을 결정하기 위해 최적화되어야한다. 라벨의 특이성 (예. RT 대, 4 ° C를) 낮은 온도에서 더 이상 배양 시간이 선호된다.
직접 또는 간접 검출을 수행하는 선택은 주로 항원 발현 수준에 달려있다. 예를 들어, 고도로 발현 된 에피토프는 간단히 인해 이차 항체를 사용하는 것이 가능 비특이적 배경을 회피하면서 따라서 빠르고 간단한 다색 염색을 가능 형광 색소 공역 차 항체로 검출 할 수있다. 그러나,의 5 월은 더 높은 비용이 낮은 신호를 생성하는 경우 직접, 수ometimes 어려울 수, 표지 된 항체는 상업적으로 사용할 수 없습니다. 생성 된 신호는 상기 일차 항체 (증폭)으로 인해 (차 항체를 숙주 종에 대해 발생하는) 적어도 두 가지 표지 된 이차 항체의 상호 작용에 더욱 강렬 같이 반대로 IIF 낮은 발현 에피토프를 탐지에 더 민감하다. 또한, 다양한 형광 접합 이차 항체의 다양한 비교적 저렴한 시판되고, 품질 제어. 그러나, 이러한 접근 방식은 교차 - 반응성을 유도 할 수 있으며, 따라서주의 깊게 다중 표지 실험을 수행 할 때 동일한 종 또는 상이한 이소 타입의 생성하지 일차 항체를 선택하도록 요구한다. IIF는 또한 때때로 추가 차단 단계가 필요하고 체계적인 음성 대조군 (아래 참조)을 포함해야합니다. 증폭은 상기 MO 당 결합 바이오틴 - 컨쥬 게이트 화 2 차 항체를 사용하여 달성 형광 아비딘 또는 스트렙 타비 딘 (네 biotins를 표시 할 수lecule). 그럼에도 불구하고,이 증폭 방법은 비특이적 결합을 방지하기 위해 부가적인 단계가 필요 인한 내인성 비오틴 높은 수준의 존재에 일부 조직 (간, 신장, 심장, 뇌, 폐, 유선 수유)의 염색에 적합 할 수 없습니다 . 그러나, 내인성 비오틴은 아비딘을 사용하여 샘플을 예비 - 인큐베이션하여 후속 차 항체와 항온 처리하기 전에 비오틴으로 차단 될 수있다. 더 짧은 파장의 광에 의해 여기 될 때 광을 방출하는 특성을 가진 작은 화학 분자 공액 형광 색소의 선택은 주로 사용 가능한 현미경 장비의 타입에 의존한다.
적절하게 사용되는 형광 색소의 스펙트럼 특성과 항체 사이의 교차 모두 교차 반응을 제한하도록 설계 될 때, 면역 형광 계 IHC는 여러 표적 세포의 동시 시각화를 허용한다.
마지막으로 중요한IHC 실험에 관한 포인트, 염색의 유효성을 지원하기 위해 실험적 인공물을 식별하기 위해 수행하고 결과의 정확한 해석되어야 양성 및 음성 대조군에 관한 것이다. 일부 조직의 결과로 이어질 수 오해 (자가 형광이라고 함) 높은 형광 배경을 나타낸다. 따라서, 조직 절편을 IHC 실험을 시작하기 전에 두 형광 및 명 시야 조명으로 관찰 할 수있다. 일차 항체를 생략 대조군 체계적 이차 항체의 결합 가능성 비특이적 모호하지 무시할 수행하고 있는지 확인하거나 특정 염색 패턴을 닮은 위해 IHC 각 실험에 포함되어야한다. 같은 이소 타입의 비 - 면역 항체로 교체하여 차 항체 모노클로 작업 할 때 이소 제어가 수행 될 수있다 (예를 들어,의 IgG1, IgG2a, 카파의 IgG2b, IgM의) 동일한 농도. 이 컨트롤은 ES에 도움샘플과 항체의 상호 작용에 기인 할 수있다 비특이적 염색, timate. 4 ℃에서, (1 몰비 10) O / N (1)의 수용성 면역원으로 : 그 항원에 대한 항체의 결합을 특정 방법을 설명하기 위해, 흡수 제어 차 항체를 미리 항온 처리하여 두 가지 방법으로 달성 될 수있다 ; 및 (2) 세포 또는 관심있는 항원을 발현하지만이 연구 조직 다를 조직 섹션 (예를 들어, 59도 4b 참조). 두 경우 모두, 차 항체의 고갈은 필연적 거의 또는 전혀 오염으로 이어질 것이다. 제어의 다른 유형은, 부적합 차 항체를 사용하여 수행 할 수있다 즉. 관심 에피토프 상이한 셀룰러 지역화 (핵 대 세포질)을 나타내는 에피토프에 대해 지시. 무관 한 항체는 관심 차 항체로서 동일 종 및 이소 타입이어야한다. IHC 실험에 대한 추가 조절은 담배 마는 샘플에서의 사용을 포함 할 수있다관심의 에피토프 (형질 전환 동물을) 명시 적 또는하지 (녹아웃 동물)하는 것으로 알려져 단말. 이것은 유용한 기준을 제공하고, IHC 절차를 최적화 할 수있다.
IF 기술의 주요 제한은 단지 두 절차 잠재적 아티팩트를 유도하는, 고정 된 (죽은)에인가 및 / 또는 세포 투과성이 될 수 있다는 것이다. 이러한 접근의 다른 제한은 샘플의 관찰 용 현미경의 사용에 기인한다. 표면 형광 및 공 초점 현미경의 광학 해상도가 제한된다 첫째, 검출 된 단백질의 위치 또는 코 로케이션 해석을 통해-안된다. 둘째, 즉, photobleaching에. 빛에 노출되는 경우 시간이 지남에 따라 형광 강도의 페이딩 차례로 형광 물질의 광화학 파괴에 이르게, 형광 여기에 따라 시료 중의 활성 산소 종의 발생에 필수적으로 기인한다. 광표백은 감소 될 수있다)으로부터 보호 샘플 유지그들의 관찰 될 때까지 IF 실험 및 보관시 빛; b) 부착 매질 antifade 제 (활성 산소 제거제)를 사용하는 단계; c) 강도 및 / 또는 여기 광의 지속 기간을 감소시키는 단계; d) 형광 물질의 농도를 증가 또는 높은 양자 효율로 형광 색소의 낮은 농도를 사용하는 단계; 및 e) (예. 알렉사 루어, 세타 루어, 또는 DyLightFluors)을 photobleaching에 덜 경향이 강력한 형광체를 사용하여. 감소 피리딘 뉴클레오티드 (NADH : 흡수가 340nm, 방출 460 ㎚)에서 포유 동물 세포; 셋째, 자기 형광 인해 플라 빈 효소 (발광, 515 nm의 흡수를 450 nm의 FAD와 FMN)의 존재로 인해 종종있다. 또한, 시료를 고정하는 알데히드, 특히 글루 타르 알데히드의 용도는 높은 수준의 형광도 초래할 수있다. 이러한 및 / 또는 프로브 및 m 광학 필터를 선택하여 이전의 항체 배양을 PBS 중 0.1 %의 수소화 붕소 나트륨으로 세척하여 샘플을 최소화 할 수있다자기 형광을 형광 신호 상대적인 aximize. 넷째, 형광 오버랩들은 종종 매우 넓은 대역폭, 상이한 비대칭 스펙트럼 프로파일뿐만 아니라, 각종 발광 피크 파장과의 수를 나타낸다으로 인해 형광체의 발광 스펙트럼 특성을 주로 (또한 블리드 - 스루, 교차 또는 크로스 토크 라) 최대. 다른 형광의 여러 형광 (여러 가지 빛깔의 라벨링)와 협력 채널 (필터)의 한 형광의 방출을 특징으로 할 때 형광 중복이 발생합니다. 그들은 종종 특히 공동 위치 파악 또는 정량적 연구의 경우, IF의 결과 해석을 복잡으로 블리드 스루 아티팩트는 최소화되어야한다. 형광 방출의 균형이 약간 IF 절차에 의해서만 향상 될 수있는 바와 같이, 블리드 - 스루 것은 주로 적절히 separ하기 위해 최적화 된 형광 필터 집합 및 / 또는 광전자 증 배관 검출기를 사용하여 화상 취득시에 감소 될 수있다형광의 스펙트럼 프로파일을 먹었다. 이 특정 검출 채널로 각각 신호를 유도하여 개별 형광체의 분화 형광 발광 스펙트럼을 허용하기 때문에이 점에있어서, 공 초점 현미경은 다색 화상에 적합하다. 또한, 공 초점 현미경의 라벨링 순차 취득 (한 번에 하나의 형광 물질)에 대한 개별 감지 채널 이득, 광전자 증 전압 또는 레이저 전력을 조정할 수있다. 이상적으로, 단일 레이블 컨트롤은 블리드을 통해 정량화 결국 계산을 제거하기 위해 수행해야합니다. 이차 항체없는 대조군 (배경 제어) 신호 이득의 한계를 설정할 준비 최적 이미지 획득을위한 각 채널의 오프셋 될 수있다. 또한 정확한 이미지 배경 (자가 형광)에 취득 이후의 처리를 위해 사용될 수있다.
결론적으로, 설명 된 방법은 쉽게 realizati 대한 간단한 표준 프로토콜을 제공한다유선 부분에 면역 염색의에. 그럼에도 불구하고, IHC 실험의 주요 단계는 특정 염색을 시각화하고 비특이적 배경 신호를 최소화하기 위해 각각의 항원 / 항체 커플에 대해 최적화되어야한다. 한 방법은 얻어진 이미지의 대부분의 후 처리에 대한 몇 가지 기본적인 방법이 포함되어 있습니다. 형광 기반의 면역 진단에 항원의 세포 편재 광범위한 응용으로 강력한 방법이다. 이러한 방식의 새로운 진보는 이미지에, 새로운 형광, 획득 장치 및 현미경 기술의 미래 발전과 생물학적 구조와 과정의 이전에 관측 정보를 얻을 수 있습니다.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
저자는 그들이 더 경쟁 재정적 이익이 없다는 것을 선언합니다.
Acknowledgments
저자는 동물 관리 및 시설 (INRA, UMR1198, JOUY-KO-Josas의)와 IERP 단위의 직원 (UE 0907, INRA, JOUY-KO-Josas의) INRA MIMA2 이미징 핵심 시설에 감사드립니다. 우리는 또한 매우 유용 antibodie으로 우리를 제공 IH 메이, MC 네빌과 S. Tooze에게 감사의 말씀을 전합니다.
Materials
| Name | Company | Catalog Number | Comments |
| Dissection | |||
| Pins | |||
| Ethanol | |||
| Scissors | |||
| Scalpel and adapted blades | |||
| Ice | |||
| Towel paper | |||
| Tissue sample preparation | Company | Catalog Number | Comments/Description |
| Phosphate Buffered Saline (pH7.4) | Sigma | P-3813 | |
| Paraformaldehyde (PFA, 32% EM grade, 100 ml) | Electron Microscopy Sciences | 15714-S | personnal protection equipment required WARNING: this product will expose you to Formaldehyde Gas, a chemical known to cause cancer |
| OCT compound/Tissue Tek | Sakura | 4583 | |
| Sucrose (D-saccharose) | VWR | 27480.294 | |
| Plastic molds | Dominique Dutscher | 39910 | |
| Liquid nitrogen | |||
| Cryostat/sample support | Leica | CM3050S | |
| Razor blades (SEC35) | Thermo Scientific | 152200 | |
| Slide box | |||
| Glass slides Superfrost/Superfrost Ultra Plus | Thermo Scientific | 10143560W90/1014356190 | |
| Brushes | |||
| IHC | Company | Catalog Number | Comments/Description |
| Super Pap Pen | Sigma | Z377821-1EA | |
| Permanent marker (black) | |||
| 50 mM NH4Cl in PBS | Sigma | A-0171 | |
| 0.1 M glycine in PBS | VWR | 24403.367 | |
| Antigen Retrieval solution: Tris 100 mM 5% urea pH9.6 | |||
| Heater (up to 100°C) | |||
| Bovine Serum Albumin (BSA) | Sigma | A7906-100G | |
| Vectashield (anti-fading mounting medium) without DAPI/with DAPI | Vector Laboratories | H-1000/H-1200 | |
| Glass coverslips 22x50mm (microscopy grade) | VWR | CORN2980-225 | |
| Nail polish | |||
| Primary antibodies | Company | Catalog Number | Comments/Description |
| Rabbit anti-mouse caseins (#7781; 1:50 dilution) | generously gifted by M.C. Neville (University of Colorado Health Sciences Center, USA) |
||
| Mouse anti-cytokeratin 8 (CK8, clone 1E8, 1:50 dilution) | Biolegend (Covance) | MMS-162P | |
| Mouse anti-cytokeratin 14 (CK14, cloneLL002, 1:50 dilution) | Thermo Scientific | MS-115-P0/P1 | |
| Rabbit anti-butyrophilin (1:300 dilution) | generously gifted by I.H. Mather (Department of Animal and Avian Sciences University of Maryland College Park, USA) | ||
| Rabbit anti-Stx6 (1:50 dilution) | generously gifted S. Tooze (Cancer Research UK, London Research Institute, London, UK) |
||
| Rabbit anti-VAMP4 (1:50 dilution) | Abcam | ab3348 | |
| Secondary antibodies | Company | Catalog Number | Comments/Description |
| Rhodamine-conjugated goat anti-rabbit IgG (H + L) (1:300 dilution) | Jackson ImmunoResearch Laboratories | 111-025-003 | |
| Counterstains | Company | Catalog Number | Comments/Description |
| Bodipy 493/503 | Life Technologies (Molecular Probes) | D-3922 | |
| DAPI (4-6-diamidino-2-phenylindole) | Life Technologies (Molecular Probes) | D-1306 | |
| Observation/Image capture | Company | Catalog Number | Comments/Description |
| conventional fluorescence microscope | Leica Leitz DMRB microscope |
Standard filters for FITC, Rhodamine and DAPI emissions, ×63 oil-immersion objective (NA 1.3), DP50 imaging camera (Olympus), CellˆF software (Olympus) |
|
| Laser Scanning Microscope (confocal microscopy) | Zeiss LSM 510 microscope |
Plan-Apochromat ×63 oil-immersion objective (NA 1.4), CLSM 510 software, Confocal facilities, MIMA2 Platform, INRA Jouy-en-Josas, France, http://mima2.jouy.inra.fr/mima2) | |
| Image treatment | Company | Catalog Number | Comments/Description |
| ImageJ 1.49k software | Free software |
References
- Watson, C. J., Khaled, W. T. Mammary development in the embryo and adult: a journey of morphogenesis and commitment. Development. , 135-995 (2008).
- Smith, G. H. Experimental mammary epithelial morphogenesis in an in vivo model: evidence for distinct cellular progenitors of the ductal and lobular phenotype. Breast Cancer Res Treat. 39, 21-31 (1996).
- Van Keymeulen, A., et al. Distinct stem cells contribute to mammary gland development and maintenance. Nature. 479, 189-193 (2011).
- Oakes, S. R., Gallego-Ortega, D., Ormandy, C. J. The mammary cellular hierarchy and breast cancer. Cell Mol Life Sci. 71, 4301-4324 (2014).
- Visvader, J. E., Stingl, J. Mammary stem cells and the differentiation hierarchy: current status and perspectives. Genes & development. 28, 1143-1158 (2014).
- Robinson, G. W. Cooperation of signalling pathways in embryonic mammary gland development. Nat Rev Genet. 8, 963-972 (2007).
- Cowin, P., Wysolmerski, J. Molecular mechanisms guiding embryonic mammary gland development. Cold Spring Harb Perspect Biol. 2, a003251 (2010).
- Brisken, C., O'Malley, B. Hormone action in the mammary gland. Cold Spring Harb Perspect Biol. 2, a003178 (2010).
- Gjorevski, N., Nelson, C. M. Integrated morphodynamic signalling of the mammary gland. Nat Rev Mol Cell Biol. 12, 581-593 (2011).
- Daniel, C. W., Smith, G. H. The mammary gland: a model for development. J Mammary Gland Biol Neoplasia. 4, 3-8 (1999).
- Howlett, A. R., Bissell, M. J. The influence of tissue microenvironment (stroma and extracellular matrix) on the development and function of mammary epithelium. Epithelial Cell Biol. 2, 79-89 (1993).
- Edwards, G., Streuli, C. Signalling in extracellular-matrix-mediated control of epithelial cell phenotype. Biochem Soc Trans. 23, 464-468 (1995).
- Hennighausen, L., Robinson, G. W. Think globally, act locally: the making of a mouse mammary gland. Genes & development. 12, 449-455 (1998).
- Topper, Y. J., Freeman, C. S. Multiple hormone interactions in the developmental biology of the mammary gland. Physiol Rev. 60, 1049-1106 (1980).
- Brisken, C., et al. A paracrine role for the epithelial progesterone receptor in mammary gland development. Proc Natl Acad Sci U S A. 95, 5076-5081 (1998).
- Ormandy, C. J., Binart, N., Kelly, P. A. Mammary gland development in prolactin receptor knockout mice. J Mammary Gland Biol Neoplasia. 2, 355-364 (1997).
- Oakes, S. R., Rogers, R. L., Naylor, M. J., Ormandy, C. J. Prolactin regulation of mammary gland development. J Mammary Gland Biol Neoplasia. 13, 13-28 (2008).
- Hennighausen, L., Robinson, G. W. Information networks in the mammary gland. Nat Rev Mol Cell Biol. 6, 715-725 (2005).
- Kouros-Mehr, H., Werb, Z. Candidate regulators of mammary branching morphogenesis identified by genome-wide transcript analysis. Dev Dyn. 235, 3404-3412 (2006).
- Khaled, W. T., et al. The IL-4/IL-13/Stat6 signalling pathway promotes luminal mammary epithelial cell development. Development. 134, 2739-2750 (2007).
- Asselin-Labat, M. L., et al. Gata-3 is an essential regulator of mammary-gland morphogenesis and luminal-cell differentiation. Nat Cell Biol. 9, 201-209 (2007).
- Barcellos-Hoff, M. H., Aggeler, J., Ram, T. G., Bissell, M. J. Functional differentiation and alveolar morphogenesis of primary mammary cultures on reconstituted basement membrane. Development. 105, 223-235 (1989).
- Robinson, G. W., McKnight, R. A., Smith, G. H., Hennighausen, L. Mammary epithelial cells undergo secretory differentiation in cycling virgins but require pregnancy for the establishment of terminal differentiation. Development. 121, 2079-2090 (1995).
- Streuli, C. H., Bissell, M. J. Mammary epithelial cells, extracellular matrix, and gene expression. Cancer Treat Res. 53, 365-381 (1991).
- Streuli, C. H., et al. Laminin mediates tissue-specific gene expression in mammary epithelia. J Cell Biol. 129, 591-603 (1995).
- Boudreau, N., Sympson, C. J., Werb, Z., Bissell, M. J. Suppression of ICE and apoptosis in mammary epithelial cells by extracellular matrix. Science. 267, 891-893 (1995).
- Pullan, S., et al. Requirement of basement membrane for the suppression of programmed cell death in mammary epithelium. J Cell Sci. 109 (Pt 3), 631-642 (1996).
- Schmidhauser, C., Bissell, M. J., Myers, C. A., Casperson, G. F. Extracellular matrix and hormones transcriptionally regulate bovine beta-casein 5' sequences in stably transfected mouse mammary cells. Proc Natl Acad Sci U S A. 87, 9118-9122 (1990).
- Streuli, C. H., et al. Stat5 as a target for regulation by extracellular matrix. J Biol Chem. 270, 21639-21644 (1995).
- Sollner, T., et al. SNAP receptors implicated in vesicle targeting and fusion. Nature. 362, 318-324 (1993).
- Jahn, R., Scheller, R. H. SNAREs--engines for membrane fusion. Nat Rev Mol Cell Biol. 7, 631-643 (2006).
- Weber, T., et al. SNAREpins: minimal machinery for membrane fusion. Cell. 92, 759-772 (1998).
- Sollner, T., Bennett, M. K., Whiteheart, S. W., Scheller, R. H., Rothman, J. E. A protein assembly-disassembly pathway in vitro that may correspond to sequential steps of synaptic vesicle docking, activation, and fusion. Cell. 75, 409-418 (1993).
- McNew, J. A. Regulation of SNARE-mediated membrane fusion during exocytosis. Chem Rev. 108, 1669-1686 (2008).
- Wang, C. C., et al. VAMP8/endobrevin as a general vesicular SNARE for regulated exocytosis of the exocrine system. Mol Biol Cell. 18, 1056-1063 (2007).
- Chat, S., et al. Characterisation of the potential SNARE proteins relevant to milk product release by mouse mammary epithelial cells. Eur J Cell Biol. 90, 401-413 (2011).
- Reinhardt, T. A., Lippolis, J. D. Bovine milk fat globule membrane proteome. J Dairy Res. 73, 406-416 (2006).
- Robenek, H., et al. Butyrophilin controls milk fat globule secretion. Proc Natl Acad Sci U S A. 103, 10385-10390 (2006).
- Fujimoto, T., Ohsaki, Y., Cheng, J., Suzuki, M., Shinohara, Y. Lipid droplets: a classic organelle with new outfits. Histochem Cell Biol. 130, 263-279 (2008).
- Mather, I. H., Keenan, T. W. Origin and secretion of milk lipids. J Mammary Gland Biol Neoplasia. 3, 259-273 (1998).
- Heid, H. W., Keenan, T. W. Intracellular origin and secretion of milk fat globules. Eur J Cell Biol. 84, 245-258 (2005).
- McManaman, J. L., Russell, T. D., Schaack, J., Orlicky, D. J., Robenek, H. Molecular determinants of milk lipid secretion. J Mammary Gland Biol Neoplasia. 12, 259-268 (2007).
- de Assis, S., Warri, A., Cruz, M. I., Hilakivi-Clarke, L. Changes in mammary gland morphology and breast cancer risk in rats. Journal of visualized experiments : JoVE. , (2010).
- Plante, I., Stewart, M. K., Laird, D. W. Evaluation of mammary gland development and function in mouse models. Journal of visualized experiments : JoVE. , (2011).
- Galio, L., et al. MicroRNA in the ovine mammary gland during early pregnancy: spatial and temporal expression of miR-21, miR-205, and miR-200. Physiol Genomics. 45, 151-161 (2013).
- Linzell, J. L., Peaker, M. The effects of oxytocin and milk removal on milk secretion in the goat. J Physiol. 216, 717-734 (1971).
- Knight, C. H., Peaker, M., Wilde, C. J. Local control of mammary development and function. Rev Reprod. 3, 104-112 (1998).
- Walid, M. S., Osborne, T. J., Robinson, J. S. Primary brain sarcoma or metastatic carcinoma? Indian J Cancer. 46, 174-175 (2009).
- Hue-Beauvais, C., et al. Localisation of caveolin in mammary tissue depends on cell type. Cell Tissue Res. 328, 521-536 (2007).
- McManaman, J. L., Neville, M. C. Mammary physiology and milk secretion. Adv Drug Deliv Rev. 55, 629-641 (2003).
- Mather, I. H., Jack, L. J. A review of the molecular and cellular biology of butyrophilin, the major protein of bovine milk fat globule membrane. J Dairy Sci. 76, 3832-3850 (1993).
- Heid, H. W., Winter, S., Bruder, G., Keenan, T. W., Jarasch, E. D. Butyrophilin, an apical plasma membrane-associated glycoprotein characteristic of lactating mammary glands of diverse species. Biochim Biophys Acta. 728, 228-238 (1983).
- Bock, J. B., Klumperman, J., Davanger, S., Scheller, R. H. Syntaxin 6 functions in trans-Golgi network vesicle trafficking. Mol Biol Cell. 8, 1261-1271 (1997).
- Tran, T. H., Zeng, Q., Hong, W. VAMP4 cycles from the cell surface to the trans-Golgi network via sorting and recycling endosomes. J Cell Sci. 120, 1028-1041 (2007).
- Wendler, F., Page, L., Urbe, S., Tooze, S. A. Homotypic fusion of immature secretory granules during maturation requires syntaxin 6. Mol Biol Cell. 12, 1699-1709 (2001).
- Wendler, F., Tooze, S. Syntaxin 6: the promiscuous behaviour of a SNARE protein. Traffic. 2, 606-611 (2001).
- Shitara, A., et al. VAMP4 is required to maintain the ribbon structure of the Golgi apparatus. Mol Cell Biochem. 380, 11-21 (2013).
- Thibault, C., Levasseur, M. C. La reproduction chez les mammifères et l'homme. , INRA Editions. 928 (2001).
- Truchet, S., Wietzerbin, J., Debey, P. Mouse oocytes and preimplantation embryos bear the two sub-units of interferon-gamma receptor. Mol Reprod Dev. 60, 319-330 (2001).



