Summary
Den indirekt immunofluorescens protokoll som beskrivs i denna artikel gör det möjligt att upptäcka och lokalisering av proteiner i mus bröstkörteln. En komplett metod ges för att framställa bröstkörtelprover, för att utföra immunohistokemi, för att avbilda de vävnadssnitt genom fluorescensmikroskopi, och att rekonstruera bilder.
Abstract
Indirekt immunofluorescens användes för att detektera och lokalisera proteiner av intresse i en vävnad. Protokollet presenteras här beskriver en komplett och enkel metod för immundetektering av proteiner, varvid musen lakterande bröstkörteln tas som ett exempel. Ett protokoll för framställning av vävnadsprover, särskilt när det gäller dissektion av mus bröstkörtel, vävnadsfixering och frusen vävnad sektionering, är detaljerade. Ett standardprotokoll för att utföra indirekt immunofluorescens, inklusive en valfri antigenåtervinning steg, presenteras också. Observationen av de märkta vävnadssnitt samt bildtagning och efterbehandlingar anges också. Detta förfarande ger en fullständig översikt, från samlingen av djurvävnad till den cellulära lokaliseringen av ett protein. Även om denna allmänna metod kan tillämpas på andra vävnadsprover bör det anpassas till varje vävnad / primär antikropp par studerades.
Introduction
Bröstkörteln är en atypisk däggdjurs exokrin organ vars huvudsakliga funktion är att producera mjölk för att föda nyfödda. Utvecklingen av bröstvävnad sker främst efter födseln och kännetecknas av en unik process där epitel invaderar omgivande stroma. Denna vävnad genomgår många förändringar (tillväxt, differentiering och regressions), särskilt under vuxenlivet, samtidigt med variationer i reproduktiv status (Figur 1). Förutom den övergripande morfologin hos vävnaden, proportionerna av olika celltyper samt deras arrangemang inom bröstkörteln förändras dramatiskt under utvecklingen 1-5.
Under embryolivet, härleder bröst epitel från bröstmjölkledningarna, vilket definieras av en liten förtjockning och skiktning av ektoderm, mellan de främre och bakbenen på var sida om mittlinjen runt embryodag 10,5 (E10.5) (Figur 1A ).På E11.5, bryter mjölkledningen upp i enskilda placodes, vilka är symmetriskt placerade utmed bröstmjölkledningen vid reproducerbara platser, och den omgivande mesenkym börjar kondensera. De placodes börjar sjunka djupare in i huden och bröst mesenkymet organiserar i koncentriska lager runt bröst knopp (E12.5-E14.5). Som av E15.5, bröst epitel, börjar att föröka sig och förlänga för att bilda den primära gro som driver genom bröst mesenkymet mot fettkudden. Den primära grodd utvecklar en ihålig lumen med en öppning på huden, präglad av bildningen av nippeln manteln. På E18.5, har förlängning kanalen vuxit till fettkudden och har grenade i en liten arborized gångsystemet omfattas i fettkudden. Utvecklingen i huvudsak arresteras och rudimentära bröstkörteln fortfarande morphogenetically vilande fram till puberteten. I den manliga embryot, aktiveringen av androgenreceptorer leder till degeneration av knopparna, som försvinnergenom E15.5. Från och med E18, upphör bröst utveckling fram till puberteten 6-9.
Vid födseln, hamnar bröstkörteln en rudimentär gångsystemet som förlänger och grenar långsamt (isometrisk tillväxt). Vid början av puberteten, sfäriska strukturer belägna vid spetsarna av kanalerna som kallas den terminala änden knoppar (TEBS), är bildade av ett yttre skikt av cap-celler och en flerskiktad inre kärna av celler (kroppsceller). Dessa strukturer är mycket proliferativ och infiltrera omgivande stromal vävnad som svar på hormonella signaler. Spridning inom TEBS resulterar i duktal töjning, i kombination med förgrening morfogenes. Denna process leder till upprättandet av en grundläggande epitel arborized nätverk som härrör från bröstvårtan (Figur 1B, puberteten). Vid ~ 10-12 veckor efter födseln, när epitelet har invaderat hela fettkudden, stoppar sin expansion och TEBS försvinna. Ductal utveckling genomgår sedan dynamiska förändringar, det vill säga, successive spridning och regression av epitelceller enligt estruscyklerna 10 (Figur 1B, vuxen).
Från starten av dräktigheten undergår bröstvävnad viktig tillväxt och morfologiska förändringar för att förbereda för amning. Bröst epitel utför proliferera och differentiera, vilket leder till en i hög grad grenad tubulo-alveolära nätverk. Samtidigt, bröstepitelceller (MECS) blir polariserad och kunna syntetisera och utsöndra mjölkprodukter. MEC organisera sig i ett stort antal alveolära strukturer (acini) som är omgivna av kontraktila myoepitelceller och ingår i en stroma består av bindväv och fettvävnad, blodkärl och nervterminaler (Figur 1B, graviditet). Dessutom är den basala sidan av MEC i nära kontakt med basalmembranet (extracellulär matrix), och samspelet mellan dessa två enheter tätt reglera både morfogenes och sekretoriska funktion av mammary epitel 11-13.
Alla dessa processer är beroende av verkan av olika miljö ledtrådar, varav de viktigaste är hormones14, parakrina faktorer och den extracellulära matrisen. Exempelvis inducerar progesteron omfattande sido förgrening 15 och alveologenesis som i kombination med prolaktin (PRL) 16,17, främjar och upprätthåller differentiering av alveolerna. Förutom steroider och PRL18, cytokiner och signalvägar i samband med utveckling (Wnt och Notch signalvägar) är också involverade i bröst härstamning engagemang och utveckling 19-21. Vid slutet av graviditeten, de luminala MEC börja producera en proteinrik mjölk kallas råmjölk i lumen i alveolerna. Dessutom fungerar progesteron på epiteliala permeabiliteten och eftersom tight junctions fortfarande är öppna, är kolostrum också i det maternella blodet.
Efter förlossning, den mammary epitel tar upp nästan hela bröstkörteln volym och mycket organiserad (Figur 2, bröst epitel). Mjölkproducerande enheter, nämligen alveolerna (Figur 2, alveol), är bildade av ett monoskikt av polariserade bröstepitelialceller sekretoriska celler (MESCs), med deras apikala plasmamembranet som avgränsar hålrummet. Alveoler ordna sig i lobules som är grupperade i lober anslutna till ledningar som dränerar mjölk på utsidan miljö (Figur 2, lob). Amning uppstår, dvs., MESCs börjar utsöndra rikliga mängder mjölk, främst utlöses av nedgången i moderkakan hormoner (främst progesteron) (Figur 1B, laktation). Mjölkprotein gener aktiveras i en bestämd tids tidsförloppet sträcker sig från graviditet till amning 9,22,23, främst till följd av hypofysen PRL släpptes vid tidpunkten för diande. Samtidigt, kontakterna mellan MESCs och den extracellulära matrisen både stimulera mjölkprotein synthesis genom signaler som medieras via interaktioner mellan cellulära integriner och laminin 24,25, och undertrycker apoptos i MESCs 26,27. Dessa signalvägar resulterar i aktivering av mjölkprotein genpromotorer 28 genom aktivering av specifika transkriptionsfaktorer 29. Cell-cellkontakter är också viktiga för vissa aspekter av differentiering, inklusive fastställandet av apikala polaritet och vektor utsöndringen av mjölkprodukter. Tight junctions snabbt nära efter början av laktationen och MESCs iscensätta fint upptaget av molekyler från blodet samt syntes, transport och utsöndring av mjölkkomponenter, som svar på de näringsbehov nyfödda. Vid tidpunkten för diande, sammandragning av myoepitelceller omger alveolerna sker som svar på oxytocin och leder till mjölkutdrivning genom ledningarna och in i nippeln. Mjölk är en komplex fluid som innehåller proteiner (mestadelskaseiner), sockerarter (huvudsakligen laktos), lipider och mineraler, samt bioaktiva molekyler såsom immunoglobuliner A (IgA), tillväxtfaktorer och hormoner. Kasein syntetiseras, samlade i supramolekylära strukturer, nämligen kaseinmiceller, transporteras längs den sekretoriska vägen, och sedan släpptes av exocytos, dvs fusion av kasein innehållande sekretoriska vesiklar (SVS) med apikala plasmamembranet hos Mesc (Figur 2).
Intracellulär trafiken bygger på materialutbyte mellan membran fack och innebär Lösliga N-etylmaleimid-Sensitive Fusion (NSF) Attachment Protein (SNAP) Receptor (SNARE) 30,31. Snaran proteiner familj är uppdelad i vesikulära Snares (V-snaror), som föreligger i vesikelmembranet, och målgrupp snaror (t-snaror), lokaliserade på rikt membranen. Genom zippa genom deras coiled-coil-domäner, V- och t-snaror samlas för att bilda en mycket stabil fyra-helixknippet komplex, kallad ee SNARE komplexet. Detta komplex främjar fusion av två motstående lipiddubbelskikt genom att gradvis föra dem i omedelbar närhet 30,32. Efteråt är SNARE-komplex dissocieras av NSF adenosintrifosfatas och dess adapter protein SNAP och SNARE proteinerna återförs till sin -delområde 33. Intressant, bosatt varje SNARE protein, främst olika cellulära fack och SNARE parning kan bidra till specificiteten av intracellulära fusion händelser 34. Tidigare studier tyder på att åtminstone Synaptosomal associerat protein 23 (SNAP23) och Vesikel-associerad membranprotein 8 (VAMP8), och syntaxins (STX) -7 och -12 spela en roll i kasein exocytos 35,36. Dessa proteiner har också påträffats i association med lipiden fraktionen av mjölk, dvs mjölk fettkulor (MFGs) 37. Den nuvarande rådande modellen förutsätter att cytoplasmiska lipiddropparna (CLDs) bildas genom ackumulering av neutrala lipids (främst triacylglyceroler och sterolestrar) och kolesterol härrör från moderns kost mellan de två bladen av endoplasmanätet (ER) membran 38-41. Stora CLDs bildas, åtminstone delvis, genom fusion av mindre CLDs under transport till den apikala sidan av MESCs där de släpps som MFGs (1-10 | j, m i diameter) genom avknoppning, varvid inhöljda av Mesc apikala plasmamembranet 40-42. Amning upphör efter valpar är avvanda, och de MESCs successivt dör genom apoptos, vilket leder till regression av bröstvävnad till en pubertets tillstånd (Figur 1B, involution).
Immunofluorescens (IF) är en vanlig analytisk laboratoriemetod som används i nästan alla aspekter av biologi, både inom forskning och klinisk diagnostik. IF-tekniker kan utföras på vävnadssnitt (immunohistokemi, IHC) eller cell (immunocytokemi ICC) prover. Denna kraftfulla synsätt bygger på användning av fluorescent-märkta antikroppar som specifikt binder (direkt eller indirekt) till antigenet av intresse, vilket möjliggör visualisering av dess vävnadsfördelning genom fluorescensmikroskopi. Fluorescens signaler beror främst på kvaliteten och koncentrationen av antikroppar och korrekt hantering av provet. En enkel indirekt immunofluorescens (IIF) protokollet presenteras för att detektera mjölkprodukter (kaseiner och MFGs) och proteiner som är involverade i mjölkproduktutsöndring (butyrophilin (btn1), snara proteiner) på frysta sektioner av mus bröstvävnad (Figur 3). Även om detta protokoll ger en komplett IHC översikt, allt från vävnadsuppsamlings bilden efterbehandling, kritisk och valfria steg samt några tekniska rekommendationer också presenteras och diskuteras.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
CD1 möss avlades vid INRA (UE0907 IERP, Jouy-en-Josas, Frankrike). Alla etiska aspekter på djurvård uppfyllde de relevanta riktlinjer och licenskrav som fastställts av franska jordbruksministeriet. De metoder som används godkändes av den lokala etiska kommittén (överenskommelse 12/097 från Comethea Jouy-en-Josas / AgroParisTech).
1. bröstkörtel Provberedning
- Mouse bröstkörtel dissektion
- Euthanize möss vid dag 10 av amning genom halsdislokation och stift djuret med sin buk uppåt.
- Blöt ventrala med etanol och torka den med hushållspapper.
- Använd pincett, dra upp bukhuden mellan de båda bakbenen och göra ett snitt (genom endast huden) på ca 1 cm med vass sax. Utgående från detta första snitt, sedan använda sax för att skära in i huden upp till halsen på musen. Dra bort huden från bukhinnan och pin längs ena sidan av huden på en gång, sträcker det lärde.
- Samla buken och inguinal mjölkkörtlarna genom att trycka bort dem från huden med en bomullstopp och slutligen dra eller skära bort dem från bukhinnan.
Obs: I detta steg kan utföras Carmine färgning för att visualisera bröst epitel inom hela körteln 43. Detta tillvägagångssätt kan vara lämpligt att analysera den globala morfologi bröstkörteln under olika förhållanden (fysiologiska utvecklingsstadier, sjukdomar, in vivo behandlingar). - Ta lymfkörteln som ligger vid korsningen av buken och inguinal körtlar 44.
- Bröstvävnad fixering
- Skär mammarvävnad i 3 mm 3 fragment med en skalpell och skölj omedelbart dessa fragment i en fosfatbuffrad saltlösning (PBS), pH 7,4, för att avlägsna så mycket mjölk som möjligt.
- Snabbt torka fragmenten på ett papperhandduk och lägg dem i en kall PBS-lösning innehållande 4% paraformaldehyd (PFA, HCHO, 32% formaldehydlösning, OBS) för 10 till 15 minuter på is.
Obs: Det finns tillräckligt med tid för att tillåta efterföljande analys på bröstvävnadssnitt från IIF36 och / eller in situ hybridisering 45. Eftersom aldehyd fixerings tränger ganska långsamt i vävnadsbitar (~ 1-3 mm per timme), den här gången kan förlängas för att säkerställa en optimal fixering av vävnadsprov. Alternativt, fixa vävnader in vivo genom perfusion en nedsövd djur med en fixeringslösning (som inte beskrivs i denna studie).
- Sackaros infusion
- Snabbt skölja bröstfragmenten i kall PBS och doppa dem i en kall PBS-lösning innehållande 40% sackaros (D-sackaros, C12H22O11, herr 342,3 g / mol) för sexton till 48 timmar vid 4 ° C under försiktig skakning.
- Vävnads inbäddning
Obs: I detta steg, bröst fragment kan slipa för att göra mindre fragment (2-3 mm 3) Eller för att justera sin form.- Korrekt märka plastformar och fylla tredjedel av volymen av formen med OCT-förening, som hölls vid rumstemperatur. Placera ett fragment (2-3 mm 3) av bröstvävnad per mögel och täck den med oktober förening.
- Placera formarna vid ytan av det flytande kvävet (på ett ark av aluminium eller med användning av en metallisk sikt) och låta produkten frysas.
Obs: Det måste bli fast och vitt innan nedsänkning av formen i flytande kväve.
- Förvara frysta prover vid -80 ° C tills vävnadssnitt utförs.
2. Frysta vävnadsSektione
Anmärkning: En kryostat, som väsentligen är en mikrotom inuti en frys, krävs för att göra frusna vävnadssektioner. En lägre temperatur krävs ofta för fett eller fettrika vävnader, såsom jungfrubröstkörteln.
- Justera temperaturen i kryostaten till -26 ° C och vänta tills den har stabiboliseras. Behåll den frusna vävnadsblock vid -26 ° C under hela snittförfarandet. Absolut undvika tina vävnaden när som helst under förfarandet.
- Kyl rakblad kapjiggen, antirullningsanordning och borsten till -26 ° C genom att placera dem i kryostaten under minst 10 minuter. Placera också en glidlåda inuti kryostaten för att kunna lagra objektglas som sektionerna är gjorda.
- Korrekt märka glas som ska användas för att samla in vävnadssnitt och underhålla dem vid RT; annars vävnadssnitt inte kommer att följa dem. Ta bort provet från mögel inuti kryostaten.
Obs: Använda positivt laddade objektglas kommer att kraftigt gynna vidhäftningen av fryst vävnadssnitt på grund av högre elektrostatisk attraktion. - Täcka ytan av en metallvävnads skiva med oktober förening (hölls vid RT) och skjut den frusna provet på det. Placera den våta montera inuti kryostaten och låt den cool i minst 15 minuter.
- Placera den våta berget i skivhållaren kryostatens. Justera cut tjocklek till 5-6 pm och, om möjligt, använd en ny vass kniv eller åtminstone ändra området på bladet används för att skära varje prov eftersom vissa vävnader kommer snabbt tråkigt det.
- Justera positionen för den antirullningsanordning över rakbladet genom att göra snitt av monteringsmediet tills skivorna är bildade jämnt och korrekt. Helst ska antirullningsanordning kliva över rakbladet med ca 1 mm.
- När inställningarna är korrekta, utför vävnadssnitt genom att vrida ratten i en kontinuerlig likformig rörelse. Om inte temperaturen är perfekt, en del vävnad, av naturen, försöker krypa upp.
- Använd en borste för att ta tag i och manövrera avsnittet över scenen för att placera det som önskas på objektglaset. Använd borsten för att städa upp resterna eventuellt är närvarande på den frusna vävnadsblock och / eller rakblad.
- dragvävnadssektionen mot användaren och undvika att trycka på kryostatens scenen. Undvik att trycka på vävnadssnitt på kryostat skede eftersom det kan leda till vidhäftningen av vävnads skiva på scenen och därmed oförmåga att återställa det med glasskiva.
- Hämta vävnadssnitt en efter en genom att plocka upp dem vid ytan av en glasskiva, genom att hålla det ovanför sektionen och vinkla ner den att röra vävnadssektionen.
Obs: Vävnadssnitt följa snabbt till den varma glaset på grund av statisk attraktion. Om flera vävnadssnitt är placerade på samma glas, vara noga med att inte överlappa dem och till rymden dem tillräckligt för att kunna individuellt innesluta dem i en hydrofob cirkel (se avsnitt 3.1.1.).
3. Indirekt immunofluorescens
- Lokalisera sektioner
- Använd en hydrofob barriär penna för att rita en hydrofob cirkel runt slide monterade vävnad. Låt cirkeln torka under ca 1 min vid rumstemperatur. Rita en linje runt temissions sektioner med en fin svart märkpenna också, men på den sida av glasskivan som är motsatt den där de vävnadssnitt är.
Obs: Denna cirkel är vattenavstötande och aceton och alkohol-olösliga. Det tillhandahåller därför en barriär för vattenlösningar som används under IHC förfarandet och reducerar volymen av nödvändiga reagenser. - Rehydrera vävnadssnitt genom att täcka dem med en droppe av ~ 250 pl PBS under några minuter vid RT. Fix vävnadssnitt genom att täcka dem med ~ 250 | il av en nyberedd 3% PFA-lösning i PBS under 10 till 15 minuter.
Obs: Du kan i detta fall använda en aldehyd släckningslösning (50 mM ammoniumklorid (NH4CI, herr 53,5 g / mol) i PBS eller 0,1 M glycin (C 2 H 5 NO 2, Mr 75,07 g / mol) i PBS ) för att stoppa bindningsreaktion. Enkelt och riklig PBS tvätt är i allmänhet tillräcklig för att avlägsna oreagerad aldehyd.
- Använd en hydrofob barriär penna för att rita en hydrofob cirkel runt slide monterade vävnad. Låt cirkeln torka under ca 1 min vid rumstemperatur. Rita en linje runt temissions sektioner med en fin svart märkpenna också, men på den sida av glasskivan som är motsatt den där de vävnadssnitt är.
- Antigenåtervinning (tillval)
- Placera AR lösning (100 mM Tris (C 4 H 11 NR 3, Herr 121,14) 5% karbamid (NH2 CONH2, herr 60,06) pH 9,6) i en bägare. Volymen av AR lösning måste vara tillräcklig för att fullständigt täcka de glasskivor placeras i en glashållare.
- Värm AR lösningen till 95 ° C genom att övervaka temperaturen med en termometer och sedan placera glasskivor på en lämplig rack, immerge stället i den varma buffert, till locket begränsa avdunstning och inkubera i 10 minuter vid 95 ° C.
- Avlägsna bägaren från vattenbadet och lämnar glasskivorna i ytterligare 10 min i buffert.
- Skölj vävnadssnitt med PBS (~ 250 pl / avsnitt) och mätta dem med en lösningav 3% bovint serumalbumin (BSA, ~ 250 | il / sektion) i PBS under minst 30 min vid RT.
- Sätt 30-50 pl av den primära antikroppen späds i PBS innehållande 2% BSA på varje avsnitt vävnad.
Notera: Denna volym är tillräckligt för att bilda en droppe som fullständigt täcker vävnadssnittet. - Placera samma volym av spädningsmedlet (2% BSA i PBS) enbart på en sektion vävnad för att utföra en negativ kontroll utan primär antikropp.
- Systematiskt inkludera denna negativ kontroll i varje IHC experiment och utföra för varje sekundär antikropp som används för att uppskatta bakgrund av experimentet (icke-specifik märkning på grund av den sekundära antikroppen och / eller vävnadsauto fluorescens). Andra typer av positiva eller negativa kontroller kan också utföras för att säkerställa specificiteten hos märkningen (se diskussion).
- Placera glasskivor i en fuktad box O / N vid 4 ° C.
Obs: Primära antikroppar som användes var musmonoklonal anti-cytokeratin8 (CK8, 1:50 utspädning), mus monoklonal anti-cytokeratin 14 (CK14, 1:50 utspädning), kanin polyklonal anti-mus kasein (# 7781, 1:50 utspädning, generöst tillhandahålls av MC Neville, University of Colorado Health Sciences Center, CO, USA), kanin polyklonal anti-btn1 (1: 300 utspädning, generöst från IH Mather, Institutionen för husdjurens och Avian Sciences, University of Maryland, College Park, MD, USA), kanin polyklonal anti-Stx6 ( 01:50 utspädning, generöst tillhandahålls av S. Tooze, Cancer Research UK, London Research Institute, London, UK) och kanin polyklonal anti-VAMP4 (1:50 utspädning). - Tvätta vävnadssnitt med PBS minst fyra gånger under 10 minuter vid RT.
- Späd den lämpliga sekundär antikropp (rodamin-konjugerad get-anti-kanin-IgG (H + L), en: 300 spädning) i PBS innehållande 2% BSA, placera 30-50 | il av denna lösning på alla vävnadssektioner, och inkubera i 1,5 h vid RT.
- Eftersom fluorokromer är ljuskänsliga molekyler, inteutsätta vävnadssnitt för ljus tills deras analys. För IIF på vävnadssnitt, gynna sekundära antikroppar kopplade till en röd fluorofor eftersom cellmembranen tenderar att alstra en grön auto fluorescens som kan störa låg märkning. Dessutom, att välja en röd fluorofor kopplad sekundär antikropp medger samtidig märkning av neutrala lipider (se nedan).
- Tvätta vävnadssnitt med PBS minst fyra gånger under 10 min vid RT.
- För vissa experiment utföra efter fixering genom att inkubera proverna med 2% PFA utspädd i PBS under 10 min vid RT för att stabilisera de ställningar antigen / antikroppskomplex. Emellertid kan detta steg utelämnas i de flesta fall.
- Att visualisera CLDs och MFGs, färg neutrala lipider genom att inkubera vävnadssnitt i 30-50 | il av en PBS-lösning innehållande 3 | ig / ml av BODIPY 493/ 503 under 10 minuter vid RT. Snabbt Skölj vävnadssnitt två gånger med PBS.
- Motfärg nukleärt DNA med 30 till 50 | j, l av en PBS-lösning innehållande 3 | iM DAPI (4-6-diamidino-2-fenylindol, 5 mg / ml stamlösning) under 10 min vid RT. Tvätta vävnadssnitt två gånger med PBS före montering bilderna för observation.
- Ta bort PBS och placera en droppe monteringsmedium på varje avsnitt vävnad.
- Placera ena sidan av locket glida i vinkel mot bilden, att ta kontakt med den yttre kanten av vätskedroppe och sänk sedan luckan långsamt, undvika luftbubblor. Låt vätskan att sprida sig mellan glasskivan och locket glida i ett par minuter och sedan avlägsna överskottet av monteringsmedel med en pappershandduk.
- Täta locket glida till objektglaset med nagellack och lagra vävnadssnitt vid 4 ° C för att förhindra deras exponering för ljus tills observation.
4. Fluorescence Observation och Image Acquisition
Obs: En fluorescensmikroskop utrustat med en kamera som styrs av bilden förvärvet programvara krävs för att observera IHC resultat.
- Innan de kan få bilder, kontrollera intensiteten i märkningen och utvärdera bakgrund av experimentet genom att titta på de negativa kontrollerna. Förvärva bilder av varje fluorescerande etikett (färgkanal) individuellt.
- Förvärva alla bilder, inklusive de motsvarande kontrollerna under samma betingelser (exponering och allmänna inställningar) för varje färgkanal.
- Konventionell mikroskopi
- Utför epifluorescensmikroskopi med ett mikroskop utrustad med standardfilter för fluoresceinisotiocyanat (FITC, grön), rodamin (röd) och DAPI (blå) utsläpp × 20 × 63 (olja-nedsänkning, NA 1,3) mål och en DP50 bildkamera.
- Konfokalmikroskopi
- Utför konfokalmikroskopi med microsCope utrustade med ZEN programvara, använder × 20 × 63 (olja-nedsänkning, NA 1,4) mål och 488- och 568-nm excitationsvåglängder av lasern.
5. bildbehandling
Obs: Alla bildefterbehandlingar som utförs med hjälp av fri programvara ImageJ (http://imagej.nih.gov/ij/).
- Lagra bild (slå samman)
- Öppna bilderna förvärvats i varje kanal som kommer att kombineras (Arkiv / Öppna). Om man arbetar med 8-bitars gråskalebilder, skriver konstgjorda färg för varje kanal med hjälp av uppslagstabellen (Bild / uppslagstabeller).
- Generera sammansatt bild från gråskala eller färgade bilder med kommandot "Sammanfoga kanaler" (Bild / Färg / Merge kanaler) och därefter tillskriva en färg till varje kanal.
- Utför bild staplar lagring på samma sätt genom att öppna staplar förvärvats i varje kanal som kommer att kombineras (Arkiv / Öppna) och använda kommandot "Merge kanaler &# 8221; (Bild / Färg / Merge kanaler) att tillskriva en färg till varje kanal. Spara sammansatta stapeln som en bildsekvens eller som en film (se avsnitt 5.4).
- Bildstapel Z projektion
- Använd Z-projiceringsfunktionen (Bild / Stapla / Zproject, Max Intensitet) för att ge en tvådimensionell vy av alla bilder i en bildstapel genom att projicera dem längs axeln vinkelrät mot bildplanet (z-axeln). Den "Maximum Intensity" alternativet skapar en bild i vilken varje pixel innehåller det högsta värdet över alla bilder i stapeln. Detta genererar en enda bild tillåter visualisering av hela färgnings observeras genom hela bildstapel för en specifik kanal eller efter överlagring av flera kanaler.
- Bildstapel 3D-projektion
- Använd 3D-projektion kommandot (Bild / Stapla / 3D-projektet, Ljusast Point, y-axeln) för att generera en sekvens av projektioner av en roterande volym på ett plan. Den visuella återgivningen av surfaces och interna strukturer beror både på projektionsmetod (närmaste-punkt, ljusaste punkten (används här), eller betyda-värde) och de visualiseringsparametrar valts. Varje ram av den animerade sekvensen är resultatet av utskjutande från en annan betraktningsvinkel.
- Rotera skapade 3D-bild runt var och en av de tre ortogonala axlar (y-axeln valdes här). Spara sekvens produceras som en enda bild eller en film.
- Bildstapel till film konvertering
- Öppna en bildstapel (Arkiv / Öppna) och spara den som en film i AVI-format med hjälp av kommandot "AVI" (Arkiv / Spara som / AVI).
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Bröstkörteln är en subkutan körtel som ligger längs den ventrala struktur både bröstkorgen och buken hos gnagare. Placeringen av de fem par körtlar i musen under dräktigheten visas i figur 4. Morfologi bröstkörteln förändras dramatiskt under dess utveckling, vilket avspeglar funktionella förändringar som krävs för att förbereda sig för full amning (Figur 1B). I jungfru eller fött ungar djur, bröstkörteln består av ett glest förgrenad duktal epitel inbäddad i ett tunt fett stroma som kan vara svåra att se. Från början av graviditeten, bröst epitel förökar och expanderar, vilket resulterar i större mjölkkörtlar som blir lättare att se och ta bort (Figur 4). Under laktation, är bröstvävnad tjockare och verkar vitare på grund av närvaron av mjölk. Endast buken och ljumskbröstkörtlar samlas eftersom livmoderhalscancer och bröstkorg bröst Glands är mindre lätt bort på grund av deras nära samarbete med muskler. För vissa försök kan valpar separeras från lakterande kvinnliga 4-6 h före avlivning för att begränsa mjölkutsöndring av MESCs 46,47.
Identifiering av bröst myoepitelial och epitelceller
Kontraktila myoepitelceller omger alveolerna kan särskiljas från luminala MESCs genom användning av antikroppar riktade mot markörer specifikt uttryckta av var och en av dessa celltyper. I bröstkörteln, den nuvarande markörer används är cytokeratiner (CKS). CKs är en stor familj av cytoplasmiska proteiner som polymeriserar för att bilda cytoskeletala intermediära filament (10 nanometer i diameter i genomsnitt) som finns i epitelvävnader. De intermediära filament är extremt stabila och ge ett mekaniskt stöd för cell arkitektur och organisera vävnader genom att bidra till cell-cell adhesion och basalcells-bindvävnadsinteraktioner. De undergrupper av CK uttrycks av epitelceller beror främst på vilken typ av epitel, dess utvecklingsstadium och dess differentiering status. Dessutom, detta gäller även för maligna motsvarigheter i epitel. Således är dessa markörer är enkla och värdefulla verktyg för att karakterisera cellpopulationer i en vävnad under fysiologiska betingelser och används för tumördiagnos och karaktärisering i kirurgisk patologi 48.
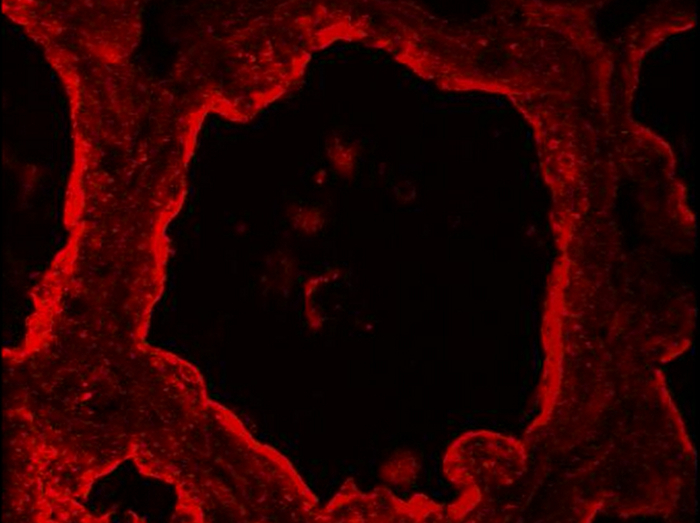
I det normala juverkörteln kan myoepitelial och luminala MESCs celler särskiljas baserat på deras differentiella uttryck för CK14 och CK8 respektive (Figur 5). Dessa cytoplasmiska markörer detekteras i bröst delar av ammande möss efter PFA fixering och AR. Bilder förvärvades med en konventionell epifluorescensmikroskop. CK8 verkar vara fördelade över hela cytoplasman av de luminala MESCs (Figur 5, Ck8). Observera att den röda bakgrunden observerad för den negativa kontrollen utan primär antikropp (Figur 5, -Ig1) är främst på grund av vävnadssektionen vikning, som föreslagits av den blå DNA märkningen, som visar flera skikt av kärnor (Figur 5, -Ig1, kärnor). CK14 är särskilt observerats i platta och avlånga myoepitelceller ligger vid foten av alveolerna (Figur 5, CK14). Ett annat vanligt sätt att identifiera myoepitelceller är att detektera alfa-aktin i glatt muskulatur (a - SMA) föreligger i dessa kontraktila celler (se figur 4 i 49).
Detektering av mus-mjölkprodukter
Efter förlossning, de fullständigt differentierade MESCs börja producera rikliga mängder mjölk. Mjölkkomponenter utsöndras av olika vägar 40,50. Kaseinmiceller utsöndras av exocytos av Golgi-härledda SVS, medan lipider frigörs som MFGs genom knoppning av den apikala plasma membran av MESCs (fig 2, bröstepitelialceller sekretoriska celler). För vissa experiment är valparna separeras från den kvinnliga 4-6 h före uppsamling av mjölkkörtlar, i syfte att bromsa mjölkavsöndringshastigheten 46,47. Under dessa förhållanden, kan det apikala plasmamembranet hos MESCs och innehållet i lumen lätt observeras, vilket inte är fallet under diande eftersom alveoler är kontrakte och lumen är stängda. Dessutom saktar ner utsöndringen är också viktigt när man studerar proteiner involverade i membranhandel såsom snaror. I själva verket, snärjer cykel mellan givare och mottagare fack och deras subcellulära lokalisering är svårt att avgöra eftersom märkningen ofta diffust när membran omsättningen är hög, dvs. Under digivning. Därför, vilket saktar ned mjölkavsöndringshastigheten genom avlägsnande valparna tillhandahåller lämpliga betingelser för att studera den intracellulära lokaliseringen av snaror när t- och v-snaror preferentiellt uppe i donatoroch acceptorn fack, respektive (se nedan).
Figur 6 visar lokaliseringen av kaseiner i lakterande mus bröstkörteln vid dag 10 av laktationen, i närvaro (figur 6, + p) eller i frånvaro (figur 6, -p) av valpar. Vävnadssektioner observerades både genom konventionell epifluorescensmikroskopi (de tre kolumnerna till höger) och konfokalmikroskopi (fig 6, den vänstra kolumnen). Under laktation, kasein verkar vara mestadels ackumuleras i den apikala regionen (figur 6, + p, pilspetsar). Konfokalmikroskopi avslöjar att kaseiner är också närvarande, om än i mindre utsträckning, på den basala sidan av MESCs i närvaro av valpar (Figur 6, + P, pilar), som inte tydligt kan iakttas i konventionell mikroskopi (Figur 6, kaseiner, jämför vänster och höger sida). I själva verket, i brett fält epifluorescence den fluorescens som emitteras av provet (bakgrunds fluorescence) passerar genom glada volymen och ändrar upplösningen av objekten som observerats i målet fokalplanet (out-of-fokus fluorescens). Detta gäller särskilt för tjocka prover (tjockare än 2 pm). Konfokalmikroskopi gör det möjligt att få högkvalitativa bilder från prover förberedda för epifluorescens, som djupet av fältet kan styras och bakgrundsfluorescens undantas från fokalplanet. Vidare i närvaro av valpar (Figur 6, + P), lumen i alveolerna är ganska stängd och den apikala sidan av MESCs är bättre observerade i frånvaro av ungar (figur 6, -P), när lumen av alveoler är dilaterad på grund av ansamling av mjölkprodukter. När mjölksekre saktas ned, kasein också visas ackumulerat under apikala plasmamembranet (figur 6, -p, pilspetsar) och tydligt observeras vid den basala sidan av MESCs (Figur 6, -p, pilar). Negativa kontroller utan primär AntibODY visade ingen märkning (Figur 6, -Ig1).
Mjölkprodukter kan lätt samar detekteras genom att kombinera IHC kasein och neutral lipid motfärgning av CLDs och MFGs (figur 7). Vävnadssektioner avbildades som Z-stackar av konfokalmikroskopi, som var efterbehandlas med ImageJ att producera Z utsprång eller 3D utsprång för varje (figur 7, kaseiner, lipider) eller alla färgkanaler (fig 7, slås samman). De bildsekvenser som producerats har sparats som enstaka bilder (figurer 7 och 8) eller filmer (se kompletterande filmer).
Även om viss märkning observerades på deras basala sida, var kaseiner mestadels ackumulerats på den apikala sidan av MESCs (Figur 7, + p), såsom redan beskrivits, när honor inte tidigare separerade från valpar (Figur 6, + P). CLDs är också i huvudsak lokaliserade i den apikala regionen MESCs, medan större hemligheted MFGs är närvarande i lumen i alveolerna. Observera att kasein och MFGs enkelt visualiseras i lumen av alveolerna i frånvaro av valpar (figur 7, jämför + p och p). Kasein inte samar lokalisera med CLDs eller MFGs i något av dessa villkor, eftersom överlagring av de två färgkanaler inte producerar gul märkning (Figur 7, slå samman bilder). Emellertid bildstapel efterbehandlingar visar att kaseiner omger de utsöndrade MFGs i lumen i alveolerna, vilket tyder på att dessa proteiner kan interagera med MFG (Figur 7, slå ihop bilder). Notera skillnaden av de bilder som produceras av varje efterbehandling användas (figur 7, jämför Zproj och 3D proj för varje färgkanal).
Detektering av butyrophilin, en proteinmarkör av MFGs.
Btn1 är en av de stora proteiner associerade med MFGs i mjölk 51. Detta transmembranprotein är mainly lokaliserat vid den apikala plasmamembranet av MESCs och följaktligen funnit vid ytan av MFG efter dess frisättning genom knoppning 52. Figur 8 visar att vid dag 10 av laktationen, är btn1 huvudsakligen lokaliserad på den apikala plasmamembranet och, i mindre utsträckning, i den apikala regionen MESCs. Btn1 omger också de MFGs närvarande i lumen av alveolerna samt några av de apikala CLDs (Figur 8, 3D proj samman, pilspetsar). Resultaten visas som en enda bild som extraherats från den förvärvade bild Z-stack (Figur 8, bild) eller som en 3D-vy som genereras med 3D-projektion befäl ImageJ, som beskrivits ovan (figur 8, 3D proj). Observera att en enda bild kan vara tillräckligt för att observera apikala fördelningen av protein, men den rumsliga sammanslutning av btn1 med utsöndrade MFGs eller apikala CLDs endast observeras efter 3D-rekonstruktion av Z-stack (Figur 8 jämför btn1 bild och 3D proj merge pictderna). Z-stacken kan också rekonstrueras som en film för att ge en bättre rumslig vy av fördelningen av proteinet. Bild Z-stack förvärvats för btn1 enbart (Kompletterande filmer 1 och 3) eller överlagras med de två andra färgkanaler (slå samman Kompletterande filmer 2 och 4) visas som exempel. Z-stack kan läsas bild-by-bild från toppen till botten (Kompletterande filmer 1 och 2) eller som en roterande vy (y-axeln) i 3D-projektion av hela bilden stacken (Kompletterande filmer 3 och 4 ).
Detektion av två SNARE proteiner: Stx6 och VAMP4
Såsom tidigare nämnts, snaror är membranbundna proteiner som cykel mellan donator- och acceptor-membran. Det är därför bättre att bromsa membran omsättning i samband med den höga sekretoriska aktiviteten hos MESCs genom att separera kvinnor från valparna innan samla bröstkörteln när man studerardessa proteiner. Stx6 och VAMP4 har både beskrivits som är associerade med den trans Golgi nätet 53,54. Dock kan dessa SNARE proteinerna också spela en viktig roll i nivå med andra cellulära avdelningar såsom sekretoriska granulerna (Stx6) 55,56 och Golgiapparaten (VAMP4) 57. Tidigare studier tyder på att SNARE proteiner spelar en roll i kasein sekre 35,36. Under amning, Stx6 och VAMP4 ligger i under apikala regionen MESCs. Stx6 observeras mellan kärnan och det apikala membranet av MEC, som motsvarar till Golgi och trans-Golgi-nätverket (Figur 9, Stx6), och är också närvarande, även om i mindre utsträckning, på kasein-innehållande SV: er 36. VAMP4 också lokaliserad i under apikala området av MESCs, men märkning tycks vara mer punktat och ackumuleras under den apikala plasmamembranet (figur 9, VAMP4) på grund av sin koppling till både CLDs och kasein-containing SVS 36. Negativ kontroll utan primär antikropp gav inte upphov till någon märkning.

Figur 1. Mouse bröstkörtelutveckling under embryonal och vuxenlivet. (A) mus bröstkörtlarna börjar utvecklas kring embryonala dag 10 (E10) från ektodermala (ljusblå) mjölkledningar (rosa). Vid E11.5, placodes bildar symmetriskt längs bröstmjölkledningen och den omgivande mesenkym (mörkblå) börjar kondensera. De placodes invaginate att bilda knoppar (E12.5-E14.5) och, på E15.5, bröst epitel (rosa), förökar sig och långsträckt för att bilda den primära gro som driver genom bröst mesenkymet mot fettkudden (ljusgrön ). En ihålig lumen former och öppnar för att ge upphov till bröstvårtan (lila). På E18.5 bildar bröst epitel en rudimentary förgrenad struktur ansluten till utsidan. Anpassad från sex med tillstånd från Macmillan Publishers Ltd: Nature Reviews Genetics, copyright 2007. (B) Under puberteten, bröst epitel (lila) går in i en betydande tillväxtfas (omfattande förlängning, förgrening och lateral förgrening). Vid början av graviditeten, omfattande och snabb spridning samt sido förgrening inträffar, vilket leder till betydande expansion av bröst epitel, som till fullo invaderar hela bröstfettkudden. Bröst epitel når en mycket differentierad funktionstillstånd under amning när luminala MESCs utsöndrar stora mängder mjölk. När amning upphör efter avvänjning, bröstkörtel evolventer. MESCs avlägsnas genom apoptos och fagocytos, vilket leder till försvinnandet av lobulo-alveolära strukturer som ersätts av fettvävnad. Anpassad från schema 1 av http://brisken-lab.epfl.ch/research och kapitel 2.2. http://tvmouse.ucdavis.edu/bcancercd/22/index.html. Klicka här för att se en större version av denna siffra.
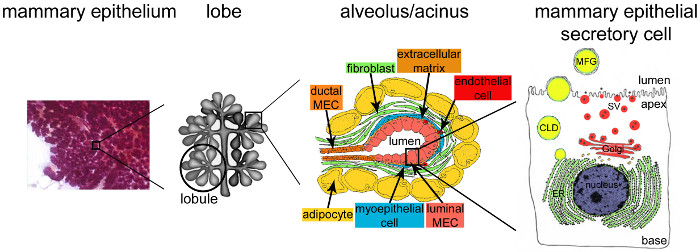
Figur 2. Arkitektur av bröstkörteln under amning. Under amning, den fullt utvecklade och högt grenade epitel (lila) står för den stora majoriteten av bröstvävnaden. Epitelvävnaden bildas genom Tubulo-alveolär strukturer inbäddade i ett stroma som innehåller olika celltyper (fibroblaster, adipocyter, glatta muskelceller, blod och lymfkärl och nervändar). MESCs är organiserade i acinära strukturer eller alveoler, samlade i lobules som bildar lober. Varje alveol är en funktionell mjölkproducerande enhet som är ansluten till en i hög grad grenad nätverk av lobulär och interlobulära kanaler, så att mjölken som skall dregnade till utsidan. Varje alveol är avgränsad av ett monoskikt av polariserade MESCs, den apikala sidan av vilken gränsar till en mittlumen. Den basala sidan av MESCs står i nära kontakt med en extracellulär matris och kontraktila myoepitelceller. Mjölkprodukter släpps på den apikala sidan av MESCs. Större mjölk (kasein) utsöndras som kaseinmiceller (svarta punkter) genom exocytos av Golgi-härledda sekretoriska vesiklar (SVS), medan lipider frigörs som mjölkfettkulor (MFGs) genom knoppning av det apikala plasmamembranet av MESCs. CLD: cytoplasmisk lipiddroppe; ER: endoplasmatiska retiklet; MEC: bröst epitelcell. Anpassad från kapitel 2.2. http://tvmouse.ucdavis.edu/bcancercd/22/index.html., fig. 02 www.cellbiol.net/ste/alpHERCEPTIN1.php, fig. 26-02 i 58 och 50. Klicka här för att se en större version av denna siffra.
.within-page = "always"> 

Figur 3. Experimentell procedur för att utföra indirekt immunofluorescens på frysta sektioner av mus bröstkörtel. Den bröstkörteln samlas in från en CD 1 kvinnlig mus vid dag 10 av amning. Den bröstvävnad skärs i små fragment som är fixerade med paraformaldehyd och infunderas i sackaros innan de bäddas in i OCT-förening och snabbfrystes. Bröstkörteln proverna skärs sedan i tunna frysta snitt och bearbetades för IIF genom successiv inkubering med primära och fluorokromkonjugerade sekundära antikroppar, respektive. Efter montering, är prover analyseras med ett fluorescensmikroskop, vilket gör att förvärv av bilder som sedan kan efterbehandlas./53179/53179fig3large.jpg "Target =" _ blank "> Klicka här för att se en större version av denna siffra.

. Figur 4. Anatomiska läge mus mjölkkörtlar Vänster: ventrala utsikt över musbröst systemet vid slutet av dräktighetsstadiet. Höger: lokalisering och aspekt av bröstkörteln i sen dräktighet skede i musen. Notera att under amning, mjölkkörtlar är tjockare och verkar vitare på grund av närvaron av mjölk i alveolerna. Anpassad från http://ctrgenpath.net/static/atlas/mousehistology/Windows/femaleu/mousemammgldiagram.html och http://www.pathbase.net/Necropsy_of_the_Mouse/index.php?file=Chapter_3.html. Klicka här för att se en större version av denna siffra.
-together.within-page = "always"> 
Figur 5. Identifiering av luminala epitelceller och basala myoepitelceller i musen bröstkörteln. Luminal MESCs och myoepitelceller identifieras genom IIF i mus bröstkörteln vid dag 10 av amning, baserat på deras uttryck av CK-8 och CK-14 , respektive. Kärn- DNA färgades med DAPI (blå). Bilder förvärvades med en konventionell epifluorescensmikroskop. Den sammansatta bilden (slå samman) visar överlagring av märkning som motsvarar kaseiner (röd) och kärnor (blå), respektive. -Ig1, Negativ kontroll utan primär antikropp. Asterisker indikerar lumen. Skala bar = 100 um. Klicka Vänligen här för att se en större version av denna siffra.
e 6 "src =" / filer / ftp_upload / 53179 / 53179fig6.jpg "/>
Figur 6. Cellulär lokalisering av kaseiner i musen bröstkörteln. Kasein detekteras genom IIF i mus bröstkörteln vid dag 10 av amning. Bröstkörteln samlades in från kvinnor i närvaro (+ p) eller i frånvaro (p) av valpar. Bilder förvärvades med ett konventionellt (höger panel, kasein, kärnor och sammanfoga) eller konfokala (kaseiner (röd), vänstra panelen) fluorescensmikroskop. I båda villkor, kasein (röd) detekteras i den apikala regionen (pilspetsar) och mer eller mindre på basala av MESCs (pilar). Negativa kontroller utan primära antikroppar inte visar någon märkning (-Ig1). Kärn DNA färgades med DAPI (blå). Den sammansatta bilden (slå samman) visar överlagring av märkning som motsvarar kaseiner (röd) och kärnor (blå), respektive. Asterisker indikerar lumen. Skala bar = 100 pm för epifluorescens bilder (högra panelen, kasein, kärnor, slå samman) och = 10 &# 181; m. För konfokala bilder (vänstra kolumnen) Klicka här för att se en större version av denna siffra.
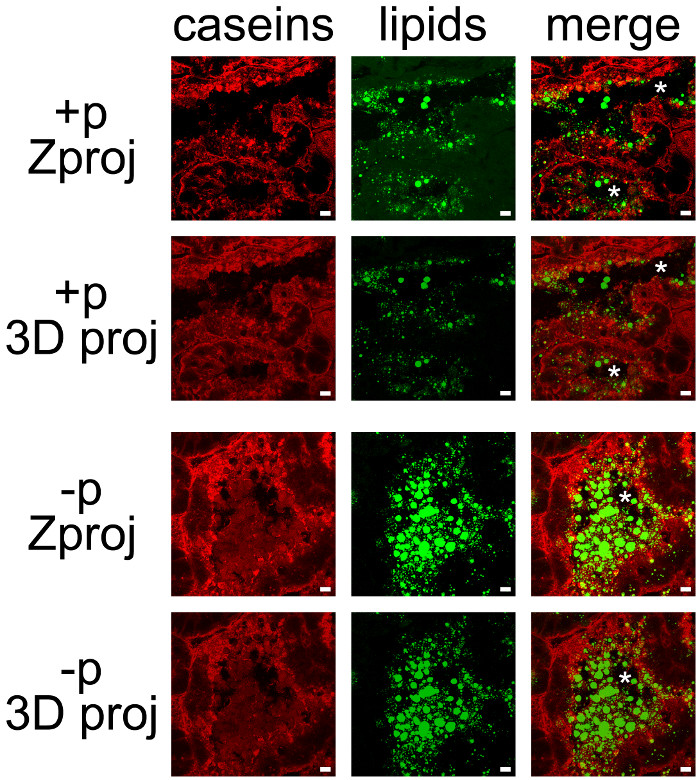
Figur 7. Cellular lokalisering av mjölkprodukter i musen bröstkörteln. Kaseiner (röda) detekteras genom IIF i mus bröstkörteln vid dag 10 av amning i närvaro (+ p) eller i frånvaro (p) av valpar. Neutrala lipider (CLDs och MFGs) motfärgas med BODIPY 493/503 (grön). De sammansatta bilder (merge) visar överlagring av de två labelings. Bilder förvärvades som Z-stackar med ett konfokalmikroskop. Z-stackar var efterbehandlas med ImageJ att alstra Z utsprång (Zproj) eller 3D-projektioner (y-axeln) (3D proj) hos de hela staplar i varje kanal för båda (slå samman). Asterisker indikerar lumen. Skalstreck= 10 mikrometer. Klicka här för att se en större version av denna siffra.

Figur 8. Cellular lokalisering av butyrophilin och lipider i musen bröstkörteln. Btn1 (röd) detekteras av IIF i mus bröstkörtel vid dag 10 av amning i frånvaro av valparna. Neutrala lipider (CLDs och MFGs) och kärn DNA motfärgades med BODIPY 493/503 (grön) och DAPI (blå), respektive. Bilder förvärvades med en konfokalmikroskop som bild Z-stackar. Resultaten visas som en enda bild som extraheras från bildstapel (bild, btn1, lipider, kärnor och slå samman) eller efter efterbehandling med ImageJ för att alstra en 3D-vy (y-axeln) av hela bildstapel (3D proj, btn1 , lipider, kärnor, slå samman). De sammansatta bilder (merge) visaröverlagring av de tre färgkanalerna. -Ig1, Negativ kontroll utan primär antikropp. Asterisker indikerar lumen. Skala bar = 10 mikrometer. Klicka Vänligen här för att se en större version av denna siffra.

Figur 9. Cellular lokalisering av två SNARE proteiner i mus bröstkörteln. Syntaxin 6 (Stx6) och VAMP4 (V4) detekteras genom IIF i mus bröstkörteln vid dag 10 av amning. Bilder förvärvades med en konventionell (conv) epifluorescence eller ett konfokalt (LSM) mikroskop. De sammansatta bilder (merge) visar överlagring av märkning observerades för varje SNARE protein (röd) och för kärn-DNA motfärgades med DAPI (falskt grön färg), respektive. -Ig1, Negativ kontroll utan primär antikropp. Asterisks anger lumen. Skala bar = 10 mikrometer för konfokala bilder och = 100 pm för epifluorescens bilder. Klicka här för att se en större version av denna siffra.


Tabell 1. Immunhistokemi felsökningsguiden.

Kompletterande film 1. Lokalisering av butyrophilin i musen bröstkörteln. Btn1 (röd) detekteras av IIF i mus bröstkörteln vid dag 10 av amning. Bilder förvärvades med en co nfocal mikroskop som en Z-stack och efterbehandlas med ImageJ för att generera en film. Z-stack läses från toppen till botten. Klicka här för att se filmen.

Kompletterande film 2. Lokalisering av butyrophilin och neutrala lipider i musen bröstkörteln. Btn1 (röd) detekteras av IIF i mus bröstkörtel vid dag 10 av amning. Neutrala lipider (CLDs och MFGs) och kärn DNA motfärgades med BODIPY 493/503 (grön) och DAPI (blå), respektive. Bilder förvärvades med ett konfokalt mikroskop som en Z-stack för varje färgkanal och var efterbehandlas med ImageJ för att alstra en sammansatt Z-stack som överlagrar de tre färgkanalerna. Det resulterande komposit Z-stacken läses från toppen till botten.https://www.jove.com/files/ftp_upload/53179/supvid2.mp4 "target =" _ blank "> Klicka här för att se filmen.
Kompletterande film 3. Lokalisering av butyrophilin i musen bröstkörteln. Btn1 (röd) detekteras av IIF i mus bröstkörteln vid dag 10 av amning. Bilder förvärvades med en konfokalmikroskop som Z-stack och efterbehandlas med ImageJ (3D-projektion) för att generera en roterande (y-axeln) spatiala utsikt över btn1 märkning. Klicka här för att se filmen.

Kompletterande film 4. Lokalisering av butyrophilin och neutrala lipider hos mus mammary körtel. btn1 (röd) detekteras av IIF i mus bröstkörteln vid dag 10 av amning. Neutrala lipider (CLDs och MFGs) och kärn DNA motfärgades med BODIPY 493/503 (grön) och DAPI (blå), respektive. Bilder förvärvades med ett konfokalt mikroskop som en Z-stack för varje färgkanal och var efterbehandlas med ImageJ för att alstra en sammansatt Z-stack som överlagrar de tre färgkanalerna. ImageJ (3D-projektion) vidare för att generera ett roterande (y-axeln) rumslig bild av den sammansatta Z-stack. Klicka här för att se filmen.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
IHC är en relativt enkel och okomplicerad experimentell metod för att lokalisera antigen i vävnadssnitt, som beror främst på specifika epitop-antikropp interaktioner. Även om ett stort antal protokoll används för att lokalisera ett protein genom IIF, är kärnan i dessa förfaranden nästan alltid densamma. Det finns dock några viktiga aspekter som starkt kan påverka resultatet och därför måste optimeras för varje enskild IHC studie. Den svåraste aspekten av detta tillvägagångssätt är att fastställa de bästa experimentella förhållanden, dvs. De som generering av en stark och specifik signal för antigenet av intresse. De variabler som måste beaktas för experimentell design och optimering är: (1) vilken typ av antigen (arter, expressionsnivåer, subcellulär plats); (2) typen epitop (sekvens, konformation, förmodade posttranslationella modifieringar); (3) provberedning (inbäddning i paraffin eller frusna snitt); (4) fixerings methOD (perfusion eller nedsänkning); (5) den fixativ som används (formaldehyd, alkohol eller aceton); (6) det blockerande reagenset (normalt serum, BSA eller fettfri mjölk); (7) AR steget; (8) detektionsmetoden (direkt eller indirekt); (8) vilken typ av primär antikropp (monoklonal eller polyklonal); (9) Den sekundära antikroppen (arter och etikett); (10) counterstains (kärn- och / eller annan cellulär märkning); och (11) i monteringsmedium (se tabell 1 för mer information). Fixeringen och blockeringsstegen, åtminstone kräva optimering av ytterligare faktorer såsom koncentration, pH, temperatur, inkuberingstid och utspädningsmedel.
Den första avgörande aspekt avser framställning av vävnadsprov, som är nära kopplade till fixeringsmetoden, som i sin tur påverkar kvaliteten på resultaten. Till exempel kan vävnadsbitar vara fast eller ej före inbäddning. Detta steg kan också bero på inbäddning valda förfarandet, dvs, oktober förening vs paraffininbäddning, Som i sin tur ibland beror på den primära antikropp som används. Vävnadsfixering kan utföras in vivo genom perfusion en nedsövd djur med en fixeringslösning. Denna metod är användbar för att bevara antigener när man studerar intakta vävnader, men får inte vara tillräcklig för att fixera vävnaden av intresse. I detta fall kan små vävnadsstycken (ej tjockare än 10 mm) vara nedsänkt i fixeringslösning. Fryst vävnad kan framställas genom nedsänkning av vävnaden i flytande kväve eller isopentan, och snäppfrysning rekommenderas för den efterföljande detekteringen av posttranslationella modifieringar såsom fosforylering. Men till skillnad från paraffininbäddad vävnad, är frysning inte lämpliga för långtidskonservering av vävnaderna på grund av bildandet av iskristaller i cellerna som kan förändra subcellulär morfologi. När klippa, kan frysta vävnadssnitt förvaras vid -80 ° C i upp till ett år. I varje fall är framställningen av vävnadsprover en kompromiss mellan att bevara vävnaden/ cellulär arkitektur och bevara epitopen integritet.
Eftersom den ändrar den kemiska sammansättningen av vävnader, är det viktigt att optimera fixerings förhållanden för att undvika både ofullständig (enligt fi xation) och överdriven (overfixation) fi xation.
Faktiskt kan underfixation reducera den specifika signalen genom att främja den proteolytiska nedbrytningen av vissa antigener. Å andra sidan, kan overfixation förändra specifik märkning genom maskering av epitop eller alstring av en stark icke-specifik bakgrund. Sålunda, förutom att valet av fixeringslösning, andra parametrar som inkubationstiden, temperaturen och pH-värdet kommer att påverka vävnadsfixering. Även PFA är den vanligaste fixativ som används för IHC, kan det inte betraktas som en "universell" fixativ. PFA inducerar protein-protein och protein-nukleinsyrakomplex tvärbindningar och kan därför artefactually modifiera epitopen (overfixation) och sedan förhindra att recognition av den primära antikroppen. Emellertid kan epitopen vara ytterligare demaskeras genom AR tekniker (se nedan). PFA kan också vara olämpliga för detektion av vissa antigener, eftersom det har visats inducera translokationen av vissa fosforylerade proteiner från membranet till cytoplasman. I sådana fall måste PFA ersättas med lämpliga alternativa fixativ såsom alkohol. Till skillnad från PFA, behöver alkoholer såsom metanol eller etanol inte maskera epitoper eftersom de medger vävnadsfixering genom att ersätta vattenmolekyler i vävnader. Detta kan leda till utfällning av proteinerna och sedan förhindra antikropp / epitop interaktion på grund av konformationsförändringar. Det är allmänt trott att alkoholer inte penetrerar och därför inte bevarar vävnadsmorfologi samt PFA. Aceton är en annan alternativ fixativ, som vanligtvis används när man arbetar med icke-fixerade, snap-frusna vävnadssektioner. Men är aceton ett starkt dehydratiseringsmedel och kan leda till irreversibel utfällning av vävnadsproteiner.
För vissa antigener, kan ett ytterligare steg för AR krävas för att få en bra signal, främst om fixerings inducerar konformationsändringen eller förändrar elektrostatisk laddning av epitopen (maskering av epitopen). AR Formerna syftar till att vända dessa processer för att återställa immunoreaktiviteten av epitopen och dess efterföljande interaktion med den primära antikroppen. AR metoder bygger i huvudsak på två tillvägagångssätt: (1) proteas-inducerad epitopretrieval, det vill säga med enzymer, såsom proteinas K, trypsin eller pepsin, som klyver peptider som maskerar epitopen; och (2) värmeinducerad epitopretrieval, det vill säga med hjälp av en mikrovågsugn, tryckkokare, vegetabiliska ångkokare, autoklaver eller vattenbad. Detta senare tillvägagångssätt är speciellt tids-, temperatur-, buffert- och pH-känsliga, och de optimala villkor måste bestämmas empiriskt (ett exempel ges i protokollet avsnitt). Alternativt kan affiniteten hos en antikropp för dess antigen förstärkasgenom att ändra pH eller katjonen koncentrationen av antikroppsutspädningsmedel.
En permeabilisering steg krävs ibland för att erhålla en bra signal för en intracellulär epitop i tjocka vävnadssnitt, i synnerhet för nukleär antigen färgning. Detta kan åstadkommas på olika sätt genom att använda: (1) alkoholer eller aceton som fixativ; eller (2) detergenter såsom Triton, NP-40 (0,1-0,2% i PBS, 10 min), digitonin, saponin eller Tween 20 (0,2-0,5% för 10 till 30 minuter) efter PFA fixering. Emellertid, valet av detergenten beror på den cellulära lokaliseringen av epitopen detekterades. I själva verket, starka rengöringsmedel såsom Triton-X100, som solubiliserar cellmembran, är lämpliga för kärn epitop upptäckt, men kan leda till signal förändring på utvinning av vissa membranproteiner. Användningen av mildare detergenter (saponin och Tween 20) är mer lämpade för detektion av cytoplasmiska epitoper.
Den andra kritiska steget är blocksg ospecifik färgning. Bindningen av en antikropp till dess målepitop styrs av intermolekylära krafter (t.ex. hydrofoba och joniska interaktioner, vätebindning). Sålunda kan växelverkan av primära och / eller sekundära antikroppar med andra proteiner än sina målantigener resultera i icke-specifik färgning. Detta genererar hög fluorescens bakgrund, vilket förhindrar visualisering av proteinet av intresse (lågt signal / brusförhållande). Blockeringsreagens minskar ospecifika interaktioner utan att försämra specifik antikropp / epitop interaktion. Ett vanligt förfarande består av inkubation vävnadssnitt med värmeinaktiverat normalt serum eller BSA. Vid användning av ett normalt serum, måste det vara från samma art som den i värddjuret av den sekundära antikroppen eller från en obesläktade arter. I samtliga fall måste den valda blockeringsreagens också tillsättas till de utspädningsmedel för de primära och sekundära antikroppar. Vidare har användningen av icke-joniska detergenter såsom Triton X-100, Tlan 20 eller saponin bidrar till att reducera icke-specifika interaktioner.
Den tredje och kanske viktigaste parametern är primär selektion-antikroppen och optimering. Självklart är det bästa valet en högkvalitativ antikropp med minimal korsreaktivitet. Som monoklonala antikroppar uppvisar vanligtvis hög affinitet och specificitet för en enda epitop, de är de bästa verktygen för att diskriminera en viss medlem av en proteinfamilj med hög sekvensidentitet. Däremot kan antikroppen / epitopen interaktion äventyras om målepitopen har förlorat sin nativa konformationstillstånd eller när tillgången till epitopen förhindras av interaktioner med andra proteiner, post-translationella modifieringar, temperatur, pH, fixering och saltkoncentration. I sådana fall, polyklonala antikroppar är mer lämpliga som de känner igen multipla epitoper av samma protein. Dessutom är de ofta mer stabila än monoklonala antikroppar över ett brett område av pH och saltkoncentration.Preliminära studier måste fastställa lämpliga inkubationsbetingelser, det vill säga arbetsutspädning (monoklonal antikropp: 5-25 mg / ml, polyklonal antikropp: 1,7-15 mg / ml), inkubationstid, utspädningsmedel och temperatur, som måste bestämmas empiriskt för varje primär antikropp. Dessa parametrar måste optimeras för att fastställa villkoren som producerar den optimal signal med låg bakgrundsljud. Specificiteten för märkningen gynnas av längre inkubationstider vid lägre temperaturer (dvs., 4 ° C mot RT).
Valet att utföra direkt eller indirekt detektion beror ofta på graden av antigenuttryck. Exempelvis kan en höggradigt uttryckt epitop enkelt detekteras med en fluorokrom-konjugerad primär antikropp, vilket möjliggör en snabb och enkel multicolor färgning samtidigt undvika eventuell icke-specifik bakgrund på grund av användningen av en sekundär antikropp. Men direkt If kan genererar en låg signal till en högre kostnad, och kan sometimes vara svårt, när märkt antikropp inte är kommersiellt tillgängliga. Omvänt är IIF känsligare att detektera lägre uttryckta epitoper som den genererade signalen är mer intensiv på grund av interaktionen av minst två märkta sekundära antikroppar (framtagna mot den primära antikroppen värdarten) med den primära antikroppen (amplifiering). Vidare ett brett spektrum av sekundära antikroppar konjugerade till olika fluoroforer är kommersiellt tillgängliga, relativt billiga, och kvaliteten kontrolleras. Dock kan detta tillvägagångssätt inducera korsreaktivitet och kräver därför att noggrant välja primära antikroppar som inte produceras i samma art eller av olika isotyper när de utför flera märkningsexperiment. IIF också ibland kräver extra blockerings steg och måste innehålla systematiska negativa kontroller (se nedan). Amplifiering kan vidare uppnås genom användning av en biotin-konjugerad sekundär antikropp och fluorescent märkt avidin eller streptavidin (fyra biotiner bundet per molecule). Ändå kräver denna amplifieringsmetod ytterligare steg för att förhindra icke-specifik bindning och kan inte anpassas för färgning av vissa vävnader (lever, njure, hjärta, hjärna, lunga och ammande bröstkörtel) beroende på närvaron av höga nivåer av endogent biotin . Däremot kan endogen biotin blockeras av pre-inkubering av provet med avidin och därefter med biotin före inkubation med den primära antikroppen. Valet av de konjugerade fluorokromer, som är små kemiska molekyler med egenskapen att emittera ljus då de exciteras av ljus med en kortare våglängd, beror primärt på typen av mikroskoputrustning som finns tillgänglig.
När korrekt utformad för att begränsa både korsreaktivitet mellan antikropparna och crossover mellan de spektrala egenskaperna hos fluorokromerna används tillåter immunofluorescens-baserade IHC samtidig visualisering av flera cellulära mål.
Den sista kritiskapunkt om IHC experiment gäller de positiva och negativa kontroller som måste utföras för att stödja giltigheten av färgning, för att identifiera experimentella artefakter och för korrekt tolkning av resultaten. Vissa vävnader uppvisar hög fluorescerande bakgrund (benämnd autofluorescens) som kan leda till en felaktig tolkning av resultaten. Således, vävnadssnitt måste observeras under både fluorescens och ljusfält belysning innan IHC experimentet. En negativ kontroll som utelämnar den primära antikroppen måste systematiskt ingå i varje IHC experiment i syfte att säkerställa att en potentiell icke-specifik bindning av den sekundära antikroppen är försumbar och inte skymmer eller likna specifika färgningsmönstret. En isotypkontroll kan utföras när man arbetar med en monoklonal primär antikropp genom att ersätta den med en icke-immun antikropp av samma isotyp (t.ex. lgG1, IgG2A, IgG2b, IgM) vid samma koncentration. Denna kontroll bidrar till estimate den icke-specifik färgning, som kan bero på samverkan av antikroppar med provet. För att demonstrera den specifika bindningen av en antikropp till dess antigen, kan en absorption kontroll åstadkommas på två sätt genom att i förväg inkubera den primära antikroppen: (1) med dess lösliga immunogen (10: 1 molförhållande) O / N vid 4 ° C ; och (2) med celler eller vävnadssnitt som uttrycker epitopen av intresse men som skiljer sig från den studerade vävnad (till exempel, se figur 4B i 59). I båda fallen bör den därav utarmning av den primära antikroppen leder till liten eller ingen färgning. En annan typ av styrning kan göras med hjälp en irrelevant primär antikropp, dvs., Riktad mot en epitop som uppvisar en cellulär lokalisering som skiljer sig från epitopen av intresse (nukleär kontra cytoplasma). Den irrelevant antikropp måste vara av samma isotyp och arter som den primära antikroppen av intresse. Ytterligare kontroller för IHC experiment kan innefatta användning av prover från tissderingar kända för att uttrycka (transgena djur) eller inte (knock-out djur) epitopen av intresse. Detta kan ge en användbar referens och bidra till att optimera IHC förfarandet.
En huvud begränsning av IF tekniker är att de endast kan tillämpas på fasta (döda) och / eller permeabiliserade celler, både förfarande potentiellt framkalla artefakter. Andra begränsningar med denna metod är på grund av användningen av ett mikroskop för observation av proverna. Först, eftersom optisk upplösning på epifluorescence och konfokala mikroskop är begränsad, plats eller samlokalisering av de detekterade proteinerna bör inte övertolkas. För det andra fotoblekning, dvs.. blekning av fluorescensintensiteten med tiden när de exponeras för ljus, är i huvudsak på grund av alstring av reaktiva syretyper i provet vid fluorescensexcitation som, i sin tur, leder till den fotokemiska förstörelse av fluoroforen. Fotoblekning kan minskas genom: a) att hålla proverna skyddas frånljus under IF experimentet och lagring tills deras observation; b) med en antifade medel (reaktiva syreradikaler asätare) i monteringsmedium; c) minska intensiteten och / eller varaktigheten av excitationsljuset; d) ökning av koncentrationen av fluoroforer eller med användning av en låg koncentration av en fluorokrom med hög kvantverkningsgrad; och e) med hjälp av robusta fluoroforer som är mindre benägna att fotoblekning (dvs.. Alexa Fluors, Seta Fluors eller DyLightFluors). För det tredje, är autofluorescens ofta på grund av närvaron av flavin koenzymer (FAD och FMN: absorption, 450 nm, utsläpp, 515 nm) och minskade pyridinnukleotider (NADH: absorption, 340 nm, utsläpp, 460 nm) i däggdjursceller. Vidare användning av aldehyder, särskilt glutaraldehyd, för att fixera proverna kan resultera i höga nivåer av autofluorescens. Detta kan minimeras genom att tvätta prover med 0,1% natriumborhydrid i PBS före antikropp inkubation och / eller genom att välja prober och optiska filter att Maximize fluorescenssignalen i förhållande till autofluorescens. För det fjärde, fluorescens överlappning (även kallad genomblödning, crossover eller överhörning) beror främst på att emissionsspektrala egenskaperna hos fluoroforer eftersom de ofta uppvisar mycket breda bandbredder, olika, asymmetriska spektrala profiler, samt olika toppemissionsvåglängder och antal maxima. Fluorescens överlappning när man arbetar med flera fluoroforer (multicolor märkning) och kännetecknas av emissionen av en fluorofor i kanalen (filtret) hos en annan fluorofor. Genomblödning artefakter skall minimeras eftersom de ofta komplicerar tolkningen av IF resultat, särskilt när det gäller samlokalisering eller kvantitativa studier. Som balansering av utsläpps fluoroforer bara kan vara något förbättras genom IF förfarande, genomblödning kan främst reduceras vid bildtagning med hjälp av en optimerad fluorescensfilteruppsättningar och / eller fotomultiplikatorn detektor för att korrekt separåt de spektrala profilerna för fluoroforerna. I detta avseende är konfokalmikroskopi väl lämpad för flerfärgsbildalstring eftersom den tillåter differentiering fluorescensemissionsspektra för individuella fluoroforer genom att rikta varje signal till en viss detekteringskanal. Dessutom tillåter konfokalmikroskopi att justera förstärkningen, fotomultiplikatorn spänning, eller lasereffekt för de enskilda detekteringskanaler för sekventiell förvärvet (endast en fluorofor i taget) av märkningen. Helst måste enkeletikett kontroller genomföras för att kvantifiera den genomblödning och slutligen ta bort det beräkningsmässigt. En kontroll utan sekundära antikroppar (bakgrundskontroll), kan framställas för att ställa in gränserna för signalförstärkning och offset för varje kanal för optimal bildinsamlande. Det kan också användas för efter förvärvet behandling för att korrekt bild bakgrund (autofluorescens).
Sammanfattningsvis, den metod som beskrivits ger en enkel standardprotokoll för enkla realizatining immunofärgning på bröstkörtel sektioner. Icke desto mindre måste de viktigaste stegen i en IHC experiment optimeras för varje antigen / antikropps par för att visualisera specifik färgning och för att minimera icke-specifika bakgrundssignaler. Det beskrivna förfarandet innefattar även flera grundläggande metoder för efterbehandling av de flesta av de erhållna bilderna. Fluorescens-baserad immundetektering är en kraftfull metod med ett brett spektrum av applikationer från den cellulära lokaliseringen av ett antigen för diagnos. Nya framsteg i dessa metoder kommer att uppnås med den framtida utvecklingen av nya fluoroforer, förvärvs enheter och mikroskopitekniker, bilden tidigare obemärkt uppgifter om biologiska strukturer och processer.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Författarna förklarar att de inte har några konkurrerande ekonomiska intressen.
Acknowledgments
Författarna är tacksamma mot INRA MIMA2 imaging core facility (INRA, UMR1198, Jouy-en-Josas) och personalen på IERP enheten (UE 0907, INRA, Jouy-en-Josas) för djuromsorg och anläggningar. Vi vill också tacka IH Mather, MC Neville och S. Tooze för att förse oss med mycket användbar antibodie.
Materials
| Name | Company | Catalog Number | Comments |
| Dissection | |||
| Pins | |||
| Ethanol | |||
| Scissors | |||
| Scalpel and adapted blades | |||
| Ice | |||
| Towel paper | |||
| Tissue sample preparation | Company | Catalog Number | Comments/Description |
| Phosphate Buffered Saline (pH7.4) | Sigma | P-3813 | |
| Paraformaldehyde (PFA, 32% EM grade, 100 ml) | Electron Microscopy Sciences | 15714-S | personnal protection equipment required WARNING: this product will expose you to Formaldehyde Gas, a chemical known to cause cancer |
| OCT compound/Tissue Tek | Sakura | 4583 | |
| Sucrose (D-saccharose) | VWR | 27480.294 | |
| Plastic molds | Dominique Dutscher | 39910 | |
| Liquid nitrogen | |||
| Cryostat/sample support | Leica | CM3050S | |
| Razor blades (SEC35) | Thermo Scientific | 152200 | |
| Slide box | |||
| Glass slides Superfrost/Superfrost Ultra Plus | Thermo Scientific | 10143560W90/1014356190 | |
| Brushes | |||
| IHC | Company | Catalog Number | Comments/Description |
| Super Pap Pen | Sigma | Z377821-1EA | |
| Permanent marker (black) | |||
| 50 mM NH4Cl in PBS | Sigma | A-0171 | |
| 0.1 M glycine in PBS | VWR | 24403.367 | |
| Antigen Retrieval solution: Tris 100 mM 5% urea pH9.6 | |||
| Heater (up to 100°C) | |||
| Bovine Serum Albumin (BSA) | Sigma | A7906-100G | |
| Vectashield (anti-fading mounting medium) without DAPI/with DAPI | Vector Laboratories | H-1000/H-1200 | |
| Glass coverslips 22x50mm (microscopy grade) | VWR | CORN2980-225 | |
| Nail polish | |||
| Primary antibodies | Company | Catalog Number | Comments/Description |
| Rabbit anti-mouse caseins (#7781; 1:50 dilution) | generously gifted by M.C. Neville (University of Colorado Health Sciences Center, USA) |
||
| Mouse anti-cytokeratin 8 (CK8, clone 1E8, 1:50 dilution) | Biolegend (Covance) | MMS-162P | |
| Mouse anti-cytokeratin 14 (CK14, cloneLL002, 1:50 dilution) | Thermo Scientific | MS-115-P0/P1 | |
| Rabbit anti-butyrophilin (1:300 dilution) | generously gifted by I.H. Mather (Department of Animal and Avian Sciences University of Maryland College Park, USA) | ||
| Rabbit anti-Stx6 (1:50 dilution) | generously gifted S. Tooze (Cancer Research UK, London Research Institute, London, UK) |
||
| Rabbit anti-VAMP4 (1:50 dilution) | Abcam | ab3348 | |
| Secondary antibodies | Company | Catalog Number | Comments/Description |
| Rhodamine-conjugated goat anti-rabbit IgG (H + L) (1:300 dilution) | Jackson ImmunoResearch Laboratories | 111-025-003 | |
| Counterstains | Company | Catalog Number | Comments/Description |
| Bodipy 493/503 | Life Technologies (Molecular Probes) | D-3922 | |
| DAPI (4-6-diamidino-2-phenylindole) | Life Technologies (Molecular Probes) | D-1306 | |
| Observation/Image capture | Company | Catalog Number | Comments/Description |
| conventional fluorescence microscope | Leica Leitz DMRB microscope |
Standard filters for FITC, Rhodamine and DAPI emissions, ×63 oil-immersion objective (NA 1.3), DP50 imaging camera (Olympus), CellˆF software (Olympus) |
|
| Laser Scanning Microscope (confocal microscopy) | Zeiss LSM 510 microscope |
Plan-Apochromat ×63 oil-immersion objective (NA 1.4), CLSM 510 software, Confocal facilities, MIMA2 Platform, INRA Jouy-en-Josas, France, http://mima2.jouy.inra.fr/mima2) | |
| Image treatment | Company | Catalog Number | Comments/Description |
| ImageJ 1.49k software | Free software |
References
- Watson, C. J., Khaled, W. T. Mammary development in the embryo and adult: a journey of morphogenesis and commitment. Development. , 135-995 (2008).
- Smith, G. H. Experimental mammary epithelial morphogenesis in an in vivo model: evidence for distinct cellular progenitors of the ductal and lobular phenotype. Breast Cancer Res Treat. 39, 21-31 (1996).
- Van Keymeulen, A., et al. Distinct stem cells contribute to mammary gland development and maintenance. Nature. 479, 189-193 (2011).
- Oakes, S. R., Gallego-Ortega, D., Ormandy, C. J. The mammary cellular hierarchy and breast cancer. Cell Mol Life Sci. 71, 4301-4324 (2014).
- Visvader, J. E., Stingl, J. Mammary stem cells and the differentiation hierarchy: current status and perspectives. Genes & development. 28, 1143-1158 (2014).
- Robinson, G. W. Cooperation of signalling pathways in embryonic mammary gland development. Nat Rev Genet. 8, 963-972 (2007).
- Cowin, P., Wysolmerski, J. Molecular mechanisms guiding embryonic mammary gland development. Cold Spring Harb Perspect Biol. 2, a003251 (2010).
- Brisken, C., O'Malley, B. Hormone action in the mammary gland. Cold Spring Harb Perspect Biol. 2, a003178 (2010).
- Gjorevski, N., Nelson, C. M. Integrated morphodynamic signalling of the mammary gland. Nat Rev Mol Cell Biol. 12, 581-593 (2011).
- Daniel, C. W., Smith, G. H. The mammary gland: a model for development. J Mammary Gland Biol Neoplasia. 4, 3-8 (1999).
- Howlett, A. R., Bissell, M. J. The influence of tissue microenvironment (stroma and extracellular matrix) on the development and function of mammary epithelium. Epithelial Cell Biol. 2, 79-89 (1993).
- Edwards, G., Streuli, C. Signalling in extracellular-matrix-mediated control of epithelial cell phenotype. Biochem Soc Trans. 23, 464-468 (1995).
- Hennighausen, L., Robinson, G. W. Think globally, act locally: the making of a mouse mammary gland. Genes & development. 12, 449-455 (1998).
- Topper, Y. J., Freeman, C. S. Multiple hormone interactions in the developmental biology of the mammary gland. Physiol Rev. 60, 1049-1106 (1980).
- Brisken, C., et al. A paracrine role for the epithelial progesterone receptor in mammary gland development. Proc Natl Acad Sci U S A. 95, 5076-5081 (1998).
- Ormandy, C. J., Binart, N., Kelly, P. A. Mammary gland development in prolactin receptor knockout mice. J Mammary Gland Biol Neoplasia. 2, 355-364 (1997).
- Oakes, S. R., Rogers, R. L., Naylor, M. J., Ormandy, C. J. Prolactin regulation of mammary gland development. J Mammary Gland Biol Neoplasia. 13, 13-28 (2008).
- Hennighausen, L., Robinson, G. W. Information networks in the mammary gland. Nat Rev Mol Cell Biol. 6, 715-725 (2005).
- Kouros-Mehr, H., Werb, Z. Candidate regulators of mammary branching morphogenesis identified by genome-wide transcript analysis. Dev Dyn. 235, 3404-3412 (2006).
- Khaled, W. T., et al. The IL-4/IL-13/Stat6 signalling pathway promotes luminal mammary epithelial cell development. Development. 134, 2739-2750 (2007).
- Asselin-Labat, M. L., et al. Gata-3 is an essential regulator of mammary-gland morphogenesis and luminal-cell differentiation. Nat Cell Biol. 9, 201-209 (2007).
- Barcellos-Hoff, M. H., Aggeler, J., Ram, T. G., Bissell, M. J. Functional differentiation and alveolar morphogenesis of primary mammary cultures on reconstituted basement membrane. Development. 105, 223-235 (1989).
- Robinson, G. W., McKnight, R. A., Smith, G. H., Hennighausen, L. Mammary epithelial cells undergo secretory differentiation in cycling virgins but require pregnancy for the establishment of terminal differentiation. Development. 121, 2079-2090 (1995).
- Streuli, C. H., Bissell, M. J. Mammary epithelial cells, extracellular matrix, and gene expression. Cancer Treat Res. 53, 365-381 (1991).
- Streuli, C. H., et al. Laminin mediates tissue-specific gene expression in mammary epithelia. J Cell Biol. 129, 591-603 (1995).
- Boudreau, N., Sympson, C. J., Werb, Z., Bissell, M. J. Suppression of ICE and apoptosis in mammary epithelial cells by extracellular matrix. Science. 267, 891-893 (1995).
- Pullan, S., et al. Requirement of basement membrane for the suppression of programmed cell death in mammary epithelium. J Cell Sci. 109 (Pt 3), 631-642 (1996).
- Schmidhauser, C., Bissell, M. J., Myers, C. A., Casperson, G. F. Extracellular matrix and hormones transcriptionally regulate bovine beta-casein 5' sequences in stably transfected mouse mammary cells. Proc Natl Acad Sci U S A. 87, 9118-9122 (1990).
- Streuli, C. H., et al. Stat5 as a target for regulation by extracellular matrix. J Biol Chem. 270, 21639-21644 (1995).
- Sollner, T., et al. SNAP receptors implicated in vesicle targeting and fusion. Nature. 362, 318-324 (1993).
- Jahn, R., Scheller, R. H. SNAREs--engines for membrane fusion. Nat Rev Mol Cell Biol. 7, 631-643 (2006).
- Weber, T., et al. SNAREpins: minimal machinery for membrane fusion. Cell. 92, 759-772 (1998).
- Sollner, T., Bennett, M. K., Whiteheart, S. W., Scheller, R. H., Rothman, J. E. A protein assembly-disassembly pathway in vitro that may correspond to sequential steps of synaptic vesicle docking, activation, and fusion. Cell. 75, 409-418 (1993).
- McNew, J. A. Regulation of SNARE-mediated membrane fusion during exocytosis. Chem Rev. 108, 1669-1686 (2008).
- Wang, C. C., et al. VAMP8/endobrevin as a general vesicular SNARE for regulated exocytosis of the exocrine system. Mol Biol Cell. 18, 1056-1063 (2007).
- Chat, S., et al. Characterisation of the potential SNARE proteins relevant to milk product release by mouse mammary epithelial cells. Eur J Cell Biol. 90, 401-413 (2011).
- Reinhardt, T. A., Lippolis, J. D. Bovine milk fat globule membrane proteome. J Dairy Res. 73, 406-416 (2006).
- Robenek, H., et al. Butyrophilin controls milk fat globule secretion. Proc Natl Acad Sci U S A. 103, 10385-10390 (2006).
- Fujimoto, T., Ohsaki, Y., Cheng, J., Suzuki, M., Shinohara, Y. Lipid droplets: a classic organelle with new outfits. Histochem Cell Biol. 130, 263-279 (2008).
- Mather, I. H., Keenan, T. W. Origin and secretion of milk lipids. J Mammary Gland Biol Neoplasia. 3, 259-273 (1998).
- Heid, H. W., Keenan, T. W. Intracellular origin and secretion of milk fat globules. Eur J Cell Biol. 84, 245-258 (2005).
- McManaman, J. L., Russell, T. D., Schaack, J., Orlicky, D. J., Robenek, H. Molecular determinants of milk lipid secretion. J Mammary Gland Biol Neoplasia. 12, 259-268 (2007).
- de Assis, S., Warri, A., Cruz, M. I., Hilakivi-Clarke, L. Changes in mammary gland morphology and breast cancer risk in rats. Journal of visualized experiments : JoVE. , (2010).
- Plante, I., Stewart, M. K., Laird, D. W. Evaluation of mammary gland development and function in mouse models. Journal of visualized experiments : JoVE. , (2011).
- Galio, L., et al. MicroRNA in the ovine mammary gland during early pregnancy: spatial and temporal expression of miR-21, miR-205, and miR-200. Physiol Genomics. 45, 151-161 (2013).
- Linzell, J. L., Peaker, M. The effects of oxytocin and milk removal on milk secretion in the goat. J Physiol. 216, 717-734 (1971).
- Knight, C. H., Peaker, M., Wilde, C. J. Local control of mammary development and function. Rev Reprod. 3, 104-112 (1998).
- Walid, M. S., Osborne, T. J., Robinson, J. S. Primary brain sarcoma or metastatic carcinoma? Indian J Cancer. 46, 174-175 (2009).
- Hue-Beauvais, C., et al. Localisation of caveolin in mammary tissue depends on cell type. Cell Tissue Res. 328, 521-536 (2007).
- McManaman, J. L., Neville, M. C. Mammary physiology and milk secretion. Adv Drug Deliv Rev. 55, 629-641 (2003).
- Mather, I. H., Jack, L. J. A review of the molecular and cellular biology of butyrophilin, the major protein of bovine milk fat globule membrane. J Dairy Sci. 76, 3832-3850 (1993).
- Heid, H. W., Winter, S., Bruder, G., Keenan, T. W., Jarasch, E. D. Butyrophilin, an apical plasma membrane-associated glycoprotein characteristic of lactating mammary glands of diverse species. Biochim Biophys Acta. 728, 228-238 (1983).
- Bock, J. B., Klumperman, J., Davanger, S., Scheller, R. H. Syntaxin 6 functions in trans-Golgi network vesicle trafficking. Mol Biol Cell. 8, 1261-1271 (1997).
- Tran, T. H., Zeng, Q., Hong, W. VAMP4 cycles from the cell surface to the trans-Golgi network via sorting and recycling endosomes. J Cell Sci. 120, 1028-1041 (2007).
- Wendler, F., Page, L., Urbe, S., Tooze, S. A. Homotypic fusion of immature secretory granules during maturation requires syntaxin 6. Mol Biol Cell. 12, 1699-1709 (2001).
- Wendler, F., Tooze, S. Syntaxin 6: the promiscuous behaviour of a SNARE protein. Traffic. 2, 606-611 (2001).
- Shitara, A., et al. VAMP4 is required to maintain the ribbon structure of the Golgi apparatus. Mol Cell Biochem. 380, 11-21 (2013).
- Thibault, C., Levasseur, M. C. La reproduction chez les mammifères et l'homme. , INRA Editions. 928 (2001).
- Truchet, S., Wietzerbin, J., Debey, P. Mouse oocytes and preimplantation embryos bear the two sub-units of interferon-gamma receptor. Mol Reprod Dev. 60, 319-330 (2001).



