Summary
在这篇文章中所描述的间接免疫荧光协议允许的检测和蛋白在小鼠乳腺定位。一个完整的方法是考虑到制备乳腺样品,利用荧光显微镜进行免疫组织化学,将图像的组织切片,并重建图像。
Abstract
间接免疫荧光来检测和定位感兴趣的蛋白质中的组织。这里介绍的协议描述了用于免疫检测的蛋白质的完整和简单的方法,鼠标哺乳期乳腺被作为例子。一种协议,它的组织样本的准备,特别是关于小鼠乳腺,组织固定和冷冻组织切片的剥离,有详细。一个标准的协议进行间接免疫荧光法,包括可选的抗原修复步骤,还赠送。也指出了标记的组织切片的观察以及图像获取和后处理。此过程提供了一个完整的概述,从动物组织收集到的蛋白质的细胞定位。虽然这种通常的方法可以适用于其他组织样品,应当适应每个组织/一级抗体耦合影响。
Introduction
乳腺是非典型哺乳动物外分泌器官,其主要功能是产生乳喂养新生儿。乳腺组织的发育主要发生在出生后,其特征是一种独特的方法,其中上皮侵入周围的基质。此组织经历了许多变化(生长,分化和回归),特别是在成人生活,与之同时变化生殖状态( 图1)。除了 组织的整体形态,不同的细胞类型以及它们的乳腺内排列的比例发展1-5中显着改变。
在胚胎生命,乳腺上皮细胞从乳房乳线,这是由外胚层的轻微增厚和分层定义导出,脱颖而出和后肢之间围绕10.5天胚胎(E10.5)(图1A中线的每一侧)。上E11.5,牛奶线分解成单个placodes,它们沿在可重现的位置的乳房乳线对称地定位,并且周围的间质开始凝结。所述placodes开始下沉更深进入真皮和乳腺间质组织周围的乳腺芽(E12.5-E14.5)同心层。作为E15.5的,乳腺上皮细胞,开始增殖和细长形成初级发芽是推动通过向脂肪垫乳腺间质。主芽开发的中空内腔具有开口到皮肤上,打上了乳头鞘的形成。在E18.5,在延长管道已成长为脂肪垫,并分流到包括在脂肪垫一个小arborized导管系统。发展基本上逮捕和基本的乳腺仍然morphogenetically静态直到青春期。在男性胚胎,雄激素受体的活化导致的芽,其消失的变性由E15.5。作为E18的,乳腺发育停止,直到青春期6-9。
出生时,乳腺藏着一个基本的导管系统,拉长和分支机构缓慢(等速生长)。在青春期开始,位于所述导管的尖端球形结构称为末端芽(TEBS),被帽细胞的外层和细胞的多层内芯(体细胞)的形成。这些结构是高度增殖和浸润周围基质组织响应于激素线索。该TEBS导致乳腺导管内延伸扩散,加上分支形态。该过程导致建立一个基本上皮arborized网络从乳头(图1B,青春期)发出的。在〜出生后10-12周,当上皮侵入整个脂肪垫,其扩张停止,并且TEBS消失。导管发展然后经历动态变化,也就是说,successi根据动情周期10( 图1B,成人)已经增殖的上皮细胞和回归。
从妊娠开始时,乳腺组织经历了重要的增长和形态变化,为哺乳做准备。乳腺上皮细胞广泛增殖和分化,导致了高度支肾小管肺泡网络。与此同时,乳腺上皮细胞(的MECs)成为偏振光,并且能够合成和分泌奶制品。的MECs组织成无数肺泡结构(腺泡)是由收缩肌上皮细胞包围,并在一个的结缔组织和脂肪组织,血管和神经末端(图1B,怀孕)组成基质并入。此外,的MECs的基部侧与基底膜(细胞外基质)紧密接触,并且在这两个实体之间的相互作用紧紧调节乳房的两个形态发生和分泌功能RY上皮11-13。
所有这些方法依赖于各种环境因素,其中最重要的是hormones14,旁分泌因子和细胞外基质的作用。例如,孕激素诱导广泛侧分支15和alveologenesis即,结合催乳激素(PRL)的16,17,促 进和维持肺泡的分化。除了 类固醇和PRL18,细胞因子和与发育相关的信号通路(Wnt信号和Notch信号转导通路)也参与了乳腺谱系提交和发展19-21。在怀孕的最后,管腔的MECs开始产生一个富含蛋白质的乳在肺泡的管腔被称为初乳。此外,孕酮作用于上皮通透性并且由于紧密连接仍然是开放的,初乳也见于母体血液流。
分娩后,mammarÿ上皮占据了几乎所有的乳腺体积和高度有组织的(图2,乳腺上皮细胞)。牛奶生产单元,即肺泡(图2,肺泡),由极化的乳腺上皮分泌细胞(MESCs)的单层形成,其顶端质膜界定的内腔中。肺泡安排自己成分为连接到漏奶到外环境( 图2,叶)导管叶小叶。哺乳期时, 即 ,MESCs开始分泌大量丰富的牛奶,主要由胎盘激素的下降(主要是黄体酮)( 图1B期,哺乳期)触发。牛奶中的蛋白质基因在规定的时间时程,从怀孕到哺乳期9,22,23激活,主要是针对在哺乳时释放的垂体泌乳素。与此同时,MESCs和细胞外基质在两者之间的接触刺激乳蛋白SYNThesis通过通过细胞整合和层粘连蛋白24,25之间的相互作用介导的,而抑制细胞凋亡MESCs 26,27信号。这些信号通路导致的乳蛋白基因启动子28通过的特异性转录激活因子29的活化。细胞 - 细胞接触也可用于分化的一些方面包括建立心尖极性和牛奶制品的矢量分泌重要。紧密连接泌乳和MESCs开始之后迅速接近微细编排分子的摄取从血液以及牛奶成分的合成,运输和分泌,响应于新生儿的营养需求。在哺乳时,周围的肺泡中的肌上皮细胞收缩发生在响应于催产素和通过导管并进入乳头导致牛奶的喷射。奶是一种复杂的流体,它包含蛋白质(大多酪蛋白),糖(主要是乳糖),脂质和矿物质,以及生物活性分子,例如免疫球蛋白A(IgA的),生长因子和激素。酪蛋白被合成,组装在超分子结构,即酪蛋白胶束,沿分泌途径转运,然后通过胞吐作用释放时, 即 ,融合的含酪蛋白分泌囊泡(SV)上与卓制的顶质膜( 图2)。
细胞内的流量依赖于膜室之间的物质交换,涉及可溶性N-乙基马来酰亚胺敏感融合(NSF)附着蛋白(SNAP)受体(SNARE)30,31。的SNARE蛋白家族被细分在囊泡斯耐尔(ⅴ-斯耐尔),存在于泡膜,和目标斯耐尔(叔斯耐尔),定位于目标膜。通过他们的卷曲螺旋结构域压缩和解,v型和叔斯耐尔组装形成一个高度稳定的四螺旋束复合物,被称为第ËSNARE复合体。这种复杂的,通过逐步使它们变成接近30,32促进了两种对立的脂质双层的融合。然后,圈套络合物由NSF三磷酸腺苷酶解离和其接头蛋白的SNAP和SNARE蛋白被再循环回到原点33的其隔室。有趣的是,每SNARE蛋白主要位于不同的细胞区室和SNARE配对可能有助于胞内融合事件34的特异性。以往的研究表明,至少有突触相关蛋白23(SNAP23)和囊泡相关膜蛋白8(VAMP8),和syntaxins(STX)-7和-12起到酪蛋白的胞外分泌35,36的作用。这些蛋白也被发现与牛奶的脂质级分, 即 ,乳脂肪球(MFGS)37。目前通行的模型假设,胞浆脂滴(限流二极管)是由中立升堆积而成ipids(主要是甘油三酯和甾醇酯)和胆固醇从内质网(ER)膜38-41的两个小叶之间的母亲饮食衍生的。大限流二极管形成,至少部分地由较小的限流二极管的融合而被运送到MESCs的顶侧在那里它们被释放为MFGS(1-10微米直径)通过出芽,被包裹由卓制顶部质膜40-42。泌乳停止幼仔断奶和MESCs逐步通过凋亡死亡,导致乳腺组织回青春期状态(图1B,退化)的回归之后。
免疫荧光(IF)是在生物学的几乎所有方面中使用的共同的分析实验室方法,无论是在研究和在临床诊断。 IF技术可以对组织切片进行(免疫组化,IHC)或细胞(免疫细胞化学,ICC)的样品。这种强大的方法依赖于使用fluorescent-特异性结合(直接或间接)到感兴趣的抗原,因此允许其组织分布通过荧光显微镜可视化标记的抗体。荧光信号大多依赖于抗体的检体的质量和浓度和适当的处理。一个简单的间接免疫荧光(IIF)协议被呈现给检测奶制品(酪蛋白和MFGS)以及参与牛奶产品分泌蛋白质(嗜乳脂蛋白(BTN1),SNARE蛋白质)对小鼠乳腺组织(图3)的冷冻切片。虽然该协议提供了一个完整的IHC概述,从组织收集到的图像后处理,关键和可选步骤以及一些技术建议也被提出和讨论。
Subscription Required. Please recommend JoVE to your librarian.
Protocol
CD1小鼠饲养在INRA(UE0907 IERP,茹伊-EN-Josas,法国)。动物护理的所有道德方面符合由农业部法国文化部制定的有关准则和许可要求。所使用的程序都经当地伦理委员会(协议12/097从Comethea的Jouy-ZH-Josas / AgroParisTech)。
1.乳腺样品制备
- 小鼠乳腺解剖
- 颈椎脱位安乐死小鼠在哺乳期的第10天,其腹部朝上脚的动物了。
- 用乙醇湿腹侧区和用纸巾擦干。
- 使用镊子,拉起两条后腿之间的腹部皮肤,并用锋利的剪刀长约1厘米切口(只通过皮肤)。从这个第一切口开始,然后用剪刀剪开皮肤至鼠标的脖子。从腹膜和PI拉扯皮肤走ñ下来的皮肤在同一时间一面,伸展它教。
- 收集腹部和腹股沟乳腺通过推动它们远离皮肤用棉签,最后拉动或切割他们远离腹膜。
注意:在这个步骤胭脂红染色可以以整个腺体43内可视化的乳腺上皮细胞中进行。这种方法可能是有用的,以分析在各种条件(生理发育阶段,疾病,在体内治疗)下的乳腺的全局形貌。 - 除去位于腹部的连接点与腹股沟淋巴结44的淋巴结。
- 乳腺组织固定
- 切割乳腺组织成3mm 3个片段用解剖刀和立即冲洗在磷酸盐缓冲盐水这些片段(PBS)的溶液,pH 7.4中,以除去尽可能多的牛奶越好。
- 快速干燥的片段上的纸毛巾,并把它们在含有4%多聚甲醛(PFA,甲醛,32%甲醛溶液,小心)为10到15分钟,在冰上冷PBS溶液。
注意:这是足够的时间,以允许对乳腺组织切片随后的分析通过IIF36和/或原位杂交45。然而,由于醛固定剂渗透相当缓慢的组织片段(〜每小时1-3毫米),该时间可能会延长,以确保组织样品的最佳固定。或者,通过灌注麻醉动物用固定液(在本研究中未详述)固定在体内组织中。
- 蔗糖输液
- 快速冲洗乳腺片段在冷PBS浸泡它们下温和摇动含40%蔗糖(D-蔗糖,C12H22O11议员,342.3克/摩尔)为16至48小时的冷PBS溶液在4℃下。
- 组织包埋
注意:在这一步,乳腺片段可重新切割,以便使更小的片段(2-3毫米3),或者,调整它们的形状。- 正确标注的塑料模具和填充第三模具OCT化合物中,保持在室温的体积。放置每个模具乳腺组织中的一个片段(2-3毫米3)中,用OCT化合物中覆盖。
- 将模具在液氮(以铝或使用金属筛的片材)的表面,并允许产品冻结。
注意:它必须成为沉浸在模具液氮前,固体和白色。
- 储存冷冻样品在-80℃,直到组织切片进行。
2.冰冻组织切片
注意:低温恒温器,它实际上是一个冰柜内的切片机,需要使冰冻组织切片。较低的温度通常需要脂肪或脂质丰富的组织如处女乳腺。
- 调节低温恒温器的温度升高到-26℃,并等待,直到它具有STABIlized。保持冷冻的组织块,在-26℃的整个切片过程。绝对避免在操作过程中解冻组织在任何时间。
- 通过将它们放置在低温恒温器,至少10分钟,冷却刀片,切割支持,防滚装置和刷到-26℃。还放置低温恒温器内的滑动箱,以便能够存储载玻片作为部分制成。
- 正确标注载玻片将用于收集组织切片和维护它们在RT;否则组织切片不会遵守。从低温恒温器内的模具中取出的样品。
注意:使用带正电荷的玻片将新鲜冰冻组织切片的附着力大大有利于由于较高的静电吸引。 - 覆盖的金属组织光盘OCT化合物中(保持在RT)的表面和冷冻样本推到它。放置在低温恒温器内部的湿片,让它合作OL至少15分钟。
- 将湿安装在低温恒温器的盘夹持器。调整切割厚度为5-6微米,如果可能的话,使用新的锋利的刀片,或者至少改变区用来切割每个样品,因为一些组织会迅速沉闷它的刀片。
- 通过使封固剂的切口,直到切片形成均匀且正确地调整在剃刀刀片的防滚装置的位置。理想的是,防滚装置将跳过的刀片由约1mm。
- 一旦设置正确,转动轮连续匀速运动进行组织切片。除非温度是理想的,组织部分将在本质上,尽量蜷缩。
- 用刷子抓住和操纵在舞台上一节,以便根据需要在载玻片上放置。用刷子清理冰冻组织块和/或刀片上可能存在的遗迹。
- 拉组织切片朝向用户和避免按压到低温恒温器阶段。避免按组织切片上低温恒温器阶段,因为它可能导致在舞台上的组织切片,因此无法与载玻片恢复它的粘附性。
- 通过拾取起来在一个玻璃载片的表面上,通过保持它上面的部分和垂钓下来触摸组织切片获取组织切片一个接一个。
注:组织切片快坚持以热烈的玻璃由于静电吸引力。如果几个组织切片放在同一张幻灯片上,注意不要重叠,他们和他们的空间足够,能够单独将它们放在一个疏水圈(参见3.1.1节)。
3.间接免疫荧光
- 定位部分
- 使用的疏水性屏障用笔画出载玻片上的组织周围的疏水性循环。让圈子干在室温约1分钟。周围绘制的T线用细黑永久性标记问题的部分,以及,但在玻璃载片相对的之一,组织切片是侧。
注意:此圆是拒水和丙酮和醇不溶性的。因此,它提供了一个屏障,IHC过程期间所使用的水溶液,并减少所需的试剂的体积。 - 通过覆盖它们用一滴〜250微升PBS在RT几分钟再水合的组织切片。通过覆盖它们与〜250微升在PBS中新鲜制备的3%PFA溶液10至15分钟,固定的组织切片。
注意:任选在这种情况下使用的醛淬火液(50mM氯化铵(NH 4氯,先生53.5克/摩尔)在PBS或0.1M甘氨酸(C 2 H 5 NO 2,先生75.07克/摩尔)在PBS中)停止结合反应。简单和丰富的PBS洗涤一般足以除去未反应的醛。
- 使用的疏水性屏障用笔画出载玻片上的组织周围的疏水性循环。让圈子干在室温约1分钟。周围绘制的T线用细黑永久性标记问题的部分,以及,但在玻璃载片相对的之一,组织切片是侧。
- 抗原修复(可选)
- 放置在一个烧杯中的AR溶液(100毫摩尔Tris(C 4 H 11 NO 3议员,121.14)5%尿素(NH 2 CONH 2,先生60.06),PH值9.6)。 AR的溶液的体积必须足以完全覆盖玻片置于玻璃支架上。
- 预热AR溶液至95℃,通过用温度计监测温度,然后将在合适的机架载玻片,浸没机架在热缓冲器,罩以限制蒸发并孵育10分钟,在95℃。
- 除去从水浴的烧杯中,并离开该玻片在缓冲区中的另一10分钟。
- 冲洗组织切片用PBS(〜250微升/部分),并与溶液饱和他们的3%牛血清白蛋白(BSA,〜250微升/部分)在PBS中至少30分钟,在RT。
- 放30-50微升稀释在含有2%BSA的每个组织切片的PBS第一抗体。
注意:此卷是足以形成一滴完全覆盖组织切片。 - 放置稀释剂(在PBS中的2%的BSA)的相同体积独自上的组织切片来执行无第一抗体的阴性对照。
- 系统包括该阴性对照中的每个IHC实验和用于估计实验的背景的每个第二抗体(非特异性标记由于第二抗体和/或所述组织自发荧光)执行。其他类型的阳性或阴性对照的,也可以进行,以确保标签的特异性(见讨论)。
- 将玻片在加湿箱O / N在4℃下。
注意:使用初级抗体是小鼠单克隆抗细胞角蛋白8(CK8,1:50稀释),鼠单克隆抗细胞角蛋白14(CK14,1:50稀释),兔多克隆抗小鼠酪蛋白(#7781,1:50稀释,慷慨MC内维尔,科罗拉多州卫生大学提供科学中心,CO,USA),兔多克隆抗BTN1(1:300稀释,用IH马瑟,动物和鸟类科学系,美国马里兰大学,学院公园,MD,USA),兔多克隆抗Stx6(慷慨提供1:50的稀释,由S. Tooze,英国癌症研究所,伦敦研究所,伦敦,英国)和兔多克隆抗VAMP4(1:50稀释)慷慨地提供。 - 彻底冲洗组织切片用PBS在室温10分钟的至少四倍。
- 稀释适当的二级抗体(罗丹明缀合的山羊抗兔IgG(H + L),1:300稀释度)在含有2%BSA的PBS,放置30-50微升上的所有组织切片的该溶液,并孵育1.5小时在RT。
- 由于荧光对光敏感的分子,不揭露组织切片光,直到他们的分析。对于IIF上的组织切片,有利于耦合到红色荧光团的二抗自细胞膜倾向于产生一个绿色自发荧光可与低标签干扰。此外,选择红色荧光团偶联的二级抗体允许中性脂质(见下文)的伴随标记。
- 彻底PBS洗涤组织切片至少四次在室温10分钟。
- 对于一些实验中,通过将用2%PFA样品在PBS中稀释,在室温10分钟,在以稳定的抗原/抗体支架进行后固定。但是,这一步骤可以与在大多数情况下,分配。
- 以通过将组织切片形象化限流二极管和MFGS,颜色中性脂质在30-50微升含有BODIPY 493 3微克/ ml的PBS溶液/ 503在室温10分钟。迅速冲洗组织切片两次用PBS。
- 染液用30-50微升含有3微米的DAPI(4-6二脒基-2-苯基吲哚,5毫克/ ml储备溶液)在室温10分钟的PBS溶液核DNA。安装的幻灯片观察之前用PBS洗两次组织切片。
- 除去PBS并放置一滴每个组织切片安装介质。
- 将盖玻片的一侧,在对幻灯片上的角度,使得与液滴外缘接触,然后放下顶盖慢慢地,避免气泡。让液体在载玻片和盖玻片之间流传了几分钟,然后去除多余的安装介质纸巾的。
- 密封盖玻片与指甲油和储存组织切片的载玻片在4℃,以防止其暴露在光线下,直至观察。
4.荧光观察和图像采集
注:配有由图像采集软件控制的摄像头必须遵守的IHC结果的荧光显微镜。
- 获取图像之前,检查标记的强度和通过查看阴性对照评估实验的背景。获得的每一个荧光标记(颜色通道)单独的照片。
- 获得的所有照片,包括那些对应的控制,在用于每个颜色通道的相同条件(曝光和常规设置)。
- 传统的显微镜
- 用装有标准滤波器异硫氰酸荧光素(FITC,绿色),若丹明(红色)和DAPI(蓝色)的排放量的显微镜进行荧光显微镜,×20至×63(油浸,NA 1.3)的目标和一个DP50成像照相机。
- 共聚焦显微镜
- 与MICROS执行共聚焦显微镜型箱搭载用ZEN软件,用×20至×63(油浸,NA 1.4)的目标和激光的488-和568纳米的激发波长。
5.图像处理
注意:所有图像后处理使用ImageJ的自由软件(http://imagej.nih.gov/ij/)执行。
- 叠加图像(合并)
- 打开,将被组合(文件/打开)各信道获得的图像。如果与8位灰度图像时,属性人工颜色使用查找表(图像/查找表)的每个信道。
- 通过使用命令“合并信道”(图像/色彩/合并通道),然后归因一种颜色给每个信道生成的灰度或彩色图像的复合图像。
- 执行图像栈叠加以同样的方式通过打开栈中,将被组合(文件/打开)各信道获取和使用命令“合并通道与#8221; (图片/颜色/合并通道),以属性的颜色给每个通道。复合堆保存为图像序列或电影(参见5.4节)。
- 图像堆栈ž投影
- 使用Z投影函数(图像/堆叠/ Zproject,最多强度)通过投影它们沿轴线垂直于图像平面(z轴),以提供一种图像栈的所有图片的一个二维视图。 “最大强度”选项创建,其中每个像素包含在堆栈中的所有图像的最大值的图像。这将生成一个单一的图像,允许所有通过整个图像堆栈针对特定通道或多个通道的叠加后观察到的染色的可视化。
- 图像堆栈3D投影
- 使用3D投影命令(图像/堆叠/ 3D项目,亮的点,y轴)产生旋转体积的突起的一个序列上的平面。苏的可视化呈现rfaces和内部结构取决于两个投影方法(最接近点,亮的点(这里使用的),或平均值)和所选择的可视化参数。动画序列的每个帧是从不同的视角突出的结果。
- 绕每个所述三个正交轴(y轴这里被选择)的创建的3D图像。除制作成一个图像或电影的序列。
- 图像堆栈电影转换
- 打开图像堆栈(文件/打开),并将其保存为一个电影.AVI格式,使用命令“AVI”(文件/另存为/ AVI)。
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
乳腺是位于沿两个胸部和在啮齿类动物的腹部的腹部结构的皮下腺。五对妊娠期间的小鼠的腺体的位置示于图4。乳腺的形态其发展过程中极大地改变,反映到全泌乳(图1B)制备所需的功能修改。在处女或动物未产妇,乳腺由一个人烟稀少分支导管上皮内嵌入一个薄的脂肪基质可能很难看到。从发病妊娠,乳腺上皮细胞的激增和膨胀,导致更大的乳腺即变得更容易看到和除去(图4)。在哺乳期,乳腺组织更厚,并且由于牛奶的存在似乎更白。只有腹部和腹股沟乳腺收集,因为颈胸乳房格兰DS是不太容易,因为它们与肌肉紧密联系删除。对于一些实验,幼仔可以从哺乳期女性4-6小时,以便限制乳汁分泌MESCs 46,47分离处死前。
乳腺的肌上皮细胞和上皮细胞的鉴定
围绕肺泡收缩肌上皮细胞可以从管腔MESCs通过使用针对由这些细胞类型的特异性表达的标志物的抗体的区别开来。在乳腺中,使用的当前标记是细胞角蛋白(CKS)。 CKS是一个大家族的聚合形成细胞骨架中间纤维(10纳米的直径平均)在上皮组织中发现的胞质蛋白。的中间丝是非常稳定的,并提供用于细胞结构的机械支持,并通过促进细胞 - 细胞粘连及基底细胞结组织的组织组织相互作用。由上皮细胞表达CKS的子集主要取决于上皮的类型,它的发展阶段和其分化状态。此外,这也适用于上皮的恶变。因此,这些标志物是简单的和有价值的工具,以在生理条件下的组织的细胞群鉴定和在外科病理48是用于肿瘤的诊断和表征。
在正常的乳腺,肌上皮和管腔MESCs细胞可以基于CK14和CK8,其差异表达分别(图5)上被区分。这些细胞质标记在哺乳期的小鼠PFA固定和AR后乳腺区段检测。图像被收购与常规落射荧光显微镜。 CK8出现整个管腔MESCs(图5,CK8)的细胞质要分发。需要注意的是红色背景观察d表示阴性对照无第一抗体(图5,-Ig1)主要是由于组织切片折叠,所建议的蓝色DNA标记,其中显示几个层细胞核(图5,-Ig1,核)。 CK14在位于肺泡(图5,CK14)的基件平坦且细长的肌上皮细胞中特异性观察。以识别肌上皮细胞的另一常用方法是检测的α-平滑肌肌动蛋白( 一- SMA)存在于这些收缩细胞(见图4中的49)。
检测鼠标奶制品
分娩后,完全分化MESCs开始生产牛奶丰富的数额。乳组分通过不同的途径40,50分泌。酪蛋白胶团是由高尔基体衍生的SV胞吐分泌,而脂质释放MFGS通过根尖PL的萌芽MESCs的阿斯玛膜(图2,乳腺上皮分泌细胞)。对于一些实验,幼仔从阴4-6小时收集乳腺,为了减缓乳汁分泌46,47之前分离。在这些条件下,MESCs的顶质膜和有管腔的内容可以容易地观察到,这是不哺乳因为肺泡收缩和管腔件闭合期间的情况。此外,减缓分泌也是必不可少的学习参与膜贩运如SNARE蛋白的蛋白质时。事实上,网罗供体和受体车厢和他们的亚细胞定位之间的周期很难确定,因为标签通常扩散膜时,换手率高, 即 ,哺乳期间。因此,通过除去幼仔减慢乳汁分泌提供适当的条件来研究斯耐尔的细胞内定位时,叔和v-SNARE蛋白优先地驻留在施主和受体隔室,分别为(见下文)。
图6示出了在哺乳小鼠乳腺酪蛋白在哺乳10天幼仔的定位,在存在(图6,+ P)或在不存在(图6,-p)。通过常规落射荧光显微镜(右边的三列)和共聚焦显微镜(图6,左柱)的组织切片进行观察两者。期间乳,酪蛋白似乎在心尖区中大多积累(图6,+ P,箭头)。共聚焦显微镜显示,酪蛋白也存在,但在较小的程度上,在幼崽的存在MESCs的基部侧(图6,+ P,箭头),从而无法 在传统的显微镜(图6,酪蛋白可以清楚地观察到,比较左和右小图)。事实上,在宽视场表面荧光,通过将样品(背景fluorescen荧光发射CE)穿过激发体积,并改变在物镜焦平面(失焦荧光)中观察到的物体的分辨率。这对于厚的样品(厚度大于2微米),尤其如此。共聚焦显微镜允许从对萤光制备试样获得高质量的图像,作为景深可以控制和背景荧光排除在焦平面上。另外,在幼崽(图6,+ P)的存在下,肺泡的内腔是相当封闭和MESCs的顶侧是在没有幼崽(图6,-p)的更好地观察,的时候,腔肺泡扩张是由于对奶制品的积累。当乳汁分泌减慢,酪蛋白也出现累积的顶部质膜(图6,-p,箭头)的下方,和在MESCs(图6,-p,箭头)的基侧被清晰地观察到。没有主antib阴性对照ODY没有表现出任何标记(图6,-Ig1)。
乳制品可以容易地通过组合IHC为酪蛋白和限流二极管和MFGS(图7)的中性脂质复染共同检测。组织切片成像为Z型堆通过共聚焦显微镜,这是后处理用ImageJ的产生ž突起或三维凸起的每个(图7,酪蛋白,脂质)或所有颜色通道(图7,合并)。产生的图像序列已被保存为单个图像( 图7和8),或动画(见补充影)。
虽然一些标签上观察到它们的基部侧,酪蛋白大多堆积在MESCs的顶侧(图7,+ P),如已经描述的,当雌以前未从幼仔(图6,+ P)分离。限流二极管也主要定位于MESCs的顶端区域,而更大的秘密编MFGS存在于肺泡的内腔中。注意,酪蛋白和MFGS容易可视化在没有幼崽的肺泡的内腔(图7,比较+ p和-p)。酪蛋白不共定位与限流二极管或MFGS在任何这些条件,因为这两个颜色通道的叠加并不产生黄色标记( 图7中的合并图片)。然而,图像堆栈后处理,显示,酪蛋白包围分泌MFGS在肺泡的管腔,这表明这些蛋白质可与MFG相互作用(图7,合并图片)。注意通过使用的每个后处理所产生的图像的差异(图7,比较Zproj和3D凸出为每个颜色通道)。
检测嗜乳脂蛋白的,MFGS的蛋白质标记。
BTN1是与MFGS牛奶51相关的主要蛋白之一。这跨膜蛋白成为内地是ý定位在MESCs的顶质膜并在其释放通过出芽52后MFG的表面结果发现,图8表明,在泌乳的第10天,BTN1主要定位在顶部质膜,并在其次,在MESCs的顶端区域。 BTN1也包围存在于肺泡的内腔以及一些心尖限流二极管的(图8,3D凸出合并,箭头)的MFGS。结果显示为从获取的图像Z堆叠(图8,图像),或作为与ImageJ的的三维投影命令生成的三维视图中提取单个图像,上述( 图8,3D凸出)所描述。请注意,单个图像可足以观察蛋白质的心尖分布,但BTN1与分泌MFGS或根尖限流二极管仅三维重建的Z堆叠的后观察到的空间关联(图8比较BTN1图像和3D凸出合并PICT数目字)。的Z堆叠也可以重构为一个电影,得到该蛋白质的分布的更好的空间图。单独获得用于BTN1图像Z堆叠(补充电影1和3)或叠加与其他两个颜色通道(合并, 补充电影2和4)被示出为示例。的Z堆叠可以读取图像逐图像从顶部至底部的全图像堆栈的三维投影的(补充的电影1和2)或作为旋转视图(y轴)(补充电影3,4 )。
检测2 SNARE蛋白:Stx6和VAMP4
如前所述,斯耐尔是膜结合蛋白,其供体和受体膜之间循环。因此,有更好的学习时,放慢与MESCs的高分泌活性分开幼崽的雌性膜相关成交收集乳腺前这些蛋白质。 Stx6和VAMP4都被描述为与反式高尔基网络53,54相关联。然而,这些SNARE蛋白也可起到如分泌颗粒(Stx6)55,56和高尔基体(VAMP4)57处的其他细胞区室水平的重要作用。以往的研究表明,SNARE蛋白发挥酪分泌35,36的作用。哺乳期,Stx6和VAMP4位于MESCs的子顶端区域。 Stx6是细胞核和的MECs的顶膜之间观察到,对应于高尔基体和反式高尔基网络(图9,Stx6),并且也存在,但在较小程度上的SV 36含有酪蛋白。 VAMP4也定位于MESCs的子顶端区域,但出现的标记更点状和蓄积根尖质膜的下方(图9,VAMP4)由于其与两个限流二极管和酪蛋白CONTA关联进不去的SV 36。无一抗阴性对照没有产生任何标签。

图1.鼠标在胚胎和成年期乳腺的发育。(A)小鼠乳腺开始发育,从周围的外胚层(浅蓝色)乳线(粉红色)10天胚胎(E10)。在E11.5,placodes对称地形成沿乳房乳线和周围间质(深蓝)开始凝结。所述placodes内陷以形成芽(E12.5-E14.5)和,在E15.5,乳腺上皮细胞(粉红色),增殖和伸长,以形成主萌芽是推动通过向脂肪垫乳腺间质(浅绿)。中空管腔形式和打开以产生乳头(紫色)。上E18.5,乳腺上皮细胞形成rudimenta连接到外部Ry的支化结构。从6改编许可,麦克米伦出 版公司:自然评论遗传学,2007年版权(B)在青春期,乳腺上皮细胞(紫色)进入显著的增长阶段(广泛的延伸,分叉和横向分支)。在出现妊娠,广泛和快速增殖以及侧分支发生,导致相当大的扩张的乳腺上皮细胞,这充分侵入整个乳房脂肪垫。乳腺上皮细胞在哺乳期达到一个高度分化的功能状态,管腔MESCs分泌大量乳汁。当哺乳断奶,乳腺渐开线后停止。 MESCs通过凋亡和吞噬作用除去,导致lobulo肺泡结构是由脂肪组织取代的消失。从http://brisken-lab.epfl.ch/research的方案1和第2.2章改编。 http://tvmouse.ucdavis.edu/bcancercd/22/index.html的。 请点击此处查看该图的放大版本。
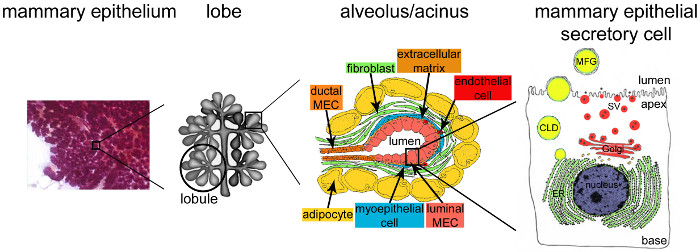
图2.架构哺乳期乳腺,哺乳期间,充分发展和高度支化的上皮细胞(紫色)占乳腺组织的绝大部分。上皮组织是由嵌入在包含多种细胞类型(成纤维细胞,脂肪细胞,平滑肌细胞,血液和淋巴管和神经末梢)一个基质肾小管间蜂窝结构而形成。 MESCs被组织成腺泡结构或肺泡,组装形成叶小叶。每个小孔是连接到一个高度支小叶和小叶间信道的网络中的功能性乳制造单元,从而允许牛奶为d下雨到外部。每个小孔由偏振光MESCs的单层分隔,其中顶侧边界中心腔。该MESCs的基部侧与细胞外基质和收缩肌上皮细胞紧密接触。乳产品被释放MESCs的顶侧。主要牛奶(酪蛋白)分泌的酪蛋白胶束(黑点)由高尔基体分泌型囊泡(SVS)胞吐作用,而脂质由MESCs的根尖质膜出芽释放的牛奶脂肪球(MFGS)。 CLD:细胞质脂滴; ER:内质网; MEC:乳腺上皮细胞。从第2.2章改编。 http://tvmouse.ucdavis.edu/bcancercd/22/index.html,图02 www.cellbiol.net/ste/alpHERCEPTIN1.php,图26-02在58和50。 请点击此处查看该图的放大版本。
.within页=“总是”> 

图3.实验步骤来执行对小鼠乳腺冰冻切片,间接免疫荧光,乳腺是由CD1雌性小鼠收集哺乳期第10天。乳腺组织切成其被包埋于OCT化合物和速冻之前用低聚甲醛固定,并注入在蔗糖小片段。乳腺样品然后,切成薄的冷冻切片中,处理IIF通过连续培养原发性和荧光标记的二抗分别。安装后,将样品用荧光显微镜进行分析,从而允许采集,可以随后进行后处理的图像。/53179/53179fig3large.jpg“目标=”_空白“>点击此处查看该图的放大版本。

图小鼠乳腺腺体4.解剖位置离开:小鼠乳腺系统在妊娠后期阶段腹面。右:定位和乳腺在鼠标妊娠后期阶段的一个方面。需要注意的是哺乳期间,乳腺比较厚,由于牛奶中的肺泡中的存在似乎更白。从http://ctrgenpath.net/static/atlas/mousehistology/Windows/femaleu/mousemammgldiagram.html和http://www.pathbase.net/Necropsy_of_the_Mouse/index.php?file=Chapter_3.html改编。 请点击此处查看该图的放大版本。
-together.within页=“总是”> 
图5.鉴定腔上皮细胞和基底肌上皮细胞在小鼠乳腺。管腔MESCs和肌上皮细胞通过IIF在小鼠乳腺泌乳10天鉴定,基于其的CK-8和CK-14的表达, 分别。核DNA染色用DAPI(蓝色)。图像被收购与常规落射荧光显微镜。复合图像(合并)示出了对应于酪蛋白(红色)和细胞核(蓝色),分别标记的叠加。 -Ig1,无一抗阴性对照。星号表示流明。比例尺= 100微米。 请点击此处查看该图的放大版本。
Ë6“SRC =”/文件/ ftp_upload / 53179 / 53179fig6.jpg“/>
图中的小鼠乳腺酪蛋白6.细胞定位 。通过IIF在小鼠乳腺泌乳10天的酪蛋白进行检测。乳腺从女性收集在存在(+ P)或在幼崽的不存在(-p)。图像被收购与传统的(右图,酪蛋白,核和合并)或共焦(酪蛋白(红色),左图)荧光显微镜。在这两种情况下,酪蛋白(红色)的顶部区域(箭头)和或多或少在MESCs(箭头)的基进行检测。无一抗阴性对照没有显示出任何标签(-Ig1)。核DNA是用DAPI(蓝色)。复合图像(合并)示出了对应于酪蛋白(红色)和细胞核(蓝色),分别标记的叠加。星号表示流明。比例尺= 100微米的落射荧光图像(右图,酪蛋白,核,合并)和= 10µ m代表共聚焦图像(左列) 点击此处查看该图的放大版本。
奶制品在小鼠乳腺图7.细胞定位。酪蛋白(红色)由IIF在小鼠乳腺在泌乳中存在10个天检测到(+ P)或在幼崽的不存在(-p)。中性脂质(限流二极管和MFGS)的counterstained用BODIPY503分之493(绿色)。复合图片(合并)显示两个标号的叠加。图像被获取作为Z型堆用共聚焦显微镜。 Z型堆进行后处理用ImageJ的来产生Z-突起(Zproj)或整个堆栈的三维凸起(y轴)(3D PROJ)在各信道为两个(合并)。星号表示流明。比例尺= 10微米。 请点击此处查看该图的放大版本。

嗜乳脂蛋白和脂质在小鼠乳腺图8.细胞定位。BTN1(红色)通过IIF在没有幼仔的检测在小鼠乳腺泌乳10天。中性脂质(限流二极管和MFGS)和核DNA都counterstained用BODIPY五百〇三分之四百九十三(绿),DAPI(蓝色),分别。获得图像用共聚焦显微镜作为图像的Z堆叠。结果显示为从图像堆栈中取出一个单个图像(图像,BTN1,脂质,细胞核和合并)或后处理用ImageJ的后以生成整个图像堆的三维视图(y轴)(3D凸出,BTN1 ,脂质,细胞核,合并)。复合图片(合并)显示叠加的三个颜色信道。 -Ig1,无一抗阴性对照。星号表示流明。比例尺= 10微米。 请点击此处查看该图的放大版本。

图中的小鼠乳腺。突触6(Stx6)和VAMP4(V4)2 SNARE蛋白9.细胞定位是通过IIF在小鼠乳腺泌乳10天检测。图像取得用常规的(CONV)表面荧光或共焦(LSM)显微镜。该复合图像(合并)示出观察到的每个SNARE蛋白(红色)和用于分别核DNA counterstained用DAPI(假绿色),标记的叠加。 -Ig1,无一抗阴性对照。星号小号表明流明。比例尺= 10微米的共聚焦图片和= 100微米的落射荧光照片。 请点击此处查看该图的放大版本。


表1.免疫组化故障排除指南。

补充电影1.定位嗜乳脂蛋白在小鼠乳腺。BTN1(红色)通过IIF在哺乳10天检测到在小鼠乳腺。获得图像与助 nfocal显微镜作为Z堆栈和后处理用ImageJ的,以产生动画。在Z堆栈从顶部至底部读取。 请点击此处观看该视频。

补充电影2.定位嗜乳脂蛋白和中性脂质在小鼠乳腺。BTN1(红色)通过IIF在哺乳10天检测小鼠乳腺。中性脂质(限流二极管和MFGS)和核DNA都counterstained用BODIPY五百〇三分之四百九十三(绿),DAPI(蓝色),分别。获得图像用共聚焦显微镜作为Z堆叠为每个颜色通道和进行后处理用ImageJ的以产生合成Z堆叠该叠加的三个色彩通道。所得到的复合Z堆叠被从顶部向底部阅读。https://www.jove.com/files/ftp_upload/53179/supvid2.mp4“目标=”_空白“>请点击此处观看该视频。
补充电影3.定位嗜乳脂蛋白在小鼠乳腺。BTN1(红色)通过IIF在哺乳10天检测到在小鼠乳腺。图像被收购与共聚焦显微镜作为Z堆栈和后处理与ImageJ的(3D投影)产生旋转(Y轴)BTN1标签空间视图。 请点击此处观看该视频。

在鼠标MA补充电影4本地化的嗜乳脂蛋白和中性脂肪mmary腺。BTN1(红色)通过IIF在哺乳10天检测到在小鼠乳腺。中性脂质(限流二极管和MFGS)和核DNA都counterstained用BODIPY五百〇三分之四百九十三(绿),DAPI(蓝色),分别。获得图像用共聚焦显微镜作为Z堆叠为每个颜色通道和进行后处理用ImageJ的以产生合成Z堆叠该叠加的三个色彩通道。 ImageJ的(3D投影)进一步用于产生旋转(Y轴)的复合Z堆栈的空间视图。 请点击此处观看该视频。
Subscription Required. Please recommend JoVE to your librarian.
Discussion
IHC是一个相对简单的和直接的实验方法来定位抗原在组织切片,这主要取决于特定的表位 - 抗体相互作用。虽然有大量的协议被用来通过IIF本地化的蛋白质,这些程序的核心是几乎总是相同的。不过,也有可强烈影响的结果,因此,必须为每个单独的IHC研究优化某些关键方面。这种方法的最具挑战性的方面是,以确定最佳的实验条件, 即 ,那些产生用于所感兴趣的抗原的强烈和特定信号。必须考虑为实验设计和优化的变量是:抗原(1)的类型(物种,表达水平,亚细胞定位); (2)表位型(序列,构象,推定的翻译后修饰); (3)样品制备(包埋在石蜡或冰冻切片); (4)定影甲基OD(灌注或浸泡); (5)使用(甲醛,醇或丙酮)的固定剂; (6)中使用的封闭试剂(正常血清,BSA或脱脂乳); (7)在AR步骤; (8)的检测方法(直接或间接); (8)第一抗体的类型(单克隆或多克隆); (9)的第二抗体(物种和标签); (10)counterstains(核和/或其它细胞区室标记);和(11)的安装介质(见表1详情)。固定和阻塞步骤,至少需要的额外因素,例如浓度,pH,温度,培养时间和稀释剂的优化。
第一关键方面涉及组织样本,这是紧密相连的固定方法,这反过来又影响了结果的质量的制备。例如,组织片段可以固定或不之前嵌入。此步骤也可以依赖于所选择的嵌入方法 ,也就是,OCT化合物与石蜡包埋,这本身有时取决于所用的一级抗体。组织固定可以在体内通过灌注麻醉动物用固定剂溶液中进行。这个方法是有用的研究完整的组织时保留抗原,但可能不足以解决感兴趣的组织。在这种情况下,小组织片段(厚度不超过10毫米)可浸入固定液。冷冻组织可通过浸入所述组织在液氮中或异戊烷制备,和扣冷冻强烈建议用于后续检测的翻译后修饰,如磷酸化。然而,石蜡包埋的组织不同,冷冻不足以长期保存的组织由于形成冰晶的细胞内可能改变亚细胞形态。一旦切,冰冻组织切片可以被储存在-80℃下长达1年。在任何情况下,该组织样品的制备,是维护所述组织之间的折衷/蜂窝结构和维护表位的完整性。
因为它改变组织的化学成分,关键是要优化定影条件,以避免这两个不完整的(下音响xation)和过度(overfixation)科幻xation。
的确,underfixation可能通过促进某些抗原的蛋白水解降解降低特定信号。另一方面,overfixation可以通过掩蔽该表位或产生强的非特异性背景改变特异性标记。因此,除了在固定液的选择,其他参数,如培养时间,温度和pH值会影响组织固定。虽然煤灰是用于IHC最常见的固定剂,它不能被认为是一个“通用”的固定剂。 PFA诱导的蛋白质 - 蛋白质和蛋白质 - 核酸交联,因此可以artefactually修改表位(overfixation),然后阻止其RECOgnition由初级抗体。然而,该表位可进一步通过AR技术(见下文)揭露。的PFA也可能不适合于某些抗原的检测中,因为它已经显示从膜到细胞质诱发一些磷酸化蛋白的易位。在这种情况下,煤灰必须由适当的替代的固定剂如醇代替。不像PFA,醇如甲醇或乙醇不遮罩表位,因为它们允许组织固定取代水分子在组织中。这可能导致蛋白质的沉淀,然后阻止抗体/表位相互作用由于构象变化。人们普遍认为,醇不穿透,因此不保留组织形态以及PFA。丙酮是另一替代的固定剂,具有未定影,搭扣冰冻组织切片中工作时这是常用。然而,丙酮是一种强的脱水剂,并可能导致组织中蛋白质的不可逆的沉淀。
对于某些抗原,可能需要的AR的附加步骤,以获得一个很好的信号,主要如果固定剂诱导构象变化或改变的表位(表位的掩蔽)的静电荷。 AR方法旨在扭转这些过程以恢复表位的免疫反应性和其与第一抗体后续交互。 AR方法主要依靠两种方法:(1)蛋白酶诱导抗原活化,也就是说,用酶如蛋白酶K,胰蛋白酶或胃蛋白酶,其裂解该掩蔽的表位肽;和(2)热诱导抗原活化, 即使用微波炉,压力锅,蒸屉,高压灭菌器或水浴。这后一种方法是特别时间,温度,buffer-,和pH敏感的,和的最佳条件,必须根据经验来确定(一个例子是在协议部分提供)。或者,抗体对其抗原的亲和力,可以提高通过改变pH值或该抗体稀释液中的阳离子浓度。
甲透步骤有时需要以获得良好的信号,用于在厚组织切片的细胞内表位,特别是对核抗原染色。这可以以各种方式使用来实现:(1)醇或丙酮作为固定剂;或(2)洗涤剂如Triton,NP-40(在PBS 0.1-0.2%,10分钟),毛地黄皂苷,皂甙或吐温20的PFA固定后(10至30分钟,0.2-0.5%)。但是,洗涤剂的选择取决于检测到的表位的细胞定位。的确,刺激性洗涤剂如Triton-X100,其中溶解细胞膜,适合用于核表位的检测,但可能会导致在一些膜蛋白的提取的信号改变。采用较温和的清洁剂(皂角苷和吐温20)更适合于细胞质的表位的检测。
第二个关键步骤是blockin克非特异性染色的。抗体与其靶表位的结合是通过分子间力(例如,疏水性和离子相互作用,氢键)管辖。因此,与其他蛋白质比其靶抗原伯和/或仲抗体的相互作用可能导致非特异性染色。这产生高荧光背景,从而防止感兴趣的蛋白质的可视化(低信号/噪声比)。封闭试剂降低了非特异性相互作用而不会损害特定抗体/表位相互作用。一个常见的程序包括培养组织切片用热灭活正常人血清或牛血清白蛋白。当使用正常血清,它必须是来自相同物种的作为二次抗体的宿主动物的或从一个不相关的物种。在所有情况下,所选择的封闭试剂,还必须加入到稀释剂的第一和第二抗体。此外,使用的非离子型去污剂如Triton X-100,T吐温20或皂素有助于减少非特异性相互作用。
第三也可能是最重要的参数是第一抗体的选择和优化。显然,最好的选择是一种高品质的抗体以最小的交叉反应性。单克隆抗体通常表现为一个单一的表位的高亲和力和特异性,他们鉴别一种蛋白质家族具有高序列同一性的特定成员的最佳工具。然而,抗体/表位相互作用可能会受到损害,如果目标表位已经失去其天然构象状态或接入到该表位被防止通过与其他蛋白质,翻译后修饰,温度,pH值,固定和盐浓度的相互作用时。在这样的情况下,多克隆抗体是更合适的,因为它们识别相同蛋白质的多个表位。此外,它们往往比在宽范围的pH和盐浓度的单克隆抗体更稳定。初步研究已定义适当的培养条件, 即工作稀释度(单克隆抗体:5-25毫克/毫升,多克隆抗体:1.7-15毫克/毫升),温育时间,稀释剂和温度,这必须要为凭经验确定每一级抗体。这些参数必须被优化,以确定该生产具有低背景噪声的最佳的信号的条件。标记的特异性由较长的温育时间在较低温度下有利(即,4℃对RT)下。
执行直接或间接检测的选择常常取决于抗原的表达水平。例如,高表达表位可简单地用荧光标记的第一抗体检测,从而允许快速且简单的多色染色,同时避免可能的非特异性背景由于使用一个二级抗体。但是,直接在有可能产生在较高成本的低信号,并且可以发ometimes是困难的,当标记的抗体无法购得。相反地,IIF更灵敏,以检测下表达的表位所产生的信号是更加激烈,由于在至少两个标记的第二抗体的相互作用(提出对第一抗体宿主物种)与第一抗体(扩增)。此外,大范围缀合到各种荧光团次级抗体是市售的,相对便宜的,和质量控制。然而,这种方法可诱导交叉反应性,因此需要谨慎地选择在不同的同种型的同种或执行多个标记实验时不产生初级抗体。 IIF有时也需要额外的阻挡步骤,并且必须包括有系统的阴性对照(见下文)。扩增可以通过使用生物素缀合的二级抗体进一步实现和荧光标记的抗生物素蛋白或链霉(4生物素每莫绑定lecule)。尽管如此,这种扩增方法需要额外的步骤,以防止非特异性结合,并可能不适合于某些组织(肝脏,肾脏,心脏,脑,肺和哺乳期乳腺)由于高水平的内源生物素的存在下的染色。然而,内源性生物素可以通过预温育抗生物素蛋白样品,随后用孵化与第一抗体的生物素之前被阻止。共轭荧光,这是小的化学分子与属性时由光波长较短的激发而发光的选择,主要是取决于显微镜设备可用的类型。
当适当地设计限制所使用的荧光染料的光谱特性之间的抗体和交叉点之间的两个交叉反应性,免疫荧光为基础的IHC允许多个细胞靶同时可视化。
最后的关键关于IHC实验点是必须执行,支持染色的有效性,以确定实验的文物和结果的准确解释的阳性和阴性对照。一些组织中显示出高荧光背景(称为自体荧光),可能导致的结果的曲解。因此,组织切片同时具有荧光和明视场照明下开始IHC实验前要进行观察。阴性对照,省略了第一抗体必须系统包括在每个IHC实验以确保一个潜在的非特异性的二级抗体的结合是微不足道的,并且不模糊或类似特异性染色图案。可以与单克隆初级抗体由具有相同同种型的非免疫抗体代替它工作时要进行的同种型对照(例如,IgG1的,IgG2a的,IgG2b的,IgM型)在相同浓度。这种控制有助于EStimate的非特异性染色,这可能是由于抗体与样品的相互作用。在4℃下:(1摩尔比10),O / N:为了证明特定抗体对其抗原的结合,吸收控制,可通过两种方式来实现由预孵育初级抗体(1)与它的可溶性免疫原;和(2)与细胞或组织切片表达感兴趣的表位,但来自所研究的组织上不同(例如,参见图4B中的59)。在这两种情况下,第一抗体的结果耗尽应该导致很少或没有染色。可以做到的另一种类型的控制的使用无关的初级抗体, 即 ,针对该显示出细胞定位是从所关注的表位不同(核与细胞质)的表位。的无关抗体必须是相同的同种型和物种作为关注第一抗体。对于IHC实验额外的控制可以包括使用样本的TISS的UE已知表达(转基因动物)或否(敲除动物)感兴趣的表位。这可以提供一个有益的参考和帮助优化IHC程序。
中频技术的主要限制是,它们只能被应用到固定的(死)和/或透化细胞,既过程潜在地诱导工件。这种方法的其它限制是由于使用显微镜用于观察的样品。首先,作为落射荧光和共焦显微镜的光学分辨率是有限的,所检测的蛋白质的位置或协同定位不应过度地解释。其次,漂白, 即 。随着时间的推移的荧光强度的衰落当暴露于光,基本上是由于产生活性氧时荧光激发样品,反过来,导致荧光团的光化学破坏。漂白可以通过减少:1)保持从受保护的样品中频实验和存储,直到他们的观察过程中的光; b)使用一种抗褪色剂(活性氧清除剂)在所述安装平台; c)降低的强度和/或激发光的持续时间;四)增加荧光团的浓度或使用带有高量子效率荧光染料的低浓度;和e)利用强大的荧光是不容易漂白( 即 Alexa的荧光剂,濑荧光染料,或DyLightFluors)。第三,自体荧光常常是由于黄素辅酶(FAD和FMN:吸收,450纳米;发射,515纳米)的存在和还原的吡啶核苷酸(NADH:吸收,340纳米;发射,460纳米)在哺乳动物细胞中。此外,使用的醛,特别是戊二醛,对固定的样品中,可能会导致高浓度的自体荧光的。这可通过洗涤含0.1%的硼氢化钠之前,抗体孵育样品在PBS被最小化和/或通过选择的探针和是m光学滤波器aximize相对于自身荧光的荧光信号。第四,荧光重叠(也称为渗出通过,交叉或串话),主要是由于该荧光团的发射光谱特性,因为它们通常表现出非常宽的带宽,不同的,不对称的光谱曲线,以及各种峰值发射波长和的数最大值。的另一荧光团与几个荧光团(多色标签)中工作时,其特征是由一个荧光团中的信道(过滤器)发射的荧光出现重叠。渗出通过工件必须被最小化,因为它们往往复杂化的IF结果的解释,特别是在共定位或定量研究的情况下。作为荧光团发射的平衡只能略微由IF过程的改善,渗出通过主要可以在图像获取的时间通过使用优化的荧光滤波器集和/或光电倍增检测器,以便适当组合通道减少吃了荧光的光谱曲线。在这方面,共聚焦显微镜是非常适合于多色成像,因为它允许个别荧光团的分化荧光发射光谱由每个信号导向一个特定检测通道。此外,共焦显微镜允许调整增益,光电倍增电压,或激光功率的各检测通道的标签的顺序采集(只有一个荧光团在一个时间)。理想的情况下,单标签控制必须执行量化渗出通过,并最终计算上卸下。没有第二抗体的对照(背景对照),可以制备以设置的信号增益的限制,并且每个通道以获得最佳图像获取的偏移。它也可以用于采集后处理,以正确的图像背景(自发荧光)。
总之,所描述的方法提供了容易realizati一个简单的标准协议免疫组化上对乳腺部分。尽管如此,在IHC实验的主要步骤必须为每个抗原/抗体夫妇以显现特异性染色,并尽量减少非特异性背景信号进行了优化。所描述的方法还包括几个基本方法的后处理的大部分获得的图像。基于荧光的免疫检测是一个功能强大的方法具有广泛的从一个抗原诊断的细胞定位的应用程序。在这些方法的新进展将与新的荧光团,采集设备和显微技术未来的发展来实现,图像生物结构和过程以前没有观察到的细节。
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
作者宣称,他们有没有竞争的财务权益。
Acknowledgments
作者感谢INRA MIMA2成像核心设施(INRA,UMR1198,茹伊-EN-Josas),并于IERP单位的工作人员(UE 0907,INRA,茹伊-EN-Josas)动物保健和设施。我们还要感谢IH马瑟,MC内维尔和S. Tooze为我们提供了非常有用的antibodie。
Materials
| Name | Company | Catalog Number | Comments |
| Dissection | |||
| Pins | |||
| Ethanol | |||
| Scissors | |||
| Scalpel and adapted blades | |||
| Ice | |||
| Towel paper | |||
| Tissue sample preparation | Company | Catalog Number | Comments/Description |
| Phosphate Buffered Saline (pH7.4) | Sigma | P-3813 | |
| Paraformaldehyde (PFA, 32% EM grade, 100 ml) | Electron Microscopy Sciences | 15714-S | personnal protection equipment required WARNING: this product will expose you to Formaldehyde Gas, a chemical known to cause cancer |
| OCT compound/Tissue Tek | Sakura | 4583 | |
| Sucrose (D-saccharose) | VWR | 27480.294 | |
| Plastic molds | Dominique Dutscher | 39910 | |
| Liquid nitrogen | |||
| Cryostat/sample support | Leica | CM3050S | |
| Razor blades (SEC35) | Thermo Scientific | 152200 | |
| Slide box | |||
| Glass slides Superfrost/Superfrost Ultra Plus | Thermo Scientific | 10143560W90/1014356190 | |
| Brushes | |||
| IHC | Company | Catalog Number | Comments/Description |
| Super Pap Pen | Sigma | Z377821-1EA | |
| Permanent marker (black) | |||
| 50 mM NH4Cl in PBS | Sigma | A-0171 | |
| 0.1 M glycine in PBS | VWR | 24403.367 | |
| Antigen Retrieval solution: Tris 100 mM 5% urea pH9.6 | |||
| Heater (up to 100°C) | |||
| Bovine Serum Albumin (BSA) | Sigma | A7906-100G | |
| Vectashield (anti-fading mounting medium) without DAPI/with DAPI | Vector Laboratories | H-1000/H-1200 | |
| Glass coverslips 22x50mm (microscopy grade) | VWR | CORN2980-225 | |
| Nail polish | |||
| Primary antibodies | Company | Catalog Number | Comments/Description |
| Rabbit anti-mouse caseins (#7781; 1:50 dilution) | generously gifted by M.C. Neville (University of Colorado Health Sciences Center, USA) |
||
| Mouse anti-cytokeratin 8 (CK8, clone 1E8, 1:50 dilution) | Biolegend (Covance) | MMS-162P | |
| Mouse anti-cytokeratin 14 (CK14, cloneLL002, 1:50 dilution) | Thermo Scientific | MS-115-P0/P1 | |
| Rabbit anti-butyrophilin (1:300 dilution) | generously gifted by I.H. Mather (Department of Animal and Avian Sciences University of Maryland College Park, USA) | ||
| Rabbit anti-Stx6 (1:50 dilution) | generously gifted S. Tooze (Cancer Research UK, London Research Institute, London, UK) |
||
| Rabbit anti-VAMP4 (1:50 dilution) | Abcam | ab3348 | |
| Secondary antibodies | Company | Catalog Number | Comments/Description |
| Rhodamine-conjugated goat anti-rabbit IgG (H + L) (1:300 dilution) | Jackson ImmunoResearch Laboratories | 111-025-003 | |
| Counterstains | Company | Catalog Number | Comments/Description |
| Bodipy 493/503 | Life Technologies (Molecular Probes) | D-3922 | |
| DAPI (4-6-diamidino-2-phenylindole) | Life Technologies (Molecular Probes) | D-1306 | |
| Observation/Image capture | Company | Catalog Number | Comments/Description |
| conventional fluorescence microscope | Leica Leitz DMRB microscope |
Standard filters for FITC, Rhodamine and DAPI emissions, ×63 oil-immersion objective (NA 1.3), DP50 imaging camera (Olympus), CellˆF software (Olympus) |
|
| Laser Scanning Microscope (confocal microscopy) | Zeiss LSM 510 microscope |
Plan-Apochromat ×63 oil-immersion objective (NA 1.4), CLSM 510 software, Confocal facilities, MIMA2 Platform, INRA Jouy-en-Josas, France, http://mima2.jouy.inra.fr/mima2) | |
| Image treatment | Company | Catalog Number | Comments/Description |
| ImageJ 1.49k software | Free software |
References
- Watson, C. J., Khaled, W. T. Mammary development in the embryo and adult: a journey of morphogenesis and commitment. Development. , 135-995 (2008).
- Smith, G. H. Experimental mammary epithelial morphogenesis in an in vivo model: evidence for distinct cellular progenitors of the ductal and lobular phenotype. Breast Cancer Res Treat. 39, 21-31 (1996).
- Van Keymeulen, A., et al. Distinct stem cells contribute to mammary gland development and maintenance. Nature. 479, 189-193 (2011).
- Oakes, S. R., Gallego-Ortega, D., Ormandy, C. J. The mammary cellular hierarchy and breast cancer. Cell Mol Life Sci. 71, 4301-4324 (2014).
- Visvader, J. E., Stingl, J. Mammary stem cells and the differentiation hierarchy: current status and perspectives. Genes & development. 28, 1143-1158 (2014).
- Robinson, G. W. Cooperation of signalling pathways in embryonic mammary gland development. Nat Rev Genet. 8, 963-972 (2007).
- Cowin, P., Wysolmerski, J. Molecular mechanisms guiding embryonic mammary gland development. Cold Spring Harb Perspect Biol. 2, a003251 (2010).
- Brisken, C., O'Malley, B. Hormone action in the mammary gland. Cold Spring Harb Perspect Biol. 2, a003178 (2010).
- Gjorevski, N., Nelson, C. M. Integrated morphodynamic signalling of the mammary gland. Nat Rev Mol Cell Biol. 12, 581-593 (2011).
- Daniel, C. W., Smith, G. H. The mammary gland: a model for development. J Mammary Gland Biol Neoplasia. 4, 3-8 (1999).
- Howlett, A. R., Bissell, M. J. The influence of tissue microenvironment (stroma and extracellular matrix) on the development and function of mammary epithelium. Epithelial Cell Biol. 2, 79-89 (1993).
- Edwards, G., Streuli, C. Signalling in extracellular-matrix-mediated control of epithelial cell phenotype. Biochem Soc Trans. 23, 464-468 (1995).
- Hennighausen, L., Robinson, G. W. Think globally, act locally: the making of a mouse mammary gland. Genes & development. 12, 449-455 (1998).
- Topper, Y. J., Freeman, C. S. Multiple hormone interactions in the developmental biology of the mammary gland. Physiol Rev. 60, 1049-1106 (1980).
- Brisken, C., et al. A paracrine role for the epithelial progesterone receptor in mammary gland development. Proc Natl Acad Sci U S A. 95, 5076-5081 (1998).
- Ormandy, C. J., Binart, N., Kelly, P. A. Mammary gland development in prolactin receptor knockout mice. J Mammary Gland Biol Neoplasia. 2, 355-364 (1997).
- Oakes, S. R., Rogers, R. L., Naylor, M. J., Ormandy, C. J. Prolactin regulation of mammary gland development. J Mammary Gland Biol Neoplasia. 13, 13-28 (2008).
- Hennighausen, L., Robinson, G. W. Information networks in the mammary gland. Nat Rev Mol Cell Biol. 6, 715-725 (2005).
- Kouros-Mehr, H., Werb, Z. Candidate regulators of mammary branching morphogenesis identified by genome-wide transcript analysis. Dev Dyn. 235, 3404-3412 (2006).
- Khaled, W. T., et al. The IL-4/IL-13/Stat6 signalling pathway promotes luminal mammary epithelial cell development. Development. 134, 2739-2750 (2007).
- Asselin-Labat, M. L., et al. Gata-3 is an essential regulator of mammary-gland morphogenesis and luminal-cell differentiation. Nat Cell Biol. 9, 201-209 (2007).
- Barcellos-Hoff, M. H., Aggeler, J., Ram, T. G., Bissell, M. J. Functional differentiation and alveolar morphogenesis of primary mammary cultures on reconstituted basement membrane. Development. 105, 223-235 (1989).
- Robinson, G. W., McKnight, R. A., Smith, G. H., Hennighausen, L. Mammary epithelial cells undergo secretory differentiation in cycling virgins but require pregnancy for the establishment of terminal differentiation. Development. 121, 2079-2090 (1995).
- Streuli, C. H., Bissell, M. J. Mammary epithelial cells, extracellular matrix, and gene expression. Cancer Treat Res. 53, 365-381 (1991).
- Streuli, C. H., et al. Laminin mediates tissue-specific gene expression in mammary epithelia. J Cell Biol. 129, 591-603 (1995).
- Boudreau, N., Sympson, C. J., Werb, Z., Bissell, M. J. Suppression of ICE and apoptosis in mammary epithelial cells by extracellular matrix. Science. 267, 891-893 (1995).
- Pullan, S., et al. Requirement of basement membrane for the suppression of programmed cell death in mammary epithelium. J Cell Sci. 109 (Pt 3), 631-642 (1996).
- Schmidhauser, C., Bissell, M. J., Myers, C. A., Casperson, G. F. Extracellular matrix and hormones transcriptionally regulate bovine beta-casein 5' sequences in stably transfected mouse mammary cells. Proc Natl Acad Sci U S A. 87, 9118-9122 (1990).
- Streuli, C. H., et al. Stat5 as a target for regulation by extracellular matrix. J Biol Chem. 270, 21639-21644 (1995).
- Sollner, T., et al. SNAP receptors implicated in vesicle targeting and fusion. Nature. 362, 318-324 (1993).
- Jahn, R., Scheller, R. H. SNAREs--engines for membrane fusion. Nat Rev Mol Cell Biol. 7, 631-643 (2006).
- Weber, T., et al. SNAREpins: minimal machinery for membrane fusion. Cell. 92, 759-772 (1998).
- Sollner, T., Bennett, M. K., Whiteheart, S. W., Scheller, R. H., Rothman, J. E. A protein assembly-disassembly pathway in vitro that may correspond to sequential steps of synaptic vesicle docking, activation, and fusion. Cell. 75, 409-418 (1993).
- McNew, J. A. Regulation of SNARE-mediated membrane fusion during exocytosis. Chem Rev. 108, 1669-1686 (2008).
- Wang, C. C., et al. VAMP8/endobrevin as a general vesicular SNARE for regulated exocytosis of the exocrine system. Mol Biol Cell. 18, 1056-1063 (2007).
- Chat, S., et al. Characterisation of the potential SNARE proteins relevant to milk product release by mouse mammary epithelial cells. Eur J Cell Biol. 90, 401-413 (2011).
- Reinhardt, T. A., Lippolis, J. D. Bovine milk fat globule membrane proteome. J Dairy Res. 73, 406-416 (2006).
- Robenek, H., et al. Butyrophilin controls milk fat globule secretion. Proc Natl Acad Sci U S A. 103, 10385-10390 (2006).
- Fujimoto, T., Ohsaki, Y., Cheng, J., Suzuki, M., Shinohara, Y. Lipid droplets: a classic organelle with new outfits. Histochem Cell Biol. 130, 263-279 (2008).
- Mather, I. H., Keenan, T. W. Origin and secretion of milk lipids. J Mammary Gland Biol Neoplasia. 3, 259-273 (1998).
- Heid, H. W., Keenan, T. W. Intracellular origin and secretion of milk fat globules. Eur J Cell Biol. 84, 245-258 (2005).
- McManaman, J. L., Russell, T. D., Schaack, J., Orlicky, D. J., Robenek, H. Molecular determinants of milk lipid secretion. J Mammary Gland Biol Neoplasia. 12, 259-268 (2007).
- de Assis, S., Warri, A., Cruz, M. I., Hilakivi-Clarke, L. Changes in mammary gland morphology and breast cancer risk in rats. Journal of visualized experiments : JoVE. , (2010).
- Plante, I., Stewart, M. K., Laird, D. W. Evaluation of mammary gland development and function in mouse models. Journal of visualized experiments : JoVE. , (2011).
- Galio, L., et al. MicroRNA in the ovine mammary gland during early pregnancy: spatial and temporal expression of miR-21, miR-205, and miR-200. Physiol Genomics. 45, 151-161 (2013).
- Linzell, J. L., Peaker, M. The effects of oxytocin and milk removal on milk secretion in the goat. J Physiol. 216, 717-734 (1971).
- Knight, C. H., Peaker, M., Wilde, C. J. Local control of mammary development and function. Rev Reprod. 3, 104-112 (1998).
- Walid, M. S., Osborne, T. J., Robinson, J. S. Primary brain sarcoma or metastatic carcinoma? Indian J Cancer. 46, 174-175 (2009).
- Hue-Beauvais, C., et al. Localisation of caveolin in mammary tissue depends on cell type. Cell Tissue Res. 328, 521-536 (2007).
- McManaman, J. L., Neville, M. C. Mammary physiology and milk secretion. Adv Drug Deliv Rev. 55, 629-641 (2003).
- Mather, I. H., Jack, L. J. A review of the molecular and cellular biology of butyrophilin, the major protein of bovine milk fat globule membrane. J Dairy Sci. 76, 3832-3850 (1993).
- Heid, H. W., Winter, S., Bruder, G., Keenan, T. W., Jarasch, E. D. Butyrophilin, an apical plasma membrane-associated glycoprotein characteristic of lactating mammary glands of diverse species. Biochim Biophys Acta. 728, 228-238 (1983).
- Bock, J. B., Klumperman, J., Davanger, S., Scheller, R. H. Syntaxin 6 functions in trans-Golgi network vesicle trafficking. Mol Biol Cell. 8, 1261-1271 (1997).
- Tran, T. H., Zeng, Q., Hong, W. VAMP4 cycles from the cell surface to the trans-Golgi network via sorting and recycling endosomes. J Cell Sci. 120, 1028-1041 (2007).
- Wendler, F., Page, L., Urbe, S., Tooze, S. A. Homotypic fusion of immature secretory granules during maturation requires syntaxin 6. Mol Biol Cell. 12, 1699-1709 (2001).
- Wendler, F., Tooze, S. Syntaxin 6: the promiscuous behaviour of a SNARE protein. Traffic. 2, 606-611 (2001).
- Shitara, A., et al. VAMP4 is required to maintain the ribbon structure of the Golgi apparatus. Mol Cell Biochem. 380, 11-21 (2013).
- Thibault, C., Levasseur, M. C. La reproduction chez les mammifères et l'homme. , INRA Editions. 928 (2001).
- Truchet, S., Wietzerbin, J., Debey, P. Mouse oocytes and preimplantation embryos bear the two sub-units of interferon-gamma receptor. Mol Reprod Dev. 60, 319-330 (2001).



