Summary
Den indirekte immunofluorescens protokollen beskrevet i denne artikel giver mulighed for påvisning og lokalisering af proteiner i musen brystkirtel. En komplet fremgangsmåde er givet til at fremstille brystkirtel prøver, til at udføre immunohistokemi til afbildning af vævssnit ved hjælp af fluorescensmikroskopi, og at rekonstruere billederne.
Abstract
Indirekte immunofluorescens bruges til at detektere og lokalisere proteiner af interesse i et væv. Protokollen præsenteres her beskriver en fuldstændig og enkel fremgangsmåde til immunpåvisning af proteiner, idet musen diegivende brystkirtel taget som et eksempel. En protokol til fremstilling af vævsprøverne, især med hensyn til dissektion af musen brystkirtel, vævsfiksering og frosne væv sektionering, er detaljerede. En standardprotokol til at udføre indirekte immunfluorescens med et valgfrit antigen hentning trin, præsenteres også. Observationen af de mærkede vævssnit samt billedoptagelse og post-behandlinger er også angivet. Denne procedure giver en fuld oversigt, fra indsamling af dyrevæv til cellulære lokalisering af et protein. Selv om denne generelle fremgangsmåde kan anvendes på andre vævsprøver, skal den tilpasses hvert væv / primært antistof par undersøgt.
Introduction
Mælkekirtlen er en atypisk pattedyr exokrin orgel, hvis vigtigste funktion er at producere mælk til foder nyfødte. Udviklingen af brystvæv forekommer hovedsageligt efter fødslen og er kendetegnet ved en unik fremgangsmåde, hvor epitel invaderer omgivende stroma. Dette væv undergår mange ændringer (vækst, differentiering og regression), især i løbet af voksenlivet, samtidig med variationer i reproduktiv status (figur 1). Ud over den samlede morfologi af vævet, andelene af forskellige celletyper samt deres arrangement inden mælkekirtlen dramatisk ændre under udviklingen 1-5.
Under fosterstadiet, brystepiteliet stammer fra brystkirtler mælkeledninger, der defineres ved en svag fortykkelse og lagdeling af ektoderm, mellem for- og bagben på hver side af midterlinjen omkring embryonale dag 10.5 (E10.5) (figur 1A ).På E11.5, mælkeledningen bryder op i individuelle placodes, som er symmetrisk placeret langs bryst-mælkeledning på reproducerbare steder, og den omgivende mesenkym begynder at kondensere. De placodes begynder at synke dybere ind i dermis og brystkirtler mesenchyme organiserer i koncentriske lag omkring mamma opløbet (E12.5-E14.5). Pr E15.5, brystepiteliet, begynder at proliferere og langstrakte for at danne den primære spire, der skubber gennem mamma mesenkym mod fedtpuden. Den primære spire udvikler et hult lumen med en åbning til huden, kendetegnet ved dannelsen af brystvorten kappe. På E18.5, har forlængede kanal vokset til fedtpuden og har forgrenet i en lille arborized gangsystemet omfattet i fedtpuden. Udvikling er hovedsagelig anholdt og den rudimentære brystkirtel forbliver morphogenetically hvile indtil puberteten. I den mandlige foster, aktiveringen af androgen receptorer fører til degeneration af knopper, der forsvinderved E15.5. Pr E18, mammary udvikling ophører indtil puberteten 6-9.
Ved fødslen, brystkirtlen huser en rudimentær gangsystemet, der forlænger og grene langsomt (isometrisk vækst). Ved starten af puberteten, sfæriske strukturer placeret ved spidserne af kanalerne kaldes afslutningsenden knopper (TEBS), er dannet af et ydre lag af cap celler og et flerlaget indre kerne af celler (kropsceller). Disse strukturer er meget proliferativ og infiltrere det omgivende stromavæv som reaktion på hormonale signaler. Spredning i TEBS resulterer i duktalt forlængelse, kombineret med forgrening morfogenese. Denne proces fører til etablering af en grundlæggende epitelial arborized netværk stammer fra brystvorten (figur 1B, pubertet). På ~ 10-12 uger efter fødslen, når epitel har invaderet hele fedtpude, dens ekspansion stopper og TEBS forsvinde. Ductal udvikling gennemgår derefter dynamiske ændringer, dvs. successive spredning og regression af epitelceller ifølge Østralperioder 10 (figur 1B, voksne).
Fra starten af svangerskabet, brystvævet undergår vigtige vækst og morfologiske ændringer for at forberede amning. Brystepiteliet udførligt formering og differentiering, hvilket fører til en stærkt forgrenet tubulo-alveolær netværk. Samtidig hermed mammaepitelceller (MEC'er) bliver polariseret og i stand til at syntetisere og udskille mejeriprodukter. MEC'er organiserer i talrige alveolære strukturer (acini), der er omgivet af kontraktile myoepitelcellerne og indarbejdet i et stroma består af bindevæv og fedtvæv, blodkar og nerveender (figur 1B, graviditet). Desuden den basale side af MEC'er er i tæt kontakt med basalmembranen (ekstracellulær matrix), og samspillet mellem disse to enheder streng regulering både morfogenese og sekretorisk funktion af mammary epitel 11-13.
Alle disse processer er afhængige af virkningen af forskellige miljømæssige tidskoder, hvoraf er de vigtigste hormones14, parakrine faktorer og den ekstracellulære matrix. For eksempel progesteron fremkalder omfattende side-forgrening 15 og alveologenesis, at der i kombination med prolactin (PRL) 16,17, fremmer og opretholder differentieringen af alveolerne. Ud over steroider og PRL18, cytokiner og signalveje i forbindelse med udvikling (Wnt og Notch signalveje) er også involveret i brystkirtler slægt engagement og udvikling 19-21. Ved slutningen af graviditeten, begynder de luminale MEC'er til frembringelse af et protein-rige mælk kendt som colostrum i lumen af alveolerne. Desuden progesteron virker på epitel permeabilitet og da tight junctions stadig er åbne, er colostrum også fundet i moderens blod stream.
Efter fødslen, det Mammary epitel optager næsten alle mælkekirtlen volumen og er stærkt organiseret (figur 2, brystepiteliet). Mælkeproducerende enheder, nemlig alveolerne (Figur 2, alveoler), er dannet af et monolag af polariserede brystepitelceller sekretoriske celler (MESCs), med deres apikale plasmamembran afgrænser hulrummet. Alveoler arrangere sig i lobules der er inddelt i lapper tilsluttet kanaler, der dræner mælken til ydersiden miljø (figur 2, lap). Amning opstår, dvs.., MESCs begynder at udskille rigelige mængder mælk, primært udløst af faldet i placenta hormoner (hovedsagelig progesteron) (figur 1B, amning). Milk-gener aktiveres i en defineret tidsmæssig tidsforløb i området fra graviditet til amning 9,22,23, hovedsageligt som svar på hypofyse PRL frigives på tidspunktet for diegivning. Samtidigt, kontakter mellem MESCs og den ekstracellulære matrix både stimulere mælkeprotein Synthesis gennem signaler, der medieres via samspillet mellem cellulære integriner og laminin 24,25, og undertrykker apoptose i MESCs 26,27. Disse signalveje resulterer i aktiveringen af mælkeprotein genpromotorer 28 gennem aktivering af specifikke transkriptionsfaktorer 29. Celle-celle kontakter er også vigtigt for nogle aspekter af differentiering, herunder etablering af apikale polaritet og vektorielle sekretion af mejeriprodukter. Tætte forbindelser hurtigt tæt efter begyndelsen af laktationen og MESCs fint orkestrere optagelsen af molekyler fra blodet samt syntese, transport og udskillelse af mælkebestanddele, som svar på de ernæringsmæssige krav hos nyfødte. På tidspunktet for diende, sammentrækning af myoepitelcellerne omgiver alveolerne sker som reaktion på oxytocin og fører til mælkenedlægningen gennem kanalerne og ind i brystvorten. Mælk er en kompleks væske, der indeholder proteiner (for det mestekaseiner), sukkerarter (hovedsagelig lactose), lipider og mineraler, samt bioaktive molekyler, såsom immunoglobuliner A (IgA), vækstfaktorer og hormoner. Kaseiner syntetiseres, samles i supramolekylære strukturer, nemlig caseinmiceller, transporteres langs den sekretoriske pathway, og derefter frigives ved exocytose, dvs. sammensmeltning af kasein-holdige sekretoriske vesikler (SV'er) med den apikale plasmamembran Mesc (figur 2).
Intracellulær trafik afhængig af materielle udvekslinger mellem hindeagtige rum og involverer Opløselige N-ethylmaleimid-Sensitive Fusion (NSF) Attachment Protein (SNAP) receptor (SNARE) 30,31. Snare proteiner familie er opdelt i vesikuløse Snares (v-Snares), der er til stede i vesikelmembranen og target snarer (t-Snares), lokaliseret på målet membraner. Ved zipping gennem deres dobbeltsnoet domæner, V- og T-snarer samles for at danne en meget stabil fire-helix bundt kompleks, benævnt the SNARE kompleks. Dette kompleks fremmer fusion af to modstående lipiddobbeltlag ved gradvist at bringe dem i tæt nærhed 30,32. Bagefter er SNARE komplekser dissocieret af NSF adenosintriphosphatase og dens adapter protein SNAP og SNARE proteiner recirkuleres tilbage til deres rum oprindelsesland 33. Interessant, hver SNARE protein overvejende er bosat i forskellige cellulære rum og SNARE parring kan bidrage til specificiteten af intracellulære fusion begivenheder 34. Tidligere undersøgelser tyder på, at mindst Synaptosomal-associeret protein 23 (SNAP23) og vesikelassocieret membranprotein 8 (VAMP8), og syntaxins (Stx) -7 og -12 spille en rolle i casein exocytose 35,36. Disse proteiner er også blevet fundet i forbindelse med lipidfraktion mælk, dvs. mælk fedtkugler (MFGs) 37. Den nuværende fremherskende model postulerer, at cytoplasmatiske lipiddråber (CLDs) dannes ved akkumulering af neutrale lipids (hovedsagelig triglycerider og sterolestere) og cholesterol afledt af moderens kost mellem de to foldere af det endoplasmatiske reticulum (ER) membran 38-41. Dannes store CLDs, i det mindste delvist, ved fusion af mindre CLDs medens de transporteres til den apikale side af MESCs hvor de er udgivet som MFGs (1-10 um i diameter) ved knopskydning, idet enwrapped af Mesc apikale plasmamembran 40-42. Amning ophører efter hvalpe er vænnet og MESCs gradvist dø ved apoptose, hvilket fører til regression af brystvævet tilbage til en pubertetsudvikling tilstand (figur 1B, involution).
Immunofluorescens (IF) er en fælles analyselaboratorium metode, der anvendes i næsten alle aspekter af biologi, både i forskning og i klinisk diagnostik. HVIS teknikker kan udføres på vævssnit (immunhistokemi, IHC) eller celle (immuncytokemi ICC) prøver. Denne kraftfulde tilgang er baseret på anvendelsen af fluorescent-mærkede antistoffer, der specifikt binder (direkte eller indirekte) til antigenet af interesse, hvilket tillader visualisering af dens vævsfordeling ved fluorescensmikroskopi. Fluorescenssignaler meste afhænger af kvaliteten og koncentration af antistofferne og korrekt håndtering af prøven. En simpel indirekte immunofluorescens (IIF) protokol præsenteres til påvisning af mejeriprodukter (kaseiner og MFGs) og proteiner involveret i mejeriprodukt sekretion (butyrophilin (BTN1), snare proteiner) på frosne snit af muse brystvæv (figur 3). Mens denne protokol giver et komplet IHC oversigt, der spænder fra væv samling til billedet efter behandling, kritisk og valgfrie trin samt nogle tekniske anbefalinger er også præsenteret og diskuteret.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
CD1 mus blev avlet på INRA (UE0907 IERP, Jouy-en-Josas, Frankrig). Alle etiske aspekter af pasning af dyr i overensstemmelse med de relevante retningslinjer og licenskrav, der er fastsat af det franske landbrugsministerium. De anvendte procedurer blev godkendt af den lokale etiske komité (aftale 12/097 fra Comethea Jouy-en-Josas / AgroParisTech).
1. brystkirtel Prøvefremstilling
- Mus brystkirtel dissektion
- Aflive mus på dag 10 af amning ved cervikal dislokation og pin dyret ned med sin mave opad.
- Fugt ventrale område med ethanol og tør den med et stykke køkkenrulle.
- Ved hjælp af pincet, trække den abdominale hud mellem de to bagben og foretage en indskæring (kun gennem huden) på ca. 1 cm med en skarp saks. Startende fra denne første indsnit, derefter bruge en saks til at skære huden op til halsen på musen. Trække huden bort fra peritoneum og pin ned den ene side af huden på et tidspunkt, der strækker sig det lærte.
- Saml den abdominale og inguinale mælkekirtler ved at skubbe dem væk fra huden med en vatpind og endelig trække eller skære dem væk fra bughinden.
Bemærk: I dette trin Carmine farvning kan udføres med henblik på at visualisere brystepiteliet i hele kirtlen 43. Denne fremgangsmåde kan være nyttigt at analysere det globale morfologi af mælkekirtlen under forskellige betingelser (fysiologiske udviklingsstadier, sygdomme, in vivo behandlinger). - Fjern lymfeknuderne placeret ved krydset af den abdominale og inguinale kirtler 44.
- Brystvæv fiksering
- Skær brystvæv i 3 mm 3 fragmenter med en skalpel og straks skylles disse fragmenter i en phosphatpufret saltopløsning (PBS), pH 7,4, med henblik på at fjerne så meget mælk som muligt.
- Tørrer hurtigt fragmenterne på et papirhåndklæde og læg dem i en kold PBS-opløsning indeholdende 4% paraformaldehyd (PFA, HCHO, 32% formaldehyd løsning, PAS) i 10 til 15 minutter på is.
Bemærk: Dette er tid nok til at tillade efterfølgende analyse på brystvæv skiver af IIF36 og / eller in situ hybridisering 45. Men som aldehyd fikseringsmidler trænge temmelig langsomt i vævsstykker (~ 1-3 mm per time), denne gang kan udvides for at sikre en optimal fiksering af vævsprøven. Alternativt løse væv in vivo ved perfusion en bedøvet dyr med en fikseringsopløsning (ikke beskrevet i den foreliggende undersøgelse).
- Saccharose infusion
- Skylles hurtigt brystkirtlerne fragmenter i koldt PBS og nedsænke dem i en kold PBS-opløsning indeholdende 40% saccharose (D-saccharose, C12H22O11, hr 342,3 g / mol) i 16 til 48 timer ved 4 ° C under forsigtig omrystning.
- Tissue indlejring
Bemærk: I dette trin, brystkirtler fragmenter kan igen skæres for at gøre mindre fragmenter (2-3 mm3) Eller for at justere deres form.- Korrekt mærke de plast forme og fylde en tredjedel af volumenet af formen med OCT-forbindelse, holdes ved stuetemperatur. Placer en fragment (2-3 mm 3) af brystvæv pr mug og dække det med OCT-forbindelse.
- Placer formene ved overfladen af den flydende nitrogen (på et ark af aluminium eller ved hjælp af en metallisk sigte) og lade produktet nedfryses.
Bemærk: Det skal være solid og hvid før neddypning af formen i flydende nitrogen.
- Opbevar frosne prøver ved -80 ° C indtil vævssnit udføres.
2. Frosset væv Sektionsinddeling
Bemærk: En kryostat, som er hovedsagelig en mikrotom inde i en fryser, er forpligtet til at gøre frosne vævssnit. En lavere temperatur er ofte nødvendig for fedt eller lipid-rige væv, såsom jomfru brystkirtel.
- Juster temperaturen af kryostaten til -26 ° C og vente, indtil det har Stabilized. Bevar den frosne væv blok ved -26 ° C under hele sektionering proceduren. Absolut undgå optøning vævet på noget tidspunkt under proceduren.
- Barberbladet, opskæring support, anti-roll enhed og børsten til -26 ° C, afkøles ved at placere dem i kryostaten i mindst 10 min. Også placere et objektglas boks inde i kryostaten med henblik på at kunne lagre objektglas som sektionerne er lavet.
- Korrekt mærke de objektglas, der vil blive anvendt til at indsamle de vævssnit og vedligeholde dem ved stuetemperatur; ellers vævssnit vil ikke holde sig til dem. Prøven fjernes fra støbeformen inde i kryostaten.
Bemærk: Brug af positivt ladede objektglas i høj grad vil favorisere vedhæftningen af friske frosne vævssnit på grund af højere elektrostatisk tiltrækning. - Dække overfladen af et metal væv disk med OCT-forbindelse (holdt ved stuetemperatur) og skub den frosne prøve på det. Placer den våde montere inde i kryostaten og lad det cool i mindst 15 min.
- Placer den våde mount i holderen skiven af kryostaten. Juster snittet tykkelse til 5-6 um og om muligt, brug en ny skarp klinge eller i det mindste ændre området på klingen anvendes til at skære hver prøve, da nogle væv vil hurtigt kedeligt det.
- Justere placeringen af anti-roll enheden via barberblad ved at gøre udskæringer af montering medium, indtil skiverne er dannet jævnt og korrekt. Ideelt set vil anti-roll enhed trin over barberbladet med ca. 1 mm.
- Når indstillingerne er korrekte, udføre vævssnit ved at dreje hjulet i en kontinuerlig ensartet bevægelse. Medmindre temperaturen er ideel, et væv afsnit vil, af natur, så prøv at krølle op.
- Brug en pensel til at få fat i og manøvrere afsnittet på tværs af scenen for at placere den som ønsket på objektglasset. Brug børsten til at rense resterne muligvis er til stede på den frosne vævsblokken og / eller barberblad.
- Trækvævssnittet mod brugeren og undgå at trykke den på kryostat fase. Undgå at trykke vævssnittet på kryostat fase, da den kan føre til vedhæftning af vævssnit på scenen og dermed manglende evne til at genvinde det med objektglasset.
- Hent vævssnit én efter én ved at samle dem op på overfladen af et objektglas, ved at holde det over sektionen og vinkle den ned at røre vævssnittet.
Bemærk: Vævssnit hurtigt holde sig til det varme glas på grund af statisk tiltrækning. Hvis flere vævssnit er placeret på samme dias, skal du passe på ikke at overlappe dem og til rummet dem nok til at være i stand til individuelt omslutte dem i en hydrofob cirkel (se afsnit 3.1.1.).
3. indirekte immunofluorescens
- Lokalisering sektioner
- Brug en hydrofob barriere pen til at tegne en hydrofob cirkel omkring slide-monteret væv. Lad cirklen tørre i ca. 1 min ved stuetemperatur. Tegn en linje rundt om tudstede sektioner med en fin sort permanent markør så godt, men på den side af objektglasset modsat den, hvor vævssnit.
Bemærk: Denne cirkel er vandafvisende og acetone og alkohol-uopløselige. Det giver derfor en barriere for vandige opløsninger, der anvendes under proceduren IHC og reducerer mængden af nødvendige reagenser. - Rehydrér vævssnit ved at dække dem med en dråbe ~ 250 pi PBS i et par minutter ved stuetemperatur. Fix vævssnit ved at dække dem med ~ 250 pi af en frisk fremstillet 3% PFA opløsning i PBS i 10 til 15 min.
Bemærk: Eventuelt i dette tilfælde anvende et aldehyd quenching-opløsning (50 mM ammoniumchlorid (NH4CI, hr 53,5 g / mol) i PBS eller 0,1 M glycin (C2 H5 NO2, hr 75,07 g / mol) i PBS ) for at stoppe optagelsen reaktionen. Enkel og rigelige PBS vask er normalt tilstrækkeligt at fjerne uomsat aldehyd.
- Brug en hydrofob barriere pen til at tegne en hydrofob cirkel omkring slide-monteret væv. Lad cirklen tørre i ca. 1 min ved stuetemperatur. Tegn en linje rundt om tudstede sektioner med en fin sort permanent markør så godt, men på den side af objektglasset modsat den, hvor vævssnit.
- Antigen genfinding (valgfrit)
- Placer AR-opløsning (100 mM Tris (C4 H 11 NO 3 hr 121,14) 5% urinstof (NH2 CONH2, hr 60,06) pH 9,6) i et bæger. Mængden af AR opløsning skal være tilstrækkelig til helt at dække objektglas hældes i et glas holder.
- Forvarm AR opløsningen til 95 ° C ved overvågning af temperaturen med et termometer og derefter placere objektglassene på et egnet stativ, immerge stativet i den varme buffer, til dækning begrænse fordampning og inkuberes i 10 minutter ved 95 ° C.
- Derefter fjernes bægerglasset fra vandbadet og lad objektglas til en anden 10 minutter i bufferen.
- Skyl vævssnit med PBS (~ 250 pl / afsnit) og mætte dem med en opløsning3% bovint serumalbumin (BSA, ~ 250 pl / afsnit) i PBS i mindst 30 minutter ved stuetemperatur.
- Sæt 30-50 pi af det primære antistof fortyndet i PBS indeholdende 2% BSA på hvert væv sektion.
Bemærk: Denne mængde er tilstrækkelig til dannelse af en dråbe, der fuldstændig dækker vævssnittet. - Placer samme volumen af fortyndingsmidlet (2% BSA i PBS) alene på et vævssnit at udføre en negativ kontrol uden primært antistof.
- Systematisk medtage denne negative kontrol i hvert forsøg IHC og udfører for hver sekundært antistof anvendes til at estimere baggrund af forsøget (ikke-specifik mærkning på grund af det sekundære antistof og / eller vævet autofluorescens). Andre typer af positive eller negative kontroller kan også udføres for at sikre specificiteten af mærkning (se diskussionen).
- Placer objektglas i en befugtet kasse O / N ved 4 ° C.
Bemærk: Primære anvendte antistoffer var monoklonalt muse-anti-cytokeratin8 (Ck8, 1:50 fortynding), mus monoklonalt anti-cytokeratin 14 (CK14, 1:50 fortynding), kaninpolyklonalt anti-mus kasein (# 7781, 1:50 fortynding, generøst leveres af MC Neville, University of Colorado Health Sciences Center, CO, USA), kanin polyklonalt anti-BTN1 (1: 300 fortynding, generøst leveres af IH Mather, Institut for Husdyrbiologi og Avian Sciences, University of Maryland, MD, USA), kanin polyklonalt anti-Stx6 ( 01:50 fortynding, generøst tilvejebragt af S. Tooze, Cancer Research UK, London Research Institute, London, UK) og kanin polyklonale anti-VAMP4 (1:50 fortynding). - Vaskes vævssnit med PBS mindst fire gange i 10 minutter ved stuetemperatur.
- Fortynd den passende sekundært antistof (rhodamin-konjugeret gede anti-kanin IgG (H + L), 1: 300 fortynding) i PBS indeholdende 2% BSA, placere 30-50 pi af denne opløsning på alle vævssnit, og der inkuberes i 1,5 timer ved stuetemperatur.
- Da fluorochromer er lysfølsomme molekyler, ikkeudsætte vævssnit for lys, indtil deres analyse. For IIF på vævssnit, begunstiger sekundære antistoffer koblet til en rød fluorofor siden cellemembraner tendens til at frembringe en grøn autofluorescens, der kan forstyrre lav mærkning. Desuden vælger en rød fluorofor-koblede sekundære antistof tillader samtidig mærkning af neutrale lipider (se nedenfor).
- Vaskes grundigt vævssnit med PBS mindst fire gange i 10 minutter ved stuetemperatur.
- For nogle forsøg udføre post-fiksering ved at inkubere prøverne med 2% PFA fortyndet i PBS i 10 minutter ved stuetemperatur med henblik på at stabilisere antigen / antistof-stilladser. Imidlertid kan dette trin udelades i de fleste tilfælde.
- At visualisere CLDs og MFGs, farve neutrale lipider ved at inkubere vævssnit i 30-50 pi en PBS-opløsning indeholdende 3 ug / ml BODIPY 493/ 503 i 10 minutter ved stuetemperatur. Skylles hurtigt vævssnit to gange med PBS.
- Kontrastfarve nuklear DNA med 30-50 pi en PBS-opløsning indeholdende 3 pM DAPI (4-6-diamidino-2-phenylindol, 5 mg / ml stamopløsning) i 10 minutter ved stuetemperatur. Vask vævssnit to gange med PBS før montering dias til observation.
- Fjern PBS og placere en dråbe montering medium på hvert vævssnit.
- Placer en side af dækglasset i en vinkel mod slæden, at komme i kontakt med den ydre kant af den flydende dråbe og sænk dækslet langsomt, undgå luftbobler. Lad væsken spredes mellem objektglas og dækglasset i et par minutter og derefter fjerne overskuddet af montering medium med en papirserviet.
- Forsegl dækglasset til objektglasset med neglelak og opbevare vævssnit ved 4 ° C for at forhindre deres eksponering for lys, indtil observation.
4. Fluorescens Observation og Image Acquisition
Bemærk: En fluorescensmikroskop udstyret med et kamera styret af billedoptagelse software er forpligtet til at overholde de resultater, IHC.
- Før erhverve billeder, tjek intensiteten af mærkning og evaluere på baggrund af forsøget ved at se på de negative kontroller. Erhverve billeder af hver fluorescerende mærke (farve kanal) individuelt.
- Erhverve alle billeder, herunder de tilsvarende kontroller, i de samme betingelser (eksponering og generelle indstillinger) for hver farvekanal.
- Konventionel mikroskopi
- Udfør epifluorescens mikroskopi med et mikroskop udstyret med standard filtre til fluoresceinisothiocyanat (FITC, grøn), rhodamin (rød) og DAPI (blå) emissioner, × 20 til × 63 (olie-nedsænkning, NA 1.3) målsætninger og en DP50 billedbehandling kamera.
- Konfokal mikroskopi
- Udfør konfokalmikroskopi med et mikroerCope udstyret med ZEN software, ved hjælp × 20 til × 63 (olie-nedsænkning, NA 1.4) mål og 488- og 568-nm excitationsbølgelængder af laseren.
5. Billede Behandling
Bemærk: Alle billede efterbehandlinger udføres ved hjælp af ImageJ gratis software (http://imagej.nih.gov/ij/).
- Oven billede (fusionere)
- Åbn de billeder, der er erhvervet i hver kanal, der vil blive kombineret (File / Open). Hvis du arbejder med 8-bit gråtonebilleder, tilskriver kunstige farve til hver kanal ved hjælp opslagstabellen (Billede / opslagstabeller).
- Generer det sammensatte billede fra gråtoner eller farvestoffer billeder ved hjælp af kommandoen "Flet kanaler" (Billede / Farve / Flet Kanaler) og derefter tillægge en farve til hver kanal.
- Udføre billedet stakke overlejring på samme måde ved at åbne stakke erhvervet i hver kanal, der vil blive kombineret (File / Open), og ved hjælp af kommandoen "Flet kanaler &# 8221; (Billede / Farve / Flet kanaler) at tillægge en farve til hver kanal. Gem den sammensatte stak som en billedsekvens eller som en film (se afsnit 5.4).
- Billedstak Z projektion
- Brug Z projektion funktion (Billede / Stak / Zproject, Max Intensitet) for at tilvejebringe en todimensional visning af alle billeder af en billedstak ved at projicere dem langs aksen vinkelret på billedplanet (z-aksen). Den "maksimal intensitet" valgmulighed skaber et billede, hvor hver pixel indeholder den maksimale værdi over alle billeder i stakken. Dette frembringer et enkelt billede tillader visualisering af hele farvningen observeret gennem hele billedstak for en bestemt kanal, eller efter sammenlægning af flere kanaler.
- Billedstak 3D-projektion
- Brug 3D-projektion kommandoen (Billede / Stak / 3D-projektet, lyseste punkt, y-aksen) for at generere en sekvens af projektioner af en roterende mængde på et plan. Den visuelle gengivelse af surfaces og interne strukturer afhænger både projektion metoden (nærmeste punkt, lyseste punkt (her anvendes), eller betyde-værdi), og visualisering parametre valgt. Hver ramme af animerede sekvens er resultatet af rager ud fra en anden synsvinkel.
- Drej skabt 3D-billede omkring hver af de tre ortogonale akser (y-aksen er valgt her). Gem sekvens produceret som et enkelt billede eller en film.
- Billedstak til film konvertering
- Åbn en billedstak (File / Open), og gemme det som en film i AVI-format ved at bruge kommandoen "AVI" (Filer / Gem som / AVI).
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Mælkekirtlen er en subkutan kirtel placeret langs den ventrale struktur både thorax og abdomen hos gnavere. Placeringen af de fem par kirtler i musen under svangerskabet er vist i figur 4. Morfologien af mælkekirtlen dramatisk ændrer under udviklingen, hvilket afspejler funktionelle ændringer, der kræves for at forberede fuld amning (figur 1B). I ubrugte eller barnløse dyr, brystkirtlen består af et tyndt forgrenet duktalt epitel indlejret i en tynd fede stroma, der kan være vanskelige at se. Fra starten af graviditeten, brystepiteliet prolifererer og udvider, hvilket resulterer i større mælkekirtler, der bliver nemmere at se og fjerne (figur 4). Under amning, brystvævet er tykkere og synes hvidere på grund af tilstedeværelsen af mælk. Kun abdominale og inguinale mælkekirtler indsamles fordi livmoderhalskræft og thorax brystkirtler Glands er mindre let fjernes på grund af deres tætte tilknytning til musklerne. For nogle forsøg, kan hvalpe adskilles fra diegivende kvinder 4-6 timer før aflivning med henblik på at begrænse mælkesekretion af MESCs 46,47.
Identifikation af mamma myoepithelial og epitelceller
Der kan skelnes mellem kontraktile myoepitelcellerne omgiver alveolerne fra luminale MESCs ved anvendelse af antistoffer rettet mod markører specifikt udtrykkes af hver af disse celletyper. I mælkekirtlen, de nuværende markører anvendes, er cytokeratiner (CKS). CK'er er en stor familie af cytoplasmatiske proteiner, der polymeriserer til dannelse af cytoskeletale intermediære filamenter (10 nanometer i diameter i gennemsnit), der findes i epitelvæv. De intermediære filamenter er ekstremt stabile og giver en mekanisk støtte for celle arkitektur og organisere væv ved at bidrage til celle-celleadhæsion og basalcelle-bindevævvævsinteraktioner. De delmængder af CKs udtrykt af epitelceller primært afhænge af typen af epitel, dens udviklingstrin og dens differentiering status. Desuden dette gælder også for de maligne modstykker i epithel. Således er disse markører er enkle og værdifulde værktøjer til at karakterisere cellepopulationer i et væv under fysiologiske betingelser og anvendes til tumordiagnose og karakterisering i kirurgisk patologi 48.
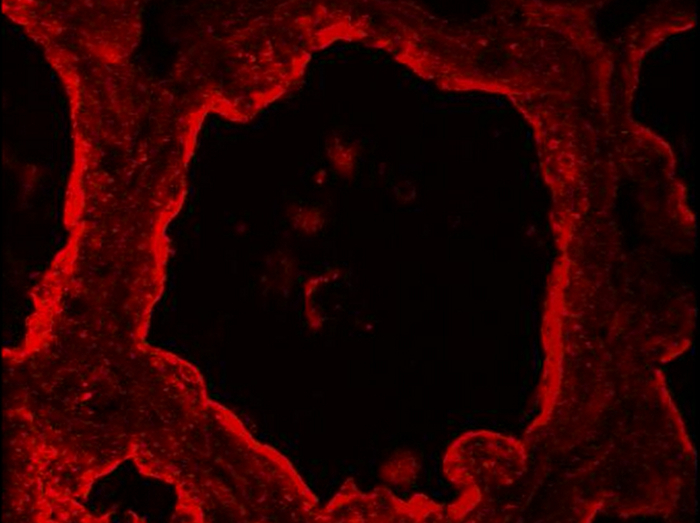
I den normale mælkekirtler, kan skelnes myoepithelial og luminale MESCs celler baseret på deres differentiel ekspression af CK14 og Ck8 henholdsvis (figur 5). Disse cytoplasmatiske markører er påvist i mammae sektioner af diegivende mus efter PFA fiksering og AR. Billeder blev erhvervet med en konventionel epifluorescensmikroskop. Ck8 synes at være fordelt i hele cytoplasmaet af de luminale MESCs (figur 5, Ck8). Bemærk, at den rød baggrund observered for den negative kontrol uden primært antistof (figur 5, -Ig1) er mest på grund af vævssnittet foldning, som foreslået af den blå DNA-mærkning, som viser flere lag af kerner (figur 5, -Ig1, kerner). CK14 specifikt observeret i flade og aflange myoepitelcellerne placeret i bunden af alveolerne (figur 5, CK14). En anden almindelig måde at identificere myoepitelcellerne er at detektere alfa-glatmuskelactin (a - SMA) til stede i disse celler (kontraktile se figur 4 i 49).
Påvisning af muse mejeriprodukter
Efter fødslen, begynder fuldt differentierede MESCs at producere rigelige mængder mælk. Mælkebestanddele udskilles af distinkte veje 40,50. Caseinmiceller udskilles ved exocytose af Golgi-afledte SV'er, mens lipider er udgivet som MFGs ved knopskydning af den apikale plasma membran MESCs (figur 2, brystepitel- sekretorisk celle). For nogle forsøg, er hvalpene adskilt fra kvindelige 4-6 timer før opsamling af de brystkirtler, med henblik på at bremse mælkesekretion 46,47. Under disse betingelser, kan let observeres den apikale plasmamembran MESCs og indholdet af lumen, hvilket ikke er tilfældet i diende siden alveolerne er kontraheret og lumenet er lukket. Desuden bremse sekretion er også afgørende, når studerer proteiner involveret i membran menneskehandel såsom Snares. Faktisk snarer cyklus mellem donor og acceptor rum, og deres subcellulære lokalisering er vanskeligt at afgøre, da mærkning ofte diffust hvor omsætningen membran er høj, dvs.., Under diegivning. Derfor bremse mælk sekretion ved at fjerne hvalpene giver ordentlige betingelser for at studere den intracellulære lokalisering af Snares når T- og v-Snares fortrinsvis bor i donorenog acceptorrummet henholdsvis (se nedenfor).
Figur 6 viser lokaliseringen af kaseiner i lakterende muse brystkirtel på dag 10 af diegivningen, i nærvær (figur 6, + p) eller i fravær (figur 6, -p) af unger. Vævssnit blev observeret både ved traditionel epifluorescensmikroskopi (de tre søjler til højre) og konfokal mikroskopi (figur 6, venstre spalte). Under diegivning, synes kaseiner at være overvejende akkumuleret i den apikale region (figur 6, + p, pilespidser). Konfokal mikroskopi viser, at caseiner er også til stede, om end i mindre grad, på den basale side af MESCs i nærvær af unger (figur 6, + P, pile), som ikke klart kan observeres i konventionelle mikroskopi (figur 6, kasein, sammenligne venstre og højre paneler). Ja, i bredt felt epifluorescens, fluorescens, der udsendes af prøven (baggrund fluorescence) passerer gennem ophidset volumen og ændrer opløsningen af de objekter observeret i målet brændplan (ud-af-fokus fluorescens). Dette gælder især for tykke prøver (tykkere end 2 um). Konfokal mikroskopi muligt at opnå billeder af høj kvalitet fra prøver fremstillet til epifluorescens, som dybden af feltet kan kontrolleres og baggrundsfluorescens udelukket fra brændplanet. Endvidere i nærvær af unger (figur 6, + p), lumen af alveolerne er helt lukket og den apikale side af MESCs er bedre observeret i fravær af unger (figur 6, -P), når lumen alveolerne er dilateret på grund af ophobning af mælkeprodukter. Hvis mælken sekretion er bremset, kaseiner synes også at være akkumuleret under den apikale plasmamembran (figur 6, -p, pilespidser), og er tydeligt observeret ved den basale side af MESCs (figur 6, -p, pile). Negative kontroller uden primær ANTIBody viste ikke nogen mærkning (figur 6, -Ig1).
Mælkeprodukter kan let co-opdaget ved at kombinere IHC for kasein og neutralt lipid modfarvning af CLDs og MFGs (figur 7). Vævssnit blev afbildet som Z-stakke ved konfokal mikroskopi, som var efterbehandlet med ImageJ at fremstille Z fremspring eller 3D prognoser for hver (figur 7, kasein, lipider) eller alle farvekanaler (figur 7, fusionere). De billedsekvenser producerede er blevet gemt som enkeltbilleder (figur 7 og 8) eller film (se supplerende film).
Selv om nogle mærkning blev observeret på deres basale side, blev kaseiner meste akkumuleret på den apikale side af MESCs (figur 7, + p), som allerede beskrevet, når kvinder der ikke tidligere er adskilt fra unger (figur 6, + P). CLDs også primært lokaliseret i den apikale region MESCs, mens større hemmeligheded MFGs er til stede i hulrummet i alveolerne. Bemærk, at kaseiner og MFGs nemt visualiseres i lumen af alveolerne i mangel af hvalpe (figur 7, sammenligne + p og -p). Kaseiner ikke co-lokalisere med CLDs eller MFGs i nogen af disse betingelser, idet sammenlægning af de to farvekanaler ikke producerer gul mærkning (figur 7, fusionere billeder). Billedstak efterbehandlinger viser imidlertid, at kaseiner omgiver de udskilte MFGs i lumen af alveolerne, hvilket antyder, at disse proteiner kan interagere med MFG (figur 7, flette billeder). Bemærk forskellen mellem de billeder, som frembringes af hver post-behandling, der anvendes (figur 7, sammenlign Zproj og 3D proj for hver farvekanal).
Påvisning af butyrophilin, et protein markør for MFGs.
BTN1 er en af de vigtigste proteiner associeret med MFGs i mælk 51. Dette transmembrane protein er mainly lokaliseret ved den apikale plasmamembran MESCs og følgelig findes på overfladen af MFG efter frigivelse ved knopskydning 52. Figur 8 viser, at på dag 10 i amning, er BTN1 primært lokaliseret ved den apikale plasmamembran og i mindre grad i den apikale region MESCs. BTN1 omgiver også MFGs til stede i hulrummet i alveolerne såvel som nogle af de apikale CLDs (figur 8, 3D proj fusionere, pilespidser). Resultaterne er vist som et enkelt billede ekstraheret fra den erhvervede billedet Z-stack (figur 8, billede) eller som en 3D-visning genereret med 3D-projektion kommandoen over ImageJ, som beskrevet ovenfor (Figur 8, 3D proj). Bemærk, at et enkelt billede kan være tilstrækkelig til at observere den apikale fordeling af protein, men den rumlige sammenslutning af BTN1 med udskilte MFGs eller apikale CLDs kun observeret efter 3D-rekonstruktion af Z-stakken (figur 8 sammenligne BTN1 billede og 3D Proj merge pictninger). Z-stakken kan også blive rekonstrueret som en film for at give en bedre rumlig afbildning af fordelingen af proteinet. Billedet Z-stack erhverves for BTN1 alene (Supplerende film 1 og 3) eller overlejret med de andre to farvekanaler (fusionere, supplerende film 2 og 4) er vist som eksempler. Z-stakken kan læses billede-for-billede fra toppen til bunden (Supplerende film 1 og 2) eller som en roterende visning (y-aksen) i 3D-projektion af hele billedstak (Supplerende film 3 og 4 ).
Påvisning af to SNARE proteiner: Stx6 og VAMP4
Som tidligere nævnt, snarer er membranbundne proteiner, der cykler mellem donor- og acceptor-membraner. Det er derfor bedre at bremse membran omsætning forbundet med den høje sekretorisk aktivitet af MESCs ved at adskille hunnerne fra hvalpene før indsamlingen mælkekirtlen, når man studererdisse proteiner. Stx6 og VAMP4 er begge blevet beskrevet som værende tilknyttet trans-Golgi netværket 53,54. Imidlertid kan disse SNARE proteiner også spiller en vigtig rolle på niveau med andre cellulære rum, såsom de sekretoriske granula (Stx6) 55,56 og Golgi-apparatet (VAMP4) 57. Tidligere undersøgelser tyder på, at SNARE proteiner spiller en rolle i sekretion kasein 35,36. Under amning, er Stx6 og VAMP4 placeret i sub-apikale region MESCs. Observeres Stx6 mellem kernen og den apikale membran af MEC'er svarende til Golgi og trans-Golgi-netværket (figur 9, Stx6), og er også til stede, om end i mindre grad på casein-holdige SV'er 36. VAMP4 også lokaliseret i sub-apikale region MESCs, men mærkningen synes at være mere punktformet og akkumuleres under den apikale plasmamembran (figur 9, VAMP4) på grund af sin tilknytning til både CLDs og kasein-contalingen SV'er 36. Negativ kontrol uden primært antistof har ikke givet anledning til nogen mærkning.

Figur 1. Mus mælkekirtlen udvikling under embryonisk og voksenliv. (A) Muse-mælkekirtler begynder at udvikle sig omkring embryonisk dag 10 (E10) fra ektodermal (lyseblå) mælkeledninger (pink). Ved E11.5, placodes danner symmetrisk langs bryst-mælkeledning og den omgivende mesenkym (mørkeblå) begynder at kondensere. De placodes invaginate at danne knopper (E12.5-E14.5) og på E15.5, brystepiteliet (lyserød), formere og langstrakt at danne den primære spire, der skubber gennem mamma mesenchym mod fedtpuden (lys grøn ). En hule lumen former og åbner for at give anledning til brystvorten (lilla). På E18.5, brystepiteliet danner en rudimentary forgrenet struktur forbundet til ydersiden. Tilpasset fra 6 med tilladelse fra Macmillan Publishers Ltd: Anmeldelser Nature Genetics, copyright 2007. (B) I puberteten, brystepiteliet (lilla) går ind i en betydelig vækst fase (omfattende forlængelse, forgrening og laterale forgrening). Ved starten af svangerskabet, omfattende og hurtig spredning samt side forgrening forekommer, hvilket fører til en betydelig udvidelse af brystepiteliet, som fuldt ud invaderer hele brystfedtpuden. Brystepiteliet når en yderst differentieret funktionel tilstand under amning, når luminale MESCs udskille store mængder mælk. Når amning ophører efter fravænning, mælkekirtlerne involutes. MESCs fjernes ved apoptose og fagocytose, fører til forsvinden af lobulo-alveolære strukturer, der er erstattet af fedtvæv. Tilpasset fra skema 1 i http://brisken-lab.epfl.ch/research og kapitel 2.2. http://tvmouse.ucdavis.edu/bcancercd/22/index.html. Klik her for at se en større version af dette tal.
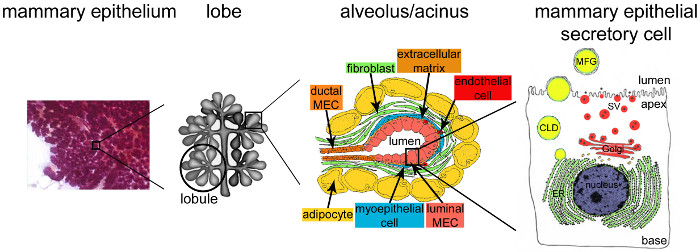
Figur 2. Arkitektur af brystkirtlen under amning. Under amning, den fuldt udviklede og stærkt forgrenet epitel (lilla) tegner sig for langt størstedelen af brystvævet. Den epitelvæv dannes ved tubulo-alveolære strukturer indlejret i en stroma, der indeholder forskellige celletyper (fibroblaster, adipocytter, glatte muskelceller, blod og lymfekar og nerveender). MESCs er organiseret i acinære strukturer eller alveolerne, samlet i lobules, der danner lapper. Hver alveole er et funktionelt mælkeproducerende enhed, der er forbundet til et stærkt forgrenet netværk af luftrør og interlobulære kanaler, således at mælken, der skal dspredes til ydersiden. Hver alveole er afgrænset af et monolag af polariserede MESCs, den apikale side som grænser op til en central lumen. Den basale side af MESCs er i tæt kontakt med en ekstracellulær matrix og kontraktile myoepitelcellerne. Mælkeprodukter frigives ved den apikale side af MESCs. Større mælk (kaseiner) udskilles som caseinmiceller (sorte punkter) ved exocytose af Golgi-afledte sekretoriske vesikler (SVS), mens lipider frigives mælk fedtkugler (MFGs) ved knopskydning af den apikale plasmamembran MESCs. CLD: cytoplasmatisk lipid dråbe; ER: endoplasmatisk reticulum; MEC: brystepitel- celle. Tilpasset fra kapitel 2.2. http://tvmouse.ucdavis.edu/bcancercd/22/index.html., fig. 02 www.cellbiol.net/ste/alpHERCEPTIN1.php, fig. 26-02 i 58, og fra 50. Klik her for at se en større version af dette tal.
.within-side = "altid"> 

Figur 3. Eksperimentel procedure at udføre indirekte immunfluorescens på frosne snit af muse brystkirtel. Mælkekirtlen opsamles fra en CD1 hunmus på dag 10 i amning. Brystvævet skæres i små fragmenter, der er fastgjort med paraformaldehyd og infunderes i saccharose, før de indlejres i OCT-forbindelse og lynfrosset. Mælkekirtlen prøver skæres derefter i tynde frosne snit og forarbejdet til IIF ved successiv inkubation med primære og fluorokromkonjugerede sekundære antistoffer, henholdsvis. Efter montering prøver analyseret med et fluorescensmikroskop, således at erhvervelsen af billeder, der efterfølgende kan efterbehandles./53179/53179fig3large.jpg "Target =" _ blank "> Klik her for at se en større version af dette tal.

. Figur 4. anatomiske placering af muse mælkekirtler Venstre: ventrale visning af musebryst systemet på den sene drægtighed fase. Højre: lokalisering og aspekt af mælkekirtlen i den sene drægtighed fase i mus. Bemærk, at under amning, mælkekirtlerne er tykkere og synes hvidere på grund af tilstedeværelsen af mælk i alveolerne. Tilpasset fra http://ctrgenpath.net/static/atlas/mousehistology/Windows/femaleu/mousemammgldiagram.html og http://www.pathbase.net/Necropsy_of_the_Mouse/index.php?file=Chapter_3.html. Klik her for at se en større version af dette tal.
-together.within-side = "altid"> 
Figur 5. Identifikation af luminale epitelceller og basale myoepitelcellerne i muse brystkirtel. Luminale MESCs og myoepitelcellerne identificeres ved IIF i muse brystkirtel på dag 10 i amning, baseret på deres ekspression af CK-8 og CK-14 , henholdsvis. Nuclear-DNA blev farvet med DAPI (blå). Billeder blev erhvervet med en konventionel epifluorescensmikroskop. Den sammensatte billede (fusionere) viser overlejring af mærkningen, der svarer til kaseiner (rød) og kerner (blå), hhv. -Ig1, Negativ kontrol uden primært antistof. Stjerner angiver lumen. Skala bar = 100 um. Klik her for at se en større version af dette tal.
e 6 "src =" / files / ftp_upload / 53179 / 53179fig6.jpg "/>
Figur 6. Cellulær lokalisering af kaseiner i muse brystkirtel. Kaseiner påvises ved IIF i musen brystkirtel på dag 10 af amning. Brystkirtlen blev indsamlet fra kvinder i tilstedeværelse (+ p) eller i fravær (-p), i hvalpe. Billeder blev erhvervet med en konventionel (højre panel, kasein, kerner og flette) eller en konfokal (kaseiner (rød), venstre panel) fluorescens mikroskop. I begge betingelser, er kaseiner (røde) påvist i den apikale region (pilespidser) og mere eller mindre på den basale af MESCs (pile). Negative kontroller uden primære antistoffer viser ikke nogen mærkning (-Ig1). Nuklear DNA farvet med DAPI (blå). Den sammensatte billede (fusionere) viser overlejring af mærkningen, der svarer til kaseiner (rød) og kerner (blå), hhv. Stjerner angiver lumen. Skala bar = 100 um for epifluorescens billeder (højre panel, kasein, kerner, flette), og = 10 &# 181;. M for konfokale billeder (venstre kolonne) Klik her for at se en større version af dette tal.
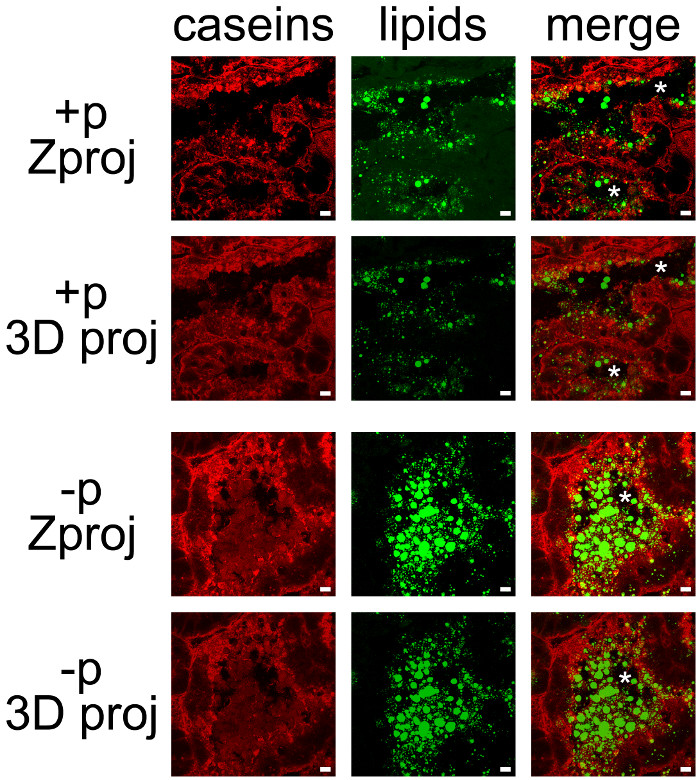
Figur 7. Cellulær lokalisering af mejeriprodukter i musen brystkirtlen. Kasein (rød) påvises ved IIF i musen brystkirtel på dag 10 af amning i tilstedeværelse (+ p), eller i fravær (-p), i hvalpe. Neutrale lipider (CLDs og MFGs) er modfarvet med BODIPY 493/503 (grøn). De sammensatte billeder (fusionere) viser sammenlægning af de to Skiltemalerer. Billeder blev erhvervet som Z-stakke med et konfokalt mikroskop. Z-stakke blev efterbehandlet med ImageJ at generere Z fremspring (Zproj) eller 3D fremspring (y-akse) (3D proj) af hele stakke i hver kanal for både (flet). Stjerner angiver lumen. Scale bar= 10 um. Klik her for at se en større version af dette tal.

Figur 8. Cellulær lokalisering af butyrophilin og lipider i muse brystkirtel. BTN1 (rød) detekteres ved IIF i muse brystkirtel på dag 10 af diegivningen i fravær af hvalpene. Neutrale lipider (CLDs og MFGs) og nuklear DNA modfarvet med BODIPY 493/503 (grøn) og DAPI (blå), henholdsvis. Billeder blev erhvervet med konfokal mikroskop som billedfiler Z-stakke. Resultaterne er vist som et enkelt billede udvundet fra billedet stakken (billede, BTN1, lipider, kerner og flette) eller efter efterbehandling med ImageJ at generere en 3D-visning (y-aksen) af hele billedstak (3D proj, BTN1 , lipider, kerner, flette). De sammensatte billeder (fusionere) visersammenlægning af de tre farvekanaler. -Ig1, Negativ kontrol uden primært antistof. Stjerner angiver lumen. Skala bar = 10 um. Klik her for at se en større version af dette tal.

Figur 9. Cellulær lokalisering af to SNARE proteiner i muse brystkirtel. Syntaxin 6 (Stx6) og VAMP4 (V4) påvises ved IIF i muse brystkirtel på dag 10 i amning. Billeder blev erhvervet med en konventionel (conv) epifluorescens eller en konfokal (LSM) mikroskop. De sammensatte billeder (flet) viser overlejring af mærkningen observeret for hver SNARE protein (rød) og for nuklear DNA modfarvet med DAPI (falsk grøn farve), hhv. -Ig1, Negativ kontrol uden primært antistof. Stjernes angiver lumen. Skala bar = 10 um for konfokale billeder og = 100 um for epifluorescens billeder. Klik her for at se en større version af dette tal.


Tabel 1. Immunohistokemi fejlfindingsvejledning.

Supplerende film 1. Lokalisering af butyrophilin i musen brystkirtlen. BTN1 (rød) detekteres ved IIF i muse brystkirtel på dag 10 i amning. Billeder blev erhvervet med en co nfocal mikroskop som Z-stack og efterbehandlet med ImageJ at generere en film. Z-stakken læses fra toppen til bunden. Klik her for at se denne video.

Supplerende film 2. Lokalisering af butyrophilin og neutrale lipider i musen brystkirtel. BTN1 (rød) er opdaget af IIF i mus brystkirtlen på dag 10 af amning. Neutrale lipider (CLDs og MFGs) og nuklear DNA modfarvet med BODIPY 493/503 (grøn) og DAPI (blå), henholdsvis. Billeder blev erhvervet med konfokal mikroskop som en Z-stack for hver farvekanal og var efterbehandlet med ImageJ at generere en sammensat Z-stak, der overlejrer de tre farvekanaler. Den resulterende sammensatte Z-stack læses fra øverst til nederst.https://www.jove.com/files/ftp_upload/53179/supvid2.mp4 "target =" _ blank "> Klik her for at se denne video.
Supplerende film 3. Lokalisering af butyrophilin i musen brystkirtlen. BTN1 (rød) detekteres ved IIF i muse brystkirtel på dag 10 i amning. Billeder blev erhvervet med konfokal mikroskop som en Z-stack og efterbehandlet med ImageJ (3D-projektion) til at generere en roterende (y-aksen) rumlig udsigt over BTN1 mærkning. Klik her for at se denne video.

Supplerende film 4. Lokalisering af butyrophilin og neutrale lipider i musen mammary kirtel. BTN1 (rød) er opdaget af IIF i musen brystkirtel på dag 10 af amning. Neutrale lipider (CLDs og MFGs) og nuklear DNA modfarvet med BODIPY 493/503 (grøn) og DAPI (blå), henholdsvis. Billeder blev erhvervet med konfokal mikroskop som en Z-stack for hver farvekanal og var efterbehandlet med ImageJ at generere en sammensat Z-stak, der overlejrer de tre farvekanaler. ImageJ (3D-projektion) blev yderligere bruges til at generere en roterende (y-aksen) rumlig opfattelse af den sammensatte Z-stak. Klik her for at se denne video.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
IHC er en relativt enkel og ligetil metode til eksperimentel lokalisere antigen i vævssnit, som først og fremmest på specifikke epitop-antistof-interaktioner. Selvom der anvendes et stort antal protokoller til at lokalisere en protein ved IIF, kernen i disse procedurer er næsten altid den samme. Men der er nogle kritiske aspekter, der kan stærkt påvirke resultatet og skal derfor optimeret til hver enkelt IHC undersøgelse. Den mest udfordrende aspekt af denne fremgangsmåde er at bestemme den bedste eksperimentelle betingelser, dvs.., Der genererer et stærkt og specifikt signal for antigenet af interesse. De variabler, der skal overvejes for eksperimentelle design og optimering er: (1) typen af antigen (arter, ekspressionsniveauer, subcellulær placering); (2) epitopen type (sekvens, kropsbygning, formodede post-translationelle modifikationer); (3) prøveforberedelse (indlejring i paraffin eller for frosne sektioner); (4) fiksering method (perfusion eller nedsænkning); (5) fiksativ anvendes (formaldehyd, alkohol eller acetone); (6) den blokerende reagens (normalt serum, BSA eller fedtfri mælk); (7) AR trin; (8) påvisningsmetoden (direkte eller indirekte); (8) typen af primært antistof (monoklonale eller polyklonale); (9) det sekundære antistof (arter og mærke); (10) counterstains (nukleare og / eller andre cellulære rum mærkning); og (11) montering medium (se tabel 1 for detaljer). Fikseringen og blokerende trin, i det mindste kræve, at optimering af yderligere faktorer såsom koncentration, pH, temperatur, inkubationstid og fortyndingsmiddel.
Det første afgørende aspekt vedrører udarbejdelse af vævsprøver, der er tæt knyttet til fiksering metode, hvilket igen påvirker kvaliteten af resultaterne. For eksempel kan vævsstykker være fast eller ikke før indlejring. Dette trin kan også afhænge af indlægningsmetode valgt, dvs. OCT-forbindelse vs. paraffinindlejring, Som i sig selv afhænger undertiden det primære antistof anvendes. Vævsfiksering kan udføres in vivo ved perfusion en bedøvet dyr med en fikseringsopløsning. Denne metode er nyttig til at bevare antigener når man studerer intakte væv, men måske ikke tilstrækkelig til at løse vævet af interesse. I dette tilfælde kan små vævsstykker (ikke tykkere end 10 mm) nedsænkes i fikseringsopløsning. Frosset væv kan fremstilles ved at nedsænke vævet i flydende nitrogen eller isopentan, og snap-frysning anbefales til efterfølgende påvisning af post-translationelle modifikationer såsom phosphorylering. Men i modsætning paraffinindlejret væv, frysning ikke er tilstrækkelig til langsigtet opbevaring af vævene på grund af dannelsen af iskrystaller inden i cellerne, som kan ændre subcellulær morfologi. Når snit, kan frosne vævssnit opbevares ved -80 ° C i op til 1 år. Under alle omstændigheder, fremstilling af vævsprøverne er et kompromis mellem at bevare vævet/ cellulære arkitektur og bevare epitop integritet.
Da det ændrer den kemiske sammensætning af væv, er det vigtigt at optimere fikseringen betingelser for at undgå både ufuldstændige (under fi xation) og overdreven (overfixation) fi xation.
Faktisk kan underfixation nedsætte det specifikke signal ved at fremme den proteolytiske nedbrydning af visse antigener. På den anden side, kan overfixation ændre den specifikke mærkning ved at skjule epitop eller frembringelse af en stærk ikke-specifik baggrund. Således, ud over valget af fikseringsopløsningen, andre parametre, såsom inkubationstiden, temperaturen og pH-værdien vil påvirke vævsfiksering. Selvom PFA er den mest almindelige fiksativ anvendes til IHC, kan det ikke betragtes som en "universel" fiksativ. PFA inducerer protein-protein og protein-nukleinsyre-tværbindinger og kan således artefactually modificere epitopen (overfixation) og derefter forhindre recognition af det primære antistof. Imidlertid kan epitopen yderligere afsløret af AR teknikker (se nedenfor). PFA kan også være uegnet til påvisning af visse antigener, som det har vist sig at inducere translokation af nogle phosphorylerede proteiner fra membranen til cytoplasmaet. I sådanne tilfælde skal PFA erstattes af egnede alternative fiksativer såsom alkohol. I modsætning til PFA, behøver alkoholer, såsom methanol eller ethanol ikke skjule epitoper, da de tillader vævsfiksering ved at erstatte vandmolekyler i væv. Dette kan føre til udfældning af proteinerne og derefter forhindre antistof / epitop interaktion på grund af konformationelle ændringer. Det er almindeligt troede, at alkoholer ikke trænge ind og dermed bevarer ikke vævsmorfologi såvel som PFA. Acetone er et andet alternativ fiksativ, der er almindeligt anvendt, når der arbejdes med ikke-fikserede, lynfrosset vævssnit. Men acetone er et stærkt dehydratiseringsmiddel og kan føre til irreversibel fældning af vævsproteiner.
For nogle antigener, kan der kræves en yderligere trin med AR for at opnå et godt signal, især hvis fiksativet inducerer konformationelle ændring eller ændrer den elektrostatiske ladning af epitopen (maskering af epitopen). AR metoder til formål at vende disse processer at genoprette immunoreaktivitet af epitopen og den efterfølgende interaktion med det primære antistof. AR metoder hovedsagelig afhænge af to metoder: (1) protease epitopgenfinding, dvs med enzymer, såsom proteinase K, trypsin eller pepsin, som spalter peptider, der maskerer epitopen; og (2) varme-induceret epitopgenfinding, dvs ved hjælp af en mikrobølgeovn, trykkogere, vegetabilske dampere, autoklaver og vandbade. Sidstnævnte metode er især tids-, temperatur-, puffer-, og pH-følsomme, og de optimale betingelser skal være empirisk (et eksempel er i protokol afsnittet). Alternativt kan affiniteten af et antistof for dets antigen forbedresved at ændre pH eller kationen koncentrationen af antistoffortynder.
Er undertiden nødvendigt med en permeabilisering trin for at opnå et godt signal til en intracellulær epitop i tykke vævssnit, især for nuklear antigenfarvning. Dette kan opnås på forskellige måder ved hjælp af: (1) alkoholer eller acetone som fikseringsmidler; eller (2) detergenter såsom Triton, NP-40 (0,1-0,2% i PBS, 10 min), digitonin, saponin eller Tween 20 (0,2-0,5% i 10 til 30 min) efter PFA fiksering. Men valget af vaskemiddel afhænger af cellulære lokalisering af epitopen påvises. Faktisk barske detergenter, såsom Triton-X100, som solubiliserer cellemembraner, er egnede til påvisning nukleare epitop, men kan føre til at signalere ændringer ved udvinding af nogle hindeagtige proteiner. Anvendelsen af mildere rengøringsmidler (saponin og Tween 20) er mere egnet til påvisning af cytoplasmatiske epitoper.
Det andet afgørende skridt er blocking uspecifik farvning. Bindingen af et antistof til dets mål-epitop er omfattet af intermolekylære kræfter (f.eks hydrofobe og ioniske interaktioner, hydrogenbinding). Således kan interaktioner af primære og / eller sekundære antistoffer med andre proteiner end deres målantigener resultere i ikke-specifik farvning. Dette genererer høj fluorescens baggrund, som forhindrer visualisering af proteinet af interesse (lavt signal / støjforhold). Blokerende reagenser reducerer ikke-specifikke interaktioner uden at forringe specifikt antistof / epitop-interaktion. En almindelig procedure består i at inkubere vævssnit med varmeinaktiveret normalt serum eller BSA. Ved brug af en normal serum, skal det være fra den samme art som dem i værtsdyret af det sekundære antistof eller fra en uafhængig arter. I alle tilfælde skal den valgte blokeringsreagens også sættes til de fortyndingsmidler til de primære og sekundære antistoffer. Endvidere er anvendelsen af ikke-ioniske detergenter, såsom Triton X-100, Tlem 20 eller saponin hjælper med at reducere ikke-specifikke interaktioner.
Den tredje og sandsynligvis vigtigste parameter er det primære antistof udvælgelse og optimering. Det er klart, det bedste valg er en høj kvalitet antistof med minimal krydsreaktivitet. Som monoklonale antistoffer normalt udviser høj affinitet og specificitet for et enkelt epitop, er de bedste redskaber til at diskriminere et bestemt medlem af en proteinfamilie med høj sekvensidentitet. Imidlertid kan antistoffet / epitop interaktion blive forringet, hvis målepitopen har mistet sin native konformationelle tilstand eller når adgangen til epitopen forhindres af interaktioner med andre proteiner, post-translationelle modifikationer, temperatur, pH, fiksering og saltkoncentration. I sådanne tilfælde polyklonale antistoffer er mere egnede som de genkender flere epitoper af det samme protein. Desuden er de ofte mere stabile end monoklonale antistoffer over en bred vifte af pH og saltkoncentration.Foreløbige undersøgelser skal definere de rette inkuberingsbetingelser, dvs arbejder fortynding (monoklonalt antistof: 5-25 mg / ml, polyklonale antistof: 1,7-15 mg / ml), inkubationstid, fortynder og temperatur, som skal bestemmes empirisk for hver primære antistof. Disse parametre skal være optimeret til at fastlægge de betingelser, der producerer den optimale signal med lav baggrundsstøj. Specificiteten af mærkningen er begunstiget af længere inkubationstider ved lavere temperaturer (dvs.., 4 ° C vs. RT).
Valget til at udføre direkte eller indirekte påvisning ofte afhænger af niveauet af antigen-ekspression. For eksempel kan en overudtrykt epitop simpelthen detekteres med en fluorokromkonjugerede primært antistof, således at en hurtig og enkel flerfarvet farvning og samtidig undgå mulige ikke-specifik baggrund på grund af anvendelsen af et sekundært antistof. , Direkte men hvis Maj genererer et lavt signal til en højere pris, og kan sometimes være vanskeligt, når mærket antistof ikke er kommercielt tilgængelige. Omvendt IIF er mere følsom til at påvise lavere udtrykt epitoper som genererede signal er mere intens på grund af samspillet af mindst to mærkede sekundære antistoffer (dannet mod det primære antistof værtsart) med det primære antistof (forstærkning). Endvidere er en lang række af sekundære antistoffer konjugeret til forskellige fluoroforer er kommercielt tilgængelige, relativt billige, og kvaliteten kontrolleres. Imidlertid kan denne tilgang fremkalde krydsreaktivitet og derfor kræver nøje vælge primære antistoffer, der ikke produceres i den samme art eller af forskellige isotyper, når du udfører flere mærkning eksperimenter. IIF kræver også nogle gange ekstra blokerende trin og skal omfatte systematiske negative kontroller (se nedenfor). Amplifikation kan yderligere opnås ved anvendelse af et biotin-konjugeret sekundært antistof og fluorescensmærket avidin eller streptavidin (fire biotiner bundet pr molecule). Dette forstærkning metode kræver dog yderligere trin for at forhindre ikke-specifik binding og kan ikke tilpasses til farvning af nogle væv (lever, nyre, hjerte, hjerne, lunge og ammende mælkekirtel) på grund af tilstedeværelsen af høje niveauer af endogen biotin . Imidlertid kan endogen biotin blokeres af præinkubering af prøven med avidin og derefter med biotin, før inkubation med det primære antistof. Valget af de konjugerede fluorokromer, som er små kemiske molekyler med egenskaben til at udsende lys, når den exciteres af lys med en kortere bølgelængde, afhænger primært af den type mikroskop udstyr til rådighed.
Ved korrekt formål at begrænse både krydsreaktivitet mellem antistoffer og crossover mellem de spektrale egenskaber af fluorochromer anvendes, immunofluorescens-baserede IHC tillader samtidig visualisering af flere cellulære mål.
Den sidste kritiskepunkt med hensyn IHC forsøg vedrører de positive og negative kontroller, der skal udføres for at støtte gyldigheden af farvning, at identificere eksperimentelle artefakter og til nøjagtig fortolkning af resultaterne. Nogle væv udviser høj fluorescerende baggrund (benævnt autofluorescens), der kunne føre til en fejlfortolkning af resultaterne. Således vævssnit skal overholdes i henhold til både fluorescens og lysfeltbelysning før du starter IHC eksperimentet. En negativ kontrol, der udelader det primære antistof skal systematisk indgå i hvert IHC eksperiment med henblik på at sikre, at en potentiel ikke-specifik binding af det sekundære antistof er ubetydelig og ikke skjule eller ligne specifikke farvningsmønster. En isotypekontrol kan udføres, når der arbejdes med et monoklonalt primært antistof ved at erstatte den med en ikke-immunt antistof af samme isotype (fx IgG1, IgG2a IgG2b, IgM) ved den samme koncentration. Denne kontrol er med til esdet intim den ikke-specifik farvning, hvilket kan skyldes interaktionerne mellem antistoffer med prøven. For at demonstrere den specifikke binding af et antistof til dets antigen, kan opnås en absorption kontrol på to måder ved præ-inkubering det primære antistof: (1) med dens opløselige immunogen (10: 1 molforhold) O / N ved 4 ° C ; og (2) med celler eller vævssektioner, der udtrykker epitopen af interesse, men som adskiller sig fra den undersøgte væv (se for eksempel figur 4B i 59). I begge tilfælde bør den deraf følgende nedbrydning af det primære antistof føre til ringe eller ingen farvning. En anden form for kontrol kan gøres ved hjælp af en irrelevant primært antistof, dvs.., Rettet mod en epitop, der udviser en cellulær lokalisering, der er forskellig fra epitopen af interesse (nuklear vs. cytoplasmatisk). Det irrelevante antistof skal være af samme isotype og art som det primære antistof af interesse. Yderligere kontroller for IHC eksperimenter kan omfatte anvendelse af prøver fra Tissdier vides at udtrykke (transgene dyr) eller ej (knock-out-dyr) epitopen af interesse. Dette kan give en nyttig reference og bidrage til at optimere IHC procedure.
En af de vigtigste begrænsning af IF teknikker er, at de kun kan anvendes på fast (døde) og / eller permeabiliserede celler, både procedure potentielt inducere artefakter. Andre begrænsninger ved denne fremgangsmåde er på grund af anvendelsen af et mikroskop til observation af prøverne. Først da den optiske opløsning på epifluorescens og konfokale mikroskoper er begrænset, placering eller co-location af de fundne proteiner bør ikke overfortolkes. For det andet, fotoblegning, dvs.. fading af fluorescensintensiteten over tid, når de udsættes for lys, skyldes hovedsagelig generering af reaktive oxygenspecies i prøven ved fluorescens excitation, som til gengæld fører til fotokemisk ødelæggelse af fluoroforen. Fotoblegning kan reduceres ved: a) at holde de beskyttede fra prøverlys under IF eksperimentet og opbevaring indtil deres observation; b) anvendelse af et antifade middel (reaktive oxygenarter scavengers) i monteringspositionen medium; c) reduktion af intensiteten og / eller varigheden af excitationslyset; d) forøgelse af koncentrationen af fluoroforer eller ved hjælp af en lav koncentration af et fluorochrom med høj kvanteeffektivitet; og e) under anvendelse af robuste fluoroforer, der er mindre tilbøjelige til at fotoblegning (dvs.. Alexa Fluors, Seta Fluors eller DyLightFluors). For det tredje, autofluorescens er ofte på grund af tilstedeværelsen af flavin coenzymer (FAD og FMN: absorption, 450 nm; emission, 515 nm) og reducerede pyridinnukleotider (NADH: absorption, 340 nm; emission, 460 nm) i pattedyrceller. Endvidere er anvendelsen af aldehyder, især glutaraldehyd, at fastsætte prøverne, kan resultere i høje niveauer af autofluorescens. Dette kan minimeres ved at vaske prøverne med 0,1% natriumborhydrid i PBS forud for antistof inkubering og / eller ved at vælge prober og optiske filtre, maximize fluorescenssignalet i forhold til autofluorescens. For det fjerde, fluorescens overlap (også betegnet gennemblødning, crossover eller krydstale) skyldes primært emissions- spektrale egenskaber af fluoroforer, da de ofte udviser meget brede båndbredder, forskellige, asymmetriske spektrale profiler, samt forskellige peak emissionsbølgelængder og antal maksima. Fluorescens overlap forekommer, når der arbejdes med flere fluoroforer (flerfarvet mærkning) og er kendetegnet ved emission af en fluorofor i kanalen (filter) i en anden fluorofor. Gennemblødning artefakter skal minimeres, da de ofte komplicerer fortolkningen af IF resultater, især i tilfælde af co-lokalisering eller kvantitative undersøgelser. Som afbalancering af fluoroforer emissionen kun kan let forbedres ved IF proceduren, bløder-through kan primært reduceres på tidspunktet for billedet erhvervelse ved hjælp en optimeret fluorescens filtersæt og / eller fotomultiplikator detektor med henblik på korrekt separspiste de spektrale profiler af fluoroforer. I denne henseende konfokal mikroskopi er velegnet til flerfarvet billeddannelse, da det giver mulighed for differentiering fluorescensemissionsspektrer af individuelle fluoroforer ved at dirigere hvert signal til en bestemt påvisning kanal. Desuden konfokal mikroskopi gør det muligt at justere forstærkningen, fotomultiplikator spænding eller laserenergi for de enkelte afsløring kanaler til sekventiel konvertering (kun én fluorofor ad gangen) til etikettering. Ideelt set skal single-label kontrol udføres for at kvantificere gennemblødning og til sidst fjerne det beregningsmæssigt. En kontrol uden sekundære antistoffer (baggrund kontrol) kan fremstilles for at indstille grænserne for signalforstærkning og offset for hver kanal for optimal erhvervelse billede. Den kan også bruges til post-erhvervelse forarbejdning til rigtige billede baggrund (autofluorescens).
Afslutningsvis den beskrevne fremgangsmåde tilvejebringer en enkel standardprotokol for let realizatiEt af immunfarvning på mælkekirtler sektioner. Ikke desto mindre må de vigtigste trin i en IHC forsøg optimeres for hvert antigen / antistof-par med henblik på at visualisere specifik farvning og for at minimere ikke-specifikke baggrundssignaler. Den beskrevne fremgangsmåde indeholder også flere grundlæggende metoder til efterbehandlingen af de fleste af de opnåede billeder. Fluorescens-baseret immunodetektion er en kraftfuld metode med en bred vifte af applikationer fra den cellulære lokalisering af et antigen til diagnosticering. Nye fremskridt i disse tilgange vil blive opnået med den fremtidige udvikling af nye fluoroforer, erhvervelse enheder og mikroskopi teknikker, til billedet tidligere uobserverede detaljer i biologiske strukturer og processer.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Forfatterne erklærer, at de ikke har nogen konkurrerende finansielle interesser.
Acknowledgments
Forfatterne er taknemmelige for INRA MIMA2 imaging core facilitet (INRA, UMR1198, Jouy-en-Josas), og til de ansatte i IERP enhed (UE 0907, INRA, Jouy-en-Josas) til pasning af dyr og faciliteter. Vi vil også gerne takke IH Mather, MC Neville og S. Tooze for at give os meget nyttige antibodie.
Materials
| Name | Company | Catalog Number | Comments |
| Dissection | |||
| Pins | |||
| Ethanol | |||
| Scissors | |||
| Scalpel and adapted blades | |||
| Ice | |||
| Towel paper | |||
| Tissue sample preparation | Company | Catalog Number | Comments/Description |
| Phosphate Buffered Saline (pH7.4) | Sigma | P-3813 | |
| Paraformaldehyde (PFA, 32% EM grade, 100 ml) | Electron Microscopy Sciences | 15714-S | personnal protection equipment required WARNING: this product will expose you to Formaldehyde Gas, a chemical known to cause cancer |
| OCT compound/Tissue Tek | Sakura | 4583 | |
| Sucrose (D-saccharose) | VWR | 27480.294 | |
| Plastic molds | Dominique Dutscher | 39910 | |
| Liquid nitrogen | |||
| Cryostat/sample support | Leica | CM3050S | |
| Razor blades (SEC35) | Thermo Scientific | 152200 | |
| Slide box | |||
| Glass slides Superfrost/Superfrost Ultra Plus | Thermo Scientific | 10143560W90/1014356190 | |
| Brushes | |||
| IHC | Company | Catalog Number | Comments/Description |
| Super Pap Pen | Sigma | Z377821-1EA | |
| Permanent marker (black) | |||
| 50 mM NH4Cl in PBS | Sigma | A-0171 | |
| 0.1 M glycine in PBS | VWR | 24403.367 | |
| Antigen Retrieval solution: Tris 100 mM 5% urea pH9.6 | |||
| Heater (up to 100°C) | |||
| Bovine Serum Albumin (BSA) | Sigma | A7906-100G | |
| Vectashield (anti-fading mounting medium) without DAPI/with DAPI | Vector Laboratories | H-1000/H-1200 | |
| Glass coverslips 22x50mm (microscopy grade) | VWR | CORN2980-225 | |
| Nail polish | |||
| Primary antibodies | Company | Catalog Number | Comments/Description |
| Rabbit anti-mouse caseins (#7781; 1:50 dilution) | generously gifted by M.C. Neville (University of Colorado Health Sciences Center, USA) |
||
| Mouse anti-cytokeratin 8 (CK8, clone 1E8, 1:50 dilution) | Biolegend (Covance) | MMS-162P | |
| Mouse anti-cytokeratin 14 (CK14, cloneLL002, 1:50 dilution) | Thermo Scientific | MS-115-P0/P1 | |
| Rabbit anti-butyrophilin (1:300 dilution) | generously gifted by I.H. Mather (Department of Animal and Avian Sciences University of Maryland College Park, USA) | ||
| Rabbit anti-Stx6 (1:50 dilution) | generously gifted S. Tooze (Cancer Research UK, London Research Institute, London, UK) |
||
| Rabbit anti-VAMP4 (1:50 dilution) | Abcam | ab3348 | |
| Secondary antibodies | Company | Catalog Number | Comments/Description |
| Rhodamine-conjugated goat anti-rabbit IgG (H + L) (1:300 dilution) | Jackson ImmunoResearch Laboratories | 111-025-003 | |
| Counterstains | Company | Catalog Number | Comments/Description |
| Bodipy 493/503 | Life Technologies (Molecular Probes) | D-3922 | |
| DAPI (4-6-diamidino-2-phenylindole) | Life Technologies (Molecular Probes) | D-1306 | |
| Observation/Image capture | Company | Catalog Number | Comments/Description |
| conventional fluorescence microscope | Leica Leitz DMRB microscope |
Standard filters for FITC, Rhodamine and DAPI emissions, ×63 oil-immersion objective (NA 1.3), DP50 imaging camera (Olympus), CellˆF software (Olympus) |
|
| Laser Scanning Microscope (confocal microscopy) | Zeiss LSM 510 microscope |
Plan-Apochromat ×63 oil-immersion objective (NA 1.4), CLSM 510 software, Confocal facilities, MIMA2 Platform, INRA Jouy-en-Josas, France, http://mima2.jouy.inra.fr/mima2) | |
| Image treatment | Company | Catalog Number | Comments/Description |
| ImageJ 1.49k software | Free software |
References
- Watson, C. J., Khaled, W. T. Mammary development in the embryo and adult: a journey of morphogenesis and commitment. Development. , 135-995 (2008).
- Smith, G. H. Experimental mammary epithelial morphogenesis in an in vivo model: evidence for distinct cellular progenitors of the ductal and lobular phenotype. Breast Cancer Res Treat. 39, 21-31 (1996).
- Van Keymeulen, A., et al. Distinct stem cells contribute to mammary gland development and maintenance. Nature. 479, 189-193 (2011).
- Oakes, S. R., Gallego-Ortega, D., Ormandy, C. J. The mammary cellular hierarchy and breast cancer. Cell Mol Life Sci. 71, 4301-4324 (2014).
- Visvader, J. E., Stingl, J. Mammary stem cells and the differentiation hierarchy: current status and perspectives. Genes & development. 28, 1143-1158 (2014).
- Robinson, G. W. Cooperation of signalling pathways in embryonic mammary gland development. Nat Rev Genet. 8, 963-972 (2007).
- Cowin, P., Wysolmerski, J. Molecular mechanisms guiding embryonic mammary gland development. Cold Spring Harb Perspect Biol. 2, a003251 (2010).
- Brisken, C., O'Malley, B. Hormone action in the mammary gland. Cold Spring Harb Perspect Biol. 2, a003178 (2010).
- Gjorevski, N., Nelson, C. M. Integrated morphodynamic signalling of the mammary gland. Nat Rev Mol Cell Biol. 12, 581-593 (2011).
- Daniel, C. W., Smith, G. H. The mammary gland: a model for development. J Mammary Gland Biol Neoplasia. 4, 3-8 (1999).
- Howlett, A. R., Bissell, M. J. The influence of tissue microenvironment (stroma and extracellular matrix) on the development and function of mammary epithelium. Epithelial Cell Biol. 2, 79-89 (1993).
- Edwards, G., Streuli, C. Signalling in extracellular-matrix-mediated control of epithelial cell phenotype. Biochem Soc Trans. 23, 464-468 (1995).
- Hennighausen, L., Robinson, G. W. Think globally, act locally: the making of a mouse mammary gland. Genes & development. 12, 449-455 (1998).
- Topper, Y. J., Freeman, C. S. Multiple hormone interactions in the developmental biology of the mammary gland. Physiol Rev. 60, 1049-1106 (1980).
- Brisken, C., et al. A paracrine role for the epithelial progesterone receptor in mammary gland development. Proc Natl Acad Sci U S A. 95, 5076-5081 (1998).
- Ormandy, C. J., Binart, N., Kelly, P. A. Mammary gland development in prolactin receptor knockout mice. J Mammary Gland Biol Neoplasia. 2, 355-364 (1997).
- Oakes, S. R., Rogers, R. L., Naylor, M. J., Ormandy, C. J. Prolactin regulation of mammary gland development. J Mammary Gland Biol Neoplasia. 13, 13-28 (2008).
- Hennighausen, L., Robinson, G. W. Information networks in the mammary gland. Nat Rev Mol Cell Biol. 6, 715-725 (2005).
- Kouros-Mehr, H., Werb, Z. Candidate regulators of mammary branching morphogenesis identified by genome-wide transcript analysis. Dev Dyn. 235, 3404-3412 (2006).
- Khaled, W. T., et al. The IL-4/IL-13/Stat6 signalling pathway promotes luminal mammary epithelial cell development. Development. 134, 2739-2750 (2007).
- Asselin-Labat, M. L., et al. Gata-3 is an essential regulator of mammary-gland morphogenesis and luminal-cell differentiation. Nat Cell Biol. 9, 201-209 (2007).
- Barcellos-Hoff, M. H., Aggeler, J., Ram, T. G., Bissell, M. J. Functional differentiation and alveolar morphogenesis of primary mammary cultures on reconstituted basement membrane. Development. 105, 223-235 (1989).
- Robinson, G. W., McKnight, R. A., Smith, G. H., Hennighausen, L. Mammary epithelial cells undergo secretory differentiation in cycling virgins but require pregnancy for the establishment of terminal differentiation. Development. 121, 2079-2090 (1995).
- Streuli, C. H., Bissell, M. J. Mammary epithelial cells, extracellular matrix, and gene expression. Cancer Treat Res. 53, 365-381 (1991).
- Streuli, C. H., et al. Laminin mediates tissue-specific gene expression in mammary epithelia. J Cell Biol. 129, 591-603 (1995).
- Boudreau, N., Sympson, C. J., Werb, Z., Bissell, M. J. Suppression of ICE and apoptosis in mammary epithelial cells by extracellular matrix. Science. 267, 891-893 (1995).
- Pullan, S., et al. Requirement of basement membrane for the suppression of programmed cell death in mammary epithelium. J Cell Sci. 109 (Pt 3), 631-642 (1996).
- Schmidhauser, C., Bissell, M. J., Myers, C. A., Casperson, G. F. Extracellular matrix and hormones transcriptionally regulate bovine beta-casein 5' sequences in stably transfected mouse mammary cells. Proc Natl Acad Sci U S A. 87, 9118-9122 (1990).
- Streuli, C. H., et al. Stat5 as a target for regulation by extracellular matrix. J Biol Chem. 270, 21639-21644 (1995).
- Sollner, T., et al. SNAP receptors implicated in vesicle targeting and fusion. Nature. 362, 318-324 (1993).
- Jahn, R., Scheller, R. H. SNAREs--engines for membrane fusion. Nat Rev Mol Cell Biol. 7, 631-643 (2006).
- Weber, T., et al. SNAREpins: minimal machinery for membrane fusion. Cell. 92, 759-772 (1998).
- Sollner, T., Bennett, M. K., Whiteheart, S. W., Scheller, R. H., Rothman, J. E. A protein assembly-disassembly pathway in vitro that may correspond to sequential steps of synaptic vesicle docking, activation, and fusion. Cell. 75, 409-418 (1993).
- McNew, J. A. Regulation of SNARE-mediated membrane fusion during exocytosis. Chem Rev. 108, 1669-1686 (2008).
- Wang, C. C., et al. VAMP8/endobrevin as a general vesicular SNARE for regulated exocytosis of the exocrine system. Mol Biol Cell. 18, 1056-1063 (2007).
- Chat, S., et al. Characterisation of the potential SNARE proteins relevant to milk product release by mouse mammary epithelial cells. Eur J Cell Biol. 90, 401-413 (2011).
- Reinhardt, T. A., Lippolis, J. D. Bovine milk fat globule membrane proteome. J Dairy Res. 73, 406-416 (2006).
- Robenek, H., et al. Butyrophilin controls milk fat globule secretion. Proc Natl Acad Sci U S A. 103, 10385-10390 (2006).
- Fujimoto, T., Ohsaki, Y., Cheng, J., Suzuki, M., Shinohara, Y. Lipid droplets: a classic organelle with new outfits. Histochem Cell Biol. 130, 263-279 (2008).
- Mather, I. H., Keenan, T. W. Origin and secretion of milk lipids. J Mammary Gland Biol Neoplasia. 3, 259-273 (1998).
- Heid, H. W., Keenan, T. W. Intracellular origin and secretion of milk fat globules. Eur J Cell Biol. 84, 245-258 (2005).
- McManaman, J. L., Russell, T. D., Schaack, J., Orlicky, D. J., Robenek, H. Molecular determinants of milk lipid secretion. J Mammary Gland Biol Neoplasia. 12, 259-268 (2007).
- de Assis, S., Warri, A., Cruz, M. I., Hilakivi-Clarke, L. Changes in mammary gland morphology and breast cancer risk in rats. Journal of visualized experiments : JoVE. , (2010).
- Plante, I., Stewart, M. K., Laird, D. W. Evaluation of mammary gland development and function in mouse models. Journal of visualized experiments : JoVE. , (2011).
- Galio, L., et al. MicroRNA in the ovine mammary gland during early pregnancy: spatial and temporal expression of miR-21, miR-205, and miR-200. Physiol Genomics. 45, 151-161 (2013).
- Linzell, J. L., Peaker, M. The effects of oxytocin and milk removal on milk secretion in the goat. J Physiol. 216, 717-734 (1971).
- Knight, C. H., Peaker, M., Wilde, C. J. Local control of mammary development and function. Rev Reprod. 3, 104-112 (1998).
- Walid, M. S., Osborne, T. J., Robinson, J. S. Primary brain sarcoma or metastatic carcinoma? Indian J Cancer. 46, 174-175 (2009).
- Hue-Beauvais, C., et al. Localisation of caveolin in mammary tissue depends on cell type. Cell Tissue Res. 328, 521-536 (2007).
- McManaman, J. L., Neville, M. C. Mammary physiology and milk secretion. Adv Drug Deliv Rev. 55, 629-641 (2003).
- Mather, I. H., Jack, L. J. A review of the molecular and cellular biology of butyrophilin, the major protein of bovine milk fat globule membrane. J Dairy Sci. 76, 3832-3850 (1993).
- Heid, H. W., Winter, S., Bruder, G., Keenan, T. W., Jarasch, E. D. Butyrophilin, an apical plasma membrane-associated glycoprotein characteristic of lactating mammary glands of diverse species. Biochim Biophys Acta. 728, 228-238 (1983).
- Bock, J. B., Klumperman, J., Davanger, S., Scheller, R. H. Syntaxin 6 functions in trans-Golgi network vesicle trafficking. Mol Biol Cell. 8, 1261-1271 (1997).
- Tran, T. H., Zeng, Q., Hong, W. VAMP4 cycles from the cell surface to the trans-Golgi network via sorting and recycling endosomes. J Cell Sci. 120, 1028-1041 (2007).
- Wendler, F., Page, L., Urbe, S., Tooze, S. A. Homotypic fusion of immature secretory granules during maturation requires syntaxin 6. Mol Biol Cell. 12, 1699-1709 (2001).
- Wendler, F., Tooze, S. Syntaxin 6: the promiscuous behaviour of a SNARE protein. Traffic. 2, 606-611 (2001).
- Shitara, A., et al. VAMP4 is required to maintain the ribbon structure of the Golgi apparatus. Mol Cell Biochem. 380, 11-21 (2013).
- Thibault, C., Levasseur, M. C. La reproduction chez les mammifères et l'homme. , INRA Editions. 928 (2001).
- Truchet, S., Wietzerbin, J., Debey, P. Mouse oocytes and preimplantation embryos bear the two sub-units of interferon-gamma receptor. Mol Reprod Dev. 60, 319-330 (2001).



