Summary
De indirecte immunofluorescentie protocol beschreven in dit artikel laat de detectie en de lokalisatie van eiwitten in de muis borstklier. Een complete methode wordt gegeven voor te bereiden borstklier monsters, om immunohistochemie uit te voeren, om de afbeelding van het weefsel secties met behulp van fluorescentie microscopie, en om beelden te reconstrueren.
Abstract
Indirecte immunofluorescentie wordt gebruikt voor het opsporen en lokaliseren eiwitten van belang in een weefsel. De hier gepresenteerde protocol beschrijft een volledige en eenvoudige methode voor het immuunsysteem detectie van eiwitten, de muis lacterende borstklier genomen als voorbeeld. Een protocol voor de voorbereiding van de weefselmonsters, met name met betrekking tot de ontrafeling van de muis borstklier, weefsel fixatie en ingevroren weefsel snijden, zijn gedetailleerd. Een standaard protocol voor indirecte immunofluorescentie voeren, inclusief een optionele antigen retrieval stap wordt gepresenteerd. De waarneming van de gelabelde coupes, alsmede het verwerven en post-behandelingen worden ook vermeld. Deze procedure geeft een volledig overzicht van het verzamelen van dierlijk weefsel om de cellulaire lokalisatie van een eiwit. Hoewel dit algemene werkwijze kan worden toegepast op andere weefselmonsters, moet worden aangepast aan elk weefsel / primair antilichaam paar onderzocht.
Introduction
De borstklier is een atypische zoogdieren exocrine orgaan waarvan de belangrijkste functie is om melk te produceren pasgeborenen te voeden. De ontwikkeling van de borstklier weefsel komt vooral na de geboorte en wordt gekenmerkt door een unieke werkwijze, waarbij het epitheel binnendringt het omliggende stroma. Dit weefsel ondergaat vele veranderingen (groei, differentiatie en regressie), met name tijdens het volwassen leven, gelijktijdig met variaties in voortplantingsstatus (figuur 1). Naast de algemene morfologie van het weefsel was het aantal verschillende celtypen en hun rangschikking in de melkklier drastisch veranderen tijdens de ontwikkeling 1-5.
Tijdens de embryonale leven, de mammaire epitheel afgeleid van mammaire melkleidingen, gedefinieerd door een lichte verdikking en stratificatie van het ectoderm, tussen de voor- en achterpoten aan weerszijden van de middellijn ongeveer embryonale dag 10,5 (E10,5) (Figuur 1A ).Op E11.5, de melk lijn breekt in individuele placodes, die symmetrisch zijn geplaatst langs de borstklier melk lijn op reproduceerbare locaties en de omringende mesenchym begint te condenseren. De placodes beginnen om dieper in de lederhuid en de borstklier mesenchym organiseert in concentrische lagen rond de borstklieren kiem (E12.5-E14.5). Vanaf E15.5, de borstklier epitheel, begint te groeien en te verlengen om de primaire spruit die duwt door de borstklier mesenchym naar het vet pad vormen. De primaire spruit ontwikkelt een hol lumen met een opening aan de huid, gekenmerkt door de vorming van de tepel huls. Op E18.5, heeft het verlengen van duct uitgegroeid tot het vet pad en heeft vertakt in een kleine arborized ductaal systeem omvatte in het vet pad. Ontwikkeling is in wezen gearresteerd en de rudimentaire borstklier blijft morfogenetisch rustig tot de puberteit. In het mannelijke embryo, het activeren van androgene receptoren leidt tot de degeneratie van de knoppen die verdwijnendoor E15.5. Vanaf E18, borstklier ontwikkeling ophoudt tot de puberteit 6-9.
Bij de geboorte, de melkklier herbergt een rudimentaire ductaal systeem dat verlengt en takken langzaam (isometrische groei). Aan het begin van de puberteit, bolvormige structuren op de uiteinden van de kanalen genoemd uiteinde knoppen (Tebs), gevormd uit een buitenlaag van cellen cap en een meerlagig kern van cellen (lichaamscellen). Deze structuren zijn zeer proliferatieve en infiltreren de omringende stromale weefsel in reactie op hormonale signalen. Proliferatie binnen de TEBS resultaten in ductale rek combinatie met vertakkende morfogenese. Dit proces leidt tot de oprichting van een basis epitheliale arborized netwerk afkomstig van de tepel (Figuur 1B, de puberteit). Bij ~ 10-12 weken na de geboorte, wanneer het epitheel van de hele dikke pad is binnengedrongen, stopt en de uitbreiding van de TEBS verdwijnen. Ductaal ontwikkeling ondergaat dynamische veranderingen, dat wil zeggen, Successive proliferatie en regressie van epitheliale cellen volgens oestrische cycli 10 (Figuur 1B, volwassene).
Vanaf het begin van de zwangerschap, het borstweefsel ondergaat belangrijke groei en morfologische veranderingen te bereiden lactatie. De borstklier epitheel uitgebreid prolifereren en differentiëren, leidt tot een sterk vertakte tubulo-alveolaire netwerk. Gelijktijdig, borstklieren epitheelcellen (MEC) worden gepolariseerd en in staat om synthetiseren en uitscheiden melkproducten. MEC organiseren in verschillende celstructuren (acini) die zijn omgeven door contractiele myo cellen en opgenomen in een stroma bestaande uit bind- en vetweefsel, bloedvaten en zenuwuiteinden (Figuur 1B, zwangerschap). Bovendien is de basale zijde van MEC in nauw contact met de basaalmembraan (extracellulaire matrix) en interacties tussen deze twee entiteiten vast te reguleren zowel morfogenese en secretoire functie van het mammary epitheel 11-13.
Al deze werkwijzen vertrouwen op de werking van verschillende omgevingsfactoren, waarvan de belangrijkste zijn hormones14, paracriene factoren en de extracellulaire matrix. Bijvoorbeeld, progesteron veroorzaakt uitgebreide-side vertakking 15 en alveologenesis dat, in combinatie met prolactine (PRL) 16,17 bevordert en handhaaft de differentiatie van de alveoli. Naast steroïden en PRL18, cytokines en signaalwegen geassocieerd met de ontwikkeling (Wnt en Notch signaalroutes) zijn betrokken bij mammaire lineage betrokkenheid en ontwikkeling 19-21. Aan het einde van de zwangerschap, het luminale MEC's beginnen een eiwitrijke melk bekend als biest in het lumen van de alveoli produceren. Bovendien progesteron werkt op de epitheliale permeabiliteit en aangezien de tight junctions nog open is colostrum ook in het maternale bloed.
Na de bevalling, de Mammary epitheel neemt bijna alle borstklier volume en sterk georganiseerd (Figuur 2, borstklier epitheel). Melkproducerende eenheden, namelijk alveoli (figuur 2, alveole), gevormd door een monolaag van gepolariseerde mammaire uitscheidende epitheelcellen (mESCs), met hun apicale plasmamembraan afbakening van het lumen. Alveoli rangschikken zichzelf in lobben die zijn gegroepeerd in lobben verbonden met leidingen die melk weglopen naar buiten milieu (figuur 2, kwab). Borstvoeding optreedt, dwz., MESCs beginnen om overvloedige hoeveelheden melk, voornamelijk veroorzaakt door de daling van de placenta hormonen (voornamelijk progesteron) (Figuur 1B, borstvoeding) afscheiden. Melkeiwitten genen geactiveerd in een gedefinieerde tijd tijdsverloop variërend van zwangerschap tot borstvoeding 9,22,23, vooral in reactie op hypofyse PRL vrijgegeven op het moment van zogen. Gelijktijdig, contacten tussen mESCs en de extracellulaire matrix zowel stimuleren melkeiwit synthesis door de signalen die worden bemiddeld via de interacties tussen cellulaire integrines en laminine 24,25 en onderdrukken apoptose in mESCs 26,27. Deze signaleringsroutes leidt tot activering van melkeiwit genpromoters 28 door de activering van specifieke transcriptiefactoren 29. Cel-cel contacten zijn ook belangrijk voor een aantal aspecten van differentiatie waaronder de oprichting van apicale polariteit en de vectoriële afscheiding van melkproducten. Tight junctions snel sluiten na het begin van de lactatie en mESCs fijn orkestreren de opname van moleculen uit het bloed en de synthese, transport en uitscheiding van melkbestanddelen, in reactie op de voedingsbehoeften van pasgeborenen. Ten tijde van het zuigen, de samentrekking van de myo-epitheliale cellen rondom de alveoli optreedt in reactie op oxytocine en leidt tot melksecretie door de kanalen en naar de tepel. Melk is een complexe vloeistof die eiwitten bevat (meestalcaseïnen), suikers (hoofdzakelijk lactose), lipiden en mineralen, alsmede biologisch actieve moleculen zoals immunoglobulinen A (IgA), groeifactoren en hormonen. Caseïne worden gesynthetiseerd, geassembleerd in supramoleculaire structuren, namelijk caseïne micellen, langs de secretieroute getransporteerd, en vervolgens vrijgegeven door exocytose, dwz de fusie van caseïne bevattende secretorische blaasjes (SV's) met de apicale plasmamembraan van MESC (figuur 2).
Intracellulaire verkeer is gebaseerd op materiële uitwisseling tussen membraneuze compartimenten en het gaat Oplosbare N-ethylmaleïmide-Sensitive Fusion (NSF) Attachment Protein (SNAP) Receptor (SNARE) 30,31. Het SNARE eiwitten familie onderverdeeld in vesiculaire SNAREs (v-SNAREs), aanwezig in het vesicle membraan, en target SNAREs (t-SNAREs), gelokaliseerd op het doel membranen. Door snellen door hun coiled-coil domeinen, v- en t-SNAREs monteren op een zeer stabiele vier-helix bundel te vormen, aangeduid als the SNARE complex. Dit complex bevordert de fusie van twee tegengestelde lipidendubbellagen door hen geleidelijk aan te brengen in de nabijheid 30,32. Daarna worden SNARE complexen gedissocieerd door het NSF adenosinetrifosfatase en de adapter eiwit SNAP en SNARE eiwitten worden teruggevoerd naar hun compartiment van herkomst 33. Interessant is dat elke SNARE eiwit woont voornamelijk in verschillende cellulaire compartimenten en snare paring kan bijdragen aan de specificiteit van intracellulaire fusie gebeurtenissen 34. Eerdere studies suggereren dat tenminste Synaptosomale-geassocieerd eiwit 23 (SNAP23) en bolletjes-geassocieerde membraaneiwit 8 (VAMP8) en syntaxins (Stx) -7 en -12 spelen een rol in caseïne exocytose 35,36. Deze eiwitten zijn ook gevonden in associatie met de lipidefractie van melk, dat wil zeggen, melkvetbolletjes (MFGs) 37. De huidige heersende model stelt dat cytoplasmatische vetdruppels (CLD's) worden gevormd door de ophoping van neutrale lipids (voornamelijk triacylglycerolen en sterolesters) en cholesterol verkregen uit de voeding van de moeder tussen twee bladen van het endoplasmatisch reticulum (ER) membraan 38-41. Grote CLDs worden gevormd, ten minste gedeeltelijk, door de fusie van kleinere CLDs terwijl aan de apicale zijde van mESCs waar ze worden vrijgelaten als MFGs (1-10 um in diameter) door knopvorming vervoerd, wordt omhuld door de MESC apicale plasmamembraan 40-42. Borstvoeding ophoudt nadat pups gespeend en mESCs geleidelijk sterven apoptose leiden tot de regressie van de zoogdierweefsel naar een puberale toestand (figuur 1B, involutie).
Immunofluorescentie (IF) is een gemeenschappelijk analytisch laboratorium methode die wordt gebruikt in bijna alle aspecten van de biologie, zowel in onderzoek en klinische diagnostiek. IF technieken kunnen worden uitgevoerd op weefselcoupes (immunohistochemie, IHC) of cellen (immunocytochemie, ICC) monsters. Deze krachtige aanpak berust op het gebruik van fluorescent-gemerkte antilichamen die specifiek binden (direct of indirect) aan het antigeen van belang, waardoor de visualisatie van de weefselverdeling met fluorescentiemicroscopie. Fluorescentiesignalen vooral afhankelijk van de kwaliteit en concentratie van de antilichamen en juiste hantering van het monster. Een eenvoudige indirecte immunofluorescentie (IIF) protocol wordt voorgelegd aan zuivelproducten (caseïne en MFGs) en eiwitten die betrokken zijn bij melkproduct secretie detecteren (butyrofiline (btn1), snare eiwitten) op bevroren delen van muizen borstweefsel (figuur 3). Hoewel dit protocol een volledig overzicht IHC, van weefselverzameltoestel aan te nabehandeling, kritisch en optionele stappen en enkele technische aanbevelingen worden ook besproken.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
CD1 muizen werden gefokt bij INRA (UE0907 IERP, Jouy-en-Josas, Frankrijk). Alle ethische aspecten van de verzorging van de dieren voldoet aan de relevante richtlijnen en eisen vergunningverlening door het Franse ministerie van Landbouw vastgelegd. De procedures die zijn goedgekeurd door de lokale ethische commissie (overeenkomst 12/097 van de Comethea Jouy-en-Josas / AgroParisTech).
1. borstklier Monstervoorbereiding
- Muis borstklier dissectie
- Euthanaseren muizen op dag 10 van de lactatie door cervicale dislocatie en speld het dier af met zijn buik naar boven.
- Bevochtig het ventrale gebied met ethanol en droog het met een papieren handdoek.
- Met behulp van een tang, trek de buikhuid tussen de beide achterpoten en maak een incisie (alleen via de huid) van ongeveer 1 cm met een scherpe schaar. Uitgaande van deze eerste incisie vervolgens met een schaar om de huid te snijden om de hals van de muis. Trek de huid weg van het buikvlies en pin een kant van de huid tegelijk rekken onderwezen.
- Verzamel de buik en de inguinale melkklieren door op hen van de huid met een wattenstaafje en uiteindelijk trekken of snijden ze weg van het peritoneum.
Opmerking: In deze stap Carmine kleuring om de borstklier epitheel zichtbaar in de gehele klier 43 kan worden uitgevoerd. Deze benadering kan nuttig zijn om de globale morfologie van de borstklier onder verschillende omstandigheden (fysiologisch ontwikkelingsstadia, ziekten, in vivo behandelingen) analyseren. - Verwijder de lymfeklieren gelegen op de kruising van de buik en de inguinale klieren 44.
- Borstklierweefsel fixatie
- Snijd het borstklierweefsel tot 3 mm 3 fragmenten met een scalpel en onmiddellijk deze fragmenten in een fosfaatgebufferde zoutoplossing (PBS), pH 7,4, teneinde zoveel mogelijk melk te verwijderen.
- Snel drogen de fragmenten op een papierenhanddoek en leg ze in een koude PBS-oplossing met 4% paraformaldehyde (PFA, HCHO, 32% formaldehyde-oplossing, OPGELET) gedurende 10 tot 15 minuten op ijs.
Opmerking: deze voldoende daaropvolgende analyse op borstweefsel slices toestaan van IIF36 en / of in situ hybridisatie 45. Aangezien aldehyde fixeermiddelen dringen eerder traag in stukken weefsel (~ 1-3 mm per uur), dit kan worden verlengd tot een optimale fixatie van het weefselmonster waarborgen. Als alternatief, fix weefsels in vivo door perfuseren een verdoofde dier met een fixeeroplossing (niet vermeld in het onderhavige onderzoek).
- Sucrose infusie
- Snel spoel de borstklier fragmenten in koud PBS en dompel ze in een koude PBS oplossing bevattende 40% sucrose (D-saccharose, C12H22O11, Mr 342,3 g / mol) gedurende 16 tot 48 uur bij 4 ° C onder voorzichtig schudden.
- Weefsel inbedding
Opmerking: In deze stap borstklier fragmenten kan worden bijgesneden om kleinere fragmenten (2-3 mm3 maken) Of hun vorm aan te passen.- Juiste label plastic mallen en vul een derde van het volume van de vorm met oktober verbinding gehandhaafd op kamertemperatuur. Plaats een fragment (2-3 mm 3) van borstweefsel per schimmel en bedek het met oktober verbinding.
- Plaats de vormen op het oppervlak van de vloeibare stikstof (op een plaat van aluminium of met een metalen zeef) en laat het product bevriezen.
Opmerking: Het moet stevig en wit voor het onderdompelen van de schimmel in vloeibare stikstof worden.
- Bewaar de ingevroren monsters bij -80 ° C totdat weefselsecties worden uitgevoerd.
2. Ingevroren weefsel Sectioning
Opmerking: een cryostaat, dat in wezen een microtoom in een diepvriezer, moet ingevroren weefselsecties maken. Een lagere temperatuur is vaak nodig voor vet of lipide-rijke weefsels zoals maagdelijke borstklier.
- Regel de temperatuur van de cryostaat tot -26 ° C en wacht tot het heeft stabiseerd. Handhaving van de ingevroren weefsel blok bij -26 ° C gedurende de hele snijden procedure. Absoluut vermijden ontdooien van het weefsel op elk moment tijdens de procedure.
- Koel het scheermesje, de zaagsteun de rolstop en de borstel -26 ° C door ze in de cryostaat ten minste 10 min. Plaats ook een dia doos in de cryostaat om te kunnen glasplaatjes slaan als de secties gemaakt.
- Behoren de objectglaasjes die wordt gebruikt om de weefselsecties te verzamelen en deze handhaven bij KT label; anders weefsel secties zullen niet aan hen. Verwijder het monster uit de matrijs in de cryostaat.
Opmerking: Het gebruik van positief geladen glasplaatjes zal sterk voorstander van de hechting van vers ingevroren weefsel secties als gevolg van hogere elektrostatische aantrekking. - Bedek het oppervlak van een metalen weefsel schijf met oktober verbinding (gehandhaafd bij RT) en druk op de bevroren monster op het. Plaats de natte monteren in de cryostaat en laat het cool gedurende tenminste 15 min.
- Plaats de natte mount op de disc houder van de cryostaat. Pas de cut dikte 5-6 urn en, indien mogelijk, gebruik maken van een nieuw scherp mes of op zijn minst op het blad gebruikt om elk monster omdat sommige weefsels zal snel saai te snijden veranderen de omgeving.
- Pas de positie van de anti-roll-apparaat over de scheermes door bezuinigingen van de montage-medium totdat de plakjes gelijkmatig en correct worden gevormd. In het ideale geval zal de anti-roll-apparaat stap over de scheermesje met ongeveer 1 mm.
- Zodra de instellingen correct zijn, presteren weefsel secties van het wiel in een continue gelijkmatige beweging draaien. Tenzij de temperatuur is ideaal, een sectie weefsel, door de natuur, probeer te krullen.
- Gebruik een borstel te grijpen en manoeuvreren het gedeelte over het podium om het gewenste plaatsen op het glaasje. Gebruik de borstel te ruimen de resten eventueel aanwezig op het bevroren weefsel blok en / of het scheermesje.
- Trekkende sectie weefsel in de richting van de gebruiker en voorkomen dat op het op de cryostaat podium. Vermijd op de weefselsectie naar de cryostaat stadium kan leiden tot de hechting van het weefsel slice op het podium en derhalve het onvermogen om te herstellen met het glaasje.
- Ophalen weefsel secties één voor één door ze op te pakken aan het oppervlak van een glasplaatje, door vast te houden boven de sectie en hengelen het naar beneden naar de sectie weefsel te raken.
Opmerking: Weefselcoupes snel vast te houden aan de warme glas door statische attractie. Als meerdere weefselcoupes op dezelfde dia worden geplaatst, wees voorzichtig om hen niet te overlappen en om ruimte hen genoeg om te kunnen om ze individueel te omsluiten in een hydrofobe cirkel (zie paragraaf 3.1.1.).
3. Indirecte Immunofluorescentie
- Lokaliseren secties
- Gebruik een hydrofobe barrière pen om een hydrofoob cirkel rond-dia gemonteerd weefsel te trekken. Laat de cirkel drogen gedurende ongeveer 1 min bij kamertemperatuur. Trek een lijn rond de tkwestie secties met een fijne zwarte permanente teller ook, maar aan de kant van het glaasje tegenover die waar de weefsel secties.
Opmerking: Deze cirkel is waterafstotend en aceton en alcohol-onoplosbaar. Het geeft ook een barrière voor waterige oplossingen tijdens de IHC procedure en vermindert de hoeveelheid benodigde reagentia. - Hydrateren weefselcoupes door ze te bedekken met een druppel ~ 250 ul PBS gedurende een paar minuten bij kamertemperatuur. Fix weefselcoupes door ze te bedekken met ~ 250 ul van een vers bereide 3% PFA-oplossing in PBS gedurende 10 tot 15 minuten.
Opmerking: Eventueel in dit geval een aldehyde quenching oplossing (50 mM ammoniumchloride (NH4Cl, Mr 53,5 g / mol) in PBS of 0,1 M glycine (C 2 H 5 NO 2, Mr 75,07 g / mol) in PBS ) van de vastlegging reactie te stoppen. Eenvoudige en overvloedige PBS wassen is over het algemeen voldoende om gereageerde aldehyde verwijderen.
- Gebruik een hydrofobe barrière pen om een hydrofoob cirkel rond-dia gemonteerd weefsel te trekken. Laat de cirkel drogen gedurende ongeveer 1 min bij kamertemperatuur. Trek een lijn rond de tkwestie secties met een fijne zwarte permanente teller ook, maar aan de kant van het glaasje tegenover die waar de weefsel secties.
- Antigen retrieval (optioneel)
- Plaats de AR-oplossing (100 mM Tris (C 4 H 11 NO 3, mijnheer 121,14) 5% urea (NH 2 CONH2, Mr 60,06) pH 9,6) in een bekerglas. Het volume van AR-oplossing moet voldoende zijn om de objectglaasjes in een glazen houder volledig dekken.
- Verwarm de AR oplossing 95 ° C door de temperatuur met een thermometer en plaats de objectglaasjes op een geschikte rek, dompel het rek in de warme buffer, deksel om verdamping te beperken en incubeer gedurende 10 min bij 95 ° C.
- Verwijder het bekerglas van het waterbad de glasplaatjes gedurende nog 10 min in buffer.
- Spoel weefsel secties met PBS (~ 250 ul / sectie) en verzadigen ze met een oplossingvan 3% runderserumalbumine (BSA, ~ 250 ul / sectie) in PBS gedurende ten minste 30 min bij kamertemperatuur.
- Zet 30-50 pl van het primaire antilichaam verdund in PBS met 2% BSA op elke weefselsectie.
Opmerking: Dit volume is voldoende om een druppel die volledig bedekt weefselsectie vormen. - Plaats hetzelfde volume van het oplosmiddel (2% BSA in PBS) alleen op een weefselsectie van een negatieve controle zonder primair antilichaam voeren.
- Systematisch deze negatieve controle bij elke IHC experiment uitgevoerd voor elke secundaire antilichaam gebruikt om de achtergrond van het experiment (niet-specifieke labeling vanwege het secundaire antilichaam en / of het weefsel auto-fluorescentie). Andere types van positieve of negatieve controles kunnen worden uitgevoerd om de specificiteit van de etikettering te waarborgen (zie bespreking).
- Plaats de objectglaasjes in een vochtige doos O / N bij 4 ° C.
Opmerking: gebruikte primaire antilichamen waren monoklonaal anti-cytokeratine8 (CK8, 1:50 verdunning), muis monoklonaal anti-cytokeratine 14 (CK14, 1:50 verdunning), konijn polyklonaal anti-muis caseïne (# 7781, 1:50 verdunning, royaal door MC Neville, Universiteit van Colorado Health Sciences Center, CO, USA), konijn polyklonaal anti-btn1 (1: 300 verdunning, royaal door IH Mather, Vakgroep Dierlijke en Avian Wetenschappen, Universiteit van Maryland, College Park, MD, USA), konijn polyklonaal anti-Stx6 ( 1:50 verdunning, royaal voorzien door S. Tooze, Cancer Research UK, London Research Institute, Londen, UK) en konijn polyklonaal anti-VAMP4 (1:50 verdunning). - Grondig weefselsecties met PBS ten minste viermaal gedurende 10 minuten bij kamertemperatuur.
- Verdun het geschikt secundair antilichaam (rhodamine-geconjugeerd geiten anti-konijnen IgG (H + L), 1: 300 verdunning) in PBS met 2% BSA, plaatst 30-50 gl van deze oplossing over alle weefselsecties, en incubeer gedurende 1,5 uur bij kamertemperatuur.
- Aangezien fluorochromen zijn lichtgevoelige moleculen, nietweefselcoupes bloot aan licht tot hun analyse. Voor IIF op weefselcoupes, gunst secundaire antilichamen gekoppeld aan een rode fluorofoor sinds celmembranen hebben de neiging om een groene auto-fluorescentie die kunnen interfereren met lage etikettering genereren. Bovendien kiezen van een rood-fluorofoor gekoppeld secundair antilichaam maakt het gelijktijdige labeling van neutrale lipiden (zie hieronder).
- Grondig wassen weefselsecties met PBS ten minste vier keer gedurende 10 min bij kamertemperatuur.
- Voor sommige experimenten uitgevoerd na fixatie door de monsters te incuberen met 2% PFA verdund in PBS gedurende 10 minuten bij kamertemperatuur om de antigen / antilichaam scaffolds stabiliseren. Echter kan deze stap achterwege blijven in de meeste gevallen.
- Om CLDs en MFGs, kleur neutrale lipiden zichtbaar door incubatie weefselsecties in 30-50 pl van een PBS oplossing met 3 ug / ml BODIPY 493/ 503 gedurende 10 minuten bij kamertemperatuur. Snel spoel weefselcoupes tweemaal met PBS.
- Tegenkleuring nucleair DNA met 30-50 ui van een PBS oplossing die 3 uM DAPI (4-6-diamidino-2-fenylindol, 5 mg / ml voorraadoplossing) gedurende 10 min bij kamertemperatuur. Was de weefselcoupes tweemaal met PBS voor het monteren van de dia's voor observatie.
- Verwijder PBS en een druppel van montage medium op elke weefselsectie.
- Plaats één zijde van het dekglas in een hoek tegen de schuif, waardoor contact met de buitenrand van de vloeibare druppel en de kap langzaam luchtbellen te vermijden. Laat de vloeistof te verspreiden tussen het glas glijbaan en het deksel slip voor een paar minuten en dan verwijder het overschot van de montage medium met een papieren handdoek.
- Dicht de dekglas om het glaasje met nagellak en winkel weefsel secties bij 4 ° C om hun blootstelling aan licht te voorkomen totdat observatie.
4. Fluorescentie observatie en Image Acquisition
Opmerking: Een fluorescentiemicroscoop uitgerust met een camera bestuurd door beeldacquisitie software nodig is om de IHC resultaten observeren.
- Alvorens beelden, controleer dan de intensiteit van de etikettering en de achtergrond van het experiment evalueren door te kijken naar de negatieve controles. Verwerven van foto's van elke fluorescent label (kleurkanaal) afzonderlijk.
- Acquire foto's, inclusief die van de overeenkomstige controles in dezelfde omstandigheden (belichting en algemene instellingen) voor elk kleurkanaal.
- Conventionele microscopie
- Voer epifluorescentie microscopie met een microscoop uitgerust met standaard filters voor fluoresceïne-isothiocyanaat (FITC, groen), rhodamine (rood) en DAPI (blauw) emissies × 20 om 63 (olie-immersie, NA 1,3) doelstellingen en DP50 beeldcamera ×.
- Confocale microscopie
- Voeren confocale microscopie met een Microscope voorzien ZEN software, gebruikt × 20-63 (olie-immersie, NA 1,4) doelstellingen en de 488- en 568-nm excitatie golflengte van de laser ×.
5. Afbeelding Behandeling
Opmerking: Alle het post-behandelingen worden uitgevoerd met behulp van de ImageJ gratis software (http://imagej.nih.gov/ij/).
- Superimpose afbeelding (samen te voegen)
- Open de verworven in elk kanaal dat zal worden gecombineerd (File / Open) beelden. Als het werken met 8-bit grijswaardenafbeeldingen, toeschrijven kunstmatige kleur aan elk kanaal met behulp van de opzoektabel (Afbeelding / Lookup Tables).
- Genereren van de samengestelde afbeelding uit grijswaarden of gekleurde beelden met behulp van het commando "kanalen samenvoegen" (Image / Color / Channels samenvoegen) en vervolgens toeschrijven van een kleur aan elk kanaal.
- Voeren afbeelding stapels superpositie op dezelfde manier door het openen van stapels verworven in elk kanaal dat zal worden gecombineerd (File / Open) en het gebruik van het commando "Merge kanalen &# 8221; (Afbeelding / kleur / Samenvoegen Channels) om een kleur aan elk kanaal toe te schrijven. Sla de samengestelde stack als een sequentie van beelden of een film (zie paragraaf 5.4).
- Afbeelding stapel Z projectie
- Gebruik de Z-projectie-functie (Beeld / Stapel / Zproject, Max Intensity) om een twee-dimensionaal beeld van de foto's van een beeld stack bieden door het projecteren ze langs de as loodrecht op het beeldvlak (z-as). De optie "Maximum Intensity" creëert een beeld waarbij elke pixel bevat de maximale waarde over alle afbeeldingen in de stack. Dit genereert een beeld waardoor de visualisatie van de kleuring waargenomen door de hele afbeeldingsstapel voor een bepaald kanaal of na de superpositie van meerdere kanalen.
- Afbeelding stapel 3D projectie
- Met de 3D projectie commando (Image / stack / 3D project helderste Point, y-as) om een reeks projecties van een draaiende volume genereren op een vlak. De visuele weergave van surfaces en interne structuren is afhankelijk van zowel de projectie methode (dichtste punt, helderste punt (hier wordt gebruikt), of gemiddelde waarde) en de visualisatie parameters geselecteerd. Elk frame van de geanimeerde sequentie het resultaat te projecteren vanuit een andere kijkhoek.
- Draai de gemaakte 3D beeld rond elk van de drie orthogonale assen (de y-as is hier gekozen). Sla de volgorde geproduceerd als een enkel beeld of een film.
- Afbeelding stapel movie conversie
- Open een afbeelding stapel (File / Open) en opslaan als een film in AVI-formaat met behulp van het commando "AVI" (File / Save As / AVI).
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
De borstklier is een klier onderhuids gelegen langs de ventrale constructie van zowel de thorax en de buik bij knaagdieren. De ligging van de vijf paren van klieren van de muis tijdens dracht wordt weergegeven in figuur 4. De morfologie van de melkklier drastisch verandert tijdens de ontwikkeling, hetgeen functionele aanpassingen nodig oog op een volledige lactatie (Figuur 1B). In maagdelijke of nullipaar dieren, de borstklier bestaat uit een dun vertakte ductaal epitheel ingebed in een dunne vette stroma dat moeilijk te zien kunnen zijn. Vanaf het begin van de zwangerschap, de mammaire epitheel prolifereert en expandeert, wat resulteert in grotere borstklieren die gemakkelijker te zien en te verwijderen (Figuur 4). Tijdens lactatie het borstweefsel dikker en witter lijkt door de aanwezigheid van melk. Alleen de buik en lies melkklieren worden verzameld omdat cervicale en thoracale borstklieren glands minder gemakkelijk verwijderd vanwege hun nauwe samenwerking met spieren. Voor sommige experimenten, kunnen pups worden gescheiden van de lacterende vrouwelijke 4-6 uur vóór opoffering om melk secretie door mESCs 46,47 te beperken.
Identificatie van mammaire epitheelcellen en myo
Contractiele myo-epitheliale cellen rondom de alveoli kan worden onderscheiden van luminale mESCs door het gebruik van antilichamen gericht tegen specifieke markers elk van deze celtypen tot expressie. In de borstklier, de huidige markers gebruikte cytokeratines (CK). CK's zijn een grote familie van cytoplasmatische eiwitten die polymeriseren om cytoskelet intermediaire filamenten (10 nanometer in diameter gemiddeld) in epitheliale weefsels vormen. De intermediaire filamenten zijn zeer stabiel en een mechanische ondersteuning voor mobiele architectuur en ordenen weefsels door bij te dragen tot cel-cel adhesie en basale cel-verbindingsweefsel interacties. De subsets van CKs door epitheelcellen tot expressie voornamelijk afhangen van het soort epitheel zijn ontwikkelingsstadium en de differentiatie status. Bovendien geldt dit ook voor de kwaadaardige tegenhangers van het epitheel. Aldus zijn deze merkers eenvoudig en waardevolle instrumenten om celpopulaties te karakteriseren in een weefsel onder fysiologische omstandigheden en worden gebruikt voor tumordiagnose en karakterisering in chirurgische pathologie 48.
In de normale borstklier, kan myo en luminale mESCs cellen worden onderscheiden op basis van hun differentiële expressie van CK14 en CK8 respectievelijk (figuur 5). Deze cytoplasmatische merkers worden gedetecteerd in de mammaire gedeelten van zogende muizen na PFA fixatie en AR. Beelden werden verworven met een conventionele epifluorescentiemicroscoop. CK8 lijkt te zijn verdeeld over het cytoplasma van de luminale mESCs (figuur 5, CK8). Merk op dat de rode achtergrond observerend voor de negatieve controle zonder primair antilichaam (Figuur 5, -Ig1) is vooral door de weefselsectie vouwen, zoals voorgesteld door de blauwe DNA labeling, waarin verschillende lagen nuclei (figuur 5, -Ig1 kernen) weergeeft. CK14 is specifiek waargenomen in vlakke en langwerpige myo-cellen aan de onderkant van de alveoli (figuur 5, CK14). Een andere veel voorkomende manier om myo cellen te identificeren is alfa-gladde spier actine detecteren (a - SMA) zich in deze contractiele cellen (zie figuur 4 in 49).
Detectie van de muis zuivelprodukten
Na de bevalling, de volledig gedifferentieerde mESCs beginnen om overvloedige hoeveelheden melk te produceren. Melkcomponenten worden uitgescheiden door verschillende paden 40,50. Caseïnemicellen worden uitgescheiden door exocytose van Golgi-afgeleide SV, terwijl lipiden worden uitgebracht als MFGs door het ontluiken van de apicale plasma membraan van mESCs (figuur 2, mammaire epitheliale secretoire cel). Voor sommige experimenten, worden de pups gescheiden van het vrouwelijke 4-6 uur voor het verzamelen van de borstklieren, teneinde te vertragen melkafscheiding 46,47. Onder deze omstandigheden kunnen de apicale plasmamembraan van mESCs en de inhoud van het lumen gemakkelijk worden waargenomen, wat niet het geval is bij zogende aangezien alveoli worden samengetrokken en het lumen gesloten. Bovendien vertraagt de afscheiding is ook van essentieel belang bij het bestuderen van eiwitten die betrokken zijn bij mensenhandel membraan zoals SNAREs. Inderdaad, snares cyclus tussen donor en acceptor compartimenten en de subcellulaire lokalisatie moeilijk te bepalen omdat etikettering wordt vaak verspreid als membraan omzet hoog is, bijv. Tijdens zogen. Daarom vertragen de melk secretie door het verwijderen van de pups voorziet juiste omstandigheden de intracellulaire lokalisatie van SNAREs bestuderen wanneer de T- en v-SNAREs voorkeur bevinden de donoren acceptor compartiment, respectievelijk (zie hieronder).
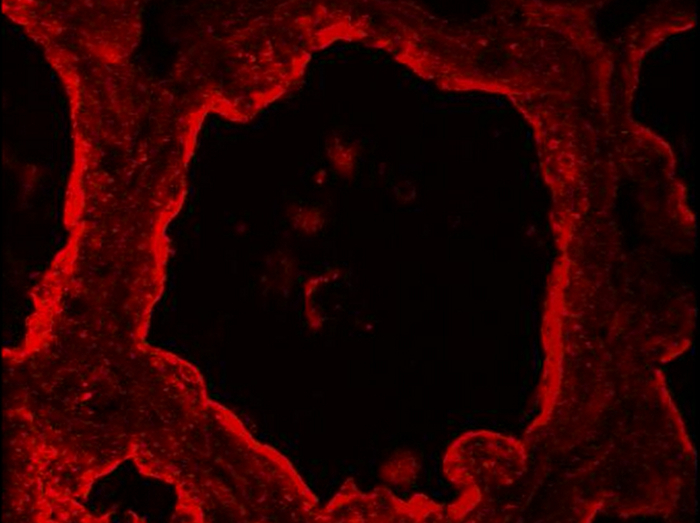
Figuur 6 toont de lokalisatie van caseïnen in lacterende borstklier muizen op dag 10 van de lactatie, met (figuur 6, p +) of afwezigheid (Figuur 6, -p) van pups. Weefsel secties werden beide waargenomen met conventionele epifluorescentie microscopie (de drie kolommen rechts) en confocale microscopie (figuur 6, linkerkolom). Tijdens het zogen, caseïne lijken vooral te worden verzameld in de apicale regio (figuur 6 + p, pijlpunten). Confocale microscopie blijkt dat caseïne ook aanwezig, zij het in mindere mate, aan de basale kant van mESCs in aanwezigheid van pups (figuur 6, + p, pijlen), die niet duidelijk kan worden waargenomen in conventionele microscopie (figuur 6, caseïne, Vergelijk links en rechts panelen). Inderdaad, in wide-field epifluorescentie, de fluorescentie uitgezonden door het monster (achtergrond fluorescence) gaat door de opgewonden volume en verandert de resolutie van de waargenomen in de doelstelling focal plane (out-of-focus fluorescentie) objecten. Dit geldt vooral voor dikke monsters (dikker dan 2 pm). Confocale microscopie maakt het mogelijk om beelden van hoge kwaliteit te verkrijgen van monsters bereid epifluorescentie, de diepte van het veld kan worden gecontroleerd en achtergrondfluorescentie buiten het brandvlak. Bovendien, in aanwezigheid van pups (figuur 6, + p), het lumen van de alveoli vrij gesloten en de apicale zijde mESCs beter waargenomen in afwezigheid van pups (figuur 6, p), wanneer de lumen van de alveoli gedilateerd door ophoping van zuivelproducten. Indien melk uitscheiding vertraagd, caseïnen ook weergegeven geaccumuleerd onder de apicale plasmamembraan (Figuur 6, -p, pijlpunten) en worden duidelijk waargenomen in de basale zijde van mESCs (figuur 6, -p, pijlen). Negatieve controles zonder primaire ANTIBody zijn geen etikettering (figuur 6, -Ig1) niet zien.
Melkproducten kan gemakkelijk worden mede-gedetecteerd door het combineren van IHC voor caseïne en neutrale lipiden tegenkleuring van CLDs en MFGs (figuur 7). Weefsel secties werden afgebeeld als Z-stacks door confocale microscopie, die waren nabehandeld met ImageJ tot Z projecties of 3D-projecties voor elk te produceren (Figuur 7, caseïne, lipiden) of alle kleurkanalen (figuur 7, samen te voegen). Het beeld sequenties geproduceerd zijn opgeslagen als afzonderlijke beelden (figuren 7 en 8) of films (zie aanvullende films).
Hoewel enige labeling werd waargenomen op de basale zijde werd caseïne voornamelijk verzameld op de apicale zijde van mESCs (figuur 7, + p), zoals reeds beschreven bij vrouwen die niet eerder gescheiden pups (figuur 6, p +). CLDs zijn ook voornamelijk gelokaliseerd in het apicale regio mESCs, terwijl grotere geheimed MFGs aanwezig zijn in het lumen van de alveoli. Merk op dat caseïne en MFGs gemakkelijk zichtbaar in het lumen van alveoli in afwezigheid van pups (figuur 7, vergelijk + p en -p). Caseïnes geen co-lokaliseren met CLDs of MFGs in een van deze voorwaarden, aangezien de overlapping van de twee kleuren kanalen produceert geen gele etikettering (figuur 7, foto's samen te voegen). Echter, afbeeldingsstapel nabehandelingen blijkt dat caseïne rond de MFGs uitgescheiden in het lumen van de alveoli, wat suggereert dat deze eiwitten kunnen interageren met de MFG (figuur 7, beelden samenvoegen). Let op het verschil van de door elk nabehandeling gebruikte beelden (figuur 7, vergelijk Zproj en 3D proj per kleurkanaal).
Detectie van butyrofiline, een eiwit marker van MFGs.
Btn1 is een van de belangrijkste eiwitten geassocieerd met MFGs melk 51. Dit transmembraan eiwit mainly gelokaliseerd op het apicale plasmamembraan van de mESCs en derhalve gevonden op het oppervlak van de MFG na vrijgave door knopvorming 52. Figuur 8 toont aan dat op dag 10 van de melkproductie, btn1 hoofdzakelijk gelokaliseerd op het apicale plasmamembraan en, mindere mate, in het apicale gebied van mESCs. Btn1 omringt ook de in het lumen van de longblaasjes evenals enkele van de apicale CLDs (Figuur 8, 3D proj merge, pijlpunten) MFGs. De resultaten worden weergegeven als één afbeelding uit het verkregen beeld Z-stack (figuur 8, beeld) of als een 3D beeld gegenereerd met 3D projectie bevel ImageJ, zoals hierboven beschreven (figuur 8, 3D proj) beschreven. Merk op dat een enkel beeld voldoende is om de apicale verdeling van het eiwit, maar de ruimtelijke associatie van btn1 met afgescheiden MFGs of apicale CLDs wordt alleen waargenomen na 3D reconstructie van de Z-stack acht kan worden (Figuur 8 vergelijkt het btn1 en 3D proj merge pictgelen). De Z-stack kan worden gereconstrueerd als een film naar een betere ruimtelijke weergave van de verdeling van het eiwit te geven. Het beeld Z-stack alleen verworven voor btn1 (aanvullende filmpjes 1 en 3) of bovenop met de twee andere kleur kanalen (samenvoegen, Aanvullende films 2 en 4) worden weergegeven als voorbeelden. De Z-stack kan worden gelezen beeld-voor-beeld van boven naar beneden (aanvullend films 1 en 2) of als een roterende view (y-as) van het 3D-projectie van de gehele afbeeldingsstapel (aanvullend films 3 en 4 ).
Detectie van twee SNARE eiwitten: Stx6 en VAMP4
Zoals eerder vermeld, SNAREs zijn membraangebonden eiwitten die cyclus tussen donor en acceptor membranen. Het is daarom beter om te vertragen membraan omzet geassocieerd met de hoge afscheidingsactiviteit van mESCs door het scheiden van de vrouwtjes van pups voor het verzamelen van de melkklier bij het bestuderendeze eiwitten. Stx6 en VAMP4 zijn beide beschreven als zijnde geassocieerd met het trans-Golgi netwerk 53,54. Echter, deze SNARE eiwitten ook op het niveau van de andere cellulaire compartimenten een belangrijke rol spelen, zoals de secretiegranula (Stx6) 55,56 en het Golgi-apparaat (VAMP4) 57. Vorige studies suggereren dat SNARE eiwitten die een rol spelen in caseïne secretie 35,36. Tijdens de lactatie, Stx6 en VAMP4 bevinden zich in de sub-apicale regio mESCs. Stx6 waargenomen tussen de kern en het apicale membraan van MEC's, die overeenkomen met de Golgi en het trans-Golgi netwerk (figuur 9, Stx6), en is ook aanwezig, zij het in mindere mate, op caseïnebevattende SV's 36. VAMP4 is ook gelokaliseerd in het sub-apicale regio mESCs, maar de labeling lijkt meer punctata en wordt geaccumuleerd onder de apicale plasmamembraan (Figuur 9, VAMP4) vanwege zijn associatie met zowel CLDs en caseïne-containing SVs 36. Negatieve controle zonder primaire antilichaam geen aanleiding tot de etikettering te geven.

Figuur 1. Mouse ontwikkeling van de borstklier tijdens de embryonale en volwassen leven. (A) De muis melkklieren beginnen te ontwikkelen rond embryonale dag 10 (E10) van de ectodermale (lichtblauw) melkleidingen (roze). Bij E11.5, placodes vormen symmetrisch langs de borstklier melk lijn en de omringende mesenchym (donkerblauw) begint te condenseren. De placodes invaginate aan knoppen (E12.5-E14.5) en, op E15.5 vormen, de borstklier epitheel (roze), vermenigvuldigen en te verlengen tot de primaire spruit die duwt door de borstklier mesenchym naar het vet pad vormen (lichtgroen ). Een holle lumen vormt en opent tot de nippel (paarse) werd verkregen. Op E18.5, de mammaire epitheel vormt een rudimentary vertakte structuur verbonden met de buitenwereld. Aangepast van 6 met toestemming van Macmillan Publishers Ltd: Nature Reviews Genetics, auteursrecht 2007. (B) Tijdens de puberteit, de borstklier epitheel (paars) gaat een belangrijke groeifase (uitgebreide rek, splitsing en laterale vertakking). Bij het begin van de zwangerschap, uitgebreid en snelle proliferatie en vertakking side optreden, waardoor de aanzienlijke uitbreiding van het mammaire epitheel, die volledig valt de hele uiervet pad. De borstklieren epitheel bereikt een zeer gedifferentieerde functionele toestand tijdens de lactatie bij luminaal mESCs afscheiden van grote hoeveelheden melk. Wanneer borstvoeding ophoudt na het spenen, de melkklier involutes. MESCs worden verwijderd door apoptose en fagocytose, wat leidt tot het verdwijnen van de lobulo-celstructuren die worden vervangen door vetweefsel. Aangepast van schema 1 van http://brisken-lab.epfl.ch/research en hoofdstuk 2.2. http://tvmouse.ucdavis.edu/bcancercd/22/index.html. Klik hier om een grotere versie van deze figuur te bekijken.
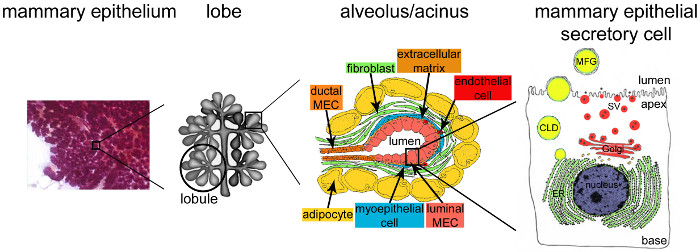
Figuur 2. Architectuur van de melkklier tijdens lactatie. Tijdens lactatie volledig ontwikkelde en hoogst vertakt epitheel (paarse) verantwoordelijk voor de overgrote meerderheid van het borstweefsel. De epitheelweefsel wordt gevormd door tubulo-celstructuren ingebed in een stroma dat verschillende celtypes (fibroblasten, adipocyten, gladde spiercellen, bloed- en lymfevaten en zenuwuiteinden) bevat. MESCs zijn georganiseerd in acinaire structuren of longblaasjes, geassembleerd in melkklieren die lobben vormen. Elk alveolus is een functioneel melkproducerende eenheid die verbonden is met een sterk vertakt netwerk van lobulaire en interlobulaire kanalen, waardoor de melk wordt dgeregend naar buiten. Elke alveole wordt begrensd door een monolaag van gepolariseerde mESCs de apicale zijde die grenst aan een centraal lumen. De basale kant van de mESCs staat in nauw contact met een extracellulaire matrix en contractiele myo cellen. Melkproducten worden vrijgegeven aan de apicale kant van mESCs. Major melk (caseïne) worden uitgescheiden als caseïnemicellen (zwarte punten) door exocytose van Golgi-afgeleide secretie blaasjes (SV), terwijl lipiden vrijkomen als melk vetbolletjes (MFGs) door het ontluiken van de apicale plasmamembraan van mESCs. CLD: cytoplasma lipide druppel; ER: endoplasmatisch reticulum; MEC: borstklieren epitheelcellen. Aangepast van hoofdstuk 2.2. http://tvmouse.ucdavis.edu/bcancercd/22/index.html., Fig. 02 www.cellbiol.net/ste/alpHERCEPTIN1.php, Fig. 26-02 in 58 en 50. Klik hier om een grotere versie van deze figuur te bekijken.
.Binnen-page = "always"> 

Figuur 3. Experimentele procedure om indirecte immunofluorescentie op bevroren delen van de muis borstklieren voeren. De borstklier wordt verzameld uit een CD1 vrouwelijke muis op dag 10 van de lactatie. Het borstklierweefsel wordt in kleine fragmenten die worden gefixeerd met paraformaldehyde en geïnfundeerd in sucrose voordat ingebed in OCT-verbinding en snel bevroren. De borstklier monsters worden vervolgens in dunne vriescoupes en verwerkt voor IIF door opeenvolgende incubatie met primaire en fluorochroom-geconjugeerde secundaire antilichamen respectievelijk. Na montage, worden monsters geanalyseerd met een fluorescentiemicroscoop, waardoor de overname van beelden die vervolgens nabehandeld kan worden./53179/53179fig3large.jpg "Target =" _ blank "> Klik hier om een grotere versie van deze figuur te bekijken.

. Figuur 4. anatomische locatie van de muis melkklieren Links: ventrale aanzicht van de muis uier in de late dracht stadium. Rechts: lokalisatie en aspect van de borstklier in het late stadium van de zwangerschap van de muis. Merk op dat tijdens lactatie, de melkklieren zijn dikker en witter lijken door de aanwezigheid van melk in de alveoli. Aangepast van http://ctrgenpath.net/static/atlas/mousehistology/Windows/femaleu/mousemammgldiagram.html en http://www.pathbase.net/Necropsy_of_the_Mouse/index.php?file=Chapter_3.html. Klik hier om bekijk een grotere versie van deze figuur.
-together.within-page = "always"> 
Figuur 5. Identificatie van de luminale epitheliale cellen en basale myo-cellen in de muis borstklier. Luminal mESCs en myo-cellen worden geïdentificeerd door IIF in de muizen mammaire klier op dag 10 van de lactatie, op basis van hun expressie van CK-8 en CK-14 , respectievelijk. Nucleair DNA werd gekleurd met DAPI (blauw). Beelden werden verworven met een conventionele epifluorescentiemicroscoop. De samengestelde afbeelding (samenvoegen) toont de overlapping van de etikettering die overeenkomt met caseïne (rood) en kernen (blauw), respectievelijk. -Ig1, Negatieve controle zonder primaire antilichaam. Sterretjes geven lumen. Schaal bar = 100 micrometer. Klik hier om een grotere versie van deze figuur te bekijken.
e 6 "src =" / files / ftp_upload / 53.179 / 53179fig6.jpg "/>
Figuur 6. Cellulaire lokalisatie van caseïnen in de muizen mammaire klier. Caseïnes worden gedetecteerd door IIF in de muis borstklier op dag 10 van de lactatie. De borstklier werd verzameld van vrouwen in de aanwezigheid (+ p) of de afwezigheid (-p) van de pups. Beelden werden verworven met een conventionele (rechter paneel, caseïne, kernen en samen te voegen) of een confocale (caseïne (rood), linker paneel) fluorescentie microscoop. In beide omstandigheden worden caseïnen (rood) gedetecteerd in het topgebied (pijlpunten) en meer of minder bij de basale van mESCs (pijlen). Negatieve controles zonder primaire antilichamen geen etikettering (-Ig1) tonen. Nucleair DNA wordt gekleurd met DAPI (blauw). De samengestelde afbeelding (samenvoegen) toont de overlapping van de etikettering die overeenkomt met caseïne (rood) en kernen (blauw), respectievelijk. Sterretjes geven lumen. Schaal bar = 100 micrometer voor epifluorescentie beelden (rechter paneel, caseïne, kernen, samenvoegen) en = 10 &# 181; m. Voor confocale beelden (linkerkolom) Klik hier om een grotere versie van deze figuur te bekijken.
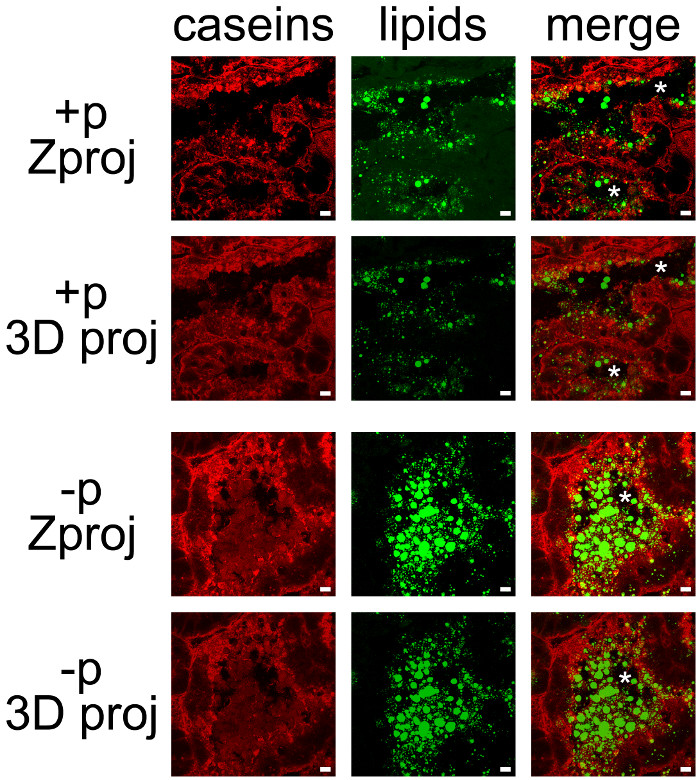
Figuur 7. Cellulaire lokalisatie van zuivelproducten in de muis borstklier. Caseïnes (rood) worden gedetecteerd door IIF in de muis borstklier op dag 10 van de lactatie in de aanwezigheid (+ p) of in de afwezigheid (-p) van de pups. Neutrale lipiden (CLDs en MFGs) worden tegengekleurd met BODIPY 493/503 (groen). De samengestelde beelden (merge) tonen de superpositie van de twee labelings. Beelden werden verworven als Z-stacks met een confocale microscoop. Z-stacks werden nabehandeld met ImageJ Z uitsteeksels (Zproj) of 3D projecties (y-as) (3D proj) van de volledige stapels in elk kanaal zowel (samenvoegen) te genereren. Sterretjes geven lumen. Schaalbalk= 10 pm. Klik hier om een grotere versie van deze figuur te bekijken.

Figuur 8. Cellulaire lokalisatie van butyrofiline en lipiden in de muis borstklier. Btn1 (rood) wordt gedetecteerd door IIF in muizen mammaire klier op dag 10 van de lactatie bij afwezigheid van de pups. Neutrale lipiden (CLDs en MFGs) en nucleair DNA worden tegengekleurd met BODIPY 493/503 (groen) en DAPI (blauw), respectievelijk. Beelden werden verworven met een confocale microscoop als het Z-stacks. De resultaten worden weergegeven als een enkel beeld uit het beeld stack (afbeelding, btn1, lipiden, kernen en samen te voegen) of na een nabehandeling met ImageJ tot een 3D-weergave (y-as) van de hele afbeelding stapel genereren (3D proj, btn1 , lipiden, kernen, samen te voegen). De samengestelde beelden (merge) tonen desuperpositie van de drie kleurkanalen. -Ig1, Negatieve controle zonder primaire antilichaam. Sterretjes geven lumen. Schaal bar = 10 micrometer. Klik hier om een grotere versie van deze figuur te bekijken.

Figuur 9. Cellulaire lokalisatie van twee SNARE eiwitten in de muis borstklier. Syntaxin 6 (Stx6) en VAMP4 (V4) worden gedetecteerd door IIF in de muis borstklier op dag 10 van de lactatie. Beelden werden verworven met een conventionele (conv) epifluorescentie of confocale (LSM) microscoop. De samengestelde beelden (samenvoegen) tonen de superpositie van het etiket waargenomen voor elke SNARE eiwitten (rood) en nucleair DNA tegengekleurd met DAPI (false groene kleur), respectievelijk. -Ig1, Negatieve controle zonder primaire antilichaam. Asterisks geven lumen. Schaal bar = 10 micrometer voor confocale beelden en = 100 micrometer voor epifluorescentie foto's. Klik hier om een grotere versie van deze figuur te bekijken.


Tabel 1. Immunohistochemie Problemen oplossen.

Aanvullende film 1. Lokalisatie van butyrofiline in de muis borstklier. Btn1 (rood) wordt gedetecteerd door IIF in de muis borstklier op dag 10 van de lactatie. Beelden werden verworven met een co nfocal microscoop als Z-stack en nabehandeld met ImageJ om een film te genereren. De Z-stack wordt gelezen van boven naar beneden. Klik hier om deze video te bekijken.

Aanvullende film 2. Lokalisatie van butyrofiline en neutrale lipiden in de muis borstklier. Btn1 (rood) wordt gedetecteerd door IIF in de muis borstklier op dag 10 van de lactatie. Neutrale lipiden (CLDs en MFGs) en nucleair DNA worden tegengekleurd met BODIPY 493/503 (groen) en DAPI (blauw), respectievelijk. Beelden werden verworven met een confocale microscoop als een Z-stack voor elke kleur kanaal en waren nabehandeld met ImageJ om een samengestelde Z-stack die de drie kleurkanalen superponeert genereren. De resulterende samengestelde Z-stack wordt gelezen van boven naar beneden.https://www.jove.com/files/ftp_upload/53179/supvid2.mp4 "target =" _ blank "> Klik hier om deze video te bekijken.
Aanvullende film 3. Lokalisatie van butyrofiline in de muis borstklier. Btn1 (rood) wordt gedetecteerd door IIF in de muis borstklier op dag 10 van de lactatie. Beelden werden verworven met een confocale microscoop als een Z-stack en nabehandeld met ImageJ (3D projectie) naar een roterende (y-as) te genereren ruimtelijke weergave van de btn1 etikettering. Klik hier om deze video te bekijken.

Aanvullende film 4. Lokalisatie van butyrofiline en neutrale lipiden in de muis mammary klier. btn1 (rood) wordt gedetecteerd door IIF in de muis borstklier op dag 10 van de lactatie. Neutrale lipiden (CLDs en MFGs) en nucleair DNA worden tegengekleurd met BODIPY 493/503 (groen) en DAPI (blauw), respectievelijk. Beelden werden verworven met een confocale microscoop als een Z-stack voor elke kleur kanaal en waren nabehandeld met ImageJ om een samengestelde Z-stack die de drie kleurkanalen superponeert genereren. ImageJ (3D projectie) werd verder gebruikt om een roterende (y-as) te genereren ruimtelijke weergave van de samengestelde Z-stack. Klik hier om deze video te bekijken.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
IHC is een relatief eenvoudige en eenvoudige experimentele methode om antigeen in weefselcoupes, die vooral afhankelijk specifiek epitoop-antilichaam interacties te lokaliseren. Hoewel een groot aantal protocollen worden gebruikt om een proteïne te lokaliseren door IIF, de kern van deze procedures is vrijwel altijd gelijk. Er zijn echter enkele kritische aspecten die sterk kunnen beïnvloeden het resultaat en moet dus worden geoptimaliseerd voor elke afzonderlijke IHC studie. De meest uitdagende aspect van deze benadering is de beste experimentele voorwaarden vast, dwz., Die het genereren van een sterk en specifiek signaal voor het antigeen van belang. De variabelen die moeten worden beschouwd voor experimentele ontwerp en optimalisatie zijn: (1) het type antigen (species, expressieniveaus, subcellulaire locatie); (2) de epitoop type (opeenvolging, bouw, vermeende post-translationele modificaties); (3) monstervoorbereiding (inbedding in paraffine of voor bevroren secties); (4) de fixatie method (perfusie of onderdompeling); (5) het fixatief (formaldehyde, alcohol of aceton); (6) het blokkerende reagens (normaal serum, BSA of vetvrije melk); (7) de AR stap; (8) de detectiewerkwijze (direct of indirect); (8) het soort primaire antilichaam (monoklonaal of polyklonaal); (9) het secundaire antilichaam (soorten en label); (10) counterstains (nucleaire en / of andere cellulaire compartiment etikettering); en (11) de montage medium (zie tabel 1 voor details). De fixatie en blokkering treden, ten minste voor het optimaliseren van andere factoren zoals de concentratie, pH, temperatuur, incubatietijd en verdunningsmiddel.
De cruciale eerste aspect betrekking op de bereiding van weefselmonsters, die nauw samenhangt met de fixatiemethode, wat op zijn beurt invloed op de kwaliteit van de resultaten. Zo kan weefselstukken worden vastgesteld of niet voorafgaand aan het inbedden. Deze stap kan ook afhangen van de integratiemethode gekozen, dat wil zeggen, oktober samengestelde vs. inbedden in paraffineDie zich soms afhangt van het primaire antilichaam gebruikt. Weefsel fixatie kan in vivo worden uitgevoerd door perfuseren een verdoofde dier met een fixeeroplossing. Deze werkwijze is nuttig om antigenen te behouden bij het bestuderen intact weefsels maar niet voldoende om het weefsel van belang te fixeren. In dit geval kunnen kleine stukken weefsel (niet dikker dan 10 mm) worden ondergedompeld in de fixeeroplossing. Ingevroren weefsel kan worden bereid door het onderdompelen van het weefsel in vloeibare stikstof of isopentaan en snap-invriezen wordt sterk aanbevolen voor de daaropvolgende detectie van posttranslationele modificaties zoals fosforylering. Anders dan in paraffine ingebed weefsel, bevriezen is niet geschikt voor langdurig behoud van het weefsel door de vorming van ijskristallen in de cellen die subcellulaire morfologie kunnen veranderen. Eenmaal gesneden, kunnen ingevroren weefsel secties worden opgeslagen bij -80 ° C gedurende maximaal 1 jaar. In elk geval is de bereiding van de weefselmonsters is een compromis tussen het behoud van de weefsel/ cellulaire architectuur en het behoud van de integriteit epitoop.
Omdat het verandert de chemische samenstelling van weefsels, is het essentieel om de fixatie te optimaliseren om zowel onvolledige (onder fixatie) en overdreven (overfixation) fixatie te vermijden.
Inderdaad kan underfixation het specifieke signaal verminderen door bevordering van de proteolytische afbraak van bepaalde antigenen. Anderzijds kan overfixation specifieke labeling wijzigen door het maskeren van de epitoop of het genereren van een sterke niet-specifieke achtergrond. Dus naast de keuze van de fixeeroplossing, andere parameters zoals de incubatietijd, de temperatuur en de pH wordt weefsel fixatie beïnvloeden. Hoewel PFA is de meest voorkomende fixeermiddel voor IHC kan niet worden beschouwd als een "universeel" fixeermiddel. PFA induceert eiwit-eiwit en eiwit-nucleïnezuur verknopingen en kan dus artefactually het epitoop (overfixation) wijzigen en vervolgens het voorkomen recognition het primaire antilichaam. Echter, de epitoop verder worden ontmaskerd door AR technieken (zie hieronder). PFA kan eveneens ongeschikt voor de detectie van bepaalde antigenen, zoals is aangetoond dat de translocatie van bepaalde gefosforyleerde eiwitten induceren van het membraan naar het cytoplasma. In dergelijke gevallen moet PFA worden vervangen door geschikte alternatieve fixatieven zoals alcohol. Anders dan PFA, hebben alcoholen zoals methanol of ethanol niet epitopen maskeren omdat hierdoor weefsel fixatie door het vervangen van watermoleculen in weefsels. Dit kan leiden tot de precipitatie van de eiwitten en voorkomen antilichaam / epitoop interactie als gevolg van conformatieveranderingen. Het wordt algemeen gedacht dat alcohol niet doordringen en zodoende niet weefselmorfologie niet zo goed te bewaren als PFA. Aceton is een ander alternatief fixatief, dat vaak wordt gebruikt bij het werken met niet vastgelegde, snap-ingevroren weefsel secties. Echter, aceton is een sterk dehydratatiemiddel en kan leiden tot irreversibele precipitatie van weefseleiwitten.
Voor bepaalde antigenen, mogelijk extra stap AR vereist een goed signaal te krijgen, vooral als het fixeermiddel induceert conformationele verandering of verandert de elektrostatische lading van het epitoop (maskeren van de epitoop). AR werkwijzen beogen deze processen tegengesteld aan de immunoreactiviteit van het epitoop en de daaropvolgende interactie met het primaire antilichaam te herstellen. AR methoden voornamelijk gebaseerd op twee benaderingen: (1) protease-geïnduceerde epitoop, dat wil zeggen met enzymen zoals proteïnase K, trypsine of pepsine, waarbij peptiden die de epitoop masker splitsen; en (2) warmte-geïnduceerde epitoop, dat wil zeggen, met behulp van een magnetron, een snelkookpan, plantaardige stoomboten, autoclaven of waterbaden. Deze laatste benadering is bijzonder tijd-, temperatuur-, buffers en pH-gevoelig, en de optimale omstandigheden moet empirisch worden bepaald (een voorbeeld is in het protocol). Alternatief kan de affiniteit van een antilichaam voor het antigeen worden verbeterddoor het veranderen van de pH of het kation concentratie van het antilichaam verdunningsmiddel.
Een permeabilisatie stap is soms nodig om een goed signaal te krijgen voor een intracellulaire epitoop in dikke weefselcoupes, met name voor nucleair antigen kleuring. Dit kan op verschillende manieren worden bereikt door: (1) alcoholen of aceton als fixeermiddelen; of (2) detergentia zoals Triton, NP-40 (0,1-0,2% in PBS, 10 min), digitonine, saponine of Tween 20 (0,2-0,5% gedurende 10 tot 30 min) na PFA fixatie. De keuze van het reinigingsmiddel hangt af van de cellulaire locatie van het gedetecteerde epitoop. Inderdaad, agressieve detergentia zoals Triton-X100, die cellulaire membranen oplosbaar, geschikt voor detectie nucleaire epitoop, maar kan leiden tot verandering van de winning van bepaalde membraneuze eiwitten signaleren. Het gebruik van mildere reinigingsmiddelen (saponine en Tween 20) zijn geschikt voor de detectie van cytoplasmatische epitopen.
De tweede belangrijke stap is de blocking niet-specifieke kleuring. De binding van een antilichaam aan zijn doel epitoop wordt geregeld door intermoleculaire krachten (bijvoorbeeld hydrofobe en ionische interacties, waterstofbinding). Aldus kan interactie van primaire en / of secundaire antilichamen met andere eiwitten dan de doel-antigenen leiden tot niet-specifieke kleuring. Dit veroorzaakt hoge achtergrond fluorescentie, die de visualisatie van het eiwit van belang (lage signaal / ruisverhouding) voorkomt. Blocking reagens vermindert niet-specifieke interacties, zonder afbreuk antilichaam / epitoop interactie. Een gemeenschappelijke procedure bestaat uit incubatie van weefsel secties met warmte geïnactiveerd normaal serum of BSA. Bij gebruik van een normaal serum, moet het van dezelfde soort als die van het gastheerdier van het secundaire antilichaam of een niet verwante species. In alle gevallen moet de gekozen blokkerende reagens worden toegevoegd aan de verdunningsmiddelen voor de primaire en secundaire antilichamen. Bovendien is het gebruik van niet-ionische detergentia zoals Triton X-100, Tween 20 of saponine helpt om niet-specifieke interacties te verminderen.
De derde en waarschijnlijk meest belangrijke parameter is de primaire selectie en optimalisatie antilichaam. Uiteraard is de beste keuze is een hoogwaardig antilichamen met minimale kruisreactiviteit. Monoklonale antilichamen vertonen gewoonlijk een hoge affiniteit en specificiteit voor een epitoop, zij het beste hulpmiddelen om een bepaald lid van een eiwitfamilie hoge sequentie-identiteit discrimineren. Echter, het antilichaam / epitoop interactie worden aangetast indien de doelepitoop zijn natuurlijke conformationele toestand uitvalt of de toegang tot het epitoop wordt voorkomen door interacties met andere eiwitten, post-translationele modificaties, temperatuur, pH, fixatie en zoutconcentratie. In dergelijke gevallen, polyklonale antilichamen zijn geschikt als zij erkennen meerdere epitopen van hetzelfde eiwit. Bovendien zijn ze vaak stabieler zijn dan monoklonale antilichamen over een breed traject van pH en zoutconcentratie.Voorlopige studies hebben de juiste incubatie-omstandigheden, dat wil zeggen, werkverdunning (monoklonaal antilichaam: 5-25 mg / ml polyklonaal antilichaam: 1,7-15 mg / ml) te bepalen, incubatietijd, verdunningsmiddel en temperatuur, waarvan empirisch bepaald te worden elke primaire antilichaam. Deze parameters worden geoptimaliseerd om de omstandigheden die optimale signaal met lage achtergrond ruis te bepalen. De specificiteit van de etikettering wordt begunstigd door langere incubatietijden bij lagere temperaturen (bijv., 4 ° C versus RT).
De keuze om directe of indirecte detectie uitvoeren vaak afhankelijk van de mate van antigen expressie. Bijvoorbeeld kan een sterk tot expressie epitoop eenvoudig worden gedetecteerd met een fluorochroom-geconjugeerd primair antilichaam, waardoor een snelle en eenvoudige multicolor kleuring met vermijding van mogelijke niet-specifieke achtergrond door het gebruik van een secundair antilichaam. Echter, direct IF mei genereert een laag signaal op een hogere kosten, en kan sometimes moeilijk, wanneer gelabeld antilichaam niet in de handel verkrijgbaar. Omgekeerd IIF gevoeliger lagere uitgedrukt epitopen detecteren het gegenereerde signaal intenser vanwege de interactie van ten minste twee gelabelde secundaire antilichamen (opgewekt tegen het primaire antilichaam gastheersoort) met het primaire antilichaam (amplificatie). Bovendien is een groot aantal secundaire antilichamen geconjugeerd aan verschillende fluoroforen zijn commercieel verkrijgbaar, relatief goedkoop en kwaliteit gecontroleerd. Echter, deze benadering kruisreactiviteit induceren en vereist dus zorgvuldig kiezen primaire antilichamen die niet worden geproduceerd in dezelfde soort of van verschillende isotypen bij het uitvoeren van meerdere-labeling experimenten. IIF soms ook vereist extra blokkerende stappen en moeten systematisch negatieve controles (zie hieronder) bevatten. Amplificatie kan verder worden bereikt door een biotine-geconjugeerd secundair antilichaam en fluorescent gelabelde avidine of streptavidine (vier biotins gebonden per molecule). Toch Deze amplificatie werkwijze vereist extra stappen om niet-specifieke binding te voorkomen en kunnen niet worden aangepast voor het kleuren van sommige weefsels (lever, nier, hart, hersenen, longen en lacterende borstklier) door de aanwezigheid van hoge niveaus van endogeen biotine . Toch kunnen endogeen biotine worden geblokkeerd door pre-incuberen van het monster met avidine en vervolgens biotine vóór incubatie met het primaire antilichaam. De keuze van de geconjugeerde fluorochromen, die kleine chemische moleculen met de eigenschap om licht bij excitatie met licht van een kortere golflengte, voornamelijk afhankelijk van het type microscoop uitrusting.
Indien juist ontworpen om kruisreactiviteit tussen antilichamen en de crossover van de spectrale eigenschappen van de gebruikte fluorochromen beperken immunofluorescentie-gebaseerde IHC maakt de gelijktijdige weergave van meerdere cellulaire doelwitten.
De laatste kritiekepunt met betrekking tot IHC experimenten betreft de positieve en negatieve controles die worden uitgevoerd om de geldigheid van kleuring ondersteunen experimentele artefacten identificeren en de nauwkeurige interpretatie van de resultaten. Sommige weefsels vertonen een hoge fluorescente achtergrond (aangeduid als autofluorescentie) die kunnen leiden tot een verkeerde interpretatie van de resultaten. Aldus weefsel secties onder zowel fluorescentie en bright-field verlichting worden waargenomen voordat de IHC experiment. Een negatieve controle die het primaire antilichaam weggelaten systematisch Bij elk experiment IHC zodat mogelijke niet-specifieke binding van het secundaire antilichaam is verwaarloosbaar en niet overdekt of lijken op de specifieke kleuring patroon. Een isotype controle kan worden uitgevoerd bij het werken met een monoklonaal primair antilichaam te vervangen door een niet-immune antilichaam van hetzelfde isotype (bijvoorbeeld, IgG1, IgG2a IgG2b, IgM) en dezelfde concentratie. Deze regeling helpt om esschattingen maken de niet-specifieke kleuring, wat kan worden veroorzaakt door de interactie van antilichamen met het monster. Om de specifieke binding van een antilichaam aan een antigeen tonen, kan een absorptie control op twee manieren worden bereikt door pre-incuberen van het primaire antilichaam: (1) met zijn oplosbaar immunogeen (10: 1 molaire verhouding) O / N bij 4 ° C ; en (2) met cellen of weefselcoupes die het epitoop van belang uitdrukken, maar die verschillen van de onderzochte weefsel (zie bijvoorbeeld figuur 4B in 59). In beide gevallen moet het daaruit voortvloeiende afname van het primaire antilichaam leiden tot weinig of geen vlekken. Een ander type regeling kan worden uitgevoerd met een irrelevant primair antilichaam, bijv., Gericht tegen een epitoop dat een cellulaire lokalisatie die verschilt van het epitoop van belang (nucleaire versus cytoplasmatische) vertoont. Het irrelevant antilichaam moet van hetzelfde isotype en species als het primaire antilichaam van belang. Extra knoppen voor IHC experimenten omvatten het gebruik van monsters van TissUE bekend te drukken (transgene dieren) of niet (knock-out dieren) de epitoop van belang. Dit kan een nuttige referentie te geven en helpen om de IHC procedure te optimaliseren.
Een belangrijke beperking van IF techniek is dat ze alleen kunnen worden toegepast op vaste (dood) en / of permeabel cellen, zowel procedure inducerende potentieel artefacten. Andere beperkingen van deze benadering door het gebruik van een microscoop voor de waarneming van de monsters. Ten eerste, zoals de optische resolutie van epifluorescentie en confocale microscopen is beperkt, locatie of co-locatie van de gedetecteerde eiwitten mag niet over-geïnterpreteerd. Ten tweede, fotobleken, dwz. verkleuring van de fluorescentie-intensiteit in de tijd bij blootstelling aan licht, in hoofdzaak als gevolg van vorming van reactieve zuurstof species in het monster fluorescentie bij excitatie die op zijn beurt leidt tot de fotochemische afbraak van de fluorofoor. Fotobleken kan worden verminderd door: a) het houden van de beschermde uit monsterslicht tijdens de IF experiment en opslag totdat hun waarneming; b) met behulp van een antifade middel (reactive oxygen species scavengers) in het fixeermiddel; c) het verminderen van de intensiteit en / of duur van het excitatielicht; d) verhogen van de concentratie van fluoroforen of met een lage concentratie van een fluorochroom met een hoog kwantumrendement; en e) het gebruik van robuuste fluoroforen die minder gevoelig zijn voor fotobleken (bijv. Alexa Fluors, Seta Fluors of DyLightFluors). Ten derde autofluorescentie wordt vaak veroorzaakt door de aanwezigheid van flavine co-enzymen (FAD en FMN: absorptie, 450 nm, emissie 515 nm) en verminderde pyridine nucleotiden (NADH: absorptie, 340 nm, emissie 460 nm) in zoogdiercellen. Verder is het gebruik van aldehyden, vooral glutaaraldehyde, de monsters bevestigen, kan tot hoge mate van autofluorescentie. Dit kan worden geminimaliseerd door het wassen van de monsters met 0,1% natriumboorhydride in PBS vóór antilichaam incubatie en / of door sensoren en optische filters dat maximize de fluorescentie-signaal ten opzichte van de autofluorescentie. Ten vierde fluorescentie overlap (ook wel doorbloeding, crossover of overspraak) is hoofdzakelijk te wijten aan de emissie spectrale eigenschappen van de fluoroforen ze vertonen vaak zeer brede bandbreedtes, verschillend, asymmetrische spectrale profielen, alsmede diverse piek emissiegolflengte en het aantal maxima. Fluorescentie overlap optreedt bij het werken met verschillende fluoroforen (multicolor etikettering) en wordt gekenmerkt door de emissie van een fluorofoor in het kanaal (filter) van een andere fluorofoor. Bloeden-through artefacten moeten worden geminimaliseerd omdat ze vaak bemoeilijken de interpretatie van IF resultaten, met name in het geval van co-lokalisatie of kwantitatieve studies. Balancering van de fluoroforen emissie slechts licht kan worden verbeterd door de IF procedure doorbloeding kan hoofdzakelijk ten tijde van beeldacquisitie verminderd door een geoptimaliseerd fluorescentie filtersets en / of fotomultiplier detector om goed SEPARat de spectrale profielen van de fluoroforen. In dit opzicht confocale microscopie is goed geschikt voor multicolor beeldvorming omdat zij de differentiatie fluorescentie-emissiespectra van individuele fluoroforen door het richten elk signaal een bepaalde detectiekanaal. Bovendien confocale microscopie stelt de gain, fotomultiplier voltage of laservermogen voor de afzonderlijke detectie kanalen voor de sequentiële acquisitie (één fluorofoor tegelijk) van het etiket aanpassen. Idealiter moet single-label controles worden uitgevoerd om de doorbloeding te kwantificeren en uiteindelijk verwijderen computationeel. Een controle zonder secundaire antilichamen (achtergrond controle) kan bereid zijn om de grenzen van de signaalversterking te stellen en offset van elk kanaal voor optimaal beeld acquisitie. Het kan ook gebruikt worden voor post-acquisitie verwerking correct achtergrondafbeelding (autofluorescentie).
Concluderend, de beschreven werkwijze een eenvoudige standaard protocol voor eenvoudige realizatieen van immunokleuring op borstklier secties. Niettemin moet de hoofdstappen van een IHC experiment worden geoptimaliseerd voor elk antigeen / antilichaam paar om specifieke kleuring visualiseren en niet- specifieke achtergrondsignalen te minimaliseren. De beschreven werkwijze omvat ook een aantal elementaire werkwijzen voor de nabehandeling van de meeste van de verkregen beelden. Op fluorescentie gebaseerde immunodetectie is een krachtige methode met een breed scala aan toepassingen van de cellulaire lokalisatie van een antigeen voor diagnose. Nieuwe ontwikkelingen in deze benaderingen zal worden bereikt met de toekomstige ontwikkeling van nieuwe fluoroforen, acquisitie apparatuur en microscopische technieken, om de afbeelding eerder onopgemerkte details van biologische structuren en processen.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
De auteurs verklaren dat ze geen concurrerende financiële belangen.
Acknowledgments
De auteurs zijn dankbaar voor de INRA MIMA2 imaging kernfaciliteit (INRA, UMR1198, Jouy-en-Josas) en aan het personeel van de IERP eenheid (UE 0907, INRA, Jouy-en-Josas) voor dierlijke zorg en voorzieningen. We willen ook graag IH Mather, MC Neville en S. Tooze bedanken voor ons zeer nuttig antibodie.
Materials
| Name | Company | Catalog Number | Comments |
| Dissection | |||
| Pins | |||
| Ethanol | |||
| Scissors | |||
| Scalpel and adapted blades | |||
| Ice | |||
| Towel paper | |||
| Tissue sample preparation | Company | Catalog Number | Comments/Description |
| Phosphate Buffered Saline (pH7.4) | Sigma | P-3813 | |
| Paraformaldehyde (PFA, 32% EM grade, 100 ml) | Electron Microscopy Sciences | 15714-S | personnal protection equipment required WARNING: this product will expose you to Formaldehyde Gas, a chemical known to cause cancer |
| OCT compound/Tissue Tek | Sakura | 4583 | |
| Sucrose (D-saccharose) | VWR | 27480.294 | |
| Plastic molds | Dominique Dutscher | 39910 | |
| Liquid nitrogen | |||
| Cryostat/sample support | Leica | CM3050S | |
| Razor blades (SEC35) | Thermo Scientific | 152200 | |
| Slide box | |||
| Glass slides Superfrost/Superfrost Ultra Plus | Thermo Scientific | 10143560W90/1014356190 | |
| Brushes | |||
| IHC | Company | Catalog Number | Comments/Description |
| Super Pap Pen | Sigma | Z377821-1EA | |
| Permanent marker (black) | |||
| 50 mM NH4Cl in PBS | Sigma | A-0171 | |
| 0.1 M glycine in PBS | VWR | 24403.367 | |
| Antigen Retrieval solution: Tris 100 mM 5% urea pH9.6 | |||
| Heater (up to 100°C) | |||
| Bovine Serum Albumin (BSA) | Sigma | A7906-100G | |
| Vectashield (anti-fading mounting medium) without DAPI/with DAPI | Vector Laboratories | H-1000/H-1200 | |
| Glass coverslips 22x50mm (microscopy grade) | VWR | CORN2980-225 | |
| Nail polish | |||
| Primary antibodies | Company | Catalog Number | Comments/Description |
| Rabbit anti-mouse caseins (#7781; 1:50 dilution) | generously gifted by M.C. Neville (University of Colorado Health Sciences Center, USA) |
||
| Mouse anti-cytokeratin 8 (CK8, clone 1E8, 1:50 dilution) | Biolegend (Covance) | MMS-162P | |
| Mouse anti-cytokeratin 14 (CK14, cloneLL002, 1:50 dilution) | Thermo Scientific | MS-115-P0/P1 | |
| Rabbit anti-butyrophilin (1:300 dilution) | generously gifted by I.H. Mather (Department of Animal and Avian Sciences University of Maryland College Park, USA) | ||
| Rabbit anti-Stx6 (1:50 dilution) | generously gifted S. Tooze (Cancer Research UK, London Research Institute, London, UK) |
||
| Rabbit anti-VAMP4 (1:50 dilution) | Abcam | ab3348 | |
| Secondary antibodies | Company | Catalog Number | Comments/Description |
| Rhodamine-conjugated goat anti-rabbit IgG (H + L) (1:300 dilution) | Jackson ImmunoResearch Laboratories | 111-025-003 | |
| Counterstains | Company | Catalog Number | Comments/Description |
| Bodipy 493/503 | Life Technologies (Molecular Probes) | D-3922 | |
| DAPI (4-6-diamidino-2-phenylindole) | Life Technologies (Molecular Probes) | D-1306 | |
| Observation/Image capture | Company | Catalog Number | Comments/Description |
| conventional fluorescence microscope | Leica Leitz DMRB microscope |
Standard filters for FITC, Rhodamine and DAPI emissions, ×63 oil-immersion objective (NA 1.3), DP50 imaging camera (Olympus), CellˆF software (Olympus) |
|
| Laser Scanning Microscope (confocal microscopy) | Zeiss LSM 510 microscope |
Plan-Apochromat ×63 oil-immersion objective (NA 1.4), CLSM 510 software, Confocal facilities, MIMA2 Platform, INRA Jouy-en-Josas, France, http://mima2.jouy.inra.fr/mima2) | |
| Image treatment | Company | Catalog Number | Comments/Description |
| ImageJ 1.49k software | Free software |
References
- Watson, C. J., Khaled, W. T. Mammary development in the embryo and adult: a journey of morphogenesis and commitment. Development. , 135-995 (2008).
- Smith, G. H. Experimental mammary epithelial morphogenesis in an in vivo model: evidence for distinct cellular progenitors of the ductal and lobular phenotype. Breast Cancer Res Treat. 39, 21-31 (1996).
- Van Keymeulen, A., et al. Distinct stem cells contribute to mammary gland development and maintenance. Nature. 479, 189-193 (2011).
- Oakes, S. R., Gallego-Ortega, D., Ormandy, C. J. The mammary cellular hierarchy and breast cancer. Cell Mol Life Sci. 71, 4301-4324 (2014).
- Visvader, J. E., Stingl, J. Mammary stem cells and the differentiation hierarchy: current status and perspectives. Genes & development. 28, 1143-1158 (2014).
- Robinson, G. W. Cooperation of signalling pathways in embryonic mammary gland development. Nat Rev Genet. 8, 963-972 (2007).
- Cowin, P., Wysolmerski, J. Molecular mechanisms guiding embryonic mammary gland development. Cold Spring Harb Perspect Biol. 2, a003251 (2010).
- Brisken, C., O'Malley, B. Hormone action in the mammary gland. Cold Spring Harb Perspect Biol. 2, a003178 (2010).
- Gjorevski, N., Nelson, C. M. Integrated morphodynamic signalling of the mammary gland. Nat Rev Mol Cell Biol. 12, 581-593 (2011).
- Daniel, C. W., Smith, G. H. The mammary gland: a model for development. J Mammary Gland Biol Neoplasia. 4, 3-8 (1999).
- Howlett, A. R., Bissell, M. J. The influence of tissue microenvironment (stroma and extracellular matrix) on the development and function of mammary epithelium. Epithelial Cell Biol. 2, 79-89 (1993).
- Edwards, G., Streuli, C. Signalling in extracellular-matrix-mediated control of epithelial cell phenotype. Biochem Soc Trans. 23, 464-468 (1995).
- Hennighausen, L., Robinson, G. W. Think globally, act locally: the making of a mouse mammary gland. Genes & development. 12, 449-455 (1998).
- Topper, Y. J., Freeman, C. S. Multiple hormone interactions in the developmental biology of the mammary gland. Physiol Rev. 60, 1049-1106 (1980).
- Brisken, C., et al. A paracrine role for the epithelial progesterone receptor in mammary gland development. Proc Natl Acad Sci U S A. 95, 5076-5081 (1998).
- Ormandy, C. J., Binart, N., Kelly, P. A. Mammary gland development in prolactin receptor knockout mice. J Mammary Gland Biol Neoplasia. 2, 355-364 (1997).
- Oakes, S. R., Rogers, R. L., Naylor, M. J., Ormandy, C. J. Prolactin regulation of mammary gland development. J Mammary Gland Biol Neoplasia. 13, 13-28 (2008).
- Hennighausen, L., Robinson, G. W. Information networks in the mammary gland. Nat Rev Mol Cell Biol. 6, 715-725 (2005).
- Kouros-Mehr, H., Werb, Z. Candidate regulators of mammary branching morphogenesis identified by genome-wide transcript analysis. Dev Dyn. 235, 3404-3412 (2006).
- Khaled, W. T., et al. The IL-4/IL-13/Stat6 signalling pathway promotes luminal mammary epithelial cell development. Development. 134, 2739-2750 (2007).
- Asselin-Labat, M. L., et al. Gata-3 is an essential regulator of mammary-gland morphogenesis and luminal-cell differentiation. Nat Cell Biol. 9, 201-209 (2007).
- Barcellos-Hoff, M. H., Aggeler, J., Ram, T. G., Bissell, M. J. Functional differentiation and alveolar morphogenesis of primary mammary cultures on reconstituted basement membrane. Development. 105, 223-235 (1989).
- Robinson, G. W., McKnight, R. A., Smith, G. H., Hennighausen, L. Mammary epithelial cells undergo secretory differentiation in cycling virgins but require pregnancy for the establishment of terminal differentiation. Development. 121, 2079-2090 (1995).
- Streuli, C. H., Bissell, M. J. Mammary epithelial cells, extracellular matrix, and gene expression. Cancer Treat Res. 53, 365-381 (1991).
- Streuli, C. H., et al. Laminin mediates tissue-specific gene expression in mammary epithelia. J Cell Biol. 129, 591-603 (1995).
- Boudreau, N., Sympson, C. J., Werb, Z., Bissell, M. J. Suppression of ICE and apoptosis in mammary epithelial cells by extracellular matrix. Science. 267, 891-893 (1995).
- Pullan, S., et al. Requirement of basement membrane for the suppression of programmed cell death in mammary epithelium. J Cell Sci. 109 (Pt 3), 631-642 (1996).
- Schmidhauser, C., Bissell, M. J., Myers, C. A., Casperson, G. F. Extracellular matrix and hormones transcriptionally regulate bovine beta-casein 5' sequences in stably transfected mouse mammary cells. Proc Natl Acad Sci U S A. 87, 9118-9122 (1990).
- Streuli, C. H., et al. Stat5 as a target for regulation by extracellular matrix. J Biol Chem. 270, 21639-21644 (1995).
- Sollner, T., et al. SNAP receptors implicated in vesicle targeting and fusion. Nature. 362, 318-324 (1993).
- Jahn, R., Scheller, R. H. SNAREs--engines for membrane fusion. Nat Rev Mol Cell Biol. 7, 631-643 (2006).
- Weber, T., et al. SNAREpins: minimal machinery for membrane fusion. Cell. 92, 759-772 (1998).
- Sollner, T., Bennett, M. K., Whiteheart, S. W., Scheller, R. H., Rothman, J. E. A protein assembly-disassembly pathway in vitro that may correspond to sequential steps of synaptic vesicle docking, activation, and fusion. Cell. 75, 409-418 (1993).
- McNew, J. A. Regulation of SNARE-mediated membrane fusion during exocytosis. Chem Rev. 108, 1669-1686 (2008).
- Wang, C. C., et al. VAMP8/endobrevin as a general vesicular SNARE for regulated exocytosis of the exocrine system. Mol Biol Cell. 18, 1056-1063 (2007).
- Chat, S., et al. Characterisation of the potential SNARE proteins relevant to milk product release by mouse mammary epithelial cells. Eur J Cell Biol. 90, 401-413 (2011).
- Reinhardt, T. A., Lippolis, J. D. Bovine milk fat globule membrane proteome. J Dairy Res. 73, 406-416 (2006).
- Robenek, H., et al. Butyrophilin controls milk fat globule secretion. Proc Natl Acad Sci U S A. 103, 10385-10390 (2006).
- Fujimoto, T., Ohsaki, Y., Cheng, J., Suzuki, M., Shinohara, Y. Lipid droplets: a classic organelle with new outfits. Histochem Cell Biol. 130, 263-279 (2008).
- Mather, I. H., Keenan, T. W. Origin and secretion of milk lipids. J Mammary Gland Biol Neoplasia. 3, 259-273 (1998).
- Heid, H. W., Keenan, T. W. Intracellular origin and secretion of milk fat globules. Eur J Cell Biol. 84, 245-258 (2005).
- McManaman, J. L., Russell, T. D., Schaack, J., Orlicky, D. J., Robenek, H. Molecular determinants of milk lipid secretion. J Mammary Gland Biol Neoplasia. 12, 259-268 (2007).
- de Assis, S., Warri, A., Cruz, M. I., Hilakivi-Clarke, L. Changes in mammary gland morphology and breast cancer risk in rats. Journal of visualized experiments : JoVE. , (2010).
- Plante, I., Stewart, M. K., Laird, D. W. Evaluation of mammary gland development and function in mouse models. Journal of visualized experiments : JoVE. , (2011).
- Galio, L., et al. MicroRNA in the ovine mammary gland during early pregnancy: spatial and temporal expression of miR-21, miR-205, and miR-200. Physiol Genomics. 45, 151-161 (2013).
- Linzell, J. L., Peaker, M. The effects of oxytocin and milk removal on milk secretion in the goat. J Physiol. 216, 717-734 (1971).
- Knight, C. H., Peaker, M., Wilde, C. J. Local control of mammary development and function. Rev Reprod. 3, 104-112 (1998).
- Walid, M. S., Osborne, T. J., Robinson, J. S. Primary brain sarcoma or metastatic carcinoma? Indian J Cancer. 46, 174-175 (2009).
- Hue-Beauvais, C., et al. Localisation of caveolin in mammary tissue depends on cell type. Cell Tissue Res. 328, 521-536 (2007).
- McManaman, J. L., Neville, M. C. Mammary physiology and milk secretion. Adv Drug Deliv Rev. 55, 629-641 (2003).
- Mather, I. H., Jack, L. J. A review of the molecular and cellular biology of butyrophilin, the major protein of bovine milk fat globule membrane. J Dairy Sci. 76, 3832-3850 (1993).
- Heid, H. W., Winter, S., Bruder, G., Keenan, T. W., Jarasch, E. D. Butyrophilin, an apical plasma membrane-associated glycoprotein characteristic of lactating mammary glands of diverse species. Biochim Biophys Acta. 728, 228-238 (1983).
- Bock, J. B., Klumperman, J., Davanger, S., Scheller, R. H. Syntaxin 6 functions in trans-Golgi network vesicle trafficking. Mol Biol Cell. 8, 1261-1271 (1997).
- Tran, T. H., Zeng, Q., Hong, W. VAMP4 cycles from the cell surface to the trans-Golgi network via sorting and recycling endosomes. J Cell Sci. 120, 1028-1041 (2007).
- Wendler, F., Page, L., Urbe, S., Tooze, S. A. Homotypic fusion of immature secretory granules during maturation requires syntaxin 6. Mol Biol Cell. 12, 1699-1709 (2001).
- Wendler, F., Tooze, S. Syntaxin 6: the promiscuous behaviour of a SNARE protein. Traffic. 2, 606-611 (2001).
- Shitara, A., et al. VAMP4 is required to maintain the ribbon structure of the Golgi apparatus. Mol Cell Biochem. 380, 11-21 (2013).
- Thibault, C., Levasseur, M. C. La reproduction chez les mammifères et l'homme. , INRA Editions. 928 (2001).
- Truchet, S., Wietzerbin, J., Debey, P. Mouse oocytes and preimplantation embryos bear the two sub-units of interferon-gamma receptor. Mol Reprod Dev. 60, 319-330 (2001).



