Summary
פרוטוקול immunofluorescence העקיף המתואר במאמר זה מאפשר זיהוי והלוקליזציה של חלבונים בבלוטת החלב עכבר. שיטה שלמה ניתן להכין דגימות בלוטת החלב, לבצע אימונוהיסטוכימיה, לתמונת סעיפי רקמות על ידי מיקרוסקופ פלואורסצנטי, ולשחזר תמונות.
Abstract
immunofluorescence העקיף משמש כדי לזהות ולאתר חלבוני עניין ברקמה. הפרוטוקול המובא כאן מתאר שיטה שלמה ופשוטה לגילוי חיסוני של חלבונים, העכבר המניקים בלוטת החלב שנלקח כדוגמא. פרוטוקול להכנת דגימות הרקמה, במיוחד בנוגע לנתיחה של בלוטת החלב עכבר, קיבעון רקמות וחתך רקמה קפוא, מפורט. פרוטוקול סטנדרטי לבצע immunofluorescence העקיף, כולל שלב אחזור אנטיגן אופציונאלי, מוצג גם. ההתבוננות בסעיפי הרקמות שכותרתו כמו גם רכישת תמונה ופוסט-טיפולים גם מוצגים. הליך זה נותן סקירה מלאה, מהאוסף של רקמת חיה ללוקליזציה הסלולרית של חלבון. למרות ששיטה כללית זה יכול להיות מיושמת על דגימות רקמה אחרות, זה צריך להיות מותאם לכל זוג נוגדן רקמה / העיקרית למד.
Introduction
בלוטת החלב היא איבר אקסוקרינית יונקים טיפוסי שעיקר תפקידו הוא לייצר חלב כדי להאכיל תינוקות. הפיתוח של רקמת השד מתרחש בעיקר לאחר לידה ומאופיינת בתהליך ייחודי שבו האפיתל פולש סטרומה שמסביב. רקמה זו עוברת שינויים רבים (צמיחה, בידול ורגרסיה), במיוחד במהלך החיים הבוגרים, במקביל עם וריאציות במצב פוריות (איור 1). בנוסף למורפולוגיה הכוללת של הרקמה, פרופורציות סוגי תאים שונים, כמו גם ההסדר שלהם בתוך בלוטת החלב של לשנות באופן דרמטי במהלך פיתוח 1-5.
במהלך חיים עובריים, אפיתל החלב נובע מהקווים חלב החלב, אשר מוגדרים על ידי עיבוי וריבוד קל של האאקטודרם, בין הגפיים הקדמי ואחוריים בכל צד של קו האמצע סביב יום עוברי 10.5 (E10.5) (איור 1 א ).על E11.5, קו חלב שובר לתוך placodes הבודד, אשר ממוקמים באופן סימטרי לאורך קו חלב החלב במקומות לשחזור, וmesenchyme מסביב מתחיל להתעבות. Placodes מתחיל לשקוע עמוק יותר לתוך הדרמיס וmesenchyme החלב מארגן בשכבות קונצנטריות סביב ניצן החלב (E12.5-E14.5). נכון לE15.5, האפיתל החלב, מתחיל להתרבות ולהאריך כדי ליצור את הנבט הראשוני שדוחף דרך mesenchyme החלב לכרית השומן. הנבט הראשוני מתפתח לומן חלול עם פתיחה לעור, מסומנת על ידי ההיווצרות של נדן הפטמה. על E18.5, צינור ההארכה גדל לתוך כרית השומן ומסועף למערכת ductal arborized קטנה הקיפה בכרית השומן. פיתוח הוא למעשה נעצר ובלוטת החלב הבסיסית נשארה morphogenetically שקטה עד גיל ההתבגרות. בעובר ממין זכר, ההפעלה של קולטני אנדרוגן מובילה לניוון של הניצנים, שייעלמועל ידי E15.5. נכון לE18, פיתוח החלב מפסיק עד גיל ההתבגרות 6-9.
בלידה, בלוטת החלב מטפחת מערכת ductal בסיסית שמתארכת וסניפים לאט (צמיחת איזומטרי). בתחילת גיל התבגרות, מבנים כדוריים הממוקמים בקצוות של הצינורות הנקראים ניצני מסוף הסוף (TEBs), נוצרים משכבה חיצונית של תאי כובע וליבה רב שכבתית פנימית של תאים (תאי גוף). מבנים אלה הם שגשוג ביותר ולחדור לרקמות שמסביב סטרומה בתגובה לאותות הורמונליים. הפצת נשק בתוך תוצאות TEBs בהתארכות ductal, בשילוב עם הסתעפות המורפוגנזה. תהליך זה מוביל להקמתה של רשת arborized אפיתל בסיסית הנובעת מהפטמה (איור 1, גיל ההתבגרות). ב ~ 10-12 שבועות לאחר הלידה, כאשר האפיתל פלש כל כרית השומן, הרחבתה עוצרת ונעלמת TEBs. פיתוח ductal אז עובר שינויים דינמיים, כלומר, successiיש התפשטות ונסיגה של תאי האפיתל על פי מחזורי ייחום 10 (איור 1, מבוגר).
מתחילת ההריון, רקמת החלב עוברת צמיחה חשובה ושינויים מורפולוגיים להתכונן להנקה. אפיתל החלב בהרחבה להתרבות ולהבדיל, שמוביל לרשת tubulo-alveolar מסועף מאוד. במקביל, תאי אפיתל החלב (MECs) הפכו מקוטבים ומסוגלים לסנתז ולהפריש מוצרי חלב. MECs לארגן למבנים רבים מכתשיים (acini) שמוקפים בתאי myoepithelial התכווצות והתאגד בסטרומה המורכבת מרקמות חיבור ושומן, כלי דם ומסוף עצב (איור 1, הריון). יתר על כן, בצד הבסיסי של MECs נמצא בקשר הדוק עם הקרום במרתף (מטריקס), ויחסי גומלין בין שני גופים אלה בחוזקה להסדיר שתי פונקצית המורפוגנזה והפרשה של האמאאפיתל ר"י 11-13.
כל התהליכים האלה מסתמכים על הפעולה של רמזים סביבתיים שונים, שהחשוב ביותר הם hormones14, גורמים אוטוקריני ומטריקס. לדוגמא, פרוגסטרון גורם נרחב 15 וalveologenesis ש, בשילוב עם פרולקטין (PRL) הסתעפות בצד 16,17, מקדם ושומר על הבידול של alveoli. בנוסף לסטרואידים וPRL18, ציטוקינים ומסלולי איתות הקשורים בהתפתחות (Wnt וNotch מסלולי איתות) הם מעורבים גם במחויבות שושלת החלב ופיתוח 19-21. בסוף ההריון, MECs luminal מתחיל לייצר חלב עשיר בחלבון הידוע כקולוסטרום בלומן של alveoli. בנוסף, פרוגסטרון פועל על חדירות אפיתל ומאז צמתים ההדוקים עדיין פתוחים, קולוסטרום נמצא גם בזרם הדם האימהי.
לאחר המלטה, mammarאפיתל y תופס כמעט את כל החלב בלוטת הנפח ומאורגן ביותר (איור 2, אפיתל החלב). יחידות ייצור חלב, כלומר alveoli (איור 2, נֹאדִית), נוצרות על ידי monolayer של תאים מקוטבים החלב אפיתל הפרשה (MESCs), עם קרום הפלזמה פסגתם תיחום לומן. Alveoli לארגן את עצמם לאוניות שמקובצות לאונות מחוברות לצינורות המנקזים חלב לסביבה החיצונית (איור 2, אונה). הנקה מתרחשת, כלומר., MESCs להתחיל להפריש כמויות שופעות של חלב, מופעלות בעיקר על ידי הירידה בהורמוני שליה (בעיקר פרוגסטרון) (איור 1, הנקה). גני חלבון חלב מופעלים בקורס זמן זמני מוגדר החל הריון להנקת 9,22,23, בעיקר בתגובה לPRL יותרת המוח שוחרר בזמן היניקה. במקביל, אנשי קשר בין MESCs ומטריקס שני לעורר synt חלבון חלבhesis באמצעות אותות שמתווכים באמצעות האינטראקציות בין integrins וlaminin 24,25 הסלולריים, ולדכא אפופטוזיס בMESCs 26,27. מסלולי איתות אלה יגרמו להפעלה של יזמי גן חלבון חלב 28 דרך ההפעלה של שעתוק ספציפי גורמי 29. קשר תאי תאים הם חשוב גם להיבטים מסוימים של בידול לרבות הקמת קוטביות הפסגה והפרשת הווקטורים של מוצרי חלב. צמתים הדוקים קרובים במהירות לאחר תחילת ההנקה וMESCs דק לתזמר את הספיגה של מולקולות מהדם, כמו גם את הסינתזה, התחבורה וההפרשה של מרכיבי חלב, בתגובה לדרישות התזונתיות של ילודים. בזמן היניקה, ההתכווצות של התאים המקיפים את myoepithelial alveoli מתרחשת בתגובה לאוקסיטוצין וגורמת לשחרור חלב דרך הצינורות ולפטמה. חלב הוא נוזל מורכב שמכיל חלבונים (בעיקרcaseins), סוכרים (בעיקר לקטוז), שומנים ומינרלים, כמו גם מולקולות ביו כגון נוגדנים (IgA), גורמי גדילה והורמונים. Caseins מסונתזים, התאסף במבנים על-מולקולריים, כלומר קזאין מיצלות, מועבר לאורך מסלול ההפרשה, ולאחר מכן שוחרר על ידי exocytosis, כלומר, שילוב של שלפוחית הפרשה המכיל קזאין (SVS) עם קרום הפלזמה הפסגה של המסקלין (איור 2).
תנועה תאית מסתמכת על חילופי חומרים בין תאים הקרומיים וכרוכה מסיס N-ethylmaleimide רגיש Fusion (NSF) חלבון קובץ מצורף (SNAP) קולטן (מלכודת) 30,31. חלבוני מלכודת המשפחה מחולק במלכודות לפוחי (V-מלכודות), הנמצאות בקרום השלפוחית, ומלכודות יעד (t-מלכודות), מקומיות על קרומי היעד. על ידי רוכס דרך תחומים סליל המפותל שלהם, למלכודות לא V- ולהרכיב כדי ליצור חבילה מורכבת ארבעה-סליל מאוד יציב, המכונה המורכב מלכודת דואר. מורכב זו מקדמת את השילוב של שני bilayers שומנים היריב על ידי הבאת אותם בהדרגה לקרבה 30,32. לאחר מכן, מתחמי מלכודת הם ניתקו על ידי triphosphatase אדנוזין NSF וחלבוני SNAP ומלכודת חלבון מתאם שלה ממוחזרים בחזרה לתא מוצאם 33. מעניין, כל חלבון מלכודת בעיקר מתגורר בתאים סלולריים שונים וזיווג מלכודת עשויה לתרום לספציפיות של אירועי היתוך תאיים 34. המחקרים קודמים מצביעים על כך שלפחות Synaptosomal הקשורים חלבון 23 (SNAP23) וחלבון שלפוחיות קרום הקשורים 8 (VAMP8), וsyntaxins (STX) -7 ו-12 לשחק תפקיד בexocytosis קזאין 35,36. חלבונים אלה יש גם נמצאים בקשר עם חלק השומנים חלב, כלומר, שומן חלב כדוריות (MFGs) 37. המודל הרווח הנוכחי מניח כי טיפות cytoplasmic שומנים (CLDs) נוצרות על ידי ההצטברות של l הניטרליipids (בעיקר triacylglycerols ואסטרים סטרולים) וכולסטרול נובע מהתזונה האימהית בין שני העלונים של קרום reticulum endoplasmic (ER) 38-41. CLDs הגדול נוצרים, לפחות בחלקו, על ידי השילוב של CLDs הקטן יותר, תוך העברתו לצד הפסגה של MESCs שבו הם שוחררו כMFGs (1-10 מיקרומטר בקוטר) על ידי ניצנים, שעטופה בקרום הפלזמה פסגת המסקלין 40-42. הנקה מפסיקה אחרי הגורים נגמלים וMESCs למות בהדרגה על ידי אפופטוזיס, שהוביל לנסיגה של רקמת השד בחזרה למצב התבגרות (איור 1, פוף).
Immunofluorescence (IF) הוא שיטת מעבדה האנליטית נפוצה בשימוש כמעט בכל ההיבטים של ביולוגיה, הן במחקר ואבחון קליני ב. אם ניתן לבצע טכניקות בסעיפי רקמות (אימונוהיסטוכימיה, IHC) או תא (immunocytochemistry, ICC) דגימות. גישה זו עוצמה מסתמכת על השימוש בניאוןנוגדנים שכותרתו כי דווקא להיקשר לאנטיגן של עניין (במישרין או בעקיפין), ובכך מאפשרים ההדמיה של רקמות ההפצה שלה באמצעות מיקרוסקופ פלואורסצנטי. אותות הקרינה בעיקר תלויים באיכות ובריכוז של הנוגדנים וטיפול נכון של הדגימה. פרוטוקול פשוט immunofluorescence העקיף (IIF) מוצג לזהות מוצרי חלב (caseins וMFGs) וחלבונים מעורבים בהפרשת מוצר חלב (butyrophilin (BTN1), מלכודת חלבונים) בחלקים קפואים של רקמת שד עכבר (איור 3). בעוד פרוטוקול זה מספק סקירת IHC מלאה, החל מאיסוף רקמות לאחר טיפול תמונה, ביקורתי וצעדים אופציונליים, כמו גם כמה המלצות טכניות גם הוצג ונדון.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
עכברי CD1 גדלו בINRA (UE0907 IERP, Jouy-en-Josas, צרפת). כל ההיבטים האתיים של טיפול בבעלי החיים עמדו בהנחיות הרלוונטיות ודרישות רישוי שנקבעו על ידי משרד החקלאות הצרפתי. הנהלים המשמשים אושרו על ידי הוועדה המקומית אתיקה (הסכם 12/097 מComethea Jouy-en-Josas / AgroParisTech).
לדוגמא הכנת 1. בלוטת החלב
- נתיחת בלוטת החלב עכבר
- להרדים עכברים ביום 10 בהנקה על ידי נקע בצוואר הרחם ולהצמיד את החיה למטה עם הבטן שלה פונה כלפי מעלה.
- להרטיב את אזור הגחון עם אתנול ולייבש אותו עם מגבת נייר.
- בעזרת מלקחיים, למשוך את עור הבטן בין שתי רגליו האחוריות ועושה חתך (דרך העור בלבד) של כ 1 סנטימטר במספריים חדים. החל מהחתך הראשון, ולאחר מכן להשתמש במספריים לחתוך את העור עד הצוואר בעכבר. למשוך את העור מהצפק ופאיn את הצד של עור אחד בכל פעם, מותח אותו לימד.
- אסוף את הבטן ובלוטות החלב מפשעתי ידי דוחף אותם במרחק של העור עם ספוגית ולבסוף מושכים או חיתוכם מהצפק.
הערה: בשלב זה מכתים קרמיין ניתן לבצע על מנת להמחיש את האפיתל החלב בתוך הבלוטה כולה 43. גישה זו יכולה להיות שימושית כדי לנתח את המורפולוגיה הגלובלית של בלוטת החלב בתנאים שונים (שלבי התפתחות פיסיולוגיים, מחלות, in vivo טיפולים). - הסר את הבלוטה לימפה ממוקמת בצומת של הבטן והבלוטות מפשעתי 44.
- קיבעון רקמות החלב
- חותך את רקמת השד ל3 מ"מ 3 שברים עם אזמל ומייד לשטוף ברים אלה שבנאגרו מלוח פוספט פתרון (PBS), pH 7.4, על מנת להסיר כמה שיותר חלב ככל האפשר.
- מהירות לייבש את שברים על ניירמגבת ולשים אותם בפתרון קר PBS המכיל paraformaldehyde 4% (PFA, HCHO, 32% תמיסת פורמלדהיד, זהירות) במשך 10 עד 15 דקות על קרח.
הערה: זה מספיק זמן כדי לאפשר ניתוח שלאחר מכן על פרוסות רקמת שד על ידי IIF36 ו / או הכלאה באתר 45. עם זאת, כפי שfixatives אלדהיד לחדור די לאט בחתיכות רקמה (~ 1-3 מ"מ לשעה), זמן זה עשוי להתארך כדי להבטיח קיבוע אופטימלי של דגימת הרקמה. לחלופין, לתקן רקמות in vivo על ידי מרוסס חיה הרדים עם פתרון מקבע (לא פורט במחקר הנוכחי).
- עירוי סוכרוז
- מהירות לשטוף את שברי החלב בקור PBS ולטבול אותם בפתרון קר PBS המכיל סוכרוז 40% (D-saccharose, C12H22O11, גרם מר 342.3 / mol) ל16-48 שעות על 4 מעלות צלזיוס בטלטול עדין.
- הטבעת רקמות
הערה:, יכולים לחתוך מחדש בשלב זה שברי החלב להיות על מנת להפוך את שברים קטנים (2-3 מ"מ 3) או להתאים את צורתם.- כראוי לתייג את תבניות הפלסטיק ולמלא שליש מהנפח של העובש עם מתחם אוקטובר, שמרו על RT. מניחים שבר אחד (2-3 מ"מ 3) של רקמת שד לעובש ולכסות אותו עם מתחם OCT.
- מניחים את התבניות על פני השטח של החנקן הנוזלי (על גיליון האלומיניום או באמצעות מסננת מתכתית) ולאפשר למוצר להקפיא.
הערה: זה חייב להיות מוצק ולבן לפני טבילת העובש בחנקן נוזלי.
- אחסן את הדגימות קפואות ב -80 ° C עד סעיפי רקמות מבוצעים.
2. חתך רקמה קפוא
הערה: cryostat, שהוא למעשה microtome בתוך מקפיא, נדרש כדי להפוך את קטעי רקמה קפוא. טמפרטורה נמוכה יותר לעתים קרובות נדרשת לרקמות שומן או שומנים בדם עשיר כגון בלוטת החלב בתולה.
- כוון את הטמפרטורה של cryostat ל-26 מעלות צלזיוס ולחכות עד שיש לו stabilized. לשמור על גוש הרקמה הקפוא ב-26 מעלות צלזיוס לאורך כל הליך חתך. בהחלט למנוע הפשרת הרקמה בכל עת במהלך ההליך.
- לקרר את סכין הגילוח, תמיכת החיתוך, מכשיר אנטי-רול והמברשת ל-26 מעלות צלזיוס על ידי הצבת אותם בcryostat לפחות 10 דקות. גם למקם תיבת שקופיות בתוך cryostat כדי להיות מסוגל לאחסן שקופיות זכוכית כחלקים נעשים.
- כראוי לתייג את שקופיות הזכוכית שתשמש לאיסוף קטעי הרקמה ולשמור אותם בRT; אחרת סעיפי רקמות לא ידבקו אליהם. הסר את המדגם מהעובש בתוך cryostat.
הערה: מטען חשמלי חיובית שקופיות זכוכית באמצעות תעדיף את ההידבקות של חלקי רקמות קפואים מאוד בשל משיכה אלקטרוסטטית גבוהה יותר. - מכסה את פני השטח של דיסק רקמת מתכת עם מתחם אוקטובר (שמרו על RT) ולדחוף את המדגם הקפוא על גבי זה. הנח הר הרטוב בתוך cryostat ולתת לו במשותףol לפחות 15 דקות.
- מניחים את ההר הרטוב בבעל הדיסק של cryostat. התאם את עובי חתך 5-6 מיקרומטר, ואם אפשר, להשתמש בסכין חד חדש או לפחות לשנות את האזור על הלהב משמש לחיתוך כל דגימה שכן כמה רקמות תהיה במהירות משעממת.
- להתאים את המיקום של המכשיר אנטי-רול על סכין הגילוח על ידי ביצוע חתכים של ההרכבה בינונית עד שהפרוסות נוצרות באופן שווה ונכון. באופן אידיאלי, המכשיר אנטי-רול יהיה לדרוך על סכין הגילוח בכ -1 מ"מ.
- ברגע שההגדרות נכונות, לבצע קטעי רקמה על ידי סיבוב הגלגל בתנועה אחידה רציפה. אלא אם כן הטמפרטורה אידיאלית, סעיף רקמה, על ידי הטבע, מנסה להתכרבל.
- השתמש במברשת כדי לתפוס ולתמרן את הסעיף לרוחב הבמה כדי למקם אותו כרצונך בשקופית הזכוכית. השתמש במברשת כדי לנקות את השרידים אולי קיימים בבלוק הקפוא רקמות ו / או סכין הגילוח.
- מְשׁוֹךסעיף הרקמה כלפי המשתמש ולהימנע מללחוץ אותו על הבמה cryostat. הימנע לחיצה על קטע הרקמה על הבמה cryostat כפי שהוא עשוי להוביל להידבקות של פרוסת הרקמה על הבמה ובכך חוסר היכולת לשחזר אותו עם שקופיות הזכוכית.
- אחזר סעיפי רקמות אחד אחד על ידי לקטוף אותם על פני השטח של שקופיות זכוכית, על ידי מחזיק אותו מעל לסעיף ולדוג אותו לגעת בסעיף הרקמה.
הערה: סעיפי רקמות לדבוק במהירות לזכוכית החמה בשל המשיכה סטטי. אם כמה קטעי רקמה ממוקמים באותו השקופיות, להיזהר שלא חופף אותם ולחלל אותם מספיק כדי להיות מסוגל לצרף אותם בנפרד במעגל הידרופובי (ראה סעיף 3.1.1.).
3. Immunofluorescence העקיף
- איתור חלקים
- השתמש בעט מחסום הידרופובי לצייר מעגל הידרופובי סביב רקמה רכוב שקופיות. בואו יבש המעגל כ 1 דקות ב RT. למתוח קו סביב tסעיפי בעיה עם סמן קבע שחור משובח, כמו גם, אבל בצד של שקופיות הזכוכית הפוכה לזה שבו סעיפי הרקמות הם.
הערה: מעגל זה הוא דוחה מים וacetone- ואלכוהול מסיס. לכן מספק מחסום לתמיסות מימיות המשמשות במהלך הליך IHC ומקטין את הנפח של חומרים כימיים הנדרשים. - רעננות סעיפי רקמות על ידי מכסה אותם עם טיפה ~ 250 μl של PBS במשך כמה דקות על RT. לתקן סעיפי רקמות על ידי מכסה אותם עם ~ 250 μl של 3% פתרון PFA מוכן טרי בPBS במשך 10 עד 15 דקות.
הערה: לחלופין במקרה זה, להשתמש בפתרון מרווה אלדהיד (אמוניום כלוריד 50 מ"מ (NH 4 Cl, מר 53.5 g / mol) ב PBS או 0.1M גליצין (C 2 H 5 מס '2, מר ז 75.07 / mol) ב PBS ) כדי לעצור את תגובת הקיבעון. שטיפת PBS פשוטה ושפע היא בדרך כלל מספיק כדי להסיר אלדהיד unreacted.
- השתמש בעט מחסום הידרופובי לצייר מעגל הידרופובי סביב רקמה רכוב שקופיות. בואו יבש המעגל כ 1 דקות ב RT. למתוח קו סביב tסעיפי בעיה עם סמן קבע שחור משובח, כמו גם, אבל בצד של שקופיות הזכוכית הפוכה לזה שבו סעיפי הרקמות הם.
- אחזור Antigen (אופציונאלי)
- מניחים את פתרון AR (4 H 100 מ"מ טריס (C 11 NO 3, מר 121.14) אוריאה 5% (NH 2 CONH 2, מר 60.06) pH 9.6) בכוס. הנפח של פתרון AR חייב להיות מספיק כדי לכסות את שקופיות הזכוכית להציב בבעל זכוכית לחלוטין.
- מחממים את פתרון AR עד 95 ° C על ידי ניטור הטמפרטורה עם מדחום ולאחר מכן למקם את שקופיות זכוכית על מדף מתאים, טובלי המדף במאגר החם, כיסוי להגביל אידוי ודגירה של 10 דקות על 95 מעלות צלזיוס.
- הסר את הכוס מאמבט המים ולהשאיר את שקופיות זכוכית לעוד 10 דקות במאגר.
- יש לשטוף את חלקי רקמות עם PBS (~ 250 μl / סעיף) ולהרוות אותם עם פתרוןשל 3% אלבומין בסרום שור (BSA, ~ 250 μl / סעיף) ב PBS לפחות 30 דקות ב RT.
- שים 30-50 μl של הנוגדן הראשוני מדולל PBS המכיל BSA 2% על כל קטע רקמה.
הערה: נפח זה מספיק כדי ליצור טיפה שמכסה את קטע הרקמה לחלוטין. - הנח את אותו הנפח של diluent (BSA 2% ב PBS) לבד בקטע רקמה לבצע ביקורת שלילית בלי נוגדן ראשוני.
- באופן שיטתי כולל שליטה שלילית זה בכל ניסוי IHC ולבצע עבור כל נוגדנים משני המשמשים להערכת הרקע של הניסוי (התיוג שאינו ספציפי בשל נוגדנים משני ו / או אוטומטי הקרינה הרקמות). סוגים אחרים של בקרות חיוביות או שליליות יכולים גם להתבצע על מנת להבטיח את הספציפיות של התיוג (ראו דיון).
- מניחים את שקופיות הזכוכית בO תיבת humidified / N ב 4 ° C.
הערה: נוגדנים חד שבטי עיקריים בם השתמשו היו עכבר אנטי cytokeratinקזאין 8 (CK8, 01:50 דילול), חד שבטי עכבר אנטי cytokeratin 14 (CK14, 01:50 דילול), ארנב polyclonal אנטי עכבר (# 7781, 01:50 דילול, הניתן בנדיבות על ידי MC נוויל, אוניברסיטת קולורדו הבריאות מרכז למדעים, CO, ארה"ב), polyclonal הארנב נגד BTN1 (דילול 1: 300, ובלבד בנדיבות על ידי IH מאת'ר, מחלקה למדעי בעלי חיים ועופות, אוניברסיטת מרילנד, MD, ארה"ב), polyclonal הארנב נגד Stx6 ( 01:50 דילול, הניתן בנדיבות על ידי ס Tooze, מחקר הסרטן בבריטניה, לונדון מכון מחקר, לונדון, בריטניה) ואנטי-VAMP4 ארנב polyclonal (01:50 דילול). - ביסודיות לשטוף חלקי רקמות עם PBS לפחות ארבע פעמים במשך 10 דקות ב RT.
- לדלל את הנוגדן המתאים המשני (IgG העז rhodamine מצומדות- נגד ארנב (L H +), 1: 300 דילול) בPBS המכיל BSA 2%, מקום 30-50 μl של פתרון זה על כל סעיפי הרקמות, ודגירה של 1.5 שעות ב RT.
- מאז fluorochromes הן מולקולות רגישות לאור, לאלחשוף חלקי רקמות לאור עד הניתוח שלהם. לIIF על סעיפי רקמות, להעדיף נוגדנים משני מצמידים את fluorophore אדום מאז קרום תא נוטה ליצור אוטומטי הקרינה ירוקה שיכול להפריע לתיוג נמוך. יתר על כן, בחירת נוגדנים משני מצמידים fluorophore אדומים מאפשרת תיוג הנלווה של שומנים ניטראליים (ראה להלן).
- ביסודיות לשטוף את חלקי רקמות עם PBS לפחות ארבע פעמים במשך 10 דקות ב RT.
- עבור חלק מניסויים, לבצע לאחר קיבוע-ידי דוגרים הדגימות עם 2% PFA מדולל PBS במשך 10 דקות ב RT על מנת לייצב את פיגומי אנטיגן / נוגדן. עם זאת, ניתן לוותר על שלב זה עם ברוב המקרים.
- כדי להמחיש CLDs וMFGs, שומנים ניטראליים צבע על ידי דוגרים סעיפי רקמות ב30-50 μl של פתרון PBS המכיל 3 מיקרוגרם / מיליליטר של bodipy 493/ 503 במשך 10 דקות ב RT. מהירות לשטוף חלקי רקמות פעמיים עם PBS.
- Counterstain DNA הגרעיני עם 30-50 μl של פתרון PBS המכיל 3 מיקרומטר של DAPI (4-6-diamidino-2-phenylindole, 5 מ"ג / מיליליטר פתרון מניות) במשך 10 דקות ב RT. שטוף את חלקי רקמות פעמיים עם PBS לפני ההרכבה המגלשות לתצפית.
- הסר PBS ומניח ירידה של מדיום הרכבה על כל קטע רקמה.
- הנח בצד אחד של להחליק את המכסה בזווית נגד השקופיות, יצירת קשר עם הקצה החיצוני של הירידה הנוזלית ולאחר מכן להוריד את הכיסוי באיטיות, למנוע בועות אוויר. תאפשר לנוזל התפשט בין שקופיות הזכוכית ולהחליק את המכסה לכמה דקות ולאחר מכן להסיר את העודפים של הרכבה בינונית עם מגבת נייר.
- לאטום את תלוש לכסות לשקופית הזכוכית עם חלקי לק ורקמת החנות ב 4 מעלות צלזיוס, כדי למנוע החשיפה שלהם לאור עד תצפית.
4. הקרינה תצפית ותמונת רכישה
הערה: מיקרוסקופ פלואורסצנטי מצויד במצלמה הנשלטת על ידי תוכנת רכישת תמונה נדרשה לבחון את תוצאות IHC.
- לפני רכישת תמונות, לבדוק את עוצמת התיוג ולהעריך את הרקע של הניסוי על ידי הסתכלות על הפקדים השליליים. לרכוש תמונות בכל תווית ניאון (ערוץ צבע) בנפרד.
- לרכוש את כל התמונות, כולל אלו של הבקרות המתאימות, באותם תנאים (חשיפה והגדרות כלליות) עבור כל ערוץ צבע.
- מיקרוסקופיה הקונבנציונלית
- בצע מיקרוסקופיה epifluorescence עם מיקרוסקופ מצויד במסננים סטנדרטיים לisothiocyanate והעמסת (FITC, ירוק), rhodamine (אדום) ופליטת DAPI (כחול), × 20 × 63 ל( טבילה שמן, NA 1.3) מטרות ומצלמה ההדמיה DP50.
- מיקרוסקופיה confocal
- בצע מיקרוסקופיה confocal עם מיקרוהתמודד, מצויד בתוכנת ZEN, באמצעות × 20 × 63 ל( טבילה שמן, NA 1.4) מטרות ואורכי גל עירור 488- 568 ננומטר ושל הלייזר.
טיפול 5. תמונה
הערה: כל פוסט טיפולי התמונה מבוצעים באמצעות תוכנת ImageJ בחינם (http://imagej.nih.gov/ij/).
- להרכיב תמונה (למזג)
- פתח את התמונות שנרכשו בכל ערוץ שיהיה משולב (קובץ / פתוח). אם עובד עם 8 ביט תמונות בגווני אפור, צבע מלאכותי לייחס לכל אחד מערוצים באמצעות טבלת החיפוש (לוחות תמונה / בדיקה).
- צור תמונה המורכבת מ תמונות בגווני אפור או בצבע באמצעות הפקודה "מיזוג ערוצים" (תמונה / צבע / מיזוג ערוצים) ולאחר מכן ייחוס צבע לכל ערוץ.
- בצע תמונת ערימות חפיפה באותו אופן על ידי פתיחת ערימות נרכשו בכל ערוץ שיהיה משולב (קובץ / פתוח) ובאמצעות הפקודה "מיזוג ערוצים ו# 8221; (תמונה / צבע / מיזוג ערוצים) לייחס צבע לכל ערוץ. שמור את המחסנית מרוכבת כרצף תמונה או כסרט (ראה סעיף 5.4).
- הקרנת Z ערימת תמונה
- השתמש בפונקצית הקרנת Z (תמונה / מחסנית / Zproject, עצמת מקס) כדי לספק תצוגה דו-ממדית של כל התמונות של ערימת תמונה על ידי הקרנתם לאורך ציר ניצב למישור התמונה (ציר z). האפשרות "העוצמה מקסימלית" יוצרת תמונה שבה כל פיקסל מכיל את הערך המקסימאלי על כל התמונות בערימה. זה יוצר תמונה אחת המאפשרת ההדמיה של כל הכתמים שנצפו דרך כל ערימת התמונה לערוץ מסוים או לאחר חפיפה של מספר ערוצים.
- הקרנת 3D ערימת תמונה
- השתמש בפקודת הקרנת 3D (פרויקט תמונה / מחסנית / 3D, הצבע בהיר, ציר y) כדי ליצור רצף של תחזיות של נפח מסתובב על מטוס. העיבוד החזותי של surfaces ומבנים פנימיים תלויים הן בשיטת ההקרנה (הקרובה ביותר לנקודה, הנקודה הבהירה ביותר (משמשת כאן), או מתכוון-הערך) ופרמטרי ההדמיה נבחרו. כל מסגרת של רצף האנימציה היא התוצאה של תכנון מזווית צפייה שונה.
- סובב את תמונת 3D שנוצרה סביב כל אחת משלושת הצירים המאונכות (ציר y נבחר כאן). שמור את הרצף מיוצר כתמונה אחת או סרט.
- ערימת תמונה להמרת סרט
- פתח ערימת תמונה (קובץ / פתוח) ולשמור אותו כסרט בפורמט .AVI באמצעות הפקודה "AVI" (קובץ / שמירה ב/ AVI).
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
בלוטת החלב היא בלוטה תת עורית הממוקמת לאורך מבנה הגחון של שני החזה והבטן במכרסמים. המיקום של חמישה הזוגות של בלוטות של העכבר במהלך ההריון מוצג באיור 4. המורפולוגיה של בלוטת החלב באופן דרמטי משתנה במהלך התפתחותו, המשקף שינויים פונקציונליים הנדרשים להכנה להנקה מלאה (איור 1). בבעלי חיים בתולה או שטרם ילדיו, בלוטת החלב מורכבת מאפיתל ductal מסועף בדלילות מוטבע בתוך סטרומה שומן דקה שעלולה להיות קשה לראות. מתחילת ההריון, proliferates האפיתל החלב ומתרחב, וכתוצאה מכך בלוטות החלב גדולות שהפכו קל יותר לראות ולהסיר (איור 4). במהלך הנקה, רקמת השד היא עבה יותר ומופיעה לבן בשל נוכחותם של חלב. רק בלוטות החלב בטן ומפשעה נאספות כי GLAN החלב צוואר רחם והחזהDS יוסרו פחות בקלות בשל הקשר ההדוק שלהם עם שרירים. עבור חלק מניסויים, ניתן להפריד גורים מהשעה 4-6 הנקבה מניקה לפני ההקרבה על מנת להגביל את הפרשת חלב על ידי MESCs 46,47.
זיהוי של myoepithelial החלב ותאי אפיתל
ניתן להבחין בין MESCs luminal תאי myoepithelial התכווצות סביב alveoli באמצעות נוגדנים המכוונים נגד סמנים הביעו במפורש על ידי כל אחד מסוגי התאים. בבלוטת החלב, הסמנים הנוכחיים משמשים הם cytokeratins (CKS). CKS הוא משפחה גדולה של חלבוני cytoplasmic שפלמר כדי ליצור חוטי cytoskeletal ביניים (10 ננומטר בקוטר בממוצע) נמצאים ברקמות אפיתל. חוטי ביניים הם יציבים מאוד ומספקים תמיכה מכאנית לארכיטקטורת תא, ולארגן את הרקמות על ידי תרומה להידבקות תא-תא ותא-חיבור בסיסיאינטראקציות רקמות. תת קבוצות של CKS מתבטא בתאי אפיתל תלויים בעיקר בסוג של האפיתל, שלב התפתחותה ובמעמדה בידול. יתר על כן, זה חל גם על העמיתים הממאירים של epithelia. לפיכך, סמנים אלה הם כלים פשוטים ורבי ערך לאפיין אוכלוסיות תאים ברקמות בתנאים פיסיולוגיים ומשמשים לאבחון גידול ואפיון בפתולוגיה כירורגית 48.
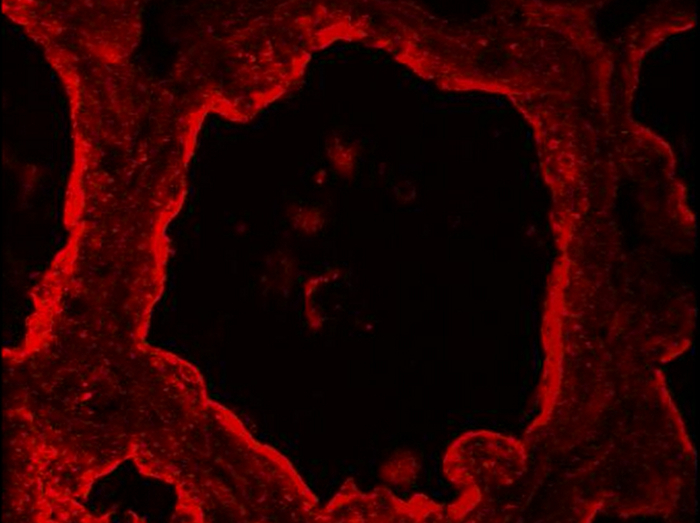
בבלוטת החלב הרגילה, ניתן להבחין בתאי myoepithelial וMESCs luminal מבוססים על הביטוי שלהם ההפרש של CK14 וCK8, בהתאמה (איור 5). סמני cytoplasmic אלה זוהו בסעיפי החלב של עכברי הנקה לאחר קיבוע PFA וAR. תמונות נרכשו באמצעות מיקרוסקופ epifluorescence קונבנציונלי. CK8 מופיע להיות מופץ ברחבי הציטופלסמה של MESCs luminal (איור 5, CK8). שימו לב שהרקע האדום להתבונןד לביקורת השלילית ללא נוגדן ראשוני (איור 5, -Ig1) הוא בעיקר בשל קיפול סעיף רקמה, כפי שהוצע על ידי תיוג DNA הכחול, אשר מציג כמה שכבות של גרעינים (איור 5, -Ig1, גרעינים). CK14 הוא ציין במיוחד בתאי myoepithelial שטוחים ומוארכים הממוקמת בבסיס של alveoli (איור 5, CK14). דרך נפוצה נוספת כדי לזהות תאי myoepithelial היא לזהות אקטין אלפא שריר חלק (- SMA) נוכחי בתאי התכווצות אלה (ראו איור 4 ב -49).
איתור של מוצרי חלב עכבר
לאחר המלטה, MESCs המובחן באופן מלא מתחיל לייצר כמויות בשפע של חלב. רכיבי חלב מופרשים על ידי מסלולים שונים 40,50. מיצלות קזאין מופרשות על ידי exocytosis של SVS נגזר Golgi, ואילו שומנים משתחררים כMFGs על ידי ניצנים של pl הפסגהקרום אסמא של MESCs (איור 2, תא הפרשת אפיתל החלב). עבור חלק מניסויים, הגורים מופרדים משעת 4-6 הנקבה לפני איסוף בלוטות החלב, על מנת להאט את הפרשת חלב 46,47. בתנאים אלה, קרום הפלזמה הפסגה של MESCs והתוכן של לומן ניתן להבחין בקלות, וזה לא המקרה ביונק מאז alveoli מכווץ ולומן סגור. יתר על כן, האטת ההפרשה חיונית גם כאשר לומדים חלבונים מעורבים בסחר בקרום כמו מלכודות. ואכן, מלכודות מחזור בין תורם ותאי acceptor ולוקליזציה subcellular קשה לקבוע מאז תיוג לעתים קרובות מתפזר כאשר מחזור הקרום הוא גבוה, כלומר., במהלך יניקה. לכן, האטת הפרשת חלב על ידי הסרת הגורים מספקת תנאים הולמים ללמוד את הלוקליזציה תאית של מלכודות כאשר T- ונ-המלכודות מעדיפים להתגורר בתורםותא acceptor, בהתאמה (ראה להלן).
איור 6 מציג את הלוקליזציה של caseins בבלוטת החלב עכבר מניקות ביום 10 בהנקה, בנוכחות (איור 6, עמ '+) או בהעדר (איור 6, -p) של גורים. קטעי רקמה נצפו שני ידי מיקרוסקופ epifluorescence הקונבנציונלי (שלוש עמודות מימין) ומיקרוסקופיה confocal (איור 6, עמודה שמאלית). במהלך יניקה, caseins להיראות בעיקר הצטברו באזור הפסגה (איור 6, עמ '+, ראשי חץ). מיקרוסקופיה confocal מגלה כי caseins גם הווה, אם כי במידה פחותה, בצד הבסיסי של MESCs בנוכחות גורים (איור 6, + P, חיצים), אשר לא ניתן לצפות במיקרוסקופ קונבנציונלי (איור 6, caseins ברור, להשוות עזב ולוחות מימין). ואכן, בepifluorescence רחב בתחום, הקרינה הנפלטת על ידי המדגם (fluorescen הרקעלסה"נ) עוברת דרך הנפח הנרגש ומשנה את הרזולוציה של האובייקטים שנצפו במישור המוקד האובייקטיבי (out-of-פוקוס הקרינה). זה נכון במיוחד עבור דגימות עבות (עבה יותר מ 2 מיקרומטר). מיקרוסקופיה confocal מאפשרת לקבל תמונות באיכות גבוהה מדגימות שהוכנו עבור epifluorescence, כעומק השדה יכול להיות נשלט וקרינת רקע שלא נכללה במישור המוקד. יתר על כן, בנוכחותו של גורים (איור 6, + P), לומן של alveoli הם די סגור וצד הפסגה של MESCs הוא טוב יותר שנצפה בהעדר הגורים (איור 6, -p), כאשר לומן של alveoli הוא מורחב בשל ההצטברות של מוצרי חלב. כאשר הפרשת החלב האטה, caseins יופיע גם צבר מתחת קרום פסגת הפלזמה (איור 6, -p, ראשי חץ), והם נצפו בבירור בצד הבסיסי של MESCs (איור 6, -p, חיצים). בקרות שליליות ללא antib העיקריody לא הראתה שום תיוג (איור 6, -Ig1).
מוצרי חלב יכולים להיות בקלות במשותף זוהה על ידי שילוב של IHC לcaseins וcounterstaining שומנים הניטרלי של CLDs וMFGs (איור 7). סעיפי רקמות היו צילמו כZ- ערימות על ידי מיקרוסקופ confocal, שהיו פוסט-טופל בImageJ לייצר תחזיות Z או תחזיות 3D לכל אחד (איור 7, caseins, שומנים) או כל ערוצי הצבע (איור 7, למזג). רצפי התמונה מיוצרים נשמרו כתמונות בודדות (איורים 7 ו -8) או סרטים (ראה סרטים נוספים).
למרות שחלק התיוג נצפה בצד הבסיסי שלהם, caseins היו בעיקר שנצבר בצד הפסגה של MESCs (איור 7, עמ '+), כפי שכבר תאר, כאשר הנקבות לא הופרדו בעבר מגורים (איור 6, + P). CLDs גם מקומי בעיקר באזור הקודקוד של MESCs, ואילו סוד גדולMFGs אד נמצא בלומן של alveoli. שים לב שcaseins וMFGs הם דמיינו בקלות בלומן של alveoli בהעדר גורים (איור 7, להשוות + P ו-p). Caseins לא משתף למקם עם CLDs או MFGs בכל התנאים הללו מאז חפיפה של שני ערוצי הצבע אינה מייצרת תיוג צהוב (איור 7, למזג תמונות). עם זאת, לאחר טיפולי ערימת תמונה מראים כי caseins מקיף את MFGs מופרש בלומן של alveoli, המצביע על כך חלבונים אלה עלולים ליצור אינטראקציה עם MFG (איור 7, למזג תמונות). שים לב להיבדל של תמונות המיוצרות על ידי כל שלאחר טיפול בשימוש (איור 7, להשוות Zproj ו3D proj לכל ערוץ צבע).
איתור של butyrophilin, סמן חלבון של MFGs.
BTN1 הוא אחד החלבונים העיקריים הקשורים MFGs בחלב 51. חלבון הטרנסממברני זה mainly מקומי בקרום הפלזמה הפסגה של MESCs וכתוצאה מכך נמצא על פני השטח של MFG לאחר שחרורה על ידי ניצני 52. איור 8 מראה כי ביום 10 בהנקה, BTN1 הוא מקומי בעיקר בקרום הפלזמה הפסגה ו, ל במידה פחותה, באזור הפסגה של MESCs. BTN1 גם מקיף את MFGs הנוכחי בלומן של alveoli, כמו גם חלק מCLDs הפסגה (איור 8, מיזוג proj 3D, ראשי חץ). תוצאות מוצגות כתמונה אחת שחולצה מתמונת Z-הערימה רכשה (איור 8, תמונה) או כתצוגה 3D שנוצרה עם פקודת הקרנת 3D של ImageJ, כפי שתוארו לעיל (איור 8, proj 3D). שים לב שתמונה אחת יכולה להיות מספיק כדי לבחון את חלוקת הפסגה של החלבון, אבל עמותת מרחבי של BTN1 עם MFGs המופרש או CLDs הפסגה נצפה רק לאחר שחזור 3D של Z-הערימה (איור 8 להשוות תמונת BTN1 ומיזוג proj 3D pictures). Z-הערימה גם ניתן לשחזר כסרט לתת מבט מרחבית טוב יותר של ההפצה של החלבון. Z-ערימת התמונה נרכשה לBTN1 לבד (סרטים משלימים 1 ו -3) או על גבי שני ערוצי צבע אחרים (למזג, סרטים משלימים 2 ו -4) מוצגים כדוגמאות. (סרטי Z-הערימה ניתן לקרוא את התמונה-אחר-תמונה מהחלק העליון לחלק התחתון (סרטים משלימים 1 ו -2) או כתצוגה מסתובבת (ציר y) של הקרנת 3D של כל ערימת התמונה משלים 3 ו -4 ).
זיהוי של שני חלבוני מלכודת: Stx6 וVAMP4
כפי שהוזכרו קודם לכן, מלכודות הן חלבוני קרום נכנסים שמחזור בין קרומי תורם acceptor. לכן עדיף להאט מחזור קרום הקשורים לפעילות ההפרשה הגבוהה של MESCs על ידי הפרדת הנשים מגורים לפני איסוף בלוטת החלב כאשר לומדיםחלבונים אלה. Stx6 וVAMP4 שניהם תוארו כקשורים עם רשת טרנס Golgi 53,54. עם זאת, חלבוני מלכודת אלה עשויים גם לשחק תפקיד חשוב ברמה של תאים סלולריים אחרים כגון גרגירי ההפרשה (Stx6) 55,56 והמערכה גולג'י (VAMP4) 57. מחקרים קודמים מצביעים על כך שחלבוני מלכודת לשחק תפקיד בהפרשת קזאין 35,36. במהלך הנקה, Stx6 וVAMP4 ממוקמים באזור תת-הפסגה של MESCs. Stx6 הוא ציין בין הגרעין וקרום הפסגה של MECs, מתאים לGolgi ורשת טרנס Golgi (איור 9, Stx6), וגם בהווה, אם כי במידה פחותה, על SVS 36 המכיל קזאין. VAMP4 גם מקומי באזור תת-הפסגה של MESCs, אבל התיוג נראה יותר punctate ומצטבר מתחת קרום הפלזמה הפסגה (איור 9, VAMP4) בשל הקשר שלה עם שתי CLDs וקזאין-contaSVS ining 36. בקרה שלילית ללא נוגדן ראשוני לא להצמיח כל תיוג.

איור 1. עכבר פיתוח בלוטת החלב במהלך חיים עובריים ובוגרים. () בלוטות החלב העכבר להתחיל לפתח סביב עוברי יום 10 (E10) מהקווים (ורוד) ectodermal (תכלת) חלב. בE11.5, placodes יוצר סימטרי לאורך קו חלב החלב וmesenchyme שמסביב (כחול כהה) מתחיל להתעבות. Placodes invaginate כדי ליצור ניצנים (E12.5-E14.5) ו, על E15.5, אפיתל החלב (ורוד), להתרבות ולהאריך כדי ליצור את הנבט הראשוני שדוחף דרך mesenchyme החלב לכרית השומן (אור ירוק ). צורות לומן חלולות ופותחת כדי להצמיח את הפטמה (הסגולה). על E18.5, אפיתל החלב מהווה rudimentaמבנה מסועף ר"י מחובר לבחוץ. מעובד מתוך 6 על ידי רשות ממקמילן מוציאים לאור בע"מ: טבע ביקורות גנטיקה, זכויות יוצרים 2007. (ב) במהלך גיל ההתבגרות, אפיתל החלב (הסגול) נכנס שלב משמעותי צמיחה (התארכות נרחבת, הסתעפות והסתעפות לרוחב). בתחילת הריון התפשטות, נרחבת ומהירה, כמו גם הסתעפות צד להתרחש, שהוביל להתרחבות הניכרת של האפיתל החלב, שפולש לכל כרית שומן החלב באופן מלא. אפיתל החלב מגיע למצב תפקודי מובחן מאוד במהלך הנקה כאשר MESCs luminal מפריש כמויות גדולות של חלב. כאשר הנקה מפסיקה לאחר הגמילה, involutes בלוטת החלב. MESCs יוסרו על ידי אפופטוזיס וphagocytosis, שהוביל להיעלמותם של מבני lobulo-alveolar שמוחלפים ברקמת שומן. מעובד מתוך תכנית 1 של http://brisken-lab.epfl.ch/research ופרק 2.2. http://tvmouse.ucdavis.edu/bcancercd/22/index.html. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
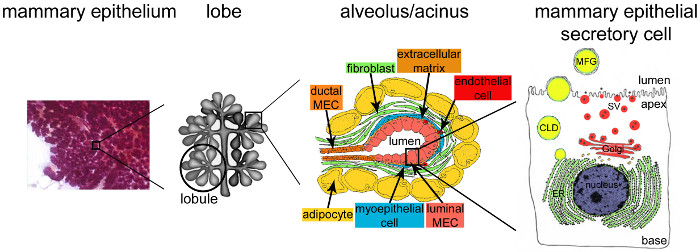
איור 2. ארכיטקטורה של בלוטת החלב בהנקה. במהלך הנקה, מפותחת ואפיתל מסועף מאוד (סגול) מהווה את הרוב המכריע של רקמת השד. רקמת האפיתל נוצר על ידי מבני tubulo-alveolar המשובץ בסטרומה המכילה תאים מסוגים שונים (fibroblasts, adipocytes, תאי שריר חלק, דם וכלי הלימפה וקצות עצבים). MESCs מאורגן במבנים acinar או alveoli, התאספו באוניות היוצרות אונות. כל נֹאדִית היא יחידת מניבת חלב פונקציונלית המחוברת לרשת מסועפת מאוד של ערוצי ובולרי וinterlobular, ובכך מאפשר את החלב שהיית ירד גשם לבחוץ. כל נֹאדִית התחום בmonolayer של MESCs המקוטב, בצד של הפסגה שגובל לומן מרכזי. הצד הבסיסי של MESCs נמצא בקשר הדוק עם מטריקס ותאי myoepithelial התכווצות. מוצרי חלב משתחררים בצד הפסגה של MESCs. חלב גדול (caseins) מופרש כמיצלות קזאין (נקודות שחורות) על ידי exocytosis של שלפוחית נגזרת Golgi הפרשה (SVS), ואילו שומנים משתחררים ככדוריות שומן חלב (MFGs) על ידי ניצנים של קרום הפלזמה הפסגה של MESCs. CLD: טיפת שומנים cytoplasmic; ER: reticulum endoplasmic; MEC: תא אפיתל החלב. מעובד מתוך פרק 2.2. http://tvmouse.ucdavis.edu/bcancercd/22/index.html., איור. 02 www.cellbiol.net/ste/alpHERCEPTIN1.php, איור. 26-02 ב -58, ובין 50. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
.within עמודים = "תמיד"> 

איור 3. הליך ניסויי לבצע immunofluorescence העקיף על חלקים קפואים של בלוטת החלב עכבר. בלוטת החלב נאסף מעכבר נקבת CD1 ביום 10 בהנקה. רקמת השד היא לחתוך לרסיסים קטנים שהם קבועים עם paraformaldehyde וחדורים בסוכרוז לפני שמוטבע במתחם OCT וsnap-קפוא. דגימות בלוטת החלב לאחר מכן לחתוך למקטעים קפוא דקים ומעובד לIIF ידי דגירה רצופה עם נוגדנים משני ראשוניים וfluorochrome מצומדות, בהתאמה. לאחר ההרכבה, דגימות מנותחות עם מיקרוסקופ פלואורסצנטי, המאפשרות הרכישה של תמונות שיכולים לאחר מכן להיות שטופל הודעה. "Target =" _ /53179/53179fig3large.jpg blank "> לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

. איור 4. מיקום האנטומי של בלוטות החלב עכבר שמאל: תצוגת הגחון של מערכת החלב עכבר בשלב מאוחר של ההריון. מימין: לוקליזציה והיבט של בלוטת החלב בשלב מאוחר של ההריון בעכבר. שים לב כי במהלך הנקה, בלוטות החלב הן עבות יותר ומופיעות לבן בשל נוכחותם של חלב בalveoli. מעובד מתוך http://ctrgenpath.net/static/atlas/mousehistology/Windows/femaleu/mousemammgldiagram.html וhttp://www.pathbase.net/Necropsy_of_the_Mouse/index.php?file=Chapter_3.html. אנא לחץ כאן ל לצפות בגרסה גדולה יותר של דמות זו.
-together.within עמודים = "תמיד"> 
איור 5. זיהוי של תאי האפיתל ותאי luminal myoepithelial בסיסיים בבלוטת החלב עכבר. MESCs Luminal ותאי myoepithelial מזוהים על ידי IIF בבלוטת החלב עכבר ביום 10 של הנקה, המבוסס על ביטוים של CK-8 וCK-14 , בהתאמה. גרעין DNA היה מוכתם בDAPI (כחול). תמונות נרכשו באמצעות מיקרוסקופ epifluorescence קונבנציונלי. התמונה מרוכבים (למזג) מראה את חפיפה של התיוג המתאים לcaseins (אדום) וגרעינים (כחול), בהתאמה. -Ig1, שליטה שלילית בלי נוגדן ראשוני. כוכביות מצביעות לומן. סרגל = 100 מיקרומטר. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
"Src =" דואר 6 "/> / קבצים / ftp_upload / 53,179 / 53179fig6.jpg
איור 6. לוקליזציה סלולרית של caseins בבלוטת החלב עכבר. Caseins מזוהה על ידי IIF בבלוטת החלב עכבר ביום 10 בהנקה. בלוטת החלב נאספה מנקבות בנוכחות (+ P) או בהעדר (-p) של גורים. תמונות נרכשו עם קונבנציונליים (פנל, caseins, גרעינים תקין ולמזג) או confocal (caseins (אדום), לוח השמאלי) מיקרוסקופ פלואורסצנטי. בשני התנאים, caseins (אדום) מזוהים באזור הפסגה (ראשי החץ) ופחות או יותר בבסיס של MESCs (חיצים). בקרות שליליות ללא נוגדנים ראשוניים לא מראות שום תיוג (-Ig1). ה- DNA הגרעיני מוכתם עם DAPI (כחול). התמונה מרוכבים (למזג) מראה את חפיפה של התיוג המתאים לcaseins (אדום) וגרעינים (כחול), בהתאמה. כוכביות מצביעות לומן. בר סולם לתמונות epifluorescence = 100 מיקרומטר (פנל מימין, caseins, גרעינים, למזג) ו= 10 &# 181;. מ 'לתמונות confocal (עמודה שמאלית) אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
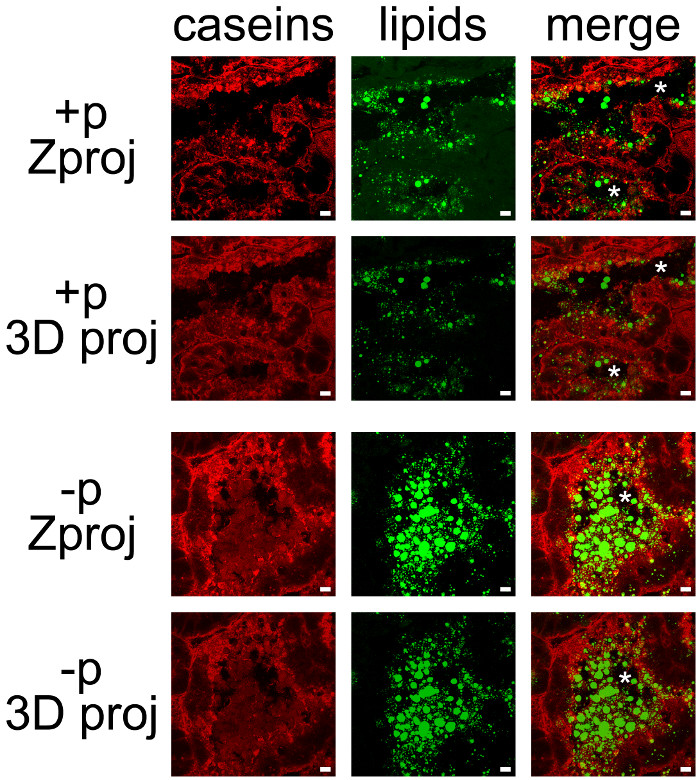
איור 7. לוקליזציה סלולרית של מוצרי חלב בבלוטת החלב העכבר. Caseins (אדום) מזוהות על ידי IIF בבלוטת החלב עכבר ביום 10 בהנקה בנוכחות (+ P) או בהעדר (-p) של גורים. שומנים ניטראליים (CLDs וMFGs) הם counterstained עם bodipy 493/503 (ירוק). תמונות המורכבות (מיזוג) להראות חפיפה של שני labelings. תמונות נרכשו כZ- ערימות עם מיקרוסקופ confocal. היו הודעה שטופלו Z- ערימות עם ImageJ לייצר תחזיות Z (Zproj) או תחזיות 3D (ציר y) (proj 3D) של כל הערימות בכל ערוץ לשניהם (למזג). כוכביות מצביעות לומן. בר סולם= 10 מיקרומטר. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 8. לוקליזציה סלולרית של butyrophilin ושומנים בבלוטת החלב עכבר. BTN1 (אדום) הוא זוהה על ידי IIF בבלוטת החלב עכבר ביום 10 בהנקה בהעדר הגורים. שומנים ניטראליים (CLDs וMFGs) ו- DNA הגרעיני counterstained עם bodipy 493/503 (ירוק) ו DAPI (כחול), בהתאמה. תמונות נרכשו באמצעות מיקרוסקופ confocal כZ-ערימות תמונה. תוצאות מוצגות כתמונה אחת שחולצה מן ערימת התמונה (תמונה, BTN1, שומנים, גרעינים ולמזג) או לאחר שלאחר טיפול עם ImageJ ליצור תצוגת 3D (ציר y) של כל ערימת התמונה (proj 3D, BTN1 , שומנים, גרעינים, למזג). תמונות המורכבות (מיזוג) מראהחפיפה של שלושה ערוצי הצבע. -Ig1, שליטה שלילית בלי נוגדן ראשוני. כוכביות מצביעות לומן. בר סולם = 10 מיקרומטר. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 9. לוקליזציה סלולרית של שני חלבוני מלכודת בחלב עכבר בלוטה. Syntaxin 6 (Stx6) וVAMP4 (V4) מזוהים על ידי IIF בבלוטת החלב עכבר ביום 10 בהנקה. תמונות נרכשו עם epifluorescence קונבנציונלי (המרה) או confocal מיקרוסקופ (LSM). תמונות המורכבות (מיזוג) להראות חפיפה של התיוג נצפה עבור כל חלבון מלכודת (אדום) ועבור ה- DNA הגרעיני counterstained עם DAPI (צבע ירוק שווא), בהתאמה. -Ig1, שליטה שלילית בלי נוגדן ראשוני. כּוֹכָבִיתים מצביע על לומן. סרגל = 10 מיקרומטר לתמונות confocal ו= 100 מיקרומטר לתמונות epifluorescence. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.


טבלת 1. מדריך לפתרון בעיות אימונוהיסטוכימיה.

סרט משלים 1. לוקליזציה של butyrophilin בבלוטת החלב עכבר. BTN1 (אדום) הוא זוהה על ידי IIF בבלוטת החלב עכבר ביום 10 בהנקה. תמונות נרכשו עם שותף מיקרוסקופ nfocal כZ-ערימה ופוסט-טופל בImageJ ליצור סרט. Z-הערימה היא לקרוא מהחלק העליון לחלק התחתון. אנא לחץ כאן כדי לצפות בסרטון זה.

סרט משלים 2. לוקליזציה של butyrophilin ושומנים ניטראליים בבלוטת החלב עכבר. BTN1 (אדום) הוא זוהה על ידי IIF בבלוטת החלב עכבר ביום 10 בהנקה. שומנים ניטראליים (CLDs וMFGs) ו- DNA הגרעיני counterstained עם bodipy 493/503 (ירוק) ו DAPI (כחול), בהתאמה. תמונות נרכשו באמצעות מיקרוסקופ confocal כZ-ערימה לכל ערוץ צבע והיו הודעה שטופלו עם ImageJ ליצור Z-ערימה מורכבת הכופה שלושה ערוצי צבע. Z-הערימה מרוכבים וכתוצאה מכך הוא קרא מלמעלה עד למטה."Target =" _ https://www.jove.com/files/ftp_upload/53179/supvid2.mp4 blank "> אנא לחץ כאן כדי לצפות בסרטון זה.
סרט משלים 3. לוקליזציה של butyrophilin בבלוטת החלב עכבר. BTN1 (אדום) הוא זוהה על ידי IIF בבלוטת החלב עכבר ביום 10 בהנקה. תמונות נרכשו באמצעות מיקרוסקופ confocal כZ-ערימה ועם ImageJ (הקרנת 3D) שטופל בפוסט ליצור (ציר y) מסתובב תצוגה המרחבית של תיוג BTN1. אנא לחץ כאן כדי לצפות בסרטון זה.

לוקליזציה 4. סרט משלים של שומני butyrophilin וניטראליים בma העכברבלוטת mmary. BTN1 (אדום) הוא זוהה על ידי IIF בבלוטת החלב עכבר ביום 10 בהנקה. שומנים ניטראליים (CLDs וMFGs) ו- DNA הגרעיני counterstained עם bodipy 493/503 (ירוק) ו DAPI (כחול), בהתאמה. תמונות נרכשו באמצעות מיקרוסקופ confocal כZ-ערימה לכל ערוץ צבע והיו הודעה שטופלו עם ImageJ ליצור Z-ערימה מורכבת הכופה שלושה ערוצי צבע. ImageJ (הקרנת 3D) שימש נוסף ליצירה (ציר y) מסתובב תצוגה המרחבית של Z-הערימה המורכבת. אנא לחץ כאן כדי לצפות בסרטון זה.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
IHC הוא שיטה ניסיונית יחסית פשוטה וישירה בתרגום אנטיגן בסעיפים רקמות, שתלוי בעיקר באינטראקציות epitope-נוגדן ספציפיים. למרות מספר גדול של פרוטוקולים המשמש בתרגום חלבון על ידי IIF, הליבה של הליכים אלה היא כמעט תמיד זהה. עם זאת, יש כמה היבטים קריטיים שיכול מאוד להשפיע על התוצאה ולכן צריך להיות מותאם לכל מחקר IHC בודד. ההיבט המאתגר ביותר של גישה זו הוא לקבוע את תנאי הניסוי הטובים ביותר, כלומר., אלה שהניבו איתות חזקה וספציפית לאנטיגן של עניין. המשתנים שיש לקחת בחשבון לעיצוב ואופטימיזציה ניסיוניים הם: (1) הסוג של אנטיגן (מינים, רמות ביטוי, מיקום subcellular); (2) סוג epitope (רצף, קונפורמציה, לאחר translational שינויים משוערים); הכנת מדגם (3) (הטבעה בפרפין או לחלקים קפואים); (4) ספיד הקיבעוןOD (זלוף או טבילה); (5) מקבע משמש (פורמלדהיד, אלכוהול או אצטון); (6) מגיב החסימה בשימוש (סרום נורמלי, BSA או חלב דל שומן); (7) צעד AR; שיטת זיהוי (8) (ישיר או עקיף); (8) הסוג של נוגדן ראשוני (חד שבטי או polyclonal); (9) נוגדנים משני (מינים ותווית); (10) counterstains (גרעיני ו / או תיוג תא סלולארי אחר); ו( 11) ההרכבה בינונית (ראה טבלה 1 לפרטים נוספים). הקיבעון והצעדים החסימה, לפחות, דורשים אופטימיזציה של גורמים נוספים, כגון ריכוז, pH, טמפרטורה, זמן דגירה וdiluent.
ההיבט החיוני הראשון נוגע להכנת דגימות רקמה, אשר קשור באופן הדוק לשיטת הקיבוע, אשר בתורו משפיעה על איכות התוצאות. לדוגמא, יכולות להיות קבועות חתיכות רקמה או לא לפני ההטבעה. צעד זה עשוי גם תלוי בשיטת ההטבעה נבחרה, כלומר, מתחם אוקטובר לעומת הטבעת פרפין, שהיא עצמה לפעמים תלוי בנוגדן הראשוני בשימוש. קיבעון רקמות ניתן לבצע in vivo על ידי מרוסס חיה הרדים עם פתרון מקבע. שיטה זו שימושית כדי לשמור על אנטיגנים כאשר לומדים רקמות שלמות אבל לא יכולה להיות מספיק כדי לתקן את הרקמות של עניין. במקרה זה, פיסות רקמה קטנות (לא עבה יותר 10 מ"מ) יכולות להיות שקועה בפתרון מקבע. רקמה קפוא יכולה להיות מוכנה על ידי טבילת הרקמות בחנקן נוזלי או איזופנטאן, וsnap-הקפאה מומלצת מאוד לגילוי הבא של לאחר translational שינויים כגון זרחון. עם זאת, בניגוד לרקמות מוטבעת פרפין, הקפאה היא לא מתאימה לשימור לטווח הארוך של הרקמות עקב היווצרות של גבישי קרח בתוך התאים שעשויים לשנות מורפולוגיה subcellular. ברגע שהחתך, ניתן לאחסן קטעי רקמה קפוא ב -80 ° C עד 1 שנה. בכל מקרה, הכנת דגימות הרקמה היא פשרה בין השמירה על הרקמה/ ארכיטקטורה סלולרית ושמירה על שלמות epitope.
מאז זה משנה את ההרכב הכימי של רקמות, חיוני כדי לייעל את תנאי הקיבעון להימנע שני קיבעון שלם (תחת קיבעון) ומוגזם (overfixation).
ואכן, underfixation עשוי להפחית את האות הספציפית על ידי קידום השפלה פרוטאוליטים של אנטיגנים מסוימים. מצד השני, overfixation יכול לשנות את התיוג הספציפי על ידי מיסוך epitope או יצירת רקע שאינו ספציפי חזק. כך, בנוסף לבחירה של הפתרון מקבע, פרמטרים אחרים כגון זמן הדגירה, הטמפרטורה והחומציות ישפיעו קיבעון רקמות. למרות PFA הוא מקבע הנפוץ ביותר בשימוש לIHC, זה לא יכול להיחשב כמקבע "אוניוורסלי". PFA גורם חלבון-חלבון וקישורים צולבים חומצת חלבון גרעין ובכך יכול לשנות artefactually epitope (overfixation) ולאחר מכן למנוע Recognition ידי הנוגדן הראשוני. עם זאת, epitope ניתן חשף עוד יותר על ידי טכניקות AR (ראה להלן). PFA יכול להיות גם אינו מתאים לזיהוי של אנטיגנים מסוימים, כפי שהוכח לגרום טרנסלוקציה של חלבונים מסוימים phosphorylated מהקרום לציטופלסמה. במקרים כאלה, PFA חייב להיות מוחלף על ידי fixatives החלופי המתאים כגון אלכוהול. שלא כמו PFA, אלכוהול כמו מתנול או אתנול לא להסוות אפיטופים שכן הם מאפשרים קיבוע רקמה על ידי החלפת מולקולות מים ברקמות. זה יכול להוביל למשקעים של החלבונים ולאחר מכן למנוע אינטראקציה הנוגדן / epitope עקב שינויי קונפורמציה. הוא חשב נרחב שאלכוהול אינו חודר ובכך לא לשמר מורפולוגיה רקמה כמו גם PFA. אצטון הוא עוד מקבע חלופי, אשר בדרך כלל משמש בעת עבודה עם חלקים מבולבל, snap-קפוא רקמות. עם זאת, אצטון הוא סוכן Dehydrating חזק ויכול להוביל למשקעים בלתי הפיכים של חלבוני רקמה.
עבור חלק אנטיגנים, ייתכן שיידרש צעד נוסף של AR לקבל אות טובה, בעיקר אם מקבע גורם שינוי קונפורמציה או משנה את המטען אלקטרוסטטי של אפיטופ (מיסוך של אפיטופ). שיטות AR שואפות להפוך תהליכים אלה כדי לשחזר את immunoreactivity של epitope והאינטראקציה הבאה שלה עם הנוגדן הראשוני. שיטות AR בעיקר מסתמכות על שתי גישות: (1) אחזור מושרה פרוטאז epitope, כלומר, עם אנזימים כגון proteinase K, טריפסין או פפסין, שדבק בפפטידים שלהסוות את epitope; ו- (2) שליפת epitope מושרה חום, כלומר, באמצעות תנור מיקרוגל, סירי לחץ, קיטור ירקות, autoclaves או אמבטיות מים. גישה זו אחרונה היא גוזלת זמן במיוחד, לטמפרטורה, buffer-, וpH רגיש, ואת התנאים אופטימליים צריכים להיקבע באופן אמפירי (למשל מסופק בסעיף הפרוטוקול). לחלופין, את הזיקה של נוגדן לאנטיגן שלה יכולה להיות משופרתעל ידי שינוי החומציות או ריכוז קטיון של diluent הנוגדן.
לפעמים נדרש צעד permeabilization לקבל אות טובה לepitope תאיים בסעיפים רקמות עבים, במיוחד עבור מכתים אנטיגן גרעיני. זו יכולה להיות מושגת בדרכים שונות על ידי שימוש: (1) אלכוהול או אצטון כfixatives; או (2) חומרי ניקוי כגון טריטון, NP-40 (0.1-0.2% ב- PBS, 10 דקות), digitonin, saponin או Tween 20 (0.2-0.5% במשך 10 עד 30 דקות) לאחר קיבוע PFA. עם זאת, הבחירה של חומר הניקוי תלויה במיקום הסלולרי של epitope זוהה. ואכן, חומרי ניקוי חריפים כגון טריטון-X100, אשר solubilize קרומים תאיים, מתאימים לזיהוי epitope גרעיני אבל יכול להוביל לשינוי לאותת על החילוץ של כמה חלבונים קרומיים. השימוש בחומרי ניקוי מתון יותר (saponin וTween 20) מתאים יותר לזיהוי של אפיטופים cytoplasmic.
השלב הקריטי השני הוא blockinגרם של כתמים שאינם ספציפיים. הכריכה של נוגדן לאפיטופ היעד שלה נשלטת על ידי כוחות מולקולאריים (אינטראקציות למשל, הידרופובי ויוניות, קשרי מימן). כך, אינטראקציות של נוגדנים עיקריים ו / או משניים עם חלבונים אחרים מאשר אנטיגנים היעד שלהם עלולות לגרום להכתמה שאינה ספציפית. זה יוצר רקע הקרינה גבוהה, אשר מונע ההדמיה של החלבון של עניין (אות / יחס רעש נמוך). חסימת ריאגנטים מפחיתה אינטראקציות שאינן ספציפיות מבלי לפגוע אינטראקציה הנוגדן / epitope ספציפי. הליך נפוץ מורכב מדוגר סעיפי רקמות עם סרום נורמלי חום מומת או BSA. בעת שימוש בסרום נורמלי, זה חייב להיות מאותו המין כמו זה של בעלי החיים המארח של הנוגדנים משני או ממינים שאינם קשורים. בכל המקרים, מגיב חסימה הנבחרת חייבים גם להוסיף לחומר המדלל לנוגדנים הראשוניים ומשניים. יתר על כן, השימוש בחומרי ניקוי שאינו יוניים כגון טריטון X-100, TWeen saponin או 20 עוזר להפחית אינטראקציות שאינן ספציפיות.
הפרמטר השלישי וכנראה החשוב ביותר הוא בחירת הנוגדן הראשונית ואופטימיזציה. ברור, הבחירה הטובה ביותר הוא נוגדן באיכות גבוהה עם תגובה צולבת מינימאלית. כנוגדנים חד שבטיים בדרך כלל תערוכה זיקה גבוהה וספציפיות לאפיטופ בודד, הם הכלים הטובים ביותר להפלות חבר מסוים של חלבון משפחה עם זהות גבוהה רצף. עם זאת, האינטראקציה הנוגדן / epitope יכולה להיות בסכנה אם epitope היעד איבד מדינת קונפורמציה האם שלה או בעת הגישה לאפיטופ נמנעה על ידי אינטראקציות עם חלבונים אחרים, שלאחר translational שינויים, טמפרטורה, pH, קיבעון וריכוז מלח. במקרים כאלה, נוגדני polyclonal מתאימים יותר כפי שהם מכירים epitopes מרובה של אותו החלבון. יתר על כן, הם לעתים קרובות יציבים יותר מנוגדנים חד שבטיים על פני טווח רחב של pH וריכוז מלח.מחקרים ראשוניים צריכים להגדיר את תנאי דגירה המתאימים, כלומר, דילול (נוגדן חד שבטי: 5-25 מ"ג / מיליליטר, נוגדן polyclonal: 1.7-15 מ"ג / מיליליטר) עובד, זמן דגירה, diluent וטמפרטורה, אשר צריך לקבוע באופן אמפירי ל כל נוגדן ראשוני. פרמטרים אלו צריכים להיות מותאמים כדי לקבוע את התנאים שמייצרים אות האופטימלית עם רעשי רקע נמוכים. הספציפיות של התיוג היא מועדף על ידי פעמים דגירה ארוכות יותר בטמפרטורות נמוכות יותר (כלומר., 4 ° C לעומת RT).
הבחירה לבצע זיהוי ישיר או עקיף תלויה לעתים קרובות ברמה של ביטוי אנטיגן. לדוגמא, epitope הביע מאוד יכול פשוט להיות מזוהה עם נוגדן ראשוני fluorochrome- מצומדות, ובכך מאפשר צביעה ססגוניות מהירה ופשוטה, תוך הימנעות רקע שאינו ספציפי אפשרי בשל השימוש בנוגדנים משני. עם זאת, ישיר, אם במאי מייצר אות נמוכה במחיר גבוה יותר, ויכול שלראשון לפעמים להיות קשה, נוגדן כאשר כותרתו אינו זמין באופן מסחרי. לעומת זאת, IIF הוא רגיש יותר לזיהוי epitopes הביעה נמוכה כאות שנוצרה היא אינטנסיבית יותר עקב האינטראקציה של לפחות שני נוגדנים משני שכותרתו (שהועלתה נגד מיני מארח נוגדן הראשוניים) עם הנוגדן הראשוני (הגברה). יתר על כן, מגוון רחב של נוגדנים משני מצומדת לfluorophores השונות הם זמינים מסחריים, זולים יחסית, ואיכות מבוקרת. עם זאת, גישה זו יכולה לגרום לתגובה צולבת ולכן דורשת לבחור בזהירות נוגדנים ראשוניים שלא מיוצרים באותו מין או של isotypes שונה בעת ביצוע ניסויים מרובה-תיוג. IIF גם לפעמים דורש צעדי חסימה נוספים ולכלול בקרות שליליות שיטתיות (ראה להלן). הגברה יכולה להיות מושגת על ידי שימוש נוספת נוגדנים משני ביוטין-מצומדות ושכותרתו fluorescently avidin או streptavidin (ארבעה biotins מחויבת לכל מוlecule). עם זאת, שיטה זו דורשת הגברה צעדים נוספים כדי למנוע הלא ספציפי מחייב ולא יכולה להיות מותאמת עבור הצביעה של רקמות מסוימות (כבד, כליות, לב, מוח, ריאות ומניקות בלוטת החלב) בשל הנוכחות של רמות גבוהות של ביוטין אנדוגני . עם זאת, ביוטין אנדוגני יכול להיחסם על ידי מראש דוגרים מדגם עם avidin ולאחר מכן עם ביוטין לפני דגירה עם הנוגדן הראשוני. הבחירה של fluorochromes מצומדות, שהם מולקולות כימיות קטנות עם הנכס לפולטות אור כאשר נרגש על ידי אור באורך גל קצר יותר, בעיקר תלוי בסוג של ציוד מיקרוסקופ זמין.
כאשר מתוכנן כראוי להגביל גם תגובה צולבת בין הנוגדנים ומוצלבים בין מאפייני רפאים של fluorochromes משמש, IHC מבוסס immunofluorescence מאפשר ההדמיה בו זמנית של יעדים סלולריים מרובים.
האחרון קריטינקודה לגבי ניסויי IHC נוגעת לבקרות החיוביות ושליליות שיש לבצע כדי לתמוך בתוקפו של צביעה, לזהות חפצים ניסיוניים ולפרשנות מדויקת של התוצאות. רקמות מסוימות מפגינות רקע גבוה פלורסנט (המכונה autofluorescence), שעלולה להוביל לפירוש לא נכון של התוצאות. לפיכך, קטעי רקמה צריכים להיות שנצפו תחת שתי תאורת הקרינה ובהיר שדה לפני תחילת ניסוי IHC. ביקורת שלילית שמשמיטה את הנוגדן הראשוני חייבים להיות כלולה באופן שיטתי בכל ניסוי IHC כדי להבטיח שאינו ספציפי פוטנציאל המחייב של הנוגדנים משני הוא זניח ולא מעורפל או דומה לדפוס מכתים הספציפי. שליטת אלוטיפ יכולה להתבצע בעת עבודה עם נוגדן ראשוני חד שבטי על ידי החלפתו בנוגדן שאינו חיסוני של אותו אלוטיפ (למשל, IgG1, IgG2a, IgG2B, IgM) באותו הריכוז. שליטה זו מסייעת לestimate הצביעה שאינה ספציפית, שיכול להיות בגלל האינטראקציות של נוגדנים עם המדגם. כדי להדגים את ספציפי מחייב של נוגדנים לאנטיגן שלה, שליטת קליטה ניתן להשיג בשתי דרכים על ידי מראש דוגרים נוגדן הראשוני: (1) עם immunogen המסיס: O (10 1 יחס טוחנת) / N ב 4 ° C ; ו- (2) עם תאים או חלקי רקמות המבטאים את epitope של עניין, אבל זה שונה מהרקמה למדה (לדוגמא, ראה איור 4 ב -59). בשני המקרים, הדלדול הסוגר של הנוגדן הראשוני צריך להוביל להכתמה קטנה או לא. סוג אחר של שליטה ניתן לעשות זאת באמצעות נוגדן ראשוני לא רלוונטי, כלומר., מכוון נגד epitope שמציג לוקליזציה סלולרית שונה מepitope של עניין (גרעינית לעומת cytoplasmic). הנוגדן רלוונטי חייב להיות מאותו אלוטיפ והמינים כנוגדן הראשוני של עניין. בקרות נוספות לניסויי IHC יכולות לכלול שימוש בדגימות מTissUES הידוע להביע (בעלי חיים מהונדסים) או לא (בעלי החיים נוק-אאוט) epitope של עניין. זה יכול לספק התייחסות שימושית ולעזור כדי לייעל את הליך IHC.
מגבלה העיקרית של טכניקות IF היא שהם יכולים להיות מיושמים רק לקבועים (מתים) ו / או permeabilized תאים, שני הליך פוטנציאל גרימת חפצים. מגבלות אחרות של גישה זו הן תוצאה של השימוש במיקרוסקופ לתצפית של הדגימות. ראשית, כפי שהרזולוציה האופטית של מיקרוסקופי epifluorescence וconfocal מוגבלת, מיקום או שיתוף מיקום של החלבונים שזוהו אין לפרש-על. שנית, photobleaching, כלומר. הדהיה של עוצמת הקרינה לאורך זמן כאשר נחשפו לאור, הוא למעשה בשל דור של מיני חמצן מגיבים במדגם על עירור הקרינה ש, בתורו, מוביל להרס פוטו של fluorophore. Photobleaching יכול להיות מופחת על ידי: א) שמירה על הדגימות מוגנות מאור במהלך ניסוי IF והאחסון עד התצפית שלהם; ב) באמצעות סוכן antifade (אוכלי נבלות מיני חמצן מגיב) בהרכבה בינונית; ג) הפחתת עוצמת ו / או משך הזמן של אור העירור; ד) הגדלת הריכוז של fluorophores או באמצעות ריכוז נמוך של fluorochrome עם יעילות גבוהה קוונטים; וה) באמצעות fluorophores החזקה כי הם נוטים פחות photobleaching (כלומר. Alexa Fluors, סטה Fluors, או DyLightFluors). שלישית, autofluorescence הוא לעתים קרובות בשל נוכחותם של coenzymes פלבין (FAD וFMN: קליטה, 450 ננומטר; פליטה, 515 ננומטר) ונוקלאוטידים פירידין מופחתים (NADH: קליטה, 340 ננומטר; פליטה, 460 ננומטר) בתאי יונקים. יתר על כן, השימוש באלדהידים, במיוחד glutaraldehyde, כדי לתקן את הדגימות, יכול לגרום לרמות גבוהות של autofluorescence. זה יכול להיות ממוזער על ידי שטיפת הדגימות עם 0.1% borohydride נתרן ב PBS לפני הדגירה נוגדן ו / או על ידי בחירת בדיקות ומסננים אופטיים שמ 'aximize אות הקרינה יחסית לautofluorescence. רביעית, חפיפה הקרינה (המכונה גם לדמם דרך, מוצלב או crosstalk) היא בעיקר בשל מאפייני רפאים הפליטה של fluorophores כפי שהם לעתים קרובות מפגינים רוחבי פס רחב מאוד, פרופילים שונים, סימטריים רפאים, כמו גם אורכי גל פליטת שיא שונים ומספר מקסימום. חפיפה הקרינה מתרחשת כאשר עובד עם כמה fluorophores (תיוג ססגוניות) ומתאפיין בפליטה של fluorophore אחד בערוץ (המסנן) של fluorophore אחר. חפצים לדמם דרך חייבים להיות ממוזערים כפי שהם לעתים קרובות לסבך את הפרשנות של אם תוצאות, במיוחד במקרה של שיתוף לוקליזציה או מחקרים כמותיים. כאיזון לפליטת fluorophores ניתן לשפר רק במעט על ידי הליך IF, לדמם דרך יכול בעיקר להיות מופחת בעת רכישת תמונה על ידי שימוש במערכות מותאמות הקרינה מסנן ו / או גלאי מכפיל כדי separ כראויאכלתי את פרופילי רפאים של fluorophores. בהקשר זה, מיקרוסקופיה confocal הוא מתאים היטב להדמית ססגוניות שכן היא מאפשרת את ספקטרום פליטת הקרינה הבידול של fluorophores פרט על ידי הפניית כל אות לערוץ גילוי מסוים. יתר על כן, מיקרוסקופיה confocal מאפשרת להתאים את הרווח, מתח מכפיל, או כוח לייזר לזיהוי הערוצים הבודדים לרכישה רציפה (fluorophore אחד בלבד בכל פעם) של התיוג. באופן אידיאלי, בקרות יחידה תווית חייבת להתבצע לכמת לדמם דרך וסופו של דבר להסיר אותו המחשוב. שליטה ללא נוגדנים משני (שליטת רקע) יכולה להיות מוכנה להגדיר את גבולות רווח אות וקיזוז של כל ערוץ לרכישת תמונה אופטימלית. גם זה יכול לשמש לעיבוד שלאחר הרכישה לרקע נכון תמונה (autofluorescence).
לסיכום, בשיטה המתוארת מספקת פרוטוקול סטנדרטי פשוט לrealizati קלעל של immunostaining על סעיפי בלוטת החלב. עם זאת, הצעדים העיקריים של ניסוי IHC חייבים להיות מותאמים לכל אנטיגן / נוגדן זוג כדי להמחיש צביעה ספציפית וכדי למזער את אותות רקע שאינם ספציפיים. השיטה המתוארת כוללת גם מספר שיטות בסיסיות לפוסט-הטיפול ברוב התמונות שהתקבלו. immunodetection הקרינה מבוססת הוא שיטה חזקה עם מגוון רחב של יישומים מהלוקליזציה הסלולרית של אנטיגן לאבחון. התקדמות חדשה בגישות אלה תושג עם ההתפתחות העתידית של fluorophores החדשה, מכשירי רכישה ושיטות מיקרוסקופיה, לתמונה בעבר פרטים בלתי נצפים של מבנים ותהליכים ביולוגיים.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
המחברים מצהירים שאין להם אינטרסים כלכליים מתחרים.
Acknowledgments
המחברים מודים למתקן גרעין ההדמיה INRA MIMA2 (INRA, UMR1198, Jouy-en-Josas) וצוות של יחידת IERP (UE 0,907, INRA, Jouy-en-Josas) לטיפול בבעלי חיים ומתקנים. כמו כן, אנו רוצים להודות לIH מאת'ר, MC נוויל וס Tooze שספק לנו antibodie מאוד שימושי.
Materials
| Name | Company | Catalog Number | Comments |
| Dissection | |||
| Pins | |||
| Ethanol | |||
| Scissors | |||
| Scalpel and adapted blades | |||
| Ice | |||
| Towel paper | |||
| Tissue sample preparation | Company | Catalog Number | Comments/Description |
| Phosphate Buffered Saline (pH7.4) | Sigma | P-3813 | |
| Paraformaldehyde (PFA, 32% EM grade, 100 ml) | Electron Microscopy Sciences | 15714-S | personnal protection equipment required WARNING: this product will expose you to Formaldehyde Gas, a chemical known to cause cancer |
| OCT compound/Tissue Tek | Sakura | 4583 | |
| Sucrose (D-saccharose) | VWR | 27480.294 | |
| Plastic molds | Dominique Dutscher | 39910 | |
| Liquid nitrogen | |||
| Cryostat/sample support | Leica | CM3050S | |
| Razor blades (SEC35) | Thermo Scientific | 152200 | |
| Slide box | |||
| Glass slides Superfrost/Superfrost Ultra Plus | Thermo Scientific | 10143560W90/1014356190 | |
| Brushes | |||
| IHC | Company | Catalog Number | Comments/Description |
| Super Pap Pen | Sigma | Z377821-1EA | |
| Permanent marker (black) | |||
| 50 mM NH4Cl in PBS | Sigma | A-0171 | |
| 0.1 M glycine in PBS | VWR | 24403.367 | |
| Antigen Retrieval solution: Tris 100 mM 5% urea pH9.6 | |||
| Heater (up to 100°C) | |||
| Bovine Serum Albumin (BSA) | Sigma | A7906-100G | |
| Vectashield (anti-fading mounting medium) without DAPI/with DAPI | Vector Laboratories | H-1000/H-1200 | |
| Glass coverslips 22x50mm (microscopy grade) | VWR | CORN2980-225 | |
| Nail polish | |||
| Primary antibodies | Company | Catalog Number | Comments/Description |
| Rabbit anti-mouse caseins (#7781; 1:50 dilution) | generously gifted by M.C. Neville (University of Colorado Health Sciences Center, USA) |
||
| Mouse anti-cytokeratin 8 (CK8, clone 1E8, 1:50 dilution) | Biolegend (Covance) | MMS-162P | |
| Mouse anti-cytokeratin 14 (CK14, cloneLL002, 1:50 dilution) | Thermo Scientific | MS-115-P0/P1 | |
| Rabbit anti-butyrophilin (1:300 dilution) | generously gifted by I.H. Mather (Department of Animal and Avian Sciences University of Maryland College Park, USA) | ||
| Rabbit anti-Stx6 (1:50 dilution) | generously gifted S. Tooze (Cancer Research UK, London Research Institute, London, UK) |
||
| Rabbit anti-VAMP4 (1:50 dilution) | Abcam | ab3348 | |
| Secondary antibodies | Company | Catalog Number | Comments/Description |
| Rhodamine-conjugated goat anti-rabbit IgG (H + L) (1:300 dilution) | Jackson ImmunoResearch Laboratories | 111-025-003 | |
| Counterstains | Company | Catalog Number | Comments/Description |
| Bodipy 493/503 | Life Technologies (Molecular Probes) | D-3922 | |
| DAPI (4-6-diamidino-2-phenylindole) | Life Technologies (Molecular Probes) | D-1306 | |
| Observation/Image capture | Company | Catalog Number | Comments/Description |
| conventional fluorescence microscope | Leica Leitz DMRB microscope |
Standard filters for FITC, Rhodamine and DAPI emissions, ×63 oil-immersion objective (NA 1.3), DP50 imaging camera (Olympus), CellˆF software (Olympus) |
|
| Laser Scanning Microscope (confocal microscopy) | Zeiss LSM 510 microscope |
Plan-Apochromat ×63 oil-immersion objective (NA 1.4), CLSM 510 software, Confocal facilities, MIMA2 Platform, INRA Jouy-en-Josas, France, http://mima2.jouy.inra.fr/mima2) | |
| Image treatment | Company | Catalog Number | Comments/Description |
| ImageJ 1.49k software | Free software |
References
- Watson, C. J., Khaled, W. T. Mammary development in the embryo and adult: a journey of morphogenesis and commitment. Development. , 135-995 (2008).
- Smith, G. H. Experimental mammary epithelial morphogenesis in an in vivo model: evidence for distinct cellular progenitors of the ductal and lobular phenotype. Breast Cancer Res Treat. 39, 21-31 (1996).
- Van Keymeulen, A., et al. Distinct stem cells contribute to mammary gland development and maintenance. Nature. 479, 189-193 (2011).
- Oakes, S. R., Gallego-Ortega, D., Ormandy, C. J. The mammary cellular hierarchy and breast cancer. Cell Mol Life Sci. 71, 4301-4324 (2014).
- Visvader, J. E., Stingl, J. Mammary stem cells and the differentiation hierarchy: current status and perspectives. Genes & development. 28, 1143-1158 (2014).
- Robinson, G. W. Cooperation of signalling pathways in embryonic mammary gland development. Nat Rev Genet. 8, 963-972 (2007).
- Cowin, P., Wysolmerski, J. Molecular mechanisms guiding embryonic mammary gland development. Cold Spring Harb Perspect Biol. 2, a003251 (2010).
- Brisken, C., O'Malley, B. Hormone action in the mammary gland. Cold Spring Harb Perspect Biol. 2, a003178 (2010).
- Gjorevski, N., Nelson, C. M. Integrated morphodynamic signalling of the mammary gland. Nat Rev Mol Cell Biol. 12, 581-593 (2011).
- Daniel, C. W., Smith, G. H. The mammary gland: a model for development. J Mammary Gland Biol Neoplasia. 4, 3-8 (1999).
- Howlett, A. R., Bissell, M. J. The influence of tissue microenvironment (stroma and extracellular matrix) on the development and function of mammary epithelium. Epithelial Cell Biol. 2, 79-89 (1993).
- Edwards, G., Streuli, C. Signalling in extracellular-matrix-mediated control of epithelial cell phenotype. Biochem Soc Trans. 23, 464-468 (1995).
- Hennighausen, L., Robinson, G. W. Think globally, act locally: the making of a mouse mammary gland. Genes & development. 12, 449-455 (1998).
- Topper, Y. J., Freeman, C. S. Multiple hormone interactions in the developmental biology of the mammary gland. Physiol Rev. 60, 1049-1106 (1980).
- Brisken, C., et al. A paracrine role for the epithelial progesterone receptor in mammary gland development. Proc Natl Acad Sci U S A. 95, 5076-5081 (1998).
- Ormandy, C. J., Binart, N., Kelly, P. A. Mammary gland development in prolactin receptor knockout mice. J Mammary Gland Biol Neoplasia. 2, 355-364 (1997).
- Oakes, S. R., Rogers, R. L., Naylor, M. J., Ormandy, C. J. Prolactin regulation of mammary gland development. J Mammary Gland Biol Neoplasia. 13, 13-28 (2008).
- Hennighausen, L., Robinson, G. W. Information networks in the mammary gland. Nat Rev Mol Cell Biol. 6, 715-725 (2005).
- Kouros-Mehr, H., Werb, Z. Candidate regulators of mammary branching morphogenesis identified by genome-wide transcript analysis. Dev Dyn. 235, 3404-3412 (2006).
- Khaled, W. T., et al. The IL-4/IL-13/Stat6 signalling pathway promotes luminal mammary epithelial cell development. Development. 134, 2739-2750 (2007).
- Asselin-Labat, M. L., et al. Gata-3 is an essential regulator of mammary-gland morphogenesis and luminal-cell differentiation. Nat Cell Biol. 9, 201-209 (2007).
- Barcellos-Hoff, M. H., Aggeler, J., Ram, T. G., Bissell, M. J. Functional differentiation and alveolar morphogenesis of primary mammary cultures on reconstituted basement membrane. Development. 105, 223-235 (1989).
- Robinson, G. W., McKnight, R. A., Smith, G. H., Hennighausen, L. Mammary epithelial cells undergo secretory differentiation in cycling virgins but require pregnancy for the establishment of terminal differentiation. Development. 121, 2079-2090 (1995).
- Streuli, C. H., Bissell, M. J. Mammary epithelial cells, extracellular matrix, and gene expression. Cancer Treat Res. 53, 365-381 (1991).
- Streuli, C. H., et al. Laminin mediates tissue-specific gene expression in mammary epithelia. J Cell Biol. 129, 591-603 (1995).
- Boudreau, N., Sympson, C. J., Werb, Z., Bissell, M. J. Suppression of ICE and apoptosis in mammary epithelial cells by extracellular matrix. Science. 267, 891-893 (1995).
- Pullan, S., et al. Requirement of basement membrane for the suppression of programmed cell death in mammary epithelium. J Cell Sci. 109 (Pt 3), 631-642 (1996).
- Schmidhauser, C., Bissell, M. J., Myers, C. A., Casperson, G. F. Extracellular matrix and hormones transcriptionally regulate bovine beta-casein 5' sequences in stably transfected mouse mammary cells. Proc Natl Acad Sci U S A. 87, 9118-9122 (1990).
- Streuli, C. H., et al. Stat5 as a target for regulation by extracellular matrix. J Biol Chem. 270, 21639-21644 (1995).
- Sollner, T., et al. SNAP receptors implicated in vesicle targeting and fusion. Nature. 362, 318-324 (1993).
- Jahn, R., Scheller, R. H. SNAREs--engines for membrane fusion. Nat Rev Mol Cell Biol. 7, 631-643 (2006).
- Weber, T., et al. SNAREpins: minimal machinery for membrane fusion. Cell. 92, 759-772 (1998).
- Sollner, T., Bennett, M. K., Whiteheart, S. W., Scheller, R. H., Rothman, J. E. A protein assembly-disassembly pathway in vitro that may correspond to sequential steps of synaptic vesicle docking, activation, and fusion. Cell. 75, 409-418 (1993).
- McNew, J. A. Regulation of SNARE-mediated membrane fusion during exocytosis. Chem Rev. 108, 1669-1686 (2008).
- Wang, C. C., et al. VAMP8/endobrevin as a general vesicular SNARE for regulated exocytosis of the exocrine system. Mol Biol Cell. 18, 1056-1063 (2007).
- Chat, S., et al. Characterisation of the potential SNARE proteins relevant to milk product release by mouse mammary epithelial cells. Eur J Cell Biol. 90, 401-413 (2011).
- Reinhardt, T. A., Lippolis, J. D. Bovine milk fat globule membrane proteome. J Dairy Res. 73, 406-416 (2006).
- Robenek, H., et al. Butyrophilin controls milk fat globule secretion. Proc Natl Acad Sci U S A. 103, 10385-10390 (2006).
- Fujimoto, T., Ohsaki, Y., Cheng, J., Suzuki, M., Shinohara, Y. Lipid droplets: a classic organelle with new outfits. Histochem Cell Biol. 130, 263-279 (2008).
- Mather, I. H., Keenan, T. W. Origin and secretion of milk lipids. J Mammary Gland Biol Neoplasia. 3, 259-273 (1998).
- Heid, H. W., Keenan, T. W. Intracellular origin and secretion of milk fat globules. Eur J Cell Biol. 84, 245-258 (2005).
- McManaman, J. L., Russell, T. D., Schaack, J., Orlicky, D. J., Robenek, H. Molecular determinants of milk lipid secretion. J Mammary Gland Biol Neoplasia. 12, 259-268 (2007).
- de Assis, S., Warri, A., Cruz, M. I., Hilakivi-Clarke, L. Changes in mammary gland morphology and breast cancer risk in rats. Journal of visualized experiments : JoVE. , (2010).
- Plante, I., Stewart, M. K., Laird, D. W. Evaluation of mammary gland development and function in mouse models. Journal of visualized experiments : JoVE. , (2011).
- Galio, L., et al. MicroRNA in the ovine mammary gland during early pregnancy: spatial and temporal expression of miR-21, miR-205, and miR-200. Physiol Genomics. 45, 151-161 (2013).
- Linzell, J. L., Peaker, M. The effects of oxytocin and milk removal on milk secretion in the goat. J Physiol. 216, 717-734 (1971).
- Knight, C. H., Peaker, M., Wilde, C. J. Local control of mammary development and function. Rev Reprod. 3, 104-112 (1998).
- Walid, M. S., Osborne, T. J., Robinson, J. S. Primary brain sarcoma or metastatic carcinoma? Indian J Cancer. 46, 174-175 (2009).
- Hue-Beauvais, C., et al. Localisation of caveolin in mammary tissue depends on cell type. Cell Tissue Res. 328, 521-536 (2007).
- McManaman, J. L., Neville, M. C. Mammary physiology and milk secretion. Adv Drug Deliv Rev. 55, 629-641 (2003).
- Mather, I. H., Jack, L. J. A review of the molecular and cellular biology of butyrophilin, the major protein of bovine milk fat globule membrane. J Dairy Sci. 76, 3832-3850 (1993).
- Heid, H. W., Winter, S., Bruder, G., Keenan, T. W., Jarasch, E. D. Butyrophilin, an apical plasma membrane-associated glycoprotein characteristic of lactating mammary glands of diverse species. Biochim Biophys Acta. 728, 228-238 (1983).
- Bock, J. B., Klumperman, J., Davanger, S., Scheller, R. H. Syntaxin 6 functions in trans-Golgi network vesicle trafficking. Mol Biol Cell. 8, 1261-1271 (1997).
- Tran, T. H., Zeng, Q., Hong, W. VAMP4 cycles from the cell surface to the trans-Golgi network via sorting and recycling endosomes. J Cell Sci. 120, 1028-1041 (2007).
- Wendler, F., Page, L., Urbe, S., Tooze, S. A. Homotypic fusion of immature secretory granules during maturation requires syntaxin 6. Mol Biol Cell. 12, 1699-1709 (2001).
- Wendler, F., Tooze, S. Syntaxin 6: the promiscuous behaviour of a SNARE protein. Traffic. 2, 606-611 (2001).
- Shitara, A., et al. VAMP4 is required to maintain the ribbon structure of the Golgi apparatus. Mol Cell Biochem. 380, 11-21 (2013).
- Thibault, C., Levasseur, M. C. La reproduction chez les mammifères et l'homme. , INRA Editions. 928 (2001).
- Truchet, S., Wietzerbin, J., Debey, P. Mouse oocytes and preimplantation embryos bear the two sub-units of interferon-gamma receptor. Mol Reprod Dev. 60, 319-330 (2001).



