Summary
Косвенным протокол иммунофлюоресценции описано в этой статье позволяет обнаруживать и локализовать белков в молочной железе мыши. Полный метод ее подготовки молочных желез образцы, для выполнения иммуногистохимии, чтобы изображение на срезах тканей с помощью флуоресцентной микроскопии, и, чтобы восстановить изображение.
Abstract
Непрямой иммунофлуоресценции используется для обнаружения и определения местоположения интерес белков в ткани. Протокол, представленные здесь описывает полное и простой способ для иммунной обнаружения белков, мышь лактирующих молочную железу, принимаемых в качестве примера. Протокол для подготовки образцов ткани, особенно в отношении рассечение молочной железы мыши, ткани фиксации и замороженной ткани срезов, подробно. Стандартный протокол для выполнения непрямой иммунофлюоресценции, в том числе дополнительного шага поиска антигена, также представлены. Наблюдение меченых срезов, а также получение изображений и пост-обработки также заявил. Эта процедура дает полный обзор, из коллекции тканей животных в клеточной локализации белка. Хотя это общий способ может быть применен к другим образцов ткани, она должна быть приспособлена к каждой ткани / первичным антителом пару изучены.
Introduction
Молочная железа является нетипичным млекопитающих экзокринной орган, основной функцией которого является производство молока, чтобы кормить новорожденных. Развитие ткани молочной железы происходит главным образом после родов и характеризуется уникального процесса, в котором эпителий вторжению в окружающую строму. Эта ткань подвергается много изменений (рост, дифференцировку и регрессия), особенно во время взрослой жизни, одновременно с изменениями в репродуктивного статуса (рисунок 1). В дополнение к общей морфологии ткани, пропорции различных типов клеток, а также их расположение в молочной железе резко изменяются в течение развития 1-5.
Во время эмбрионального жизни, молочной эпителия происходит от молочных линий молоко, которое определяется небольшим утолщением и стратификации эктодермы, между передними и задними конечностями с каждой стороны от средней линии вокруг эмбрионального день 10,5 (E10.5) (рис 1А ).На E11.5, молокопровод распадается на отдельные плакодах, которые симметрично расположены вдоль линии молочной молоко воспроизводимых местах, и окружающие мезенхимы начинает конденсироваться. Плакод начинают все глубже в дерму и молочной мезенхимы организует в концентрических слоев вокруг молочной зародыше (E12.5-E14.5). По E15.5, молочной эпителий, начинает размножаться и удлиненные, чтобы сформировать первичную росток, который толкает через молочной мезенхимы к жировой ткани. Основной росток развивает полый просвет с отверстием для кожи, отмеченной формирования соска оболочки. На E18.5, то удлиняя канал превратился в жировой ткани и имеет разветвленную в небольшой arborized системы протоков охватила в жировой ткани. Разработка, по существу, арестован и в зачаточном состоянии молочной железы остается морфогенетически покоя до наступления половой зрелости. В мужской эмбрион, активация рецепторов андрогенов приводит к дегенерации почек, которые исчезаютпо E15.5. По E18, молочной развития не перестает до полового созревания 6-9.
При рождении, молочной железы таит в себе элементарное систему протоков, что продлевает и филиалы медленно (изометрической роста). В начале полового созревания, сферические структуры, расположенные на кончиках протоков называют концевой почки (TEBS), образуются из внешнего слоя клеток рака простаты и многослойной внутреннего ядра клеток (клеток тела). Эти структуры являются весьма пролиферативного и проникнуть в окружающую ткань стромы в ответ на гормональные сигналы. Распространение в результатах TEBS в протоковой удлинения, в сочетании с морфогенеза ветвления. Этот процесс приводит к созданию основного эпителиального arborized сети, исходящей из соска (рис 1B, период полового созревания). В ~ 10-12 недель после рождения, когда эпителий вторглись весь жировой ткани, ее расширение прекращается и TEBS исчезают. Развитие протоков затем подвергается динамические изменения, т.е. успехуве пролиферацию и регресс эпителиальных клеток в соответствии с эстрального цикла 10 (Рис 1В, взрослых).
С самого начала беременности, молочной ткани подвергается существенный рост и морфологические изменения, чтобы подготовиться к лактации. Молочная эпителия интенсивно пролиферируют и дифференцируются, что ведет к сильно разветвленного тубуло-альвеолярного сети. Одновременно, эпителиальных клеток молочной железы (МИК) поляризованы и способны синтезировать и секретировать молочные продукты. МИК организовать в многочисленных альвеолярных структур (ацинусов), которые окружены сократительных клеток миоэпителиальных и включены в строме, состоящей из соединительной ткани и жировой, кровеносных сосудов и нервных окончаний (Фигура 1В, беременность). Кроме того, базальные сторона MECs находится в тесном контакте с базальной мембраной (внеклеточного матрикса), и взаимодействие между этими двумя организациями плотно регулировать как морфогенез и секреторную функцию молочной железыры эпителий 11-13.
Все эти процессы опираются на действия различных экологических киев, из которых наиболее важными являются hormones14, паракринных факторов и внеклеточного матрикса. Например, прогестерон вызывает обширный боковой ветвления 15 и alveologenesis, что, в сочетании с пролактина (PRL) 16,17, продвигает и поддерживает дифференцировку альвеол. В дополнение к стероидам и PRL18, цитокинов и сигнальных путей, связанных с развитием (Wnt и Notch сигнальными путями) также участвуют в молочной приверженности клонов и развития 19-21. В конце беременности, просвета МИК начинают производить богатой белком молока, известный как молозиво в просвете альвеол. Кроме того, прогестерон действует на эпителиальной проницаемости и так как плотные соединения остаются открытыми, молозиво также в материнском кровотоке.
После родов, то Mammarу эпителий занимает почти всю молочную железу и объема имеет высокую степень организации (рисунок 2, эпителия молочной железы). Молоко производящих единиц, а именно альвеолы (Рисунок 2, альвеолы), формируются монослоя поляризованных эпителиальных молочных секреторных клеток (MESCs), с их апикальной плазматической мембраны разграничения просвет. Альвеолы организовать себя на дольки, которые сгруппированы в долях, связанных с каналами, которые истощают молоко с внешним среде (рис 2, доли). Лактации происходит, т.е.., MESCs начинают секретировать обильные количества молока, в первую очередь вызвано снижением плацентарных гормонов (главным образом прогестерон) (фиг.1В, лактации). Гены молочного белка активируются в определенном временном время хода в диапазоне от беременности лактации 9,22,23, главным образом, в ответ на PRL гипофиза, опубликованном в момент кормления грудью. Одновременно, контакты между MESCs и внеклеточного матрикса как стимулировать молочный белок SYNThesis через сигналы, которые передаются через взаимодействий между клеточными интегринов и ламинином 24,25, подавляющих апоптоз и в MESCs 26,27. Эти сигнальные пути приводит к активации молочного белка промоторов генов 28 через активацию факторов транскрипции конкретного 29. Межклеточных контактов также важны для некоторых аспектов дифференцировки, включая создание верхушечного полярности и векторной секреции молочных продуктов. Плотные соединения быстро закрыть после начала лактации и MESCs мелко организовать поглощение молекул из крови, а также синтеза, транспорта и секреции молочных компонентов, в ответ на потребности в питании новорожденных. Во время сосания, сокращение миоэпителиальных клеток, окружающих альвеолы происходит в ответ на окситоцина и приводит к выделению молока по протокам и в соске. Молоко представляет собой сложную жидкость, которая содержит белки (в основномказеин), сахара (в основном лактозы), липиды и минеральные вещества, а также биологически активные молекулы, такие как иммуноглобулины (IgA), факторов роста и гормонов. Казеины синтезируются, собраны в супрамолекулярных структур, а именно казеин мицеллы, транспортируемые вдоль секреторного пути, а затем выпущен экзоцитоза, то есть сплав казеина, содержащего секреторные везикулы (КА) с апикальной мембране мЭСК (рисунок 2).
Внутриклеточного транспорта зависит от материальных обменов между мембранных отсеков и включает в себя Растворимый N-этилмалеимид-Чувствительный Fusion (NSF) Приложение белка (SNAP) рецепторов (SNARE) 30,31. Семья SNARE белки подразделяется на везикулярного SNAREs (V-ловушки), присутствующих в мембране везикул и целевых SNAREs (т-ловушки), локализованные на целевых мембран. По сжать через их биспиральных доменов, V и Т-SNAREs собрать с образованием высокостабильный четыре спиралей комплекс, называют йе SNARE комплекс. Этот комплекс способствует сочетание двух противоположных липидного бислоя постепенно привести их в непосредственной близости 30,32. Впоследствии, Малый комплексы диссоциируют на NSF аденозинтрифосфатазы и его адаптер белка SNAP и малого белки возвращают обратно в купе происхождения 33. Интересно, что каждый белок SNARE преимущественно проживает в различных клеточных отсеках и малого спаривания может внести свой вклад в специфичность внутриклеточных событий термоядерных 34. Предыдущие исследования показывают, что, по крайней мере Синаптосомальное-ассоциированный белок 23 (SNAP23) и везикул-ассоциированный мембранный белок 8 (VAMP8) и syntaxins (STX) -7 -12 и играют важную роль в казеина экзоцитоза 35,36. Эти белки были также обнаружены в ассоциации с липидной фракции молока, т.е. молоко жировых шариков (МФГС) 37. В настоящее время преобладает модель постулирует, что цитоплазматические капли липидов (CLDs) образуются в результате накопления нейтральной лipids (главным образом триглицериды и эфиры стеринов) и холестерин, полученный от материнской диете между двумя листовок эндоплазматическая сеть (ЭР) мембраны 38-41. Большие CLDs формируются, по крайней мере частично, путем слияния меньших CLDs во время транспортировки в апикальной стороне MESCs где они будут освобождены, как MFGS (1-10 мкм в диаметре) почкованием, будучи enwrapped по MESC апикальной мембране 40-42. Кормление грудью прекращается через щенки отнимают и MESCs постепенно умирают путем апоптоза, что приводит к регрессии ткани молочной железы обратно в пубертатном состоянии (рис 1B, инволюция).
Иммунофлуоресценции (ИФ) является общим аналитическая лаборатория метод используется практически во всех аспектах биологии, и в научных исследованиях и в клинической диагностике. Если методы могут быть выполнены на срезах тканей (иммуногистохимия, IHC) или (иммуноцитохимия, ICC) Образцы клеток. Этот мощный подход основан на использовании fluorescent-меченые антитела, которые специфически связываются (прямо или косвенно) к интересующему антигену, таким образом позволяя визуализацию его распределение в тканях через флуоресцентной микроскопии. Флуоресцентных сигналов во многом зависит от качества и концентрации антител и надлежащей обработки образца. Простой непрямой иммунофлюоресценции (IIF) протокол представлен для обнаружения молочные продукты (казеин и МФГС) и белков, участвующих в секреции молочных продуктов (butyrophilin (btn1), Малый белки) на замороженных участках молочной железы мыши ткани (рисунок 3). Хотя этот протокол обеспечивает полный обзор IHC, начиная от сбора ткани для изображения после лечения, важно и дополнительных шагов, а также некоторых технических рекомендаций также представлены и обсуждены.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Мышей CD1 были выведены на INRA (UE0907 IERP, Жуи-ан-Жоза, Франция). Все этические аспекты ухода за животными соблюдены соответствующих руководящих принципов и требований лицензирования, установленными французского министерства сельского хозяйства. Процедуры, используемые были утверждены местным комитетом по этике (соглашения 12/097 от Comethea Жуи-ан-Жоза / AgroParisTech).
1. молочной железы Подготовка проб
- Мышь молочной железы рассечение
- Эвтаназии мышей на 10-й день лактации путем смещения шейных позвонков и закрепить животное вниз с его живота вверх.
- Намочите вентральной области с этанолом и высушить его с бумажным полотенцем.
- Использование щипцов, подтянуть кожу живота между двух задних ногах и сделать надрез (только через кожу) около 1 см с острыми ножницами. Начиная с этого первого разреза, а затем использовать ножницы, чтобы вырезать кожу до шеи на мышь. Потяните кожу от брюшины и пин вниз одной стороны кожи в то время,, растягивание его учили.
- Соберите брюшной полости и паховых молочных желез от толкая их от кожи с помощью тампона и, наконец, потянув или резки их от брюшины.
Примечание: На этом этапе окрашивание кармин может быть выполнена для того, чтобы визуализировать эпителия молочной железы в течение всей железы 43. Этот подход может быть полезен для анализа глобальной морфологии молочной железы при различных условиях (физиологические этапы развития, заболевания, в естественных условиях обработки). - Снимите лимфатический узел, расположенный на стыке брюшной и паховых желез 44.
- Молочная фиксация тканей
- Вырезать ткань молочной железы на 3 мм 3 фрагменты скальпелем и немедленно промойте эти фрагменты в фосфатным буферным раствором (PBS), раствор, рН 7,4, для того, чтобы удалить как можно больше молока, насколько это возможно.
- Быстро высушить фрагменты на бумагеполотенце и положить их в холодный раствор PBS, содержащего 4% параформальдегида (PFA, HCHO, 32% раствор формальдегида, осторожность) в течение 10 до 15 минут на льду.
Примечание: Это достаточно времени, чтобы последующий анализ на срезах тканей молочных путем IIF36 и / или в гибридизация 45. Однако, как альдегидные фиксаторы проникают довольно медленно в тканевых частей (~ 1-3 мм в час), в этот раз может быть продлен чтобы обеспечить оптимальный фиксацию образца ткани. Кроме того, исправить ткани в естественных условиях путем перфузии наркозом животное с фиксирующим раствором (не описано в данном исследовании).
- Сахароза настой
- Быстро промыть молочной фрагменты в холодной PBS и погружают их в растворе PBS холодной, содержащего 40% сахарозы (D-сахароза, C12H22O11, н 342,3 г / моль) в течение 16 ч до 48 при 4 ° С при легком встряхивании.
- Ткань вложение
Примечание: На этом этапе, молочные фрагменты могут быть повторно сократить для того, чтобы мелких фрагментов (2-3 мм 3) Или настроить свою форму.- Правильно маркировать пластиковые формы и заполнить треть объема пресс-формы с соединением ОСТ, поддерживаемой при комнатной температуре. Разместите один фрагмент (2-3 мм 3) ткани молочной железы на форму и покрыть ее ОКТ соединения.
- Поместите формы на поверхности жидкого азота (на листе алюминия или с помощью металлического сита) и позволяют продукт для замораживания.
Примечание: Она должна стать твердым и белый перед погружением формы в жидком азоте.
- Хранить замороженные образцы при -80 ° С до тех пор, срезы тканей не производится.
2. Замороженные ткани Секционирование
Примечание: криостат, которая по существу является микротом внутри морозильной камеры, требуется, чтобы сделать замороженных срезов. Более низкая температура часто требуется для жира или с высоким содержанием липидов тканей, таких как девственной молочной железы.
- Отрегулируйте температуру криостата до -26 ° C и подождите, пока он не имеет STABIванный. Поддерживать блок замороженной ткани на -26 ° C на протяжении всей процедуры секционирования. Совершенно избежать оттаивания ткани в любой момент во время процедуры.
- Охладите лезвие, поддержка резания, стабилизирующая устройства и кисть до -26 ° С, помещая их в криостат, по крайней мере 10 мин. Кроме разместить слайд коробку внутри криостата, чтобы иметь возможность хранить стеклянные пластинки, как секции выполнены.
- Правильно маркировать стеклянные слайды, которые будут использоваться для сбора срезов тканей и поддерживать их при комнатной температуре; в противном случае срезы ткани не будет придерживаться их. Удалить образец из формы внутри криостата.
Примечание: Использование положительно заряженные предметные стекла значительно способствовать адгезии свежих замороженных срезов из-за более высокой электростатического притяжения. - Накройте поверхность металлической ткани диска с ОКТ соединения (поддерживается при комнатной температуре) и нажмите замороженные пробы на него. Поместите влажный монтировать внутри криостата и пусть он совместноол, по крайней мере 15 мин.
- Поместите влажный крепление в держатель диска криостата. Отрегулируйте толщину резки до 5-6 мкм, и, если это возможно, использовать новую острое лезвие или по крайней мере изменить область на лезвии, используемой, чтобы сократить каждого образца, так как некоторые ткани будет быстро скучно его.
- Регулировка положение стабилизатора устройства над лезвием путем куски монтажной среды до тех пор, пока кусочки образуются равномерно и правильно. В идеале, стабилизатор устройство шаг за лезвием бритвы по 1 мм.
- После того, как все настройки верны, выполните срезов тканей, поворачивая колесо в непрерывном равномерном движении. Если температура не является идеальным, срез ткани будет, по своей природе, попробуйте свернуться.
- Используйте щетку, чтобы захватить и маневрировать в разрезе по сцене, чтобы разместить его по своему желанию на предметное стекло. Используйте щетку для очистки остатки, возможно, присутствующие на замерзшем блока тканей и / или лезвием бритвы.
- Тянутьраздел ткани к пользователю и избегать нажатия его на сцену криостата. Избегайте нажатия срезы ткани на стадии криостата, как это может привести к адгезии тканей срез на стадии и, следовательно, невозможности восстановления его предметное стекло.
- Получить срезах тканей по одному, выбирая их на поверхности стекло, держа его над секцией и рыбалка вниз, чтобы коснуться срезы ткани.
Примечание: участки ткани быстро присоединиться к теплой стекла из-за статического притяжения. Если несколько разделов ткани помещают на одном слайде, будьте осторожны, чтобы не перекрывать их и интервалы между ними достаточно, чтобы быть в состоянии индивидуально вложить их в гидрофобной окружности (см раздел 3.1.1.).
3. непрямой иммунофлуоресценции
- Расположение разделы
- Используйте гидрофобный барьер перо, чтобы нарисовать круг вокруг гидрофобного слайд-монтажа ткани. Пусть круг высохнуть в течение примерно 1 мин при комнатной температуре. Нарисуйте линию вокруг твыпуск участки с тонкой черной перманентным маркером, а также, но на стороне стекле напротив той, где участки ткани.
Примечание: Этот круг водоотталкивающий и acetone- и алкоголь нерастворимых. Поэтому оно предлагает барьер для водных растворов, используемых в процессе IHC и уменьшает объем требуемых реагентов. - Увлажняет срезах тканей путем покрытия их с каплей ~ 250 мкл PBS в течение нескольких минут при комнатной температуре. Fix срезах тканей путем покрытия их ~ 250 мкл свежеприготовленного 3% -ным раствором PFA в PBS в течение 10 до 15 мин.
Примечание: При желании в этом случае, используйте решение альдегид закалки (50 мМ хлорида аммония (NH 4 Cl, г-н 53,5 г / моль) в PBS или 0,1 М глицин (C 2 H 5 NO 2, г-н 75.07 г / моль) в PBS ), чтобы остановить реакцию связывания. Простой и обильные PBS стиральная правило, достаточно, чтобы удалить непрореагировавший альдегид.
- Используйте гидрофобный барьер перо, чтобы нарисовать круг вокруг гидрофобного слайд-монтажа ткани. Пусть круг высохнуть в течение примерно 1 мин при комнатной температуре. Нарисуйте линию вокруг твыпуск участки с тонкой черной перманентным маркером, а также, но на стороне стекле напротив той, где участки ткани.
- Поиск антигена (по желанию)
- Поместите AR решение (100 мМ Трис (C 4 H 11 NO 3, г 121,14) 5% мочевины (NH 2 CONH 2, г 60,06) рН 9,6) в химическом стакане. Объем раствора AR должна быть достаточной, чтобы полностью покрыть стеклянные слайды помещают в держатель стекла.
- Разогреть AR решение 95 ° C с помощью мониторинга температуры с помощью термометра, а затем поместить стеклянные слайды на подходящем стойки, immerge стойку в горячей буфера, крышка, чтобы ограничить испарение и инкубировать в течение 10 мин при 95 ° С.
- Удалить стакан с водяной бани и оставляют стеклянные слайды течение еще 10 мин в буфере.
- Промыть срезах тканей с PBS (~ 250 мкл / раздела) и насыщают их решения3% бычьего сывороточного альбумина (BSA, ~ 250 мкл / раздела) в PBS в течение не менее 30 мин при комнатной температуре.
- Поместите 30-50 мкл первичного антитела, разбавленного в PBS, содержащий 2% BSA в каждой секции ткани.
Примечание: Этот объем достаточно, чтобы сформировать каплю, который полностью покрывает секцию ткани. - Поместите тот же объем разбавителя (2% BSA в PBS) в покое на срез ткани для выполнения отрицательный контроль без первичных антител.
- Систематический этот негативный контроль в каждом эксперименте IHC и выполнять для каждого вторичного антитела, используемого для оценки фона эксперимента (неспецифической маркировки в связи с вторичным антителом и / или тканей автофлуоресценции). Другие типы положительных или отрицательных контролей также может быть выполнена, чтобы обеспечить специфичность маркировки (обсуждение см).
- Поместите стеклянные пластинки в увлажненной коробки O / N при 4 ° С.
Примечание: Первичные антитела были использованы мышиные моноклональные антитела-цитокератин8 (CK8, разведение 1:50), мышиное моноклональное анти-цитокератин 14 (CK14, разведение 1:50), кроличьи поликлональные антитела против мышиного казеина (# 7781, 1:50 разбавления, любезно предоставлена MC Невилл, Университета Колорадо здравоохранения Центр наук, СО, США), кроличьи поликлональные анти-btn1 (1: 300 разведение, любезно предоставлена IH Mather, Департамент животных и птиц наук, Университет штата Мэриленд, Колледж-Парк, штат Мэриленд, США), кролик поликлональных анти-Stx6 ( разведение 1:50, любезно предоставлена С. Туз, Cancer Research UK, научно-исследовательского института в Лондоне, Лондон, Великобритания) и кролик поликлональных анти-VAMP4 (разведение 1:50). - Тщательно мыть срезах тканей с PBS, по крайней мере четыре раза в течение 10 мин при комнатной температуре.
- Развести соответствующий вторичного антитела (родамин-конъюгированного козьего анти-кроличьего IgG (H + L), 1: 300 разведение) в PBS, содержащий 2% BSA, разместить 30-50 мкл этого раствора на всех срезах тканей, и инкубируют в течение 1,5 ч при комнатной температуре.
- Так флуорохромы являются молекулы светочувствительные, нене подвергайте срезах тканей на свет, пока их анализа. Для IIF на срезах тканей, способствуют вторичных антител, соединенных с красным флуорофором, поскольку клеточные мембраны имеют тенденцию генерировать зеленый автофлуоресценции, которые могут помешать низкой маркировки. Кроме того, выбирая красный флуорофора связью вторичного антитела позволяет сопутствующей маркировке нейтральных липидов (см. Ниже)
- Тщательно промыть срезы ткани с PBS, по крайней мере четыре раза в течение 10 мин при комнатной температуре.
- Для некоторых экспериментах, выполнить пост-фиксацию путем инкубации образцов с 2% PFA в PBS разбавленные в течение 10 мин при комнатной температуре, чтобы стабилизировать каркасов антиген / антитело. Тем не менее, этот шаг можно обойтись в большинстве случаев.
- Для визуализации CLDs и МФГС, цветные нейтральные липиды путем инкубации срезов ткани в 30-50 мкл раствора PBS, содержащего 3 мкг / мл BODIPY 493/ 503 в течение 10 мин при комнатной температуре. Быстро промойте срезы ткани дважды PBS.
- Контрастное ядерной ДНК с 30-50 мкл раствора PBS, содержащего 3 мкМ DAPI (4-6-диамидино-2-фенилиндола, 5 мг / мл исходного раствора) в течение 10 мин при комнатной температуре. Вымойте срезах тканей с PBS в два раза, прежде чем устанавливать слайды для наблюдения.
- Удалить PBS и поместить каплю монтажа среды на каждом разделе ткани.
- Поместите одну сторону покровным под углом по отношению к слайд, в контакт с внешним краем капли жидкости, а затем опустить крышку медленно, во избежание воздушных пузырей. Дайте жидкости распределяется между стекле и покровным в течение нескольких минут, а затем удалить излишки монтажа среды с бумажным полотенцем.
- Печать покровное к стекло с лаком для ногтей и магазин тканей разделов при 4 ° С не допустить их попадания света до наблюдения.
4. флуоресценции Наблюдательные Приобретение изображения
Примечание: флуоресцентный микроскоп оснащен камерой контролируется программным обеспечением захвата изображений требуется соблюдать результаты IHC.
- Прежде, чем приобрести изображения, проверить интенсивность маркировки и оценить фон эксперимента, глядя на отрицательных контролей. Приобретать фотографии каждого флуоресцентной метки (цвет канала) в отдельности.
- Приобретать все фотографии, в том числе и соответствующие элементы управления, в тех же условиях (воздействия и общих настроек) для каждого цветового канала.
- Обычные микроскопии
- Выполните эпифлуоресцентной микроскопии с помощью микроскопа, оснащенного стандартным фильтрам для флуоресцеинизотиоцианатом (FITC, зеленый), родамин (красный) и DAPI (синий) выбросов, × 20 до × 63 (масло-погружение, NA 1.3) целей и камеру изображения DP50.
- Конфокальной микроскопии
- Выполните конфокальной микроскопии с Microsризу оснащен программным обеспечением ZEN, используя × 20 × 63 для масла (погружение-NA, 1.4) целей и длин волн возбуждения 488- и 568-нм лазера.
Лечение 5. Изображение
Примечание: Все изображения пост-обработки производится при помощи бесплатного программного обеспечения ImageJ (http://imagej.nih.gov/ij/~~HEAD=dobj).
- Наложение изображения (слияние)
- Откройте изображения, полученные в каждом канале, что будут объединены (Файл / Открыть). При работе с 8-битными изображениями в градациях серого, атрибут искусственный цвет на каждый канал, используя таблицу поиска (таблицы Изображение / Lookup).
- Создание составного изображения в градациях серого с цветными изображениями, используя команду "Объединить каналы" (изображение / цвет / Объединить каналы), а затем, приписывая цвет каждого канала.
- Выполните изображение складывается наложение таким же образом, открыв стеки, приобретенные в каждом канале, что будут объединены (Файл / Открыть) и с помощью команды "Объединить каналы и# 8221; (Изображение / цвет / Объединить каналы) приписывать цвет каждого канала. Сохраните составной стек в виде последовательности изображений или в виде фильма (см раздел 5.4).
- Изображение стек Z проекция
- Используйте функцию Z проекции (изображения / Стек / Zproject, Макс Intensity), чтобы обеспечить двумерное представление всех фотографий стека изображения, проецируя их вдоль оси, перпендикулярной к плоскости изображения (Z-оси). Опция "Максимальная интенсивность" создает образ, в котором каждый пиксель содержит максимальное значение за всех изображений в стеке. Это создает одно изображение, позволяя визуализацию всей наблюдаемой окрашивания через стек изображения всей для конкретного канала или после наложения нескольких каналов.
- Изображение стек 3D проекция
- Используйте команду 3D проецирования (Изображение / Стек / 3D проект, яркая точка, ось у), чтобы сформировать последовательность проекций вращающейся объема на плоскости. , Визуализация суrfaces и внутренние структуры зависит как метод проектирования (ближайшие точки, яркая точка (используется здесь), или среднего значения) и параметры визуализации выбран. Каждый кадр анимационного последовательности является результатом проецирования под другим углом зрения.
- Поверните созданный 3D изображения вокруг каждой из трех ортогональных осей (ось у была выбрана здесь). Сохранить последовательность, полученный в качестве одного изображения или фильма.
- Стек изображение, чтобы фильм преобразования
- Открыть стека изображений (Файл / Открыть) и сохраните его как фильм в формате .AVI с помощью команды "AVI" (Файл / Сохранить как / AVI).
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Молочная железа является подкожная железа, расположенная вдоль вентральной структуры как грудной клетки и брюшной полости у грызунов. Расположение пяти пар желез мыши во время беременности показано на рисунке 4. Морфология молочной железы резко меняется в своем развитии, что отражает функциональные изменения, необходимые для подготовки к полной лактации (Фиг.1В). В девственных или нерожавших животных, молочной железы состоит из слабо разветвленной эпителия протоков встроенного в тонком жировой стромы, которые могут быть трудно увидеть. С самого начала беременности, молочных эпителия размножаются и расширяется, в результате больших молочных желез, которые становятся легче увидеть и удалить (рисунок 4). В период лактации, молочная ткань толще и появляется белее из-за наличия молока. Только в животе и паховые молочных желез собраны, потому что шейного и грудного отделов молочной ГланDS менее легко удален из-за их тесной связи с мышцами. Для некоторых экспериментах, щенков может быть отделен от кормящих женской 4-6 ч до умерщвления, чтобы ограничить секрецию молока путем MESCs 46,47.
Идентификация молочной Миоэпителиальные и эпителиальных клеток
Контрактильные миоэпителиальные клетки, окружающие альвеолы можно отличить от просвета MESCs путем использования антител, направленных против маркеров специфически экспрессируется каждый из этих типов клеток. В молочной железе, текущие маркеры используются цитокератины (Cks). Cks большое семейство цитоплазматических белков, которые образуют Полимеризация в цитоскелета промежуточных филаментов (10 нанометров в диаметре в среднем) найдены в эпителиальных тканях. Промежуточные филаменты очень стабильны и обеспечивают механическую поддержку архитектуры клеток, тканей и организовать, способствуя межклеточной адгезии и базальных клеток соединительной-ткань взаимодействия. Подмножества Cks выраженных эпителиальных клеток, главным образом, зависит от типа эпителия, его стадии развития и его статус дифференцировки. Кроме того, это также относится и к злокачественных контрагентами эпителия. Таким образом, эти маркеры являются простыми и ценные инструменты для характеризуют клеточных популяций в тканях в физиологических условиях и используются для диагностики опухолей и характеристики в хирургической патологией 48.
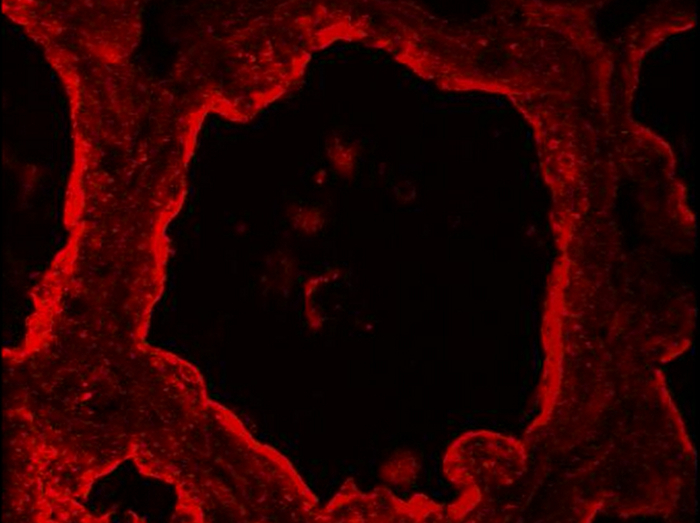
В нормальном молочной железы, миоэпителиальные и просвета MESCs клетки можно отличить на основе их дифференциальной экспрессии CK14 и CK8, соответственно (рис 5). Эти цитоплазматические маркеры обнаружены в молочных секциях кормящей мышей после PFA фиксации и АР. Изображения были получены с помощью обычного эпифлуоресцентной микроскопом. CK8 по-видимому, распределены по всей цитоплазме просвета MESCs (фиг.5, CK8). Обратите внимание, что красный фон наблюдатьd для отрицательного контроля без первичного антитела (рис 5, -Ig1) в основном из-за раздела тканей складывания, как это было предложено синей маркировки ДНК, который отображает несколько слоев ядер (рисунок 5, -Ig1, ядра). CK14 специально наблюдается в плоских и удлиненных миоэпителиальных клеток, расположенных у основания альвеол (фиг.5, CK14). Другим распространенным способом определения Миоэпителиальные клетки является обнаружение альфа-актин гладких мышц (А - SMA), присутствующих в этих клетках сократительных (рисунок 4 в 49).
Обнаружение мыши молочных продуктов
После родов, в полной мере дифференцированные MESCs начинают продуцируют обильные количества молока. Компоненты молока вырабатываются различными путями 40,50. Казеин мицеллы секретируется экзоцитоза Гольджи, полученных КА, в то время как липиды выпущен как МФГС по бутонизации апикальной плАсма мембрана MESCs (Рисунок 2, молочной эпителиальных клеток секреторных). Для некоторых экспериментов, щенки отделяются от женской 4-6 ч до сбора молочных желез, для того, чтобы замедлить секрецию молока 46,47. В этих условиях, апикальная плазматическая мембрана MESCs и содержание просвет легко можно наблюдать, что это не так, поскольку во молочного альвеолы контракт и просвет закрыты. Кроме того, замедление секрецию также имеет важное значение при изучении белков, участвующих в торговле людьми, таких как мембраны SNAREs. В самом деле, ловушки цикл между донором и акцептором отсеков и их субклеточном локализации трудно определить, так как маркировка часто распространяются, когда оборот мембраны высока, то есть., Во время сосания. Таким образом, замедляя секрецию молока путем удаления щенков обеспечивает надлежащие условия для изучения внутриклеточного локализацию SNAREs когда t- и V-SNAREs преимущественно проживают в донораи акцепторный отсека, соответственно (см. ниже)
Рисунок 6 показывает локализацию казеинов в кормящих молочной железы мыши на 10 день лактации, в присутствии (рисунок 6, + Р) или в отсутствие (рис 6, р) щенков. Срезы тканей наблюдается и с помощью обычной микроскопии (эпифлуоресцентной три колонны справа) и конфокальной микроскопии (рис 6, левая колонка). Во время сосания, казеин, кажется, в основном, накапливается в апикальной области (рисунок 6, + P, наконечники стрел). Конфокальной микроскопии показывают, что казеин также присутствуют, хотя и в меньшей степени, в базальной стороне MESCs в присутствии щенков (фиг.6, + Р, стрелки), которые не могут быть четко наблюдаемые в обычных микроскопии (фиг.6, казеин, сравнить левую и правую панели). В самом деле, в широком поля эпифлуоресцентной флуоресценции, испускаемый образца (фон fluorescenCE) проходит через возбужденного объема и изменяет разрешение объектов, наблюдаемых в фокальной плоскости объектива (из фокуса флуоресценции). Это особенно верно для толстых образцов (толще, чем 2 мкм). Конфокальной микроскопии позволяет получать высококачественные изображения с образцов, приготовленных для эпифлуоресцентной, так как глубина поля можно контролировать и фон флуоресценции исключены из фокальной плоскости. Кроме того, в присутствии щенков (фиг.6, + Р), просвет альвеол достаточно закрытой и апикальный сторона MESCs лучше наблюдаемый в отсутствие щенков (фиг.6, -P), при просвете альвеол расширен за счет накопления молочных продуктов. Когда секреция молока замедляется, казеин также появляются накоплен под апикальной плазматической мембране (рис 6, р, наконечники стрел), и отчетливо наблюдается на базальной стороне MESCs (рис 6, -p, стрелки). Отрицательные контроли без первичных Антибоды не показать любой маркировки (рисунок 6, -Ig1).
Молочные продукты могут быть легко обнаружены совместно путем объединения IHC для казеинов и нейтрального липида counterstaining из CLDs и МФГС (рисунок 7). Срезы ткани были обследованы, как Z-стеки конфокальной микроскопией, которые были подвергнуты последующей обработке с ImageJ, чтобы произвести Z выступы или 3D проекции для каждого (фиг.7, казеин, липиды) или всех цветовых каналов (фиг.7, сливаются). В последовательности изображений, произведенные были сохранены как отдельные картинки (рис 7 и 8) или фильмы (см Дополнительных Фильмы).
Хотя некоторые маркировки наблюдалось на их базальной стороне, казеин в основном накапливаются на апикальной стороне MESCs (фиг.7, + Р), как уже было описано, когда самки не ранее отделены от детенышей (фиг.6, + Р). CLDs также локализованы в основном в апикальной области MESCs, в то время как большей тайнеред MFGS присутствуют в просвете альвеол. Следует отметить, что казеин и MFGS легко визуализируется в просвете альвеол в отсутствии щенков (фиг.7, сравните + р и р). Казеины не ко-локализуются с CLDs или МФГС в любое из этих условий, так как наложение двух цветовых каналов не производят желтый маркировке (рисунок 7, сливаются фотографии). Тем не менее, стек изображений пост-обработки показывают, что казеин окружают секретируемые MFGS в просвете альвеол, предполагая, что эти белки могут взаимодействовать с MFG (фиг.7, объединить изображения). Обратите внимание на разницу изображений, произведенных каждым пост-обработки, используемой (фиг.7, сравните Zproj и 3D Рго для каждого цветового канала).
Обнаружение butyrophilin, белок маркером МФГС.
Btn1 является одним из основных белков, ассоциированных с MFGS в молоке 51. Это трансмембранный белок mainlу локализованы на апикальной мембране из MESCs и, следовательно, найти на поверхности MFG после его выхода почкованием 52. Рисунок 8 показывает, что в 10-й день лактации, btn1 в основном локализованы на апикальной мембране и, к в меньшей степени, в апикальной зоне MESCs. Btn1 также окружает МФГС, присутствующих в просвете альвеол, а также некоторые из верхушечных CLDs (рис 8, слияния 3D Proj, наконечники стрел). Результаты представлены в виде одного изображения, выделенных из полученного изображения Z стека (рис 8, изображение) или в виде 3D генерируемого с помощью команды 3D проекции ImageJ, как описано выше (рис 8, 3D PROJ). Обратите внимание, что один образ может быть достаточно, чтобы наблюдать верхушечный распределение белка, но пространственное объединение btn1 с секретируемых МФГС или верхушечный CLDs наблюдается только после 3D реконструкции Z-стека (рисунок 8 сравнивать btn1 изображение и 3D PROJ слияния пиктОЭС). Z-стека могут быть восстановлены в виде фильма, чтобы дать лучшее пространственное представление о распределении белка. Z-стек изображение, полученное для btn1 одиночку (дополнительные фильмы 1 и 3) или накладывается с двумя другими цветовыми каналами (слияние, дополнительные фильмы 2 и 4) показаны в качестве примеров. Z-стек можно прочитать изображение-по-образ от верхней до нижней (Дополнительный фильмы 1 и 2) или как вращающейся зрения (Y-ось) 3D проекции стек изображения всей (дополнительные фильмы 3 и 4 ).
Обнаружение двух SNARE белков: Stx6 и VAMP4
Как упоминалось ранее, это SNAREs мембраной белки, которые переключаются между донорными и акцепторными мембранами. Поэтому лучше, чтобы замедлить оборот мембраны, связанный с повышенной секреторной деятельности MESCs путем разделения самок из щенков перед сбором молочной железы при изученииэти белки. Stx6 и VAMP4 оба были описаны как связанные с транс-Гольджи сеть 53,54. Тем не менее, эти SNARE белки могут также играть важную роль на уровне других клеточных отсеков, такие как секреторных гранул (Stx6) 55,56 и Гольджи (VAMP4) 57. Предыдущие исследования показывают, что SNARE белки играют важную роль в секреции казеина 35,36. Во время кормления грудью, Stx6 и VAMP4 находятся в суб-верхушечный области MESCs. Stx6 наблюдается между ядром и апикальной мембране MECs, соответствующий Гольджи и транс-сети Гольджи (фиг.9, Stx6), и также присутствует, хотя и в меньшей степени, от казеина, содержащего КА-36. VAMP4 также локализуется в предвершинное области MESCs, но маркировка представляется более точечное и накапливается под апикальной мембране (рис 9, VAMP4) из-за его ассоциации с обеих CLDs и казеин-Контаоцен- ками КА 36. Отрицательный контроль без первичного антитела не приводят к любой маркировки.

Рисунок 1. Мышь молочной железы развитие во время эмбрионального и взрослой жизни. (A) молочные железы мыши начинают развиваться вокруг эмбрионального день 10 (E10) от эктодермы (светло-голубой) молока линий (розовые). В E11.5, плакоды формируют симметрично по молочной линии молока и окружающая мезенхимы (темно-синий) начинает конденсироваться. Плакод инвагинировать сформировать бутоны (E12.5-E14.5), а с E15.5, молочной эпителий (розовый), размножаться и удлиненные, чтобы сформировать первичную росток, который толкает через молочной мезенхимы к жировой ткани (светло-зеленый ). Полый формы просвет и открывает привести к соску (фиолетовый). На E18.5, молочной эпителий образует RudimentaRy разветвленной структурой соединен с внешней стороны. Взято из 6 с разрешения из Macmillan Publishers Ltd: Nature Reviews Genetics, об авторском праве 2007 года (В) В период полового созревания, эпителий молочной (фиолетовый) входит значительное фазу роста (удлинение обширный, бифуркации и бокового ветвления). В начале беременности, обширной и быстрым распространением, а также боковой ветвления произойти, ведущих к значительному расширению эпителия молочной железы, которые в полной мере весь вторгается молочной жировой ткани. Молочная эпителий достигает весьма дифференцированный функциональное состояние в период лактации, когда просвета MESCs выделяют большое количество молока. При кормлении грудью перестает после отъема, молочной железы эвольвент. MESCs удаляются путем апоптоза и фагоцитоза, что приводит к исчезновению lobulo-альвеолярного структур, которые заменены жировой ткани. Взято из схемы 1 http://brisken-lab.epfl.ch/research и главе 2.2. http://tvmouse.ucdavis.edu/bcancercd/22/index.html. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
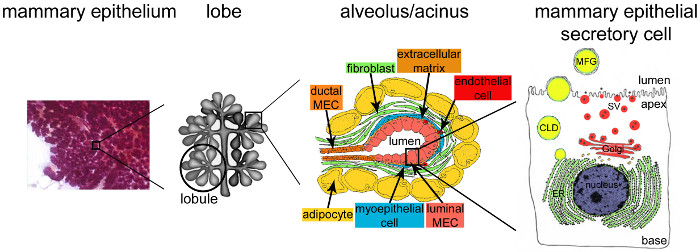
Рисунок 2. Архитектура молочной железы во время лактации. Во время лактации, полностью разработаны и сильно разветвленные эпителий (фиолетовый) приходится подавляющее большинство из ткани молочной железы. Эпителиальной ткани формируется Тубулоинтерстициальные-альвеолярной структуры встроенных в строме, которая содержит различные типы клеток (фибробласты, адипоциты, клетки гладких мышц, кровеносных и лимфатических сосудов и нервных окончаний). MESCs организованы в ацинарных структур или альвеол, собранных в дольки, которые образуют лепестки. Каждый альвеолы является функциональной молочно-производственной единице, что подключено к сильно разветвленной сети лобулярных и интерлобулярных каналов, что позволяет молоко будет Dдождь наружу. Каждый альвеолы ограничена монослоя поляризованных MESCs, верхушечный сторона, которая граничит с центральной просвет. Базальная сторона MESCs находится в тесном контакте с внеклеточным матриксом и сократительных клеток миоэпителиальных. Молочные продукты выпускаются в апикальной стороне MESCs. Кафедра молоко (казеин) выделяются как казеин мицеллы (черных точек) по экзоцитоза Гольджи, полученных секреторных везикул (SVS), в то время как липиды выпущен как молоко жировых шариков (МФГС) путем почкования апикальной плазматической мембране MESCs. CLD: цитоплазматическая липидов капли; ЭР: эндоплазматическая сеть; MEC: молочной эпителиальных клеток. Взято из главы 2.2. http://tvmouse.ucdavis.edu/bcancercd/22/index.html., рис. 02 www.cellbiol.net/ste/alpHERCEPTIN1.php, рис. 26-02 в 58, и с 50. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Не познее-страница = "всегда"> 

Рисунок 3. Методика эксперимента выполнить непрямой иммунофлуоресценции на замороженных срезах мышиных молочной железы. Молочные железы собирают из CD1 самок мышей на 10-й день лактации. Молочная ткань нарезать небольшими фрагментами, которые являются фиксированными параформальдегидом и переплетаются в сахарозы перед встроен в ОКТ соединения и быстро замораживают. Молочной железы Образцы затем разрезают на тонкие секции и замороженных обработаны для IIF последовательным инкубации с первичными и конъюгированное с флуорохромом вторичных антител, соответственно. После установки, образцы анализируют с флуоресцентным микроскопом, что позволяет приобретение изображений, которые впоследствии могут быть подвергнуты последующей обработке./53179/53179fig3large.jpg "Целевых =" _blank "> Нажмите здесь, чтобы посмотреть большую версию этой фигуры.

. Рисунок 4. Анатомический расположение мыши молочных желез Слева: вид снизу системы молочной железы мыши на поздней стадии беременности. Справа: локализация и аспект молочной железы на поздней стадии беременности у мышей. Следует отметить, что в период лактации, молочные железы толще и белее из-за наличия молока в альвеолах. Взято из http://ctrgenpath.net/static/atlas/mousehistology/Windows/femaleu/mousemammgldiagram.html и http://www.pathbase.net/Necropsy_of_the_Mouse/index.php?file=Chapter_3.html. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой фигуры.
-together.within-страница = "всегда"> 
Рисунок 5. Определение просвета эпителиальных клеток и базальных клеток миоэпителиальных в молочной железы мыши. Просветными MESCs и миоэпителиальные клетки идентифицируются IIF в молочной железы мыши на 10 день лактации, в зависимости от их выражения CK-8 и CK-14 , соответственно. Ядерная ДНК окрашивали DAPI (синий). Изображения были получены с помощью обычного эпифлуоресцентной микроскопом. Композиционный изображения (объединить) показывает наложение маркировки соответствующей казеин (красный) и ядер (синий), соответственно. -Ig1, Отрицательный контроль без первичного антитела. Звездочки указывают люмен. Масштаб бар = 100 мкм. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
е 6 "SRC =" / файлы / ftp_upload / 53179 / 53179fig6.jpg "/>
6. Клеточная локализация казеина в молочной железы мыши. Казеины обнаружены ИИФ в мышь молочной железы у 10-й день лактации. Молочные железы были собраны от самок в присутствии (+ р) или в отсутствие (-P) детенышей. Изображения были получены с помощью обычного (правая панель, казеин, ядер и объединить) или конфокальной (казеин (красный), левая панель) флуоресцентный микроскоп. В обоих условиях, казеин (красный) обнаруживаются в апикальной области (стрелки) и более или менее в базальной части MESCs (стрелки). Отрицательные контроли без первичных антител не показывают маркировки (-Ig1). Ядерная ДНК окрашивали DAPI (синий). Композиционный изображения (объединить) показывает наложение маркировки соответствующей казеин (красный) и ядер (синий), соответственно. Звездочки указывают люмен. Масштаб бар = 100 мкм для эпифлуоресцентной изображений (правая панель, казеин, ядер, слияние) и = 10 &# 181; м. Для конфокальной изображений (левая колонка) Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
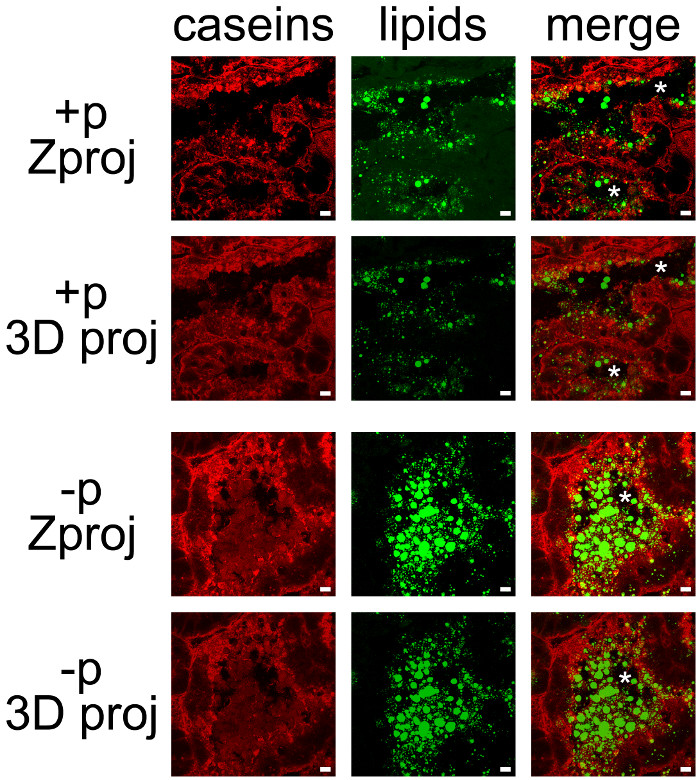
Рисунок 7. клеточной локализации молочных продуктов в молочной железы мыши. Казеины (красный) обнаруживаются IIF в молочной железы мыши на 10 день лактации в присутствии (+ р) или в отсутствие (-P) детенышей. Нейтральные липиды (CLDs и МФГС) являются контрастно BODIPY 493/503 (зеленый). Композитные фотографий (слияния) показать наложение двух маркировок. Изображения были получены в Z-стеки с конфокальной микроскопии. Z-стеки были последующей обработке с ImageJ генерировать Z проекции (Zproj) или 3D проекции (Y-ось) (3D PROJ) всего штабеля в каждом канале для обоих (слияния). Звездочки указывают люмен. Масштабная линейка= 10 мкм. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 8. клеточной локализации butyrophilin и липидов у мышей молочной железы. Btn1 (красный) обнаруживается IIF в молочной железы мыши на 10 день лактации при отсутствии щенков. Нейтральные липиды (CLDs и МФГС) и ядерное ДНК контрастно BODIPY 493/503 (зеленый) и DAPI (синий), соответственно. Изображения были получены с конфокальной микроскопии как изображение Z-стеков. Результаты представлены в виде одного изображения, извлеченного из стека изображений (изображений, btn1, липидов, ядер и объединить) или после пост-обработки с ImageJ для создания 3D-вид (Y-ось) стека изображения всей (3D Proj, btn1 , липиды, ядер, слияние). Композитные фотографий (слияния) показываютНаложение трех цветовых каналов. -Ig1, Отрицательный контроль без первичного антитела. Звездочки указывают люмен. Масштаб бар = 10 мкм. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 9. Клеточная локализация двух SNARE белков в молочной железы мыши. Синтаксина 6 (Stx6) и VAMP4 (V4) обнаружены ИИФ в мышь молочной железы у 10-й день лактации. Изображения были получены с помощью обычного (усл) эпифлуоресцентной или конфокальной (LSM) микроскопом. Композитные фотографий (слияния) показать наложение маркировке наблюдается для каждого SNARE белка (красный) и ядерной ДНК контрастно DAPI (ложно-зеленого цвета), соответственно. -Ig1, Отрицательный контроль без первичного антитела. Звездочкас указывают люмен. Масштаб бар = 10 мкм для конфокальной картины и = 100 мкм для эпифлуоресцентной фотографий. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.


Таблица 1. Иммуногистохимия руководство по устранению неполадок.

Дополнительное фильм 1. Локализация butyrophilin в мышь молочной железы. Btn1 (красный) обнаруживается IIF в мышь молочной железы у 10-й день лактации. Изображения были получены с СО nfocal микроскопа в Z-стека и последующей обработке с ImageJ генерировать кино. Z-стек читается сверху вниз. Пожалуйста, нажмите здесь, чтобы смотреть это видео.

Дополнительное фильм 2. Локализация butyrophilin и нейтральных липидов в мышь молочной железы. Btn1 (красный) обнаруживается IIF в мыши молочной железы у 10-й день лактации. Нейтральные липиды (CLDs и МФГС) и ядерное ДНК контрастно BODIPY 493/503 (зеленый) и DAPI (синий), соответственно. Изображения были получены с конфокальной микроскопии в Z-стека для каждого цветового канала и были последующей обработке с ImageJ, чтобы создать композитный Z-Stack, что накладывает три цветовых каналов. Полученный композит Z-стека считывается из верхней к нижней.https://www.jove.com/files/ftp_upload/53179/supvid2.mp4 "целевых =" _blank "> Нажмите здесь, чтобы просмотреть это видео.
Дополнительное фильм 3. Локализация butyrophilin в мышь молочной железы. Btn1 (красный) обнаруживается IIF в мышь молочной железы у 10-й день лактации. Изображения были получены с конфокальной микроскопии в Z-стека и пост-обработанного ImageJ (3D проекции), чтобы генерировать вращающееся (Y-ось) пространственное представление о маркировке btn1. Пожалуйста, нажмите здесь, чтобы смотреть это видео.

Дополнительное фильм 4. Локализация butyrophilin и нейтральных липидов в ма мышиmmary железы. btn1 (красный) обнаруживается IIF в мышь молочной железы у 10-й день лактации. Нейтральные липиды (CLDs и МФГС) и ядерное ДНК контрастно BODIPY 493/503 (зеленый) и DAPI (синий), соответственно. Изображения были получены с конфокальной микроскопии в Z-стека для каждого цветового канала и были последующей обработке с ImageJ, чтобы создать композитный Z-Stack, что накладывает три цветовых каналов. ImageJ (3D проекция) дополнительно используется для генерации вращающегося (Y-ось) пространственное представление сводного Z-стека. Пожалуйста, нажмите здесь, чтобы смотреть это видео.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
IHC является относительно простой и прямой экспериментальный метод локализации антигена в срезах тканей, которые в первую очередь зависит специфический эпитоп-антитело взаимодействий. Хотя большое количество протоколов используются для локализации белка на IIF, сердечник из этих процедур почти всегда то же самое. Тем не менее, есть некоторые критические аспекты, которые могут сильно повлиять на результат и поэтому должны быть оптимизированы для каждого индивидуального исследования IHC. Наиболее сложным аспектом этого подхода является то, чтобы определить лучшие условия эксперимента, т.е.., Те, генерирующих сильное и определенный сигнал для представляющим интерес антигеном. Переменные, которые необходимо учитывать для эксперимента и оптимизации являются: (1) тип антигена (виды, уровни экспрессии, субклеточном местоположение); (2) тип эпитоп (последовательность, конформация, предполагаемые посттрансляционные модификации); (3) подготовка проб (вложение в парафин или замороженных срезов); (4) фиксация метOD (перфузии или погружения); (5) фиксатор используется (формальдегид, спирт или ацетон); (6) блокирование реагентом, используемым (нормальной сывороткой, БСА или обезжиренное молоко); (7) стадию АР; (8) метод обнаружения (прямое или косвенное); (8) тип первичного антитела (поликлональные или моноклональные); (9) вторичный антител (виды и этикетка); (10) counterstains (ядерная и / или другой клеточный компартмент маркировки); и (11) крепления средней (см таблицу 1 для деталей). Фиксация и шаги блокировки, по крайней мере, требуют оптимизации дополнительных факторов, таких как концентрации, рН, температуры, времени инкубации и разбавителя.
Первый важный аспект касается подготовки образцов тканей, которые тесно связаны с методом фиксации, которая, в свою очередь влияет на качество результатов. Например, кусочки ткани может быть фиксированной или не до встраивания. Этот шаг может также зависеть от способа, выбранного вложения, т.е. OCT соединения против парафин, Который сам по себе, иногда в зависимости от используемого первичного антитела. Ткань фиксации могут быть выполнены в естественных путем перфузии наркозом животное с фиксирующим раствором. Этот метод полезен для сохранения антигенов при изучении здоровых тканей, но не может быть достаточно, чтобы исправить интересующей ткани. В этом случае небольшие кусочки ткани (не толще 10 мм) может быть погружена в раствор фиксирующего. Замороженную ткань может быть получена путем погружения ткани в жидком азоте или изопентан, и оснастки замораживание рекомендуется для последующего обнаружения посттрансляционных модификаций, таких как фосфорилирование. Однако, в отличие парафин ткани, замораживание не подходит для длительного хранения тканей из-за образования кристаллов льда внутри клеток, которые могут изменить внутриклеточную морфологию. После того, как вырезать, замороженных срезов можно хранить при температуре -80 ° С в течение до 1 года. В любом случае, подготовка образцов ткани является компромиссом между сохранением ткани/ сотовой архитектуры и сохранения целостности эпитоп.
Так он изменяет химический состав тканей, важно оптимизировать условия фиксации, чтобы избежать как неполной (в фантастическом xation) и чрезмерное (overfixation) фи xation.
Действительно, underfixation может снизить удельный сигнал путем содействия протеолитической деградации некоторых антигенов. С другой стороны, overfixation может изменить конкретную маркировку путем маскировки или эпитоп генерации сильного неспецифического фона. Таким образом, в дополнение к выбору Фиксирующий раствор, другие параметры, такие как время инкубации, температура и рН повлияет ткани фиксацию. Несмотря на то, PFA является наиболее распространенным фиксатор для IHC, она не может рассматриваться в качестве "универсального" фиксатора. PFA вызывает белок-белок и белок-нуклеиновых кислот перекрестные ссылки и, таким образом, artefactually изменить эпитоп (overfixation), а затем предотвратить его Recognition первичным антителом. Тем не менее, эпитоп может быть дополнительно разоблачен AR методов (см. Ниже) PFA может быть также непригодны для обнаружения определенным антигенам, как это было показано, чтобы побудить транслокации белков некоторых фосфорилированных из мембраны в цитоплазму. В таких случаях, PFA должны быть заменены соответствующими альтернативными фиксаторами, такими как спирт. В отличие PFA, спирты, такие как метанол или этанол не маскируют эпитопы, так как они позволяют ткани фиксацию путем замены молекул воды в тканях. Это может привести к осаждению белков, а затем предотвратить антитела / эпитоп взаимодействия за счет конформационных изменений. Он широко думали, что спирты не проникают и, таким образом, не сохраняют морфологию тканей, а также PFA. Ацетон является еще одной альтернативой фиксатор, который обычно используется при работе с незакрепленными, секции оснастки замороженной ткани. Тем не менее, ацетон является сильным дегидратирующий агент и может привести к необратимой осаждения тканевых белков.
Для некоторых антигенов, дополнительный шаг АР может потребоваться, чтобы получить хороший сигнал, главным образом, если фиксирующий индуцирует конформационные изменения или изменяет электростатический заряд эпитопа (маскирование эпитопа). AR методы направлены изменить эти процессы для восстановления иммунореактивности эпитопа и его последующее взаимодействие с первичным антителом. Методы AR основном полагаются на два подхода: (1) извлечения эпитоп протеазы-индуцированной, т.е. с ферментами, такими как протеиназы К, трипсин или пепсин, которые расщепляют пептиды, которые маскируют эпитоп; и (2) тепло-индуцированной поиска эпитоп, то есть с использованием микроволновой печи, скороварки, пароварки растительные, автоклавы или водные ванны. Этот последний подход особенно по времени, от температуры, buffer-, и рН-чувствительных и оптимальные условия должны быть определены эмпирически (пример приведен в разделе Protocol). Кроме того, аффинность антитела в отношении его антигена может быть повышенапутем изменения рН или концентрацию катионов разбавителя антител.
Шаг пермеабилизации иногда требуется, чтобы получить хороший сигнал для внутриклеточного эпитопом в разделах толстых тканей, в частности, для окрашивания ядерного антигена. Это может быть достигнуто различными способами с помощью: (1) спирты или ацетон, как фиксаторов; или (2) детергенты, такие как Тритон, NP-40 (0,1-0,2% в ПБС, 10 мин), дигитонин, сапонина или Tween 20 (0,2-0,5% в течение 10 30 мин) после фиксации PFA. Тем не менее, выбор моющего средства зависит от клеточной локализации эпитопа обнаружено. Действительно, жесткие детергенты, такие как Тритон-X100, которые солюбилизации клеточных мембран пригодны для обнаружения ядерного эпитоп, но может привести к сигнал изменения при добыче некоторых мембранных белков. Использование более мягких моющих средств (сапонинов и Tween 20) являются более подходящими для обнаружения цитоплазматических эпитопов.
Второй важный шаг является blockinг неспецифической окрашивания. Связывание антител к целевой эпитоп регулируется межмолекулярных сил (например, гидрофобных взаимодействий и, ионных водородных связей). Таким образом, взаимодействие первичных и / или вторичных антител с другими белками, чем их антигенов-мишеней может привести к неспецифической окрашивания. Это порождает высокий флуоресценции фон, который предотвращает визуализации интересующего белка (низкое отношение сигнал / шум). Блокирующими реагентами уменьшает неспецифических взаимодействий без ухудшения специфическое взаимодействие антител / эпитоп. Обычная процедура состоит из инкубации срезов ткани с инактивированной нагреванием сыворотки или нормальной BSA. При использовании нормальной сыворотке, он должен быть из того же вида, что и животное-хозяина вторичного антитела или от неродственного вида. Во всех случаях выбранный блокирующий реагент также следует добавить к разбавителей для первичных и вторичных антител. Кроме того, использование неионных детергентов, таких как Triton X-100, TWeen 20 или сапонины помогает уменьшить неспецифические взаимодействия.
Третий и, возможно, наиболее важным параметром является выбор первичного антитела и оптимизация. Очевидно, что лучшим выбором является высокое качество антител с минимальным перекрестной реактивности. Как моноклональные антитела, как правило, обладают высокой специфичностью и сродством для одного эпитопа, они лучшие инструменты для различения конкретного члена семьи белка с высокой идентичности последовательностей. Тем не менее, взаимодействие антитела / эпитоп может быть нарушена, если цель эпитоп потерял свою родную конформационные состояния или когда доступ к эпитопу предотвращается взаимодействие с другими белками, пост-трансляционных модификаций, температуры, рН, фиксации и концентрации соли. В таких случаях, поликлональные антитела являются более подходящими как они признают, множественные эпитопы одного и того же белка. Кроме того, они часто более стабильны, чем моноклональных антител в широком диапазоне рН и концентрации соли.Предварительные исследования должны определить соответствующие условия инкубации, то есть, работает разбавления (моноклональное антитело: 5-25 мг / мл, поликлональные антитела: 1.7-15 мг / мл), время инкубации, разбавителя и температуры, которые должны быть определены эмпирически для каждый первичный антитело. Эти параметры должны быть оптимизированы, чтобы определить условия, которые дают оптимальное сигнал с низким фоновым шумом. Специфичность маркировки способствуют увеличению времени инкубации при более низких температурах (т.е.., 4 ° С против РТ).
Выбор для выполнения прямого или косвенного обнаружения часто зависит от уровня экспрессии антигенов. Например, высокий уровень экспрессии эпитопа может быть просто обнаружено флюорохромом конъюгированного с первичным антителом, таким образом позволяя быстро и просто окрашивание многоцветный, не допуская возможного неспецифического фона в связи с использованием вторичного антитела. Тем не менее, прямой если мая генерирует сигнал низкой на более высокую стоимость, а может ейometimes быть трудно, когда меченое антитело нет в продаже. С другой стороны, IIF более чувствительны, чтобы обнаружить более низкие, выраженные в эпитопы генерируемый сигнал является более интенсивным за счет взаимодействия по меньшей мере двух меченых антител (вторичных выработанном против первичных видов хозяев антитела) с первичным антителом (усиления). Кроме того, широкий спектр вторичных антител, конъюгированных с различными флуорофоров являются коммерчески доступными, относительно недорогой и контроль качества. Тем не менее, этот подход может вызвать перекрестную реактивность и, следовательно, требует тщательно выбирать первичных антител, которые не производятся в тех же видов или различных изотипов при выполнении нескольких экспериментов маркировки. IIF также иногда требует дополнительных шагов препятствия и должна включать в себя систематические отрицательные контроли (см ниже). Усиление может быть дополнительно достигнуто с помощью биотин-конъюгированные вторичные антитела, и флуоресцентно меченных авидин или стрептавидин (четыре биотины связаны в месlecule). Тем не менее, этот метод амплификации требует дополнительных стадий, чтобы предотвратить неспецифическое связывание и не могут быть приспособлены для окрашивания некоторых тканей (печень, почки, сердце, мозг, легкие и кормящих молочной железы) в связи с наличием высоких уровней эндогенного биотина , Тем не менее, эндогенного биотина может быть заблокирован до инкубации образца с авидином, а затем с биотином перед инкубацией с первичными антителами. Выбор конъюгированных флюорохромами, это небольшие химические молекулы, обладающие свойством излучать свет при возбуждении светом более короткой длиной волны, в первую очередь зависит от типа микроскопа имеющегося оборудования.
При правильном предназначены для ограничения как перекрестную реактивность между антителами и кроссовера между спектральными свойствами используемых флюорохромами, иммунофлюоресценции на основе IHC позволяет одновременной визуализации нескольких клеточных мишеней.
Последнее важнопункт относительно IHC экспериментов касается положительных и отрицательных элементов управления, которые должны быть выполнены, чтобы поддержать справедливость окрашивания, чтобы определить экспериментальные артефакты и для точной интерпретации результатов. Некоторые ткани обладают высокой флуоресцентный фон (именуемые флуоресценции), что может привести к неправильной интерпретации результатов. Таким образом, срезы ткани должны соблюдаться в рамках как флуоресценции и светлого поля освещения перед началом эксперимента IHC. Отрицательный контроль, который опускает первичное антитело должно систематически быть включены в каждом эксперименте IHC, чтобы гарантировать, что потенциальный неспецифическое связывание вторичного антитела можно пренебречь и не закрывается или напоминают специфическую картину окрашивания. Контроля изотипа может быть выполнена при работе с моноклональным первичным антителом, заменив его с не-антитела иммунной же изотипа (например, IgG1, IgG2a, IgG2b, IgM) при той же концентрации. Этот контроль позволяет ESлеть неспецифической окрашивание, что может быть связано с взаимодействием антител с образцом. Чтобы продемонстрировать специфическое связывание антитела с его антигеном, элемент управления поглощение может быть достигнуто двумя способами путем предварительного инкубирования первичного антитела: (1) с растворимой иммуногена (10: 1 мольное отношение) O / N при 4 ° С ; и (2) с клетками или срезов ткани, которые экспрессируют эпитоп интерес, но которые отличаются от исследуемой ткани (например, см фиг.4В в 59). В обоих случаях, последующее истощение первичного антитела должно привести к практически без окрашивания. Другой тип управления может быть сделано с помощью ненужной первичное антитело, т.е.., Направлены против эпитопа, который показывает клеточную локализацию, которая отличается от эпитопа (ядерный против цитоплазматических). Нерелевантные антитела должны быть же изотипа и видов в качестве первичного антитела, представляющего интерес. Дополнительные элементы управления для IHC экспериментов может включать в себя использование образцов с TISSЕЭС известные выразить (трансгенных животных) или нет (по нокаут-животные) эпитоп интерес. Это может обеспечить полезные ссылки и помочь оптимизировать процедуру IHC.
Основным ограничением методов, если они могут быть применены только к фиксированной (мертвый) и / или проницаемыми клетки, и процедура потенциально вызывая артефакты. Другие ограничения этого подхода из-за использования микроскопа для наблюдения образцов. Во-первых, как оптическое разрешение эпифлуоресцентной и конфокальной микроскопы ограничены, местоположение или совместное размещение обнаруженных белков не должно быть более интерпретированы. Во-вторых, фотообесцвечивания, то есть. выцветание интенсивности флуоресценции с течением времени под действием света, по существу, за счет генерации активных форм кислорода в образце при возбуждении флуоресценции, которые, в свою очередь, приводит к фотохимической деструкции флуорофора. Фотообесцвечивание может быть уменьшен путем: а) выдержки образцов в защищенном отсвет во время эксперимента ПЧ и хранения до их наблюдения; б) с использованием antifade агента (активных форм акцепторов кислорода) в монтажной среды; в) снижение интенсивности и / или длительности светового возбуждения; г) повышение концентрации флуорофоров или с использованием низкой концентрации флуорохромом с высокой квантовой эффективности; д) с помощью надежных флуорофоры, которые менее склонны к фотообесцвечивания (то есть. Alexa Fluors, Seta Fluors или DyLightFluors). В-третьих, флуоресценции часто из-за наличия флавиновых коферментов (FAD и FMN: поглощения, 450 нм; выбросов, 515 нм) и сниженным нуклеотидов пиридин (NADH: поглощения, 340 нм; выбросов, 460 нм) в клетках млекопитающих. Кроме того, использование альдегидов, в частности глутаровый альдегид, чтобы исправить образцы, может привести к высокому уровню флуоресценции. Это может быть сведено к минимуму путем промывки образцов с 0,1% боргидрида натрия в PBS до антитела инкубации и / или путем выбора зондов, светофильтры, что Maximize сигнала флуоресценции по отношению к флуоресценции. В-четвертых, флуоресценция перекрытия (также называется проступание, кроссовер или перекрестные помехи), главным образом, из-за выбросов спектральных свойств флуорофоров, поскольку они часто проявляют очень широкие полосы пропускания, различные асимметричные спектральные профили, а также различные пиковые длины волн излучения и количество Максимумы. Флуоресценции перекрытия происходит при работе с несколькими флуорофоров (многоцветной маркировки) и характеризуется испусканием одного флуорофора в канале (фильтр) другого флуорофора. Проступание артефакты должны быть минимизированы, поскольку они часто усложнить интерпретацию, если результаты, особенно в случае совместной локализации или количественных исследований. Как балансировка эмиссии флуорофоров может быть слегка улучшена только процедуру, если, проступание основном может быть снижена во время получения изображения с помощью оптимизированной флуоресценции наборы фильтров и / или детектор ФЭУ, чтобы правильно Separели спектральные профили флуорофорами. В связи с этим, конфокальной микроскопии хорошо подходит для многоцветной визуализации, так как позволяет дифференциации спектры флуоресценции отдельных флуорофоров, направляя каждый сигнал на конкретный канал обнаружения. Кроме того, конфокальной микроскопии позволяет регулировать усиление, ФЭУ напряжения или мощности лазера для отдельных каналов обнаружения для последовательного приобретения (только один флуорофора в то время) в маркировке. В идеале, управление одной-метка должна быть выполнена для количественной оценки проступание и в конечном итоге удалить его в вычислительном. Контрольную без вторичных антител (фон управления) могут быть получены, чтобы установить пределы усиления сигнала и смещение каждого канала для оптимального захвата изображения. Он также может быть использован для обработки после приобретения в правильном фоновое изображение (автофлуоресцентной).
В заключение, способ, описанный обеспечивает простой стандартный протокол легких realizatiна иммуноокрашивания на молочной железы разделах. Тем не менее, основные этапы эксперимента IHC должна быть оптимизирована для каждого антигена / пара антител для визуализации специфичное окрашивание и минимизации неспецифических фоновых сигналов. Описанный способ также включает в себя несколько основных методов для пост-обработки большинства изображений, полученных. Флуоресценции на основе иммунологического является мощным методом с широким спектром применения: от клеточной локализации антигена к диагностике. Новые достижения в этих подходах будет достигнута с будущей разработки новых флуорофоров, устройств сбора и методов микроскопии, чтобы изображение, предварительно ненаблюдаемые детали биологических структур и процессов.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Авторы заявляют, что у них нет конкурирующих финансовых интересов.
Acknowledgments
Авторы благодарны основной изображений объекта ИНРА MIMA2 (INRA, UMR1198, Жуи-ан-Жоза) и сотрудникам аппарата IERP (UE 0907, ИНРА, Жуи-ан-Жоза) для ухода за животными и удобствам. Мы хотели бы также поблагодарить IH Mather, MC Невилл и С. Туз за предоставление нам очень полезную antibodie.
Materials
| Name | Company | Catalog Number | Comments |
| Dissection | |||
| Pins | |||
| Ethanol | |||
| Scissors | |||
| Scalpel and adapted blades | |||
| Ice | |||
| Towel paper | |||
| Tissue sample preparation | Company | Catalog Number | Comments/Description |
| Phosphate Buffered Saline (pH7.4) | Sigma | P-3813 | |
| Paraformaldehyde (PFA, 32% EM grade, 100 ml) | Electron Microscopy Sciences | 15714-S | personnal protection equipment required WARNING: this product will expose you to Formaldehyde Gas, a chemical known to cause cancer |
| OCT compound/Tissue Tek | Sakura | 4583 | |
| Sucrose (D-saccharose) | VWR | 27480.294 | |
| Plastic molds | Dominique Dutscher | 39910 | |
| Liquid nitrogen | |||
| Cryostat/sample support | Leica | CM3050S | |
| Razor blades (SEC35) | Thermo Scientific | 152200 | |
| Slide box | |||
| Glass slides Superfrost/Superfrost Ultra Plus | Thermo Scientific | 10143560W90/1014356190 | |
| Brushes | |||
| IHC | Company | Catalog Number | Comments/Description |
| Super Pap Pen | Sigma | Z377821-1EA | |
| Permanent marker (black) | |||
| 50 mM NH4Cl in PBS | Sigma | A-0171 | |
| 0.1 M glycine in PBS | VWR | 24403.367 | |
| Antigen Retrieval solution: Tris 100 mM 5% urea pH9.6 | |||
| Heater (up to 100°C) | |||
| Bovine Serum Albumin (BSA) | Sigma | A7906-100G | |
| Vectashield (anti-fading mounting medium) without DAPI/with DAPI | Vector Laboratories | H-1000/H-1200 | |
| Glass coverslips 22x50mm (microscopy grade) | VWR | CORN2980-225 | |
| Nail polish | |||
| Primary antibodies | Company | Catalog Number | Comments/Description |
| Rabbit anti-mouse caseins (#7781; 1:50 dilution) | generously gifted by M.C. Neville (University of Colorado Health Sciences Center, USA) |
||
| Mouse anti-cytokeratin 8 (CK8, clone 1E8, 1:50 dilution) | Biolegend (Covance) | MMS-162P | |
| Mouse anti-cytokeratin 14 (CK14, cloneLL002, 1:50 dilution) | Thermo Scientific | MS-115-P0/P1 | |
| Rabbit anti-butyrophilin (1:300 dilution) | generously gifted by I.H. Mather (Department of Animal and Avian Sciences University of Maryland College Park, USA) | ||
| Rabbit anti-Stx6 (1:50 dilution) | generously gifted S. Tooze (Cancer Research UK, London Research Institute, London, UK) |
||
| Rabbit anti-VAMP4 (1:50 dilution) | Abcam | ab3348 | |
| Secondary antibodies | Company | Catalog Number | Comments/Description |
| Rhodamine-conjugated goat anti-rabbit IgG (H + L) (1:300 dilution) | Jackson ImmunoResearch Laboratories | 111-025-003 | |
| Counterstains | Company | Catalog Number | Comments/Description |
| Bodipy 493/503 | Life Technologies (Molecular Probes) | D-3922 | |
| DAPI (4-6-diamidino-2-phenylindole) | Life Technologies (Molecular Probes) | D-1306 | |
| Observation/Image capture | Company | Catalog Number | Comments/Description |
| conventional fluorescence microscope | Leica Leitz DMRB microscope |
Standard filters for FITC, Rhodamine and DAPI emissions, ×63 oil-immersion objective (NA 1.3), DP50 imaging camera (Olympus), CellˆF software (Olympus) |
|
| Laser Scanning Microscope (confocal microscopy) | Zeiss LSM 510 microscope |
Plan-Apochromat ×63 oil-immersion objective (NA 1.4), CLSM 510 software, Confocal facilities, MIMA2 Platform, INRA Jouy-en-Josas, France, http://mima2.jouy.inra.fr/mima2) | |
| Image treatment | Company | Catalog Number | Comments/Description |
| ImageJ 1.49k software | Free software |
References
- Watson, C. J., Khaled, W. T. Mammary development in the embryo and adult: a journey of morphogenesis and commitment. Development. , 135-995 (2008).
- Smith, G. H. Experimental mammary epithelial morphogenesis in an in vivo model: evidence for distinct cellular progenitors of the ductal and lobular phenotype. Breast Cancer Res Treat. 39, 21-31 (1996).
- Van Keymeulen, A., et al. Distinct stem cells contribute to mammary gland development and maintenance. Nature. 479, 189-193 (2011).
- Oakes, S. R., Gallego-Ortega, D., Ormandy, C. J. The mammary cellular hierarchy and breast cancer. Cell Mol Life Sci. 71, 4301-4324 (2014).
- Visvader, J. E., Stingl, J. Mammary stem cells and the differentiation hierarchy: current status and perspectives. Genes & development. 28, 1143-1158 (2014).
- Robinson, G. W. Cooperation of signalling pathways in embryonic mammary gland development. Nat Rev Genet. 8, 963-972 (2007).
- Cowin, P., Wysolmerski, J. Molecular mechanisms guiding embryonic mammary gland development. Cold Spring Harb Perspect Biol. 2, a003251 (2010).
- Brisken, C., O'Malley, B. Hormone action in the mammary gland. Cold Spring Harb Perspect Biol. 2, a003178 (2010).
- Gjorevski, N., Nelson, C. M. Integrated morphodynamic signalling of the mammary gland. Nat Rev Mol Cell Biol. 12, 581-593 (2011).
- Daniel, C. W., Smith, G. H. The mammary gland: a model for development. J Mammary Gland Biol Neoplasia. 4, 3-8 (1999).
- Howlett, A. R., Bissell, M. J. The influence of tissue microenvironment (stroma and extracellular matrix) on the development and function of mammary epithelium. Epithelial Cell Biol. 2, 79-89 (1993).
- Edwards, G., Streuli, C. Signalling in extracellular-matrix-mediated control of epithelial cell phenotype. Biochem Soc Trans. 23, 464-468 (1995).
- Hennighausen, L., Robinson, G. W. Think globally, act locally: the making of a mouse mammary gland. Genes & development. 12, 449-455 (1998).
- Topper, Y. J., Freeman, C. S. Multiple hormone interactions in the developmental biology of the mammary gland. Physiol Rev. 60, 1049-1106 (1980).
- Brisken, C., et al. A paracrine role for the epithelial progesterone receptor in mammary gland development. Proc Natl Acad Sci U S A. 95, 5076-5081 (1998).
- Ormandy, C. J., Binart, N., Kelly, P. A. Mammary gland development in prolactin receptor knockout mice. J Mammary Gland Biol Neoplasia. 2, 355-364 (1997).
- Oakes, S. R., Rogers, R. L., Naylor, M. J., Ormandy, C. J. Prolactin regulation of mammary gland development. J Mammary Gland Biol Neoplasia. 13, 13-28 (2008).
- Hennighausen, L., Robinson, G. W. Information networks in the mammary gland. Nat Rev Mol Cell Biol. 6, 715-725 (2005).
- Kouros-Mehr, H., Werb, Z. Candidate regulators of mammary branching morphogenesis identified by genome-wide transcript analysis. Dev Dyn. 235, 3404-3412 (2006).
- Khaled, W. T., et al. The IL-4/IL-13/Stat6 signalling pathway promotes luminal mammary epithelial cell development. Development. 134, 2739-2750 (2007).
- Asselin-Labat, M. L., et al. Gata-3 is an essential regulator of mammary-gland morphogenesis and luminal-cell differentiation. Nat Cell Biol. 9, 201-209 (2007).
- Barcellos-Hoff, M. H., Aggeler, J., Ram, T. G., Bissell, M. J. Functional differentiation and alveolar morphogenesis of primary mammary cultures on reconstituted basement membrane. Development. 105, 223-235 (1989).
- Robinson, G. W., McKnight, R. A., Smith, G. H., Hennighausen, L. Mammary epithelial cells undergo secretory differentiation in cycling virgins but require pregnancy for the establishment of terminal differentiation. Development. 121, 2079-2090 (1995).
- Streuli, C. H., Bissell, M. J. Mammary epithelial cells, extracellular matrix, and gene expression. Cancer Treat Res. 53, 365-381 (1991).
- Streuli, C. H., et al. Laminin mediates tissue-specific gene expression in mammary epithelia. J Cell Biol. 129, 591-603 (1995).
- Boudreau, N., Sympson, C. J., Werb, Z., Bissell, M. J. Suppression of ICE and apoptosis in mammary epithelial cells by extracellular matrix. Science. 267, 891-893 (1995).
- Pullan, S., et al. Requirement of basement membrane for the suppression of programmed cell death in mammary epithelium. J Cell Sci. 109 (Pt 3), 631-642 (1996).
- Schmidhauser, C., Bissell, M. J., Myers, C. A., Casperson, G. F. Extracellular matrix and hormones transcriptionally regulate bovine beta-casein 5' sequences in stably transfected mouse mammary cells. Proc Natl Acad Sci U S A. 87, 9118-9122 (1990).
- Streuli, C. H., et al. Stat5 as a target for regulation by extracellular matrix. J Biol Chem. 270, 21639-21644 (1995).
- Sollner, T., et al. SNAP receptors implicated in vesicle targeting and fusion. Nature. 362, 318-324 (1993).
- Jahn, R., Scheller, R. H. SNAREs--engines for membrane fusion. Nat Rev Mol Cell Biol. 7, 631-643 (2006).
- Weber, T., et al. SNAREpins: minimal machinery for membrane fusion. Cell. 92, 759-772 (1998).
- Sollner, T., Bennett, M. K., Whiteheart, S. W., Scheller, R. H., Rothman, J. E. A protein assembly-disassembly pathway in vitro that may correspond to sequential steps of synaptic vesicle docking, activation, and fusion. Cell. 75, 409-418 (1993).
- McNew, J. A. Regulation of SNARE-mediated membrane fusion during exocytosis. Chem Rev. 108, 1669-1686 (2008).
- Wang, C. C., et al. VAMP8/endobrevin as a general vesicular SNARE for regulated exocytosis of the exocrine system. Mol Biol Cell. 18, 1056-1063 (2007).
- Chat, S., et al. Characterisation of the potential SNARE proteins relevant to milk product release by mouse mammary epithelial cells. Eur J Cell Biol. 90, 401-413 (2011).
- Reinhardt, T. A., Lippolis, J. D. Bovine milk fat globule membrane proteome. J Dairy Res. 73, 406-416 (2006).
- Robenek, H., et al. Butyrophilin controls milk fat globule secretion. Proc Natl Acad Sci U S A. 103, 10385-10390 (2006).
- Fujimoto, T., Ohsaki, Y., Cheng, J., Suzuki, M., Shinohara, Y. Lipid droplets: a classic organelle with new outfits. Histochem Cell Biol. 130, 263-279 (2008).
- Mather, I. H., Keenan, T. W. Origin and secretion of milk lipids. J Mammary Gland Biol Neoplasia. 3, 259-273 (1998).
- Heid, H. W., Keenan, T. W. Intracellular origin and secretion of milk fat globules. Eur J Cell Biol. 84, 245-258 (2005).
- McManaman, J. L., Russell, T. D., Schaack, J., Orlicky, D. J., Robenek, H. Molecular determinants of milk lipid secretion. J Mammary Gland Biol Neoplasia. 12, 259-268 (2007).
- de Assis, S., Warri, A., Cruz, M. I., Hilakivi-Clarke, L. Changes in mammary gland morphology and breast cancer risk in rats. Journal of visualized experiments : JoVE. , (2010).
- Plante, I., Stewart, M. K., Laird, D. W. Evaluation of mammary gland development and function in mouse models. Journal of visualized experiments : JoVE. , (2011).
- Galio, L., et al. MicroRNA in the ovine mammary gland during early pregnancy: spatial and temporal expression of miR-21, miR-205, and miR-200. Physiol Genomics. 45, 151-161 (2013).
- Linzell, J. L., Peaker, M. The effects of oxytocin and milk removal on milk secretion in the goat. J Physiol. 216, 717-734 (1971).
- Knight, C. H., Peaker, M., Wilde, C. J. Local control of mammary development and function. Rev Reprod. 3, 104-112 (1998).
- Walid, M. S., Osborne, T. J., Robinson, J. S. Primary brain sarcoma or metastatic carcinoma? Indian J Cancer. 46, 174-175 (2009).
- Hue-Beauvais, C., et al. Localisation of caveolin in mammary tissue depends on cell type. Cell Tissue Res. 328, 521-536 (2007).
- McManaman, J. L., Neville, M. C. Mammary physiology and milk secretion. Adv Drug Deliv Rev. 55, 629-641 (2003).
- Mather, I. H., Jack, L. J. A review of the molecular and cellular biology of butyrophilin, the major protein of bovine milk fat globule membrane. J Dairy Sci. 76, 3832-3850 (1993).
- Heid, H. W., Winter, S., Bruder, G., Keenan, T. W., Jarasch, E. D. Butyrophilin, an apical plasma membrane-associated glycoprotein characteristic of lactating mammary glands of diverse species. Biochim Biophys Acta. 728, 228-238 (1983).
- Bock, J. B., Klumperman, J., Davanger, S., Scheller, R. H. Syntaxin 6 functions in trans-Golgi network vesicle trafficking. Mol Biol Cell. 8, 1261-1271 (1997).
- Tran, T. H., Zeng, Q., Hong, W. VAMP4 cycles from the cell surface to the trans-Golgi network via sorting and recycling endosomes. J Cell Sci. 120, 1028-1041 (2007).
- Wendler, F., Page, L., Urbe, S., Tooze, S. A. Homotypic fusion of immature secretory granules during maturation requires syntaxin 6. Mol Biol Cell. 12, 1699-1709 (2001).
- Wendler, F., Tooze, S. Syntaxin 6: the promiscuous behaviour of a SNARE protein. Traffic. 2, 606-611 (2001).
- Shitara, A., et al. VAMP4 is required to maintain the ribbon structure of the Golgi apparatus. Mol Cell Biochem. 380, 11-21 (2013).
- Thibault, C., Levasseur, M. C. La reproduction chez les mammifères et l'homme. , INRA Editions. 928 (2001).
- Truchet, S., Wietzerbin, J., Debey, P. Mouse oocytes and preimplantation embryos bear the two sub-units of interferon-gamma receptor. Mol Reprod Dev. 60, 319-330 (2001).



