Summary
Bu makalede açıklanan dolaylı immünfloresan protokol algılama ve fare meme bezinde proteinlerin yerelleştirme verir. Tam bir yöntem olup, meme bezi örnekleri hazırlamak için floresan mikroskobu ile görüntü, doku kesitlerinde immunhistokimya gerçekleştirmek için ve görüntüleri yeniden verilir.
Abstract
Dolaylı immünoflüoresans algılar ve bir dokuda ilgili proteinleri bulmak için kullanılır. Burada sunulan protokol proteinlerinin bağışıklık saptanması için bir tam ve basit bir yöntem olup, meme bezi laktasyondaki fare örnek olarak alınmıştır açıklanmaktadır. Özellikle fare meme bezi, doku fiksasyon ve dondurulmuş doku kesit diseksiyon ilgili doku örneklerinin hazırlanması için bir protokol, ayrıntılı olarak açıklanmıştır. Bir standart bir protokol isteğe bağlı antijen alma aşaması da dahil olmak üzere, dolaylı immünofloresan gerçekleştirmek için de sunulmaktadır. Etiketli doku kesitlerinin gözlem yanı sıra görüntü toplama ve post-tedavileri de belirtilmiştir. Bu prosedür, bir proteinin hücresel lokalizasyonu hayvan dokusunun koleksiyonundan tam bir bakış verir. Bu genel yöntem, diğer doku örnekleri uygulanabilir olsa da, çalışılan her doku / birincil antikor çift göre adapte edilmelidir.
Introduction
Meme bezi asıl işlevi yenidoğanların beslemek için süt üretmek için bir atipik memeli exocrine organıdır. Meme dokusu gelişimi esas olarak doğum sonrası meydana gelir ve epitel çevreleyen dokudan işgal ettiği benzersiz bir süreç ile karakterize edilir. Bu doku eş zamanlı üreme durumu varyasyonların (Şekil 1), özellikle erişkin yaşamı boyunca, pek çok değişiklik (büyüme, farklılaşma ve regresyon) uğrar. Doku genel morfolojisine ek olarak, farklı hücre tiplerinin yanı sıra meme bezi içindeki düzenlemesinin oranlar önemli ölçüde gelişme 1-5 boyunca değişmez.
Embriyonik yaşamı boyunca meme epitel embriyonik gün 10,5 (E10.5) (Şekil 1A yaklaşık orta hattın her iki tarafında ön ve arka bacak arasında ektoderm hafif bir kalınlaşma ve tabakalaşma tarafından tanımlanan meme süt çizgileri türeyen ).E11.5 üzerinde süt hattı simetrik tekrarlanabilir yerlerde meme süt hattı boyunca konumlandırılmış bireysel placodes, içine kırılır ve çevredeki mezenşimin yoğunlaşmaya başlar. Placodes dermis içine derin batmaya başlar ve meme mezenşimin meme tomurcuğu (E12.5-E14.5) etrafında konsantrik tabakalar halinde düzenler. E15.5 itibarıyla meme epitel, çoğalmaya ve yağ yastığı doğru meme mezenşimin aracılığıyla iter birincil filiz oluşturmak üzere uzatılması başlar. Birincil filiz nipel kılıf oluşumu ile işaretlenmiş cilde bir açıklığı olan bir içi boş lümen geliştirir. E18.5 üzerinde uzama kanal yağ yastığı haline geldi ve yağ yastığı kapsayan küçük bir arborized duktal sistemi içine dallı gelmiştir. Kalkınma esas tutuklandı ve ilkel meme bezi ergenliğe kadar morfogenetik sessiz kalır. Erkek embriyo, androjen reseptörlerinin aktivasyonu yok tomurcukları, dejenerasyonuna yol açarE15.5 tarafından. E18 itibariyle meme gelişimi ergenlik 6-9 kadar durur.
Doğumda, meme bezi uzatır ve dalları yavaş yavaş (izometrik büyüme) bir ilkel duktal sistemi barındırıyor. Ergenlik başlangıcında, kanalların ucunda yer alan küre biçimli yapılar terminal uç tomurcukları (TEB), kapak hücrelerin bir dış tabaka ve bir hücre tabakalı iç kısım (vücut hücreleri) oluşturulmaktadır adlandırılır. Bu yapılar yüksek proliferatif ve hormonal uyaranlara yanıt olarak çevreleyen stromal doku sızmak. Duktal uzama TEB'in sonuçlar içinde Silahların Yayılmasını Önleme, morfolojilerinden dallanma ile birleştiğinde. Bu süreç meme başı (Şekil 1B, ergenlik) kaynaklanan bir temel epitel arborized ağının kurulmasına yol açar. ~ 10-12 hafta doğumdan sonra, epitel bütün yağ yastığı işgal etmiştir, genişleme durur ve at TEB kaybolur. Duktal geliştirme sonra dinamik değişiklikleri, yani Successi uğraröstrus döngüsü 10 (Şekil 1B, yetişkin) göre olan epitel hücrelerin proliferasyonunu ve regresyonu ettik.
Gebeliğin başlangıcından itibaren, meme dokusu emzirme hazırlanmak için önemli büyüme ve morfolojik değişikliklere uğrar. Meme epitel yoğun bir çok dallı tübülo-alveol ağa lider, çoğalmaya ve ayırt. Buna paralel, meme epitel hücreleri (MECler) polarize ve sentez ve süt ürünleri salgılar mümkün hale gelir. MECler kasılma myoepitelyal hücreleri ile çevrilidir ve bağ ve yağ dokuları, kan damarları ve sinir terminalleri (Şekil 1B, gebelik) oluşan bir stroma dahil edilmiştir sayıda alveol yapılar (acininin) içine düzenliyoruz. Ayrıca, MECS bazal yan bazal membran (hücre dışı matris) ile yakın temas içinde olduğunu ve bu iki varlık arasındaki etkileşimler sıkıca memenin hem morfogenezine ve salgı fonksiyonunu düzenlerry epitel 11-13.
Tüm bu işlemler, en önemli hormones14 olan çeşitli çevre hareketlerine, parakrin faktörleri ve hücre dışı matrisin etkisine dayanır. Örneğin, progesteron, geniş yan dallanma prolaktin (PRL) ile kombinasyon halinde, 15 ve 16,17 alveologenesis indükler teşvik eder ve alveol farklılaşmasını korur. Steroidler ve PRL18, sitokinler ve gelişimi ile ilişkili sinyal yolları yanı sıra (Wnt sinyal yolları ve Notch) ayrıca meme soy bağlılığı ve geliştirme 19-21 katılmaktadırlar. Gebeliğin sonunda lümen MECler alveol lümeninde kolostrum olarak bilinen bir protein bakımından zengin süt üretmeye başlarlar. Ayrıca, progesteron epitel geçirgenliğine etki eder ve sıkı bağlantıları hala açık olduğundan, kolostrum maternal kan akışı bulunur.
Doğumdan sonraki, mammary epiteli (Şekil 2, meme epitel) hemen hemen tüm meme bezi hacminin kadar sürer ve son derece organize edilmektedir. Süt üreten üniteler, yani alveollerin (Şekil 2, alveol), apikal plazma zarı lümen sınırlayan ile polarize meme epitelyum salgılama hücrelerinde (MESCs) bir tek tabaka ile oluşturulmuştur. Alveoller dış ortamın (Şekil 2, lob) süt drenaj kanallarına bağlı loblar şeklinde gruplandırılmış lobülleri kendilerini düzenlemek. Emzirme oluşur yani., MESCs öncelikle plasental hormonlar damla (özellikle progesteron) (Şekil 1B, laktasyon) tarafından tetiklenen süt bol miktarda, salgılamaya başlar. Süt protein genleri esas emzirme sırasında serbest bırakılacak hipofiz PRL yanıt olarak, gebelikten laktasyon 9,22,23 arasında değişen belirli bir zamansal zamanla aktif hale gelir. Buna paralel, MESCs hem ekstraselüler matriks arasındaki temaslar süt protein synt teşvikHücresel integrinler ve laminin 24,25 arasındaki etkileşimlerin aracılık ettiği ve MESCs 26,27 apoptoz bastırmak sinyallerin aracılığıyla nüklerde. Bu sinyal yolları belirli bir transkripsiyon aktivasyonu 29 faktörleri ile süt protein geni promoterlerinden 28 aktivasyonu ile sonuçlanır. Hücre-hücre kişileri de apikal kutupluluk kurulması ve süt ürünlerinin vektörel salgılanması da dahil olmak üzere farklılaşma bazı yönleri için önemlidir. Laktasyon ve MESCs başladıktan sonra hızla kapatmak sıkı bağlantılar ince yenidoğanlarda besin ihtiyaçlarına yanıt olarak kanda yanı sıra süt bileşenlerinin sentezi, taşınması ve salgılanması gelen moleküllerin alımını orchestrate. Emzirme sırasında, alveoller çevreleyen myoepitelyal hücrelerinin kasılması oksitosin yanıt olarak ortaya çıkar ve kanallar boyunca ve meme ucu içine süt fırlatma yol açar. Süt proteinleri içeren karmaşık bir sıvı (çoğunluklakazein), şekerler (özellikle laktoz) gibi immünoglobulinler A (IgA), büyüme faktörleri ve hormonlar gibi lipidler ve mineraller gibi biyolojik olarak aktif moleküller. Kazeinler, yani salgı yolu boyunca taşınan miseller, kazein, supramoleküler yapılarda monte sentezlenebilir ve daha sonra exocytosis tarafından yayımlanan, yani Mesc apikal plazma membranı ile kazein içeren salgı kabarcıklarına füzyonu (SVS) (Şekil 2).
Hücre içi trafik membranöz bölmeleri arasındaki maddi borsalarında dayanır ve gerektirir Çözünür N-etilmaleimit Duyarlı Füzyon (NSF) Eklenti Protein (SNAP) Reseptör (SNARE) 30,31. SNARE proteinleri ailesi, hedef zarlarında lokalize veziküler vesikül membran içinde mevcut tuzak (v tuzak), ve hedef tuzak (t-tuzak) bölünmüştür. Bunların halkalaştırılmış halka etki ile sıkıştırma ile, v-ve t-tuzak oldukça dengeli bir dört sarmal demet kompleksi oluşturmak üzere birleşir, ifade inci gibie SNARE kompleksi. Bu kompleks giderek yakın 30,32 içine getirerek iki karşıt lipit bilayers füzyon teşvik etmektedir. Daha sonra, Snare kompleksleri NSF adenozin trifosfat tarafından ayrışmış ve onun adaptör protein SNAP ve Snare proteinler kökenli 33 kendi bölmesine geri geri dönüştürülür. İlginçtir ki, her SNARE protein ağırlıklı hücre içi füzyon olayları 34 özgüllük katkıda bulunabilir farklı hücre bölmeleri ve SNARE eşleştirme bulunur. Daha önceki çalışmalar, en azından Protein 23 (SNAP23) ve veziküllü Associated Membrane Protein 8 (VAMP8) ve syntaxins (STX) sinaptozomal-ilişkili olduğunu göstermektedir -7 ve -12 kasein Ekzositoz 35,36 bir rol oynayabilir. Bu proteinler aynı zamanda sütün lipid fraksiyon, örneğin, süt yağı globülleri (MFG'ler) 37 ile bağlantılı olarak tespit edilmiştir. Mevcut olan model, sitoplazmik lipid damlacıkları (clds) nötr l birikimi ile oluşturulmaktadır öne sürülenipids (özellikle triaçilgliseroller ve sterol esterleri) ve endoplazmik retikulum (ER) zarında 38-41 iki broşürler arasında anne diyet türetilen kolesterol. Büyük clds MESC apikal plazma membran ile sarılmış olan, tomurcuklanarak bunlar MFG'lerin olarak yayınlanırlar MESCs apikal tarafında (çapı 1-10 um) nakledilirken küçük CLD füzyonuyla, en azından kısmen oluşturulmaktadır 40-42. Yavrular sütten ve MESCs giderek geri puberte durumuna (Şekil 1B, involution) için meme dokusunun gerileme neden apoptoz ile ölmek sonra Emzirme sona erer.
İmmünofloresan (IF) araştırma ve klinik teşhis hem de biyoloji neredeyse tüm yönleriyle kullanılan yaygın bir analitik laboratuvar yöntemidir. Teknikler doku kesitlerinde yapılabilir IF (immünohistokimya, İHK) veya hücre (immünsitokimya, ICC) örnekleri. Bu güçlü bir yaklaşım fluorescent- kullanımına dayanmaktadırÖzellikle bu şekilde floresan mikroskobu aracılığıyla doku dağılım gözönünde canlandırılmasına olanak tanıyan ilgilenilen antijene (doğrudan ya da dolaylı olarak) bağlanan etiketli antikorlar. Floresan sinyalleri çoğunlukla numunenin kalitesi ve konsantrasyonu antikorların ve doğru olarak kullanma bağlıdır. Basit bir indirekt immunfloresan (IIF) protokolü süt ürünleri (kazein ve MFG'ler) ve süt ürünleri salgılanması yer alan proteinler tespit etmek için sunulan fare meme dokusu (Şekil 3) donmuş bölümlerinde (butirofilin (BTN1), proteinler trampet). Bu protokol, doku toplama görüntü tedavi sonrası, eleştirel ve isteğe bağlı adımların yanı sıra bazı teknik önerilere kadar, tam bir İHK bakış sağlarken aynı zamanda sunulmuş ve tartışılmıştır.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
CD1 fareleri INRA (UE0907 IERP, Jouy-en-Josas, Fransa) yetiştirilmiş. Hayvan bakımı tüm etik yönleri Fransa Tarım Bakanlığı tarafından belirlenen ilgili kurallar ve lisans gereklerine uyulması. Kullanılan prosedürler (Comethea Jouy-en-Josas / AgroParisTech gelen anlaşma 12/097) yerel etik kurul tarafından onaylanmıştır.
1. Meme Bezi Numune Hazırlama
- Fare meme bezi diseksiyon
- Servikal dislokasyon ile laktasyonun 10. günde fareler Euthanize ve karın yukarı bakacak şekilde aşağı hayvan pin.
- Etanol ile ventral bölgeyi ıslatın ve bir kağıt havlu ile kurulayın.
- Forseps kullanarak, iki arka bacaklarının arasına karın cildi yukarı çekin ve keskin bir makas ile yaklaşık 1 cm (sadece deri yoluyla) bir kesi yapmak. Bu ilk kesi başlayarak, daha sonra fare üzerinde boynuna cilt kadar kesmek için makas kullanın. Periton ve pi Cildi uzakta çekinn Bir kerede cilde bir tarafında aşağı o öğretti germe.
- Karın ve çubukla deriden uzak iterek ve nihayet çekerek veya uzak periton onları keserek inguinal meme bezlerinin toplayın.
Not: Bu adımda Carmine boyama tüm bezi 43 olan meme epitel görselleştirmek için gerçekleştirilebilir. Bu yaklaşım, çeşitli koşullarda (fizyolojik gelişim aşamaları, hastalıklar, in vivo tedavi) altında meme bezinin genel morfolojisi analiz etmek faydalı olabilir. - Karın kavşağında ve kasık bezlerinde 44 bulunan lenf düğümü çıkarın.
- Meme dokusu tespit
- Mümkün olduğu kadar süt uzaklaştırmak için (PBS) çözeltisi, pH 7.4 bir fosfat tamponlu tuzlu su içinde bu parçaları yıkayın hemen bir neşter ile 3 mm 3 parça halinde meme doku kesip.
- Hızlı bir kağıda parçaları kurulayınhavlu ve buz üzerinde 10 ila 15 dakika süreyle% 4 paraformaldehid (PFA, HCHO,% 32 formaldehit çözeltisi, DİKKAT) içeren soğuk PBS çözeltisi koyun.
Not: Bu IIF36 ve / veya in situ hibridizasyon 45 meme dokusu dilimleri üzerinde bir sonraki analiz izin vermek için yeterli zamandır. Aldehid sabitleyiciler doku parçaları oldukça yavaş nüfuz Ancak, (~ saatte 1-3 mm), bu zaman doku numunesinin optimal fiksasyonu sağlamak için uzatılabilir. Alternatif olarak, bir fiksatif solüsyonu (bu çalışmada ayrıntılı olmayan) bir anestezi hayvan perfüze in vivo doku düzeltin.
- Sukroz infüzyon
- Hızlı bir şekilde soğuk PBS meme parçalarını yıkayın ve hafifçe çalkalanarak altında 4 ° C de 16 saat 48 için% 40 sükroz (D-sakaroz, C12H22O11, Bay 342.3 g / mol) ihtiva eden soğuk bir PBS çözeltisi sokmaktan.
- Doku gömme
Not: Bu adımda, meme parçaları küçük parçaları (2-3 mm 3 yapmak için yeniden kesilebilir) Ya da şeklini ayarlamak için.- Düzgün plastik kalıp etiket ve oda sıcaklığında muhafaza Ekim bileşiği ile kalıp hacminin 3 doldurun. Kalıp başına meme dokusunun bir parçası (2-3 mm 3) yerleştirin ve OCT bileşiği ile örtün.
- (Alüminyum veya metal bir elek kullanılarak bir tabaka üzerine), sıvı azot yüzeyinde kalıpları yerleştirin ve ürün dondurularak izin verir.
Not: sıvı azot içinde kalıp batırılması önce katı ve beyaz olmak zorundadır.
- Doku kesitleri yapılana kadar -80 ° C'de donmuş örnekleri saklayın.
2. Donmuş doku Kesit
Not: esas olarak bir dondurucu içinde bir mikrotom olan bir kriyostat, donmuş doku bölümleri yapmak için gereklidir. Daha düşük bir sıcaklıkta, genellikle örneğin saf meme bezi gibi hayvansal yağ veya lipid bakımından zengin dokular için gereklidir.
- ° C -26 kadar kriyostat sıcaklığını ayarlayın ve stabilitenin sahip kadar bekleyinlized. Tüm kesit işlem boyunca -26 ° C 'de dondurulmuş doku bloğu koruyun. Kesinlikle işlem sırasında herhangi bir zamanda doku çözündükten kaçının.
- En az 10 dakika süreyle kriyostat yerleştirerek ° C -26 kadar jilet kesme desteği, anti-roll cihaz ve fırça soğutun. Ayrıca bölümler yapılmış gibi cam slaytlar saklamak edebilmek için kriyostat içinde bir slayt kutusu yerleştirin.
- Düzgün RT'de onları doku bölümleri toplamak ve korumak için kullanılacak cam slaytlar etiket; Aksi takdirde doku bölümleri kendilerine bağlı olmayacaktır. Kriyostat içinde kalıp örneği çıkarın.
Not: Kullanımı pozitif yüklü cam slaytlar büyük ölçüde nedeniyle yüksek elektrostatik çekim taze donmuş doku bölümleri yapışmasını tercih edecektir. - (Oda sıcaklığında tutulan) Ekim bileşiği ile metal doku diskin yüzeyini kaplayan ve bunun üzerine donmuş örneği itin. Islak kriyostat içinde monte yerleştirin ve co izinEn az 15 dakika boyunca ol elde edilir.
- Kriyostat disk yuvasına ıslak montaj yerleştirin. Mümkünse, yeni keskin bıçak kullanın ya da en azından her bir örnek bu yana bazı dokular olacak hızla sıkıcı onu kesmek için kullanılan bıçak üzerinde alanını değiştirmek, 5-6 um kesim kalınlığı ayarlayın ve.
- Dilimler eşit ve doğru oluşana kadar montaj orta kesim yaparak jilet üzerinde anti-roll cihazının konumunu ayarlayın. İdeal olarak, anti-roll cihazı yaklaşık 1 mm jilet üzerinde adım olacaktır.
- Ayarların doğru olduğunu bir kez sürekli bir üniforma hareket tekerleği çevirerek doku bölümleri gerçekleştirin. Sıcaklık ideal sürece, bir doku kesiti, doğası gereği, bükmek için çalışacağız.
- Kapmak ve cam slayt istediğiniz gibi yerleştirmek için sahneye genelinde bölümü manevra için bir fırça kullanın. Dondurulmuş doku bloğu ve / veya jilet üzerinde muhtemelen mevcut kalıntıları temizlemek için bir fırça kullanın.
- Çekkullanıcı doğru doku kesiti ve kriyostat sahneye bastırarak kaçının. O sahnede doku dilim ve böylece cam slayt ile onu kurtarmak için yetersizlik yapışması neden olabilir kriyostat sahneye doku kısmını bastırarak kaçının.
- Bölümünde yukarıda tutarak ve doku bölüme dokunmak için aşağı olta balıkçılığı yoluyla, bir cam slayt yüzeyinde onları toplayıp doku kesitlerine teker teker alın.
Not: Doku kesitleri hızla nedeniyle statik cazibe sıcak cama yapışır. Birkaç doku kesitleri aynı slaytta yerleştirilir, bunları üst üste ve uzay onları yeterince ayrı bir hidrofobik daire içine alın edebilmek için dikkatli olmak (bölüm 3.1.1 bakın.).
3. Dolaylı İmmünofloresan
- Bölümleri yerlerinin
- Slayt monte doku etrafında bir hidrofobik daire çizmek için hidrofobik bir bariyer kalem kullanın. RT'de yaklaşık 1 dakika boyunca daire kurumasını bekleyin. T etrafında bir çizgi çizinSorun ince siyah kalıcı bir kalem ile bölümleri yanı sıra, fakat üzerinde doku kesitleri olan birine zıt cam slayt tarafı.
Not: Bu çevre su itici ve aseton ve alkol çözünmeyen. Bu nedenle, IHC prosedüründe kullanılan sulu çözeltiler karşı bir bariyer sağlar ve gereken reaktifler hacmini azaltmaktadır. - Oda sıcaklığında bir kaç dakika için ~ bir damla PBS 250 ul kaplayarak doku bölümleri rehidrate. ~ 10 ila 15 dakika süreyle PBS içinde yeni hazırlanmış bir% 3 PFA çözeltisi 250 ul kaplayarak doku bölümleri sabitleyin.
Not: İsteğe bağlı olarak, bu durumda, bir aldehid söndürme çözeltisi kullanmak (50 mM amonyum klorid (NH4CI, Bay PBS içinde 53,5 g / mol) ve 0.1 M glisin (C2, H 5, NO 2, Bay 75,07 g / mol), PBS içinde ) sabitleme reaksiyonu durdurmak için. Basit ve bol miktarda PBS Yıkama reaksiyona girmemiş olan aldehit çıkanlması ve genel olarak yeterlidir.
- Slayt monte doku etrafında bir hidrofobik daire çizmek için hidrofobik bir bariyer kalem kullanın. RT'de yaklaşık 1 dakika boyunca daire kurumasını bekleyin. T etrafında bir çizgi çizinSorun ince siyah kalıcı bir kalem ile bölümleri yanı sıra, fakat üzerinde doku kesitleri olan birine zıt cam slayt tarafı.
- Antijen alma (isteğe bağlı)
- Beher AR çözeltisi (100 mM Tris (Cı 4H 11 NO 3, Bay 121.14),% 5 üre (NH2 CONH2, Mr 60,06) pH 9.6) yerleştirin. AR çözeltisinin hacmi tamamen cam tutucu yerleştirilmiş cam slaytlar karşılamak için yeterli olmalıdır.
- Bir termometre ile takip edilerek 95 ° C'ye kadar AR çözeltisi önceden ısıtmak ve daha sonra uygun bir raf üzerinde cam slaytlar yer sıcak tamponu içinde raf immerge kapak buharlaşma sınırlayacak ve 95 ° C de 10 dakika inkübe etmek.
- Su banyosu beher çıkarın ve tampon maddesi içinde 10 dakika daha cam slaytlar bırakın.
- PBS (~ 250 ul / bölüm) ile doku bölümleri durulayın ve bir çözüm ile onları doyurmak% 3 sığır serum albümini (BSA, ~ 250 ul / bölümü) oda sıcaklığında en az 30 dakika boyunca PBS içinde.
- PBS her doku bölümündeki% 2 BSA içeren seyreltilmiş primer antikor 30-50 ul koyun.
Not: Bu birim tamamen doku bölümü kapsayan bir damla oluşturmak için yeterlidir. - Birincil antikor olmayan bir negatif kontrol gerçekleştirmek için, bir doku bölümü üzerinde tek başına seyreltici, (PBS içinde% 2 BSA) ile aynı hacmi yerleştirin.
- Sistematik olarak, her IHC deneyde, bu negatif kontrol içerir ve (sekonder antikor ve / veya doku bir oto-floresan için spesifik-olmayan etiketleme) deneyi arka tahmin etmek için kullanılan her bir ikincil antikor için gerçekleştirin. Pozitif veya negatif kontrollerin diğer tipleri de (tartışmaya bakınız) etiketleme özgünlüğünü sağlamak için gerçekleştirilebilir.
- 4 ° C'de / nemlendirilmiş bir kutu O'da N cam slaytlar yerleştirin.
Not: Kullanılan Birincil antikorlar fare monoklonal anti-sitokeratin vardı8 (CK8, 1:50 seyreltme), fare monoklonal 14 (CK14, 1:50 seyreltme), anti-sitokeratin, tavşan poliklonal anti-fare kasein (# 7781, 1:50 seyrelti, cömertçe MC Neville, Colorado Sağlık Üniversitesi tarafından sağlanan Bilimleri Merkezi, CO, USA), tavşan poliklonal anti-BTN1 (1: cömertçe IH Mather, Hayvan ve Kuş Bilimleri Bölümü, University of Maryland, College Park, MD, ABD), tavşan poliklonal anti-Stx6 (tarafından sağlanan 300 seyreltme, cömertçe S. Tooze, Cancer Research, İngiltere, Londra Araştırma Enstitüsü, Londra, UK) ve tavşan poliklonal anti-VAMP4 (1:50 seyreltme) tarafından sağlanan 1:50 seyrelti,. - İyice oda sıcaklığında 10 dakika boyunca PBS ile en az dört kez doku bölümleri yıkayın.
- PBS,% 2 BSA içeren tüm doku kesitlerinde Bu çözeltinin 30-50 ul koyun ve 1.5 saat boyunca inkübe: Uygun ikincil antikoru (300 seyreltme rodamin-konjuge keçi anti-tavşan IgG (H + L), 1) seyreltin oda sıcaklığında karıştırıldı.
- Fluorochromes ışığa duyarlı moleküller olduğundan, yokOnların analize kadar ışığa doku bölümleri maruz bırakmaktadır. Hücre zarları, düşük etiketleme engelleyebilir yeşil bir otomatik floresan üretmek eğilimindedir beri doku kesitlerinde IIF, kırmızı flüorofora bağlı ikincil antikorlar lehine. Ayrıca, kırmızı bir florofor-bağlı ikincil antikor seçiminde nötral lipidlerin (aşağıya bakınız) eşlik eden etiketleme sağlar.
- İyice oda sıcaklığında 10 dakika boyunca PBS ile en az dört kez doku bölümleri yıkayın.
- Bazı deneyler için, antijen / antikor iskeleleri stabilize etmek için oda sıcaklığında 10 dakika süreyle PBS içinde seyreltilmiş 2% PFA için örneklerin inkübe edilmesi ile sonradan tespit gerçekleştirin. Bununla birlikte, bu adım birçok durumda gerek kalmaz.
- BODIPY 493 3 ug / ml ihtiva eden bir PBS çözeltisinden 30-50 ul doku bölümleri inkübe edilerek clds ve MFG'ler, renk nötr lipidler görselleştirmek içinOda sıcaklığında 10 dakika süreyle / 503. Hızla PBS ile iki kez doku bölümleri yıkayın.
- Oda sıcaklığında 10 dakika boyunca DAPI (4-6-diamidino-2-fenilindol, 5 mg / ml stok çözeltisi) 3 uM ihtiva eden bir PBS çözeltisinden 30-50 ul nükleer DNA Counterstain. Gözlem için slaytlar monte etmeden önce PBS ile iki kez doku bölümleri yıkayın.
- PBS çıkarın ve her doku bölümünde montaj orta bir damla yerleştirin.
- Hava kabarcıklarını önlemek, slayt karşı bir açıyla kapak kayma bir tarafını yerleştirin sıvı damla dış kenarı ile temas ve sonra yavaşça kapağı indirin. Sıvı bir kaç dakika için cam slayt ve kapak slip arasında yayılır ve daha sonra bir kağıt havlu ile orta montaj fazlasının ayrılması için izin verir.
- Gözlem kadar ışığa maruz kaldıkları önlemek için 4 ° C'de oje ve mağaza doku bölümleri ile cam slayt kapak kayma mühür.
4. Floresan Gözlem ve Image Acquisition
Not: görüntü alma yazılımı tarafından kontrol edilen bir kamera İHK sonuçlarını gözlemlemek için gerekli donatılmış bir floresan mikroskop.
- Görüntüleri elde etmeden önce, etiketleme yoğunluğunu kontrol etmek ve negatif kontroller bakarak deneyin arka değerlendirir. Tek tek her floresan etiket (renk kanalı) fotoğraflarını edinin.
- Her renk kanalı için aynı koşullar (pozlama ve genel ayarlar) karşılık gelen kontrol de dahil olmak üzere, tüm resimleri edinin.
- Geleneksel mikroskopi
- 63 (yağ daldırma, NA 1.3) hedefleri ve DP50 görüntüleme kamerasını × 20 × standart floresein izotiyosiyanat için filtreler (FITC, yeşil), rodamin (kırmızı) ve DAPI (mavi) emisyonları ile donatılmış bir mikroskop ile Epifloresans mikroskopi gerçekleştirin.
- Mikroskopisi
- Bir MICROS ile konfokal mikroskopi gerçekleştirin63 (yağ daldırma, NA 1.4) hedefleri ve lazer 488- ve 568 nm dalga boylarında uyarım × × 20 kullanılarak, ZEN yazılımı ile donatılmış başa çıkabilmek.
5. Görüntü Tedavisi
Not: Tüm görüntü sonrası tedaviler ImageJ özgür yazılım (http://imagej.nih.gov/ij/) kullanılarak yapılmaktadır.
- Görüntüyü üst üste (birleştirme)
- (Dosya / Aç) kombine olacak her kanalda edinilen görüntüleri açın. 8-bit gri tonlamalı görüntüleri ile çalışan varsa, arama tablosunu (Resim / Arama Tabloları) kullanarak her kanala yapay renk bağlıyor.
- Her kanala bir renk atfetmek ardından (Görüntü / Renkli / Kanallar Birleştirme) "Kanal Birleştirme" komutunu kullanarak ve gri tonlama veya renkli görüntülerden kompozit resmi oluşturun.
- (Dosya / Aç) kombine olacak her kanalda edinilen yığınları açılması ve & kanallarını Birleştirme "komutunu kullanarak görüntü aynı şekilde superimposition yığınlarının gerçekleştirin# 8221; Her kanala bir renk atfetmek (Görüntü / Renkli / Kanalları Birleştirme). Bir görüntü dizisi gibi kompozit yığını Kaydet veya bir film olarak (bölüm 5.4).
- Görüntü yığını Z projeksiyon
- Görüntü düzlemi (z ekseni) dik eksen boyunca onları yansıtarak bir görüntü yığınının tüm resimlerin iki boyutlu bir görünüm sağlamak için Z projeksiyon işlevini (Resim / Stack / Zproject Max Yoğunluğu) kullanın. "Maksimum Yoğunluk" seçeneği her piksel yığınının tüm görüntüleri üzerinde maksimum değeri içeren bir görüntü oluşturur. Bu, belirli bir kanala veya birkaç kanal üst üste sonra tüm görüntü yığınını gözlenen tüm lekelenme görselleştirme sağlayan tek bir görüntü oluşturur.
- Görüntü yığını 3D projeksiyon
- Bir düzlem üzerine dönen hacim projeksiyonları bir dizi oluşturmak için 3D projeksiyon komutunu (Resim / Stack / 3D projesi, parlak Noktası, y-ekseni) kullanın. Su görsel renderediniz varsa ve iç yapıları hem projeksiyon yöntemi (en yakın nokta, burada kullanılan parlak nokta () veya ortalama değeri) bağlıdır ve görselleştirme parametreleri seçildi. Animasyonlu dizinin Her kare, farklı bir görüş açısı çıkıntı sonucudur.
- Üç ortogonal eksen (y-ekseni burada seçildi) her etrafında oluşturulan 3D görüntüyü döndürmek. Tek bir resim veya bir film olarak üretilen dizisi kaydedin.
- Film dönüşüm Görüntü yığını
- Görüntü yığını (Dosya / Aç) açın ve şu komutu "AVI" (Dosya / Kaydet / AVI) kullanarak AVI formatında bir film olarak kaydedebilirsiniz.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Meme bezi toraks ve kemirgenler karın hem ventral yapısı boyunca yer alan deri altı bezdir. Gebelik sırasında fare bezleri beş çift konumu Şekil 4'te gösterilmiştir. Meme bezi morfolojisi önemli ölçüde tam bir emzirme (Şekil 1B) hazırlamak için gerekli olan fonksiyonel değişiklikler yansıtan gelişimi sırasında değişir. Saf ya da doğum yapmamış hayvanlarda, meme bezi görülmesi zor olabilir ince bir yağ stroma içinde gömülü bir dağınık dallı bir duktal epitelyum oluşur. Görmek ve (Şekil 4) kaldırmak daha kolay hale geniş meme bezlerinde ortaya çıkan gebeliğin başlangıcından, meme epitel çoğalmakta ve genişletir, Dan. Laktasyon sırasında, meme dokusu, daha kalın ve bağlı süt varlığı beyaz görünür. Sadece karın ve kasık meme bezleri Servikal ve torakal meme Glan nedeniyle toplananDS az kolaylıkla kasları ile yakın ilişki nedeniyle kaldırılır. Bazı deneyler için, yavrular MESCs 46,47 süt salgılanmasını sınırlamak amacıyla, kurban edilmelerinden önceki emziren bir kadın 4-6 saat ayrılabilir.
Meme miyoepitel ve epitel hücrelerinin tanımlanması
Alveoller Çevre Kontraktil miyoepitelial hücreler spesifik olarak, bu hücre tiplerinin her biri tarafından ifade edilen markerler karşı yönelik antikorların kullanımı yoluyla lümen MESCs ayırt edilebilir. Meme bezi, kullanılan akım belirteçler sitokeratinler (CKs) bulunmaktadır. CKs epitelyum dokularında bulunan iskelet ara filamentleri (ortalama çapı 10 nanometre) oluşturmak için de polimerize sitoplazmik proteinlerin büyük ailesidir. Ara filamanlan son derece kararlı olan ve hücre mimarisi için mekanik destek sağlamak ve hücre-hücre yapışması ve bazal hücreli-bağ katkı dokuları düzenlemekDoku etkileşimleri. Epitel hücreleri tarafından ifade edilen CKS alt kümeleri esas epitel türü, gelişim aşamasında ve farklılaşma durumuna bağlıdır. Ayrıca, bu, aynı zamanda epitel malign meslektaşları için de geçerlidir. Bu nedenle, bu belirteçler, fizyolojik koşullar altında, bir dokuda hücre popülasyonları için basit ve değerli araçlar ve cerrahi patoloji 48 tümör teşhisi ve karakterizasyonu için kullanılmıştır.
Normal meme bezi olarak, miyoepitelial ve lümen MESCs hücreleri CK14 ve CK8, kendi farklı ekspresyonu, sırasıyla (Şekil 5) göre ayırt edilebilir. Bu sitoplazmik belirteçler PFA fiksasyon ve AR sonra emziren farelerin meme bölümlerinde tespit edilir. Görüntüler geleneksel Epifloresans mikroskobu ile elde edildi. CK8 lümen MESCs (Şekil 5, CK8) sitoplazması içinde dağılmış olarak görünmektedir. Kırmızı zemin gözlemlemek unutmayınçekirdeklerin çeşitli katmanları (Şekil 5, -Ig1, çekirdekler) gösterir mavi DNA etiketleme önerdiği primer antikor negatif kontrol (Şekil 5, -Ig1) d, doku kesiti katlama çoğunlukla kaynaklanmaktadır. CK14 özellikle alveol (Şekil 5, CK14) tabanında bulunan, düz ve uzun miyoepitelial hücrelerde görülmektedir. Bu kasılma hücrelerde (49. Şekil 4) bulunan - (SMA a) myoepitelyal hücreleri belirlemek için başka bir yaygın yolu, alfa-düz kas aktin tespit etmektir.
Fare sütü ürünlerinin ortaya çıkarılması,
Doğum sonrasında tamamen farklılaşmış MESCs süt bol miktarda üretmeye başlar. Süt bileşenleri farklı yollar 40,50 salgılanır. Lipidler apikal pl tomurcuklanan tarafından MFG'lerin olarak yayınlandı oysa kazein miselleri, Golgi kökenli SVS ekzositoz tarafından salgılananMESCs arasında asma membran (Şekil 2, memeli epitel salgılama hücresi). Bazı deneyler için, yavrular süt salgılanması 46,47 yavaşlatmak amacıyla, meme bezlerinin toplama önce kadın 4-6 saat ayrılır. Bu koşullar altında, MESCs apikal plazma zarı ve lümen içeriği kolayca alveol sözleşmeli ve lümen kapalı beri emip sırasında durum böyle değil, gözlenebilir. Böyle tuzaklarına membran kaçakçılığı proteinleri okuyan Dahası, salgılanmasını yavaşlatarak da önemlidir. Nitekim, donör ve alıcı bölmeleri ve bunların hücre içi lokalizasyonu arasındaki çevrim zar cirosu yüksek olduğunda etiketleme genellikle dağınık olduğundan, yani., Emzirme sırasında belirlemek zordur tuzaklarına. Bu nedenle, yavrular kaldırarak süt salgılanmasını yavaşlatarak t ve v-tuzaklarına tercihen donör ikamet zaman tuzaklarına hücre içi lokalizasyonu incelemek için uygun koşulları sağlarve alıcı bölmesi sırasıyla (aşağıya bakınız).
Şekil 6, yavruların varlığı laktasyon 10. günde emzikli fare meme bezi kazein lokalizasyonunu, (Şekil 6, + p) veya yokluğunda (Şekil 6, p) görülmektedir. Doku kesitleri, geleneksel Epifloresans mikroskobu (sağda üç sütun) ve konfokal mikroskobu (Şekil 6, sol kolon) ile her iki gözlendi. Emzirme sırasında kazein çoğunlukla apikal bölgede (Şekil 6, + p, ok başları) birikmiş gibi görünür. Konfokal mikroskopi, kazeinler yavruların varlığı MESCs bazal tarafında, her ne kadar daha az ölçüde de (Şekil 6, + p, oklar) mevcut net bir şekilde, geleneksel mikroskobu (Şekil 6, kazeinler gözlenen edilemez olduğunu göstermektedir Karşılaştırmak) sağ ve sol panelleri. Nitekim, geniş alan Epifloresans olarak, floresan örnek (arka plan flüoresan tarafından yayılance) heyecanlı hacim geçer ve (out-of-odak floresan) objektif odak düzlemi gözlenen nesnelerin çözünürlüğünü değiştirir. Bu kalın kesitlerle (daha kalın 2 mikron) için özellikle doğrudur. Alan derinliği kontrol edilebilir ve arka plan floresan odak düzlemi dışında da mikroskopisi, Epifloresans için hazırlanan örneklerden yüksek kaliteli görüntüleri elde etmesini sağlar. Bundan başka, yavrular (Şekil 6, + p) varlığında, alveol lümeni çok kapalı ve MESCs apikal tarafı arasında olduğunda lümen yavru (Şekil 6, p) yokluğunda daha iyi görülmektedir alveol nedeniyle süt ürünlerinin birikimi dilate olduğunu. Süt salgılanması yavaşladığı zaman, kazeinler apikal plazma zarı (Şekil 6, p, ok başları) altında biriken görünür ve açıkça MESCs (Şekil 6, -p, oklar) bazal tarafında görülmektedir. Birincil antib olmayan negatif kontrollerody herhangi etiketleme (Şekil 6, -Ig1) yoktu.
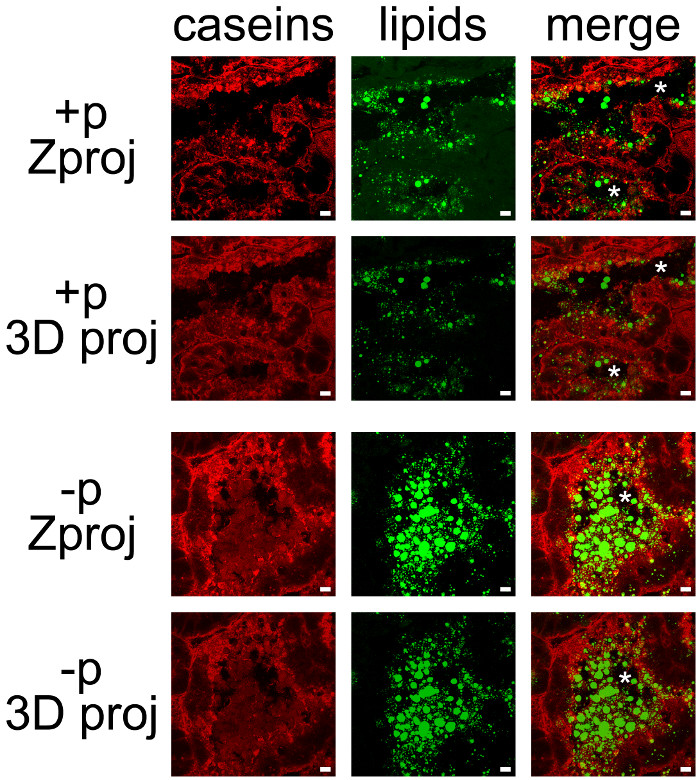
Süt ürünleri kolayca kazein ve CLD ve MFG'lerin (Şekil 7) nötral lipid counterstaining için IHC birleştirerek algılanan eş olabilir. Doku kesitleri her Z projeksiyonlar veya 3D projeksiyonlar üretmek için ImageJ post-muamele edildi konfokal mikroskobu ile Z-yığınlarının, (Şekil 7, kazein, lipidler) ya da bütün renk kanallarına (Şekil 7, birleştirme) olarak görüntülendi. Üretilen görüntü dizileri tek görüntüleri (Şekil 7 ve 8) veya film (Ek Filmler bakınız) olarak kaydedildi.
Bazı markalama bazal tarafında tespit edilmesine rağmen, daha önce dişi yavru (Şekil 6, + p) ayrılmadığı zaman zaten tarif edildiği gibi, kazeinler, çoğunlukla, MESCs apikal tarafında (Şekil 7, + p) üzerine biriktirilmiştir. CLDS da ağırlıklı olarak büyük sır ise, MESCs apikal bölgede lokalize olaned MFG'ler alveol lümen yer almaktadır. (Şekil 7 + p ve p karşılaştırın) kazeinler ve MFG'ler kolayca yavruların yokluğunda alveol lümeninde görselleştirildiği unutmayın. Kazeinler iki renk kanalları superimposition (Şekil 7 resim birleştirme) sarı etiketleme üretmek değil çünkü bu koşullarda herhangi CLD veya MFG'lerin ile lokalize co yok. Ancak, görüntü yığını sonrası tedaviler kazein bu proteinler (resim birleştirme, Şekil 7) MFG ile etkileşime girebilir düşündüren, alveol lümeninde salgılanan MFG'ler çevreleyen olduğunu göstermektedir. (Her renk kanalı için Zproj ve 3D proj karşılaştırmak, Şekil 7) kullanılan her tedavi sonrası üretilmiş görüntülerin farka dikkat edin.
Butirofilin tespiti, MFG'lerin bir protein işaretleyicisi.
BTN1 süt 51 MFG'lerin ilişkili önemli proteinlerden biridir. Bu transmembran protein, mainl olduğuy MESCs apikal plazma membranında lokalize ve dolayısıyla 52 tomurcuklanan tarafından yayımlanmasından sonra MFG yüzeyinde bulunur. a, laktasyonun 10. günde, BTN1 ağırlıklı apikal plazma membranında lokalize olduğunu gösterir Şekil 8 ve daha az bir ölçüde, MESCs apikal bölgede. BTN1 da alveol lümeninde de apikal CLD gibi bazı (Şekil 8, 3D proj birleştirme, ok başları) bulunan MFG'ler çevreler. (Şekil 8, 3D proj) yukarıda tarif edildiği gibi Sonuçlar, elde edilen görüntü Z-yığını (Şekil 8, görüntü) ya da ImageJ 3 boyutlu projeksiyon komutu ile üretilen bir 3 boyutlu bir görünüm olarak ekstre tek bir görüntü olarak gösterilmektedir. Tek bir görüntü proteinin apikal dağılımı, ancak salgılanan MFG'lerin veya apikal CLDS sadece Z-yığının 3D rekonstrüksiyon sonrasında görülmektedir ile BTN1 mekansal ilişki gözlemlemek için yeterli olabileceğini unutmayın (Şekil 8 BTN1 görüntü karşılaştırmak ve 3D proj birleştirme pictures). Z-yığını da protein dağılımının daha iyi bir mekansal bir görünüm vermek için bir film olarak yeniden inşa edilebilir. Yalnız BTN1 için elde edilen görüntü Z-yığını (Ek film 1 ve 3) veya iki renk kanallı üst üste (birleştirme, Yardımcı film 2 ve 4) örnek olarak gösterilmiştir. Z-yığını tüm görüntü yığını 3D projeksiyon (Ek filmleri 1 ve 2) ya da dönen bir görünüm olarak (y-ekseni) üstten alta görüntü-by-image okunabilir (Ek filmler 3 ve 4 ).
İki SNARE proteinlerinin tespiti: Stx6 ve VAMP4
Daha önce belirtildiği gibi, tuzak zara bağlı proteinler olduğu, verici ve alıcı membranların arasında çevrim. Bu eğitim sırasında meme bezi toplama önce yavrular gelen kadın ayırarak MESCs yüksek salgı aktivitesi ile ilişkili membran ciro yavaşlatmak nedenle daha iyidirBu proteinler. Stx6 ve VAMP4 hem trans-Golgi ağı 53,54 ile ilişkili olarak tarif edilmiştir. Bununla birlikte, bu proteinler, SNARE salgılama granüller (Stx6) 55,56 ve Golgi aygıtının (VAMP4) 57 gibi diğer hücresel bölümlerin düzeyinde önemli bir rol oynayabilir. Daha önceki çalışmalar, SNARE proteinler kasein salgılanması 35,36 bir rol oynadığını düşündürmektedir. Laktasyon sırasında Stx6 ve VAMP4 MESCs alt apikal bölgenin yer almaktadır. Stx6 Golgi ve trans Golgi ağı-(Şekil 9, Stx6) tekabül eden, nükleus ve MECS apikal membran arasında gözlendi ve daha az bir ölçüde, ancak kazein içeren adet SV 36, bu aynı zamanda mevcut bulunmaktadır. VAMP4 da MESCs alt apikal bölgede lokalize olur, ancak etiketleme daha noktasal olarak görünür ve apikal plazma zarı altında biriken (Şekil 9, VAMP4) nedeniyle CLD ve kazein-conta hem de derneğeining adet SV 36. Primer antikor olmadan negatif kontrol herhangi bir etiketleme yol vermediler.

Şekil 1. Fare embriyonik ve yetişkin yaşamı boyunca meme bezi gelişimi. (A) fare meme bezlerinin (pembe) ektodermal (açık mavi) süt hatlarından embriyonik gün 10 (E10) etrafında gelişmeye başlar. E11.5 anda, placodes meme süt hattı boyunca simetrik formu ve çevresindeki mezenşimin (koyu mavi) yoğunlaşmasına başlar. Placodes E15.5 üzerinde tomurcukları (E12.5-E14.5) ve oluşturmak için invagine, meme epitel (pembe), çoğalmaya ve (yağ yastığı doğru meme mezenşimin aracılığıyla iter birincil filiz oluşturmak üzere açık yeşil uzatmak ). Bir çukur lümen formları ve meme ucu (mor) yol açar. E18.5 üzerinde, meme epitelyum, rudimenta oluştururdış bağlı ry dallanmış yapı. Macmillan Publishers Ltd. izni ile 6 uyarlanmıştır: Doğa ergenlik sırasında Genetik, telif hakkı 2007. (B) Yorumu, meme epitel (mor) önemli bir büyüme fazı (geniş uzama, çatallanma ve lateral dallanma) girer. Gebelik, yaygın ve hızlı çoğalma başlangıcı hem de yan dallanma 'de tamamen bütün meme yağ pedi işgal meme epitel, önemli genişlemesine neden olmaktadır. Lümen MESCs süt büyük miktarda salgılar zaman meme epitel laktasyon döneminde son derece farklılaşmış fonksiyonel durumunu ulaşır. Laktasyon, meme bezi basıtlar sütten sonra kesildiğinde. MESCs yağ dokusu ile değiştirilir lóbulo-alveol yapılarının yok olmasına yol, apoptoz ve fagositoz ile uzaklaştırılır. Http://brisken-lab.epfl.ch/research düzeni 1 ve bölüm 2.2 uyarlanmıştır. http://tvmouse.ucdavis.edu/bcancercd/22/index.html. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
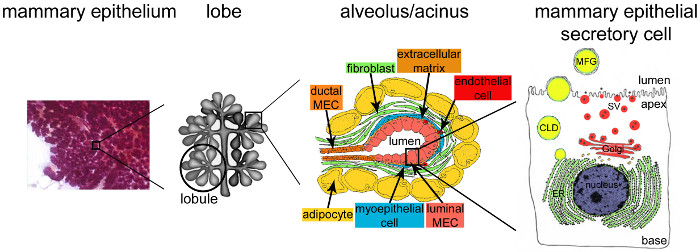
Emzirme sırasında meme bezi Şekil 2. Mimarlık. Laktasyon sırasında, tam gelişmiş ve çok dallı epitel (mor) meme dokusunun büyük çoğunluğu oluşturmaktadır. Epitel doku çeşitli hücre tipleri (fibroblastlar, adipositler, düz kas hücreleri, kan ve lenf damarları ve sinir uçlarının) ihtiva eden bir stroma gömülü tubulo-alveoler yapılar tarafından oluşturulmaktadır. MESCs lobu oluşturan lobules monte asiner yapılar veya alveollere, halinde düzenlenmiştir. Her alveol nedenle, süt d sağlayan lobüler ve interlo- kanalların yüksek ölçüde dallanmış bir ağa bağlı olan fonksiyonel bir süt üreten bir birimdirdışarıya yağmur. Her alveol polarize MESCs bir tek tabaka ile sınırlandırılmış olup, apikal tarafında merkezi lümen komşudur. MESCs bazal tarafı bir hücre dışı matriks ve kontraktil myoepitelyal hücreler ile yakın temas halindedir. Süt ürünleri MESCs apikal tarafında serbest bırakılır. Lipidler MESCs apikal plazma membranının tomurcuklanmasıyla süt yağı globülleri (MFG'ler) halinde serbest kaldığında Üretilen süt (kazein), Golgi-türevi salgı kabarcıklarına (SVS) ekzositozu göre kazein miselleri (siyah nokta) olarak salgılanırlar. CLD: sitoplazmik lipid damlacığı; ER: endoplazmik retikulum; MEC: meme epitel hücresi. Bölüm 2.2 uyarlanmıştır. http://tvmouse.ucdavis.edu/bcancercd/22/index.html., Şek. 02 www.cellbiol.net/ste/alpHERCEPTIN1.php, Şek. 58 yılında 26-02 ve 50. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
.within-page = "always"> 

Şekil 3. Deney prosedürü fare meme bezinin donmuş bölümlerinde dolaylı immünofloresan gerçekleştirmek için. Meme bezi laktasyonun 10. günde bir CD1 kadın fare toplanır. Meme dokusu OCT bileşiği içine gömülü ve hızlı bir şekilde dondurulup önce paraformaldehid ile sabitlenmiş ve sukroz infüzyon küçük parçalara kesilir. Meme bezi numuneler daha sonra, sırasıyla, ilk ve florokrom-konjuge sekonder antikor ile art arda inkübe edilerek, ince donmuş bölümler halinde kesilmiş ve IIF için işlenir. Montajdan sonra, numuneler, daha sonra art işlemden geçirilmiş olabilir görüntü kazanımını sağlayan bir floresan mikroskobu ile analiz edilmiştir./53179/53179fig3large.jpg "Target =" _ blank "> bu rakamın büyük halini görmek için lütfen buraya tıklayınız.

. Şekil fare meme bezlerinin 4. Anatomik konumu Sol: Geç gebelik aşamasında fare meme sisteminin ventral görünümü. Sağ: yerelleştirme ve fare geç gebelik aşamasında meme bezinin yönü. Emzirme sırasında meme bezleri kalın nedeniyle alveol süt varlığı beyaz göründüğüne dikkat edin. Http://ctrgenpath.net/static/atlas/mousehistology/Windows/femaleu/mousemammgldiagram.html ve http://www.pathbase.net/Necropsy_of_the_Mouse/index.php?file=Chapter_3.html uyarlanmıştır. Için tıklayınız Bu rakamın büyük bir sürümünü görüntüleyin.
-together.within-page = "always"> 
Fare meme bezinde luminal epitel hücreleri ve bazal myoepitelyal hücrelerin Şekil 5. Kimlik. Lüminal MESCs ve myoepitelyal hücreler CK-8 ve CK-14 kendi ifadesine dayalı, laktasyonun 10. günde fare meme bezi IIF tarafından tanımlanır , sırasıyla. Nükleer çekirdekteki DNA, DAPI (mavi) ile boyanmıştır. Görüntüler geleneksel Epifloresans mikroskobu ile elde edildi. Kompozit resim (birleştirme) sırasıyla kazeinlerin (kırmızı) ve çekirdekler (mavi) karşılık gelen etiketleme superimposition gösterir. -Ig1, Birincil antikor negatif kontrol. Yıldız lümen göstermektedir. Ölçek çubuğu = 100 mikron. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
e 6 "src =" / files / ftp_upload / 53179 / 53179fig6.jpg "/>
Şekil fare meme bezinde kazeinlerin 6. Hücresel lokalizasyonu. Kazeinler laktasyon 10. günde, fare meme bezi IIF tarafından tespit edilir. Meme bezi varlığı (+ p) 'de ya da yavruların yokluğunda (-p), kadınlarda toplanmıştır. Görüntüler geleneksel edinilen (sağ panel, kazein, çekirdeklerin ve birleştirme) ya da olduğu bir confocal (kazein (kırmızı), sol panel) floresan mikroskop. Her iki durumda da, kazein (kırmızı) apikal bölgede (ok başları) ve MESCs (oklar) bazal daha az ya da tespit edilmiştir. Primer antikor olmadan Negatif kontroller hiçbir etiketleme (-Ig1) görünmüyor. Nükleer DNA DAPI (mavi) ile boyandı. Kompozit resim (birleştirme) sırasıyla kazeinlerin (kırmızı) ve çekirdekler (mavi) karşılık gelen etiketleme superimposition gösterir. Yıldız lümen göstermektedir. Ölçek çubuğu Epifloresans görüntüler için = 100 mikron (sağ panel, kazein, çekirdek, birleştirme) ve = 10 &# 181;. Konfokal görüntüleri (sol sütun) m bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Fare meme bezinde süt ürünlerinin Şekil 7. Hücresel yerelleştirme. Kazeinler (kırmızı) varlığında laktasyonun 10. günde fare meme bezi IIF tarafından tespit edilir (+ p) ya da yavruların yokluğunda (-p) içinde. Nötr lipidler (CLDS ve MFG'ler) BODIPY 493/503 (yeşil) ile zıt olan. Kompozit resimler (birleştirme) iki labelings bir superimposition göstermektedir. Görüntüler konfokal mikroskop ile Z-yığınlarının olarak elde edildi. Z-yığınlar her ikisi için de her bir kanal (birleştirme) Z çıkıntılar (Zproj) veya yığınların 3D projeksiyonlar (y-ekseni) (3D Proj) oluşturmak üzere ImageJ post-muamele edilmiştir. Yıldız lümen göstermektedir. Ölçek çubuğu= 10 mikron. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.

Fare meme bezi butirofilin ve lipid Şekil 8. Hücresel lokalizasyon. BTN1 (kırmızı) yavruların yokluğunda laktasyon 10. günde, fare meme bezi IIF tarafından tespit edilir. Nötr lipidler (CLDS ve MFG'ler) ve nükleer DNA sırasıyla BODIPY 493/503 (yeşil) ve DAPI (mavi) ile zıt olan. Görüntüler görüntü Z-yığınlarının olarak konfokal mikroskop ile elde edildi. Sonuçlar görüntü yığını çıkarılan tek bir görüntü olarak gösterilir (resim, BTN1, lipidler, çekirdeklerin ve birleştirme) tüm görüntü yığını bir 3D görünümü (y-ekseni) üretmek için veya ImageJ post-tedaviden sonra olan (3D proj, BTN1 , lipidler, çekirdek,) birleştirme. Kompozit resimler (birleştirme) göstermekÜç renk kanallarının superimposition. -Ig1, Birincil antikor negatif kontrol. Yıldız lümen göstermektedir. Ölçek çubuğu = 10 mikron. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.

Şekil fare meme bezi. Sintaksin 6 (Stx6) ve VAMP4 (V4) 'de, iki, SNARE proteinlerinin 9. hücresel lokalizasyonu laktasyon 10. günde, fare meme bezi IIF tarafından tespit edilir. Görüntüler geleneksel (conv) Epifloresans veya konfokal (EKK) mikroskop ile elde edildi. Kompozit resimler (birleştirme) her SNARE protein (kırmızı) ve sırasıyla DAPI ile zıt nükleer DNA (yanlış yeşil renk), gözlemlenen etiketleme superimposition göstermektedir. -Ig1, Birincil antikor negatif kontrol. Yıldız işaretis lümen gösterir. Ölçek çubuğu konfokal resimler için = 10 mm ve Epifloresans resimler için = 100 mikron. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.


Tablo 1. İmmünohistokimya sorun giderme kılavuzu.

Yardımcı film, fare meme bezi butirofilin 1. lokalizasyonu. BTN1 (kırmızı) laktasyon 10. günde, fare meme bezi IIF tarafından tespit edilir. Görüntüler bir işbirliği ile elde edildi Z-yığını gibi nOdak mikroskobu bir film oluşturmak için ImageJ ile yazılan-işlemden geçirildi. Z-yığını yukarıdan aşağıya okunur. Bu videoyu görmek için lütfen buraya tıklayınız.

Yardımcı film, fare meme bezi butirofilin ve nötr lipidlerin 2. lokalizasyonu. BTN1 (kırmızı) laktasyon 10. günde, fare meme bezi IIF tarafından tespit edilir. Nötr lipidler (CLDS ve MFG'ler) ve nükleer DNA sırasıyla BODIPY 493/503 (yeşil) ve DAPI (mavi) ile zıt olan. Görüntüler her renk kanalı için bir Z-yığını olarak konfokal mikroskop ile edinilen ve üç renk kanalları üst üste bindirir kompozit Z-yığını oluşturmak için ImageJ post-tedavi edildi. Elde edilen bileşik Z-yığın üstten alta doğru okunur.https://www.jove.com/files/ftp_upload/53179/supvid2.mp4 "target =" _ blank "> Bu videoyu görmek için lütfen buraya tıklayınız.
Yardımcı film, fare meme bezi butirofilin 3. lokalizasyonu. BTN1 (kırmızı) laktasyon 10. günde, fare meme bezi IIF tarafından tespit edilir. Görüntüler Z-yığını ve sonrası tedavi edilen ImageJ (3D projeksiyon) ile BTN1 etiketleme mekansal görünümü dönen (y-ekseni) üretmek için bir konfokal mikroskop ile elde edildi. Bu videoyu görmek için lütfen buraya tıklayınız.

Fare ma butirofilin ve nötr lipidlerin Ek film 4. Yerelleştirmemmary bezi. BTN1 (kırmızı) laktasyon 10. günde, fare meme bezi IIF tarafından tespit edilir. Nötr lipidler (CLDS ve MFG'ler) ve nükleer DNA sırasıyla BODIPY 493/503 (yeşil) ve DAPI (mavi) ile zıt olan. Görüntüler her renk kanalı için bir Z-yığını olarak konfokal mikroskop ile edinilen ve üç renk kanalları üst üste bindirir kompozit Z-yığını oluşturmak için ImageJ post-tedavi edildi. ImageJ (3D projeksiyon) ayrıca kompozit Z-yığının mekansal görünümü dönen (y-ekseni) oluşturmak için kullanıldı. Bu videoyu görmek için lütfen buraya tıklayınız.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
IHC esas olarak belirli bir epitop antikor etkileşimlerine bağlıdır doku bölgeleri, antijeni lokalize için nispeten basit ve kolay bir deney yöntemidir. Protokolleri sayıda IIF bir proteinin lokalize etmek için kullanılsa da, bu işlemler çekirdek hemen hemen her zaman aynıdır. Ancak, güçlü bir sonucu etkileyebilir ve bu nedenle her İHK çalışma için optimize edilmesi gereken bazı kritik yönleri vardır. Bu yaklaşımın en zor yanı, yani en iyi deneysel koşullarını belirlemektir., Ilgilenilen antijen için güçlü ve spesifik sinyali üreten olanlar. Deneysel tasarım ve optimizasyon için dikkate alınması gereken değişkenler: antijen (1) tipi (türler, ekspresyon düzeyleri, hücre içi konumu); (2) epitop tipi (sekansı, konformasyon, farazi post-translasyonel modifikasyonlar); (3) örnek hazırlama (parafin ya da donmuş bölümleri için gömme); (4) sabitleme mete (perfüzyon veya daldırma); (5) (formaldehit, alkol ya da aseton) kullanılan fıksaj maddesi; (6) kullanılan blokaj reajanı (normal serum, BSA veya yağsız süt); (7) AR adımı; (8) algılama yöntemi (doğrudan veya dolaylı); (8) (monoklonal ya da poliklonal) birincil antikor tipi; (9) sekonder antikor (türler ve etiket); (10) counterstains (çekirdek ve / veya diğer hücresel bölmesi etiketleme); ve (11), montaj ortamı (ayrıntılar için Tablo 1 'e bakınız). Fiksasyon ve bloke adım, en azından böyle bir konsantrasyonu, pH, sıcaklık, inkübasyon süresi ve seyreltici gibi diğer faktörleri optimizasyon gerektirir.
İlk önemli yönü yakından da sonuçlarının kalitesini etkiler tespit yöntemi ile bağlantılı olan doku örnekleri, hazırlanmasına ilişkindir. Örneğin, doku parçaları sabit olabilir ya da gömme önce değildir. Bu adım, parafine genel, yani seçilen gömme yöntemi, OCT bileşiği bağlı olabilir, Ki kendisi de bazen kullanılmaktadır birincil antikor bağlıdır. Doku sabitleme fıksatif çözeltisi ile, anestezi verilen hayvanın perfüze in vivo gerçekleştirilebilir. Bu yöntem, sağlam dokuları inceleyerek zaman antijenleri korumak için yararlıdır, ancak ilgi doku düzeltmek için yeterli olmayabilir. Bu durumda, küçük bir doku parçaları (kalın olmayan ve kalınlığa göre daha mm 10) sabitleştirici çözeltisine batırılmış edilebilir. Dondurulmuş doku, sıvı azot veya izopentan içinde doku daldırılmasıyla hazırlanabilir ve ek dondurma olabilir yüksek fosforilasyon gibi translasyon sonrası modifikasyonların saptanmasında için tavsiye edilir. Bununla birlikte, parafine gömülmüş doku farklı olarak, dondurma nedeniyle hücre içi morfolojisini değiştirebilir hücre içinde buz kristalleri oluşumu dokuların uzun süreli korunması için yeterli değildir. Bir kez kesildiğinde, dondurulmuş doku kesitleri 1 yıla kadar -80 ° C'de muhafaza edilebilir. Herhangi bir durumda, doku örneklerinin hazırlanması doku muhafaza arasında bir uzlaşmadır/ hücresel mimarisi ve epitop bütünlüğünü koruyarak.
Bu dokuların kimyasal bileşimini değiştirir bu yana, (fiksasyon altında) eksik ve aşırı (overfixation) fiksasyon sakınmayı sabitleme koşulları optimize etmek için kritiktir.
Gerçekten de, bazı antijenler underfixation proteolitik degradasyonu teşvik belirli bir sinyal azaltabilir. Öte yandan, overfixation epitopu maskeleme veya güçlü bir non-spesifik bir arka plan üreten belirli etiketleme değiştirebilir. Böylece, sabitleyici çözeltisi seçimine ek olarak, böyle bir inkübasyon süresi gibi diğer parametreler, sıcaklık ve pH doku fiksasyon etkileyecektir. PFA IHC için en yaygın olarak kullanılan sabitleyici olsa da, bu "evrensel" sabitleyici olarak kabul edilemez. PFA protein-protein, protein-nükleik asit, çapraz bağlantıları indükler ve bu nedenle de artefakt Recó önlenmesi daha sonra epitopu (overfixation) değiştirmek ve edebilirBirincil antikor tarafından gnition. Bununla birlikte, epitop daha AR teknikleri (aşağıya bakınız) ile ortaya çıkarılabilir olabilir. Sitoplazmaya membran bazı fosforile edilmiş proteinler translokasyon indüklediği gösterilmiştir gibi PFA aynı zamanda, belirli bir antijen tespiti için uygun olabilir. Bu gibi durumlarda, PFA, alkol gibi uygun alternatif fiksatif ile değiştirilmelidir. Dokularda su molekülleri değiştirerek doku fiksasyon izin verirse, PFA farklı olarak, örneğin, metanol ya da etanol gibi alkoller epitopları maskesi yok. Bu proteinlerin çökelmesine yol ve daha sonra bağlı konformasyonel değişikliklere antikor / epitop etkileşimi engelleyebilir. Bu yaygın alkoller nüfuz etmez ve bu nedenle PFA gibi doku morfolojisi korumaz düşünülmektedir. Aseton sabitlenmemiş, hızlı bir şekilde dondurulup doku kesitleriyle çalışırken yaygın olarak kullanılan diğer bir alternatif sabitleyici vardır. Bununla birlikte, aseton kuvvetli bir dehidratasyon maddesi ve doku proteinlerine geri döndürülemez çökelmesine neden olabilir.
Bazı antijenler için AR ek bir adım sabitleyici yapı değişikliklerini oluşturmaktadır ya da (epitop maskeleme) epitopunun elektrostatik yük değiştirir özellikle eğer iyi bir sinyal elde etmek için gerekli olabilir. AR yöntemler epitop immunoreaktivitesini ve primer antikor ile onun sonraki etkileşimi geri bu süreçlerin tersine hedefliyoruz. AR yöntemleri temel olarak iki yaklaşım dayanır: bu epitop peptidleri maskesi bölen proteinaz K, tripsin ya da pepsin gibi enzimleri ile (1) proteaz kaynaklı epitop, yani; ve (2) ısı kaynaklı epitop alma, yani bir mikrodalga fırın, düdüklü tencereler, sebze vapurları, otoklav veya su banyoları ile. Bu ikinci yaklaşım, özellikle, zaman ısıya, tampon-ve pH duyarlı olduğunu ve optimal koşullar ampirik (bir örnek Protokolü bölümünde sağlanan) tespit edilmelidir. Alternatif olarak, antijen için bir antikorun afinitesinin arttırılabilirpH veya antikor seyreltici katyon konsantrasyonunun değiştirilmesi gereklidir.
Permeabilizasyon aşaması bazen, özellikle çekirdek antijeni boyama, kalın bir doku bölümlerinde bir hücre içi epitopuna iyi bir sinyal elde etmek için gereklidir. Bu kullanılarak çeşitli yollardan elde edilebilir: (1) fiksatif gibi alkoller veya aseton; ya da (2) bu tür Triton, NP-40 (PBS içinde% 0.1-0.2, 10 dakika), digitonin, saponin ya da Tween 20 gibi deterjanlar PFA tespit sonrasında (10 dakika 30 için 0.2-0.5%). Bununla birlikte, deterjan seçimi tespit epitopuna hücresel konumuna bağlıdır. Gerçekten de, hücre zarının çözündürme gibi Triton-X100 gibi sert deterjanlar, nükleer epitop algılama için uygundur, ancak bazı zar proteinlerinin ekstraksiyonu sonucunda değişikliğe sinyal yol açabilir. Hafif deterjan (saponin ve Tween 20) kullanılması, sitoplazmik epitoplarının saptanması için daha uygundur.
İkinci kritik bir adım olduğunu Blockinspesifik olmayan lekelemeye g. Hedef epitopa bir antikorun bağlanma moleküller arası kuvvetler (örneğin, hidrofobik ve iyonik etkileşimler, hidrojen bağı) ile yönetilmektedir. Bu nedenle, hedef antijenlere göre başka proteinlere olan primer ve / veya sekonder antikor etkileşimi spesifik olmayan lekelemeye neden olabilir. Bu ilgi protein görselleştirme (düşük sinyal / gürültü oranı) önler, yüksek floresan arka plan oluşturur. Reaktifler engelleme spesifik antikor / epitop etkileşimi bozmadan spesifik olmayan etkileşimleri azaltır. Genel bir prosedür, ısı ile inaktive edilmiş normal serum veya BSA ile doku bölümleri inkübe oluşur. Normal bir serum kullanılarak, bu ikincil antikor konak hayvanın bu veya alakasız bir türden aynı türden olması gerekir. Her durumda, seçilen bloke edici ayıracı, birincil ve ikincil antikorlar için seyrelticiler ilave edilmelidir. Bundan başka, örneğin Triton X-100, T gibi iyonik olmayan deterjanların kullanılmasıween 20 veya saponindir spesifik olmayan etkileşimleri azaltmaya yardımcı olur.
Üçüncü ve belki de en önemli parametre birincil antikor seçimi ve optimizasyonu olduğunu. Tabii ki, en iyi seçim az çapraz reaktiviteli yüksek kaliteli bir antikordur. Monoklonal antikorlar, genellikle tek bir epitopu için yüksek bir çekim ve özelliğe sergileyen gibi, yüksek dizi benzerliği olan bir protein ailesi belirli bir elemanı ayırmak için en iyi araçlardır. Hedef epitop doğal oluşum durumunu kaybettiği takdirde, veya epitopa erişim diğer proteinler, post-translasyonel modifikasyonlar, sıcaklık, pH, tuz konsantrasyonu tespit ve etkileşim ile engellenir, ancak antikor / epitop etkileşimi elde edilebilir. Bu gibi durumlarda, poliklonal antikorlar, aynı proteinin birden fazla epitopları tanıyan daha fazla uygundur. Ayrıca, bunlar genellikle pH ve tuz konsantrasyonunun bir geniş bir aralıkta tek klonlu antikorlara göre daha stabildir.Için ampirik olarak tespit olması, kuluçkalama süresi, seyreltici ve sıcaklık, ön çalışmalar uygun inkübasyon koşulları, örneğin, çalışma seyreltisi (1,7-15 mg / ml: 5-25 mg / ml, poliklonal antikor, monoklonal antikor) tanımlanmalıdır Her primer antikor. Bu parametreler, düşük arka plan gürültüsü ile uygun bir sinyal üretmek koşulları belirlemek için optimize edilmiş olması gerekir. Etiketleme özgüllüğü (yani., Oda sıcaklığında genel, 4 ° C) daha düşük sıcaklıklarda daha uzun kuluçka sürelerinde tarafından tercih edilmektedir.
Doğrudan ya da dolaylı bulgulamanın yerine getirilmesi için seçimi genellikle antijen ekspresyonunun seviyesine bağlıdır. Örneğin, yüksek ölçüde sentezlenmiş bir epitop basit bağlı ikincil bir antikorun kullanılması ile mümkün olan spesifik olmayan arka plan kaçınarak ve böylece hızlı ve basit bir renkli boyama sağlayan bir florokrom-eşlenik primer antikor ile tespit edilebilir. Ancak, s may daha yüksek bir maliyetle düşük sinyal üretir IF doğrudan ve canometimes zor olabilir, işaretlenmiş antikor ticari olarak mevcut değildir. Üretilen sinyal, birincil antikor (büyütme) ile bağlı (birincil antikor konak türlerinden karşı üretilmiş) en az iki etiketli sekonder antikor etkileşimi daha yoğun olduğu Tersine, IIF düşük ifade epitopları belirlemek için daha duyarlıdır. Bundan başka, çeşitli floroforlar konjüge sekonder antikor geniş, nispeten ucuz, ticari olarak temin edilebilir, ve kalite kontrol edilir. Bununla birlikte, bu yaklaşım, çapraz reaktivite indükleyebilir ve böylece dikkatle birden etiketleme deneyler aynı türler ya da farklı izotiplerin üretilmeyen primer antikorlar tercih gerektirir. IIF bazen ilave bloke adımları gerektirir ve sistematik negatif kontrol (aşağı bakınız) içermelidir. Amplifikasyon daha mo başına bağlanan bir biyotin-konjuge sekonder antikor kullanılarak elde ve floresan avidin veya streptavidin (dört biotins etiketlenebilirlecule). Bununla birlikte, bu amplifikasyon yöntemi spesifik olmayan bağlanma önlemek için ek adımlar gerektirir ve endojen biyotin yüksek seviyelerinin mevcudiyetine bazı dokularda (karaciğer, böbrek, kalp, beyin, akciğer ve meme bezi laktasyondaki) boyama için adapte edilemez . Bununla birlikte, endojen biyotin, avidin numune ön kuluçka ve daha sonra primer antikor ile inkübe edilmeden önce, biotin ile bloke edilebilir. Daha kısa dalga boylu ışığı tarafından uyarıldığı zaman ışık yayarlar özelliği ile küçük kimyasal moleküller olan konjuge fluorochromes, seçimi, öncelikle mevcut mikroskop ekipman tipine bağlıdır.
Doğru kullanıldığında fluorochromes spektral özellikleri arasındaki antikorlar ve çapraz arasında her iki çapraz reaktivite sınırlamak için tasarlanmış zaman immünofloresan tabanlı İHK çoklu hücresel hedeflere eş zamanlı görüntüleme sağlar.
Son kritikİHK deneyleri ile ilgili nokta, lekelenme geçerliliğini desteklemek için deneysel eserler belirlemek için gerçekleştirilen ve sonuçların doğru yorumlanması için gereken pozitif ve negatif kontroller ile ilgilidir. Bazı doku sonuçlarının yanlış yorumlanmasına yol açabilir (otofloresansı olarak anılacaktır), yüksek floresan arka plan sergiler. Böylece, doku kesitleri IHC deney başlamadan önce her iki floresan ve parlak alan aydınlatma altında uyulması gerekmektedir. Birincil antikor atlar bir negatif kontrol sistemli ikincil antikor bağlanmasının potansiyel bir spesifik olmayan belirsiz olmayan önemsizdir ve yok olmasını sağlamak veya belirli boyama paternine daha çok benzemesine için her bir IHC deneyde dahil edilmesi gerekir. Aynı izotipin olmayan bir bağışıklık antikor ile değiştirerek bir monoklonal primer antikor ile çalışırken bir izotip kontrol gerçekleştirilebilir (örneğin, IgG1, IgG2a, IgG2b, IgM) aynı konsantrasyonda. Bu kontrol es olurnumune ile antikorların etkileşimi nedeniyle olabilir, spesifik olmayan boyama, kurabilme becerisini. 4 ° C 'de: (1 mol oranı 10) O / N (1), bunun çözünebilir immünojen ile: kendi antijene karşı bir antikorun spesifik bağlanmasını göstermek için, bir emme kontrol primer antikor ön kuluçka iki şekilde elde edilebilir ; ve (2) hücrelerin veya ilgi epitopunu ifade ancak çalışılan dokudan farklı doku kesitleriyle (örneğin, 59 Şekil 4B 'ye bakınız). Her iki durumda da, birincil antikor sonucu azalması çok az veya hiç lekelenmeye neden olmalıdır. Kontrol, başka tür, alakasız bir primer antikor kullanılarak yapılabilir, yani., Ilgi konusu epitopu farklı bir hücresel lokalizasyonunu (sitoplazmik genel nükleer) sergileyen bir epitopa karşı yönlendirilen. Ilgisiz bir antikor da primer antikor olarak aynı izotip ve türden olmalıdır. IHC deneyleri için ilave kontroller Tiss örnekler kullanımını içerebilirÇevrede epitopunu (transgenik hayvanlar) ifade ya da (knock-out hayvan) bilinen ues. Bu yararlı bir referans sağlamak ve İHK prosedürü optimize etmek için yardımcı olabilir.
IF teknikler ana sınırlama sadece, her iki prosedür, potansiyel olarak eserler indükleyici, sabit (ölü) tatbik edilir ve / veya hücrelerin geçirgen olmasıdır. Bu yaklaşımın diğer sınırlamalar numunelerin gözlem için mikroskop kullanımına bağlıdır. Epifloresans ve konfokal mikroskop optik çözünürlük sınırlı olduğu gibi İlk olarak, tespit protein konumu ya da eş-yere yorumlanır aşırı olmamalı. İkinci olarak, yani, ışıkla ağartma. ışığına maruz kaldığında zaman içinde floresan yoğunluğu solmasını da, fluorofor fotokimyasal yıkıma yol açan, floresans uyarıldığında numunede reaktif oksijen türlerinin üretimi üzerine inşa edilmiştir. Photobleaching azaltılabilir: a) korunmaktadır örnekleri tutmakOnların gözlem kadar IF deney ve depolama sırasında ışık; b) montaj orta bir antifade madde (reaktif oksijen türleri temizleyiciler) kullanılarak c) yoğunluğu ve / veya uyarma ışık süresini azaltarak; d) fluorophores konsantrasyonunun arttırılması veya yüksek kuantum verimi ile florokrom maddenin düşük bir konsantrasyonunu kullanmak; ve e) (örn. Alexa Fluors, Seta Fluors veya DyLightFluors) ışıkla ağartma karşı daha az eğilimlidirler sağlam fluorophores kullanılmıştır. Ve indirgenmiş piridin nükleotitlerin (NADH: emme, 340 nm, emisyon 460 nm), memeli hücrelerinde;: Üçüncü olarak, otofloresansı bağlı flavin koenzimler (emisyon 515 nm emilim, 450 nm FAD ve FMN) varlığında için sık sık. Ayrıca, numune düzeltmek için aldehidler, özellikle de glutaraldehid, kullanımı otofloresansı yüksek seviyeleriyle sonuçlanabilmektedir. Bu ve / veya probları ve m, optik filtreleri seçerek ve önceden antikor inkübasyon PBS içinde% 0.1 sodyum borohidrid ile örnekleri yıkanmasıyla en aza indirilebilirotofloresansı floresan sinyal göreli aximize. Dördüncü olarak, floresan örtüşme genellikle çok geniş bir bant genişliği, farklı asimetrik spektral profillerin yanı sıra çeşitli tepe emisyon dalga boyları ve sayısını gösterir ve bu durum nedeniyle florofor emisyon spektrum özelliklerinin esas olarak (aynı zamanda, boşaltma yoluyla, çapraz veya çapraz olarak adlandırılır) maksimum nokta bulunmamaktadır. Başka bir fluorofor birkaç flüoroforlar (renkli etiketleme) ile çalışan ve kanal (filtre) bir floroforun emisyonu ile karakterizedir zaman Floresan örtüşme meydana gelir. Genellikle, özellikle eş-lokalizasyonu veya kantitatif çalışmalardan durumunda sonuç IF yorumlanmasını da karmaşık olarak akmalarını eserler en aza indirilmelidir. Flüoroforlar emisyon dengeleme biraz IF prosedürü ile sadece gelişmiş olabilir gibi, kanama-through başta düzgün separ amacıyla optimize edilmiş floresan filtre setleri ve / veya photomultiplier dedektör kullanılarak görüntü elde zamanında azaltılabilirflorofor spektral profiller yedi. Belirli bir algılama kanalı her işaretin, tek tek fluorophores farklılaşma floresans emisyon sağlar Bu bağlamda, konfokal mikroskopi renkli görüntüleme çok uygundur. Ayrıca, konfokal mikroskopi etiketleme sıralı edinme (bir seferde sadece tek bir fluorofor) için ayrı ayrı tespit kanalları için kazanç, photomultiplier gerilimi veya lazer gücünü ayarlamak için izin verir. İdeal olarak, tek etiketli kontrolleri boşaltma-through ölçmek ve sonunda hesaplama kaldırmak için yapılmalıdır. Ikincil antikorlar olmadan bir kontrol (arka plan kontrol) sinyal kazancının limitlerini ayarlamak hazırlanan ve optimum görüntü elde etmek için her kanalın mahsup edilebilir. Ayrıca doğru görüntü arka planı (otofloresansı) post-satın alma işlemi için de kullanılabilir.
Sonuç olarak, açıklanan yöntem kolay realizati için basit bir standart protokol sağlarMeme bezi bölümlerinde immün on. Bununla birlikte, bir IHC deney ana aşamaları, spesifik boyama görselleştirmek ve non-spesifik bir arka plan sinyalleri en aza indirmek için her bir antijen / antikor, çift için optimize edilmelidir. Tarif edilen yöntem de elde görüntülerden en sonrası tedavi için birkaç temel yöntem içerir. Floresans tabanlı immunodeteksiyon tanıya bir antijenin hücresel lokalizasyon gelen geniş bir uygulama yelpazesi ile güçlü bir yöntemdir. Bu yaklaşımlar yeni gelişmeler görüntüye yeni fluorophores, satın alma cihazları ve mikroskopi teknikleri gelecekteki gelişimi ile biyolojik yapıların ve süreçlerin önceden farkedilmemiş ayrıntıları elde edilecektir.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Yazarlar hiçbir rakip mali çıkarlarını var olduğunu beyan ederiz.
Acknowledgments
Yazarlar, hayvan bakımı ve tesisler için (INRA, UMR1198, Jouy-en-Josas) ve IERP biriminin personel (UE 0907, INRA, Jouy-en-Josas) INRA MIMA2 görüntüleme çekirdek tesisine minnettarız. Biz de çok kullanışlı Antikorların bize sağlamak için IH Mather, MC Neville ve S. Tooze teşekkür etmek istiyorum.
Materials
| Name | Company | Catalog Number | Comments |
| Dissection | |||
| Pins | |||
| Ethanol | |||
| Scissors | |||
| Scalpel and adapted blades | |||
| Ice | |||
| Towel paper | |||
| Tissue sample preparation | Company | Catalog Number | Comments/Description |
| Phosphate Buffered Saline (pH7.4) | Sigma | P-3813 | |
| Paraformaldehyde (PFA, 32% EM grade, 100 ml) | Electron Microscopy Sciences | 15714-S | personnal protection equipment required WARNING: this product will expose you to Formaldehyde Gas, a chemical known to cause cancer |
| OCT compound/Tissue Tek | Sakura | 4583 | |
| Sucrose (D-saccharose) | VWR | 27480.294 | |
| Plastic molds | Dominique Dutscher | 39910 | |
| Liquid nitrogen | |||
| Cryostat/sample support | Leica | CM3050S | |
| Razor blades (SEC35) | Thermo Scientific | 152200 | |
| Slide box | |||
| Glass slides Superfrost/Superfrost Ultra Plus | Thermo Scientific | 10143560W90/1014356190 | |
| Brushes | |||
| IHC | Company | Catalog Number | Comments/Description |
| Super Pap Pen | Sigma | Z377821-1EA | |
| Permanent marker (black) | |||
| 50 mM NH4Cl in PBS | Sigma | A-0171 | |
| 0.1 M glycine in PBS | VWR | 24403.367 | |
| Antigen Retrieval solution: Tris 100 mM 5% urea pH9.6 | |||
| Heater (up to 100°C) | |||
| Bovine Serum Albumin (BSA) | Sigma | A7906-100G | |
| Vectashield (anti-fading mounting medium) without DAPI/with DAPI | Vector Laboratories | H-1000/H-1200 | |
| Glass coverslips 22x50mm (microscopy grade) | VWR | CORN2980-225 | |
| Nail polish | |||
| Primary antibodies | Company | Catalog Number | Comments/Description |
| Rabbit anti-mouse caseins (#7781; 1:50 dilution) | generously gifted by M.C. Neville (University of Colorado Health Sciences Center, USA) |
||
| Mouse anti-cytokeratin 8 (CK8, clone 1E8, 1:50 dilution) | Biolegend (Covance) | MMS-162P | |
| Mouse anti-cytokeratin 14 (CK14, cloneLL002, 1:50 dilution) | Thermo Scientific | MS-115-P0/P1 | |
| Rabbit anti-butyrophilin (1:300 dilution) | generously gifted by I.H. Mather (Department of Animal and Avian Sciences University of Maryland College Park, USA) | ||
| Rabbit anti-Stx6 (1:50 dilution) | generously gifted S. Tooze (Cancer Research UK, London Research Institute, London, UK) |
||
| Rabbit anti-VAMP4 (1:50 dilution) | Abcam | ab3348 | |
| Secondary antibodies | Company | Catalog Number | Comments/Description |
| Rhodamine-conjugated goat anti-rabbit IgG (H + L) (1:300 dilution) | Jackson ImmunoResearch Laboratories | 111-025-003 | |
| Counterstains | Company | Catalog Number | Comments/Description |
| Bodipy 493/503 | Life Technologies (Molecular Probes) | D-3922 | |
| DAPI (4-6-diamidino-2-phenylindole) | Life Technologies (Molecular Probes) | D-1306 | |
| Observation/Image capture | Company | Catalog Number | Comments/Description |
| conventional fluorescence microscope | Leica Leitz DMRB microscope |
Standard filters for FITC, Rhodamine and DAPI emissions, ×63 oil-immersion objective (NA 1.3), DP50 imaging camera (Olympus), CellˆF software (Olympus) |
|
| Laser Scanning Microscope (confocal microscopy) | Zeiss LSM 510 microscope |
Plan-Apochromat ×63 oil-immersion objective (NA 1.4), CLSM 510 software, Confocal facilities, MIMA2 Platform, INRA Jouy-en-Josas, France, http://mima2.jouy.inra.fr/mima2) | |
| Image treatment | Company | Catalog Number | Comments/Description |
| ImageJ 1.49k software | Free software |
References
- Watson, C. J., Khaled, W. T. Mammary development in the embryo and adult: a journey of morphogenesis and commitment. Development. , 135-995 (2008).
- Smith, G. H. Experimental mammary epithelial morphogenesis in an in vivo model: evidence for distinct cellular progenitors of the ductal and lobular phenotype. Breast Cancer Res Treat. 39, 21-31 (1996).
- Van Keymeulen, A., et al. Distinct stem cells contribute to mammary gland development and maintenance. Nature. 479, 189-193 (2011).
- Oakes, S. R., Gallego-Ortega, D., Ormandy, C. J. The mammary cellular hierarchy and breast cancer. Cell Mol Life Sci. 71, 4301-4324 (2014).
- Visvader, J. E., Stingl, J. Mammary stem cells and the differentiation hierarchy: current status and perspectives. Genes & development. 28, 1143-1158 (2014).
- Robinson, G. W. Cooperation of signalling pathways in embryonic mammary gland development. Nat Rev Genet. 8, 963-972 (2007).
- Cowin, P., Wysolmerski, J. Molecular mechanisms guiding embryonic mammary gland development. Cold Spring Harb Perspect Biol. 2, a003251 (2010).
- Brisken, C., O'Malley, B. Hormone action in the mammary gland. Cold Spring Harb Perspect Biol. 2, a003178 (2010).
- Gjorevski, N., Nelson, C. M. Integrated morphodynamic signalling of the mammary gland. Nat Rev Mol Cell Biol. 12, 581-593 (2011).
- Daniel, C. W., Smith, G. H. The mammary gland: a model for development. J Mammary Gland Biol Neoplasia. 4, 3-8 (1999).
- Howlett, A. R., Bissell, M. J. The influence of tissue microenvironment (stroma and extracellular matrix) on the development and function of mammary epithelium. Epithelial Cell Biol. 2, 79-89 (1993).
- Edwards, G., Streuli, C. Signalling in extracellular-matrix-mediated control of epithelial cell phenotype. Biochem Soc Trans. 23, 464-468 (1995).
- Hennighausen, L., Robinson, G. W. Think globally, act locally: the making of a mouse mammary gland. Genes & development. 12, 449-455 (1998).
- Topper, Y. J., Freeman, C. S. Multiple hormone interactions in the developmental biology of the mammary gland. Physiol Rev. 60, 1049-1106 (1980).
- Brisken, C., et al. A paracrine role for the epithelial progesterone receptor in mammary gland development. Proc Natl Acad Sci U S A. 95, 5076-5081 (1998).
- Ormandy, C. J., Binart, N., Kelly, P. A. Mammary gland development in prolactin receptor knockout mice. J Mammary Gland Biol Neoplasia. 2, 355-364 (1997).
- Oakes, S. R., Rogers, R. L., Naylor, M. J., Ormandy, C. J. Prolactin regulation of mammary gland development. J Mammary Gland Biol Neoplasia. 13, 13-28 (2008).
- Hennighausen, L., Robinson, G. W. Information networks in the mammary gland. Nat Rev Mol Cell Biol. 6, 715-725 (2005).
- Kouros-Mehr, H., Werb, Z. Candidate regulators of mammary branching morphogenesis identified by genome-wide transcript analysis. Dev Dyn. 235, 3404-3412 (2006).
- Khaled, W. T., et al. The IL-4/IL-13/Stat6 signalling pathway promotes luminal mammary epithelial cell development. Development. 134, 2739-2750 (2007).
- Asselin-Labat, M. L., et al. Gata-3 is an essential regulator of mammary-gland morphogenesis and luminal-cell differentiation. Nat Cell Biol. 9, 201-209 (2007).
- Barcellos-Hoff, M. H., Aggeler, J., Ram, T. G., Bissell, M. J. Functional differentiation and alveolar morphogenesis of primary mammary cultures on reconstituted basement membrane. Development. 105, 223-235 (1989).
- Robinson, G. W., McKnight, R. A., Smith, G. H., Hennighausen, L. Mammary epithelial cells undergo secretory differentiation in cycling virgins but require pregnancy for the establishment of terminal differentiation. Development. 121, 2079-2090 (1995).
- Streuli, C. H., Bissell, M. J. Mammary epithelial cells, extracellular matrix, and gene expression. Cancer Treat Res. 53, 365-381 (1991).
- Streuli, C. H., et al. Laminin mediates tissue-specific gene expression in mammary epithelia. J Cell Biol. 129, 591-603 (1995).
- Boudreau, N., Sympson, C. J., Werb, Z., Bissell, M. J. Suppression of ICE and apoptosis in mammary epithelial cells by extracellular matrix. Science. 267, 891-893 (1995).
- Pullan, S., et al. Requirement of basement membrane for the suppression of programmed cell death in mammary epithelium. J Cell Sci. 109 (Pt 3), 631-642 (1996).
- Schmidhauser, C., Bissell, M. J., Myers, C. A., Casperson, G. F. Extracellular matrix and hormones transcriptionally regulate bovine beta-casein 5' sequences in stably transfected mouse mammary cells. Proc Natl Acad Sci U S A. 87, 9118-9122 (1990).
- Streuli, C. H., et al. Stat5 as a target for regulation by extracellular matrix. J Biol Chem. 270, 21639-21644 (1995).
- Sollner, T., et al. SNAP receptors implicated in vesicle targeting and fusion. Nature. 362, 318-324 (1993).
- Jahn, R., Scheller, R. H. SNAREs--engines for membrane fusion. Nat Rev Mol Cell Biol. 7, 631-643 (2006).
- Weber, T., et al. SNAREpins: minimal machinery for membrane fusion. Cell. 92, 759-772 (1998).
- Sollner, T., Bennett, M. K., Whiteheart, S. W., Scheller, R. H., Rothman, J. E. A protein assembly-disassembly pathway in vitro that may correspond to sequential steps of synaptic vesicle docking, activation, and fusion. Cell. 75, 409-418 (1993).
- McNew, J. A. Regulation of SNARE-mediated membrane fusion during exocytosis. Chem Rev. 108, 1669-1686 (2008).
- Wang, C. C., et al. VAMP8/endobrevin as a general vesicular SNARE for regulated exocytosis of the exocrine system. Mol Biol Cell. 18, 1056-1063 (2007).
- Chat, S., et al. Characterisation of the potential SNARE proteins relevant to milk product release by mouse mammary epithelial cells. Eur J Cell Biol. 90, 401-413 (2011).
- Reinhardt, T. A., Lippolis, J. D. Bovine milk fat globule membrane proteome. J Dairy Res. 73, 406-416 (2006).
- Robenek, H., et al. Butyrophilin controls milk fat globule secretion. Proc Natl Acad Sci U S A. 103, 10385-10390 (2006).
- Fujimoto, T., Ohsaki, Y., Cheng, J., Suzuki, M., Shinohara, Y. Lipid droplets: a classic organelle with new outfits. Histochem Cell Biol. 130, 263-279 (2008).
- Mather, I. H., Keenan, T. W. Origin and secretion of milk lipids. J Mammary Gland Biol Neoplasia. 3, 259-273 (1998).
- Heid, H. W., Keenan, T. W. Intracellular origin and secretion of milk fat globules. Eur J Cell Biol. 84, 245-258 (2005).
- McManaman, J. L., Russell, T. D., Schaack, J., Orlicky, D. J., Robenek, H. Molecular determinants of milk lipid secretion. J Mammary Gland Biol Neoplasia. 12, 259-268 (2007).
- de Assis, S., Warri, A., Cruz, M. I., Hilakivi-Clarke, L. Changes in mammary gland morphology and breast cancer risk in rats. Journal of visualized experiments : JoVE. , (2010).
- Plante, I., Stewart, M. K., Laird, D. W. Evaluation of mammary gland development and function in mouse models. Journal of visualized experiments : JoVE. , (2011).
- Galio, L., et al. MicroRNA in the ovine mammary gland during early pregnancy: spatial and temporal expression of miR-21, miR-205, and miR-200. Physiol Genomics. 45, 151-161 (2013).
- Linzell, J. L., Peaker, M. The effects of oxytocin and milk removal on milk secretion in the goat. J Physiol. 216, 717-734 (1971).
- Knight, C. H., Peaker, M., Wilde, C. J. Local control of mammary development and function. Rev Reprod. 3, 104-112 (1998).
- Walid, M. S., Osborne, T. J., Robinson, J. S. Primary brain sarcoma or metastatic carcinoma? Indian J Cancer. 46, 174-175 (2009).
- Hue-Beauvais, C., et al. Localisation of caveolin in mammary tissue depends on cell type. Cell Tissue Res. 328, 521-536 (2007).
- McManaman, J. L., Neville, M. C. Mammary physiology and milk secretion. Adv Drug Deliv Rev. 55, 629-641 (2003).
- Mather, I. H., Jack, L. J. A review of the molecular and cellular biology of butyrophilin, the major protein of bovine milk fat globule membrane. J Dairy Sci. 76, 3832-3850 (1993).
- Heid, H. W., Winter, S., Bruder, G., Keenan, T. W., Jarasch, E. D. Butyrophilin, an apical plasma membrane-associated glycoprotein characteristic of lactating mammary glands of diverse species. Biochim Biophys Acta. 728, 228-238 (1983).
- Bock, J. B., Klumperman, J., Davanger, S., Scheller, R. H. Syntaxin 6 functions in trans-Golgi network vesicle trafficking. Mol Biol Cell. 8, 1261-1271 (1997).
- Tran, T. H., Zeng, Q., Hong, W. VAMP4 cycles from the cell surface to the trans-Golgi network via sorting and recycling endosomes. J Cell Sci. 120, 1028-1041 (2007).
- Wendler, F., Page, L., Urbe, S., Tooze, S. A. Homotypic fusion of immature secretory granules during maturation requires syntaxin 6. Mol Biol Cell. 12, 1699-1709 (2001).
- Wendler, F., Tooze, S. Syntaxin 6: the promiscuous behaviour of a SNARE protein. Traffic. 2, 606-611 (2001).
- Shitara, A., et al. VAMP4 is required to maintain the ribbon structure of the Golgi apparatus. Mol Cell Biochem. 380, 11-21 (2013).
- Thibault, C., Levasseur, M. C. La reproduction chez les mammifères et l'homme. , INRA Editions. 928 (2001).
- Truchet, S., Wietzerbin, J., Debey, P. Mouse oocytes and preimplantation embryos bear the two sub-units of interferon-gamma receptor. Mol Reprod Dev. 60, 319-330 (2001).



