Introduction
再加上柱后衍生(PCD)的高效液相色谱(HPLC)是一个强大的工具,是在分析实验室解决的一些问题是有用的。它可用于检测与该套件可用1,2-探测器否则不可检测的化合物,增加目标分析物,这允许检测和定量3-5的下限或选择性的信号衍生的靶分析物,以避免基质效应6。常用的PCD反应包括胺类,如氨基酸的反应中,用邻- phthaladehyde 7-9,茚三酮9,10-或荧光胺11,12,活性氧的衍生(ROS)与2,2-二苯基1- picrylhydrazil自由基(DPPH•)13,14或2,2'-连氮基-双(3-乙基苯并噻唑-6-磺酸(ABTS)15,16,以及使用碘化物叠氮化物试剂的衍生化磺丙ontaining化合物17,18。
有,但是,众多的缺点使用PCD反应的高效液相色谱系统6。在这些主要是添加衍生试剂(S)和所述检测器,其允许时间用于混合和发生8反应的点之间的使用反应线圈。这些反应环路通常具有500微升或更多,相对于HPLC系统19的其余部分的容积是显著的卷。使用这些高容量的反应循环中增加的峰加宽的结果相比,现在将未经反应环的存在下观察到的。这将导致在具有定量和检测的更高的限制更短,更宽的峰和负效应色谱分辨率。 图1和2突出,从加入各种柱后反应循环体积导致峰形状的恶化。这种分析用94%甲醇的流动相组合物和6%Milli-Q水进行。流动相的流速为1毫升/分钟,注射体积为20μl,并在分析波长为265纳米。从20微升至1000微升变化死体积的线圈插入柱并以模拟在PCD方法反应循环死体积的效应的检测器之间。这些环被从0.5mm内径的不锈钢管来制备。该实验由一个控制器(SCL-10AVP)的HPLC系统上进行,一个低压梯度阀(FCL-10ALVP),一个泵(LC-20AD)中,喷油器(SIL-10ADVP)和PDA检测器( SPD-M10ADVP)。流动相通过脱气引入HPLC系统之前泵送。使用250毫米×4.6mm内径5微米柱进行分离。实验条件选择为典型的最近已经在文献中公开的PCD反应。
该最简单,最常见的柱后反应器设置被称为非分段的管状反应器,它实际上是一个长,细管,通过它可以使液体流出,反应可以发生。在这个系统中的峰变宽取决于不仅添加到系统中的死体积,而且还作为强调由饭岛等人 8的管的内径上。此外,线圈的几何形状起着观察品牌变宽的一部分。斯图尔特20指出,反应器的卷绕改变二次流剖面,导致更好的混合,这意味着死体积可以被最小化。据指出,峰宽用针织线圈21一 个开放的管状时不显著。当峰加宽过大时,其它类型的反应器也可考虑20,22。这些可能包括床反应器或分段流反应器。这些反应器是反应慢了,否则会特别requir有用Ë大的反应循环。作为非分段的管状反应器是将PCD应用中最常用的类型的反应器,本文涉及这种类型的反应器装置的其余部分。
反应流程(RF)列的设计采用了多端口端部装配件,允许流动相,或者通过设在位于外柱的径向中心区域或三个端口的单个端口退出(或输入)该列列的壁区域( 见图3)。这两个流使用含有由不可渗透的环是依次由延伸出到塔壁的外多孔玻璃料包围一个中央多孔玻璃料一个端部接头隔开。由于中央不透水环横流不是两个多孔区之间可能的。
在反应流层析,所述衍生化试剂(多个)被泵对流动相的流动方向成一个或总重量澳反应流柱的外部端口。柱洗脱剂通过自由外端口与外玻璃料的衍生试剂(多个)混合,并传递给检测器。反应流程可用于任一单一试剂衍生(1端口的衍生试剂,1端口到柱洗脱液传递给检测器和1个端口的阻塞状态)或双试剂系统(2个端口的衍生试剂和1端口通过柱洗脱剂的检测器)。从中央流的流动可以被用来检测未衍生柱洗脱液,有效地多路复用检测23,或传递给浪费。
一个主要的调整技术是可用时运行的RF-PCD色谱是中枢和外周流的比率。每个衍生的最佳比例取决于许多因素,如中央流是否将被检测或传递给浪费。因此,一旦最佳的比率已经确定,应当确保该正确流量比前正在执行每个运行来实现的。
业已发现,使用玻璃料的给列洗脱液流和射频PCD导致更有效的混合与通常采用零死体积T型件或低死体积的传统混合技术相比,衍生试剂混合W-片的两个流混合。这允许使用相对较小的反应的循环,或者在反应循环的甚至完全取消。反应回路尺寸的结果更清晰峰的减少相比传统的柱后衍生的方法。这意味着,尽管并非所有的柱洗脱液的衍生化,信噪比更大的信号被观察并且可以实现检测和定量的,因此下限。
反应流层析已经开发克服与PCD反应的适应性困难s至因造成的,需要采用大体积反应循环大柱后死体积现代HPLC柱和系统,特别是在致频带加宽效率的损失。相比于常规的PCD中的RF-PCD的更有效的混合过程意味着较小的反应环体积可以采用导致的增加观察到的分离效率。此外射频-PCD色谱同时显示增加的信号并进行比较,以产生相对于常规的PCD方法检测和定量的下限常规的PCD技术减少噪音。相比于常规的PCD方法的RF-PCD的另一个优点是,以监视来自RF列的中央端口以及从所述塔的外围区域洗脱衍生的流洗脱未衍生流的能力。 RF-PCD是一个相对较新的,但有前途的技术,该技术相对于传统的PCD方法显示许多优点。
Subscription Required. Please recommend JoVE to your librarian.
Protocol
注意:请参考所有材料和试剂材料安全数据表(MSDS)使用前( 即 MSDS甲醇)。处理溶剂和高效液相色谱法(HPLC)洗脱时,确保使用的所有适当的安全措施。确保适当使用高效液相色谱仪,分析天平和检测仪器仪表工程控制,保证使用个人防护用品(防护眼镜,手套,实验室外套,全长裤,封闭趾鞋)。
注意:此协议描述了特定于感兴趣的化学化合物的性质不同的试剂反应流柱后衍生的3种方法(RF-PCD)技术,每个。对于ROS的分析去一节“1. ROS的检测用DPPH•”,对于伯胺见的分析“2.检测使用荧光胺伯胺的”,而对酚类化合物的分析,去节“3 。酚的检测使用4 aminoantipyrene和铁氰化钾“,用超纯水( 如 Milli-Q水)全程。
注意:射频柱的连接是在几乎相同的方式与主要差别是端部装配件的一个射频列的数目的常规HPLC柱来实现。用于连接标准HPLC柱的HPLC系统接头能够被用于一个射频柱连接到HPLC系统。
1. ROS的检测用DPPH•
- 设置HPLC仪器的
- 制备具有A线100%的水和B线100%甲醇作为流动相的高效液相色谱仪。吹扫泵按照制造商的要求。
- 设置HPLC仪器组件和如在图4A中所示的附加 衍生泵。
- 设定UV-Vis检测在520纳米的波长进行分析。
- 设置最多RF列
- 射频柱的入口连接至HPLC仪器。
- 连接0.13毫米ID管的15厘米长到出口的RF列的中心港。
- 出口外设端口连接到采用0.13毫米内径管15厘米长的UV-Vis检测。
- 的DPPH•泵线连接到外围端口上的射频柱的出口。
- 阻止在使用柱塞射频列的出口的未使用的外设端口。
- 带来的HPLC泵的流速到1ml分-1,在100%的线B - 100%甲醇。
- 平衡与100%甲醇的流动相柱10分钟为4.6毫米内径×100毫米长柱。这个时间应该根据用户可采用其他列的尺寸来缩放。
- 清除DPPH•试剂准备
- 制备在甲醇DPPH•的0.1mg / ml的溶液。 超声处理含有DPPH•试剂10分钟烧瓶中。
- 盖瓶铝箔以防止暴露在光线下。
- 吹扫DPPH•泵与制备DPPH•试剂按照制造商的要求。
- 调谐RF柱出口
- 准确称取两个干净和干燥的船只。标签一艘船中央和其他外围。
- 收集退出中央口插入标中部为1.0分钟,容器中的污水。
- 重新称量中央口容器中,并从中央口计算流量的重量如下:
中央端口(克)的重量=中部港口船只(G)的最终重量 - 中环港容器的初始重量(g) - 用于退出紫外可见是连接到RF列的外设端口和计算重量为外设端口容器中的流出物重复步骤1.4.2和1.4.3如下:
外设端口(克)的重量=外设端口船(G)的最终重量 - 外设端口容器的初始重量(g) - 计算从中央和外围端口来如下流动的百分比:
中央%环港端口(克)=体重/×100(中央端口(G)+外设端口(克)重的重量)
%外设端口外设端口(克)=体重/×100(中央端口(G)+外设端口(克)重的重量) - 确保中央流和外围流量之间的分割比为30:70(中央:周边)。如果中央流量为30%以上,通过添加0.13毫米ID管道的长度向中央端口的出口降低流动排出的量。如果中央流量低于30%从中央口减少0.13毫米管的长度。
- 重复步骤1.4.1至1.4.6,直到30:70的分割比例(中央:外设)的实现。
- 设置D的流量PPH•试剂泵0.5毫升分钟-1。
注意:设置与DPPH•试剂射频列现在准备进行分析。样品现在可以注入。
- 运行后关机条件
- 一旦所有的样品被注射,表明运行完成,停止衍生试剂泵的流量。
- 取下外设端口的DPPH•试剂泵线和塞住端口。
- 平衡用流动相在其中是通过使流动相以1ml分通过塔传递-1 10分钟被存储在列中。
- 停止对HPLC仪器流动相泵的流量。
- 更换DPPH•试剂用甲醇和清除额外的泵。
注意:现在HPLC系统可以关闭。
2.使用Fluoresc伯胺的检测胺
- 流动相的制备
- 制备1升的10mM的醋酸铵溶液,将溶液的pH调节至9.0与5 M氢氧化铵稀释之前至体积。
- 添加52.6毫升乙腈(ACN)的对乙酸铵缓冲以达到95:05(缓冲液:ACN)预混流动相。
- 设置HPLC仪器的
- 与线A的预混合制备的缓冲液作为流动相制备HPLC仪器。吹扫泵按照制造商的要求。
- 设置HPLC仪器组件和如在图4A中所示的附加 衍生泵。
- 附加脉冲阻尼器线圈衍生泵。
- 设置荧光检测器(FLD)与475纳米390纳米,发射波长的激发波长。
- 设置RF列
- 第连接射频列高效液相色谱仪电子入口。
- 连接0.13毫米ID管的15厘米长到出口的RF列的中心港。
- 射频柱的出口外设端口的连接采用0.13毫米内径的管道有15厘米长的FLD检测。
- 衍生泵线连接到外围端口上的射频柱的出口。
- 阻止在使用柱塞射频列的出口的未使用的外设端口。
- 带来的HPLC泵的流速到1ml分-1为100%的线A -的10mM乙酸铵缓冲液pH 9中,用5%的ACN预混。
- 平衡与100%的线路流动相柱10分钟为4.6毫米内径×100毫米长度列。这个时间可以根据用户可采用其他列的尺寸来缩放。
- 荧光胺试剂的制备
- 赚100毫升0.1毫克毫升-1荧光胺试剂。 <利>超声处理1分钟。
- 用铝箔盖,防止暴露在光线下。
- 吹扫与制备荧光胺试剂按照制造商的要求的试剂泵。
- 准确称取两个干净和干燥的船只。标签一艘船中央和其他外围。
- 收集退出中央口插入标中部为1.0分钟,容器中的污水。
- 重新称量中央容器,并从中央口计算流量的权重作为在步骤1.4.3如下。
- 重复步骤2.5.2至2.5.3用于退出是连接到RF列的外设端口和外围计算重量作为步骤1.4.4如下FLD的流出。
- 计算从中央和外围端口来作为步骤1.4.5如下流的百分比。
- 确保中央流和外围之间的分割比率流量是43:57(中央:外设)。如果中心流43%以上,通过添加0.13毫米ID管道的长度向中央端口的出口降低流动排出的量。如果中央流量低于43%,从中央口减少0.13毫米管的长度。
- 重复步骤2.5.1至2.5.6,直到43:57分割比例(中央:外设)的实现。
- 流动相泵的流速设置为0.7毫升分钟-1。
- 设置衍生泵以0.1ml min至流动-1。
注意:设置与荧光试剂的RF列现在准备进行分析。样品现在可以注入。
- 一旦所有的样品被注射,表明运行完成,停止衍生泵。
- 除去从外设端口和塞子衍生泵线。
- 在移动相平衡色谱柱它是通过使流动相以1ml分通过塔传递-1 10分钟被存储。
- 停止流动相泵的流量。
- 替换用乙腈荧光胺试剂和清除衍生泵。
注意:现在HPLC系统可以关闭。
3.酚的4 Aminoantipyrene和铁氰化钾的检测
- 流动相的制备
- 制备1升的的100mM乙酸铵溶液,将溶液的pH调节至9.0与5 M氢氧化铵稀释之前至体积。
- 加52.6毫升甲醇的乙酸铵缓冲达到95的预混流动相:5(缓冲液:甲醇)。
- 设置HPLC仪器的
- 与线A的预混合制备的缓冲液作为流动相制备HPLC仪器。吹扫泵按照制造商的氏要求。
- 设置HPLC仪器组件和如图4B中所示的两个附加试剂泵。
- 附加脉冲阻尼器线圈每一个试剂泵。
- 设定UV-Vis检测在500nm的波长进行分析。
- 设置RF列
- 射频柱的入口连接至HPLC仪器。
- 连接0.13毫米ID管的15厘米长到出口的RF列的中心港。
- 射频柱的出口外围端口连接到采用0.13毫米内径管15厘米长的UV-Vis检测。
- 连接每个试剂( 即 ,4-aminoantipyrene和铁氰化钾)泵线到RF射频列的出口的外设端口。
- 带来的HPLC泵的流速到1ml分-1为100%的线A -的100mM乙酸铵缓冲液pH 9中,用5%甲醇预混合。
- 平衡柱子W¯¯第i个10分钟为4.6毫米内径×100毫米长度列的100%线的移动相。这个时间可以根据用户可采用其他列的尺寸来缩放。
- 4- aminoantipyrene试剂的制备
- 通过以下步骤3.1.1制备具有pH为9的醋酸铵缓冲液。
- 重150毫克4- aminoantipyrene和在100毫升制备的乙酸铵缓冲液(pH 9)的溶解。
- 超声处理1分钟。
- 用铝箔盖,防止暴露在光线下。
- 清除第一试剂泵与制备4- aminoantipyrene试剂按照制造商的要求。
- 铁氰化钾的试剂制备
- 重150毫克的铁氰化钾和在按步骤3.1.1制备100毫升乙酸铵缓冲液(pH为9)溶解。
- 超声处理1分钟。
- 铝箔盖,防止暴露在光线下。
- PURGE中的第二试剂泵与制备铁氰化钾的试剂按照制造商的要求。
- RF列的调整
- 准确称取两个干净和干燥的船只。标签一艘船中央和其他外围。
- 收集退出中央口插入标中部为1.0分钟,容器中的污水。
- 重新称量中央容器,并从中央口计算流量的权重作为在步骤1.4.3如下。
- 重复步骤3.6.2至3.6.3用于退出紫外可见是连接到RF列的外设端口和外围计算重量作为步骤1.4.4如下的流出物。
- 计算从中央和外围端口来作为步骤1.4.5如下流的百分比。
- 确保中央流和外围流量之间的分割比率为50:50(中央:周边)。如果中央流量为50%以上,降低流通过添加0.13毫米ID管道的长度到出口中央口排出的量。如果中央流量低于50%时,从中央口减少0.13毫米管的长度。
- 重复步骤3.6.1至3.6.6,直到50:50的分割比(中央:外设)的实现。
- 4 aminoantipyrene泵的流速设置为0.5毫升分钟-1。
- 铁氰化钾泵的流速设置为0.25毫升分钟-1。
注:建立与双组分试剂射频列现在准备用于分析。样品现在可以注入。
- 运行后关机条件
- 一旦所有的样品都被注入的运行已完成,表明运行完成,停止试剂泵。
- 从外围端口移除试剂泵线并用15厘米的一块0.13毫米管替换它们。
- 在WHI流动相平衡色谱柱通道它是通过使流动相以1ml分通过塔传递-1 10分钟被存储。
- 停止对HPLC仪器流动相泵的流量。
- 更换既对试剂试剂用甲醇泵和清除额外的泵根据制造商的要求。
注意:现在HPLC系统可以关闭。
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
这是适于通过射频PCD使用第一PCD方法是使用2,2-二苯基-1- picrylhydrazil自由基(DPPH•)24抗氧化剂的衍生。此反应通过Koleva 等人介绍了 25,并一直被广泛使用。检测依赖于DPPH•的脱色活性氧的存在下自由基,因此在观察到的吸光度的下降的抗氧化剂的结果存在。的DPPH•反应经常采用500微升或更13-15的大反应循环,但人们发现,使用RF-PCD柱时需要进行无反应循环。 图5示出的短萃取浓缩咖啡的咖啡的样品的两个色谱使用衍生DPPH自由基•用常规PCD和RF-PCD仪器。
已适于通过射频PCD使用第二PCD方法是德使用荧光胺作为衍生化试剂23四个氨基酸(甘氨酸,亮氨酸,苯丙氨酸和色氨酸)ivatization。该方法是从工作适于通过Udenfriend 等人 11,用流动相组合物,荧光胺的浓度和荧光胺流速为与射频列使用最优化。传统方法使用一个两试剂衍生系统,其中,加入的pH 9.0缓冲液的流出物流在加入荧光胺试剂之前,同时利用一个已经缓冲的流动相在RF-PCD方法,从而只有单个试剂衍生系统需要。对于本申请的衍生流在使用紫外可见光检测器,其对应于通过荧光用于检测的激发波长390纳米进行分析。衍生的流可以使用荧光检测器,提供了更大的信号对噪声和检测和定量的,因此下限被检测itation,按照工作由Udenfriend 等人 11。此外,来自RF-PCD设置的中心端口来洗脱液使用第二紫外可见检测器监测。
所述RF-PCD方法的氨基酸衍生的性能比常规的PCD法。 表为每个在两个RF-PCD和常规PCD模式分析氨基酸的定量和检测的1列出所计算的限制。检测限被定义为同时定量限被定义为,其中达到一个信号10的信噪比的浓度,其中,获得一个信号的2信噪比的浓度。 图6显示了四个的色谱氨基酸使用常规的PCD方法中,RF-PCD方法和从RF-PCD方法未衍生流分析; 图7是信号为豌豆获得的比较由于同时使用常规的PCD法和RF-PCD方法甘氨酸和亮氨酸KS, 图8的峰宽使用常规的PCD方法中,RF-PCD方法和未衍生流从RF-分析时比较色氨酸峰的PCD方法。
已适于通过射频-PCD 26使用最后的PCD方法是四个酚类(苯酚,4-甲氧基苯酚, 对甲酚和生育酚)的衍生。该方法改编自比格利和格罗布27小的改动工作,以优化射频列使用的方法。这一工作使用的其中两个-4- amionantiprine和铁氰化钾的溶液加到柱洗脱液在RF柱的端部嵌合的双组分衍生反应。结果发现,使用RF柱用于反应时使用不需要额外的柱后反应循环。 图9示出的色谱,其中的一个例子含有某些成分,显示的衍生方案和应对一些不,分离,衍生和检测(黑色线)的21组件测试样品。相同的混合物也分离和检测未衍生用于比较(红色迹线)。 图9中的RF-PCD响应已被显示为容易视觉区分(获得的检测器的响应是肯定的)的否定响应, 图10示出p的峰形状的比较甲酚既使用RF-PCD柱衍生和未衍生。
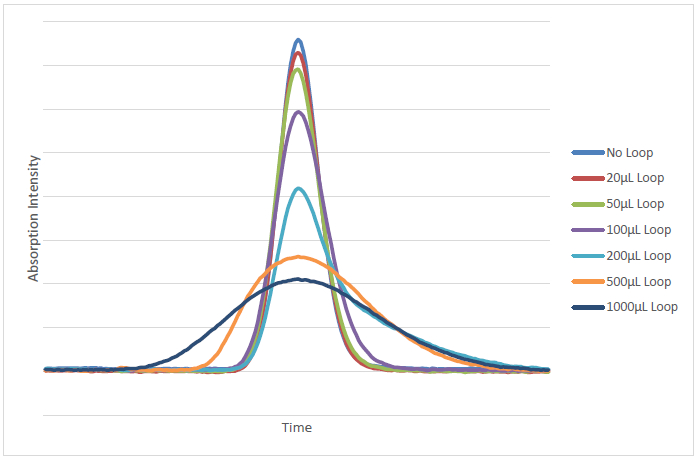
图1. 色谱己基苯注入柱和检测器之间添加各种死体积的HPLC系统上的重叠。 请点击此处查看该图的放大版本。

图2. 甲苯,乙苯,丙注入柱和检测器之间添加的各种死体积HPLC系统上色谱覆盖。 请点击此处查看该图的放大版本。

图3.反应流柱设计的插图。 请点击此处查看该图的放大版本。
tp_upload / 53462 / 53462fig4.jpg“/>
图4.仪器设置RF-PCD的。(A)单试剂( 即 DPPH•或荧光胺衍生化试剂)和(B)双试剂( 即 4 aminoantipyrene和铁氰化钾衍生化试剂)。 请点击这里查看一个更大的版本这个数字。

图 5. 短萃取浓缩咖啡与咖啡使用的检测柱后衍生分离后的色谱的2,2-二苯基-1- picrylhydrazil自由基(DPPH•)。使用传统的柱,用500微升反应线圈进行衍生化(A)和一个反应流柱(B 荣>)。 请点击此处查看该图的放大版本。

图6 的四个氨基酸色谱覆盖(甘氨酸(G),亮氨酸(L),苯丙氨酸(P)和色氨酸(T))比使用荧光胺作为PCD试剂后通过柱后衍生检测10到1000ppm的范围内通过HPLC分离 。色谱图如下:( 一 )传统PCD,(B)RF-PCD,以及(C)从RF-PCD中心(非衍生)端口。 请点击此处查看该图的放大版本。
_upload / 53462 / 53462fig7.jpg“/>
图 7. 甘氨酸(第一峰),并从传统的PCD(红色曲线)和RF-PCD(黑色线),亮氨酸(第二次峰值)获得的信号比较。 请点击此处查看该图的放大版本。

峰由于基于(A)中的保留时间和(B)的峰体积色氨酸图8.峰宽度进行比较。黑色跟踪显示常规PCD方法中,红色迹线示出了RF-PCD方法和绿色迹线示出了从RF-PCD方法的中央端口未衍生流。 请点击此处查看该图的放大版本。

图9. 人造样品的色谱分离。这些组件包括苯酚(P),4-甲氧基苯酚(M), 对甲酚(C)和生育酚(T),以及众多的烷基苯,多环芳香烃,苯甲醚,phentanole,咖啡因,苯丙氨酸和苯甲酰胺。峰标记为I,II和III烷基苯出乎意料地回应了衍生方案。黑线代表用紫外检测器在254nm处,而红色曲线代表在500nm的衍生响应非衍生反应。注意视觉清晰的衍生反应已经反转。 请点击此处查看该图的放大版本。
 图10. 对甲酚色谱响应。黑线代表在254nm处用紫外检测器的非衍生响应,而红色曲线代表在500nm的衍生(RF-PCD)的响应。 请点击此处查看大图这个数字。
图10. 对甲酚色谱响应。黑线代表在254nm处用紫外检测器的非衍生响应,而红色曲线代表在500nm的衍生(RF-PCD)的响应。 请点击此处查看大图这个数字。
| 反应型 | 甘氨酸 | 亮氨酸 | 苯丙氨酸 | 色氨酸 | ||||
| LOD(PPM) | 定量限(PPM) | LOD(PPM) | 定量限(PPM) | LOD(PPM) | 定量限(PPM) | LOD(PPM) | 定量限(PPM) | |
| RF-PCD | 6 | 25 | 10 | 100 | 25 | 250 | 50 | 250 |
| RF-PCD中央端口(未衍生) | 没有检测到 | 没有检测到 | 没有检测到 | 1 | 10 | |||
| 常规PCD | 10 | 100 | 50 | 500 | 50 | 500 | 100 | 500 |
表1. 检测和使用荧光胺通过HPLC分离后的衍生化试剂不同柱后衍生系统检测到4种不同的氨基酸定量限度。
Subscription Required. Please recommend JoVE to your librarian.
Discussion
RF-PCD允许与HPLC流出柱后衍生化试剂在不使用反应线圈的有效混合,减少频带加宽的影响,并提高分离性能。的RF-PCD方法也示于相对于检测方法的信号响应的改善。 Camenzuli 等 28是第一个报道的意式咖啡样品中DPPH•使用反应流列用于检测ROS的。他们的研究中所涉及的分析和射频条件的优化,以达到最大的性能,测试了一系列的DPPH•浓度与各种DPPH•试剂流速。得出的结论是0.1毫克毫升-1 0.5毫升min的DPPH•试剂流速DPPH•浓度-1为最佳下的RF-PCD的改进的分离性能( 即 ,效率和灵敏度)相比的DPPH•衍生常规的PCD法的条件。 图5示出了利用DPPH•抗氧化剂的测定浓咖啡样品中的两个色谱。特别有趣的是具有约5分钟的保留时间的高强度峰。由此可以看出,使用500微升反应循环,这是典型的传统的DPPH•衍生方法时,一个单一的,宽峰可以观察到。然而,当RF-PCD方法,而不需要在反应循环中使用,变得清楚的是,单峰用500μl的循环是实际上两个峰观察到。此外,更多的细节可以后5.5分钟使用RF-PCD安装时看到。因此,对于活性氧的样品中使用DPPH•RF-PCD的技术的分析证明是优于使用DPPH•ROS分析的常规方法。
RF-PCD与荧光胺试剂已被用于初级氨基酸分析和比较的PCD与荧光20的常规形式。由于RF柱端配合也提供了用于多重检测的平台,未衍生中心流动是通过紫外可见监测,而流出物和荧光胺的衍生物在RF端接头的外侧区域通过紫外线进行的和检测到的可见。一系列的含四个氨基酸的测试标准进行了复用的RF-PCD的条件下进行分析。 图6的色谱轮廓为PCD( 图6A)和RF-PCD(检测的衍生( 图6B)的传统方法进行比较,并且未衍生( 图6C))的一系列氨基酸。 图7是通过常规的PCD和RF-PCD获得的两个氨基酸的信号的重叠。可以看出,由于t时更有效的观测分离他除去反应循环,导致更大的信号响应,尽管并非所有的柱流出物被衍生化。此外,更有效的衍生试剂的混合方案导致较低的基线噪声,进一步增加了信噪比。在检测和定量用于RF-PCD方法相比,在表1中的常规的PCD法计算的下限这种效果证明。这种趋势也可在图5中,其中,以DPPH•的抗氧化反应是更大的可见RF-PCD方法比常规的PCD方法。显著峰劣化在使用一个常规的PCD设置这导致了该方法的较低的信号响应的色谱中观察到。
图8色氨酸的峰形时RF-PCD(包括衍生化和非衍生流)和常规PCD比较分析。当峰值轮廓对时间作图峰宽都似乎是大致相同的( 图8A)。当峰值轮廓针对峰体积( 图8B)绘制在RF-PCD发现相比于常规的PCD的改进是显而易见的。当针对峰体积作图,很显然,尽管对RF-PCD峰显示比未衍生峰降解少量,降解,然而,相对于从常规的PCD法观察最小。在RF-PCD相比于常规的PCD的分离效率的改进也展示于图7,其通过常规的PCD和RF-PCD衍生后甘氨酸和亮氨酸的峰形进行比较。由此可以看出,在常规的PCD模式甘氨酸和亮氨酸的峰是勉强基线分离,而在RF-PCD模式的信号是在基线为两峰之间更长的时间。
一个相比于常规的PCD方法的RF-PCD的额外的好处是从射频柱使多重检测的中心端口监视器未衍生流出物的能力。这是可能的,在RF端部装配件内的玻璃料的设计不允许在径向中央区域的流动与在端部接头的周边区域的流动混合,从而使衍生流的监测从外部区域嵌合以及从中央口未衍生流的监视。这种能力是通过在表1中,这是众所周知的有衍生后差信号响应色氨酸获得的结果由荧光胺20突出,但是,不像其它氨基酸它显示了未衍生时(在280nm处),以UV检测器的响应。对于这两种衍生系统检测和定量的限制相对较高,检测和定量的但是限分别在t低得多他未衍生流。用的能力,同时监测衍生和非衍生流出物流中的检测参数可被优化,得到的性能对各氨基酸的最大水平。
射频终端配件的多端口设计允许双衍生化试剂的分析。塞利姆等人 23调查使用RF-PCD条件酚类化合物的分析相比,使用4- aminoantipyrene和铁氰化钾PCD的现有技术两种试剂(4- aminoantipyrene和铁氰化钾)的性能。这种类型的PCD技术需要两个泵和反应的循环,而不是一个泵,反应环路DPPH•每个衍生化试剂。各种酚类和烷基苯化合物的常规和RF PCD条件下进行分析。有趣的是,传统的方法下未检测到的非酚类化合物实际上是检测未DER射频-PCD的条件。 图9示出了紫外-可见色谱响应和一个标准的测试混合物中的RF-PCD比色反应。射频PCD 如图10观察仪器方面提供了一种简化的PCD技术,未经分离性能折衷。 图10比较对甲酚的峰轮廓用RF-PCD和未经衍生化时分析也。它可以看出,在RF-PCD色谱的峰宽是非常相似的未衍生色谱。两个色谱之间的主要区别在于,在RF-PCD色谱是在基地稍宽。这表明,有很少或没有峰分散体,由于在RF-PCD技术。在图9中表示,它不仅是一种具有当由射频PCD衍生相比,其未衍生峰相似的峰值宽度的对甲酚峰中观察到类似的反应,但所有的酚与烷基这回应了衍生方案lbenzenes显示此相同的趋势。虽然,RF-PCD与使用两个衍生化试剂而获得的类似的分离性能与传统的非衍生化的方法,该RF-PCD允许酚类化合物的选择性探测,其中之一,这不是非衍生化的条件下检测到的。
作为RF-PCD是常规HPLC-PCD方法的发展,所有的诸如流动相组合物中一般的HPLC方法中可用的调谐工具和流速,注射体积和分析波长是适用于RF-PCD方法。此外,在常规HPLC-PCD方法,如流动相到PCD试剂流量比以及PCD的试剂组合物可调谐的工具都适用于RF-PCD方法。可用一个额外的调谐工具使用RF-PCD时,是不是在常规的PCD可用方法是从中枢和外周来流的比率列的端口。的流量是由通过控制交检测器的长度和/或内径改变在各线的相对背压控制(或如果未检测到来自中央口来的流动后列)管。中央的外周流动的最佳比例依赖于所讨论的反应,以及其他因素,诸如,是否被检测到或不中央端口。 60%的外周和40%,市中心的一个流量比通常是一个很好的起点。
与调谐参数,许多可与使用的RF-PCD柱而产生的问题也与常规的PCD方法普遍。该色谱分析必须知道执行RF-PCD分析时的一个特定的参数是在系统中的流量和压力的稳定,特别是试剂泵(多个)。如果系统中的流动是不稳定的,它会引起因此基线不稳定减小信噪比,并随后定量和检测的极限。
RF-PCD层析已经开发来克服在适应PCD反应现代HPLC柱和系统的困难。射频的PCD与常规的PCD方法相比的主要优点是更有效的混合,由于它采取射频柱的端部装配件内的玻璃料内的地方,这种混合是在稍高的背压。这允许最小化或甚至消除了在许多常规的PCD方法中使用的大体积反应循环。这一最小化的柱后死体积的,具有较大的色谱分离更有效的分离可以进行。
RF-PCD模式已经导致分离效率,峰形和信号改善噪声相比于常规的PCD方法。然而,要注意,信号的改进是检测器依赖性是重要的。例如探测器取决于该样本量可以不表现出与常规方法相比的RF-PCD条件下的信号响应的增加。这是因为传统的方法下列取样的100%的被检测到,RF-PCD条件仅上柱样品的一定比例下,其中根据不同的分割比被检测到。它不过是,预期的RF-PCD反应将能适用于任何一种或两种试剂(只要两种试剂都同时加入)以最小的重新优化的PCD反应和对于所有三个观察到的好处反应迄今为止检测将转化为其他PCD反应。
Subscription Required. Please recommend JoVE to your librarian.
Materials
| Name | Company | Catalog Number | Comments |
| HPLC instrument | Agilent | 1290 Series HPLC | |
| Additional Pump(s) for derivatization system | Shimadzu | LC-20A | |
| RF colum | Non-commercial | ||
| PEEK tubing | Sigma Aldrich | Z227307 | |
| Column stoppers | Provided with column | ||
| PEEK tube cutter | Sigma Aldrich | Z290882 | |
| Analytical Scale Balance | 4-point analytical balance | ||
| Stop watch | Non-Scientific equiptment | ||
| Eluent collection vials | Any Small vial with a flat bottom will do, e.g., HPLC vials | ||
| HPLC Vials | Will depend on instrument used | ||
| Vessels for mobile phase and derivatization solution(s) | Sigma Aldrich | Z232211 | |
| General Laboratory glassware | Volumetric Flasks, pippettes, etc. Quantity and volumes will depend on sample preparation method. | ||
| Methanol | Sigma Aldrich | 34860 | |
| DPPH | Sigma Aldrich | D9132 | |
| Ammonium Acetate | Sigma Aldrich | 17836 | |
| Ammonia | Sigma Aldrich | 320145 | Corrosive |
| Acetonitrile | Sigma Aldrich | 34998 | |
| Fluorescamine | Sigma Aldrich | F9015 | |
| 4-aminoantipyrene | Acros Organics BVBA | AC103151000 | |
| Potassium ferricyanide | AnalaR | B10204-30 |
References
- Srijaranai, S., et al. Use of 1-(2-pyridylazo)-2-naphthol as the post column reagent for ion exchange chromatography of heavy metals in environmental samples. Microchem. J. 99, 152-158 (2011).
- Kubickova, A., Kubicek, V., Coufal, P. UV-VIS detection of amino acids in liquid chromatography: online post-column solid-state derivatization with Cu(II) ions. J Sep Sci. 34, 3131-3135 (2011).
- Quinto, M., Spadaccino, G., Palermo, C., Centonze, D. Determination of aflatoxins in cereal flours by solid-phase microextraction coupled with liquid chromatography and post-column photochemical derivatization-fluorescence detection. J. Chromatogr. A. 1216, 8636-8641 (2009).
- Lee, M., Lee, Y., Soltermann, F., von Gunten, U. Analysis of N-nitrosamines and other nitro(so) compounds in water by high-performance liquid chromatography with post-column UV photolysis/Griess reaction. Water Res. 47, 4893-4903 (2013).
- Niu, Y., et al. Identification of isoflavonoids in Radix Puerariae for quality control using on-line high performance liquid chromatography-diode array detector-electrospray ionization-mass spectrometry coupled with post-column derivatization. Food Res Int. 48, 528-537 (2012).
- Zacharis, C. K., Tzanavaras, P. D. Liquid chromatography coupled to on-line post column derivatization for the determination of organic compounds: a review on instrumentation and chemistries. Anal. Chim. Acta. 798, 1-24 (2013).
- Dousa, M., Brichac, J., Gibala, P., Lehnert, P. Rapid hydrophilic interaction chromatography determination of lysine in pharmaceutical preparations with fluorescence detection after postcolumn derivatization with o-phtaldialdehyde. J Pharm Biomed Anal. 54, 972-978 (2011).
- Iijima, S., et al. Optimization of an Online Post-Column Derivatization System for Ultra High-Performance Liquid Chromatography (UHPLC) and Its Applications to Analysis of Biogenic Amines. Anal Sci. 29, 539-545 (2013).
- Cunico, R. L., Schlabach, T. Comparison of Ninhydrin and o-Phthalaldehyde Postcolumn Detection Techniques for High Performance Liquid Chromatography of Free Amino. J. Chromatogr. A. 1983, 461-470 (1983).
- Donahue, E. P., Brown, L. L., Flakoll, P. J., Abumrad, N. N. Rapid Measurement of Leucine-specific Activity in Biological Fluids by Ion-exchange Chromatography and Post-column Ninhydrin Detection. J. Chromatogr. A. 571, 29-36 (1998).
- Udenfriend, S., et al. Fluorescamine: A Reagent for Assay of Amino Acids, Peptides, Proteins and Primary Amines in the Picomole Range. Science. 1972, 871-872 (1972).
- Samejima, K. Separation of Fluorescamine Derivitices of Aliphatic Diamines and Polyamines by High Speed Liquid Chromatography. J. Chromatogr. A. 96, 250-254 (1974).
- Zhang, Y., et al. Evaluation of antioxidant activity of ten compounds in different tea samples by means of an on-line HPLC-DPPH assay. Food Res Int. 53, 847-856 (2013).
- Niu, Y., et al. Identification of the anti-oxidants in Flos Chrysanthemi by HPLC-DAD-ESI/MS(n) and HPLC coupled with a post-column derivatisation system. Phytochem Anal. 24, 59-68 (2013).
- Raudonis, R., Bumblauskiene, L., Jakstas, V., Pukalskas, A., Janulis, V. Optimization and validation of post-column assay for screening of radical scavengers in herbal raw materials and herbal preparations. J. Chromatogr. A. 1217, 7690-7698 (2010).
- Raudonis, R., Raudone, L., Jakstas, V., Janulis, V. Comparative evaluation of post-column free radical scavenging and ferric reducing antioxidant power assays for screening of antioxidants in strawberries. J. Chromatogr. A. 1233, 8-15 (2012).
- Zakrzewski, R. Determination of Methimazole in Pharmaceutical Preparations using an HPLC Method Coupled with an Iodine-Azide Post-Column Reaction. J. Liq. Chrom. Rel. Technol. 32, 383-398 (2008).
- Zakrzewski, R. Development and validation of a reversed-phase HPLC method with post-column iodine-azide reaction for the determination of thioguanine. J. Anal. Chem. 64, 1235-1241 (2009).
- Gritti, F., Guiochon, G. Accurate measurements of the true column efficiency and of the instrument band broadening contributions in the presence of a chromatographic column. J. Chromatogr. A. 1327, 49-56 (2014).
- Stewart, J. T. Post cotumn derivatization methodology in high performance liquid chromatography (HPLC). Trends Anal. Chem. 1, 170-174 (1982).
- Rigas, P. G. Post-column labeling techniques in amino acid analysis by liquid chromatography. Anal. Bioanal. Chem. 405, 7957-7992 (2013).
- Frei, R. W. Reaction Detectors in Modern Liquid Chromatography. Chromatographia. 15, 161-166 (1982).
- Pravadil-Cekic, S., et al. Using Reaction Flow Chromatography for the Analysis of Amino Acid: Derivatisation With Fluorescamine Reagent. Microchem. J. , (Accepted Manuscript) (2015).
- Camenzuli, M., Ritchie, H. J., Dennis, G. R., Shalliker, R. A. Parallel segmented flow chromatography columns with multiplexed detection: An illustration using antioxidant screening of natural products. Microchem. J. 110, 726-730 (2013).
- Koleva, I. I., Niederlander, H. A. G., van Beek, T. A. An On-Line HPLC Method for Detection of Radical Scavenging Compounds in Complex Mixtures. Anal Chem. 72, 2323-2328 (2000).
- Selim, M., et al. A Two-component Post-column Derivatisation Method Utilsing Reaction Flow Chromatography. Microchem. J. 116, 87-91 (2014).
- Bigley, F. P., Grob, R. L. Determination of Phenols in Water and Wastewater by Post-column Reaction Detection High-performance Liquid Chromatography. J. Chromatogr. A. 350, 407-416 (1985).
- Camenzuli, M., Ritchie, H. J., Dennis, G. R., Shalliker, R. A. Reaction flow chromatography for rapid post column derivatisations: The analysis of antioxidants in natural products. J. Chromatogr. A. 1303, 62-65 (2013).



