Summary
يتم تقديم الإعداد التجريبي الأصلي لخلايا التدفئة في طبق الثقافة باستخدام 1.94 ميكرون الإشعاع المستمر الموجة الليزر هنا. باستخدام هذه الطريقة، والاستجابات البيولوجية للخلايا الظهارية الصباغية الظهارية (ربي) بعد التعرض الحراري مختلفة يمكن التحقيق فيها.
Abstract
يتم عرض طريقة الأصلي لتسخين الخلايا المستزرعة باستخدام 1.94 ميكرون المستمر الموجة ليزر ثيوليوم للتقييم البيولوجي هنا. يتم امتصاص إشعاع الليزر ثوليوم بقوة عن طريق الماء، ويتم تسخين الخلايا في الجزء السفلي من طبق الثقافة من خلال نشر الحراري. يتم تعيين الألياف الليزر التي يبلغ قطرها 365 ميكرون حوالي 12 سم فوق طبق الثقافة، من دون أي البصريات، بحيث قطر شعاع الليزر يكاد يعادل تقريبا القطر الداخلي للطبق الثقافة (30 ملم). من خلال الحفاظ على كمية متسقة من وسط الثقافة في كل تجربة، فمن الممكن أن تشعي الخلايا مع زيادة درجة الحرارة استنساخه للغاية.
لمعايرة زيادة درجة الحرارة وتوزيعها في طبق ثقافة خلية واحدة لكل إعداد الطاقة، تم قياس درجة الحرارة خلال 10 ثانية من التشعيع في مواقع مختلفة وعلى المستوى الخلوي. تم تمثيل توزيع درجة الحرارة باستخدام برنامج الرسومات الرياضيةالبرنامج، ونمطه عبر طبق الثقافة كان في شكل غاوس. بعد تشعيع الليزر، يمكن إجراء تجارب بيولوجية مختلفة لتقييم استجابات الخلايا المعتمدة على درجة الحرارة. في هذه المخطوطة، يتم تقديم تلطيخ البقاء على قيد الحياة ( أي تمييز الحية، موت الخلايا المبرمج، والخلايا الميتة) للمساعدة في تحديد درجات حرارة عتبة موت الخلايا المبرمج والموت بعد نقاط مختلفة في الوقت المناسب.
مزايا هذا الأسلوب هي دقة درجة الحرارة ووقت التدفئة، فضلا عن كفاءة عالية في خلايا التدفئة في طبق ثقافة الخلية بأكملها. وعلاوة على ذلك، فإنه يسمح للدراسة مع مجموعة واسعة من درجات الحرارة والمدد الزمنية، والتي يمكن أن تسيطر عليها بشكل جيد من قبل نظام التشغيل المحوسب.
Introduction
فهم الاستجابات البيولوجية الخلية المعتمدة على درجة الحرارة هو من أهمية كبيرة لنجاح العلاجات هيبرثرميا. تصوير الشبكية الضوئي بالليزر مع الليزر الحراري، المستخدمة في طب العيون، هي واحدة من العلاجات الليزر الأكثر استقرارا في الطب. الضوء المرئي، ومعظمهم من الأخضر إلى الموجات الصفراء، ويستخدم في علاج الشبكية بالليزر. يتم امتصاص الضوء للغاية من قبل الميلانين في الشبكية الخلايا الصبغية الظهارية (ربي)، والتي تشكل أحادي الطبقة خلية أحادية الشبكية. كان هناك اهتمام مؤخرا بين الأطباء والباحثين في أشعة خفيفة جدا الحراري (التصوير الضوئي تحت المرئية) كاستراتيجية علاجية جديدة لأنواع مختلفة من اضطرابات الشبكية 1 ، 2 . بعد هذا الاتجاه، اهتمامنا هو في الخلايا تحت رمي التدفئة ربي تحت التحكم في درجة الحرارة دقيقة، وهي تقنية تسمى الحرارة الضوئية التي تسيطر عليها العلاج (تك-بت).
البصريات الأخيرةوقد سمح التكنولوجيا الصوتية من معهدنا لقياس الوقت الحقيقي للزيادات في درجات الحرارة في المواقع المشععة في شبكية العين. وهذا يتيح التحكم في زيادة درجة الحرارة أثناء التشعيع 3 . ومع ذلك، منذ فرط الحرارة شبه قاتلة على شبكية العين، والناجمة عن خلايا ربي التدفئة دون قاتلة، لم ينظر في السابق بسبب استحالة قياس والتحكم في درجة الحرارة، واستجابات الخلايا المعتمدة على درجة الحرارة من الخلايا ربي التالية أشعة الليزر الحرارية لديها ودرس القليل جدا حتى الآن. وعلاوة على ذلك، ليس فقط الفرق في درجة الحرارة لم تناقش بالتفصيل، ولكن أيضا الفرق في سلوك الخلية من الخلايا على قيد الحياة بعد تشعيع قاتلة وقاتلة. لذلك، لجمع الأدلة العلمية على العلاجات القائمة على تك-بت، ونحن نهدف إلى توضيح الاستجابات البيولوجية الخلية ربي تعتمد على درجة الحرارة وآلياتها باستخدام في المختبر الاجهزة التجريبية.
ل tالغرض من ذلك، فمن الضروري إنشاء الإعداد خلية التدفئة التي تلبي الشروط التالية: 1) إمكانية لزيادة درجة الحرارة بسرعة، 2) على وجه التحديد الوقت ودرجة الحرارة التي تسيطر عليها، و 3) عدد كبير نسبيا من الخلايا فحصها للتجارب البيولوجية . أما بالنسبة لطريقة التسخين، فإن الليزر السريري، مثل ليزر Nd.YAG المضاعف (532 نانومتر)، لسوء الحظ غير مناسب لتدفئة ثقافة الخلايا. ويرجع هذا إلى انخفاض عدد الميلانوسومات في خلايا ربي المستزرعة. قد يكون امتصاص ضوء الليزر غير متجانسة، وتزداد درجة الحرارة على المستوى الخلوي بين التجارب، حتى عندما تشعع بنفس القدرة الإشعاعية. وقد ذكرت العديد من الدراسات السابقة استخدام ورقة سوداء تحت قاع الطبق خلال التشعيع 4 أو استخدام ميلانوسومات إضافية التي هي فاجوسيتيزد من قبل الخلايا ثقافة قبل التجارب 5 ، 6 . العديد منأجريت الدراسات البيولوجية في المختبر لتقييم استجابات الخلايا التي يسببها ارتفاع الحرارة باستخدام لوحة ساخنة، حمام ماء، أو حاضنة كو 2 مع إعداد درجة الحرارة 7 . تتطلب هذه الأساليب فترة تدفئة طويلة لأنها تستغرق بعض الوقت ( أي عدة دقائق) للوصول إلى درجة الحرارة المطلوبة. وعلاوة على ذلك، باستخدام هذه الأساليب، فإنه من الصعب الحصول على التاريخ الحراري مفصل ( أي درجة الحرارة مضروبا في الوقت) على المستوى الخلوي. وعلاوة على ذلك، قد تختلف درجة الحرارة بين الخلايا في مواقع مختلفة في طبق ثقافة واحدة بسبب انتشار درجة الحرارة المتغيرة. في معظم الحالات، لم تؤخذ هذه المعلومات الزمنية ودرجة الحرارة المكانية أثناء ارتفاع الحرارة بعين الاعتبار للتحليلات البيولوجية، على الرغم من أن استجابة الخلايا البيولوجية قد تتأثر بشكل حاد من درجة الحرارة والمدة الزمنية لدرجة الحرارة المتزايدة.
للتغلب على هذه المشاكل، كونتيتم استخدام ليزر ثيوليوم الموجة الجديدة هنا لتسخين الخلايا. يتم امتصاص إشعاع الليزر ثوليوم (λ = 1.94 ميكرون) بقوة 8 ، ويتم تحفيز الخلايا في الجزء السفلي من طبق الثقافة حراريا فقط من خلال نشر الحراري. يتم تعيين الألياف الليزر مع قطر 365 ميكرون حوالي 12 سم فوق طبق الثقافة، من دون أي البصريات بينهما. قطر شعاع الليزر يتباعد بحيث يكاد يكون ما يعادل القطر الداخلي للطبق الثقافة (30 ملم) على سطح وسط الاستزراع.مع كمية ثابتة من الوسط الثقافي، فمن الممكن أن تشعي الخلايا مع زيادة درجة الحرارة من التكرار عالية. وتتيح إعدادات القدرة المتغيرة التشعيع بما يصل إلى 20 وات، ويمكن زيادة درجة الحرارة المتوسطة على المستوى الخلوي حتى ΔT ≈ 26 ° C في 10 ثوان.
من خلال تعديل ظروف التشعيع، فمن الممكن أيضا لتغيير شعاع الليزر الشخصي لتغيير ديستريبوتي درجة الحرارةعن، إلى داخل، أداة تعريف إنجليزية غير معروفة، استنبات، ديش. على سبيل المثال، فمن الممكن التحقيق مع توزيع الحرارة مثل غاوس، كما هو الحال في الدراسة الحالية، أو مع توزيع درجة الحرارة متجانسة. هذا الأخير قد يكون مفيدا للتحقيق في آثار استجابات الخلايا المعتمدة على درجة الحرارة بشكل أكثر تحديدا للزيادات في درجة الحرارة شبه القاتلة، ولكن ليس لضغوط موت الخلايا أو استجابات التئام الجروح.
وإجمالا، يمكن أن تشعيع ثيوليوم الليزر التحقيق في أنواع مختلفة من العوامل البيولوجية، مثل التعبير الجيني / البروتين، حركية الموت الخلية، تكاثر الخلايا، وتطوير وظائف الخلية، بعد التعرض الحراري مختلفة.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. ربي خلية الثقافة
- عزل الخلايا ربي من عيون الخنازير
- الحصول على عيون الخنازير طازجة مستخرج من المسلخ المحلي. إبقائها باردة (4 درجة مئوية) وفي بيئة مظلمة.
- إزالة الأنسجة خارج الخلية مع مقص ونقع العينين في محلول مطهر لمدة 5 دقائق.
- وضع العينين في محلول ملحي الفوسفات معقم دون الكالسيوم والمغنيسيوم (بس (-)) حتى الاستخدام.
- باستخدام مشرط، اختراق الصلبة في حوالي 5 ملم الخلفي إلى حوف القرنية. استئصال الجزء الأمامي كله من العين عن طريق قطع مع مقص طوال الطريق، موازية لحوف القرنية.
- إزالة الجزء الأمامي من العين ( أي القرنية والعدسة) والجسم الزجاجي. إضافة 1 مل من برنامج تلفزيوني (-) وإزالة بلطف الشبكية العصبية.
ملاحظة: هذا "كوب العين"، تتكون من الصلبة، المشيمية، و ربي، هو الآن على استعداد. - إضافة قبل تحسنت (37 درجة مئوية) 0.25٪ التربسين في Pبس (-) إلى كوب العين. ضبط مستوى الصوت بحيث يتم ملء حوالي 80٪ من كوب العين مع هذا الحل التربسين.
- احتضان كوب العين مع الحل التربسين في 5٪ كو 2 حاضنة عند 37 درجة مئوية لمدة 10 دقيقة.
- إزالة كوب العين من الحاضنة واستبدال الحل التربسين 0.25٪ مع برنامج تلفزيوني (-) محلول مع 0.05٪ التربسين + 0.2٪ إيثيلينديامينتيتراكيتيك حمض تيتراصوديوم الملح (إدتا · 4N). احتضان كوب العين في الحاضنة لمدة 45 دقيقة.
ملاحظة: بعد 45 دقيقة، فإن الخلايا ربي تكون إما تعلق فضفاضة فقط على غشاء بروك أو فصلها بالفعل وتطفو في الحل التربسين إدتا. - جمع الخلايا ربي بواسطة بيبتينغ لطيف. جمع الخلايا والحل في أنبوب مخروطي مليئة 10 مل من الوسط الثقافي (دمم ارتفاع الجلوكوز مع L- الجلوتامين)، بما في ذلك مصل الخنازير 10٪، المضادات الحيوية / أنتيميكوتيك، وبيروفات الصوديوم (1 ملم).
ملاحظة: المصل قد تحييد تأثير التربسين. - أجهزة الطرد المركزيتعليق خلية في 400 x ج لمدة 5 دقائق في درجة حرارة الغرفة.
- إزالة طاف وإضافة 10 مل من المتوسطة الطازجة. أجهزة الطرد المركزي مرة أخرى في ظل نفس الظروف لمدة 5 دقائق.
- إزالة طاف وإضافة وسط جديد، بحيث نتائج تركيز الخلية في 5 × 10 5 خلايا / مل (يحددها عد الخلايا باستخدام عدادة الكريات). مزيج جيدا عن طريق بيبتينغ لطيف.
- توزيع تعليق الخلية في أطباق ثقافة الخلية. استخدام 3 مل لكل 60 ملم قطر طبق الثقافة.
ملاحظة: تسمى هذه الثقافة مرور الصفر (P0). - الحفاظ على الخلايا في 5٪ كو 2 حاضنة عند 37 درجة مئوية. تغيير نصف المتوسطة مكيفة إلى المتوسطة الطازجة كل يوم ثان.
- الثقافة الفرعية (الخطوة 1.2) إذا أصبح متموجة.
- ثقافة فرعية من ثقافة الخلايا ربي
- إزالة الوسط والثقافة وشطف الخلايا مرتين مع برنامج تلفزيوني (-).
- احتضان الخلايا مع برنامج تلفزيوني (-) حل مع 0.05٪ التربسين + 0.2٪ إدتا طنا 5٪ كو 2 حاضنة عند 37 درجة مئوية لمدة 5 دقائق.
- فصل الخلايا ربي بواسطة بيبتينغ لطيف وجمع تعليق خلية في أنبوب مخروطي مليئة 10 مل من وسط الثقافة، بما في ذلك 10٪ مصل الخنازير.
- الطرد المركزي تعليق خلية في 400 x ج لمدة 5 دقائق في درجة حرارة الغرفة.
- إزالة طاف وإضافة وسط ثقافة جديدة، مما يجعل تركيز الخلية 5 × 10 5 خلايا / مل (يحددها عد عدد الخلايا مع عدادة الكريات). توزيع الخلايا في أطباق ثقافة قطرها 60 ملم جديد، كما هو موضح في الخطوة 1.1.13.
ملاحظة: ثقافة الخلية هي الآن مرور 1 (P1). - بعد التوصل كونفلنسي، ثقافة فرعية ثقافة P1 إلى P2، وذلك باستخدام نفس الإجراء الموصوف في الخطوات 1.2.1-1.2.5. من ثقافة P2، البذور الخلايا على أطباق ثقافة أصغر (القطر الداخلي 30 ملم) بدلا من أطباق ثقافة قطرها 60 ملم.
- للتجارب، استخدم P2 أو P3 الثقافات.
2. ثولأيوم الليزر التشعيع
- بناء محطة التشعيع
- توصيل جهاز ليزر ثوليوم (1.94 ميكرون، نطاق الطاقة: 0-20 W) إلى 0.22-نا، 365 ميكرون الألياف قطرها الأساسية.
- ميكانيكيا إصلاح طرف الألياف إلى الذراع المعدنية التي يتم تثبيت أفقيا إلى آخر المعدن الرأسي من محطة التشعيع. وضع آخر عمودي بحيث يقع غيض من الألياف الليزر فوق لوحة الساخنة التي طبق الثقافة الخلية هو أن توضع أثناء التشعيع.
- وضع ورقة بيضاء على لوحة الساخنة وتحويل شعاع تهدف على (λ = 635 نانومتر، كحد أقصى = 1 ميغاواط، والقطر على مستوى الورق ≈ 30 مم). وضع علامة على محيط شعاع تهدف على ورقة بيضاء بحيث أن الموقف حيث يتم وضع طبق الثقافة خلال التشعيع هو معروف.
ملاحظة: قد تكون Z- طائرة من طرف الألياف قابلة للتغيير. دون أي البصريات التصوير إضافية، قطر بقعة الليزر على الطائرة ثقافة الخلية، وضعت 12 سم تحت طرف الألياف، ط ق حوالي 30 ملم، وهو ما يعادل تقريبا إلى القطر الداخلي للطبق ثقافة الخلية. ويرد الرسم التخطيطي للإعداد في الشكل 1 .

الشكل 1: صورة تخطيطية لمحطة أشعة الليزر ثوليوم. يتم وضع طبق الثقافة على لوحة التدفئة. يتم وضع الخلايا 12 سم تحت طرف الألياف الليزر ثوليوم بحيث حجم شعاع يكاد يكون متطابقا إلى القطر الداخلي للطبق الثقافة (حوالي 30 ملم). يتم التحكم في إجراء تشعيع الليزر بواسطة روتين تسيطر عليه الزمن من منصة تصميم النظام حسب الطلب. يجب تحديد إعداد الطاقة قبل بدء تشغيل برنامج التشعيع. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
- بدء = "2">
- أشعة الليزر من ثقافة الخلية
- 1 ساعة قبل التشعيع، واستبدال وسط الثقافة تماما مع 1.2 مل من المتوسطة الطازجة.
ملاحظة: هذه خطوة حاسمة ويجب اتباعها بدقة. - وضع محطة التشعيع ( أي لوحة الساخنة وآخر التي لإصلاح الألياف الليزر) على مقاعد البدلاء نظيفة.
- إزالة طبق ثقافة الخلية من الحاضنة ووضعه على موقف ملحوظ على طبق ساخن (الخطوة 2.1.3).
- ارتداء نظارات واقية. بدوره على ثيوليوم الليزر. تعيين السلطة على النحو المطلوب على جهاز الليزر (الانضباطي من 0-20 W). تشغيل الانبعاثات.
- بدء نظام تصميم النظام الذي يتحكم في أشعة الليزر وبروتوكول توقيت (ملف تكميلي).
- مباشرة بعد وضع طبق الثقافة على طبق ساخن، انقر فوق "وقت التدفئة قبل" لبدء الموقت لمدة 140 ثانية ("قبل التدفئة الوقت 1")؛ وهذا سيبقي على درجة حرارة متوسطة الثقافة في 37 درجة مئوية قبل التشعيع.
مالحظة: بعد 140 ثانية، سيتم تشغيل صوت تنبيه، وسيبدأ الموقت التالي) "وقت التسخين المسبق 2" (بالعد تلقائيا 8 ثوان. خلال هذا ث 8، الفاحص قد فتح طبق الثقافة. بعد 148 ثانية من ما قبل التسخين، سيتم إجراء 10 أشعة الليزر طويلة s على ثقافة الخلية تلقائيا. في حالة الطوارئ، تجهيز جهاز الليزر مع زر الإقلاع عن القوة لوقف الليزر على الفور. هذه خطوة حاسمة ويجب اتباعها بدقة. نقطة خاصة من الحذر تتعلق بفتح غطاء الطبق قبل التشعيع، في بداية 8 ثانية قبل التسخين الوقت. فتح الغطاء قد يبرد السطح المتوسط بسرعة كبيرة. - بعد التشعيع، وضع الغطاء مرة أخرى على طبق الثقافة، وترك طبق الثقافة على طبق ساخن لمدة 7 ثانية، ووضعه مرة أخرى في 5٪ كو 2 حاضنة عند 37 درجة مئوية.
- 1 ساعة قبل التشعيع، واستبدال وسط الثقافة تماما مع 1.2 مل من المتوسطة الطازجة.
- قياس توزيع درجة الحرارة فيالمستوى الخلوي (معايرة درجة الحرارة)
- جعل ثقوب صغيرة (حوالي 300 ميكرون في القطر) على مقربة من أسفل على أربعة جوانب (كل 90 درجة) من 30 ملم طبق الثقافة قطرها (بدون خلايا). استخدام غيض من إبرة (20G) ساخنة مع الموقد بنسن. ختم الثقوب مع شريط العزل الكهربائي من الخارج وجعل ثقب صغير مع إبرة دقيقة بحيث يمكن إدراج فقط الحرارية الحرارية (200 ميكرون في القطر) من خلال هذا الثقب تحت ظروف مضادة للماء.
- في الخارج من أسفل طبق الثقافة، ورسم 2 عمودي أقطار وتعيين نقطة العبور ( أي مركز الجانب السفلي) كما الإحداثيات صفر (0). علامة كل 3 ملم شعاعي إلى الخارج من طبق ( أي 0 و 3 و 6 و 9 و 12 و 15 ملم) في كل اتجاه على طول خطوط ( الشكل 2 ، النقاط الزرقاء). ينبغي أن يكون عدد النقاط 21 في المجموع.
- ملء طبق ثقافة الخلية مع 1.2 مل من وسط ثقافة جديدة. وضع الثقافة دإيش على لوحة ساخنة عند 37 درجة مئوية، إدراج الحرارية الحرارية (200 ميكرون في القطر) في الحفرة الجانبية، ووضع طرف حساسة على موقف ملحوظ لقياسها.
- ارتداء نظارات واقية. بدوره على الليزر ثوليوم وتعيين يدويا السلطة (بين 0 و 20 W، في 0.1-W الزيادات) من الليزر ابتكار.
مالحظة: بالنسبة لمعايرة درجة الحرارة، ينبغي أن تكون القياسات ذات القدرة بزيادات قدرها 3 واط كافية. - قم بتشغيل نظام تصميم النظام وانقر على زر "بدء درجة الحرارة الاستحواذ" (ملف تكميلي) لبدء قياس درجة الحرارة.
- إجراء نفس الإجراء كما هو الحال في الخطوة 2.2.6.
ملاحظة: يقيس برنامج التحكم درجة الحرارة الحرارية إدراج كل 100 مللي ثانية ويظهر تطور درجة الحرارة أثناء التشعيع في واجهة المستخدم الرسومية. - إجراء هذه الإجراءات لجميع نقاط القياس 21 وفي إعدادات الطاقة المختلفة. كرر الإجراء كله ثلاث مرات لجميع النقاط ولجميع السلطة سيتينغس لتحقيق بيانات موثوقة.
- تصدير بيانات درجة الحرارة كبيانات كسف، والتي يمكن تحويلها في نهاية المطاف إلى جدول بيانات. متوسط درجة الحرارة القصوى في نهاية التشعيع للقياسات ثلاثية في كل نقطة. متوسط القيم من النقاط على نفس الدائرة (4 نقاط في المجموع، باستثناء النقطة المركزية).
- رسم درجة الحرارة القصوى التي تم الحصول عليها تم الحصول عليها على الرسم البياني، مما يجعل المسافة من وسط الطبق (مم) كمحور س وزيادة درجة الحرارة (ΔT، درجة مئوية) كمحور ص. استخدام وظيفة تناسب برنامج البرمجيات الرياضية لتناسب نموذج غاوس إلى البيانات الخام. إنشاء توزيع درجة الحرارة مناسبا غاوس.

الشكل 2: نقاط لمعايرة درجة الحرارة في صحن ثقافة خلية واحدة. تم قياس بيانات درجة الحرارة في المركز و 5نقطة شعاعي أكثر من 4 زوايا مختلفة (النقاط الزرقاء). الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
3. التقييمات البيولوجية لاستجابات الخلية بعد الإشعاع الحراري المختلفة
- تقييم بقاء الخلية ( أي، المعيشة، موت الخلايا المبرمج، والموتى) بعد إعدادات الطاقة المختلفة وتحديد عتبة الموت الخلية
- في النقاط الزمنية المشار إليها ( أي 3، 24، و 48 ساعة بعد التشعيع)، وغسل الخلايا مع بس (-) واستخدام مجموعة متوفرة تجاريا لتقييم بقاء الخلية ( أي حيوية، موت الخلايا المبرمج، ميتة) بروتوكول.
- إعداد حل تلطيخ عن طريق إضافة 5 ميكرولتر من إيسوثيوسيانات فلوريسئين (فيتس) -انكسين الخامس، 5 ميكرولتر من هوموديمر إيثيديوم الثالث، و 5 ميكرولتر من هويشت 33342 إلى 100 ميكرولتر من العازلة ملزمة 1X (كلها هي عدةمكونات). إعداد ما يكفي من حل تلطيخ لتغطية الخلايا. احتضان الخلايا لمدة 15 دقيقة.
- غسل ثقافة الخلية مع العازلة ملزمة مرتين، واستبدال العازلة ملزمة مع برنامج تلفزيوني (-)، وتعيين الثقافة على خشبة المسرح من المجهر مضان.
- تبديل مسار الضوء إلى عدسة العين، حدد 4 '، 6-دياميدين-2-فينيليندول (دابي) تصفية، بدوره على ضوء الإضاءة، والعثور على الطائرة ركزت مع الهدف 4x.
- تغيير مسار الضوء إلى الكاميرا، والعثور على الصورة على شاشة الكمبيوتر في برامج التصوير المجهر، وضبط التركيز.
- استخدام وظيفة غرزة ( أي وظيفة لتسجيل صور متعددة عبر الطبق ثم قم بإنشاء صورة واحدة كبيرة) من البرنامج المجهر محددة للحصول على صورة مضان من طبق ثقافة الخلية بأكملها. استخدام 3 مجموعات تصفية مختلفة - دابي، فيتس، وتيترامثيلدرهودامين (تريتك) -to صورة هوشست 33342 خلايا إيجابية (جميع نوى الخلية)، فيتس-أنيكسين V- بوسيتيفي الخلايا (موت الخلايا المبرمج)، و إيثيديوم هوموديمر خلايا إيجابية إي (ميت)، على التوالي.
- قياس دائرة نصف قطرها (مم) من القتلى (إثيديوم هوموديمر إي إيجابية) المنطقة ونصف قطرها الخارجي / الداخلي من المستمدة (أنيكسين الخامس إيجابية) منطقة شكل الفرقة في الثقافات الخلية الملون. تطبيق هذه الشعاع على وظيفة غاوس المجهزة لتوزيع درجة الحرارة لإعداد الطاقة المقابلة. حساب درجة الحرارة بالضبط على حافة منطقة ميتة أو موت الخلايا المبرمج لتوضيح درجات الحرارة العتبة للموت الخلايا وتغير موت الخلايا المبرمج.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
توزيع درجة الحرارة بعد إعدادات الطاقة المختلفة
تم رصد جميع التطورات درجة الحرارة لكل تشعيع واحد في معايرة درجة الحرارة. من هذه البيانات، تم الحصول على درجة الحرارة القصوى عند النقطة المقاسة وتعرف بأنها T ماكس (° C). كما هو مبين في الشكل 3A ، تم تنفيذ البرنامج في الوقت عند وضع طبق الثقافة على لوحة التدفئة. بعد 140 ثانية "قبل التسخين الوقت 1"، والتي كانت مطلوبة لأرشفة درجة حرارة متوسطة مستقرة عند 37 درجة مئوية، تمت إزالة غطاء طبق الثقافة خلال 8 ثانية "قبل التسخين الوقت 2." في نهاية "قبل التدفئة الوقت 2،" انبعاث الليزر بدأت تلقائيا. هذا المنحنى هو تقدم درجة الحرارة التمثيلية لمدة 10 ثانية تشعيع. خلال التشعيع، زادت درجة الحرارة، وعلى الفور بعد انبعاث الليزرإيقاف، بدأت درجة الحرارة في الانخفاض. تم تعريف درجة الحرارة القصوى في وسط طبق الثقافة في هذه الدراسة ك T ماكس (درجة مئوية). كان T ماكس يتناسب مع قوة الليزر ( الشكل 3B ). ويبين الشكل 3C توزيع درجة الحرارة القصوى لكل سلطة عبر طبق الثقافة. التوزيعات هي على شكل جرس، كما هو مبين في الشكل 3C ، وتتناسب مع وظيفة غاوس وفقا للمعادلة التالية:
t (r) = t بيس + A · 
حيث r، t قاعدة ، a، و w الوقوف للمسافة من مركز (مم)، أدنى درجة الحرارة للمنحنى، السعة، وعرض منحنى، على التوالي. المعلمات (t قاعدة ، A، و W) من G المجهزةالمنحنى الروسي لكل إعداد السلطة، وهي لكل T ماكس ، وترد في الجدول بجانب الرسم البياني.
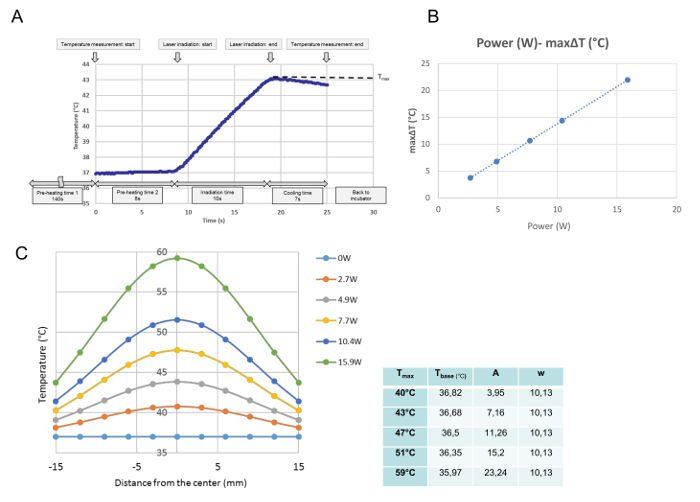
الشكل 3: بيانات معايرة درجة الحرارة. ( A )، العلاقة النسبية بين طاقة الليزر و ΔT ماكسيمال في الموضع المركزي لثقافة الخلية ( B )، وتوزيعات درجة الحرارة عبر صحن الثقافة بعد إعدادات الطاقة المختلفة (C). (A) يتم تنفيذ البرنامج من الوقت الذي يتم وضع طبق الثقافة على لوحة التدفئة. بعد 140 ثانية من "وقت التسخين المسبق 1"، الذي هو مطلوب لأرشفة درجة حرارة متوسطة مستقرة عند 37 درجة مئوية، يتم إزالة غطاء طبق الثقافة لمدة 8-S "قبل التسخين الوقت2. "في نهاية" وقت التسخين المسبق 2 "، يبدأ انبعاث الليزر تلقائيا، وهذا المنحنى هو تقدم درجة الحرارة التمثيلية في الموضع المركزي خلال 10-s التشعيع عند 4.9 W. أثناء التشعيع، يزيد من درجة الحرارة، و مباشرة بعد أن يتم إيقاف انبعاث الليزر، تبدأ درجة الحرارة في الانخفاض، ويتم الحصول على درجة الحرارة القصوى في نهاية التشعيع، الذي تم تعريفه في هذه الدراسة على أنها T ماكس (° C). (B) قوة الليزر والأقصى (ΔT كحد أقصى ) تتناسب مع (C) وظائف غاوس المجهزة لتوزيعات درجة الحرارة المقاسة عبر طبق الثقافة، وتظهر المعلمات للوظائف، التي تم تحديدها مع برنامج رياضي، في الجدول على جانب الرسم البياني الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
بقاء الخلية بعد التشعيع الحراري
كما هو مبين في الشكل 4A ، وهناك ثلاثة أنماط تلطيخ مختلفة تشير إلى بقاء الخلية بعد تشعيع الليزر: 1) لا أنيكسين V / إثيديوم هوموديمر إي إيجابية ( أي يعيش فقط)، 2) أنيكسين الخامس إيجابية في المركز ( أي تقريبا فقط موت الخلايا المبرمج في وقت مبكر فقط)، و 3) إيثيديوم هوموديمر الثالث إيجابية في المركز ( أي الخلايا الميتة) محاطة بالخلايا المبرمج على الحدود بين القتلى والخلايا الحية ( الشكل 4B ). حجم منطقة ميتة / موت الخلايا المبرمج يعتمد بشكل عام على T ماكس والوقت بعد التشعيع تصل إلى 48 ساعة بعد التشعيع. لم يتم الكشف عن أي تغيير جدوى واضح في الثقافات المشع مع T ماكس ≤43 درجة مئوية. ويمكن ملاحظة التغيير الوحيد في نهاية المبكرة (3 ساعات)، تليها في وقت متأخر موت الخلايا بعد التشعيع مع T ماكس = 47 درجة مئوية. تم العثور على موت الخلايا مباشرة أو مبكرة (تصل إلى 3 ساعات) في الثقافات المشع مع T كحد أقصى ≥ 51 درجة مئوية (الجدول 1).

الشكل 4: نمط تلطيخ الجدوى بعد إعدادات الطاقة المختلفة (A) وصورة نموذجية على حافة الميت ومنطقة موت الخلايا المبرمج بعد الإشعاع بالليزر القاتلة (B).
(A) ثلاثة أنماط من تلطيخ يمكن أن يحدث، اعتمادا على درجة الحرارة. (B) منطقة موت الخلايا المبرمج (فيتس-أنيكسين V إيجابية: الأخضر) حول المنطقة الميتة (إيثيديوم هوموديمر إي إيجابي: الأحمر). جميع الخلايا إيجابية ل هويشت 33342 (الأزرق)، والخلايا ذات النوى الزرقاء هي الخلايا الحية. أخذت الصورة 24 ساعة بعد تشعيع في T ماكس = 59 درجة مئوية. بار = 100 ميكرون./files/ftp_upload/54326/54326fig4large.jpg "تارجيت =" _ بلانك "> الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الجدول 1: أنيكسين V واستجابات إيثيديوم هوموديمر الثالث في درجات حرارة ومواعيد مختلفة.
تحديد درجة حرارة العتبة للموت الخلوي
تم قياس متوسط أشعة المنطقة الميتة (الحمراء) ومنطقة الأبوطوز (الأخضر) وتطبيقها على الدالة الغوسية لتوزيع درجة الحرارة لتحديد درجات حرارة ذروة العتبة لموت الخلايا وموت الخلايا المبرمج بعد 10 ثوان من التشعيع. ووفقا لهذا التحليل، كانت درجات الحرارة الدنيا لعتبة موت الخلايا الكاملة 3 ساعات و 24 ساعة و 48 ساعة بعد التشعيع 54.0 درجة مئوية و 50.9 درجة مئوية و 50.1 درجة مئوية على التوالي. متوسط ثريشووكانت درجة الحرارة لد لتغير الخلايا المبرمج أقل بنحو 2 - 3 درجات مئوية، مع درجات حرارة العتبة لمدة 3 ساعات و 24 ساعة و 48 ساعة عند 51.7 درجة مئوية و 48.0 درجة مئوية و 47.0 درجة مئوية على التوالي ( الشكل 5 ).
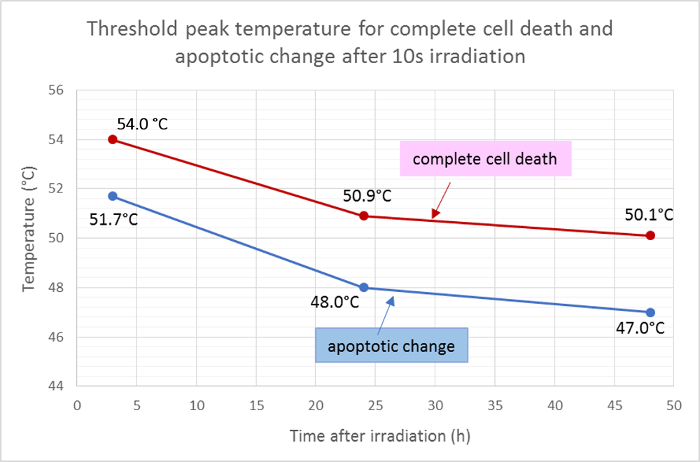
الشكل 5: درجات حرارة عتبة موت الخلايا المبرمج والموت الخلوي.
متوسط درجات حرارة العتبة لموت الخلايا كاملة (إيجابية ل هويشت 33342، أنيكسين الخامس، و إيثيديوم هوموديمر الثالث) وموت الخلايا المبرمج (إيجابية فقط ل هويشت 33342 و أنيكسين الخامس) في نقاط زمنية مختلفة في بعد التشعيع، محسوبة من نتائج تلطيخ البقاء مضان . الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
في مناقشة الاستجابات الخلوية البيولوجية ذات الصلة بالحرارة، ليس فقط درجة الحرارة، ولكن أيضا المدة الزمنية لدرجة الحرارة المتزايدة، من الأهمية، لأن معظم العمليات الكيميائية الحيوية تعتمد على الوقت. ولا سيما في مجال ارتفاع الحرارة الناجم عن الليزر في طب العيون، ويرجع ذلك إلى فترة زمنية قصيرة - من ميلي ثانية إلى ثانية - فمن الصعب التحقيق في الآثار الحرارية الخلوية مع التحكم في درجة الحرارة دقيقة. ولذلك، فإن إعداد أشعة الليزر مناسبة لنموذج ثقافة الخلية ومع نظام التشغيل الذي يسمح درجة الحرارة الصارمة والوقت التحكم هو المطلوب. التقييم البيولوجي لاستجابات الخلايا بعد التعرض الحراري، مثل التعبير عن البروتين أو إفراز، يتطلب التقييمات الكمية المتكررة على عدد كاف من الخلايا المتضررة. وكان هذا عقبة أمام الدراسات باستخدام البقع الليزر عدة مئات من ميكرومتر في القطر، كما هو الحال في العلاجات السريرية. التحليل الكمي في بقعة ليزر واحد هو بو جداrdensome. في هذه الدراسة، بذلت محاولات لتحقيق هذه المطالب قدر الإمكان. باستخدام 1.94 ميكرون الطول الموجي المستمر الموجة ليزر الثوليوم مع برنامج مراقبة التشعيع، يمكن إجراء ارتفاع درجة الحرارة الزمنية في ثقافة خلية كاملة في غضون فترة زمنية قصيرة. منذ يمكن تعديل توزيع درجة الحرارة عن طريق تغيير مسار الضوء، ويمكن إجراء أنواع مختلفة من التجارب ذات الصلة ارتفاع الحرارة باستخدام هذا الإعداد.
الحد من التقنية المعروضة هو استحالة إجراء قياسات درجة الحرارة في وقت واحد خلال أشعة الليزر من الخلايا. منذ استخدام المزدوجات الحرارية ليست مناسبة لثقافات الخلايا المعقمة، يجب إجراء معايرة درجة الحرارة بشكل منفصل عن تشعيع الخلية. وبالنظر إلى الاختلافات المحتملة في انتاج الطاقة الليزر، والقياسات في الوقت الحقيقي درجة الحرارة خلال كل تشعيع الليزر سيكون مثاليا لتقييم مباشرة الاستجابات الخلوية المقابلة لالجرعة الحرارية. وعلاوة على ذلك، تم إنشاء توزيع درجة الحرارة المستخدمة هنا من خلال الاستيفاء البيانات على أساس القياسات في 21 نقطة على طبق الثقافة وفي العديد من إعدادات الطاقة المختلفة. ولذلك، للتغلب على هذه القيود والنقاط الحاسمة، هو هدفنا لتطوير طريقة بديلة تسمح لقياس درجة حرارة طبق الثقافة في حين يتم تنفيذ أشعة الليزر. ونحن نهدف أيضا الحصول على المعلومات درجة الحرارة المكانية في آن واحد. التصوير بالأشعة تحت الحمراء (الحراري) هو أحد الطرق الممكنة لقياس درجة الحرارة خلال أشعة الليزر 10 . ميزة كبيرة من هذا الأسلوب هو قياس درجة الحرارة في الوقت الحقيقي على المستوى الخلوي لكل تشعيع. يمكن أن تكون الاستجابات البيولوجية الخلية اللاحقة دائما على حدة مقارنة مع تاريخ درجة الحرارة أثناء التشعيع. وبالنظر إلى فعالية التكلفة وسهولة الاستخدام، ومع ذلك، باستخدام الحرارة لتجارب التدفئة الخلية غير ممكن لكل لابوراتأوري.
في طريقة باستخدام ليزر ثيوليوم في الطول الموجي 1.94 ميكرون، يتم تسخين المياه في طبق ثقافة الخلية في سطحه، وتستخدم الحرارية نشر والحمل الحراري لتسخين الخلايا. ارتفاع وسط الثقافة في هذا الإعداد التشعيع، مع 1.2 مل من وسط الثقافة، هو 935 ميكرون في الموضع المركزي (من القياس السابق باستخدام التصوير المقطعي التماسك البصري). مستوى امتصاص ثيوليوم الليزر في الماء مرتفع جدا (معامل الامتصاص: 127 سم -1 عند 35 درجة مئوية)، و 72٪ من الضوء يمتص في أول 100 ميكرون من وسط الاستزراع. لا يوجد تقريبا أي امتصاص (0.0007٪) على عمق 935 ميكرون.
من المهم أن نلاحظ أن واحدة من النقاط الحرجة في البروتوكول هو إضافة نفس الكمية من المتوسطة (1200 ميكرولتر) لكل تشعيع. استخدام كميات مختلفة من الوسط الثقافي قد يؤدي إلى اختلافات الارتفاع، والتي قد تسبب اختلافات في درجة الحرارة طنكريس من الخلايا. النقطة الحرجة الثانية تتعلق بتوقيت فتح طبق الثقافة. يجب أن يتم ذلك في نفس الوقت - في هذه الدراسة، 8 ثانية قبل بدء التشعيع، عندما يجعل النظام الصوت. الاختلافات في هذا التوقيت قد تختلف درجة الحرارة الأساسية بسبب التبريد الناجم عن الهواء المحيط (حوالي 23 درجة مئوية). وهذا يمكن أن يؤدي إلى اختلافات كبيرة في درجة الحرارة التي يسببها الليزر.
لمعايرة درجة الحرارة، تم استخدام نفس الكمية المتوسطة (1.2 مل) الذي تم استخدامه في التجارب لقياس توزيع درجة الحرارة في الجزء السفلي من أطباق ثقافة خالية من الخلايا. ومع ذلك، قد يكون الارتفاع المتوسط مع أحادي الطبقة الخلية مختلف عن واحد من دون خلايا، حتى مع نفس حجم المتوسطة المضافة. كشف القياس باستخدام التصوير المقطعي التماسك البصري أن هناك فرق 58 ميكرون في الموضع المركزي بين الأطباق مع وبدون أحادي الطبقة خلية متموجة (877 ميكرون دون خلايا، مقارنة tس 935 ميكرون مع الخلايا). هذا الاختلاف يحتمل أن يكون بسبب العمل الشعري للخلايا. ويمكن أن يكون الاختلاف 58 ميكرون في الارتفاع في الموضع المركزي بسبب ما يقرب من 40 ميكرولتر من المتوسطة (البيانات المقاسة). كما تم التأكد من أن هذا الاختلاف في الارتفاع لم يسبب اختلافات كبيرة في T ماكس في جميع إعدادات الطاقة. لذلك، استنتجنا أن هذا الاختلاف لا يؤثر تأثيرا كبيرا على نتائج التحليلات التي أجريت في هذه الدراسة. ومع ذلك، لجمع معلومات درجة الحرارة أكثر دقة، كما هو مكتوب أعلاه، ينبغي وضع طريقة لمعايرة درجة الحرارة باستخدام طبق ثقافة الخلية التي تحتوي على طبقة أحادية الخلية. وعلاوة على ذلك، فإن النمذجة الرياضية للانتشار الحراري والحمل الحراري في وسط الثقافة كلها مطلوب أيضا.
في هذه الدراسة، تم تسخين الخلايا مع توزيع درجة حرارة غاوسية. هناك عدة طرق ممكنة لتسخين المتوسط كله بشكل أكثر اتساقا مع مرور الوقت. واحد هو استخدام مصدر ليزر مع انخفاض معامل الامتصاص في الماء. ومع ذلك، فإن العيب هو أنه في هذه الحالة، يجب أن يكون الليزر أعلى قوة، حيث يتم امتصاص نسبة صغيرة فقط من الضوء أكثر من حوالي 0.9 ملم. إمكانية أخرى هي صورة طرف الألياف البعيدة من الألياف البصرية المتعدد الذي ينقل ضوء الليزر في الطائرة من طبق الثقافة. يمكن اختيار التكبير بشكل تعسفي من قبل البصريات.
تسليط الضوء الثاني من هذا البروتوكول هو قدرته على تحديد درجة حرارة عتبة موت الخلايا وموت الخلايا المبرمج باستخدام صورة الفلورسنت من تلطيخ البقاء على قيد الحياة وتوزيع درجة الحرارة الجانبية. والهدف على المدى الطويل ليس فقط لتحديد بقاء الخلية، ولكن أيضا لتوضيح نطاق درجة الحرارة للاستجابات البيولوجية الخلية المتعلقة وظائف الخلية، مثل التعبير البروتين وتكاثر الخلايا. تحديد درجة حرارة عتبة موت الخلية هو من مصلحة كبيرة للباحثين"> 10. باستخدام هذه الطريقة، قد يكون من الممكن تحديد العوامل الحاسمة للموت الخلوي، بما في ذلك موت الخلايا المبرمج، ويمكن تحديد العوامل الحاسمة لموت الخلايا التي يسببها الليزر الحراري ليس فقط من خلال تاريخ درجة الحرارة، ولكن أيضا من خلال العوامل الذاتية ( أي العوامل داخل الخلوية وخارجها على المستوى الجزيئي)، وقد تمهد الإجابة على هذه الأسئلة الطريق لفهم آليات موت الخلايا والحركية بعد التعرض الحراري المختلف وفي مختلف أمراض الشبكية.وعلاوة على ذلك، يمكن أن يساعد أيضا في توضيح القضايا التي تمت ملاحظتها سريريا، مثل الفرق بين الأفراد في الاستجابة للعلاج بالليزر أو التباين في حجم الندبة بعد تخثر الضوئية الشبكية، حتى عندما كان حجم البقعة الأولية متطابقا تقريبا ("الزحف الضموري") 11 .
والهدف النهائي من هذه الدراسة هو المساعدة في تطوير العلاج الحرارة الضوئية التي تسيطر عليها درجة الحرارة من شبكية العين. لتحقيق ذلك، في موازاة وايث التقدم التقني لقياس درجة الحرارة 3 ، مزيد من توضيح سلوك الخلايا ربي بعد التعرض الحراري، تحدد باستخدام هذه الطريقة، سيكون من فائدة كبيرة.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
الكتاب ليس لديهم ما يكشف.
Acknowledgments
وأيد هذا العمل منحة بحثية من وزارة التعليم والبحث الاتحادية الألمانية (بمبف) (منحة رقم 13GW0043C) ومكتب أوروبي للبحث والتطوير في مجال الفضاء الجوي (إيوارد، ومنح # FA9550-15-1-0443)
Materials
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Dulbecco’s Modified Eagle’s Medium - high glucose | Sigma-Aldrich | D5796-500ML | Add (2)-(4) before use. Warm in 37 °C water bath before use. |
| Antibiotic Antimycotic Solution (100 ×) | Sigma-Aldrich | A5955-100ML | Containing 10,000 units penicillin, 10 mg streptomycin and 25 μg Amphotericin B in 1mL. Add 5.5 mL in 500 mL medium bottle (1) before use. |
| Sodium pyruvate (100 mM) | Sigma-Aldrich | S8636-100ML | Add 5.5 mL in 500 mL medium bottle (1) before use (final concentration: 1 mM) |
| Porcine serum | Sigma-Aldrich | 12736C-500ML | Add 50 mL in 500 mL medium bottole (1) before use (final: 10%) |
| Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537-500ML | |
| Trypsin from porcine pancreas | Sigma-Aldrich | T4799-25G | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | ED-100G | |
| Human VEGF Quantikine ELISA Kit | R&D System | DVE00 | |
| Oxiselect Total Glutathione Assay Kit | Cell Biolabs, Inc | STA-312 | |
| Apoptotic/Necrotic/Healthy Cells Detection Kit | PromoKine | PK-CA707-30018 | |
| Name | Company | Catalog Number | Comments |
| Equipments | |||
| Thulium laser | Starmedtec GmbH | Prototype | 0-20 W |
| 365 mm core diameter fiber | LASER COMPONENTS Germany | CF01493-52 | |
| Thermocouple | Omega Engineering Inc | HYP-0- 33-1-T-G-60-SMPW-M | |
| Heating plate | MEDAX | ||
| Microplate reader (spectrofluorometer) | Molecular Device | Spectramax M4 | |
| cell homogenizer | QIAGEN | TissueLyser LT | |
| Fluorescence microscope | Nikon | ECLIPSE Ti | |
| mathematical software program | The Mathworks. Inc | MATLAB Release 2015b | |
| system-design platform | National Instrument | Labview | Laboratory Virtual Instrument Engineering Workbench |
References
- Inagaki, K., et al. Comparative efficacy of pure yellow (577-nm) and 810-nm subthreshold micropulse laser photocoagulation combined with yellow (561-577-nm) direct photocoagulation for diabetic macular edema. Jpn J Ophthalmol. 59 (1), 21-28 (2015).
- Roider, J., et al. Selective retina therapy (SRT) for clinically significant diabetic macular edema. Graefes Arch Clin Exp Ophthalmol. 248 (9), 1263-1272 (2010).
- Brinkmann, R., et al. Real-time temperature determination during retinal photocoagulation on patients. J Biomed Opt. 17 (6), 061219 (2012).
- Yoshimura, N., et al. Photocoagulated human retinal pigment epithelial cells produce an inhibitor of vascular endothelial cell proliferation. Invest Ophthalmol Vis Sci. 36 (8), 1686-1691 (1995).
- Denton, M. L., et al. Damage Thresholds for Exposure to NIR and Blue Lasers in an In Vitro RPE Cell System. Invest Ophthalmol Vis Sci. 47 (7), 3065-3073 (2006).
- Shrestha, R., Choi, T. Y., Chang, W., Kim, D. A high-precision micropipette sensor for cellular-level real-time thermal characterization. Sensors (Basel). 11 (9), 8826-8835 (2011).
- Gao, F., Ye, Y., Zhang, Y., Yang, J. Water bath hyperthermia reduces stemness of colon cancer cells. Clin Biochem. 46 (16-17), 1747-1750 (2013).
- Jansen, E. D., van Leeuwen, T. G., Motamedi, M., Borst, C., Welch, A. J. Temperature dependence of the absorption coefficient of water for midinfrared laser radiation. Lasers Surg Med. 14 (3), 258-268 (1994).
- Iwami, H., Pruessner, J., Shiraki, K., Brinkmann, R., Miura, Y. Protective effect of a laser-induced sub-lethal temperature rise on RPE cells from oxidative stress. Exp Eye Res. 124, 37-47 (2014).
- Denton, M. L., et al. Spatially correlated microthermography maps threshold temperature in laser-induced damage. J Biomed Optics. 16 (3), (2011).
- Morgan, C. M., Schatz, H. Atrophic creep of the retinal pigment epithelium after focal macular photocoagulation. Ophthalmology. 96 (1), 96-103 (1989).



