Summary
Der introduceres en original eksperimentel opsætning til opvarmning af celler i en kulturskål ved brug af 1,94 μm kontinuerlig bølge laserstråling. Ved anvendelse af denne metode kan de biologiske reaktioner af retinale pigmentepiteliale (RPE) celler efter forskellige termiske eksponeringer undersøges.
Abstract
En oprindelig metode til opvarmning af dyrkede celler ved anvendelse af en 1,94 μm kontinuerlig bølge-thuliumlaser til biologisk vurdering indføres her. Thulium laserstråling absorberes kraftigt af vand, og cellerne i bunden af dyrkningsskålen opvarmes ved termisk diffusion. En laserfiber med en diameter på 365 μm er sat omkring 12 cm over dyrkningsskålen uden nogen optik, således at laserstrålediameteren er næsten ækvivalent med den indre diameter af dyrkningsskålen (30 mm). Ved at holde en konsistent mængde kulturmedium i hvert forsøg er det muligt at bestråle cellerne med en høj reproducerbar temperaturforøgelse.
For at kalibrere temperaturforøgelsen og dens fordeling i en cellekulturskål for hver effektindstilling måles temperaturen i løbet af 10 s af bestråling i forskellige positioner og på cellulærniveau. Temperaturfordelingen blev repræsenteret ved hjælp af en matematisk grafiksoftwareProgram, og dets mønster på tværs af kulturskålen var i gaussisk form. Efter laserbestråling kunne forskellige biologiske eksperimenter udføres for at vurdere temperaturafhængige celleresponser. I dette manuskript introduceres levedygtighedsfarvning ( dvs. at skelne levende, apoptotiske og døde celler) for at hjælpe med at bestemme tærskelværdierne for celleapoptose og død efter forskellige tidspunkter.
Fordelene ved denne metode er præcisionen af temperaturen og tidspunktet for opvarmning såvel som dens høje effektivitet i opvarmningsceller i en hel cellekulturskål. Desuden giver det mulighed for at studere med en lang række temperaturer og tidsvarigheder, som kan styres godt af et edb-operativsystem.
Introduction
Forståelse af temperaturafhængige cellebiologiske reaktioner er af stor betydning for vellykkede hypertermi behandlinger. Retinal laserfotokoagulation med en termisk laser, der anvendes i oftalmologi, er en af de mest etablerede laserbehandlinger i medicin. Synligt lys, hovedsagelig fra grøn til gul bølgelængder, bruges til retinal laserbehandling. Lyset absorberes stærkt af melaninet i retinale pigmentepiteliale (RPE) celler, der danner det yderste celle monolag af nethinden. Der har været nylig interesse blandt læger og forskere ved meget mild termisk bestråling (sub-synlig fotokoagulation) som en ny terapeutisk strategi for forskellige former for retinale sygdomme 1 , 2 . Som følge af denne tendens er vores interesse i RPE-celler med lette opvarmning under præcis temperaturregulering, en teknik kaldet temperaturstyret fototermisk terapi (TC-PTT).
Seneste optoAkustisk teknologi fra vores institut har muliggjort realtidsmålingen af temperaturstigninger på bestrålede steder i nethinden. Dette gør det muligt at styre temperaturforøgelsen under bestråling 3 . Eftersom sublethal hypertermi på retina, der er forårsaget af opvarmning af RPE-celler sublethalt, ikke er blevet betragtet tidligere på grund af umuligheden af at måle og styre temperaturen, har de temperaturafhængige cellereaktioner af RPE-celler efter termisk laserbestråling imidlertid Blevet undersøgt meget lidt til dato. Desuden har temperaturforskellen ikke kun været diskuteret i detaljer, men også forskellen i cellernes adfærd hos de overlevende celler efter sublethal og dødelig bestråling. For at indsamle videnskabeligt bevis på TC-PTT-baserede behandlinger sigter vi derfor på at belyse de temperaturafhængige RPE-cellebiologiske reaktioner og deres mekanismer ved hjælp af in vitro eksperimentelle opsætninger.
For tHans formål er det nødvendigt at etablere en celleopvarmning opsætning, der opfylder følgende betingelser: 1) en mulighed for hurtig temperaturstigning, 2) en præcist styret tid og temperatur og 3) et relativt højt antal undersøgte celler til biologiske eksperimenter . Med hensyn til opvarmningsmetoden er en klinisk laser, såsom en frekvensdobbelt Nd.YAG laser (532 nm), desværre uegnet til celledyrkning. Dette skyldes det stærkt reducerede antal melanosomer i dyrkede RPE-celler. Laserlysabsorptionen kan være inhomogen, og temperaturstigningen på cellulærniveau varierer mellem forsøg, selv når det bestråles med samme strålingseffekt. Flere tidligere undersøgelser har rapporteret brugen af sortpapir under skålbunden under bestråling 4 eller anvendelsen af yderligere melanosomer, der fagocytiseres af kulturcellerne før forsøgene 5 , 6 . Mange afDe in vitro biologiske undersøgelser til vurdering af hypertermi-inducerede celleresponser er blevet udført ved anvendelse af en varmplade, et vandbad eller en CO 2- inkubator med en temperaturindstilling 7 . Disse metoder kræver en lang varmetid, fordi det tager noget tid ( dvs. flere minutter) for at nå den ønskede temperatur. Derudover er det vanskeligt at opnå en detaljeret termisk historie ( dvs. temperatur multipliceret med tiden) på cellulært niveau ved hjælp af disse metoder. Desuden kan temperaturen mellem cellerne i forskellige positioner i en kulturskål være forskellig på grund af diffusion af variabel temperatur. I de fleste tilfælde er denne tidsmæssige og rumlige temperaturinformation under hypertermi ikke taget i betragtning til biologiske analyser, selvom biologisk cellerespons kan påvirkes kritisk af temperaturen og tidsvarigheden af den forøgede temperatur.
For at overvinde disse problemer, en kontiNuous-bølge thulium laser blev anvendt her til opvarmning af cellerne. Thulium laserstråling (λ = 1,94 μm) absorberes kraftigt af vand 8 , og cellerne i bunden af dyrkningsskålen stimuleres termisk udelukkende gennem termisk diffusion. Laserfibre med en diameter på 365 μm er sat omkring 12 cm over dyrkningsskålen uden nogen optik imellem. Laserstrålediameteren afviger således, at den næsten svarer til den indre diameter af dyrkningsskålen (30 mm) ved dyrkningsmedlets overflade. Med en konsistent mængde dyrkningsmedium er det muligt at bestråle cellerne med temperaturforøgelsen Af høj repeterbarhed. Variable power settings gør det muligt at bestråle op til 20 W, og medietemperaturen på mobilniveau kan øges op til ΔT ≈ 26 ° C om 10 s.
Ved at ændre bestrålingsbetingelserne er det også muligt at ændre laserstråleprofilen for at variere temperaturfordelingenPå i en kultur skål. For eksempel er det muligt at undersøge med en Gauss-lignende temperaturfordeling som i den aktuelle undersøgelse eller med en homogen temperaturfordeling. Sidstnævnte kan være fordelagtigt til undersøgelse af virkningerne af temperaturafhængige celleresponser mere specifikt for sublethal temperaturstigninger, men ikke for celledødspænding eller sårhelingsresponser.
Samlet set kan thulium-laserbestråling muliggøre undersøgelse af forskellige slags biologiske faktorer, såsom gen / proteinekspression, celledødskinetik, celleproliferation og udvikling af cellefunktionalitet efter forskellige termiske eksponeringer.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. RPE-cellekultur
- Isolering af RPE-celler fra svine øjne
- Hent frisk enucleated svin øjne fra det lokale slagteri. Hold dem kølige (4 ° C) og i et mørkt miljø.
- Fjern ekstracellulært væv med saks og blød øjnene i en antiseptisk opløsning i 5 min.
- Anbring øjnene i steriliseret phosphatbufret saltvand uden calcium og magnesium (PBS (-)) indtil brug.
- Brug en skalpel, trænge ind i sclera på ca. 5 mm bagved hornhinde limbus. Resekt hele den forreste del af øjet ved at skære med saks hele vejen igennem, parallelt med hornhinde limbus.
- Fjern den forreste del af øjet ( dvs. hornhinden og objektivet) og glaspladen. Tilsæt 1 ml PBS (-) og fjern forsigtigt nervehinden.
BEMÆRK: Denne "øjenkage", der består af sclera, choroid og RPE, er nu klar. - Tilsæt forvarmet (37 ° C) 0,25% trypsin i PBS (-) til øjet kop. Juster lydstyrken således, at ca. 80% af øjenkoppen er fyldt med denne trypsinopløsning.
- Inkubér øjekoppen med trypsinopløsningen i en 5% CO 2- inkubator ved 37 ° C i 10 minutter.
- Fjern øjenkoppen fra inkubatoren og erstat 0,25% trypsinopløsningen med en PBS (-) opløsning med 0,05% trypsin + 0,2% ethylendiamintetraeddikesyre tetranatriumsalt (EDTA · 4N). Inkubér øjenkoppen i inkubatoren i 45 minutter.
BEMÆRK: Efter 45 minutter er RPE-cellerne enten løst fastgjort til Bruchs membran eller allerede løsrevet og flydende i trypsin-EDTA-opløsningen. - Saml RPE-cellerne ved forsigtig pipettering. Saml cellerne og opløsningen i et konisk rør fyldt med 10 ml dyrkningsmedium (DMEM-høj glucose med L-glutamin), herunder 10% porcin serum, antibiotikum / antimycotisk og natriumpyruvat (1 mM).
BEMÆRK: Serumet kan neutralisere effekten af trypsin. - CentrifugerCelle suspension ved 400 xg i 5 minutter ved stuetemperatur.
- Fjern supernatanten og tilsæt 10 ml frisk medium. Centrifuger igen under de samme betingelser i 5 minutter.
- Fjern supernatanten og tilføj nyt medium, således at cellekoncentrationen resulterer i 5 x 10 5 celler / ml (bestemt ved at tælle cellerne ved hjælp af et hæmocytometer). Bland godt ved forsigtig pipettering.
- Fordel cellesuspensionen i cellekulturskål. Brug 3 ml per 60 mm diameter dyrkningsskål.
BEMÆRK: Denne kultur hedder passage nul (P0). - Vedligehold cellerne i en 5% CO 2 inkubator ved 37 ° C. Skift halvdelen af det konditionerede medium til frisk medium hver anden dag.
- Subkultur (trin 1.2), hvis det bliver sammenflydende.
- Subkultur af RPE cellekulturen
- Fjern kulturmediet og skyll cellerne to gange med PBS (-).
- Inkuber cellerne med PBS (-) opløsning med 0,05% trypsin + 0,2% EDTA iNa 5% CO 2 inkubator ved 37 ° C i 5 minutter.
- Fjern RPE-cellerne ved forsigtig pipettering og opsaml cellesuspensionen i et konisk rør fyldt med 10 ml dyrkningsmedium, inklusiv 10% porcin serum.
- Centrifuge cellesuspensionen ved 400 xg i 5 minutter ved stuetemperatur.
- Fjern supernatanten og tilsæt nyt kulturmedium, hvilket gør cellekoncentrationen 5 x 10 5 celler / ml (bestemt ved at tælle celle nummeret med et hæmocytometer). Fordel cellerne i nye kulturskåle med 60 mm diameter som beskrevet i trin 1.1.13.
BEMÆRK: Cellekulturen er nu passage 1 (P1). - Efter at konfluens er nået, subkulturer P1-kulturen til P2 ved anvendelse af den samme fremgangsmåde beskrevet i trin 1.2.1-1.2.5. Fra P2-kulturen frøer cellerne på mindre dyrkningsskåle (30 mm indre diameter) i stedet for 60 mm diameter kultivarer.
- Til forsøgene skal du bruge P2- eller P3-kulturer.
2. ThulIum laserbestråling
- Opførelse af bestrålingsstation
- Tilslut en thulium laser enhed (1,94 μm, effektområde: 0-20 W) til en 0,22-NA, 365 μm kerne diameter fiber.
- Fastgør fiberstangen mekanisk til metalarmen, der er horisontalt fastgjort til det vertikale metalplade af bestrålingsstationen. Placer den lodrette stolpe således, at spidsen af laserfiberen er placeret over varmepladen, på hvilken celledyrkningsskålen skal anbringes under bestråling.
- Læg et hvidt papir på varmepladen og drej den sigte stråle på (λ = 635 nm, maks = 1 mW, diameter på papirniveau ≈ 30 mm). Marker omkredsen af den målende stråle på hvidbogen, så den position, hvor kulturskålen skal placeres under bestråling, er kendt.
BEMÆRK: Fiberspidsens z-plan kan være omskifteligt. Uden yderligere billedoptagelsesoptik placeres laserpunktdiameteren på cellekulturplanet 12 cm under fibertappen, iS ca. 30 mm, hvilket næsten svarer til den indre diameter af cellekulturskålen. En skematisk tegning af opsætningen er vist i figur 1 .

Figur 1: Skematisk billede af Thulium Laser Bestrålings Station. En kulturskål er anbragt på varmepladen. Cellerne er anbragt 12 cm under thulium-laserfiberspidsen, således at strålestørrelsen er næsten identisk med kulturdisternes indre diameter (ca. 30 mm). Laserbestrålingsproceduren styres af en tidsstyret rutine af den skræddersyede systemdesignplatform. Strømindstillingen skal bestemmes, inden bestrålingsprogrammet startes. Klik her for at se en større version af denne figur.
- 1 time før bestråling, erstatt kulturmediet fuldstændigt med 1,2 ml frisk medium.
BEMÆRK: Dette er et kritisk trin og skal følges nøje. - Placer bestrålingsstationen ( dvs. varmepladen og stolpen, som skal fastgøres på laserfiberen) på en ren bænk.
- Fjern cellekulturskålen fra inkubatoren og læg den på den markerede position på varmepladen (trin 2.1.3).
- Brug beskyttelsesbriller. Tænd thuliumlaseren. Indstil effekten som ønsket på laserenheden (indstillelig fra 0 - 20 W). Tænd emissionen på.
- Start en systemdesignplatform, der styrer laserbestråling og timingprotokol (supplerende fil).
- Straks efter at kultiveringsskålen er sat på varmepladen, skal du klikke på "forvarmningstid" for at starte timeren i 140 s ("forvarmningstid 1"); Dette vil holde kulturmedietemperaturen ved 37 ° C før bestråling.
BEMÆRK: Efter 140 s tændes en lydsignal, og næste timer ("forvarmningstid 2") starter automatisk med 8 s. I løbet af denne 8 s kan eksaminator åbne kulturskålen. Efter 148 s af forvarmning udføres en 10 s lang laserbestråling på cellekulturen automatisk. I tilfælde af nødsituation skal laserenheden udstyres med en tænd-knappen for at stoppe laseren med det samme. Dette er et kritisk trin og skal følges nøje. Et særligt forsigtighedsforhold vedrører åbning af skålens afdækning lige inden bestråling, ved begyndelsen af 8 s forvarmningstid. Åbning af dækslet kan afkøle medieoverfladen meget hurtigt. - Efter bestråling skal du straks lægge dækslet tilbage på kulturskålen, lade kulturskålen stå på varmepladen i yderligere 7 s, og læg den tilbage i 5% CO 2- inkubatoren ved 37 ° C.
- Lav små huller (ca. 300 μm i diameter) tæt på bunden på fire sider (hver 90 °) af en 30 mm diameter kulturskål (uden celler); Brug spidsen af en nål (20G) opvarmet med en Bunsen brænder. Sæt hullerne med elektrisk isoleringstape udefra og lav et lille hul med en fin nål, så kun et fint termoelement (200 μm i diameter) kan indsættes gennem dette hul under vandtætte forhold.
- På ydersiden af kulturskålbunden tegner du 2 vinkelrette diametre og sætter krydsningspunktet ( dvs. midt på bundsiden) som koordinatnul (0). Markér hver 3 mm radialt til ydersiden ud af fadet ( dvs. 0, 3, 6, 9, 12 og 15 mm) i hver retning langs linjerne ( figur 2 , blå prikker); Antallet af point skal være 21 i alt.
- Fyld cellekulturskålen med 1,2 ml nyt dyrkningsmedium. Placer kulturen dIsh på en varm plade ved 37 ° C, indsæt et fint termoelement (200 μm i diameter) i sidevandet og læg det følsomme spids på en markeret position, der skal måles.
- Brug beskyttelsesbriller. Tænd thuliumlaseren, og indstil strømmen manuelt (mellem 0 og 20 W, i 0,1-W trin) af laserudformningen.
BEMÆRK: Ved temperaturkalibrering skal målinger med effekt i trin på 3 W være tilstrækkelige. - Tænd systemdesignplatformen og klik på knappen "Start Temp. Acquisition" (supplerende fil) for at starte temperaturmåling.
- Udfør samme procedure som i trin 2.2.6.
BEMÆRK: Kontrolprogrammet måler temperaturen på det indsatte termoelement hvert 100 ms og viser temperaturprogressionen under bestråling i GUI'en. - Gennemfør disse procedurer for alle 21 målepunkter og ved forskellige strømindstillinger. Gentag hele proceduren tre gange for alle punkter og for alle strømforsyningerGs for at opnå pålidelige data.
- Eksporter temperaturdata som csv-data, som i sidste ende kan konverteres til et regneark. Gennemsnitt den maksimale temperatur i slutningen af bestråling til de tredobbelte målinger på hvert punkt. Gennemsnit værdierne fra punkterne i den samme cirkel (4 point i alt, undtagen det centrale punkt).
- Plot den opnåede gennemsnitlige maksimale temperatur på en graf, idet afstanden fra skålens midten (mm) som x-aksen og temperaturen stiger (ΔT, ° C) som y-aksen. Brug pasformfunktionen af et matematisk softwareprogram til at passe en gaussisk model til de rå data. Opret en Gaussisk pasformstemperaturfordeling.

Figur 2: Punkterne til temperaturkalibrering i en cellekulturskål. Temperaturdataene blev målt i midten og ved 5 ° CRadiale punkter over 4 forskellige vinkler (blå prikker). Klik her for at se en større version af denne figur.
3. Biologiske vurderinger af cellereaktioner efter forskellige termiske bestrålinger
- Vurdering af cellelevedygtighed ( dvs. levende, apoptotisk og død) efter forskellige strømindstillinger og bestemmelse af celledødstærsklen
- På de angivne tidspunkter ( dvs. 3, 24 og 48 timer efter bestråling) skal cellerne vaskes med PBS (-) og anvende et kommercielt tilgængeligt kit til at vurdere cellelevedygtighed ( dvs. vital, apoptotisk, død) ifølge producentens protokol.
- Forbered en farvningsopløsning ved tilsætning af 5 μl fluoresceinisothiocyanat (FITC) -annexin V, 5 μl ethidium homodimer III og 5 μL Hoechst 33342 til 100 μl 1x bindingsbuffer (alle er kitkomponenter). Forbered nok farvningsløsning til at dække cellerne. Inkuber cellerne i 15 minutter.
- Vask cellekulturen med bindingsbufferen to gange, erstat bindingsbufferen med PBS (-) og sæt kulturen på scenen af et fluorescensmikroskop.
- Skift lysvej til det okulære objektiv, vælg filteret 4 ', 6-Diamidin-2-phenylindol (DAPI), tænd lyslyset og find det fokuserede plan med 4x-målet.
- Skift lysvej til kameraet, find billedet på computerskærmen i mikroskop billedprogrammet, og juster fokuset.
- Brug stingfunktionen ( dvs. funktionen til at optage flere billeder på tværs af skålen og derefter oprette et enkelt stort billede) af den mikroskopspecifikke software for at opnå fluorescensbilledet af hele cellekulturskålen. Brug 3 forskellige filtersæt-DAPI, FITC og tetramethylrhodamin (TRITC) til billede Hoechst 33342-positive celler (alle cellekerner), FITC-annexin V-positiVe-celler (apoptotiske) og henholdsvis ethidium homodimer III-positive celler (død).
- Mål radiusen (mm) for den døde (etidium homodimer III-positiv) region og den ydre / inderste radius af det apoptotiske (annexin V-positive) båndformområde i de farvede cellekulturer. Anvend disse radii til den monterede Gaussiske funktion af temperaturfordelingen for den tilsvarende effektindstilling. Beregn den nøjagtige temperatur ved fælgen af det døde eller apoptotiske område for at præcisere tærskeltemperaturerne for celledød og apoptotisk ændring.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Temperaturfordeling efter forskellige strømindstillinger
Alle temperaturudviklinger for hver enkelt bestråling blev overvåget ved temperaturkalibrering. Ud fra disse data blev den maksimale temperatur ved det målte punkt opnået og defineret som T max (° C). Som vist i figur 3A blev programmet udført på tidspunktet, hvor kulturskålen blev anbragt på varmepladen. Efter 140 s "forvarmningstid 1", som var nødvendig for at arkivere en stabil mellemtemperatur ved 37 ° C, blev kultursætets dæk fjernet i 8 s "forvarmningstid 2." I slutningen af "forvarmningstid 2" startede laseremissionen automatisk. Denne kurve er en repræsentativ temperaturprogression for en 10 s bestråling. Under bestråling steg temperaturen og umiddelbart efter laseremissionenSlukket, temperaturen begyndte at falde. Den maksimale temperatur i centrum af kulturskålen blev defineret i dette studie som T max (° C). T max var proportional med laserkraften ( figur 3B ). Figur 3C viser fordelingen af den maksimale temperatur for hver effekt over kulturskålen. Fordelingen er klokkeformet som vist i figur 3C og passer til en Gaussisk funktion i overensstemmelse med følgende formel:
T (r) = t base + A · 
Hvor r, t base , A og w står for afstanden fra midten (mm), den laveste temperatur for kurven, amplituden og bredden af kurven. Parametrene (t base , A og w) af den monterede GAussisk kurve for hver effektindstilling, nemlig for hver Tmax , vises i tabellen ved siden af grafen.
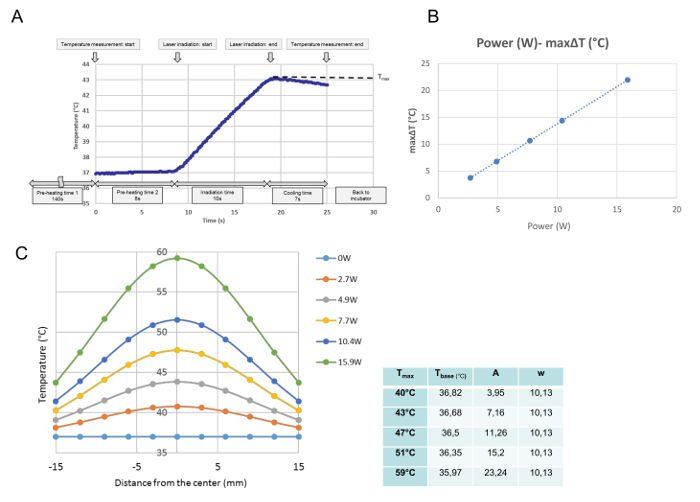
Figur 3: Temperaturkalibreringsdata. En repræsentativ temperaturudvikling ved den centrale position efter en enkelt bestråling ved 4,9 W (T max = 43 ° C) ( A ), Proportionalforholdet mellem laserkraften og den maksimale ΔT ved den centrale position for en cellekultur ( B ) Og temperaturfordeling over kulturskålen efter forskellige strømindstillinger (C). (A) Programmet udføres fra det tidspunkt, hvor kulturskålen er anbragt på varmepladen. Efter 140 s af "forvarmningstid 1", som er nødvendig for at arkivere en stabil mellemtemperatur ved 37 ° C, fjernes kulturskålens dækning i 8-s "forvarmningstid2. "I slutningen af" forvarmningstid 2 "starter laseremissionen automatisk. Denne kurve er en repræsentativ temperaturprogression i den centrale position under en 10 s stråling ved 4,9 W. Under bestråling øges temperaturen og Umiddelbart efter at laseremissionen er slukket, begynder temperaturen at falde. Den maksimale temperatur opnås ved afslutning af bestrålingen, som er defineret i dette studie som T max (° C). (B) Laserkraften og den maksimale Temperaturforøgelse (ΔT max ) er proportional. (C) De monterede gaussiske funktioner af de målte temperaturfordelinger over kulturskålen. Parametrene for funktionerne, bestemt med et matematisk softwareprogram, er vist i tabellen ved siden af grafen . Klik venligst her for at se en større version af denne figur.
Cell levedygtighed efter termisk bestråling
Som vist i figur 4A er der tre forskellige farvemønstre, der indikerer cellelevedygtighed efter laserbestråling: 1) ingen bilag V / ethidium homodimer III-positiv ( dvs. kun levende), 2) annexin V-positiv i midten ( dvs. næsten Kun tidlig apoptose) og 3) ethidium homodimer III-positiv i centrum ( dvs. døde celler) omgivet af apoptotiske celler ved grænsen mellem døde og levende celler ( figur 4B ). Størrelsen af det døde / apoptotiske område er generelt afhængig af T max og efterbestrålingstiden op til 48 timer efter bestråling. Der blev ikke fundet nogen tilsyneladende ændringer i levedygtigheden i de kulturer bestrålet med T max ≤43 ° C. Den eneste apoptotiske ændring kunne observeres på et tidligt tidspunkt (3 timer) efterfulgt af et sent tidspunkt Celledød efter en bestråling med T max = 47 ° C. Umiddelbar eller tidlig celledød (op til 3 timer) blev fundet i de kulturer bestrålet med T max ≥ 51 ° C (tabel 1).

Figur 4: Færdighedsfarvemønster efter forskellige strømindstillinger (A) og et eksemplarisk billede ved døde rand og apoptotiske område efter dødelige laserbestråling (B).
(A) Tre farvemønstre kan forekomme afhængigt af temperaturen. (B) Den apoptotiske zone (FITC-annexin V-positiv: grøn) omkring det døde område (ethidium homodimer III-positiv: rød). Alle celler er positive for Hoechst 33342 (blå), og cellerne med blå kerner er levende celler. Billedet blev taget 24 timer efter en bestråling ved T max = 59 ° C. Bar = 100 μm./files/ftp_upload/54326/54326fig4large.jpg "target =" _ blank "> Venligst klik her for at se en større version af denne figur.

Tabel 1: Bilag V og Ethidium Homodimer III-reaktioner ved forskellige temperaturer og tider.
Bestemmelse af tærskelværdien for celledød
Den gennemsnitlige radius af det døde område (rødt) og det apoptotiske område (grønt) blev målt og anvendt til den Gaussiske funktion af temperaturfordelingen for at bestemme tærskel-toppetemperaturerne for celledød og apoptose efter 10 s bestråling. Ifølge denne analyse var de gennemsnitlige tærskeltemperaturer for fuldstændig celledød 3 timer, 24 timer og 48 timer efter bestråling henholdsvis 54,0 ° C, 50,9 ° C og 50,1 ° C. Den gennemsnitlige threshoLd-temperaturen for celleapoptotisk ændring var lavere ved ca. 2 - 3 ° C med tærskelværdierne i henholdsvis 3 timer, 24 timer og 48 timer ved henholdsvis 51,7 ° C, 48,0 ° C og 47,0 ° C ( figur 5 ).
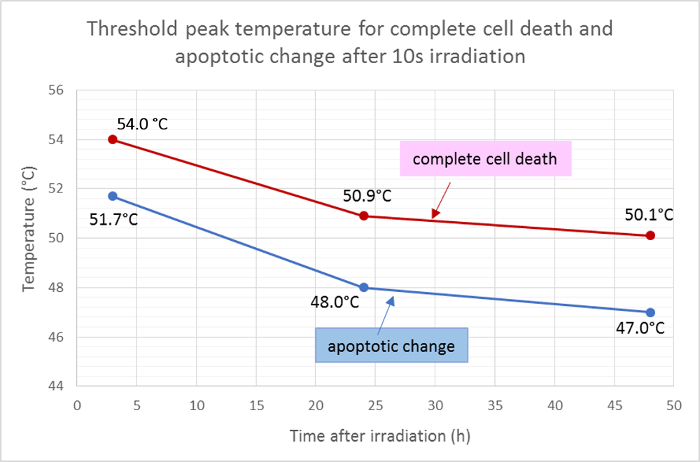
Figur 5: Tærskelværdier for apoptose og celledød.
Gennemsnitlige tærskelværdier for fuldstændig celledød (positiv for Hoechst 33342, annexin V og ethidium homodimer III) og for apoptose (positiv kun for Hoechst 33342 og annexin V) ved forskellige tidspunkter efter bestråling beregnet ud fra resultaterne af fluorescens-levedygtighedsfarvning . Klik her for at se en større version af denne figur.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Ved diskussion af temperaturrelaterede biologiske cellulære reaktioner er ikke kun temperaturen men også tidsvarigheden af den forøgede temperatur vigtig, da de fleste biokemiske processer er tidsafhængige. Især inden for laser-induceret hypertermi i oftalmologi, på grund af den korte tidsperiode fra millisekunder til sekunder-det er svært at undersøge cellulære termiske effekter med præcis temperaturkontrol. Derfor er en laserbestrålingsopsætning egnet til cellekulturmodellen og med et operationssystem, som muliggør strenge temperatur- og tidsstyring, ønsket. Den biologiske vurdering af celleresponser efter termisk eksponering, såsom proteinekspression eller sekretion, kræver gentagne kvantitative evalueringer på et tilstrækkeligt antal berørte celler. Dette har været en hindring for undersøgelser ved brug af laserpletter med flere hundrede mikrometer i diameter, som i kliniske behandlinger. Kvantitativ analyse på en enkelt laserplade er ret burdensome. I denne undersøgelse er der gjort forsøg på at opfylde disse krav så meget som muligt. Ved at anvende en 1,94 μm bølgelængde kontinuerlig bølge-thuliumlaser med et bestrålingsstyringsprogram, kunne en temporær temperaturstigning udføres i en hel cellekultur inden for en kort tidsramme. Da temperaturfordelingen kan justeres ved at ændre lysbanen, kan forskellige typer hypertermi-relaterede eksperimenter udføres ved hjælp af denne opsætning.
Begrænsningen af den præsenterede teknik er umuligheden af at foretage samtidige temperaturmålinger under laserbestråling af cellerne. Da anvendelsen af termoelementer ikke er egnet til steriliserede cellekulturer, skal temperaturkalibrering udføres separat fra cellebestråling. I betragtning af de mulige variationer i laser-effektudgangen ville realtids-temperaturmålinger under hver laserbestråling være ideel til direkte at vurdere cellers respons svarende tilTermisk dosis. Desuden blev temperaturfordelingen anvendt her ved hjælp af datainterpolation baseret på målingerne ved 21 point på en kulturskål og ved flere forskellige strømindstillinger. For at overvinde disse begrænsninger og kritiske punkter er det derfor vores mål at udvikle en alternativ metode, som gør det muligt at måle temperaturen på kulturskålen, mens laserbestråling udføres. Vi tilstræber også at få oplysninger om rumlig temperatur på én gang. Infrarød billeddannelse (termografi) er en mulig metode til måling af temperaturen under laserbestråling 10 . Den store fordel ved denne metode er realtids temperaturmåling på mobilniveau for hver bestråling; Efterfølgende cellebiologiske reaktioner kan altid sammenlignes individuelt med temperaturhistorien under bestråling. I betragtning af omkostningseffektivitet og brugervenlighed er det imidlertid ikke muligt for alle laboratorier at anvende termografi til celleopvarmning eksperimenterrisk.
Ved fremgangsmåden ved anvendelse af en thuliumlaser ved en bølgelængde på 1,94 μm opvarmes vandet i cellekulturskålen på dens overflade, og termisk diffusion og konvektion anvendes til opvarmning af cellerne. Højden af dyrkningsmediet i denne bestrålingsopsætning med 1,2 ml dyrkningsmedium er 935 μm i den centrale position (fra en tidligere måling under anvendelse af optisk kohærens-tomografi). Niveauet for absorption af thuliumlaseren i vand er meget høj (absorptionskoefficient: 127 cm -1 ved 35 ° C), og 72% af lyset absorberes i de første 100 μm af dyrkningsmediet. Der er næsten ingen absorption (0,0007%) i en dybde på 935 μm.
Det er vigtigt at bemærke, at et af de kritiske punkter i protokollen er at tilføje den samme mængde medium (1200 μL) for hver bestråling. Brug af forskellige mængder af kulturmedium kan føre til højdeforskelle, hvilket kan forårsage forskelle i temperaturen iNcrease af cellerne. Det andet kritiske punkt vedrører tidspunktet for åbningen af kulturskålen. Det skal gøres samtidig - i denne undersøgelse, 8 s før bestrålingsstart, når systemet laver en lyd. Forskelle i denne timing kan variere basetemperaturen på grund af afkøling forårsaget af omgivende luft (ca. 23 ° C). Dette kan føre til signifikante forskelle i den laserinducerede temperatur.
Til temperaturkalibrering blev den samme mængde medium (1,2 ml), der blev anvendt i forsøgene, anvendt til måling af temperaturfordelingen i bunden af cellefrie dyrkningsskåle. Mellemhøjden med et celle monolag kan dog være forskellig fra den uden celler, selv med det samme volumen af tilsat medium. Måling ved hjælp af optisk kohærens tomografi afslørede, at der er en 58 μm forskel i den centrale position mellem skåle med og uden et sammenflytende celle monolag (877 μm uden celler sammenlignet tO 935 μm med celler). Denne forskel skyldes potentielt cellernes kapillære virkning. 58-μm højdeforskellen i den centrale position kan skyldes ca. 40 μl medium (målt data). Det blev også bekræftet, at denne forskel i højde ikke medførte væsentlige forskelle i T max ved alle strømindstillinger. Derfor har vi konkluderet, at denne forskel ikke påvirker resultaterne af analyserne i denne undersøgelse væsentligt. Ikke desto mindre, for at indsamle mere præcise temperaturoplysninger, som beskrevet ovenfor, bør der udvikles en metode til kalibrering af temperaturen ved anvendelse af en cellekulturskål indeholdende et cellemonolag. Desuden er den matematiske modellering af termisk diffusion og konvektion i hele dyrkningsmediet også påkrævet.
I dette studie blev cellerne opvarmet med en Gaussisk temperaturfordeling. Der er flere mulige metoder til at opvarme hele mediet mere ensartet over tid. En Er at bruge en laser kilde med en lavere absorptionskoefficient i vand. Imidlertid er ulempen, at laserne i dette tilfælde skal have en højere effekt, da kun en lille procentdel af lyset absorberes over ca. 0,9 mm. En anden mulighed er at afbilde distalfiberspidsen af en multimode optisk fiber, der overfører laserlyset ind i kulturskålens plan Forstørrelsen kan vælges vilkårligt af optikken.
Den anden højdepunkt i denne protokol er dens evne til at bestemme tærskeltemperaturen for celledød og apoptose ved anvendelse af det fluorescerende billede af levedygtighedsfarvning og den laterale temperaturfordeling. Et langsigtet mål er ikke kun at bestemme cellelevedygtighed, men også for at belyse temperaturområdet for cellebiologiske reaktioner relateret til cellefunktionalitet, såsom proteinekspression og celleproliferation. Bestemmelsen af celledødstærskelværdien er af stor interesse for forskere"> 10. Ved hjælp af denne metode kan det være muligt at bestemme de kritiske faktorer for celledød, herunder apoptose. Kritiske faktorer for termisk laserinduceret celledød kan bestemmes ikke kun gennem temperaturhistorien, men også gennem de endogene faktorer ( Dvs. intra / ekstracellulære faktorer på molekylært niveau.) Besvarelse af disse spørgsmål kan bane vejen for forståelse af celledødsmekanismer og kinetik efter forskellige termiske eksponeringer og i forskellige retinale patologier. Desuden kan det også bidrage til at klarlægge klinisk observerede problemer, Såsom den inter-individuelle forskel som respons på laserbehandling eller variabiliteten i arstørrelse efter retinalfotokoagulering, selv når den oprindelige spotstørrelse var næsten identisk ("atrofisk kryb") 11 .
Det endelige formål med denne undersøgelse er at hjælpe med at udvikle temperaturstyret fototermisk behandling af nethinden. For at opnå dette, i parallel wiDen tekniske udvikling af temperaturmåling 3 , yderligere belysning af RPE-celleadfærd efter termisk eksponering, bestemt ved anvendelse af denne metode, vil være til stor gavn.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Forfatterne har intet at afsløre.
Acknowledgments
Dette arbejde blev støttet af et forskningsbidrag fra det tyske føderale ministerium for uddannelse og forskning (BMBF) (tilskud nr. 13GW0043C) og og et europæisk kontor for luftfartsforskning og udvikling (EOARD, grant # FA9550-15-1-0443)
Materials
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Dulbecco’s Modified Eagle’s Medium - high glucose | Sigma-Aldrich | D5796-500ML | Add (2)-(4) before use. Warm in 37 °C water bath before use. |
| Antibiotic Antimycotic Solution (100 ×) | Sigma-Aldrich | A5955-100ML | Containing 10,000 units penicillin, 10 mg streptomycin and 25 μg Amphotericin B in 1mL. Add 5.5 mL in 500 mL medium bottle (1) before use. |
| Sodium pyruvate (100 mM) | Sigma-Aldrich | S8636-100ML | Add 5.5 mL in 500 mL medium bottle (1) before use (final concentration: 1 mM) |
| Porcine serum | Sigma-Aldrich | 12736C-500ML | Add 50 mL in 500 mL medium bottole (1) before use (final: 10%) |
| Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537-500ML | |
| Trypsin from porcine pancreas | Sigma-Aldrich | T4799-25G | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | ED-100G | |
| Human VEGF Quantikine ELISA Kit | R&D System | DVE00 | |
| Oxiselect Total Glutathione Assay Kit | Cell Biolabs, Inc | STA-312 | |
| Apoptotic/Necrotic/Healthy Cells Detection Kit | PromoKine | PK-CA707-30018 | |
| Name | Company | Catalog Number | Comments |
| Equipments | |||
| Thulium laser | Starmedtec GmbH | Prototype | 0-20 W |
| 365 mm core diameter fiber | LASER COMPONENTS Germany | CF01493-52 | |
| Thermocouple | Omega Engineering Inc | HYP-0- 33-1-T-G-60-SMPW-M | |
| Heating plate | MEDAX | ||
| Microplate reader (spectrofluorometer) | Molecular Device | Spectramax M4 | |
| cell homogenizer | QIAGEN | TissueLyser LT | |
| Fluorescence microscope | Nikon | ECLIPSE Ti | |
| mathematical software program | The Mathworks. Inc | MATLAB Release 2015b | |
| system-design platform | National Instrument | Labview | Laboratory Virtual Instrument Engineering Workbench |
References
- Inagaki, K., et al. Comparative efficacy of pure yellow (577-nm) and 810-nm subthreshold micropulse laser photocoagulation combined with yellow (561-577-nm) direct photocoagulation for diabetic macular edema. Jpn J Ophthalmol. 59 (1), 21-28 (2015).
- Roider, J., et al. Selective retina therapy (SRT) for clinically significant diabetic macular edema. Graefes Arch Clin Exp Ophthalmol. 248 (9), 1263-1272 (2010).
- Brinkmann, R., et al. Real-time temperature determination during retinal photocoagulation on patients. J Biomed Opt. 17 (6), 061219 (2012).
- Yoshimura, N., et al. Photocoagulated human retinal pigment epithelial cells produce an inhibitor of vascular endothelial cell proliferation. Invest Ophthalmol Vis Sci. 36 (8), 1686-1691 (1995).
- Denton, M. L., et al. Damage Thresholds for Exposure to NIR and Blue Lasers in an In Vitro RPE Cell System. Invest Ophthalmol Vis Sci. 47 (7), 3065-3073 (2006).
- Shrestha, R., Choi, T. Y., Chang, W., Kim, D. A high-precision micropipette sensor for cellular-level real-time thermal characterization. Sensors (Basel). 11 (9), 8826-8835 (2011).
- Gao, F., Ye, Y., Zhang, Y., Yang, J. Water bath hyperthermia reduces stemness of colon cancer cells. Clin Biochem. 46 (16-17), 1747-1750 (2013).
- Jansen, E. D., van Leeuwen, T. G., Motamedi, M., Borst, C., Welch, A. J. Temperature dependence of the absorption coefficient of water for midinfrared laser radiation. Lasers Surg Med. 14 (3), 258-268 (1994).
- Iwami, H., Pruessner, J., Shiraki, K., Brinkmann, R., Miura, Y. Protective effect of a laser-induced sub-lethal temperature rise on RPE cells from oxidative stress. Exp Eye Res. 124, 37-47 (2014).
- Denton, M. L., et al. Spatially correlated microthermography maps threshold temperature in laser-induced damage. J Biomed Optics. 16 (3), (2011).
- Morgan, C. M., Schatz, H. Atrophic creep of the retinal pigment epithelium after focal macular photocoagulation. Ophthalmology. 96 (1), 96-103 (1989).



