Summary
Viene introdotto un setup sperimentale originale per le celle di riscaldamento in un piatto di coltura utilizzando radiazioni laser a onda continua da 1,94 μm. Utilizzando questo metodo, le risposte biologiche delle cellule epiteliali del pigmento retinico (RPE) dopo diverse esposizioni termiche possono essere studiate.
Abstract
Viene introdotto un metodo originale per riscaldare le cellule coltivate usando un laser di thulium a onda continua da 1,94 μm per la valutazione biologica. La radiazione laser di tiulio è fortemente assorbita dall'acqua e le cellule nella parte inferiore del piatto di coltura vengono riscaldate attraverso la diffusione termica. Una fibra laser con un diametro di 365 μm è impostata circa 12 cm al di sopra del piatto di coltura, senza alcuna ottica, in modo tale che il diametro del fascio laser sia quasi equivalente al diametro interno del piatto di coltura (30 mm). Tenendo una quantità consistente di campioni di coltura in ogni esperimento, è possibile irradiare le cellule con un aumento di temperatura altamente riproducibile.
Per calibrare l'aumento della temperatura e la sua distribuzione in un piatto di coltura cellulare per ogni impostazione di potenza, la temperatura è stata misurata durante 10 s di irradiazione in posizioni diverse e a livello cellulare. La distribuzione della temperatura è stata rappresentata utilizzando un software grafico matematicoProgramma, e il suo modello attraverso il piatto della cultura era in forma gaussiana. Dopo l'irradiazione laser, potrebbero essere eseguiti diversi esperimenti biologici per valutare le risposte delle cellule dipendenti dalla temperatura. In questo manoscritto viene introdotta la colorazione della vitalità ( cioè distinguere le cellule vive, apoptotiche e morte) per aiutare a determinare le temperature di soglia per l'apoptosi cellulare e la morte dopo diversi punti nel tempo.
I vantaggi di questo metodo sono la precisione della temperatura e del tempo di riscaldamento, nonché la sua elevata efficienza nelle celle di riscaldamento in un intero impianto di coltura. Inoltre, consente di studiare con un'ampia varietà di temperature e durate, che possono essere ben controllate da un sistema operativo computerizzato.
Introduction
La comprensione delle risposte biologiche delle cellule dipendenti dalla temperatura è di grande importanza per i trattamenti di ipertermia con successo. La fotocoagulazione laser retinica con un laser termico, utilizzata in oftalmologia, è uno dei trattamenti laser più rinomati della medicina. La luce visibile, per lo più da lunghezze d'onda di verde a giallo, viene usata nel trattamento laser retinico. La luce è altamente assorbita dal melanina nelle cellule epiteliali del pigmento retinico (RPE), che costituiscono il monostrato cellulare più esterno della retina. Interessanti interessi tra medici e ricercatori in irraggiamento termico molto lieve (fotocoagulazione sub-visibile) come nuova strategia terapeutica per diversi tipi di disturbi della retina 1 , 2 . A seguito di questa tendenza, il nostro interesse è quello di sottoporre letti a calore le cellule RPE sotto controllo preciso della temperatura, una tecnica chiamata terapia fototermica controllata dalla temperatura (TC-PTT).
Opto recenteLa tecnologia acustica del nostro istituto ha consentito di misurare in tempo reale gli aumenti di temperatura nei siti irradiati nella retina. Ciò consente di controllare l'aumento della temperatura durante l'irradiazione 3 . Tuttavia, poiché l'ipertermia sub-letale sulla retina, causata dalla riscaldamento delle cellule RPE sotto-letali, non è stata precedentemente considerata a causa dell'impossibilità di misurare e controllare la temperatura, le risposte delle cellule RPE dipendenti dalla temperatura dalle cellule RPE dopo l'irradiazione laser termico Sono stati studiati molto poco fino ad oggi. Inoltre, non solo la differenza di temperatura non è stata discussa in dettaglio, ma anche la differenza nel comportamento delle cellule delle cellule sopravvissute dopo irradiazione sub-letale e letale. Pertanto, per raccogliere prove scientifiche sui trattamenti basati su TC-PTT, ci proponiamo di chiarire le risposte biologiche delle cellule RPE dipendenti dalla temperatura e dai loro meccanismi utilizzando strutture sperimentali in vitro .
Per tIl suo scopo è stabilire un impianto di riscaldamento a cellule che soddisfi le seguenti condizioni: 1) possibilità di aumenti di temperatura veloci, 2) tempo e temperatura precisi e 3) un numero relativamente elevato di cellule esaminate per esperimenti biologici . Per quanto riguarda il metodo di riscaldamento, un laser clinico, come un laser Nd.YAG raddoppiato a frequenza (532 nm), è purtroppo inadatto per il riscaldamento della coltura cellulare. Questo è dovuto al numero fortemente ridotto di melanosomi nelle cellule RPE coltivate. L'assorbimento della luce laser potrebbe essere inomogeneo e l'aumento della temperatura a livello cellulare è variabile tra gli esperimenti, anche quando irradiato con la stessa potenza radiante. Numerosi studi precedenti hanno riportato l'uso di carta nera sotto il fondo del piatto durante l'irradiazione 4 o l'uso di melanosomi aggiuntivi che sono fagocitizzati dalle cellule di coltura prima degli esperimenti 5 , 6 . Molti diGli studi biologici in vitro per la valutazione delle reazioni cellulari indotte da ipertermia sono state eseguite usando una piastra calda, un bagno d'acqua o un incubatore di CO 2 con una regolazione della temperatura 7 . Questi metodi richiedono un lungo periodo di riscaldamento perché richiede un certo tempo ( cioè diversi minuti) per raggiungere la temperatura desiderata. Inoltre, utilizzando questi metodi, è difficile ottenere una storia termica dettagliata ( cioè la temperatura moltiplicata per il tempo) a livello cellulare. Inoltre, la temperatura tra le cellule in posizioni diverse in un piatto di coltura può variare a causa della diffusione a temperatura variabile. Nella maggior parte dei casi, queste informazioni di temperatura temporali e spaziali durante l'ipertermia non sono state prese in considerazione per le analisi biologiche, anche se la risposta biologica cellulare può essere criticamente influenzata dalla temperatura e dalla durata della temperatura aumentata.
Per superare questi problemi, un contaIl laser di thulium a nuous wave è stato usato qui per riscaldare le cellule. La radiazione laser di tiulio (λ = 1,94 μm) è fortemente assorbita dall'acqua 8 e le cellule al fondo del piatto di coltura sono stimolate termicamente solo attraverso la diffusione termica. La fibra laser con un diametro di 365 μm è fissata a circa 12 cm al di sopra del piatto di coltura, senza alcuna ottica fra. Il diametro del fascio laser diviene tale che è quasi equivalente al diametro interno del piatto di coltura (30 mm) alla superficie del mezzo di coltura. Con una quantità consistente di terreno di coltura è possibile irradiare le cellule con l'aumento della temperatura Di alta ripetibilità. Le impostazioni di potenza variabili consentono l'irraggiamento fino a 20 W e la temperatura media a livello cellulare può essere aumentata fino a ΔT ≈ 26 ° C per 10 s.
Modificando le condizioni di irraggiamento, è anche possibile modificare il profilo del fascio laser per variare la temperatura distribuitaIn un piatto di cultura. Ad esempio, è possibile indagare con una distribuzione di temperatura simile a Gaussian, come nell'attuale studio, o con una distribuzione omogenea della temperatura. Quest'ultimo può essere vantaggioso per indagare gli effetti delle risposte delle cellule dipendenti dalla temperatura più specificamente per gli aumenti di temperatura sub-letali, ma non per gli stress di morte cellulare o le reazioni di guarigione delle ferite.
Nel complesso, l'irradiazione laser del tiume può consentire l'individuazione di diversi fattori biologici, come l'espressione genico / proteica, la cinetica della morte cellulare, la proliferazione cellulare e lo sviluppo delle funzionalità delle cellule dopo diverse esposizioni termiche.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. Cultura delle cellule RPE
- Isolamento delle cellule RPE dagli occhi di maiale
- Ottieni gli occhi di maiale appena enucleati dal macello locale. Tenerli raffreddati (4 ° C) e in un ambiente buio.
- Rimuovere i tessuti extracellulari con forbici e immergere gli occhi in una soluzione antisettica per 5 min.
- Mettere gli occhi in salina sterilizzata tamponata con fosfato senza calcio e magnesio (PBS (-)) fino all'uso.
- Usando un bisturi, penetrare la sclera a circa 5 mm posteriormente al limbo corneale. Riprendere l'intera parte anteriore dell'occhio tagliandosi con le forbici in tutta la direzione, parallela al limbo corneale.
- Rimuovere la parte anteriore dell'occhio ( cioè la cornea e l'obiettivo) e la vetreria. Aggiungere 1 ml di PBS (-) e rimuovere delicatamente la retina neurale.
NOTA: Questa "coppa dell'occhio", costituita dalla sclera, dal coroide e dalla RPE, è ora pronta. - Aggiungere pre-riscaldato (37 ° C) 0,25% di trysina in PBS (-) alla coppa dell'occhio. Regolare il volume in modo che circa l'80% della coppa dell'occhio sia riempito con questa soluzione di tripsina.
- Incubare la coppa con la soluzione di tripsina in un incubatore di CO 2 a 5% a 37 ° C per 10 min.
- Rimuovere la coppa dell'oculato dall'incubatore e sostituire la soluzione di trypsina allo 0,25% con una soluzione PBS (-) con 0,05% di tripossina + 0,2% di tetranodio di acido etilendiammetratoacetico (EDTA · 4N). Incubare la coppa dell'occhio nell'incubatore per 45 min.
NOTA: Dopo 45 minuti, le cellule RPE saranno solo leggermente attaccate alla membrana di Bruch o già staccate e galleggianti nella soluzione tripsina-EDTA. - Raccogliere le cellule RPE con pipetta gentile. Raccogliere le cellule e la soluzione in un tubo conico riempito con 10 ml di terreno di coltura (glutammina al DMEM elevata con L-glutamina), compreso 10% siero di porcellino, antibiotico / antimicotico e piruvato di sodio (1 mM).
NOTA: Il siero può neutralizzare l'effetto della tripsina. - Centrifuga laCella a 400 xg per 5 min a temperatura ambiente.
- Rimuovere il surnatante e aggiungere 10 ml di terreno fresco. Centrifugare nuovamente nelle stesse condizioni per 5 min.
- Rimuovere il surnatante e aggiungere nuovo mezzo, in modo tale che la concentrazione delle cellule determini 5 x 10 5 cellule / mL (determinata contando le cellule usando un emocitometro). Mescolare bene con pipetta gentile.
- Distribuire la sospensione cellulare nei piatti di coltura cellulare. Utilizzare 3 ml per piatto di coltura da 60 mm di diametro.
NOTA: Questa coltura è chiamata passaggio zero (P0). - Mantenere le cellule in un incubatore di CO 2 a 5% a 37 ° C. Cambiare la metà del mezzo condizionato a fresco ogni secondo giorno.
- Subcultura (fase 1.2) se diventa confluente.
- Subcultura della coltura cellulare RPE
- Rimuovere il mezzo di coltura e sciacquare le cellule due volte con PBS (-).
- Incubare le cellule con soluzione PBS (-) con 0,05% di tripsina + 0,2% di EDTANa 5% CO 2 incubatore a 37 ° C per 5 min.
- Staccare le cellule RPE pipettando delicatamente e raccogliere la sospensione cellulare in un tubo conico riempito con 10 ml di terreno di coltura, compreso il siero di suini del 10%.
- Centrifugare la sospensione cellulare a 400 xg per 5 minuti a temperatura ambiente.
- Rimuovere il surnatante e aggiungere nuovo mezzo di coltura, rendendo la concentrazione cellulare 5 x 10 5 cellule / mL (determinata contando il numero di cellule con un emocitometro). Distribuire le celle in nuovi piatti di coltura da 60 mm, come descritto nel passaggio 1.1.13.
NOTA: la coltura delle cellule è ora il passaggio 1 (P1). - Una volta raggiunta la confluenza, subcultura la coltura P1 a P2, utilizzando la stessa procedura descritta nei passaggi 1.2.1-1.2.5. Dalla coltura P2, sementi le cellule su piatti più piccoli di coltura (diametro interno di 30 mm) invece di piatti di coltura di diametro di 60 mm.
- Per gli esperimenti, utilizzare le colture P2 o P3.
2. ThulIum irradiazione laser
- Costruzione della stazione di irraggiamento
- Collegare un dispositivo laser di tiuma (1,94 μm, range di potenza: 0-20 W) ad una fibra di diametro del centro di 0,22-NA, 365 μm.
- Fissare meccanicamente la punta in fibra al braccio metallico fissato orizzontalmente al supporto metallico verticale della stazione di irraggiamento. Posizionare l'albero verticale in modo che la punta della fibra laser sia posta sopra la piastra calda su cui deve essere posizionato il piatto di coltura cellulare durante l'irraggiamento.
- Posizionare un foglio bianco sulla piastra calda e girare il fascio di mira (λ = 635 nm, max = 1 mW, diametro a livello carta ≈ 30 mm). Segnare la circonferenza del fascio di mira sul foglio bianco in modo che sia nota la posizione in cui il piatto di coltura deve essere posto durante l'irradiazione.
NOTA: il piano z della punta della fibra può essere modificabile. Senza alcuna altra ottica di imaging, il diametro del punto laser sul piano di coltura delle cellule, posizionato 12 cm sotto la punta della fibra, iCirca 30 mm, quasi equivalente al diametro interno del piatto di coltura cellulare. Un disegno schematico della configurazione è mostrato in Figura 1 .

Figura 1: Immagine schematica della stazione di irradiazione laser di Thulium. Il piatto di coltura è posto sulla piastra riscaldante. Le cellule sono poste 12 cm sotto la punta della fibra del laser di tulium in modo che la dimensione del fascio sia quasi identica al diametro interno del piatto di coltura (circa 30 mm). La procedura di irradiazione laser è controllata da una routine controllata dal tempo della piattaforma di progettazione del sistema su misura. Prima di avviare il programma di irraggiamento, è necessario determinare l'impostazione di potenza. Clicca qui per visualizzare una versione più grande di questa figura.
- 1 h prima dell'irradiazione, sostituire completamente il mezzo di coltura con 1,2 ml di terreno fresco.
NOTA: questo è uno STEP CRITICO e deve essere rispettato rigorosamente. - Posizionare la stazione di irraggiamento ( cioè la piastra calda e il post con cui fissare la fibra laser) su una panca pulita.
- Rimuovere il piatto della coltura cellulare dall'incubatore e posizionarlo sulla posizione contrassegnata sulla piastra calda (passo 2.1.3).
- Indossare occhiali protettivi. Accendere il laser del tium. Impostare la potenza desiderata sul dispositivo laser (regolabili da 0 a 20 W). Spegnere l'emissione.
- Avviare una piattaforma di progettazione del sistema che controlla il protocollo di irradiazione laser e timing (file aggiuntivo).
- Immediatamente dopo aver posizionato il piatto di coltura sulla piastra calda, fare clic sul "tempo di preriscaldamento" per avviare il timer per 140 s ("tempo di preriscaldamento 1"); Questo manterrà la temperatura media della coltura a 37 ° C prima dell'irradiazione.
NOTA: dopo 140 secondi, un segnale acustico si accenderà e il timer successivo ("tempo di preriscaldamento 2") inizia automaticamente contando 8 s. Durante questo periodo di 8 s, l'esaminatore può aprire il piatto di coltura. Dopo 148 s di preriscaldamento, viene eseguita automaticamente un'irradiazione laser da 10 secondi sulla coltura cellulare. In caso di emergenza, dotare il dispositivo laser con un pulsante di arresto di forza per arrestare immediatamente il laser. Questo è un passaggio CRITICO e deve essere seguita rigorosamente. Un punto particolare di cautela riguarda l'apertura del coperchio del piatto appena prima dell'irradiazione, all'inizio del tempo di preriscaldamento di 8 sec. Apertura del coperchio può raffreddare rapidamente la superficie media. - Dopo l'irraggiamento, posizionare immediatamente la copertura sul piatto di coltura, lasciare il piatto di coltura sulla piastra calda per altri 7 secondi e riportarlo indietro nel 5% CO 2 incubatore a 37 ° C.
- Realizzare piccoli fori (circa 300 μm di diametro) vicino al fondo su quattro lati (ogni 90 °) di un piatto di coltura di diametro di 30 mm (senza celle); Utilizzare la punta di un ago (20G) riscaldato con un bruciatore di Bunsen. Sigillare i fori con nastro di isolamento elettrico dall'esterno e fare un piccolo foro con un ago fine in modo che solo un termocoppino fine (200 μm di diametro) possa essere inserito attraverso questo foro in condizioni impermeabili.
- All'esterno del fondo della piastra di coltura, disegnare 2 diametri perpendicolari e impostare il punto di attraversamento ( cioè il centro del lato inferiore) come coordinato zero (0). Segnare ogni 3 mm radialmente all'esterno il piatto ( cioè 0, 3, 6, 9, 12 e 15 mm) in ogni direzione lungo le linee ( figura 2 , punti blu); Il numero di punti dovrebbe essere complessivamente 21.
- Riempire il piatto di coltura cellulare con 1,2 ml di nuovo substrato di coltura. Mettere la cultura dSu un piatto caldo a 37 ° C, inserire una termocoppia (200 μm di diametro) nel foro laterale e posizionare la punta sensibile in una posizione marcata da misurare.
- Indossare occhiali protettivi. Accendere il laser di tiulio e impostare manualmente la potenza (tra 0 e 20 W, in incrementi 0,1 W) del laser.
NOTA: per la calibrazione della temperatura, le misure con potenza in incrementi di 3 W dovrebbero essere sufficienti. - Accendere la piattaforma di progettazione del sistema e fare clic sul pulsante "Avvio Temp. Acquisizione" (file aggiuntivo) per avviare la misurazione della temperatura.
- Eseguire la stessa procedura come al punto 2.2.6.
NOTA: Il programma di controllo misura la temperatura della termocoppia inserita ogni 100 ms e mostra la progressione della temperatura durante l'irradiazione nella GUI. - Eseguire queste procedure per tutti e 21 i punti di misura e alle diverse impostazioni di potenza. Ripetere l'intera procedura tre volte per tutti i punti e per tutta la potenza settinGs per ottenere dati affidabili.
- Esportare i dati della temperatura come dati csv, che possono eventualmente essere convertiti in un foglio di calcolo. Media la temperatura massima alla fine dell'irradiazione per le misurazioni triplicate in ogni punto. Media i valori dei punti sullo stesso cerchio (4 punti in totale, tranne il punto centrale).
- Tracciare la temperatura media misurata ottenuta su un grafico, facendo l'asse x e l'aumento della temperatura (ΔT, ° C) come l'asse y, la distanza dal centro del piatto (mm). Utilizza la funzione di misura di un programma software matematico per adattare un modello Gaussian ai dati grezzi. Creare una distribuzione della temperatura di misura Gauss.

Figura 2: I punti per la calibrazione della temperatura in un piatto di cultura della cella. I dati sulla temperatura sono stati misurati al centro e al 5Punti radiali su 4 angoli diversi (puntini blu). Clicca qui per visualizzare una versione più grande di questa figura.
3. Valutazione biologica per le risposte delle cellule dopo differenti irradiazione termica
- Valutazione della vitalità cellulare ( vale a dire, vivente, apoptotica e morta) dopo diverse impostazioni di potenza e determinazione della soglia di morte cellulare
- Nei punti indicati ( cioè 3, 24 e 48 ore dopo l'irraggiamento), lavare le cellule con PBS (-) e utilizzare un kit disponibile in commercio per valutare la vitalità delle cellule ( vale a dire, vitale, apoptotica, morta) protocollo.
- Preparare una soluzione di colorazione aggiungendo 5 μL di isotiocianato fluoresceina (FITC) -annexina V, 5 μL di homodimer III di etidio e 5 μL di Hoechst 33342 a 100 μl di 1x buffer di legame (tutti sono kitcomponenti). Preparare una soluzione di colorazione sufficiente per coprire le cellule. Incubare le cellule per 15 minuti.
- Lavare la coltura delle cellule con il buffer di legame due volte, sostituire il buffer di legame con PBS (-) e impostare la coltura sullo stadio di un microscopio a fluorescenza.
- Passare il percorso della luce all'obiettivo oculare, selezionare il filtro 4 ', 6-Diamidin-2-fenilindol (DAPI), accendere la luce di illuminazione e trovare il piano mirato con l'obiettivo 4x.
- Cambiare il percorso della luce alla fotocamera, individuare l'immagine sullo schermo del computer nel software di imaging del microscopio e regolare la messa a fuoco.
- Utilizzare la funzione punto ( cioè la funzione per registrare più immagini sul piatto e creare una singola immagine grande) del software specifico del microscopio per ottenere l'immagine di fluorescenza dell'intero piatto di coltura cellulare. Utilizzare 3 diversi set di filtri - DAPI, FITC e tetrametilrodamina (TRITC) - Immagini Hoechst 33342-cellule positive (tutti i nuclei cellulari), FITC-annexin V-positiVe (cellule apoptotiche), e cellule III eterogene omodimide etidium (morte), rispettivamente.
- Misurare il raggio (mm) della regione morta (ethidium homodimer III-positiva) e il raggio esterno / interno della regione a forma di banda apoptotica (annexin V-positiva) nelle colture cellulari macchiate. Applicare questi raggi alla funzione gaussiana montata della distribuzione della temperatura per la corrispondente impostazione di potenza. Calcolare la temperatura esatta al bordo della regione morta o apoptotica per chiarire le temperature di soglia per la morte cellulare e il cambiamento apoptotico.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Distribuzione della temperatura dopo diverse impostazioni di alimentazione
Tutti gli sviluppi della temperatura per ogni singolo irraggiamento sono stati monitorati nella taratura della temperatura. Da questi dati è stata ottenuta la temperatura massima del punto misurato e definita come T max (° C). Come mostrato in Figura 3A , il programma è stato eseguito nel momento in cui il piatto di coltura è stato posto sulla piastra riscaldante. Dopo il tempo di preriscaldamento di 140 s, necessario per archiviare una temperatura media stabile a 37 ° C, il coperchio del piatto di coltura è stato rimosso durante il tempo di preriscaldamento di 8 secondi. Al termine del "tempo di preriscaldamento 2", l'emissione laser è iniziata automaticamente. Questa curva è una progressione di temperatura rappresentativa per un'irraggiamento di 10 s. Durante l'irraggiamento, la temperatura aumenta e subito dopo l'emissione laserSpento, la temperatura ha cominciato a diminuire. La temperatura massima al centro del piatto di coltura è stata definita in questo studio come T max (° C). La T max era proporzionale al potere laser ( Figura 3B ). La Figura 3C mostra la distribuzione della temperatura massima per ogni potenza attraverso il piatto di coltura. Le distribuzioni sono a forma di campana, come mostrato nella Figura 3C , e adattano a una funzione Gaussiana secondo la seguente formula:
T (r) = t base + A · 
Dove r, base t, A e w stano per la distanza dal centro (mm), la temperatura più bassa della curva, l'ampiezza e la larghezza della curva rispettivamente. I parametri ( base t, A e w) del G montatoLa curva aussiana per ogni impostazione di potenza, vale a dire per ogni Tmax, è mostrata nella tabella accanto al grafico.
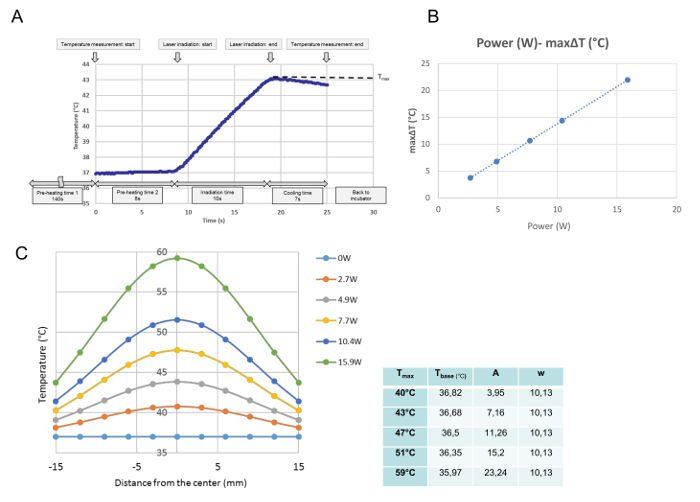
Figura 3: dati di calibrazione della temperatura. Uno sviluppo di temperatura rappresentativo nella posizione centrale dopo una singola irradiazione a 4,9 W (T max = 43 ° C) ( A ), la relazione proporzionale tra l'energia laser e la massima ΔT nella posizione centrale di una cultura cellulare ( B ) E distribuzioni di temperatura in tutto il piatto di cultura dopo diverse impostazioni di potenza (C). (A) Il programma viene eseguito dal momento in cui il piatto di coltura è posto sulla piastra riscaldante. Dopo 140 s di "tempo di preriscaldamento 1", necessario per archiviare una temperatura media stabile a 37 ° C, viene rimossa la copertura del piatto di coltura per il tempo di preriscaldamento di 8 volte2. "Alla fine del" tempo di preriscaldamento 2 ", l'emissione laser inizia automaticamente, questa curva rappresenta una progressione di temperatura rappresentativa nella posizione centrale durante un'irraggiamento a 10 a 4.9 W. Durante l'irraggiamento la temperatura aumenta e Subito dopo che l'emissione laser viene disattivata, la temperatura inizia a diminuire.La temperatura massima si ottiene alla fine dell'irraggiamento, che è definito in questo studio come T max (° C) (B) Il potere laser e il massimo L'aumento della temperatura (ΔT max ) è proporzionale (C) Le funzioni Gaussiane montate delle distribuzioni di temperatura misurate sul piatto di coltura I parametri delle funzioni, determinati con un programma software matematico, sono mostrati nella tabella a lato del grafico Clicca qui per visualizzare una versione più grande di questa figura.
Cellulare dopo l'irraggiamento termico
Come mostrato nella figura 4A , esistono tre differenti modelli di colorazione che indicano la stabilità cellulare dopo l'irradiazione laser: 1) nessun anidina V / etidio homodimer III-positivo ( vale a dire solo vivo), 2) annexin V-positivo al centro ( cioè quasi Solo apoptosi iniziale) e 3) l'etodio homodimer III-positivo al centro ( cioè cellule morte) circondato da cellule apoptotiche al confine tra cellule morte e vive ( Figura 4B ). La dimensione della zona morta / apoptotica è generalmente dipendente da T max e dal tempo di post-irraggiamento fino a 48 h dopo l'irraggiamento. Non è stata rilevata alcuna variabilità apparente di vitalità nelle colture irradiate con T max ≤43 ° C. L'unico cambiamento apoptotico potrebbe essere osservato in un momento iniziale (3 h), seguito da un ritardo Morte cellulare dopo un'irradiazione con T max = 47 ° C. La morte cellulare immediata o precoce (fino a 3 h) è stata trovata nelle colture irradiate con T max ≥ 51 ° C (Tabella 1).

Figura 4: Pattern of Viability Coloring dopo diverse impostazioni di potenza (A) e un'immagine esemplare all'orlo della zona morta e apoptotica dopo irradiazione laser letale (B).
(A) Tre modelli di colorazione possono verificarsi, a seconda della temperatura. (B) La zona apoptotica (FITC-annexin V-positivo: verde) intorno alla zona morta (etido homodimer III-positivo: rosso). Tutte le cellule sono positive per Hoechst 33342 (blu), e le cellule con nuclei blu sono le cellule vive. L'immagine è stata presa 24 h dopo un'irradiazione a T max = 59 ° C. Bar = 100 μm./files/ftp_upload/54326/54326fig4large.jpg "target =" _ blank "> Fare clic qui per visualizzare una versione più grande di questa figura.

Tabella 1: Responses di Annexin V e Ethidium Homodimer III a diverse temperature e tempi.
Determinazione della temperatura soglia per la morte cellulare
I raggi medi della zona morta (rossa) e l'area apoptotica (verde) sono stati misurati e applicati alla funzione gaussiana della distribuzione della temperatura per determinare le temperature di picco di soglia per la morte cellulare e l'apoptosi dopo 10 s di irradiazione. Secondo questa analisi, le temperature medie di soglia per la morte totale della cellula di 3 h, 24 h e 48 h dopo l'irraggiamento erano rispettivamente 54,0 ° C, 50,9 ° C e 50,1 ° C. Il thresho medioLa temperatura ld per il cambiamento apoptotico delle cellule era inferiore di circa 2-3 ° C, con temperature di soglia per 3 h, 24 h e 48 h a 51,7 ° C, 48,0 ° C e 47,0 ° C, rispettivamente ( Figura 5 ).
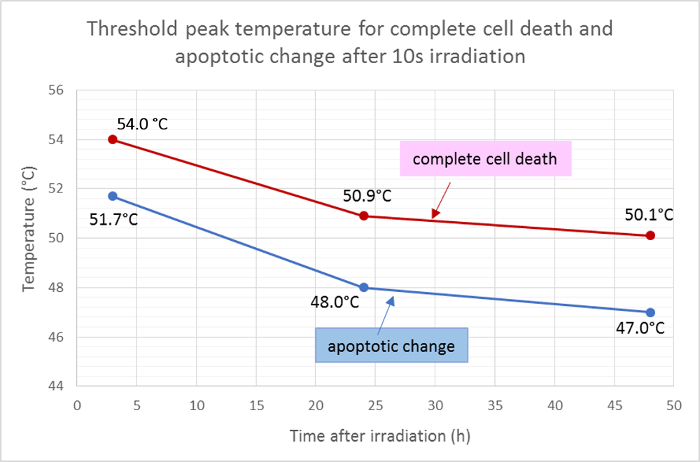
Figura 5: Temperature di soglia per l'apoptosi e la morte cellulare.
Temperature medie di soglia per la morte cellulare completa (positivi per Hoechst 33342, annexin V e homodimer III di etidio) e per apoptosi (positivi solo per Hoechst 33342 e annexin V) in diversi punti temporali dopo l'irraggiamento, calcolata dai risultati della colorazione della viabilità di fluorescenza . Clicca qui per visualizzare una versione più grande di questa figura.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Nel discutere le risposte cellulari biologiche correlate alla temperatura, non è solo la temperatura, ma anche la durata di tempo della temperatura aumentata, poiché la maggior parte dei processi biochimici dipende dal tempo. Particolarmente nel campo della ipertermia indotta dal laser in oculistica, a causa del breve periodo di tempo - da millisecondi a secondi - è difficile studiare gli effetti termici cellulari con un preciso controllo della temperatura. Pertanto, è desiderabile un'impostazione di irradiazione laser adatta al modello di coltura cellulare e con un sistema operativo che consente un controllo rigoroso della temperatura e del tempo. La valutazione biologica delle risposte cellulari dopo l'esposizione termica, come l'espressione o la secrezione di proteine, richiede valutazioni quantitative ripetute su un numero sufficiente di cellule interessate. Questo è stato un ostacolo agli studi con macchie laser di diverse centinaia di micrometri di diametro, come nei trattamenti clinici. L'analisi quantitativa in un singolo punto laser è abbastanza burdensome. In questo studio sono stati fatti tentativi per soddisfare queste richieste quanto più possibile. Utilizzando un laser di thulium ad onda continua con lunghezza d'onda di 1,94 μm con un programma di controllo dell'irradiazione, un'evoluzione temporale della temperatura potrebbe essere condotta in una coltura di cellule intere entro un breve lasso di tempo. Poiché la distribuzione della temperatura può essere regolata cambiando il percorso della luce, possono essere condotti diversi tipi di esperimenti legati all'ipertermia utilizzando questa impostazione.
La limitazione della tecnica presentata è l'impossibilità di effettuare misure di temperatura simultanee durante l'irradiazione laser delle cellule. Poiché l'uso di termocoppie non è adatto a colture cellulari sterilizzate, la calibrazione della temperatura deve essere condotta separatamente dall'irradiazione cellulare. Considerando le possibili variazioni dell'uscita di potenza laser, le misure di temperatura in tempo reale durante ogni irradiazione laser sarebbero ideali per valutare direttamente le risposte cellulari corrispondenti alleDose termica. Inoltre, la distribuzione di temperatura utilizzata qui è stata creata attraverso l'interpolazione dei dati basata sulle misurazioni a 21 punti su un piatto di coltura e in diverse impostazioni di potenza diverse. Pertanto, per superare questi limiti e punti critici, è nostro obiettivo sviluppare un metodo alternativo che consente la misura della temperatura del piatto di coltura mentre l'irradiazione laser viene eseguita. Abbiamo anche l'obiettivo di ottenere le informazioni sulla temperatura spaziale contemporaneamente. L'imaging infrarosso (termografia) è un metodo possibile per misurare la temperatura durante l'irradiazione laser 10 . Il grande vantaggio di questo metodo è la misurazione della temperatura in tempo reale a livello cellulare per ogni irraggiamento; Le successive risposte biologiche delle cellule possono essere sempre confrontate individualmente alla storia della temperatura durante l'irradiazione. Considerando la redditività e l'usabilità, tuttavia, utilizzando termografia per esperimenti di riscaldamento cellulare non è possibile per ogni laboratorioory.
Nel metodo che utilizza un laser di tiulio ad una lunghezza d'onda di 1,94 μm, l'acqua nel piatto di coltura cellulare viene riscaldata alla sua superficie, e la diffusione termica e la convezione vengono utilizzate per riscaldare le cellule. L'altezza del mezzo di coltura in questa configurazione di irraggiamento, con 1,2 ml di terreno di coltura, è di 935 μm nella posizione centrale (da una precedente misurazione utilizzando la tomografia di coerenza ottica). Il livello di assorbimento del laser di tiumio in acqua è molto elevato (coefficiente di assorbimento: 127 cm -1 a 35 ° C) e il 72% della luce viene assorbito nel primo 100 μm del mezzo di coltura. Non c'è quasi assorbimento (0,0007%) ad una profondità di 935 μm.
È importante notare che uno dei punti critici del protocollo è quello di aggiungere la stessa quantità di mezzo (1.200 μL) per ogni irraggiamento. L'utilizzo di diverse quantità di terreno di coltura può portare alle differenze di altezza, che possono causare differenze nella temperatura iNcrease delle cellule. Il secondo punto critico riguarda il tempo di apertura del piatto di coltura. Deve essere fatto allo stesso tempo - in questo studio, 8 s prima dell'inizio dell'irradiazione, quando il sistema emette un suono. Le differenze in questo tempo possono variare la temperatura di base a causa del raffreddamento causato dall'aria circostante (circa 23 ° C). Ciò può portare a differenze significative nella temperatura indotta dal laser.
Per la calibrazione della temperatura, la stessa quantità di mezzo (1,2 mL) utilizzata negli esperimenti è stata utilizzata per misurare la distribuzione della temperatura in fondo ai piatti di coltura senza cellule. Tuttavia, l'altezza media con un monostrato cellulare può essere diversa da quella senza celle, anche con lo stesso volume di media aggiunto. La misurazione usando la tomografia di coerenza ottica ha rivelato che vi è una differenza di 58 μm nella posizione centrale tra i piatti con e senza un monolayer cellulare confluente (877 μm senza cellule, rispetto aO 935 μm con le cellule). Questa differenza è potenzialmente dovuta all'azione capillare delle cellule. La differenza di altezza di 58 μm nella posizione centrale può essere causata da circa 40 μL di media (dati misurati). È stato anche confermato che questa differenza di altezza non ha causato differenze significative in T max in tutte le impostazioni di alimentazione. Pertanto, abbiamo concluso che questa differenza non influenza in modo significativo i risultati delle analisi effettuate in questo studio. Tuttavia, per raccogliere informazioni di temperatura più precise, come scritto sopra, dovrebbe essere sviluppato un metodo per calibrare la temperatura utilizzando un piatto di coltura di cellule contenente un monolayer cellulare. Inoltre, è necessaria anche la modellazione matematica della diffusione termica e della convezione in tutto il mezzo di coltura.
In questo studio le cellule sono state riscaldate con una distribuzione di temperatura Gaussiana. Ci sono diversi metodi possibili per riscaldare tutto il mezzo in modo più uniforme nel tempo. Uno È utilizzare una sorgente laser con un coefficiente di assorbimento inferiore in acqua. Tuttavia, l'inconveniente è che, in questo caso, i laser devono avere un potere più elevato, in quanto solo una piccola percentuale della luce viene assorbita per circa 0,9 mm. Un'altra possibilità è quella di rappresentare la punta di fibra distale di una fibra ottica multimodale che trasmette la luce laser nel piano del piatto di coltura; L'ingrandimento può essere scelto arbitrariamente dall'ottica.
Il secondo punto di riferimento di questo protocollo è la sua capacità di determinare la temperatura di soglia per la morte cellulare e l'apoptosi utilizzando l'immagine fluorescente della colorazione della vitalità e la distribuzione laterale della temperatura. Un obiettivo a lungo termine non è solo quello di determinare la vitalità cellulare, ma anche di chiarire l'intervallo di temperatura delle risposte biologiche delle cellule relative alla funzionalità cellulare, come l'espressione di proteine e la proliferazione cellulare. La determinazione della temperatura soglia di morte cellulare è di grande interesse per i ricercatori"> 10. Utilizzando questo metodo, potrebbe essere possibile determinare i fattori critici per la morte cellulare, inclusa l'apoptosi. I fattori critici per la morte cellulare causata dal laser termico potrebbero essere determinati non solo attraverso la storia della temperatura, ma anche attraverso i fattori endogeni ( Cioè, fattori intra / extra-cellulari a livello molecolare), rispondendo a queste domande potrebbe aprire la strada per la comprensione dei meccanismi di morte cellulare e della cinetica dopo diverse esposizioni termiche e in diverse patologie retiniche e può anche contribuire a chiarire problemi clinicamente osservati, Come la differenza inter-individuale in risposta al trattamento laser o la variabilità della dimensione delle cicatrici dopo la fotocoagulazione retinica, anche quando la dimensione iniziale era quasi identica ("creep atrofica") 11 .
Lo scopo finale di questo studio è quello di aiutare nello sviluppo della terapia fototermica controllata dalla temperatura della retina. Per raggiungere questo obiettivo, in parallelo wiL'avanzamento tecnico della misurazione della temperatura 3 , ulteriore chiarimento del comportamento delle cellule RPE dopo l'esposizione termica, determinato con questo metodo, sarà di grande utilità.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Gli autori non hanno nulla da rivelare.
Acknowledgments
Questo lavoro è stato sostenuto da una sovvenzione di ricerca del Ministero Federale tedesco della Pubblica Istruzione e della Ricerca (BMBF) (sovvenzione # 13GW0043C) e di un ufficio europeo per la ricerca e lo sviluppo aerospaziale (EOARD, concedere il numero # FA9550-15-1-0443)
Materials
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Dulbecco’s Modified Eagle’s Medium - high glucose | Sigma-Aldrich | D5796-500ML | Add (2)-(4) before use. Warm in 37 °C water bath before use. |
| Antibiotic Antimycotic Solution (100 ×) | Sigma-Aldrich | A5955-100ML | Containing 10,000 units penicillin, 10 mg streptomycin and 25 μg Amphotericin B in 1mL. Add 5.5 mL in 500 mL medium bottle (1) before use. |
| Sodium pyruvate (100 mM) | Sigma-Aldrich | S8636-100ML | Add 5.5 mL in 500 mL medium bottle (1) before use (final concentration: 1 mM) |
| Porcine serum | Sigma-Aldrich | 12736C-500ML | Add 50 mL in 500 mL medium bottole (1) before use (final: 10%) |
| Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537-500ML | |
| Trypsin from porcine pancreas | Sigma-Aldrich | T4799-25G | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | ED-100G | |
| Human VEGF Quantikine ELISA Kit | R&D System | DVE00 | |
| Oxiselect Total Glutathione Assay Kit | Cell Biolabs, Inc | STA-312 | |
| Apoptotic/Necrotic/Healthy Cells Detection Kit | PromoKine | PK-CA707-30018 | |
| Name | Company | Catalog Number | Comments |
| Equipments | |||
| Thulium laser | Starmedtec GmbH | Prototype | 0-20 W |
| 365 mm core diameter fiber | LASER COMPONENTS Germany | CF01493-52 | |
| Thermocouple | Omega Engineering Inc | HYP-0- 33-1-T-G-60-SMPW-M | |
| Heating plate | MEDAX | ||
| Microplate reader (spectrofluorometer) | Molecular Device | Spectramax M4 | |
| cell homogenizer | QIAGEN | TissueLyser LT | |
| Fluorescence microscope | Nikon | ECLIPSE Ti | |
| mathematical software program | The Mathworks. Inc | MATLAB Release 2015b | |
| system-design platform | National Instrument | Labview | Laboratory Virtual Instrument Engineering Workbench |
References
- Inagaki, K., et al. Comparative efficacy of pure yellow (577-nm) and 810-nm subthreshold micropulse laser photocoagulation combined with yellow (561-577-nm) direct photocoagulation for diabetic macular edema. Jpn J Ophthalmol. 59 (1), 21-28 (2015).
- Roider, J., et al. Selective retina therapy (SRT) for clinically significant diabetic macular edema. Graefes Arch Clin Exp Ophthalmol. 248 (9), 1263-1272 (2010).
- Brinkmann, R., et al. Real-time temperature determination during retinal photocoagulation on patients. J Biomed Opt. 17 (6), 061219 (2012).
- Yoshimura, N., et al. Photocoagulated human retinal pigment epithelial cells produce an inhibitor of vascular endothelial cell proliferation. Invest Ophthalmol Vis Sci. 36 (8), 1686-1691 (1995).
- Denton, M. L., et al. Damage Thresholds for Exposure to NIR and Blue Lasers in an In Vitro RPE Cell System. Invest Ophthalmol Vis Sci. 47 (7), 3065-3073 (2006).
- Shrestha, R., Choi, T. Y., Chang, W., Kim, D. A high-precision micropipette sensor for cellular-level real-time thermal characterization. Sensors (Basel). 11 (9), 8826-8835 (2011).
- Gao, F., Ye, Y., Zhang, Y., Yang, J. Water bath hyperthermia reduces stemness of colon cancer cells. Clin Biochem. 46 (16-17), 1747-1750 (2013).
- Jansen, E. D., van Leeuwen, T. G., Motamedi, M., Borst, C., Welch, A. J. Temperature dependence of the absorption coefficient of water for midinfrared laser radiation. Lasers Surg Med. 14 (3), 258-268 (1994).
- Iwami, H., Pruessner, J., Shiraki, K., Brinkmann, R., Miura, Y. Protective effect of a laser-induced sub-lethal temperature rise on RPE cells from oxidative stress. Exp Eye Res. 124, 37-47 (2014).
- Denton, M. L., et al. Spatially correlated microthermography maps threshold temperature in laser-induced damage. J Biomed Optics. 16 (3), (2011).
- Morgan, C. M., Schatz, H. Atrophic creep of the retinal pigment epithelium after focal macular photocoagulation. Ophthalmology. 96 (1), 96-103 (1989).



