Summary
1.94 μm 연속파 레이저 방사를 사용하여 배양 접시에서 세포를 가열하는 독창적 인 실험 장치를 소개합니다. 이 방법을 사용하여 다양한 열 노출 후 망막 색소 상피 세포 (RPE)의 생물학적 반응을 조사 할 수 있습니다.
Abstract
생물학적 평가를 위해 1.94 μm 연속파 툴륨 레이저를 사용하여 배양 된 세포를 가열하는 독창적 인 방법을 소개합니다. 툴륨 레이저 방사는 물에 강하게 흡수되며 배양기 바닥의 세포는 열 확산을 통해 가열됩니다. 365 μm의 직경을 가진 레이저 섬유는 배양 접시의 약 12 cm 위에 놓여 있으며, 레이저 빔 직경은 배양 접시 (30 mm)의 내경과 거의 동일합니다. 각 실험에서 일관된 양의 배양 배지를 유지함으로써 재현성 높은 온도 증가로 세포를 조사 할 수 있습니다.
각각의 파워 세팅을 위해 하나의 세포 배양 접시에서 온도 증가 및 그 분포를 보정하기 위해, 온도는 상이한 위치 및 세포 수준에서 10 초 동안 조사되었다. 온도 분포는 수학 그래픽 소프트웨어프로그램, 문화 격판 덮개의 맞은 편에 그것의 본은 가우스 모양에서이었다. 레이저 조사 후, 온도 의존성 세포 반응을 평가하기 위해 상이한 생물학적 실험을 수행 할 수있다. 이 원고에서 생존 염색 (생존, 세포 자멸 및 사멸 세포 구별)은 시간 경과에 따른 세포 사멸 및 사망의 역치 온도를 결정하는 데 도움이됩니다.
이 방법의 장점은 전체 세포 배양 접시에서 가열 세포의 고효율뿐만 아니라 온도 및 가열 시간의 정확성입니다. 또한, 컴퓨터 운영 체제로 잘 제어 할 수있는 다양한 온도 및 시간 간격으로 학습 할 수 있습니다.
Introduction
온도 의존성 세포 생물학적 반응을 이해하는 것은 성공적인 고온 치료에 매우 중요합니다. 안과에서 사용되는 열 레이저로 망막 레이저 광응고술은 의학에서 가장 잘 알려진 레이저 치료법 중 하나입니다. 주로 녹색에서 노란색 파장의 가시 광선이 망막 레이저 치료에 사용됩니다. 빛은 망막 색소 상피 (RPE) 세포에서 멜라닌에 의해 많이 흡수되며 망막의 최 외각 세포 단층을 형성합니다. 여러 종류의 망막 장애에 대한 새로운 치료 전략으로 매우 가벼운 열 방사선 (sub-visible photocoagulation)에서 의사와 연구자들 사이에 최근의 관심이있었습니다 1,2 . 이러한 추세에 따라, 우리의 관심은 온도 조절 광열 요법 (TC-PTT)이라는 정확한 온도 조절하에 RPE 세포를 치사 적으로 가열하는 것에 있습니다.
최근 옵토우리 연구소의 음향 기술은 망막의 조사 된 부위에서 온도 증가를 실시간으로 측정 할 수있게 해주었습니다. 이로써 조사 중 온도 상승을 제어 할 수 있습니다 3 . 그러나 온도를 측정하고 조절할 수 없기 때문에 RPE 세포를 준 사염 적으로 가열함으로써 망막의 치명적이지 않은 고열이 이전에 고려되지 않았기 때문에 열 레이저 조사 후 RPE 세포의 온도 의존 세포 반응은 지금까지 연구 된 적은 거의 없다. 더욱이, 온도차는 상세하게 논의되지 않았을뿐만 아니라 준 치명적 및 치명적 조사 후에 살아남은 세포의 세포 행동의 차이도 또한 상세하게 논의되지 않았다. 따라서 TC-PTT 기반 치료법에 대한 과학적 증거를 수집하기 위해 우리는 온도 의존적 인 RPE 세포 생물학적 반응 및 시험 관내 실험 장치를 사용하여 그 기전을 밝혀내는 것을 목표로한다.
t그의 목적은 다음과 같은 조건을 충족시키는 세포 가열 장치를 확립하는 것이 필요하다 : 1) 빠른 온도 증가 가능성, 2) 정확한 시간 및 온도 제어, 3) 생물학적 실험을위한 비교적 많은 수의 검사 세포 . 가열 방법과 관련하여, 주파수가 두 배로 증가한 Nd.YAG 레이저 (532 nm)와 같은 임상 레이저는 불행히도 세포 배양 가열에 적합하지 않습니다. 이는 배양 된 RPE 세포에서 멜라노 좀의 수가 크게 감소했기 때문입니다. 레이저 광 흡수는 불균일 할 수 있으며 세포 수준에서의 온도 증가는 동일한 복사 전력으로 조사 된 경우에도 실험간에 가변적입니다. 몇몇 이전의 연구는 실험 5 , 6 전에 배양 세포에 의해 탐식 된 추가 멜라노 좀의 사용 또는 조사 4 동안 접시 바닥 아래에 검은 종이의 사용을보고했다. 많은온열 플레이트, 수 욕조 또는 온도 설정이 7 인 CO2 배양기를 사용하여 고열로 유발 된 세포 반응을 평가하기위한 시험 관내 생물학적 연구가 수행되었습니다. 이러한 방법은 원하는 온도에 도달하는 데 약간의 시간 ( 즉, 몇 분)이 걸리므로 가열 시간이 길어야합니다. 또한, 이러한 방법을 사용하면 세포 수준에서 상세한 열 이력 (시간에 온도를 곱한 값)을 얻는 것이 어렵습니다. 또한, 하나의 배양 접시에서 상이한 위치의 세포들 사이의 온도는 가변 온도 확산으로 인해 다를 수있다. 생물학적 세포 반응이 온도의 증가와 온도의 지속 시간에 의해 결정적으로 영향을받을지라도, 대부분의 경우 고온 치료 중이 시간 및 공간 온도 정보는 생물학적 분석을 위해 고려되지 않았습니다.
이러한 문제를 극복하기 위해 conti여기에 nuous-wave thulium 레이저를 사용하여 세포를 가열했다. 툴륨 레이저 방사 (λ = 1.94 μm)는 물에 의해 강하게 흡수되며, 배양 접시의 바닥에있는 세포는 열확산을 통해 단독으로 열 자극을 받는다. 365-μm 직경의 레이저 섬유는 배양 접시 위에서 약 12cm 위에 놓았으며 그 사이에는 광학 장치가 없습니다. 레이저 광선의 직경은 배양 접시 표면의 배양 접시 (30mm)의 내경과 거의 동일하게 발산한다. 배양액의 양이 일정한 경우 세포의 온도 상승을 조사 할 수있다 높은 반복성. 가변 출력 설정은 최대 20W의 조사가 가능하며 세포 수준의 중간 온도는 10 초 동안 ΔT ≈ 26 ° C까지 증가 할 수 있습니다.
조사 조건을 변경함으로써, 레이저 빔 프로파일을 변경하여 온도 분포를 변화시킬 수있다문화 요리에. 예를 들어, 현재의 연구 에서처럼 가우스 형태의 온도 분포로 또는 균질 한 온도 분포로 조사하는 것이 가능합니다. 후자는 치명적이지 않은 온도 증가에 대해서는 온도 의존성 세포 반응의 효과를 조사하는데 유리하지만 세포 사멸 스트레스 또는 상처 치유 반응에는 유리하지 않을 수있다.
전체적으로, 툴륨 레이저 조사는 상이한 열 노출 후에 유전자 / 단백질 발현, 세포 사멸 동력학, 세포 증식 및 세포 기능 발달과 같은 여러 종류의 생물학적 요인을 조사 할 수 있습니다.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. RPE 세포 배양
- 돼지 눈에서 RPE 세포 분리
- 지역의 도축장에서 새롭게 적출 된 돼지 눈을 구하십시오. 차가운 곳 (4 ° C)과 어두운 곳에서 보관하십시오.
- 가위로 세포 외 조직을 제거하고 눈을 소독액에 5 분간 담근다.
- 사용하기 전 칼슘과 마그네슘이없는 멸균 된 인산 완충 식염수 (PBS (-))에 눈을 넣으십시오.
- 메스를 사용하여 각막 윤부 후방 약 5 mm에서 공막을 관통시킵니다. 각막 윤부와 평행하게 모든 방법을 통해 가위로 절단하여 눈 앞부분 전체를 절제하십시오.
- 눈 앞부분 ( 즉, 각막과 렌즈)과 유리체를 제거하십시오. PBS (-) 1 ML을 추가하고 부드럽게 신경 망막을 제거합니다.
참고 :이 "안구 컵"은 공막, 맥락막 및 RPE로 구성되어 이제 준비되었습니다. - P에서 예열 된 (37 ° C) 0.25 % 트립신 추가BS (-)를 아이 컵에 넣으십시오. 아이 컵의 약 80 %가이 트립신 용액으로 채워지도록 볼륨을 조절하십시오.
- 37 ° C에서 10 분 동안 5 % CO 2 배양기에서 트립신 용액으로 아이 컵을 배양하십시오.
- 인큐베이터에서 아이 컵을 제거하고 0.05 % 트립신 + 0.2 % ethylenediaminetetraacetic 산 tetrasodium 소금 (EDTA · 4N)와 PBS (-) 솔루션과 0.25 % 트립신 솔루션을 대체하십시오. 45 분 동안 인큐베이터에서 아이 컵을 품어 라.
참고 : 45 분 후 RPE 세포는 Bruch의 막에 느슨하게 부착되거나 이미 분리되어 트립신 -EDTA 용액에 부유합니다. - 부드러운 pipetting하여 RPE 세포를 수집합니다. 10 % 돼지 혈청, 항생제 / antimycotic 및 나트륨 pyruvate (1 MM)를 포함하여 문화 매체 (L - 글루타민과 DMEM 높은 포도당), 10 ML으로 가득 원뿔 튜브에있는 세포와 솔루션을 수집합니다.
참고 : 혈청은 트립신의 효과를 중화시킬 수 있습니다. - 원심 분리기실온에서 5 분 동안 400 xg에서 세포 현탁액.
- 뜨는을 제거하고 신선한 매체 10 ML을 추가합니다. 같은 조건에서 5 분 동안 다시 원심 분리하십시오.
- 세포 농도가 5 x 10 5 세포 / ML (hemocytometer를 사용하여 세포를 계산하여 결정) 결과에 따라 뜨는을 제거하고 새로운 매체를 추가합니다. 부드러운 pipetting하여 잘 섞는다.
- 세포 현탁액을 세포 배양 접시에 분배하십시오. 직경 60mm의 배양 접시 당 3ml를 사용하십시오.
참고 :이 배양을 통로 영 (P0)이라고합니다. - 37 ° C에서 5 % CO 2 배양기에서 세포를 유지하십시오. 매 2 일마다 조정 된 배지의 반을 새로운 배지로 변경하십시오.
- 합류하는 경우 이관 (1.2 단계).
- RPE 세포 배양의 계대
- 배양액을 제거하고 PBS (-)로 세포를 두 번 헹구십시오.
- 0.05 % 트립신 + 0.2 % EDTA와 PBS (-) 솔루션으로 세포를 품어5 % CO 2 배양기에서 37 ℃로 5 분간 배양 하였다.
- 부드러운 pipetting하여 RPE 세포를 분리하고 10 % 돼지 혈청을 포함한 10 ML의 매체로 가득 원뿔 튜브에 세포 현탁액을 수집하십시오.
- 상온에서 5 분 400 XG에서 세포 현탁액을 원심 분리기.
- 뜨는를 제거하고 세포 농도 5 X 10 5 세포 / ML (hemocytometer와 셀 수를 계산하여 결정) 만들기, 새로운 문화 매체를 추가합니다. 단계 1.1.13에서 설명한대로 새로운 60mm 직경의 문화 요리에 세포를 배포합니다.
참고 : 세포 배양 물은 이제 1 번 관절입니다 (P1). - confluency에 도달 한 후, 단계 1.2.1-1.2.5에서 설명한 동일한 절차를 사용하여 P1 문화를 P2로 subculture. P2 문화에서 60mm 직경의 문화 요리 대신 작은 문화 요리 (30mm 내경)에 세포를 뿌리십시오.
- 실험을 위해서는 P2 또는 P3 배양 물을 사용하십시오.
2. Thulium 레이저 조사
- 조사 스테이션의 건설
- 툴륨 레이저 장치 (1.94 μm, 전력 범위 : 0-20 W)를 0.22 NA, 365 μm 코어 직경의 광섬유에 연결하십시오.
- 조사 스테이션의 수직 금속 포스트에 수평으로 고정 된 금속 팔에 섬유 팁을 기계적으로 고정합니다. 레이저 섬유의 끝이 세포 배양 접시가 조사하는 동안 배치되는 뜨거운 접시 위에 위치하고 있도록 수직 게시물을 놓습니다.
- 핫 플레이트에 흰 종이를 놓고 조준 광선을 켜십시오 (λ = 635 nm, 최대 = 1 mW, 종이 레벨에서 지름 ≈ 30 mm). 백혈구에 조준 광선의 주위를 표시하여 배양 접시가 방사선 조사 중에 놓이는 위치를 알 수 있도록하십시오.
참고 : 섬유 팁의 z- 평면은 변경 가능할 수 있습니다. 추가 이미징 광학이 없으면, 세포 배양면의 레이저 스폿 직경은 섬유 팁 아래 12cm에 위치한다.약 30mm로 세포 배양 접시의 내경과 거의 동일하다. 설정의 개략도가 그림 1에 나와 있습니다.

그림 1 : 툴륨 레이저 조사 스테이션의 개략적 인 이미지. 배양 접시는 가열판에 놓는다. 세포는 트럼륨 레이저 섬유 팁 아래 12cm에 위치하여 빔 크기가 배양 접시 (약 30mm)의 내경과 거의 동일하게됩니다. 레이저 조사 절차는 맞춤형 시스템 설계 플랫폼의 시간 제어 루틴에 의해 제어됩니다. 조사 설정 프로그램을 시작하기 전에 전원 설정을 결정해야합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 조사 1 시간 전에, 배지를 완전히 새로운 배지 1.2 mL로 교체한다.
참고 : 이것은 중요한 단계이므로 엄격히 준수해야합니다. - 깨끗한 벤치에 조사 스테이션 ( 예 : 핫 플레이트 및 레이저 파이버를 고정 할 포스트)을 놓습니다.
- 인큐베이터에서 세포 배양 접시를 꺼내 핫 플레이트의 표시된 위치에 놓습니다 (2.1.3 단계).
- 보호 안경을 착용하십시오. 툴륨 레이저를 켭니다. 레이저 장치에서 원하는대로 전원을 설정합니다 (0 - 20W에서 조정 가능). 방출을 켜십시오.
- 레이저 조사 및 타이밍 프로토콜 (보충 파일)을 제어하는 시스템 설계 플랫폼을 시작하십시오.
- 배양 접시를 핫 플레이트에 놓은 직후 "pre-heating time"을 클릭하여 140 초 동안 타이머를 시작합니다 ( "예열 시간 1"). 이것은 배지 온도를 3 ℃로 유지할 것이다.조사 전 7 ° C.
참고 : 140 초 후에 삐 소리가 켜지고 다음 타이머 ( "예열 시간 2")가 자동으로 8 초를 시작합니다. 이 8 초 동안, 심사관은 문화 요리를 열 수 있습니다. 148 초의 예열 후, 세포 배양에 10 초간 레이저 조사가 자동으로 수행됩니다. 응급 상황이 발생하면 즉시 레이저를 멈추기 위해 레이저 장치에 강제 종료 버튼을 장비하십시오. 이것은 중요한 단계이며 반드시 지켜 져야합니다. 특별한주의 사항은 8 초의 예열 시간이 시작될 때, 조사 직전에 접시의 덮개를 여는 것과 관련이 있습니다. 덮개를 열면 매체 표면이 매우 빨리 냉각 될 수 있습니다. - 조사 후 즉시 문화 접시에 다시 커버를 놓고 추가 7 초 동안 뜨거운 접시에 문화 접시를두고 37 ° C 5 % CO 2 배양기에 다시 놓습니다.
- 세포가없는 30mm 직경의 배양 접시의 4면 (90 °마다)의 바닥에 가까운 작은 구멍 (직경 약 300 μm)을 만듭니다. 분젠 버너로 가열 한 바늘 (20G)의 끝 부분을 사용하십시오. 구멍을 외부로부터 절연 테이프로 밀봉하고 미세 바늘로 작은 구멍을 만들어 방수 조건에서이 구멍을 통해 미세한 열전대 (직경 200 μm) 만 삽입되도록하십시오.
- 배양 접시 바닥면의 바깥쪽에 2 개의 수직 직경을 그리고 교차점 ( 즉, 바닥면 중앙)을 좌표 영 (0)으로 설정합니다. 선을 따라 각 방향으로 요리 ( 즉, 0, 3, 6, 9, 12 및 15 mm) 외부로 방사형으로 3 mm마다 표시합니다 ( 그림 2 , 파란색 점). 점수는 총 21 점이어야합니다.
- 세포 배양 접시에 1.2 mL의 새로운 배지를 채 웁니다. 문화 d 배치37 ° C에서 핫 플레이트에 올려 놓고, 옆 구멍에 미세한 열전대 (직경 200 μm)를 삽입하고 표시된 민감한 팁을 측정 할 표시된 위치에 놓습니다.
- 보호 안경을 착용하십시오. 툴륨 레이저를 켜고 레이저 장비의 전원을 수동으로 설정합니다 (0.1W 단위로 0W에서 20W 사이).
참고 : 온도 보정의 경우 전원을 3W 단위로 측정하면 충분합니다. - 시스템 설계 플랫폼을 켜고 "Start Temp.Aquisition"버튼 (보충 파일)을 클릭하여 온도 측정을 시작하십시오.
- 2.2.6 단계와 동일한 절차를 수행합니다.
참고 : 제어 프로그램은 삽입 된 열전쌍의 온도를 100ms마다 측정하고 GUI에서 조사 도중 온도 진행을 표시합니다. - 21 개의 모든 측정 지점과 다른 전원 설정에 대해이 절차를 수행하십시오. 모든 포인트와 모든 파워 셋팅에 대해 전체 과정을 3 번 반복하십시오.신뢰할 수있는 데이터를 얻을 수 있습니다.
- 온도 데이터를 csv 데이터로 내 보내면 결국 스프레드 시트로 변환 될 수 있습니다. 각 포인트에서 3 회 측정을 위해 조사가 끝날 때 최대 온도를 평균화합니다. 동일한 원에있는 점의 평균값입니다 (중심점을 제외한 총 4 점).
- 그래프에서 얻은 평균 최대 온도를 플롯하여 접시의 중심으로부터의 거리 (mm)를 x 축으로하고 온도 증가 (ΔT, ° C)를 y 축으로합니다. 수학적 소프트웨어 프로그램의 fit 함수를 사용하여 가우시안 모델을 원시 데이터에 맞 춥니 다. 가우스 피팅 온도 분포를 만듭니다.

그림 2 : 하나의 세포 배양 접시에서 온도 보정을위한 요점. 온도 데이터는 중앙 및 5에서 측정되었다.방사형 점 4 가지 각도 이상 (파란색 점). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. 열 방사선 조사 후의 세포 반응에 대한 생물학적 평가
- 다양한 전원 설정 및 세포 사망 문턱치의 결정에 따라 세포 생존력 ( 즉, 생존, 세포 사멸 및 사멸) 평가
- 표시된 시점 ( 즉, 방사선 조사 후 3, 24 및 48 시간)에 PBS (-)로 세포를 씻고 시판중인 키트를 사용하여 제조 회사의 지침에 따라 세포 생존력 ( 즉, 중요 세포, 사멸 세포, 죽은 세포)을 평가합니다. 실험 계획안.
- fluorescein isothiocyanate (FITC) - anexin V 5 μL, ethidium homodimer III 5 μL, Hoechst 33342 5 μL를 1x binding buffer 100 μL에 첨가하여 염색 용액을 준비하십시오.구성 요소). 세포를 덮기에 충분한 염색 용액을 준비하십시오. 15 분 동안 세포를 품어.
- 결합 버퍼로 두 번 세포 배양을 씻어 PBS (-)로 바인딩 버퍼를 교체하고 형광 현미경의 무대에서 문화를 설정합니다.
- 빛의 경로를 접안 렌즈로 전환하고 4 ', 6-Diamidin-2-phenylindol (DAPI) 필터를 선택하고 조명 등을 켜고 4x 대물 렌즈로 초점을 맞춘 평면을 찾으십시오.
- 카메라의 빛 경로를 변경하고 현미경 이미징 소프트웨어에서 컴퓨터 화면의 이미지를 찾은 다음 초점을 조정합니다.
- 전체 세포 배양 접시의 형광 이미지를 얻기 위해 스티치 기능 ( 즉, 접시에 여러 이미지를 기록하고 단일 대형 이미지를 만드는 기능)을 사용하여 현미경 특유의 소프트웨어를 사용하십시오. DAPI, FITC 및 tetramethylrhodamine (TRITC)의 3 가지 필터 세트를 사용하여 Hoechst 33342 양성 세포 (모든 세포 핵), FITC-annexin V-positive 세포 (apoptotic), ethidium homodimer III- 양성 세포 (죽은 세포)가있다.
- 죽은 (ethidium homodimer III 양성) 부위의 반경 (mm)과 염색 된 세포 배양에서의 apoptotic (annexin V- 양성) band-form 부위의 외경 / 내경을 측정하십시오. 해당 반경 설정 값에 맞는 온도 분포의 가우스 함수를 적용하십시오. 세포 사멸 및 세포 사멸 변화를위한 임계 온도를 명확히하기 위해 죽은 또는 apoptosis 영역의 림에서 정확한 온도를 계산하십시오.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
다양한 전원 설정 후 온도 분포
각 단일 조사에 대한 모든 온도 변화는 온도 보정에서 모니터링되었습니다. 이 데이터로부터 측정 된 점에서 최대 온도가 구해지고 T max (℃)로 정의됩니다. 도 3A에 나타낸 바와 같이, 배양 접시가 가열판에 놓인 시점에서 프로그램을 수행 하였다. 37 ° C에서 안정된 중간 온도를 보관하는 데 필요한 140 초의 "예열 시간 1"후 8 초의 예열 시간 2 동안 배양 접시의 덮개가 제거되었습니다. "예열 시간 2"가 끝나면 레이저 방출이 자동으로 시작됩니다. 이 곡선은 10 초 조사의 대표적인 온도 진행입니다. 조사 동안, 온도는 증가하였고, 레이저 방출 직후꺼지면 온도가 내려 가기 시작했습니다. 배양 접시의 중심에서 최대 온도는 본 연구에서 T max (℃)로 정의되었다. T max 는 레이저 출력에 비례한다 ( 그림 3B ). 도 3C 는 배양 접시에 걸친 각 힘의 최대 온도 분포를 나타낸다. 분포는 도 3c에 도시 된 바와 같이 종형이며, 다음 식에 따라 가우스 함수에 적합하다 :
t (r) = tbase + A · 
여기서 r, t base , A 및 w는 중심에서의 거리 (mm), 곡선의 최저 온도, 진폭 및 곡선의 폭을 나타냅니다. 장착 된 G의 파라미터 (t base , A, w)각 전력 설정에 대한 aussian 곡선, 즉 각 T max 에 대한 그래프가 그래프 옆의 테이블에 표시됩니다.
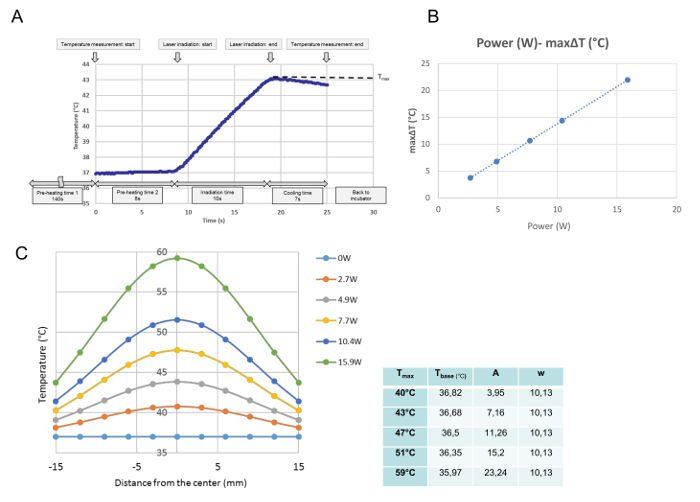
그림 3 : 온도 보정 데이터. 4.9 W (T max = 43 ° C)의 단일 조사 후 중심 위치에서의 대표 온도 발달 ( A ), 세포 배양의 중심 위치에서 레이저 출력과 최대 ΔT 사이의 비례 관계, 및 다른 온도 설정 (C) 후 문화 요리에 걸쳐 온도 분포. (A) 배양 접시가 가열판에 놓인 시점부터 프로그램을 수행한다. 37 ° C에서 안정적인 중간 온도를 보관하는 데 필요한 "예열 시간 1"의 140 초 후에 배양 접시의 덮개가 8 초의 예열 시간 동안 제거됩니다2. "예열 시간 2"가 끝날 때 레이저 방출이 자동으로 시작됩니다.이 곡선은 4.9W에서 10 초간 조사하는 동안 중심 위치에서 대표적인 온도 진행입니다. 조사 중 온도가 상승하고 레이저 방출이 꺼지 자마자 온도가 감소하기 시작한다. 최대 온도는이 연구에서 T max (℃)로 정의 된 조사의 끝에서 얻어진다. (B) 레이저 출력과 최대 온도 증가 (ΔT max )는 비례 함 (C) 배양 접시에서 측정 된 온도 분포의 가우시안 함수 수학적 소프트웨어 프로그램으로 결정된 함수의 매개 변수는 그래프 옆의 표에 나와 있습니다 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
열 조사 후 세포 생존율
도 4a에 도시 된 바와 같이, 레이저 조사 후 세포 생존 능력을 나타내는 3 가지 상이한 염색 패턴이있다 : 1) 아네 신 V / 에티 디움 호모 다이머 III- 양성 ( 즉, 단지 생존), 2) 아 넥신 V- 양성 ( 즉, 거의 오직 초기 세포 사멸), 그리고 3) 죽은 세포와 살아있는 세포 사이의 경계에서 세포 사멸 세포로 둘러싸인 중심 ( 즉, 죽은 세포)에서의 에티 디움 호모 디머 III 양성 ( 그림 4B ). 죽은 / 아폽토시스 영역의 크기는 일반적으로 T max 와 조사 후 48 시간까지의 조사 후 시간에 좌우된다. T max가 43 ℃ 이하로 조사 된 배양 균에서 생존력의 변화는 발견되지 않았다. 유일한 apoptotic 변화는 시간 (3 시간)의 초기에 관찰 될 수 있었고, 늦은 T max = 47 ° C의 조사 후 세포 사멸. T max ≥ 51 ° C (표 1)로 조사 된 배양 물에서 즉각 또는 초기 세포 사멸 (최대 3 시간)이 발견되었다.

그림 4 : 다른 전원 설정 (A) 후 치명적인 얼룩의 패턴과 치명적인 레이저 조사 후 죽은 자의 림 (Apoptotic Area)에서 모범적 인 이미지 (B).
(A) 온도에 따라 3 가지 염색 패턴이 발생할 수 있습니다. (B) 죽은 지역 (ethidium homodimer III- 양성 : 적색) 주변의 apoptotic zone (FITC-annexin V- 양성 : 녹색). 모든 세포는 Hoechst 33342 (파란색)에 대해 양성이며 파란색 핵을 가진 세포는 살아있는 세포입니다. 이미지는 T max = 59 ° C에서 조사 후 24 시간 동안 촬영되었습니다. 막대 = 100 μm./files/ftp_upload/54326/54326fig4large.jpg "target ="_ blank ">이 그림의 확대 버전을 보려면 여기를 클릭하십시오.

표 1 : 다양한 온도와 시간에서 Annexin V와 Ethidium Homodimer III 반응.
세포 사멸을위한 역치 온도 결정
죽은 지역 (적색)과 apoptotic 지역 (녹색)의 평균 반지름은 온도 분포의 가우스 함수에 측정하고 10 초 방사선 조사 후 세포 죽음과 apoptosis에 대한 임계 피크 온도를 결정하기 위해 적용되었다. 이 분석에 따르면, 조사 후 3 시간, 24 시간 및 48 시간의 완전한 세포 사멸의 평균 임계 온도는 각각 54.0 ℃, 50.9 ℃ 및 50.1 ℃였다. 평균 thresho51.7 ℃, 48.0 ℃ 및 47.0 ℃에서 각각 3 시간, 24 시간 및 48 시간 동안 임계 온도와 함께 세포 아폽토시스 변화에 대한 온도는 약 2 - 3 ℃ 낮아졌다 ( 그림 5 ).
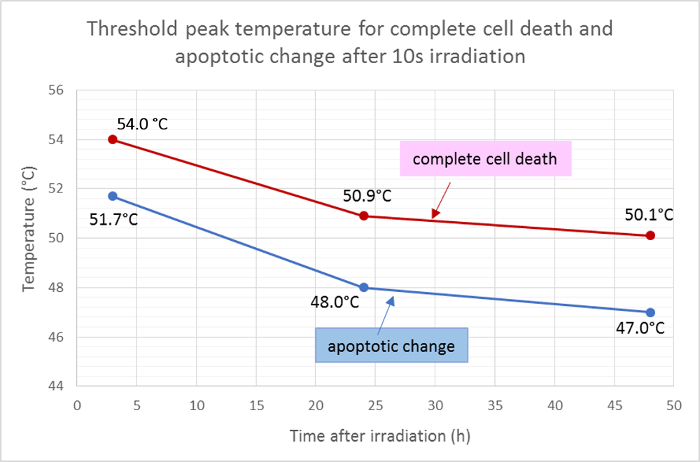
그림 5 : 아폽토시스 및 세포 사멸을위한 임계 온도.
형광 현탁액의 염색 결과로부터 계산 된, 완전한 세포 사멸 (Hoechst 33342, annexin V 및 ethidium homodimer III에 대한 양성) 및 방사선 조사 후 상이한 시점에서의 세포 사멸 (Hoechst 33342 및 annexin V에만 양성)에 대한 평균 임계 온도 . 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
온도와 관련된 생물학적 세포 반응을 논의 할 때, 대부분의 생화학 적 과정은 시간에 의존하기 때문에 온도뿐 아니라 증가 된 온도의 지속 시간도 중요합니다. 특히 안과에서 레이저로 유발되는 고열의 경우 밀리 초에서 초까지의 짧은 시간 범위로 인해 정확한 온도 제어로 세포 열 효과를 조사하기가 어렵습니다. 따라서, 세포 배양 모델 및 엄격한 온도 및 시간 제어를 가능하게하는 조작 시스템에 적합한 레이저 조사 장치가 요구된다. 단백질 발현이나 분비와 같은 열 노출 후 세포 반응의 생물학적 평가는 충분한 수의 영향을받는 세포에 대해 반복적으로 정량적 평가가 필요합니다. 이것은 임상 치료에서와 같이 직경이 수백 마이크로 미터 인 레이저 스폿을 사용하는 연구에 장애가되고 있습니다. 단일 레이저 지점에서의 정량 분석은 매우 유용합니다.rdensome. 이 연구에서는 가능한 한 이러한 요구를 충족시키기위한 시도가 이루어졌다. 조사 제어 프로그램과 함께 1.94 μm 파장의 연속파 두륨 레이저를 사용함으로써, 짧은 시간 내에 전체 세포 배양에서 일시적인 온도 상승을 수행 할 수 있었다. 온도 분포는 광 경로를 변경하여 조정할 수 있으므로이 설정을 사용하여 다양한 종류의 고온 관련 실험을 수행 할 수 있습니다.
제시된 기술의 한계는 세포의 레이저 조사 중에 동시 온도 측정을 수행 할 수 없다는 것이다. 열전쌍의 사용은 멸균 된 세포 배양에 적합하지 않기 때문에 온도 보정은 세포 조사와 별도로 수행해야합니다. 레이저 출력의 가능한 변화를 고려할 때 각 레이저 조사 중 실시간 온도 측정은 레이저 방사 출력에 해당하는 세포 반응을 직접 평가하는 데 이상적입니다.열 복용량. 또한, 여기에서 사용 된 온도 분포는 배양 접시상의 21 개 지점에서의 측정 및 몇몇 상이한 전력 설정에 기초한 데이터 보간을 통해 생성되었다. 따라서 이러한 한계점과 한계점을 극복하기 위해 레이저 조사가 진행되는 동안 배양 접시의 온도를 측정 할 수있는 대체 방법을 개발하는 것이 우리의 목표입니다. 우리는 또한 즉시 공간 온도 정보를 얻는 것을 목표로한다. 적외선 이미지 (열 화상)는 레이저 조사 중 온도를 측정하는 가능한 방법 중 하나입니다. 이 방법의 가장 큰 장점은 각 조사에 대해 세포 수준에서의 실시간 온도 측정입니다. 후속 세포 생물학적 반응은 조사 중 온도 이력과 항상 개별적으로 비교 될 수있다. 그러나 비용 효율성과 유용성을 고려할 때 셀 히터 실험을 위해 열 화상 사진을 사용하는 것은 모든 실험실에서 가능하지 않습니다오라이.
1.94 μm의 파장에서 툴륨 레이저를 사용하는 방법에서 세포 배양 접시의 물은 표면에서 가열되고 열확산과 대류는 세포를 가열하는 데 사용됩니다. 배양 배지 1.2 mL를 포함한이 조사 설정에서 배양 배지의 높이는 중심 위치에서 (광학 단층 촬영을 사용한 이전 측정에서) 935 μm입니다. 물 속의 툴륨 레이저의 흡수 수준은 매우 높습니다 (35 ° C에서 흡수 계수 : 127 cm -1 ). 그리고 빛의 72 %는 배양 배지의 첫 번째 100 μm에서 흡수됩니다. 935 μm의 깊이에는 거의 흡수가 없습니다 (0.0007 %).
프로토콜의 중요한 점 중 하나는 각 조사에 대해 동일한 양의 매체 (1,200 μL)를 추가하는 것입니다. 다른 양의 배양 배지를 사용하면 높이 차이가 생길 수 있으며 이로 인해 온도 차이가 발생할 수 있습니다.세포의 증가. 두 번째 중요한 점은 문화 요리가 열리는시기와 관련이 있습니다. 시스템이 소리를 낼 때, 조사 시작 8 초 전인이 연구에서 동시에 수행해야합니다. 이 타이밍의 차이는 주변 공기 (약 23 ° C)로 인한 냉각 때문에 기온이 달라질 수 있습니다. 이것은 레이저 유도 온도에 상당한 차이를 초래할 수 있습니다.
온도 보정을 위해, 실험에 사용 된 동일한 양의 배지 (1.2 mL)를 무 세포 배양 접시의 바닥에서 온도 분포를 측정하기 위해 사용 하였다. 그러나, 세포 단일 층을 갖는 중간 높이는 심지어 동일한 부피의 배지가 첨가 되더라도, 세포가없는 것보다 다를 수있다. 광학 단층 촬영기를 사용하여 측정 한 결과, 합류 세포 단층이 있거나없는 요리 사이의 중심 위치에 58 μm의 차이가 있음이 밝혀졌습니다 (세포가없는 877 μm,세포와 함께 935 μm). 이 차이는 잠재적으로 세포의 모세관 현상 때문입니다. 중앙 위치에서 높이의 58-μm 차이는 약 40 μL의 매개물 (측정 된 데이터)에 의해 야기 될 수 있습니다. 또한이 높이의 차이가 모든 출력 설정에서 Tmax 에 큰 차이를 일으키지 않았 음을 확인했습니다. 그러므로 우리는이 차이가이 연구에서 수행 된 분석 결과에 유의미한 영향을 미치지 않는다고 결론 지었다. 그럼에도 불구하고, 위에서 설명한 것처럼 더 정확한 온도 정보를 수집하려면 세포 단층이 들어있는 세포 배양 접시를 사용하여 온도를 보정하는 방법을 개발해야합니다. 또한 전체 배양 배지에서의 열 확산 및 대류에 대한 수학적 모델링이 필요합니다.
이 연구에서, 세포는 가우스 온도 분포로 가열되었다. 시간이 지남에 따라 매체를 더 균일하게 가열하는 몇 가지 가능한 방법이 있습니다. 하나 물에서 흡수 계수가 낮은 레이저 소스를 사용하는 것입니다. 그러나, 단점은,이 경우, 레이저는 약 0.9mm 이상으로 흡수되는 광의 비율이 적기 때문에, 레이저는 더 높은 파워를 가져야한다는 것이다. 또 다른 가능성은 레이저 광을 배양 접시의 평면으로 전송하는 다중 모드 광섬유의 원위 섬유 팁을 이미지화하는 것입니다. 배율은 광학계에 의해 임의로 선택 될 수있다.
이 프로토콜의 두 번째 하이라이트는 생존 염색 및 측면 온도 분포의 형광 이미지를 사용하여 세포 죽음과 apoptosis에 대한 임계 온도를 결정하는 능력입니다. 장기적인 목표는 세포 생존력을 결정할뿐만 아니라 단백질 발현 및 세포 증식과 같은 세포 기능과 관련된 세포 생물학적 반응의 온도 범위를 밝히는 것입니다. 세포 사멸 역치 온도의 결정은 연구자들에게 큰 관심거리입니다이 방법을 사용하면 세포 사멸을 비롯한 세포 사멸의 주요 요인을 결정할 수있을 것입니다. 열 레이저 유도 세포 죽음의 중요한 요인은 온도 내역뿐만 아니라 내인성 요인을 통해 결정될 수 있습니다 ( 즉, 분자 수준에서의 세포 내 / 세포 외 요인) 이러한 질문에 대답하면 열 노출 후와 망막 병증이 다른 세포 사멸 기작과 동역학을 이해할 수있을뿐만 아니라 임상 적으로 관찰 된 문제를 명확히하는 데 도움이 될 수 있습니다. 레이저 치료에 대한 환자 간 개인차 또는 망막 광응고술 후 흉터 크기의 다양성과 같은 초기 스팟 크기가 거의 동일 할 때조차도 ( "위축성 크립") 11 .
이 연구의 최종 목표는 망막의 온도 조절 광열 요법을 개발하는 데 도움을주는 것입니다. 이것을 달성하기 위해 병렬로온도 측정 3 의 기술적 진보,이 방법을 사용하여 결정된 열 노출 후 RPE 세포 행동의 추가 설명은 큰 이익이 될 것입니다.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
저자는 공개 할 것이 없습니다.
Acknowledgments
이 연구는 독일 연방 교육 연구부 (BMBF) (부여 # 13GW0043C)와 유럽 우주 항공 연구 개발국 (EOARD, grant # FA9550-15-1-0443)의 연구비 지원에 의해 지원되었으며,
Materials
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Dulbecco’s Modified Eagle’s Medium - high glucose | Sigma-Aldrich | D5796-500ML | Add (2)-(4) before use. Warm in 37 °C water bath before use. |
| Antibiotic Antimycotic Solution (100 ×) | Sigma-Aldrich | A5955-100ML | Containing 10,000 units penicillin, 10 mg streptomycin and 25 μg Amphotericin B in 1mL. Add 5.5 mL in 500 mL medium bottle (1) before use. |
| Sodium pyruvate (100 mM) | Sigma-Aldrich | S8636-100ML | Add 5.5 mL in 500 mL medium bottle (1) before use (final concentration: 1 mM) |
| Porcine serum | Sigma-Aldrich | 12736C-500ML | Add 50 mL in 500 mL medium bottole (1) before use (final: 10%) |
| Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537-500ML | |
| Trypsin from porcine pancreas | Sigma-Aldrich | T4799-25G | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | ED-100G | |
| Human VEGF Quantikine ELISA Kit | R&D System | DVE00 | |
| Oxiselect Total Glutathione Assay Kit | Cell Biolabs, Inc | STA-312 | |
| Apoptotic/Necrotic/Healthy Cells Detection Kit | PromoKine | PK-CA707-30018 | |
| Name | Company | Catalog Number | Comments |
| Equipments | |||
| Thulium laser | Starmedtec GmbH | Prototype | 0-20 W |
| 365 mm core diameter fiber | LASER COMPONENTS Germany | CF01493-52 | |
| Thermocouple | Omega Engineering Inc | HYP-0- 33-1-T-G-60-SMPW-M | |
| Heating plate | MEDAX | ||
| Microplate reader (spectrofluorometer) | Molecular Device | Spectramax M4 | |
| cell homogenizer | QIAGEN | TissueLyser LT | |
| Fluorescence microscope | Nikon | ECLIPSE Ti | |
| mathematical software program | The Mathworks. Inc | MATLAB Release 2015b | |
| system-design platform | National Instrument | Labview | Laboratory Virtual Instrument Engineering Workbench |
References
- Inagaki, K., et al. Comparative efficacy of pure yellow (577-nm) and 810-nm subthreshold micropulse laser photocoagulation combined with yellow (561-577-nm) direct photocoagulation for diabetic macular edema. Jpn J Ophthalmol. 59 (1), 21-28 (2015).
- Roider, J., et al. Selective retina therapy (SRT) for clinically significant diabetic macular edema. Graefes Arch Clin Exp Ophthalmol. 248 (9), 1263-1272 (2010).
- Brinkmann, R., et al. Real-time temperature determination during retinal photocoagulation on patients. J Biomed Opt. 17 (6), 061219 (2012).
- Yoshimura, N., et al. Photocoagulated human retinal pigment epithelial cells produce an inhibitor of vascular endothelial cell proliferation. Invest Ophthalmol Vis Sci. 36 (8), 1686-1691 (1995).
- Denton, M. L., et al. Damage Thresholds for Exposure to NIR and Blue Lasers in an In Vitro RPE Cell System. Invest Ophthalmol Vis Sci. 47 (7), 3065-3073 (2006).
- Shrestha, R., Choi, T. Y., Chang, W., Kim, D. A high-precision micropipette sensor for cellular-level real-time thermal characterization. Sensors (Basel). 11 (9), 8826-8835 (2011).
- Gao, F., Ye, Y., Zhang, Y., Yang, J. Water bath hyperthermia reduces stemness of colon cancer cells. Clin Biochem. 46 (16-17), 1747-1750 (2013).
- Jansen, E. D., van Leeuwen, T. G., Motamedi, M., Borst, C., Welch, A. J. Temperature dependence of the absorption coefficient of water for midinfrared laser radiation. Lasers Surg Med. 14 (3), 258-268 (1994).
- Iwami, H., Pruessner, J., Shiraki, K., Brinkmann, R., Miura, Y. Protective effect of a laser-induced sub-lethal temperature rise on RPE cells from oxidative stress. Exp Eye Res. 124, 37-47 (2014).
- Denton, M. L., et al. Spatially correlated microthermography maps threshold temperature in laser-induced damage. J Biomed Optics. 16 (3), (2011).
- Morgan, C. M., Schatz, H. Atrophic creep of the retinal pigment epithelium after focal macular photocoagulation. Ophthalmology. 96 (1), 96-103 (1989).



