Summary
Aquí se introduce una configuración experimental original para calentar células en un plato de cultivo usando radiación de láser de onda continua de 1,94 μm. Utilizando este método, se pueden investigar las respuestas biológicas de las células epiteliales del pigmento retiniano (RPE) después de diferentes exposiciones térmicas.
Abstract
Aquí se introduce un método original para calentar células cultivadas usando un láser de thulium de onda continua de 1,94 μm para la evaluación biológica. La radiación láser de túlio es fuertemente absorbida por el agua, y las células en el fondo del plato de cultivo son calentadas por difusión térmica. Una fibra láser con un diámetro de 365 μm se coloca aproximadamente a 12 cm por encima del plato de cultivo, sin ninguna óptica, de manera que el diámetro del haz de láser sea casi equivalente al diámetro interior del plato de cultivo (30 mm). Al mantener una cantidad constante de medio de cultivo en cada experimento, es posible irradiar las células con un aumento de temperatura altamente reproducible.
Para calibrar el aumento de temperatura y su distribución en un plato de cultivo celular para cada ajuste de potencia, se midió la temperatura durante 10 s de irradiación en diferentes posiciones ya nivel celular. La distribución de la temperatura se representó utilizando un software de gráficos matemáticosPrograma, y su patrón a través del plato de la cultura estaba en forma gaussiana. Después de la irradiación con láser, se pueden realizar diferentes experimentos biológicos para evaluar las respuestas celulares dependientes de la temperatura. En este manuscrito, se introduce la tinción de viabilidad ( es decir, distinguir las células vivas, apoptóticas y muertas) para ayudar a determinar las temperaturas umbral para la apoptosis celular y la muerte después de diferentes puntos en el tiempo.
Las ventajas de este método son la precisión de la temperatura y el tiempo de calentamiento, así como su alta eficiencia en células de calentamiento en un plato de cultivo de células enteras. Además, permite estudiar con una amplia variedad de temperaturas y duraciones de tiempo, las cuales pueden ser bien controladas por un sistema operativo computarizado.
Introduction
La comprensión de las respuestas biológicas celulares dependientes de la temperatura es de gran importancia para los tratamientos exitosos de hipertermia. La fotocoagulación láser retiniana con láser térmico, utilizada en oftalmología, es uno de los tratamientos con láser más establecidos en medicina. La luz visible, sobre todo de longitudes de onda verdes a amarillas, se utiliza en el tratamiento láser de la retina. La luz es altamente absorbida por la melanina en las células epiteliales del pigmento retiniano (RPE), que forman la monocapa celular más externa de la retina. Ha habido un interés reciente entre los médicos y los investigadores en la irradiación térmica muy leve (fotocoagulación sub-visible) como una nueva estrategia terapéutica para diferentes tipos de trastornos de la retina 1 , 2 . Siguiendo esta tendencia, nuestro interés está en calentar letalmente células RPE bajo un control preciso de la temperatura, una técnica llamada terapia fototérmica con temperatura controlada (TC-PTT).
Opto recienteAcústica de nuestro instituto ha permitido la medición en tiempo real de los aumentos de temperatura en los sitios irradiados en la retina. Esto permite controlar el aumento de la temperatura durante la irradiación 3 . Sin embargo, dado que la hipertermia sub-letal en la retina, causada por el calentamiento de las células RPE sub letalmente, no se ha considerado previamente debido a la imposibilidad de medir y controlar la temperatura, las respuestas celulares dependientes de la temperatura de las células RPE tras la irradiación con láser térmico Se ha estudiado muy poco hasta la fecha. Además, no sólo se ha discutido en detalle la diferencia de temperatura, sino también la diferencia en el comportamiento celular de las células supervivientes después de la irradiación letal y letal. Por lo tanto, para reunir evidencia científica sobre los tratamientos basados en TC-PTT, nuestro objetivo es elucidar las respuestas biológicas dependientes de la temperatura de las células de RPE y sus mecanismos utilizando configuraciones experimentales in vitro .
Para tSu propósito, es necesario establecer un sistema de calentamiento de células que cumpla con las siguientes condiciones: 1) una posibilidad de aumentos rápidos de temperatura, 2) un tiempo y temperatura controlados con precisión, y 3) un número relativamente alto de células examinadas para experimentos biológicos . Respecto al método de calentamiento, un láser clínico, tal como un láser Nd.YAG de frecuencia doble (532 nm), desafortunadamente no es adecuado para el calentamiento del cultivo celular. Esto es debido al número fuertemente reducido de melanosomas en células RPE cultivadas. La absorción de la luz láser puede ser heterogénea, y el aumento de la temperatura a nivel celular es variable entre los experimentos, incluso cuando se irradia con la misma potencia de radiación. Varios estudios anteriores han informado sobre el uso de papel negro bajo el fondo del plato durante la irradiación 4 o el uso de melanosomas adicionales que son fagocitados por las células de cultivo antes de los experimentos 5 , Muchos deLos estudios biológicos in vitro para evaluar las respuestas de células inducidas por hipertermia se han realizado utilizando una placa caliente, un baño de agua o una incubadora de CO 2 con un ajuste de temperatura 7 . Estos métodos requieren un largo período de calentamiento porque lleva algún tiempo ( es decir, varios minutos) alcanzar la temperatura deseada. Además, utilizando estos métodos, es difícil obtener un historial térmico detallado ( es decir, la temperatura multiplicada por el tiempo) a nivel celular. Además, la temperatura entre las células en diferentes posiciones en un plato de cultivo puede diferir debido a la difusión de temperatura variable. En la mayoría de los casos, esta información de temperatura temporal y espacial durante la hipertermia no ha sido tomada en consideración para los análisis biológicos, aunque la respuesta celular biológica puede ser afectada críticamente por la temperatura y la duración del tiempo de aumento de la temperatura.
Para superar estos problemas,El láser de thulium de onda nuous se usó aquí para calentar las células. La radiación láser de thulium (λ = 1,94 μm) es fuertemente absorbida por el agua 8 , y las células en el fondo del plato de cultivo son estimuladas térmicamente únicamente por difusión térmica. La fibra láser con un diámetro de 365 μm se coloca alrededor de 12 cm por encima del plato de cultivo, sin ninguna óptica entre ellas. El diámetro del haz láser diverge de tal manera que es casi equivalente al diámetro interior del plato de cultivo (30 mm) en la superficie del medio de cultivo. Con una cantidad constante de medio de cultivo, es posible irradiar las células con el aumento de temperatura De alta repetibilidad. Los ajustes de potencia variable permiten la irradiación con hasta 20 W, y la temperatura del medio en el nivel celular puede aumentarse hasta ΔT ≈ 26 ° C en 10 s.
Mediante la modificación de las condiciones de irradiación, también es posible cambiar el perfil del haz de láser para variar la distribución de la temperaturaEn un plato de cultivo. Por ejemplo, es posible investigar con una distribución de temperatura de tipo gaussiano, como en el presente estudio, o con una distribución de temperatura homogénea. Este último puede ser ventajoso para investigar los efectos de las respuestas celulares dependientes de la temperatura más específicamente para aumentos de temperatura sub-letales, pero no para el estrés por muerte celular o las respuestas de cicatrización de heridas.
En conjunto, la irradiación láser de thulium puede permitir la investigación de diferentes tipos de factores biológicos, como la expresión de genes / proteínas, la cinética de muerte celular, la proliferación celular y el desarrollo de la funcionalidad celular, después de diferentes exposiciones térmicas.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. Cultivo celular de RPE
- Aislamiento de células RPE de ojos porcinos
- Obtenga los ojos de porcino recién enucleados del matadero local. Manténgalos frescos (4 ° C) y en un ambiente oscuro.
- Quitar los tejidos extracelulares con tijeras y remojar los ojos en una solución antiséptica durante 5 min.
- Coloque los ojos en solución salina tamponada con fosfato esterilizada sin calcio y magnesio (PBS (-)) hasta su uso.
- Usando un bisturí, penetre la esclerótica a unos 5 mm por detrás del limbo corneal. Resect toda la parte anterior del ojo cortando con tijeras a través de todo, paralelo al limbo corneal.
- Quitar la parte anterior del ojo ( es decir, la córnea y la lente) y el vítreo. Añadir 1 ml de PBS (-) y retirar suavemente la retina neural.
NOTA: Esta "copa ocular", que consiste en la esclerótica, coroides y RPE, está lista. - Añadir tripsina pre-calentada (37 ° C) al 0,25% en PBS (-) a la copa del ojo. Ajustar el volumen de modo que se llene aproximadamente el 80% de la copa del ojo con esta solución de tripsina.
- Incubar la copa ocular con la solución de tripsina en una incubadora de CO2 al 5% a 37 ° C durante 10 min.
- Quitar la copa ocular de la incubadora y reemplazar la solución de tripsina al 0,25% con una solución de PBS (-) con 0,05% de tripsina + sal tetrasódica de ácido etilendiaminotetraacético al 0,2% (EDTA · 4N). Incubar el vaso del ojo en la incubadora durante 45 min.
NOTA: Después de 45 minutos, las células de RPE serán o bien ligadas de forma suelta a la membrana de Bruch o ya separadas y flotando en la solución de tripsina-EDTA. - Recoger las células RPE por pipeteado suave. Recoger las células y la solución en un tubo cónico llenado con 10 ml de medio de cultivo (DMEM glucosa alta con L-glutamina), incluyendo suero porcino al 10%, antibiótico / antimicótico y piruvato sódico (1 mM).
NOTA: El suero puede neutralizar el efecto de la tripsina. - Centrifugar elDe células a 400 xg durante 5 min a temperatura ambiente.
- Se retira el sobrenadante y se añaden 10 ml de medio fresco. Centrifugar de nuevo bajo las mismas condiciones durante 5 min.
- Se retira el sobrenadante y se añade nuevo medio, de modo que la concentración celular da como resultado 5 x 105 células / ml (determinado contando las células utilizando un hemocitómetro). Mezclar bien por pipeteado suave.
- Distribuir la suspensión celular en placas de cultivo celular. Utilice 3 mL por 60 mm de diámetro de cultivo de plato.
NOTA: Este cultivo se denomina paso cero (P0). - Mantener las células en una incubadora de CO2 al 5% a 37 ° C. Cambie la mitad del medio acondicionado a medio fresco cada dos días.
- Subcultivo (paso 1.2) si se convierte en confluente.
- Subcultura del cultivo celular de RPE
- Eliminar el medio de cultivo y enjuagar las células dos veces con PBS (-).
- Incubar las células con solución de PBS (-) con 0,05% de tripsina + 0,2% de EDTA iNa 5% CO 2 incubadora a 37 ° C durante 5 min.
- Separar las células de RPE por pipeteado suave y recoger la suspensión de células en un tubo cónico lleno con 10 ml de medio de cultivo, incluyendo el 10% de suero porcino.
- Centrifugar la suspensión celular a 400 xg durante 5 min a temperatura ambiente.
- Se retira el sobrenadante y se añade nuevo medio de cultivo, haciendo que la concentración celular sea de 5 x 10 5 células / mL (determinada contando el número de células con un hemocitómetro). Distribuir las células en nuevas placas de cultivo de 60 mm de diámetro, como se describe en el paso 1.1.13.
NOTA: El cultivo celular es ahora el paso 1 (P1). - Después de alcanzar la confluencia, subcultivo el cultivo P1 a P2, usando el mismo procedimiento descrito en los pasos 1.2.1-1.2.5. A partir del cultivo P2, siembra las células en placas de cultivo más pequeñas (diámetro interior de 30 mm) en lugar de placas de cultivo de 60 mm de diámetro.
- Para los experimentos, utilizar cultivos P2 o P3.
2. ThulIum Irradiación láser
- Construcción de la estación de irradiación
- Conecte un dispositivo láser de thulium (1,94 μm, rango de potencia: 0-20 W) a una fibra de 0,22-NA y 365 μm de diámetro central.
- Fije mecánicamente la punta de la fibra al brazo metálico que está fijado horizontalmente al poste metálico vertical de la estación de irradiación. Coloque el poste vertical de modo que la punta de la fibra láser se sitúe por encima de la placa caliente sobre la cual se va a colocar el plato de cultivo celular durante la irradiación.
- Coloque un papel blanco sobre la placa caliente y gire el rayo de enfoque (λ = 635 nm, máx = 1 mW, diámetro al nivel del papel ≈ 30 mm). Marque la circunferencia del haz de orientación sobre el papel blanco de modo que se conozca la posición en la que se coloca el plato de cultivo durante la irradiación.
NOTA: El plano z de la punta de la fibra puede ser cambiable. Sin ninguna óptica de formación de imágenes adicional, el diámetro del punto láser en el plano de cultivo celular, situado a 12 cm por debajo de la punta de la fibra, iS de aproximadamente 30 mm, que es casi equivalente al diámetro interior del plato de cultivo celular. Un dibujo esquemático de la configuración se muestra en la Figura 1 .

Figura 1: Imagen Esquemática de la Estación de Irradiación Láser de Túlio. Se coloca un plato de cultivo sobre la placa calefactora. Las células se colocan 12 cm por debajo de la punta de la fibra láser de thulium de manera que el tamaño del haz es casi idéntico al diámetro interior del plato de cultivo (aproximadamente 30 mm). El procedimiento de irradiación con láser es controlado por una rutina controlada por el tiempo de la plataforma de diseño del sistema a medida. El ajuste de potencia debe determinarse antes de iniciar el programa de irradiación. Haga clic aquí para ver una versión más grande de esta figura.
- 1 h antes de la irradiación, reemplazar completamente el medio de cultivo con 1,2 ml de medio fresco.
NOTA: Este es un PASO CRÍTICO y debe ser estrictamente seguido. - Coloque la estación de irradiación ( es decir, la placa caliente y el poste con el que fijar la fibra láser) sobre un banco limpio.
- Retire el plato de cultivo celular de la incubadora y colóquelo en la posición marcada en la placa caliente (paso 2.1.3).
- Use gafas protectoras. Encienda el láser de thulium. Ajuste la potencia deseada en el dispositivo láser (sintonizable de 0 a 20 W). Encienda la emisión.
- Iniciar una plataforma de diseño del sistema que controla el protocolo de irradiación y sincronización con láser (archivo suplementario).
- Inmediatamente después de colocar el plato de cultivo en la placa caliente, haga clic en el "tiempo de precalentamiento" para iniciar el temporizador durante 140 s ("tiempo de precalentamiento 1"); Esto mantendrá la temperatura del medio de cultivo en 37 ° C antes de la irradiación.
NOTA: Después de 140 s, se activará un pitido y el siguiente temporizador ("tiempo de precalentamiento 2") comenzará a contar automáticamente 8 s. Durante estos 8 s, el examinador puede abrir el plato de cultivo. Después de 148 s de precalentamiento, se llevará a cabo automáticamente una irradiación con láser de 10 s de longitud sobre el cultivo celular. En caso de emergencia, equipar el dispositivo láser con un botón de parada de fuerza para detener el láser inmediatamente. Este es un PASO CRÍTICO y debe ser estrictamente seguido. Un punto especial de precaución se refiere a abrir la tapa del plato justo antes de la irradiación, al comienzo del tiempo de precalentamiento de 8 s. Abrir la cubierta puede enfriar la superficie del soporte muy rápidamente. - Después de la irradiación, vuelva a colocar la tapa sobre el plato de cultivo, deje el plato de cultivo sobre la placa caliente durante 7 s adicionales y colóquelo de nuevo en el incubador de CO 2 al 5% a 37 ° C.
- Hacer pequeños orificios (cerca de 300 μm de diámetro) cerca del fondo en cuatro lados (cada 90 °) de un plato de cultivo de 30 mm de diámetro (sin células); Use la punta de una aguja (20G) calentada con un quemador Bunsen. Sellar los orificios con cinta de aislamiento eléctrico desde el exterior y hacer un agujero pequeño con una aguja fina para que sólo un termopar fino (200 μ m de diámetro) se puede insertar a través de este agujero en condiciones de estanqueidad.
- En el exterior del fondo del plato de cultivo, dibujar 2 diámetros perpendiculares y establecer el punto de cruce ( es decir, el centro del lado inferior) como el cero de coordenadas (0). Marque cada 3 mm radialmente al exterior fuera del plato ( es decir, 0, 3, 6, 9, 12 y 15 mm) en cada dirección a lo largo de las líneas ( Figura 2 , puntos azules); El número de puntos debe ser 21 en total.
- Llene el plato de cultivo celular con 1,2 ml de nuevo medio de cultivo. Coloque la cultura dEn una placa caliente a 37 ° C, introduzca un termopar fino (200 μm de diámetro) en el orificio lateral, y coloque su punta sensible sobre una posición marcada a medir.
- Use gafas protectoras. Encienda el láser de thulium y ajuste manualmente la potencia (entre 0 y 20 W, en incrementos de 0,1-W) del dispositivo láser.
NOTA: Para la calibración de la temperatura, las mediciones con la potencia en incrementos de 3 W deberían ser suficientes. - Encienda la plataforma de diseño del sistema y haga clic en el botón "Start Temp. Acquisition" (archivo suplementario) para iniciar la medición de la temperatura.
- Realizar el mismo procedimiento que en el paso 2.2.6.
NOTA: El programa de control mide la temperatura del termopar insertado cada 100 ms y muestra la progresión de la temperatura durante la irradiación en la GUI. - Lleve a cabo estos procedimientos para los 21 puntos de medición y con diferentes ajustes de potencia. Repetir todo el procedimiento tres veces para todos los puntos y para todos los settin de potenciaGs para obtener datos confiables.
- Exportar datos de temperatura como datos csv, que eventualmente pueden convertirse en una hoja de cálculo. Promediar la temperatura máxima al final de la irradiación para las mediciones triplicadas en cada punto. Promedio de los valores de los puntos en el mismo círculo (4 puntos en total, excepto el punto central).
- Trace la temperatura máxima promedio obtenida en un gráfico, haciendo la distancia desde el centro del plato (mm) como el eje xy el aumento de temperatura (ΔT, ° C) como el eje y. Utilice la función de ajuste de un programa de software matemático para ajustar un modelo gaussiano a los datos sin procesar. Cree una distribución de temperatura gaussiana.

Figura 2: Los puntos para la calibración de temperatura en un plato de cultivo celular. Los datos de temperatura se midieron en el centro y en 5Puntos radiales sobre 4 ángulos diferentes (puntos azules). Haga clic aquí para ver una versión más grande de esta figura.
3. Evaluaciones biológicas de las respuestas celulares después de diferentes irradiaciones térmicas
- Evaluación de la viabilidad celular ( es decir, vivos, apoptóticos y muertos) después de diferentes ajustes de potencia y la determinación del umbral de muerte celular
- En los puntos de tiempo indicados ( es decir, 3, 24 y 48 h después de la irradiación), lavar las células con PBS (-) y utilizar un kit disponible comercialmente para evaluar la viabilidad celular ( es decir, vital, apoptótico, muerto) protocolo.
- Preparar una solución de tinción añadiendo 5 μl de isotiocianato de fluoresceína (FITC) -nexina V, 5 μl de homodímero de etidio III y 5 μl de Hoechst 33342 a 100 μl de tampón de unión 1x (todos son kitComponentes). Preparar suficiente solución de tinción para cubrir las células. Incubar las células durante 15 min.
- Lavar el cultivo de células con el tampón de unión dos veces, sustituir el tampón de unión con PBS (-), y establecer el cultivo en la etapa de un microscopio de fluorescencia.
- Cambie el trayecto de la luz a la lente ocular, seleccione el filtro 4 ', 6-Diamidin-2-phenylindol (DAPI), active la luz de iluminación y encuentre el plano enfocado con el objetivo 4x.
- Cambie la trayectoria de la luz a la cámara, encuentre la imagen en la pantalla de la computadora en el software de la proyección de imagen del microscopio, y ajuste el foco.
- Utilice la función de puntada ( es decir, la función para grabar múltiples imágenes a través del plato y luego crear una sola imagen grande) del software específico del microscopio para obtener la imagen de fluorescencia del plato de cultivo de células completo. Utilice 3 conjuntos de filtros diferentes: DAPI, FITC y tetrametilrhodamina (TRITC), para la imagen de células positivas a Hoechst 33342 (todos los núcleos celulares), FITC-anexina V-positiVe (apoptóticas) y las células homodímero III de ethidium (muertas), respectivamente.
- Medir el radio (mm) de la región muerta (región homodímero III de etidio) y el radio exterior / interior de la región de la banda en forma de banda apoptótica (anexina V-positiva) en los cultivos celulares teñidos. Aplique estos radios a la función Gaussiana de la distribución de temperatura para el ajuste de potencia correspondiente. Calcular la temperatura exacta en el borde de la región muerta o apoptótica para aclarar las temperaturas umbral de la muerte celular y el cambio apoptótico.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Distribución de la temperatura después de diferentes ajustes de potencia
Todos los desarrollos de temperatura para cada irradiación simple se controlaron en la calibración de temperatura. A partir de estos datos, se obtuvo la temperatura máxima en el punto medido y se definió como T _ { max} (° C). Como se muestra en la Figura 3A , el programa se ejecutó en el momento en el que el plato de cultivo se colocó sobre la placa calefactora. Después de 140 s de "tiempo de precalentamiento 1", que se necesitó para archivar una temperatura estable del medio a 37 ° C, se retiró la cubierta de la placa de cultivo durante los 8 s "tiempo de precalentamiento 2". Al final del "tiempo de precalentamiento 2", la emisión láser se inicia automáticamente. Esta curva es una progresión de temperatura representativa para una irradiación de 10 s. Durante la irradiación, la temperatura aumentó, e inmediatamente después de la emisión del láserApagado, la temperatura comenzó a disminuir. La temperatura máxima en el centro del plato de cultivo se definió en este estudio como T _ { max} (° C). El Tmax era proporcional a la potencia del láser ( Figura 3B ). La Figura 3C muestra la distribución de la temperatura máxima para cada potencia a través del plato de cultivo. Las distribuciones son en forma de campana, como se muestra en la Figura 3C , y se ajustan a una función Gaussiana de acuerdo con la siguiente fórmula:
T (r) = t base + A · 
Donde r, t base , A y w representan la distancia desde el centro (mm), la temperatura más baja para la curva, la amplitud y el ancho de la curva, respectivamente. Los parámetros (t base , A y w) del G ajustadoAussian para cada ajuste de potencia, es decir, para cada Tmax , se muestran en la tabla junto al gráfico.
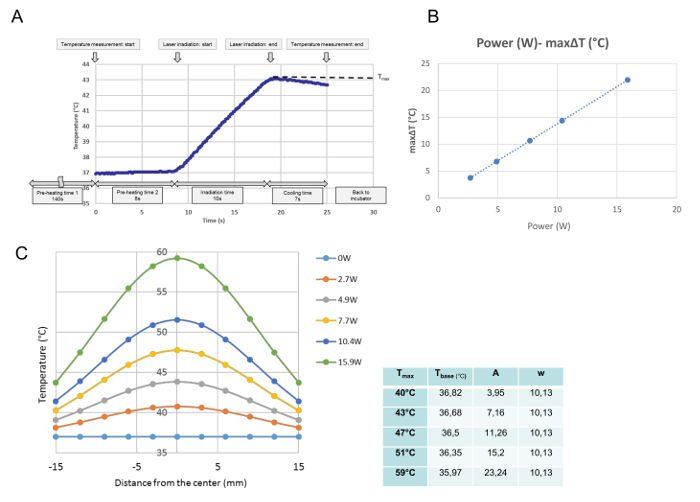
Figura 3: Datos de calibración de temperatura. Un desarrollo de temperatura representativo en la posición central después de una única irradiación a 4,9 W ( Tmax = 43ºC) ( A ), la relación proporcional entre la potencia del láser y el ΔT máximo en la posición central de un cultivo celular ( B ) Y las distribuciones de temperatura a través del plato de la cultura después de ajustes de energía diferentes (C). (A) El programa se ejecuta desde el punto de tiempo en el que se coloca el plato de cultivo sobre la placa calefactora. Después de 140 s de "tiempo de precalentamiento 1", que se necesita para archivar una temperatura estable del medio a 37 ° C, se retira la cubierta de la cápsula de cultivo durante el tiempo de precalentamiento de 8 s2. Al final del "tiempo de precalentamiento 2", la emisión láser comienza automáticamente, esta curva es una progresión de temperatura representativa en la posición central durante una irradiación de 10 s a 4,9 W. Durante la irradiación, la temperatura aumenta y Inmediatamente después de que la emisión del láser se apague, la temperatura comienza a disminuir.La temperatura máxima se obtiene al final de la irradiación, que se define en este estudio como Tmax (° C). (ΔT max ) son proporcionales (C) Las funciones Gaussianas de las distribuciones de temperatura medidas a través de la placa de cultivo Los parámetros para las funciones, determinados con un programa de software matemático, se muestran en la tabla al lado de la gráfica Haga clic aquí para ver una versión más grande de esta figura.
La viabilidad celular después de la irradiación térmica
Como se muestra en la Figura 4A , hay tres patrones de tinción diferentes que indican la viabilidad celular después de la irradiación con láser: 1) no anexina V / homidímero de etidio III positivo ( es decir, sólo vivo), 2) anexina V positivo en el centro ( es decir, casi Sólo apoptosis temprana), y 3) homodímero de etidio III-positivo en el centro ( es decir, células muertas) rodeado por células apoptóticas en el borde entre las células muertas y vivas ( Figura 4B ). El tamaño de la zona muerta / apoptótica depende generalmente de Tmax y el tiempo de post-irradiación hasta 48 horas después de la irradiación. No se detectó ningún cambio de viabilidad aparente en los cultivos irradiados con Tmax ≤43 ºC. El único cambio apoptótico se pudo observar en un momento temprano en el tiempo (3 h), seguido de un retraso Muerte celular después de una irradiación con T _ { max } = 47ºC. La muerte celular inmediata o temprana (hasta 3 h) se encontró en los cultivos irradiados con Tmax ≥ 51 ° C (Tabla 1).

Figura 4: Patrón de tinción de la viabilidad después de diferentes ajustes de potencia (A) y una imagen ejemplar en el borde del área muerta y apoptótica después de las irradiaciones láser letales (B).
(A) Pueden ocurrir tres patrones de tinción, dependiendo de la temperatura. (B) La zona apoptótica (FITC-anexina V-positiva: verde) alrededor de la zona muerta (homodímero de etidio III-positivo: rojo). Todas las células son positivas para Hoechst 33342 (azul), y las células con núcleos azules son las células vivas. La imagen se tomó 24 h después de una irradiación a T _ { max } = 59ºC. Barra = 100 mu m./files/ftp_upload/54326/54326fig4large.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta figura.

Tabla 1: Respuestas de Annexin V y Ethidium Homodimer III a diversas temperaturas y tiempos.
Determinación de la temperatura umbral para la muerte celular
Se midieron los radios medios del área muerta (rojo) y el área apoptótica (verde) y se aplicó a la función gaussiana de la distribución de temperatura para determinar las temperaturas pico umbral de muerte celular y apoptosis después de 10 s de irradiación. Según este análisis, las temperaturas umbral medias para la muerte celular completa 3 h, 24 h y 48 h después de la irradiación fueron 54,0ºC, 50,9ºC y 50,1ºC, respectivamente. El thresho medioLd para el cambio apoptótico celular fueron inferiores en aproximadamente 2 - 3 ° C, con las temperaturas umbral de 3 h, 24 h, y 48 h a 51,7 ° C, 48,0 ° C, y 47,0 ° C, respectivamente ( Figura 5 ].
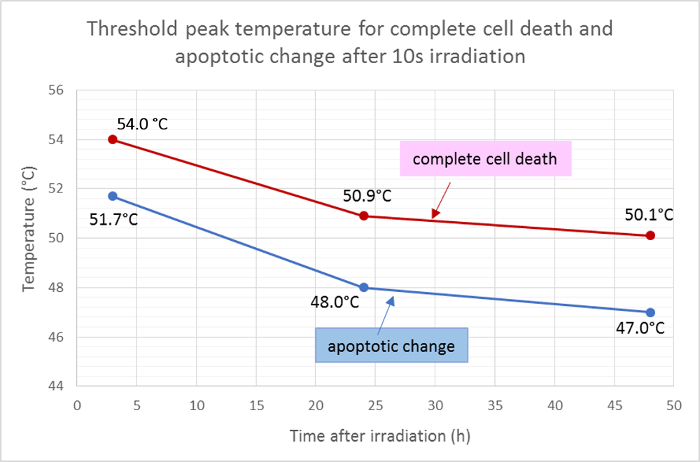
Figura 5: Temperaturas Umbral para Apoptosis y Muerte Celular.
Las temperaturas umbral medias para la muerte celular completa (positivas para Hoechst 33342, anexina V y homidímero de etidio III) y para la apoptosis (positivas sólo para Hoechst 33342 y anexina V) en diferentes puntos temporales después de la irradiación, calculadas a partir de los resultados de tinción de fluorescencia . Haga clic aquí para ver una versión más grande de esta figura.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Al discutir las respuestas celulares biológicas relacionadas con la temperatura, no sólo la temperatura, sino también la duración del tiempo de aumento de la temperatura, es importante, ya que la mayoría de los procesos bioquímicos son dependientes del tiempo. Particularmente en el campo de la hipertermia inducida por láser en oftalmología, debido al corto intervalo de tiempo -desde milisegundos a segundos- es difícil investigar los efectos térmicos celulares con un control preciso de la temperatura. Por lo tanto, se desea una configuración de irradiación con láser adecuada para el modelo de cultivo celular y con un sistema de operación que permita un control estricto de la temperatura y el tiempo. La evaluación biológica de las respuestas celulares después de la exposición térmica, como la expresión o secreción de proteínas, requiere evaluaciones cuantitativas repetidas sobre un número suficiente de células afectadas. Esto ha sido un obstáculo para los estudios que usan manchas láser de varios cientos de micrómetros de diámetro, como en los tratamientos clínicos. El análisis cuantitativo en un solo punto láser es bastanteRdensome En este estudio, se han hecho intentos para satisfacer estas demandas tanto como sea posible. Mediante el uso de un láser de thulium de onda continua de longitud de onda de 1,94 μm con un programa de control de irradiación, se podría llevar a cabo un aumento de temperatura temporal en un cultivo de células enteras en un corto periodo de tiempo. Dado que la distribución de la temperatura se puede ajustar mediante el cambio de la trayectoria de la luz, diferentes tipos de experimentos relacionados con la hipertermia se puede realizar utilizando esta configuración.
La limitación de la técnica presentada es la imposibilidad de realizar mediciones de temperatura simultáneas durante la irradiación láser de las células. Dado que el uso de termopares no es adecuado para cultivos celulares esterilizados, la calibración de temperatura debe llevarse a cabo separadamente de la irradiación celular. Teniendo en cuenta las posibles variaciones en la salida de potencia del láser, las mediciones de temperatura en tiempo real durante cada irradiación con láser serían ideales para evaluar directamente las respuestas celulares correspondientes a laDosis térmica Por otra parte, la distribución de la temperatura usada aquí fue creada a través de la interpolación de los datos basados en las medidas en 21 puntos en un plato de la cultura y en varios diversos ajustes de la energía. Por lo tanto, para superar estas limitaciones y puntos críticos, es nuestro objetivo desarrollar un método alternativo que permita la medición de la temperatura del plato de cultivo mientras se está realizando la irradiación con láser. También buscamos obtener la información de temperatura espacial de una sola vez. La imagen infrarroja (termografía) es un método posible para medir la temperatura durante la irradiación láser 10 . La gran ventaja de este método es la medición de la temperatura en tiempo real a nivel celular para cada irradiación; Las respuestas biológicas celulares subsiguientes siempre se pueden comparar individualmente con la historia de la temperatura durante la irradiación. Sin embargo, considerando la rentabilidad y la usabilidad, no es posible el uso de la termografía para experimentos de calentamiento celular para cada laboratorioOry
En el método que utiliza un láser de thulium a una longitud de onda de 1,94 μm, el agua en el plato de cultivo celular se calienta en su superficie, y la difusión térmica y la convección se utilizan para calentar las células. La altura del medio de cultivo en esta configuración de irradiación, con 1,2 ml de medio de cultivo, es de 935 μm en la posición central (a partir de una medición previa usando tomografía de coherencia óptica). El nivel de absorción del láser de thulium en el agua es muy alto (coeficiente de absorción: 127 cm -1 a 35 ° C) y el 72% de la luz se absorbe en los primeros 100 μm del medio de cultivo. No hay casi absorción (0,0007%) a una profundidad de 935 μm.
Es importante señalar que uno de los puntos críticos en el protocolo es agregar la misma cantidad de medio (1.200 μl) para cada irradiación. El uso de diferentes cantidades de medio de cultivo puede conducir a las diferencias de altura, que pueden causar diferencias en la temperatura iAumento de las células. El segundo punto crítico se refiere al momento de la apertura del plato de cultivo. Se debe hacer al mismo tiempo-en este estudio, 8 s antes del inicio de la irradiación, cuando el sistema hace un sonido. Las diferencias en este tiempo pueden variar la temperatura base debido al enfriamiento causado por el aire circundante (aproximadamente 23 ° C). Esto puede conducir a diferencias significativas en la temperatura inducida por láser.
Para la calibración de la temperatura, se utilizó la misma cantidad de medio (1,2 ml) que se utilizó en los experimentos para medir la distribución de temperatura en el fondo de las placas de cultivo libres de células. Sin embargo, la altura media con una monocapa celular puede ser diferente de la que no tiene células, incluso con el mismo volumen de medio añadido. La medición mediante tomografía de coherencia óptica reveló que existe una diferencia de 58 μm en la posición central entre platos con y sin una monocapa de células confluentes (877 μm sin células, en comparación con tO 935 mu m con células). Esta diferencia es potencialmente debido a la acción capilar de las células. La diferencia de altura de 58 μm en la posición central puede ser causada por aproximadamente 40 μl de medio (datos medidos). También se confirmó que esta diferencia de altura no causó diferencias significativas en T max en todos los ajustes de potencia. Por lo tanto, hemos concluido que esta diferencia no influye significativamente en los resultados de los análisis realizados en este estudio. No obstante, para obtener información de temperatura más precisa, tal como se ha escrito anteriormente, debería desarrollarse un método para calibrar la temperatura utilizando un plato de cultivo de células que contiene una monocapa de células. Además, también se requiere el modelado matemático de la difusión térmica y la convección en todo el medio de cultivo.
En este estudio, las células se calentaron con una distribución de temperatura gaussiana. Hay varios métodos posibles para calentar el medio entero más uniformemente con el tiempo. Uno Es utilizar una fuente láser con un coeficiente de absorción más bajo en agua. Sin embargo, el inconveniente es que, en este caso, los láseres deben tener una potencia mayor, ya que sólo un pequeño porcentaje de la luz se absorbe sobre aproximadamente 0,9 mm. Otra posibilidad es la imagen de la punta de fibra distal de una fibra óptica multimodo que transmite la luz láser en el plano del plato de cultivo; La ampliación puede ser elegida arbitrariamente por la óptica.
El segundo punto culminante de este protocolo es su capacidad para determinar la temperatura umbral para la muerte celular y la apoptosis utilizando la imagen fluorescente de la tinción de viabilidad y la distribución de temperatura lateral. Un objetivo a largo plazo no es sólo determinar la viabilidad celular, sino también elucidar el intervalo de temperaturas para las respuestas biológicas de las células relacionadas con la funcionalidad celular, como la expresión de proteínas y la proliferación celular. La determinación de la temperatura umbral de muerte celular es de gran interés para los investigadores"> 10. Usando este método, podría ser posible determinar los factores críticos para la muerte celular, incluida la apoptosis.Los factores críticos para la muerte celular inducida por láser térmico podría determinarse no sólo a través de la historia de la temperatura, sino también a través de los factores endógenos Es decir, los factores intracelulares y extracelulares a nivel molecular) .La respuesta a estas preguntas podría allanar el camino para la comprensión de mecanismos de muerte celular y cinética después de diferentes exposiciones térmicas y en diferentes patologías retinianas.Además, también puede ayudar a aclarar las cuestiones clínicamente observadas, Como la diferencia interindividual en respuesta al tratamiento con láser o la variabilidad en el tamaño de la cicatriz después de la fotocoagulación retiniana, incluso cuando el tamaño del punto inicial era casi idéntico ("fluencia atrófica") 11 .
El objetivo final de este estudio es ayudar en el desarrollo de terapia fototérmica controlada por temperatura de la retina. Para lograr esto, en paralelo wiEl avance técnico de la medición de la temperatura 3 , la elucidación adicional del comportamiento de las células RPE después de la exposición térmica, determinada usando este método, será de gran beneficio.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Los autores no tienen nada que revelar.
Acknowledgments
Este trabajo fue apoyado por una subvención de investigación del Ministerio Federal Alemán de Educación e Investigación (BMBF) (subvención # 13GW0043C) y una Oficina Europea de Investigación y Desarrollo Aeroespacial (EOARD, beca # FA9550-15-1-0443)
Materials
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Dulbecco’s Modified Eagle’s Medium - high glucose | Sigma-Aldrich | D5796-500ML | Add (2)-(4) before use. Warm in 37 °C water bath before use. |
| Antibiotic Antimycotic Solution (100 ×) | Sigma-Aldrich | A5955-100ML | Containing 10,000 units penicillin, 10 mg streptomycin and 25 μg Amphotericin B in 1mL. Add 5.5 mL in 500 mL medium bottle (1) before use. |
| Sodium pyruvate (100 mM) | Sigma-Aldrich | S8636-100ML | Add 5.5 mL in 500 mL medium bottle (1) before use (final concentration: 1 mM) |
| Porcine serum | Sigma-Aldrich | 12736C-500ML | Add 50 mL in 500 mL medium bottole (1) before use (final: 10%) |
| Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537-500ML | |
| Trypsin from porcine pancreas | Sigma-Aldrich | T4799-25G | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | ED-100G | |
| Human VEGF Quantikine ELISA Kit | R&D System | DVE00 | |
| Oxiselect Total Glutathione Assay Kit | Cell Biolabs, Inc | STA-312 | |
| Apoptotic/Necrotic/Healthy Cells Detection Kit | PromoKine | PK-CA707-30018 | |
| Name | Company | Catalog Number | Comments |
| Equipments | |||
| Thulium laser | Starmedtec GmbH | Prototype | 0-20 W |
| 365 mm core diameter fiber | LASER COMPONENTS Germany | CF01493-52 | |
| Thermocouple | Omega Engineering Inc | HYP-0- 33-1-T-G-60-SMPW-M | |
| Heating plate | MEDAX | ||
| Microplate reader (spectrofluorometer) | Molecular Device | Spectramax M4 | |
| cell homogenizer | QIAGEN | TissueLyser LT | |
| Fluorescence microscope | Nikon | ECLIPSE Ti | |
| mathematical software program | The Mathworks. Inc | MATLAB Release 2015b | |
| system-design platform | National Instrument | Labview | Laboratory Virtual Instrument Engineering Workbench |
References
- Inagaki, K., et al. Comparative efficacy of pure yellow (577-nm) and 810-nm subthreshold micropulse laser photocoagulation combined with yellow (561-577-nm) direct photocoagulation for diabetic macular edema. Jpn J Ophthalmol. 59 (1), 21-28 (2015).
- Roider, J., et al. Selective retina therapy (SRT) for clinically significant diabetic macular edema. Graefes Arch Clin Exp Ophthalmol. 248 (9), 1263-1272 (2010).
- Brinkmann, R., et al. Real-time temperature determination during retinal photocoagulation on patients. J Biomed Opt. 17 (6), 061219 (2012).
- Yoshimura, N., et al. Photocoagulated human retinal pigment epithelial cells produce an inhibitor of vascular endothelial cell proliferation. Invest Ophthalmol Vis Sci. 36 (8), 1686-1691 (1995).
- Denton, M. L., et al. Damage Thresholds for Exposure to NIR and Blue Lasers in an In Vitro RPE Cell System. Invest Ophthalmol Vis Sci. 47 (7), 3065-3073 (2006).
- Shrestha, R., Choi, T. Y., Chang, W., Kim, D. A high-precision micropipette sensor for cellular-level real-time thermal characterization. Sensors (Basel). 11 (9), 8826-8835 (2011).
- Gao, F., Ye, Y., Zhang, Y., Yang, J. Water bath hyperthermia reduces stemness of colon cancer cells. Clin Biochem. 46 (16-17), 1747-1750 (2013).
- Jansen, E. D., van Leeuwen, T. G., Motamedi, M., Borst, C., Welch, A. J. Temperature dependence of the absorption coefficient of water for midinfrared laser radiation. Lasers Surg Med. 14 (3), 258-268 (1994).
- Iwami, H., Pruessner, J., Shiraki, K., Brinkmann, R., Miura, Y. Protective effect of a laser-induced sub-lethal temperature rise on RPE cells from oxidative stress. Exp Eye Res. 124, 37-47 (2014).
- Denton, M. L., et al. Spatially correlated microthermography maps threshold temperature in laser-induced damage. J Biomed Optics. 16 (3), (2011).
- Morgan, C. M., Schatz, H. Atrophic creep of the retinal pigment epithelium after focal macular photocoagulation. Ophthalmology. 96 (1), 96-103 (1989).



