Summary
En original experimentell inställning för uppvärmning av celler i en kulturrätt med användning av 1,94 μm kontinuerligvåglasstrålning introduceras här. Med hjälp av denna metod kan de biologiska svaren hos retinala pigmentepiteliala (RPE) celler efter olika termiska exponeringar undersökas.
Abstract
En ursprunglig metod för att värma odlade celler med användning av en 1,94 μm kontinuerlig våg thuliumlaser för biologisk bedömning införs här. Thuliumlaserstrålningen absorberas kraftigt av vatten, och cellerna i botten av odlingsskålen upphettas genom termisk diffusion. En laserfiber med en diameter av 365 μm sätts ca 12 cm över odlingsskålen utan någon optik, så att laserstrålediametern är nästan ekvivalent med odlingsskålens (30 mm) innerdiameter. Genom att hålla en konsekvent mängd odlingsmedium i varje experiment är det möjligt att bestråla cellerna med en höggradigt reproducerbar temperaturökning.
För att kalibrera temperaturökningen och dess fördelning i en cellkulturskål för varje effektinställning uppmättes temperaturen under 10 s av bestrålning vid olika positioner och på cellulär nivå. Temperaturfördelningen representerades med användning av en matematisk grafikprogramvaraProgram, och dess mönster över kulturrätten var i Gaussisk form. Efter laserbestrålning kunde olika biologiska experiment utföras för att utvärdera temperaturberoende cellresponser. I detta manuskript introduceras livskraftbar färgning ( dvs. att skilja levande, apoptotiska och döda celler) för att bestämma tröskelvärdena för cellapoptos och död efter olika tidpunkter.
Fördelarna med denna metod är precisionen av temperaturen och upphettningstiden, liksom dess höga effektivitet i uppvärmningsceller i en hel cellodlingsskål. Dessutom tillåter det studier med en mängd olika temperaturer och tidsperioder, vilket kan styras av ett datoriserat operativsystem.
Introduction
Förstå temperaturberoende cellbiologiska reaktioner är av stor betydelse för framgångsrika hypertermibehandlingar. Retinal laserfotokoagulering med en termisk laser, som används i oftalmologi, är en av de mest etablerade laserbehandlingarna i medicin. Synligt ljus, mestadels från grön till gul våglängder, används vid retinal laserbehandling. Ljuset absorberas starkt av melaninet i retinala pigmentepiteliala (RPE) celler, som bildar det yttersta cellmonolaget i näthinnan. Det har varit aktuellt intresse bland läkare och forskare vid mycket mild termisk bestrålning (sub-synlig fotokoagulering) som en ny terapeutisk strategi för olika typer av retinala sjukdomar 1 , 2 . Efter denna trend är vårt intresse att höja RPE-celler med lågt värme under exakt temperaturkontroll, en teknik som kallas temperaturstyrd fototermisk terapi (TC-PTT).
Senaste optoAkustisk teknik från vårt institut har gjort det möjligt för realtidsmätning av temperaturökningar vid bestrålade platser i näthinnan. Detta möjliggör kontroll över temperaturökning under bestrålning 3 . Eftersom sub-dödlig hypertermi på näthinnan, orsakad av upphettning av RPE-celler sub-lethalt, inte tidigare har beaktats på grund av omöjligheten att mäta och styra temperaturen, har emellertid de temperaturberoende cellreaktionerna av RPE-celler efter termisk laserbestrålning Har studerats väldigt lite hittills. Dessutom har inte temperaturskillnaden inte diskuterats i detalj, utan även skillnaden i cellöverträdandet hos de överlevande cellerna efter sub-dödlig och dödlig bestrålning. För att samla vetenskapliga bevis på TC-PTT-baserade behandlingar strävar vi därför efter att klargöra de temperaturberoende RPE-cellbiologiska svaren och deras mekanismer med hjälp av in vitro experimentella inställningar.
För tHans syfte är det nödvändigt att upprätta en celluppvärmningsinstallation som uppfyller följande villkor: 1) möjligheten för snabb temperaturökning ökar, 2) en exakt kontrollerad tid och temperatur och 3) ett relativt högt antal undersökta celler för biologiska experiment . Beträffande uppvärmningsmetoden är en klinisk laser, såsom en frekvensdubblad Nd.YAG-laser (532 nm), tyvärr olämplig för cellodling. Detta beror på det starkt reducerade antalet melanosomer i odlade RPE-celler. Laserljusabsorptionen kan vara inhomogen, och temperaturökningen på cellulär nivå varierar mellan experiment, även vid bestrålning med samma strålningseffekt. Flera tidigare studier har rapporterat användningen av svart papper under diskbotten under bestrålning 4 eller användningen av ytterligare melanosomer som fagocytiseras av odlingscellerna före experimenten 5 , 6 . Många avDe in vitro biologiska studierna för att bedöma hypertermiinducerad cellrespons har utförts med användning av en hetplatta, ett vattenbad eller en CO2-inkubator med en temperaturinställning 7 . Dessa metoder kräver en lång uppvärmningsperiod, eftersom det tar lite tid ( dvs flera minuter) för att nå önskad temperatur. Vidare är det svårt att erhålla en detaljerad termisk historia ( dvs temperatur multiplicerad med tiden) på cellulär nivå med hjälp av dessa metoder. Vidare kan temperaturen mellan cellerna vid olika positioner i en odlingsskål variera beroende på diffusion av variabel temperatur. I de flesta fall har denna tidsmässiga och rumsliga temperaturinformation under hypertermi inte beaktats för biologiska analyser, även om biologiskt cellsvar kan påverkas kritiskt av temperaturen och tiden för den ökade temperaturen.
För att övervinna dessa problem, en fortsättningNuös-våg-thuliumlaser användes här för att värma cellerna. Thuliumlaserstrålning (A = 1,94 μm) absorberas starkt av vatten 8 och cellerna i botten av odlingsskålen stimuleras termiskt endast genom termisk diffusion. Laserfibern med en diameter på 365 μm är satt ca 12 cm över odlingsskålen utan någon optik däremellan. Laserstråldiametern avviker så att den nästan motsvarar den inre diameteren av odlingsskålen (30 mm) vid odlingsmediets yta. Med en konsekvent mängd odlingsmedium är det möjligt att bestråla cellerna med temperaturökning Av hög repeterbarhet. Variabla effektinställningar möjliggör bestrålning med upp till 20 W och medeltemperaturen på mobilnivån kan ökas upp till ΔT ≈ 26 ° C på 10 s.
Genom att ändra bestrålningsförhållandena är det också möjligt att byta laserstråleprofil för att variera temperaturdistributionenPå i en kulturrätt. Det är till exempel möjligt att undersöka med en Gauss-liknande temperaturfördelning, som i den aktuella studien, eller med en homogen temperaturfördelning. Det senare kan vara fördelaktigt för att undersöka effekterna av temperaturberoende cellreaktioner mer specifikt för sub-dödlig temperaturökning, men inte för celldödspänning eller sårläkningssvar.
Sammantaget kan thuliumlaserbestrålning möjliggöra undersökning av olika typer av biologiska faktorer, såsom gen / proteinuttryck, celldödskinetik, cellproliferation och utveckling av cellfunktionalitet efter olika termiska exponeringar.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. RPE-cellkultur
- Isolering av RPE-celler från svinögon
- Hämta fräscha enukleerade svinögon från det lokala slakteriet. Håll dem svala (4 ° C) och i en mörk miljö.
- Ta bort extracellulära vävnader med sax och blöt i ögonen i en antiseptisk lösning i 5 minuter.
- Placera ögonen i steriliserad fosfatbuffrad saltlösning utan kalcium och magnesium (PBS (-)) tills användning.
- Använd en skalpell, tränga in i sclera på ca 5 mm bakom hornhinnets limbus. Resekt hela framsidan av ögat genom att klippa med sax hela vägen, parallellt med hornhinnan limbus.
- Ta bort den främre delen av ögat ( dvs. hornhinnan och linsen) och glasögonet. Tillsätt 1 ml PBS (-) och ta försiktigt bort nervhinnan.
OBS: Den här "ögonkoppen", som består av sclera, choroid och RPE, är nu klar. - Tillsätt förvärmd (37 ° C) 0,25% trypsin i PBS (-) till ögonkoppen. Justera volymen så att ca 80% av ögonkoppen fylls med denna trypsinlösning.
- Inkubera ögonkoppen med trypsinlösningen i en 5% CO2-inkubator vid 37 ° C under 10 minuter.
- Ta bort ögonkoppen från inkubatorn och byt ut 0,25% trypsinlösningen med en PBS (-) lösning med 0,05% trypsin + 0,2% etylendiamintetraättiksyratetranatriumsalt (EDTA · 4N). Inkubera ögonkoppen i inkubatorn i 45 minuter.
OBS! Efter 45 min kommer RPE-cellerna antingen att vara löst fastsatta på Bruchs membran eller redan lossnade och flytande i trypsin-EDTA-lösningen. - Samla RPE-cellerna genom försiktig pipettering. Samla cellerna och lösningen i ett koniskt rör fyllt med 10 ml odlingsmedium (DMEM-hög glukos med L-glutamin), inklusive 10% svinserum, antibiotikum / antimykotiska och natriumpyruvat (1 mM).
OBS: Serumet kan neutralisera effekten av trypsin. - CentrifugeraCellsuspension vid 400 xg under 5 min vid rumstemperatur.
- Ta bort supernatanten och tillsätt 10 ml färskt medium. Centrifugera igen under samma förhållanden under 5 min.
- Ta bort supernatanten och tillsätt nytt medium, så att cellkoncentrationen resulterar i 5 x 10 5 celler / ml (bestämd genom att räkna cellerna med hjälp av en hemocytometer). Blanda väl med mild pipettering.
- Fördela cellsuspensionen i cellodlingsdiskar. Använd 3 ml per 60 mm diameter odlingsskål.
OBS: Denna kultur kallas passage noll (P0). - Bibehålla cellerna i en 5% CO2-inkubator vid 37 ° C. Byt hälften av det konditionerade mediet till färskt medium varannan dag.
- Subkultur (steg 1.2) om det blir sammanflödet.
- Subkultur av RPE-cellkulturen
- Ta bort odlingsmediet och skölj cellerna två gånger med PBS (-).
- Inkubera cellerna med PBS (-) lösning med 0,05% trypsin + 0,2% EDTA iNa 5% CO2 inkubator vid 37 ° C i 5 min.
- Lossa RPE-cellerna genom försiktig pipettering och samla cellsuspensionen i ett koniskt rör fyllt med 10 ml odlingsmedium, inklusive 10% svinserum.
- Centrifugera cellsuspensionen vid 400 xg i 5 min vid rumstemperatur.
- Ta bort supernatanten och tillsätt nytt odlingsmedium, vilket gör cellkoncentrationen 5 x 10 5 celler / ml (bestämd genom att räkna cellnummeret med en hemocytometer). Distribuera cellerna i nya kulturskålar med 60 mm diameter, som beskrivs i steg 1.1.13.
OBS: Cellkulturen är nu passage 1 (P1). - Efter att sammanflödet har uppnåtts subkultureras Pl-kulturen till P2, med användning av samma procedur som beskrivs i steg 1.2.1-1.2.5. Från P2-kulturen fröda cellerna på mindre odlingsskål (30 mm inre diameter) istället för odlingsskålar med 60 mm diameter.
- För experimenten, använd P2 eller P3 kulturer.
2. ThulIum laserbestrålning
- Konstruktion av bestrålningsstationen
- Anslut en thuliumlaseranordning (1,94 μm, effektområde: 0-20 W) till en 0,22-NA, 365 μm kärndiameterfiber.
- Mekaniskt fixera fiberspetsen till metallarmen som är horisontellt fixerad till det vertikala metallposten hos bestrålningsstationen. Placera det vertikala inlägget så att spetsen av laserfibrerna är belägen ovanför den hetplatta på vilken cellodlingsskålen ska placeras under bestrålning.
- Lägg ett vitt papper på värmeplattan och vrid sikten på (A = 635 nm, max = 1 mW, diameter på pappersnivå ≈ 30 mm). Markera omkretsen på den siktade strålen på vitpapper så att den position där odlingsskålen ska placeras under bestrålning är känd.
OBS: Fiberspetsens z-planet kan vara bytbart. Utan någon ytterligare bildningsoptik placerades laserpunktdiametern på cellodlingsplanet 12 cm under fiberspetsen, iS ca 30 mm, vilket är nästan ekvivalent med cellkulturskålens inre diameter. En schematisk ritning av inställningen visas i Figur 1 .

Figur 1: Schematisk bild av Thulium Laser Bestrålningsstation. En odlingsskål placeras på värmeplattan. Cellerna placeras 12 cm under thuliumlaserfiberspetsen så att strålstorleken är nästan identisk med odlingsskålens innerdiameter (ca 30 mm). Laserbestrålningsproceduren styrs av en tidsstyrd rutin i den skräddarsydda systemdesignplattformen. Ströminställningen måste bestämmas innan bestrålningsprogrammet startas. Vänligen klicka här för att se en större version av denna figur.
- 1 h före bestrålning, ersätt odlingsmediet fullständigt med 1,2 ml färskt medium.
OBS: Detta är ett KRITISK STEG och måste följas strikt. - Placera bestrålningsstationen ( dvs. värmeplattan och stolpen för att fixera laserfibern) på en ren bänk.
- Ta bort cellodlingsskålen från inkubatorn och placera den på märkt läge på värmeplattan (steg 2.1.3).
- Använd skyddsglasögon. Slå på thuliumlasern. Ställ in effekten som önskad på lasernheten (inställbar från 0 - 20 W). Slå på utsläppet.
- Starta en systemdesignplattform som styr laserbestrålning och timingprotokoll (kompletterande fil).
- Omedelbart efter att odlingsskålen placerats på varmplattan, klicka på "föruppvärmningstid" för att starta timern i 140 s ("föruppvärmningstid 1"); Detta kommer att hålla kulturmedietemperaturen vid 37 ° C före bestrålning.
OBS! Efter 140 s slås ett ljudsignal på och nästa timer ("föruppvärmningstid 2") börjar automatiskt räkna 8 s. Under denna 8 s kan examinator öppna kulturrätten. Efter 148 s av föruppvärmning, kommer en 10 s lång laserbestrålning på cellkulturen att utföras automatiskt. Vid nödsituation, utrusta laserns apparaten med en kraftuttagsknapp för att omedelbart stoppa lasern. Detta är ett kritiskt steg och måste följas strikt. En särskild försiktighet gäller att öppna skåpet på skålen strax före bestrålning, i början av 8 s förvärmningstid. Öppning av locket kan svalna medeltycket mycket snabbt. - Efter bestrålning placera omslaget omedelbart på odlingsskålen, låt odlingsrätten stå på kokplattan under ytterligare 7 s och placera den tillbaka i 5% CO2-inkubatorn vid 37 ° C.
- Gör små hål (ca 300 μm i diameter) nära botten på fyra sidor (var 90: e) av en 30 mm diameter odlingsskål (utan celler); Använd spetsen av en nål (20G) uppvärmd med en Bunsen-brännare. Tät hålen med elektriskt isoleringsband utifrån och gör ett litet hål med en fin nål så att endast ett fint termoelement (200 μm i diameter) kan sättas in genom detta hål under vattentäta förhållanden.
- På utsidan av odlingsskålens botten ritar du 2 vinkelräta diametrar och ställer korspunkten ( dvs. mittpunkten på undersidan) som koordinat noll (0). Markera var 3 mm radiellt utåt på skålen ( dvs 0, 3, 6, 9, 12 och 15 mm) i varje riktning längs linjerna ( Figur 2 , blåa punkter). Antalet poäng ska vara 21 totalt.
- Fyll cellodlingsskålen med 1,2 ml nytt odlingsmedium. Placera kulturen dIsh på en het platta vid 37 ° C, sätt in ett fint termoelement (200 μm i diameter) i sidhålet och placera sin känsliga spets på en markerad position som ska mätas.
- Använd skyddsglasögon. Slå på thuliumlasern och ställ in strömmen (mellan 0 och 20 W, i 0,1-W steg) av lasertänkningen manuellt.
OBS: För temperaturkalibrering bör mätningar med effekt i inkrement på 3 W vara tillräckliga. - Slå på systemdesignplattformen och klicka på knappen "Start Temp Acquisition" (tilläggsfil) för att starta temperaturmätningen.
- Gör samma procedur som i steg 2.2.6.
OBS: Kontrollprogrammet mäter temperaturen på det insatta termoelementet varje 100 ms och visar temperaturprogressionen under bestrålning i GUI. - Genomför dessa procedurer för alla 21 mätpunkter och vid olika kraftinställningar. Upprepa hela proceduren tre gånger för alla punkter och för all kraftuttagGs för att uppnå tillförlitliga data.
- Exportera temperaturdata som csv-data, som så småningom kan konverteras till ett kalkylblad. Genomsnittlig maximal temperatur i slutet av bestrålningen för triplikata mätningar vid varje punkt. Medelvärdena från punkterna i samma cirkel (4 poäng totalt, utom den centrala punkten).
- Avbilda den erhållna genomsnittliga maximala temperaturen på ett diagram, vilket gör avståndet från mitten av maträtten (mm) som x-axeln och temperaturen ökar (ΔT, ° C) som y-axeln. Använd passformfunktionen för ett matematiskt program för att passa en gaussisk modell till rådata. Skapa en Gaussisk passformstemperaturfördelning.

Figur 2: Punkterna för temperaturkalibrering i en cellkulturskål. Temperaturdata mättes i mitten och vid 5Radiella punkter över 4 olika vinklar (blå prickar). Vänligen klicka här för att se en större version av denna figur.
3. Biologiska bedömningar för cellreaktioner efter olika termiska bestrålningar
- Bedömning av cellens livskraft ( dvs. levande, apoptotisk och död) efter olika kraftinställningar och bestämning av tröskeln för celldöd
- Tvätta cellerna med PBS (-) vid de angivna tidpunkterna ( dvs. 3, 24 och 48 h efter bestrålning) och använd ett kommersiellt tillgängligt kit för att bedöma cellens livskraft ( dvs. vital, apoptotisk, död) enligt tillverkarens protokoll.
- Förbered en färglösning genom att tillsätta 5 | il fluoresceinisotiocyanat (FITC) -annexin V, 5 | il etidiumhomodimer III och 5 | il Hoechst 33342 till 100 | il av 1x bindningsbuffert (alla är kitkomponenter). Förbered tillräckligt med färglösning för att täcka cellerna. Inkubera cellerna i 15 minuter.
- Tvätta cellodlingen med bindningsbufferten två gånger, ersätt bindningsbufferten med PBS (-) och sätt kulturen på scenen av ett fluorescensmikroskop.
- Byt ljusväg till okularlinsen, välj filteret 4 ', 6-Diamidin-2-fenylindol (DAPI), sätt på belysningsljuset och hitta det fokuserade planet med 4x-objektivet.
- Ändra ljusbanan till kameran, hitta bilden på datorskärmen i mikroskopbildningsprogrammet och justera fokusen.
- Använd stygnfunktionen ( dvs. funktionen för att spela in flera bilder över disken och skapa sedan en enda stor bild) av den mikroskopspecifika mjukvaran för att få fluorescensbilden av hela cellkulturskålen. Använd 3 olika filteruppsättningar-DAPI, FITC och tetrametylrhodamin (TRITC) -till bild Hoechst 33342-positiva celler (alla cellkärnor), FITC-annexin V-positiVe-celler (apoptotiska) respektive etidium homodimer III-positiva celler (död).
- Mät radien (mm) hos den döda (etidium homodimer III-positiva) regionen och den yttre / inre raden av det apoptotiska (annex V-positiva) bandformområdet i de färgade cellkulturerna. Applicera dessa radier på den utrustade Gaussiska funktionen av temperaturfördelningen för motsvarande effektinställning. Beräkna den exakta temperaturen vid kanten av den döda eller apoptotiska regionen för att klargöra tröskelvärdena för celldöd och apoptotisk förändring.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Temperaturfördelning efter olika ströminställningar
Alla temperaturutvecklingar för varje enskild bestrålning övervakades vid temperaturkalibrering. Från denna data erhölls maximal temperatur vid den uppmätta punkten och definierad som T max (° C). Som visas i figur 3A exekverades programmet vid tidpunkten när odlingsskålen placerades på värmeplattan. Efter 140 s "föruppvärmningstid 1", som behövdes för att arkivera en stabil medeltemperatur vid 37 ° C, avlägsnades kulturen av kåpan under 8 s "föruppvärmningstid 2." I slutet av "föruppvärmningstid 2" startades laserutsläpp automatiskt. Denna kurva är en representativ temperaturprogression för en 10 s bestrålning. Under bestrålning ökade temperaturen och omedelbart efter laserutsläppetStängdes av, temperaturen började minska. Den maximala temperaturen i mitten av odlingsrätten definierades i denna studie som T max (° C). T max var proportionell mot laserkraften ( figur 3B ). Figur 3C visar fördelningen av den maximala temperaturen för varje kraft över odlingsskålen. Fördelningarna är klockformade, som visas i Figur 3C , och passar till en Gaussisk funktion enligt följande formel:
T (r) = t bas + A · 
Där r, t basen , A och w står för avståndet från mitten (mm), den lägsta temperaturen för kurvan, amplituden och kurvans bredd. Parametrarna (t bas , A och w) hos den monterade GAussisk kurva för varje effektinställning, nämligen för varje Tmax , visas i tabellen bredvid grafen.
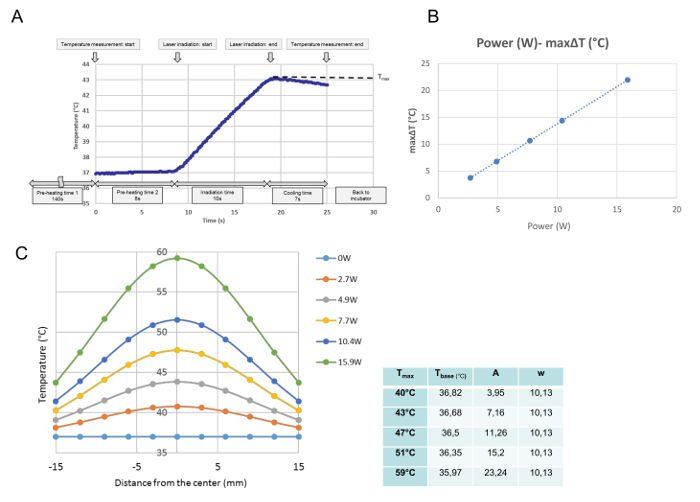
Figur 3: Temperaturkalibreringsdata. En representativ temperaturutveckling vid den centrala positionen efter en enkel bestrålning vid 4,9 W ( Tmax = 43 ° C) ( A ), Proportionell Förhållande Mellan Laserkraft och Maximal AT vid den centrala positionen för en cellkultur ( B ) Och temperaturfördelningar över kulturskålen efter olika kraftinställningar (C). (A) Programmet körs från den tidpunkt då odlingsskålen placeras på värmeplattan. Efter 140 s av "föruppvärmningstid 1", som behövs för att arkivera en stabil medeltemperatur vid 37 ° C, avlägsnas odlingen av odlingsskålen för 8-s "föruppvärmningstid2. "I slutet av" föruppvärmningstiden 2 "startar laserutsläppet automatiskt. Denna kurva är en representativ temperaturprogression vid det centrala läget vid en 10 s strålning vid 4,9 W. Under bestrålning ökar temperaturen och Omedelbart efter att laserutsläppet är avstängt, börjar temperaturen minska. Den maximala temperaturen uppnås i slutet av bestrålningen, vilket definieras i denna studie som T max (° C). (B) Laserkraften och maximal Temperaturförhöjning (ΔT max ) är proportionell. (C) De monterade gaussfunktionerna av de uppmätta temperaturfördelningarna över odlingsskålen. Parametrarna för funktionerna, bestämda med ett matematiskt program, visas i tabellen vid sidan av diagrammet . Vänligen klicka här för att se en större version av denna figur.
Cellleabilitet efter termisk bestrålning
Såsom visas i figur 4A finns tre olika färgmönster som indikerar cellleabilitet efter laserbestrålning: 1) inget annex V / etidium homodimer III-positivt ( dvs. endast levande), 2) annexin V-positivt i mitten ( dvs nästan Endast tidig apoptos) och 3) etidium homodimer III-positiv i mitten ( dvs. döda celler) omgivna av apoptotiska celler vid gränsen mellan döda och levande celler ( Figur 4B ). Storleken på det döda / apoptotiska området är generellt beroende av Tmax och efterbestrålningstiden upp till 48 timmar efter bestrålning. Ingen uppenbar förändring av lönsamheten upptäcktes i kulturerna bestrålade med T max ≤43 ° C. Den enda apoptotiska förändringen kunde observeras vid en tidig tidpunkt (3 timmar), följt av en sen Celldöd efter en bestrålning med Tmax = 47 ° C. Omedelbar eller tidig celldöd (upp till 3 timmar) hittades i de odlingar som bestrålades med Tmax ≥ 51 ° C (Tabell 1).

Figur 4: Färgfärgsmönster efter olika kraftinställningar (A) och ett exemplifierande avbild vid döden och det apoptotiska området efter dödliga laserbestrålningar (B).
(A) Tre färgmönster kan förekomma, beroende på temperaturen. (B) Den apoptotiska zonen (FITC-annexin V-positiv: grön) runt det döda området (etidium homodimer III-positiv: röd). Alla celler är positiva för Hoechst 33342 (blå), och cellerna med blåkärnor är levande celler. Bilden togs 24 h efter en bestrålning vid T max = 59 ° C. Bar = 100 | im./files/ftp_upload/54326/54326fig4large.jpg "target =" _ blank "> Vänligen klicka här för att se en större version av denna figur.

Tabell 1: Bilaga V och Ethidium Homodimer III Svar vid olika temperaturer och tider.
Bestämning av tröskelvärdet för celldöd
De genomsnittliga radierna för det döda området (rött) och det apoptotiska området (grönt) mättes och applicerades på den Gaussiska funktionen av temperaturfördelningen för att bestämma tröskelvärdet för celldöd och apoptos efter 10 s strålning. Enligt denna analys var de genomsnittliga tröskelvärdena för fullständig celldöd 3 h, 24 h och 48 h efter bestrålning 54,0 ° C, 50,9 ° C respektive 50,1 ° C. Den genomsnittliga threshoLd-temperaturen för cellapoptotisk förändring var lägre med ca 2 - 3 ° C, med tröskelvärdena i 3 h, 24 h och 48 h vid 51,7 ° C, 48,0 ° C respektive 47,0 ° C ( Figur 5 ).
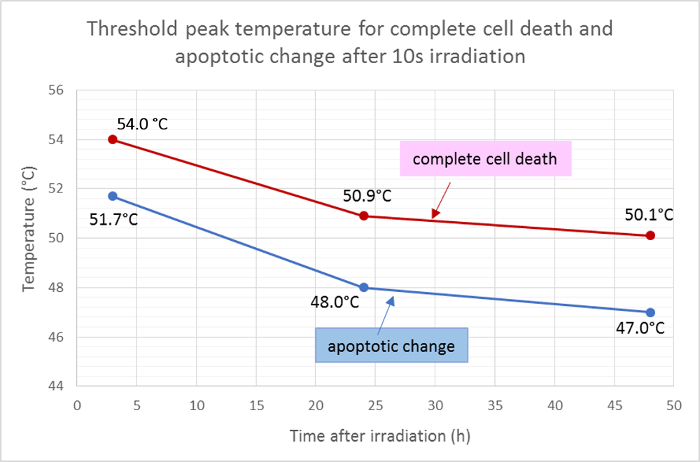
Figur 5: Tröskelvärden för apoptos och celldöd.
Medelvärdet för tröskelvärden för fullständig celldöd (positiv för Hoechst 33342, annexin V och etidium homodimer III) och för apoptos (positiv endast för Hoechst 33342 och annexin V) vid olika tidspunkter efter bestrålning beräknat utifrån resultaten av fluorescens-viabilitetsfärgning . Vänligen klicka här för att se en större version av denna figur.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Vid diskussion av temperaturrelaterade biologiska cellulära reaktioner är inte bara temperaturen men också tiden för den ökade temperaturen av betydelse, eftersom de flesta biokemiska processer är tidsberoende. Särskilt inom området för laserinducerad hypertermi i oftalmologi, på grund av det korta tidsintervallerna, från millisekunder till sekunder, är det svårt att undersöka cellulära termiska effekter med exakt temperaturkontroll. Därför är en laserbestrålningsinstallation lämplig för cellodlingsmodellen och med ett operationssystem som möjliggör strikt temperatur och tidskontroll önskat. Den biologiska bedömningen av cellsvar efter termisk exponering, såsom proteinuttryck eller utsöndring, kräver upprepade kvantitativa utvärderingar på ett tillräckligt antal drabbade celler. Detta har hindrat studier med laserfläckar med flera hundra mikrometer i diameter, som i kliniska behandlingar. Kvantitativ analys vid en enda laserpunkt är ganska burdensome. I denna studie har försök gjorts så att de uppfyller dessa krav så mycket som möjligt. Genom att använda en 1,94 | im våglängds kontinuerlig våg-thuliumlaser med ett bestrålningskontrollprogram, kunde en temporär temperaturökning öka i en hel cellodling inom en kort tidsram. Eftersom temperaturfördelningen kan justeras genom att ändra ljusbanan kan olika typer av hypertermi-relaterade experiment utföras med hjälp av denna inställning.
Begränsningen av den presenterade tekniken är omöjligheten att genomföra samtidiga temperaturmätningar under laserbestrålningen av cellerna. Eftersom användningen av termoelement inte är lämplig för steriliserade cellkulturer måste temperaturkalibrering utföras separat från cellbestrålning. Med tanke på de möjliga variationerna i laserkraftutmatningen skulle realtidstemperaturmätningar under varje laserbestrålning vara idealisk för att direkt bedöma cellulära svar som motsvararTermisk dos. Dessutom skapades temperaturfördelningen som användes här genom datainterpolering baserat på mätningarna vid 21 poäng på en kulturrätt och vid flera olika effektinställningar. För att övervinna dessa begränsningar och kritiska punkter är det därför vårt mål att utveckla en alternativ metod som möjliggör mätning av temperaturen hos odlingsrätten medan laserbestrålning utförs. Vi strävar också efter att få information om rums temperaturen på en gång. Infraröd avbildning (termografi) är en möjlig metod för mätning av temperaturen under laserbestrålning 10 . Den stora fördelen med denna metod är realtidstemperaturmätningen på mobilnivån för varje bestrålning; Efterföljande cellbiologiska svar kan alltid individuellt jämföras med temperaturhistoriken under bestrålning. Med tanke på kostnadseffektivitet och användbarhet är det emellertid inte möjligt att använda termografi för celluppvärmningsexperiment för varje laboratory.
Vid metoden med användning av en thuliumlaser vid en våglängd av 1,94 um, värms vattnet i cellodlingsskålen vid dess yta och termisk diffusion och konvektion används för att värma cellerna. Höjden av odlingsmediet i denna bestrålningsinstallation med 1,2 ml odlingsmedium är 935 pm vid det centrala läget (från en tidigare mätning med användning av optisk koherens-tomografi). Nivån av absorptionen av thuliumlasern i vatten är mycket hög (absorptionskoefficient: 127 cm -1 vid 35 ° C) och 72% av ljuset absorberas i de första 100 | im av odlingsmediet. Det finns nästan ingen absorption (0,0007%) vid ett djup av 935 μm.
Det är viktigt att notera att en av de kritiska punkterna i protokollet är att tillsätta samma mängd medium (1200 μL) för varje bestrålning. Användning av olika mängder odlingsmedium kan leda till höjdskillnaderna, vilket kan orsaka skillnader i temperaturen iNcreas av cellerna. Den andra kritiska punkten avser tidpunkten för öppningen av kulturrätten. Det måste göras samtidigt - i den här studien, 8 s före strålningsstart, när systemet gör ett ljud. Skillnader i denna tid kan variera bastemperaturen på grund av kylningen som orsakas av omgivande luft (ca 23 ° C). Detta kan leda till signifikanta skillnader i den laserinducerade temperaturen.
För temperaturkalibrering användes samma mängd medium (1,2 ml) som användes i experimenten för att mäta temperaturfördelningen vid botten av cellfria odlingsrätter. Medelhöjden med ett cellmonolag kan emellertid vara annorlunda än den utan celler, även med samma volym mediet tillsatt. Mätningen med användning av optisk koherens tomografi avslöjade att det finns en 58 μm skillnad i det centrala läget mellan rätter med och utan ett sammanfogat cellmonolag (877 μm utan celler, jämfört tO 935 pm med celler). Denna skillnad är potentiellt beroende på kapillärverkan hos cellerna. 58-μm skillnaden i höjd i det centrala läget kan orsakas av cirka 40 μl medium (uppmätt data). Det bekräftades också att denna skillnad i höjd inte orsakade signifikanta skillnader i T max vid alla ströminställningar. Därför har vi dragit slutsatsen att denna skillnad inte väsentligt påverkar resultaten av analyserna som gjorts i denna studie. För att emellertid samla mer exakt temperaturinformation, såsom skrivits ovan, bör en metod för kalibrering av temperaturen med hjälp av en cellkulturskål innehållande ett cellmonolag utvecklas. Dessutom krävs också den matematiska modelleringen av termisk diffusion och konvektion i hela odlingsmediet.
I denna studie uppvärmdes cellerna med en Gaussisk temperaturfördelning. Det finns flera möjliga metoder för att värma hela mediet mer enhetligt över tiden. Ett Är att använda en laserkälla med en lägre absorptionskoefficient i vatten. Nackdelen är emellertid att i detta fall måste lasrarna ha högre effekt eftersom endast en liten andel av ljuset absorberas över ca 0,9 mm. En annan möjlighet är att avbilda distalfiberspetsen hos en multimod optisk fiber som överför laserljuset till odlingsskålens plan. Förstoringen kan väljas godtyckligt av optiken.
Den andra höjdpunkten i detta protokoll är dess förmåga att bestämma tröskelvärdet för celldöd och apoptos med hjälp av den fluorescerande bilden av livskraftbar färgning och sidotemperaturfördelning. Ett långsiktigt mål är inte bara att bestämma cellens livskraft, men också för att belysa temperaturområdet för cellbiologiska svar relaterade till cellfunktionalitet, såsom proteinuttryck och cellproliferation. Bestämningen av tröskeltemperaturen för celldöd är av stort intresse för forskare"> 10. Med hjälp av denna metod kan det vara möjligt att bestämma de kritiska faktorerna för celldöd, inklusive apoptos. Kritiska faktorer för termisk laserinducerad celldöd kan bestämmas inte bara genom temperaturhistoriken utan också genom de endogena faktorerna ( Dvs intra / extracellulära faktorer på molekylivå.) Att svara på dessa frågor kan bana väg för att förstå celldödsmekanismer och kinetik efter olika termiska exponeringar och i olika retinala patologier. Dessutom kan det också bidra till att klargöra kliniskt observerade problem, Såsom den interna individuella skillnaden som svar på laserbehandling eller variationen i ärstorlek efter retinalfotokoagulering, även när den ursprungliga punktstorleken var nästan identisk ("atrofisk kryp") 11 .
Det slutgiltiga syftet med denna studie är att bidra till att utveckla temperaturstyrd fototermisk behandling av näthinnan. För att uppnå detta, parallellt wiDen tekniska utvecklingen av temperaturmätningen 3 , ytterligare belysande av RPE-cellbeteende efter termisk exponering, bestämd med användning av denna metod kommer att vara till stor nytta.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Författarna har ingenting att avslöja.
Acknowledgments
Detta arbete stöddes av ett forskningsbidrag från det tyska federala ministeriet för utbildning och forskning (BMBF) (bidrag nr 13GW0043C) och och ett europeiskt kontor för rymdforskning och utveckling (EOARD, bevilja # FA9550-15-1-0443)
Materials
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Dulbecco’s Modified Eagle’s Medium - high glucose | Sigma-Aldrich | D5796-500ML | Add (2)-(4) before use. Warm in 37 °C water bath before use. |
| Antibiotic Antimycotic Solution (100 ×) | Sigma-Aldrich | A5955-100ML | Containing 10,000 units penicillin, 10 mg streptomycin and 25 μg Amphotericin B in 1mL. Add 5.5 mL in 500 mL medium bottle (1) before use. |
| Sodium pyruvate (100 mM) | Sigma-Aldrich | S8636-100ML | Add 5.5 mL in 500 mL medium bottle (1) before use (final concentration: 1 mM) |
| Porcine serum | Sigma-Aldrich | 12736C-500ML | Add 50 mL in 500 mL medium bottole (1) before use (final: 10%) |
| Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537-500ML | |
| Trypsin from porcine pancreas | Sigma-Aldrich | T4799-25G | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | ED-100G | |
| Human VEGF Quantikine ELISA Kit | R&D System | DVE00 | |
| Oxiselect Total Glutathione Assay Kit | Cell Biolabs, Inc | STA-312 | |
| Apoptotic/Necrotic/Healthy Cells Detection Kit | PromoKine | PK-CA707-30018 | |
| Name | Company | Catalog Number | Comments |
| Equipments | |||
| Thulium laser | Starmedtec GmbH | Prototype | 0-20 W |
| 365 mm core diameter fiber | LASER COMPONENTS Germany | CF01493-52 | |
| Thermocouple | Omega Engineering Inc | HYP-0- 33-1-T-G-60-SMPW-M | |
| Heating plate | MEDAX | ||
| Microplate reader (spectrofluorometer) | Molecular Device | Spectramax M4 | |
| cell homogenizer | QIAGEN | TissueLyser LT | |
| Fluorescence microscope | Nikon | ECLIPSE Ti | |
| mathematical software program | The Mathworks. Inc | MATLAB Release 2015b | |
| system-design platform | National Instrument | Labview | Laboratory Virtual Instrument Engineering Workbench |
References
- Inagaki, K., et al. Comparative efficacy of pure yellow (577-nm) and 810-nm subthreshold micropulse laser photocoagulation combined with yellow (561-577-nm) direct photocoagulation for diabetic macular edema. Jpn J Ophthalmol. 59 (1), 21-28 (2015).
- Roider, J., et al. Selective retina therapy (SRT) for clinically significant diabetic macular edema. Graefes Arch Clin Exp Ophthalmol. 248 (9), 1263-1272 (2010).
- Brinkmann, R., et al. Real-time temperature determination during retinal photocoagulation on patients. J Biomed Opt. 17 (6), 061219 (2012).
- Yoshimura, N., et al. Photocoagulated human retinal pigment epithelial cells produce an inhibitor of vascular endothelial cell proliferation. Invest Ophthalmol Vis Sci. 36 (8), 1686-1691 (1995).
- Denton, M. L., et al. Damage Thresholds for Exposure to NIR and Blue Lasers in an In Vitro RPE Cell System. Invest Ophthalmol Vis Sci. 47 (7), 3065-3073 (2006).
- Shrestha, R., Choi, T. Y., Chang, W., Kim, D. A high-precision micropipette sensor for cellular-level real-time thermal characterization. Sensors (Basel). 11 (9), 8826-8835 (2011).
- Gao, F., Ye, Y., Zhang, Y., Yang, J. Water bath hyperthermia reduces stemness of colon cancer cells. Clin Biochem. 46 (16-17), 1747-1750 (2013).
- Jansen, E. D., van Leeuwen, T. G., Motamedi, M., Borst, C., Welch, A. J. Temperature dependence of the absorption coefficient of water for midinfrared laser radiation. Lasers Surg Med. 14 (3), 258-268 (1994).
- Iwami, H., Pruessner, J., Shiraki, K., Brinkmann, R., Miura, Y. Protective effect of a laser-induced sub-lethal temperature rise on RPE cells from oxidative stress. Exp Eye Res. 124, 37-47 (2014).
- Denton, M. L., et al. Spatially correlated microthermography maps threshold temperature in laser-induced damage. J Biomed Optics. 16 (3), (2011).
- Morgan, C. M., Schatz, H. Atrophic creep of the retinal pigment epithelium after focal macular photocoagulation. Ophthalmology. 96 (1), 96-103 (1989).



