Introduction
techniques électrochimiques fournissent une méthode rapide et relativement peu coûteux pour obtenir les propriétés électrochimiques d'un matériau. Ces techniques reposent principalement sur la capacité de détecter la corrosion d'un métal en observant la réaction du processus de transfert de charge à une perturbation électrochimique contrôlée 1-5. La corrosion des implants métalliques dans un environnement de corps est critique en raison des conséquences néfastes sur la biocompatibilité et de matériel d' intégrité 6. Le principal facteur contribuant à la corrosion des implants à l' intérieur du corps est la dissolution de l'oxyde de surface conduisant à une libération accrue d'ions métalliques 7-11. Cela se traduit par des réactions biologiques indésirables, qui peut être trouvé localement, mais avec des effets potentiellement systémique conduisant à une défaillance prématurée de l'implant 10,12-28.
Les caractéristiques de la corrosion d'un échantillon d'essai sont prédites à partir de l'analyse de polarisation produitepar un potentiostat. Une analyse de polarisation permet l'extrapolation des paramètres cinétiques et la corrosion d'un substrat métallique. Lors d'un balayage, l'oxydation ou la réduction d'une espèce électro-active sont limitées par le transfert de charge et le mouvement des corps réactionnels ou des produits. Tous ces facteurs sont encapsulés par le balayage de polarisation; donc l'importance d'avoir un système qui produit une analyse de polarisation fiable et reproductible sur plusieurs cycles est d'une grande importance. L'objectif principal de ce manuscrit est de fournir un protocole d'identifier les raisons et les mesures prises pour obtenir un système de corrosion potentiodynamique fonctionne bien.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. Construction du titulaire échantillon
- Construire le porte-échantillon à partir des entretoises en acier inoxydable et une vis en acier inoxydable M3 filetée, tenue en place avec un écrou hexagonal M3.
- Retirez la tête de la vis filetée avec une pince et polir le segment de coupe pour maintenir le modèle de fil.
- Lorsque tous les composants individuels sont prêts, assembler les porte-électrodes. Chaque porte-électrode contient trois entretoises réunies par les vis M3 résultant en une poignée de 11,5 cm. Placez les écrous hexagonaux à la jonction de la vis et des entretoises pour verrouiller la connexion.
- Solder (60/40% Sn / Pb), une pince crocodile édenté sur la vis à l'extrémité de la tige. Cela permettra d'assurer une prise ferme pour fixer ultérieurement l'électrode lors de l'analyse.
- Une fois que les porte-électrodes sont assemblées, appliquer plusieurs couches de laque d'arrêt-off (mastic électrique) pour empêcher les tiges en acier inoxydable de corroder tout immergé dans la chambre de la corrosion.
- Placez tous les porte-électrodes avec les échantillons fixés à la pince crocodile dans une hotte avant le revêtement. Placez une seringue de 20 ml dans la hotte. Utilisez la seringue pour recueillir la laque d'arrêt-off.
- Allumez la hotte et verser la laque d'arrêt-off dans un petit pot de verre. Tirez 10 ml d'arrêt-off laque dans la seringue et enduire la surface des porte-électrodes. Assurez-vous de ne pas couvrir l'échantillon d'essai, qui va être analysé pour la corrosion.
- Manteau moitié de chaque porte-électrode et place dans la hotte pour sécher avant de revêtir l'autre moitié. Cela vous aidera à obtenir une couche complète bien fermé, sans endommager les zones à revêtir. Veiller à ce que pendant la phase de séchage, les régions fraîchement enduites ne touchent pas d'autres surfaces, car cela va ruiner la couche appliquée.
- Placer les porte-électrodes dans une position élevée pendant le séchage sans contact à toutes les surfaces. Enduire les électrodes rapidement en raison de la solidification rapide de la laque d'arrêt-off.Ceci termine la première couche.
- Une fois sec, répéter le processus pour obtenir 3 couches sur toute la région.
- Avant de commencer la course à la corrosion, laisser les détenteurs sécher pendant 24 heures après la fin de la dernière couche. Tous les procédés de revêtement se produisent à la température ambiante, sans chauffage ou de refroidissement étapes sont nécessaires même si elles peuvent accélérer / ralentir le processus de durcissement.
- Faire une cage de faraday
- Construire une cage de Faraday en revêtant deux récipients en plastique de la même taille avec 4 couches de papier d'aluminium pour couvrir tous les côtés.
- Couper deux petits trous sur le rebord du récipient en matière plastique supérieure pour permettre la connexion de l'électrode au potentiostat et la conduite d'azote dans le réservoir d'azote à traverser. Une conception de scission de la cage de Faraday permet au composant supérieur à retirer à la fin d'une course sans avoir besoin de remplacer la partie inférieure logeant le réservoir.
- Monter le compartiment extérieur (de la chambre de l'eau) dans la cage de Faraday. Leave la seconde moitié sur le côté et placer sur le dessus du compartiment inférieur que lorsque le navire de la corrosion a été scellé (plus tard dans la procédure).
2. Nettoyage de la verrerie
- Nettoyer la cuve à la corrosion (700 ml en flacon cylindrique) avant chaque cycle de corrosion. Frotter le récipient avec un détergent ménager et rincer abondamment à l'eau du robinet. Répétez cette étape 3 fois.
- Rincer la cuve à la corrosion 3 fois avec de l'eau (DI) eau déminéralisée pour éliminer les contaminants potentiels trouvés dans l'eau du robinet.
- Une fois le rinçage avec de l'eau DI est terminée verser 300 ml d'éthanol à 95% dans la cuve de la corrosion et tourbillonner autour de contacter toutes les surfaces internes. Verser l'éthanol et répétez cette étape 3 fois.
- En quittant le navire à la corrosion sous une hotte pendant 30 min pour permettre à tous de l'éthanol pour évaporer complètement.
- Prenez le bateau à la corrosion propre, sec et rincer avec l'électrolyte qui sera utilisé pour la course à la corrosion. Pour each rinçage remplir la cuve de la corrosion avec 200 ml de l'électrolyte et répétez cette procédure 3 fois. Pour cette étude, rincer le récipient à la corrosion avec un tampon phosphate salin (PBS). La composition chimique du PBS (10 L) est utilisé à travers l' électrolyte 80 g de NaCl, 11,5 g de Na 2 HPO 4, 2 g de KCl et 2 g KHPO 4.
- À la suite du rinçage, remplir le récipient de corrosion avec le volume requis de PBS prêt pour la réaction.
3. Mise en place d'appareils
- Serrage d'un dispositif de chauffage avec un système de circulation intégré sur le côté du compartiment extérieur à l'aide d'une pince. La taille du compartiment extérieur doit être d'environ 30 cm x 20 cm x 20 cm et réalisé en verre ou en polymère pour être capable de loger le récipient de corrosion plus faible et le système de chauffage.
- Remplir le compartiment extérieur avec de l'eau du robinet jusqu'à ce que le niveau d'eau est supérieure à la hauteur des électrodes en suspension à l'intérieur du récipient contre la corrosion. Le compartiment inférieurest le navire à la corrosion (décrit précédemment dans la section 2).
- Sceller le récipient de corrosion, avec un couvercle de réaction en verre et la pince pour assurer un joint étanche à l'eau. Le couvercle de la chambre fournit six points pour appareil expérimental et de mesure d'entrée.
- Suspendre un thermomètre, d'un des points du couvercle de réaction d'entrée pour fournir une lecture de la température dans la cellule de corrosion. Suspendre les trois électrodes du couvercle en utilisant les autres points d'entrée 3. Utilisez le polytétrafluoroéthylène (PTFE) pour garantir l'étanchéité de chaque connexion.
- Utilisez une configuration à trois électrodes consistant en une référence, compteur, et l'électrode de travail. L'électrode de travail est la vis en acier inoxydable (spécimen en cours d'analyse). Avant d'insérer l'électrode dans la cuve de la corrosion, essuyez avec un éthanol de 80% trempé essuyez et placer dans un récipient en verre rempli de 100 ml de PBS.
- Utilisez une broche de connexion pour fixer les porte-électrodes sur les bretelles d'électrodes. Monter le electrode des bretelles dans les points du couvercle de la cuve de la corrosion d'entrée.
- Placez l'électrode de travail au centre avec le compteur et l'électrode de référence étant suspendu de chaque côté. Sceller le point d'entrée en verre et les bretelles de corrosion à l'aide de ruban PTFE.
- Pour l'électrode de référence, utiliser une norme Ag / AgCl. Pour la contre-électrode, utiliser un maillage de platine qui a été légèrement pliés à enrouler autour de l'échantillon sous test (électrode de travail).
- Remplir l'électrode Ag / AgCl avec 3 M KCl à l'aide d'une pipette. Après utilisation intensive, le changement et remplir le Ag Ag / Cl. Pour ce faire, la libération de la pointe de l'électrode pour vider le liquide dans un récipient de petite collection de verre (bécher). Une fois que toute la solution est retirée d'insérer la pointe et remplir avec 3 M KCl.
- Utilisez du ruban adhésif sur toutes les jonctions pour assurer toute la chambre est scellée.
- Une fois que la chambre est scellée avec toutes les électrodes placées à l'intérieur du récipient à la corrosion, régler la température à 37 ° C et d'ouvrir l'esprit de la valve d'azoteha débit de 150 cm 3 / min débit. Laissez la température et de l'azote en cours d'exécution pendant 60 min avant d'effectuer une course. Gardez l'azote en cours d'exécution pour la durée de l'expérience.
4. Exécution de l'essai de corrosion
- Ouvrir le progiciel électrochimique, qui établit une interface avec le potentiostat commandé USB.
- Faire les connexions électriques entre le potentiostat et les 3 électrodes, puis tourner le potentiostat sur.
- Ouvrir et utiliser la vue "mesure" pour afficher les lectures actuels et potentiels de l'environnement à la corrosion. Au cours de la phase potentiel de circuit ouvert (OCP), où aucun potentiel de rampe est encore appliqué la lecture en cours entre le travail (potentiel positif) et contre (négatif) électrode est d'environ (0 ± 0,01) uA. L'étanchéité inadéquate de la chambre avec du ruban PTFE peut causer des fluctuations dans la lecture actuelle en raison de la chambre étant aérée avec de l'azote gazeux pour éliminer les molécules d'oxygène.
- Quitter lel'échantillon à l'équilibre et à stabiliser dans l'environnement du récipient à la corrosion. La durée de cette variable (1 à 6 heures) et dépend de la matière. Surveiller le potentiel grâce à la vue de mesure pour déterminer si les conditions stabilisées sont atteintes. Le potentiel sera constant sans fluctuations lorsque les conditions de stabilité sont atteintes.
- Après des conditions stables sont atteintes, commencer la course à la corrosion. Cependant avant que cela puisse se faire, remplissez le "programme de corrosion" et "voltamétrie cyclique (CV)" conditions en utilisant le modèle de squelette fourni par un logiciel d'analyse.
- Sélectionnez la procédure voltammetry potentiostat cyclique dans la vue de configuration à partir de l'onglet de la procédure.
- Activer les paramètres suivants pour être échantillonnés pour la corrosion run: le temps, l'électrode de travail (WE) potentiel, et le courant pour la course à la corrosion.
- Sélectionnez l'option pour automatiser la gamme actuelle. Réglez le courant le plus élevé dans la gamme à être 10 mA, et le courant le plus faible dans la range soit 10 nA pour le WE.
- Veiller à la sélection finale de coupure est commandée par le potentiel en définissant le «retour du cycle 'paramètre à 0,8 mV pour permettre à la boucle d'hystérésis pour terminer.
- Enregistrez l'OCP de la vue de mesure dans la zone de texte de paramètre OCP. Réglez le début potentiel de 100 mV en dessous de la valeur OCP enregistrée. Définir le potentiel de sommet supérieur à 800 mV, le sommet inférieur à 100 mV au-dessous du potentiel de départ et le potentiel d'arrêt à 100 mV au-dessous du potentiel de sommet inférieur. Réglez la vitesse de balayage à 0,001 V / sec et le potentiel de l'étape à 0,0024 V / sec. Maintenant, appuyez sur Start.
5. Après l'achèvement de la corrosion Run
Note: Après l'achèvement de la corrosion exécuter l'analyse de polarisation est montré dans la vue de l'analyse du logiciel. Pour chaque polarisation exécuter le mode Présentateur répertorie l'OCP, la parcelle E vs t et l'escalier CV qui est une parcelle de E en fonction de Log (i).
- Dans chaque parcelle lencre, déterminer la filtration interne des points de données, Tafel extrapolation, et les options de tracé. Développez chaque lien présenté pour montrer différents paramètres d'intérêt, qui forment collectivement les paramètres électrochimiques. L'analyse de polarisation (densité de courant par rapport à un potentiel), détermine le potentiel de circuit ouvert, opposant potentiel (E pit) et le potentiel de protection (E pro).
- Tabulez anodique et constantes Tafel cathodique, le taux de corrosion, le courant de corrosion, la corrosion densité de courant, le potentiel de démarrage, et le potentiel d'extrémité sous le taux de corrosion en utilisant le lien de pente Tafel.
6. Retrait de l'échantillon du porte-électrode
- Préparez 3 petits pots de 50 ml avec du dichlorométhane sous la hotte.
- Prélever des échantillons testés à partir des supports d'électrode en immergeant l'extrémité inférieure du support dans le dichlorométhane pendant 30 min à l'intérieur d'un hottes.
- Une fois détaché, placer l'échantillon dans le prochain pot dedichlorométhane et laisser reposer pendant 15 min. Répétez ce processus avec le troisième et dernier rinçage pour se débarrasser de tout excès de revêtement sur les sections de fixation de l'échantillon.
- Essuyez le mastic restant du clip et de l'échantillon et enfin rincer avec de l'eau déminéralisée.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
A l'issue de la procédure un système in vitro de la corrosion dans l' installation est de mener des études de corrosion. Des procédures spécifiques tels que le nettoyage de la cuve de la corrosion et la cage de Faraday ont été introduits dans le protocole pour améliorer les performances de bruit. Le concept fondamental d'une bonne analyse de polarisation est d'identifier les conditions électro-physiques du matériau fournissant des informations précieuses pour comprendre la sensibilité à la corrosion d'un matériau métallique. La procédure et le protocole est essentiel pour obtenir des résultats fiables et reproductibles. Obtenir des informations sur lesquelles les optimisations peuvent aider certains problèmes qui peuvent survenir lors de l'utilisation, sont identifiés et a ajouté dans la procédure en cours. Le système préexistant non calibré produit un balayage de polarisation (figure 1). Cette analyse montre une collection de points épars, qui ne permettent pas directement la détermination de la cond électro-physiqueitions du matériau en cours d'examen. L'identification de l'OCP était pas pratique et à la corrosion ou repassivation potentiels sont difficiles à lire. Défauts trouvés avec la configuration pré-existante inclus une analyse de polarisation qui n'a pas atteint le potentiel maximal et a été coupée prématurément en raison de niveaux de bruit élevés. Deuxièmement, le balayage au cours de la phase d'enregistrement en direct présentait des oscillations, ce qui peut potentiellement être due à un niveau de bruit élevé d'instabilité ou. Oscillations pendant la course ont été observés à la suite de l'instabilité. Enfin balayages consécutifs ne seraient pas des résultats reproductibles ce qui rend impossible de déterminer les propriétés électro-physiques d'un matériau spécifique.

Figure 1. L'analyse de polarisation d'un échantillon de Nitanol après avoir subi une polarisation potentiostatique électrodynamique. Cette figure montre une parcelle bruyante thà ne fournit pas une interprétation précise des paramètres de corrosion. S'il vous plaît cliquer ici pour voir la version originale de ce chiffre.
L'amélioration de la performance acoustique est présentée dans la (Figure 2). L'analyse montre la direction de la marche avant et arrière balayages et indique le point où le potentiel de protection (E pro) et opposant potentiel (E fosse) sont observées. Le terrain est propre, sans bruit ou de divergence dans l'ensemble de balayage permettant à l'ensemble de la plage à observer proprement. La boucle d'hystérésis est inversée au potentiel établi et retourne à intercepter la courbe anodique, identifiant le potentiel de protection. L'analyse de polarisation et Tafel terrain sont les sorties, qui fournissent les paramètres fondamentaux requis. Ces paramètres sont déterminés à partir de l'analyse de polarisation, donc VHAment un système qui fournit des analyses de haute qualité qui sont reproductibles et fiables est important avant d'identifier les paramètres qui peuvent être extrapolées.

Figure 2. Une analyse de polarisation de l' acier inoxydable 316. Ceci est un tracé clair ressemble à une analyse de polarisation suivant la corrosion où les paramètres d'intérêt peuvent être facilement détectés. S'il vous plaît cliquer ici pour voir la version originale de ce chiffre.
Une étude a été menée pour analyser les changements de la topographie de la surface des vis métalliques suivantes corrosion par piqûres. La valeur moyenne E corr obtenue à partir de l'étude était (-0,414 ± 0,05) V. Le potentiel moyen par piqûres pour les échantillons était (0,49 ± 0,12) V, qui était l' esprithin la région active de la courbe de polarisation. Le potentiel de protection de la moyenne des échantillons était (-0,16 ± 0,02) V. Chaque vis formé des fosses localisées le long de la surface confirmant les résultats des images macroscopiques montrant des changements topographiques détaillées en raison de la formation des fosses et les changements dans les fosses (Figure 3). La quantification de la topographie de la surface du matériau montre que la rugosité du matériau a diminué et la rugosité de surface totale; des vis R a été (159,9 ± 7,3) um (non corrodé) et (124,7 ± 18,3) um (corrodés). R a été significativement plus faible (p = 0,02) pour l'échantillon corrodés par rapport à la non corrodées. La moyenne hauteur maximale R z étant de (469,3 ± 16,5) um (non corrodé) et (683,2 ± 85,8) pm (corrodée) identifie une différence significative (p = 0,04) pour la variation de hauteur entre un échantillon corrodé et non corrodées. La HEIG maximale moyenneht (R t) a été abaissé pour non corrodé à (502,61 ± 51,2) um par rapport aux vis corrodées au (592,23 ± 119,7) um.
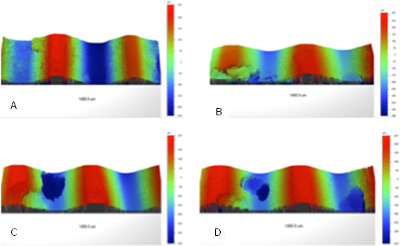
Figure 3. Les images du profilomètre optique qui montrent la corrosion localisée sur une surface filetée. La corrosion a été détectée à la fois dans les vallées et les creux de la surface. L'observation visuelle de la corrosion par piqûres a été réalisée avec succès par la configuration de la corrosion. S'il vous plaît cliquer ici pour voir la version originale de ce chiffre.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Les analyses de polarisation obtenus à partir des échantillons d'acier inoxydable ont montré des parcelles continues propres corrélant avec des scans vus dans la littérature indicative d'un système qui fonctionne bien à la corrosion , qui est à la fois fiable et reproductible 29. Une mauvaise reproductibilité des potentiels de piqûres potentiodynamiques est identifié avec un écart de quelques centaines de millivolts, avec piqûres potentiel étant caractérisé par un processus stochastique 29. Ceci est généralement dû aux variables de température, de teneur en halogénure et un potentiel (V); donc la plus petite variation obtenue dans le E corr de la configuration pratique est indicative du protocole et des ajustements mentionnés ci - dessus ayant amélioré la configuration in vitro.
Une étape critique dans la procédure consistait à établir un environnement stable à l'intérieur du récipient de réaction et de réduire le bruit. Création et suivant les étapes spécifiques pour nettoyer le récipient de réaction avant chaque essai amélioré les résultats et les prdes lectures reproductibles et fiables ovided. Les contaminants contenus dans l'électrolyte peuvent altérer l'environnement de la corrosion et de la réponse du matériau à la corrosion, ce qui provoque des anomalies dans les résultats. Minimiser cela a été trouvé pour être une étape critique dans le protocole. Les procédures de nettoyage en place pour les électrodes et à la corrosion navire éliminer les impuretés potentielles, ce qui aurait pu être un facteur contribuant aux écarts observés précédemment.
Une deuxième étape critique dans la procédure était de fournir un bouclier électro aux porteurs de l'échantillon afin d'éliminer tout contact métallique dans la chambre. L'importance de la protection des supports en métal complètement de toute conductivité électrochimique était d'empêcher l'interférence des métaux externes. Sans isoler l'échantillon métallique à tester de toute autre forme d'espèces métalliques l'analyse de la corrosion ne peut pas fournir des lectures précises de l'éprouvette. Si les titulaires ne sont pas revêtues correctement, ils vont se corroder. Si corrosion est visible sur les composants métalliques qui ne sont pas en cours d'examen les lectures ne peuvent pas être utilisées pour une analyse et un autre terme seraient nécessaires.
Initialement, le balayage au cours de la phase d'enregistrement en direct présentait des oscillations, qui peuvent potentiellement être dues à l'instabilité ou un niveau de bruit élevé. Oscillations pendant la course ont été observés à la suite de l'instabilité. Cela est dû à l'échec de l'potentiostat pour maintenir le contrôle des cellules potentielles 30. Oscillations en raison d'un niveau de bruit élevé peuvent provenir de sources externes, qui nécessitent un degré de filtration. La clé de dépannage est de connecter des condensateurs de disques en céramique entre les électrolytes et la contre-électrode. condensateurs de suppression sont généralement incorporés dans l'alternance des filtres de ligne actuels pour supprimer le bruit de commutation électrique électromagnétique ou interférence de fréquence radio, ainsi que la réduction de ce qui est communément produit par l'équipement électrique / électronique. Quatre grandeurs différentes de capa céramiquecitors ont été utilisés pour analyser leur efficacité de suppression de bruit sur la courbe de polarisation allant de 0,001 à 1 pF. Le condensateur 0,1 uF lissée de manière significative la courbe de polarisation. Tout le bruit a été supprimé; enlever tous les pics trouvés dans les scans originaux. Les résultats expérimentaux indiquent que l'inductance commence à réduire l'efficacité de suppression de bruit du condensateur de 1 pF, sans nuire aux 0,1 uF dans la gamme de fréquences du bruit présent.
La corrosion potentiodynamique fournira un système in vitro de l' essai de corrosion pour des matériaux dans des environnements contrôlés. la capacité de la corrosion d'un matériau peut être évaluée suivant toute forme de manipulation faite à la matière. L'analyse de la corrosion avec la capacité de contrôler différents paramètres fournira l'examen et l'analyse des changements de corrosion dans les matériaux métalliques plus loin. Le protocole proposé a des limitations et des avantages. L'importance de cette rencontrehod par rapport à d' autres méthodes est le coût relativement faible et un processus rapide pour effectuer une analyse 1,4,5 sophistiquée. Le protocole fournira une source fiable de tests de laboratoire à effectuer. Toutefois, une limitation du protocole est le nombre limité d'échantillons parallèles qui peuvent être testés à un moment donné. L'installation fournit un seul échantillon par test, ce qui permettra de prolonger le temps de test pour un grand nombre d'échantillons.
Subscription Required. Please recommend JoVE to your librarian.
Materials
| Name | Company | Catalog Number | Comments |
| Potentiostat | Metrohm | PGSTAT101 | |
| Ag/AgCl reference electrode, shielded | Metrohm | 6.0729.100 | |
| Electrode shaft | Metrohm | 6.1241.060 | |
| Polisher Forcipol 1v | Metkon | 3602 | |
| Clindrical flask 700 ml | SciLabware | FR700F | |
| Reaction lid | SciLabware | MAF2/41 | |
| Dichloromethane | Sigma-Aldrich | MKBR7629V | Use under a fumehood. Wear protective clothing. |
| Thermo / HAAKE D Series Immersion Circulators | Haake |
References
- Isaacs, H. S. Aspects of corrosion from the ECS Publications. J. Electrochem. Soc. 149 (12), 85-87 (2002).
- Fontana, M. G., Greene, N. D. Corrosion Engineering. , 2nd edn, McGraw-Hill, NY, USA. (1978).
- Pourbaix, M. Electrochemical corrosion of metallic biomaterials. Biomaterials. 5 (3), 122-134 (1984).
- Rechnitz, G. A. Controlled-Potential Analysis. , Pergamon Press Inc. New York. (1963).
- Silverman, D. C. Chapter 68. Uhlig's Corrosion Handbook. Revie, R. W. , John Wiley and Sons Inc. (2000).
- Gurappa, I. Characterization of different materials for corrosion resistance under simulated body fluid conditions. Mater Charact. 49 (1), 73-79 (2002).
- Antoniou, J., et al. Metal ion levels in the blood of patients after hip resurfacing: a comparison between twenty-eight and thirty-six-millimeter-head metal-on-metal prostheses. J Bone Joint Surg Am. 90, Suppl 3. 142-148 (2008).
- Billi, F., Campbell, P. Nanotoxicology of metal wear particles in total joint arthroplasty: a review of current concepts. J Appl Biomater Funct Mater. 8 (1), 1-6 (2010).
- Bradberry, S. M., Wilkinson, J. M., Ferner, R. E. Systemic toxicity related to metal hip prostheses. Clin Toxicol (Phila). 52 (8), 837-847 (2014).
- Davda, K., Lali, F. V., Sampson, B., Skinner, J. A., Hart, A. J. An analysis of metal ion levels in the joint fluid of symptomatic patients with metal-on-metal hip replacements. J Bone Joint Surg Br. 93 (6), 738-745 (2011).
- Clarke, M. T., Lee, P. T., Arora, A., Villar, R. N. Levels of metal ions after small and large diameter metal-on-metal hip arthroplasty. J Bone Joint Surg Br. 85 (6), 913-917 (2003).
- Brown, S. A., Hughes, P. J., Merritt, K. In vitro studies of fretting corrosion of orthopaedic materials. J Orthop Res. 6 (4), 572-579 (1988).
- Bryant, M., et al. Characterisation of the surface topography, tomography and chemistry of fretting corrosion product found on retrieved polished femoral stems. J Mech Behav Biomed Mater. 32, 321-334 (2014).
- Jantzen, C., Jørgensen, H. L., Duus, B. R., Sporring, S. L., Lauritzen, J. B. Chromium and cobalt ion concentrations in blood and serum following various types of metal-on-metal hip arthroplasties. A literature review. Acta Orthopaedica. 84 (3), 229-236 (2013).
- Campbell, P., et al. Histological Features of Pseudotumor-like Tissues From Metal-on-Metal Hips. Clin. Orthop. Relat. Res. 468 (9), 2321-2327 (2010).
- Cook, S. D., et al. The in vivo performance of 250 internal fixation devices: a follow-up study. Biomaterials. 8 (3), 177-184 (1987).
- Cooper, H. J., Urban, R. M., Wixson, R. L., Meneghini, R. M., Jacobs, J. J. Adverse local tissue reaction arising from corrosion at the femoral neck-body junction in a dual-taper stem with a cobalt-chromium modular neck. J Bone Joint Surg Am. 95 (10), 865-872 (2013).
- Langton, D. J., Sprowson, A. P., Joyce, T. J., Reed, M., Carluke, I., Partington, P., Nargol, A. V. Blood metal ion concentrations after hip resurfacing arthroplasty. J Bone Joint Surg Br. 91 (10), 1287-1295 (2009).
- Langton, D. J., Jameson, S. S., Joyce, T. J., Webb, J., Nargol, A. V. The effect of component size and orientation on the concentrations of metal ions after resurfacing arthroplasty of the hip. J Bone Joint Surg Br. 90 (9), 1143-1151 (2008).
- Daniel, J., Ziaee, H., Pradhan, C., McMinn, D. J. Six-year results of a prospective study of metal ion levels in young patients with metal-on-metal hip resurfacings. J Bone Joint Surg Br. 91 (2), 176-179 (2009).
- De Haan, R., et al. Correlation between inclination of the acetabular component and metal ion levels in metal-on-metal hip resurfacing replacement. J Bone Joint Surg Br. 90 (10), 1291-1297 (2008).
- Dijkman, M. A., de Vries, I., Mulder-Spijkerboer, H., Meulenbelt, J. Cobalt poisoning due to metal-on-metal hip implants. Ned Tijdschr Geneeskd. 156 (42), A4983 (2012).
- Fisher, J. Bioengineering reasons for the failure of metal-on-metal hip prostheses: an engineer's perspective. J Bone Joint Surg Br. 93 (8), 1001-1004 (2011).
- Goldberg, J. R., et al. A Multicenter Retrieval Study of the Taper Interfaces of Modular Hip Prostheses. Clin. Orthop. Relat. Res. (401), 149-161 (2002).
- Ingham, E., Fisher, J. Biological reactions to wear debris in total joint replacement. Proc Inst Mech Eng H. 214 (1), 21-37 (2000).
- Gilbert, J. L., Buckley, C. A., Jacobs, J. J. In vivo corrosion of modular hip prosthesis components in mixed and similar metal combinations. The effect of crevice, stress, motion and allot coupling. J. Biomed. Mater. Res. Res, J. .B. iomed.M. ater. 76 (1), 1533-1544 (1993).
- Browne, J. A., Bechtold, C. D., Berry, D. J., Hanssen, A. D., Lewallen, D. G. Failed metal-on-metal hip arthroplasties: a spectrum of clinical presentations and operative findings. Clin. Orthop. Relat. Res. 468 (9), 2313-2320 (2010).
- Jantzen, C., Jorgensen, H. L., Duus, B. R., Sporring, S. L., Lauritzen, J. B. Chromium and cobalt ion concentrations in blood and serum following various types of metal-on-metal hip arthroplasties: a literature overview. Acta Orthop. 84 (3), 229-236 (2013).
- Frangini, S., De Cristofaro, N. Analysis of galvanostatic polarisation method for determining reliable pitting potentials on stainless steels in crevice-free conditions. Corros Sci. 45 (12), 2769-2786 (2002).
- Bio-Logic. Potentiostat stability mystery explained. Application Note 4. , Available from: http://www.bio-logic.info/assets/app%20notes/Application%20note%204.pdf 1-7 (2015).



