Introduction
Antistoffer som kan bretting og fungerer i det intracellulære miljø er lovende verktøy for både forskning og terapeutiske anvendelser. De har evnen til å modulere proteinaktivitet ved å binde til en mål-protein i cellene for å forhindre protein-protein interaksjoner, avbryte innvirkningen mellom protein-nukleinsyre-interaksjoner, eller forhindre substrat adgang til enzymer 1-5.
Selv om antistoffene har mye potensial for intracellulære anvendelser, å konstruere dem for riktig folding og oppløselighet i den intracellulære miljøet samtidig som evnen til å binde til en mål-antigen er utfordrende. Den reduserende miljø cytoplasmatiske hindrer dannelsen av disulfidbindingene som normalt kreves for stabil folding av full-lengde antistoffer og antistoff-fragmenter, inkludert enkeltkjedevariabel-fragment (scFv) antistoffer 6,7. En rekke rettet evolusjon tilnærminger har blitt brukt til å konstruere antistoffer med high slektskap for målet antigener 8-10. Disse metodene vanligvis bruker fag display, gjær overflate display, eller bakteriell overflaten skjerm til skjerm store biblioteker av antistoffer 11-13. Disse metodene er kraftige og effektive for å identifisere antistoffer som binder seg til mål, men de er avhengig av sekretoriske vei for å transportere proteiner som skal vises 14-16. Den sekretoriske vei translocates utfoldet proteiner fra redusere cytoplasma inn i det endoplasmatiske retikulum lumen i gjær eller inn periplasmaet i bakterier. Proteinene deretter kaste under oksiderende betingelser og vises på celleoverflaten eller pakket inn i fagpartikler å screene for binding affinitet 17,18. Som et resultat, vil antistoffer som er isolert ved hjelp av disse teknikkene ikke nødvendigvis å brette godt i cytoplasmaet, og intracellulær oppløselighet må ofte være konstruert separat hvis antistoffene vil bli brukt i intracellulære anvendelser.
Å forbedreeffektiviteten av tekniske antistoffer som er godt brettes i cytoplasma, vi tidligere har rapportert suksess for MAD-TRAP (membran-forankret display for Tat-baserte gjenkjennelse til å forbinde seg proteiner), en fremgangsmåte for screening av et scFv-antistoff-bibliotek ved bruk av Escherichia coli Inner- membran skjerm 19. Bakteriell indre membran-skjerm er avhengig av tvilling-arginin trans (TAT) vei for å transportere vist antistoffer, i motsetning til andre vanlig visningsmetoder som bruker den sekretoriske vei. Den Tat veien inneholder en kvalitetskontroll mekanisme som bare tillater løselig, korrekt foldet protein for å bli transportert fra E. coli cytoplasma, tvers over den indre membran, og inn i periplasma 20,21. Overexpressed Tat-substrater (f.eks., Proteiner som er målrettet mot Tat vei med en N-terminal fusjon til Tat signalpeptidet ssTorA) som er godt foldet i cytoplasma danner en langlivet transmellomproduktet med den N-terminale ende in cytoplasma og den C-terminale enden i periplasmaet 19. Dette tillater visning av korrekt foldede Tat underlag, som antistoff-fragmenter, i det periplasmatiske flate av E. coli indre membran. Etter å ha fjernet den ytre membran ved enzymatisk fordøyelse for å generere sferoplaster, blir antistoffer eksponert til det ekstracellulære rommet (figur 1). Dette gjør at Tat substrater som vises på den indre membran som skal siktes for binding til et bestemt mål. Viktigere, utnytte Tat vei for celle-overflate-skjerm sikrer at bare de antistoffer i biblioteket som er godt foldet i cytoplasma vil bli avhørt for binding, slik at samtidig prosjektering av bindende affinitet og intracellulær folding. I denne protokollen beskriver vi hvordan du kan vise en scFv bibliotek på E. coli indre membran, panorere biblioteket mot et målantigen, og utføre en andre screening for å identifisere de mest lovende bestanddelene i biblioteket. Mens vi fokuserer protokollen på scFvs, kan metoden brukes til å konstruere noen protein som applikasjonen krever binding og intracellulær folding.
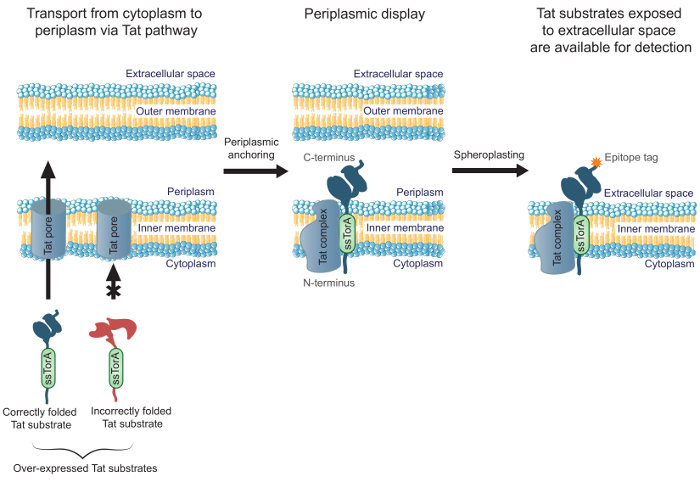
Figur 1. Tat indre membran display. I E. coli, er scFv-antistoff som er uttrykt som en fusjon til den ssTorA signalsekvensen og korrekt foldet i cytoplasma transporteres gjennom den indre membran. En transmellomformer, hvor scFv er forankret i den indre membran med den N-terminale ende i cytoplasma og den C-terminale enden i periplasmaet. E. coli ytre membran blir enzymatisk spaltet under dannelse av sfæroplaster, for derved å eksponere de forankrede antistoffer mot det ekstracellulære rom og gjør dem tilgjengelige for deteksjon ved hjelp av et antistoff som binder til den C-terminalt smeltet epitop tag på den viste antistoff.belastning / 54583 / 54583fig1large.jpg "target =" _ blank "> Klikk her for å se en større versjon av dette tallet.
Protocol
1. Klargjør scFv bibliotek som en fusjon til ssTorA Signal Sequence
- Skaff en deoksyribonukleinsyre (DNA) bibliotek som inneholder varianter av en scFv gen.
MERK: Biblioteket kan også bygges ved hjelp av en passende modus for å generere mangfold over hele scFv gen eller målrettede domener 22 (f.eks, den tredje komplementaritetsbestemmende partier, CDR3s.). - Sett DNA-bibliotek inn i pIMD plasmid (figur 2) ved anvendelse av standard molekylære kloningsmetoder 23.
MERK: Dette plasmidet uttrykker scFv som en genetisk fusjon til den ssTorA signalsekvensen (N-terminal til scFv) og FLAG-epitop tag (C-terminal til scFv). Utformingen av plasmid for indre membran skjerm er blitt beskrevet tidligere 19. Den pIMD plasmid er tilgjengelig fra forfatterne.

Figur 2. Indre membran skjerm plasmid (pIMD) på kart (trinn 1.2 ved 1.3). Dette plasmidet inneholder en lac-promoter, ColE1 replikasjonsorigo, og et kloramfenikol-resistensgen. ScFv gen er kondensert til den ssTorA signalsekvens for å målrette scFv til Tat vei og til en FLAG-epitop tag, med alle tre i den samme leseramme. Restriksjonsenzymseter er indikert. For et bibliotek inn mellom Xbal og Noti- restriksjonsenzymseter, størrelsen på plasmidet er 2219 bp pluss størrelsen scFv. Klikk her for å se en større versjon av dette tallet.
- Transform plasmid DNA inneholder biblioteket i MC4100 E. coli-celler 23. Gjenopprette og vokse denne bakterielle formen for biblioteket. Sentrifuger ved 4000 x g i 15 minutter ved RT for å samle cellene. Fjern supernatanten og resuspender oppsamlede celleri 25% glyserol i Luria-Bertani (LB) media. Oppbevar alikvoter ved -80 ° C inntil nødvendig, eller gå videre til trinn to.
MERK: Protokollen er bekreftet med MC4100 celler, selv om andre E. coli-stammer er også forventet å være kompatibel med protokollen. Elektroporering er den foretrukne fremgangsmåte for transformasjon, på grunn av høy transformasjonseffektivitet. Biblioteket bør vanligvis bestå av minst 10 9 scFv varianter i denne fasen, og hver aliquot bør inneholde nok celler slik at biblioteket er dekket 100-fold.
2. Uttrykk Bibliotek og Forbered sfæroplaster
- Tine en alikvot av bakterie biblioteket (fra trinn 1.3) ved romtemperatur, og tilsett alikvot til en kolbe inneholdende 100 ml LB-medium med 20 pg / ml kloramfenikol (Cm). Vokse i 3 timer ved 37 ° C og 225 rpm i en ryste inkuberes.
- Etter tre timer, fjern kolben fra 37 ° C inkuberes shaker. Tillate ekspresjon av scFv biblioteket tilfortsette O / N for 15 til 22 timer ved 20 ° C og 225 rpm i en ryste inkuberes.
MERK: Ingen induser er nødvendig når du bruker pIMD plasmid, som arrangøren er lekk. Merk at MC4100 cellene ikke overuttrykker Lac repressor (og Laci er ikke funnet på plasmid).

Figur 3. E. coli-celler og sfæroplaster. (A) E. coli-celler har sylindrisk form. (B) Etter spheroplasting ved hjelp av EDTA og lysozym, den ytre membran av E. coli-celler er ødelagt, og de resulterende sfæroplastene er sfæriske i form. Differential interferens kontrast (DIC) mikroskopi bilder ble oppnådd ved hjelp av en 100X objektiv på en invertert mikroskop. Vennligst cslikke her for å se en større versjon av dette tallet.
- Forbered biblioteket sfæroplaster.
MERK: sfæroplaster er dannet ved brudd i ytre membran av E. coli og har sfærisk form (Figur 3).- Forberede de nødvendige buffere.
MERK: Alle buffere bør være sterile.- Fremstille 1 x fosfatbufret saltoppløsning (PBS; pH 7,4) ved å oppløse 8 g NaCl, 0,2 g KCl, 1,44 g Na2 HPO 4, og 0,24 g KH 2PO 4 i destillert H2O til et sluttvolum på 1000 ml. Hold på is.
- Forbered PBS med 0,1% (w / v) bovint serum albumin (BSA) ved å oppløse 0,2 g BSA i 200 ml 1 x PBS. Hold på is.
- Klargjør fraksjoneringsbufferen (FB) ved å blande 7,5 ml sterilfiltrert 1 M sukrose, 1 ml av 1 M Tris-buffer (pH 8,0), og 1,5 ml destillert H2O Hold på is.
- Fremstille 1 mM etylendiamintetraeddiksyre (EDTA) ved tilsetning av 30 ul of 0,5 M EDTA til 14.97 ml destillert H 2 O.
- Fremstille 0,5 M MgCl2 ved å oppløse 4,76 g MgCl2 i 100 ml destillert H2O Hold på is.
- Fjern kolben fra shaker, og måle den optiske tetthet (OD) ved 600 nm ved hjelp av et spektrofotometer for å bestemme den celletetthet. Beregn volum av induserte kultur er nødvendig slik at hver prøve for spheroplasting har 1 x 10 10 celler.
MERK: tilnærmelse til en OD 600 på en indikerer en konsentrasjon på 10 9 celler / ml for E. coli kan brukes 24. - Sentrifuger det beregnede volumet av indusert kultur i et 1,5 ml mikrosentrifugerør ved 12.000 x g ved romtemperatur i 5 min. Forbered minst to prøver i tilfelle et problem oppstår i prøveopparbeidelse.
- Fjern supernatanten fra de sentrifugerte kulturene og resuspender hver cellepelleten i 100 ul iskald FB. Sentrifuger ved 12000 xg ved RT i 1 min, og deretter fjerne supernatanten ved pipettering. Resuspender hver pellet i 350 ul iskald FB supplert med 3,5 ul av 10 mg / ml lysozym.
- Sakte vortex hvert rør, og tilfører dråpevis 700 ul 1 mM EDTA, og deretter inkuberes rørene ved RT i 20 minutter under langsom rotasjon på et rør rotator for å blande prøvene. Fjerne rørene fra rotatoren, tilsett 50 pl iskald 0,5 M MgCl2 til hvert rør, og inkuber dem på is i 10 min. Sentrifuger rørene ved 11000 x g ved 4 ° C i 10 min.
- Isoler spheroplast pellet.
- Bruk en mikropipette med en 1 ml tips til å trekke opp en del av pellet. Ved å holde røret i en vinkel med åpningen direkte over et nytt 1,5 ml rør, sakte løfte pipettespissen ut av supernatanten og skyv pellet inn i det nye røret.
- Hvis en vesentlig volum av supernatanten blir overført til nye rør, fjerne den ved pipettering. Hvis pellet er ikke fast enough å overføre, re-sentrifuger ved 11 000 x g i 2 minutter og forsøk pellet isolasjon igjen.
- Resuspender pellet sfæroplast i hvert rør i 1 ml iskald 1 x PBS. Veksle mellom pipettering og sakte virvling på en vortex holderen til pellets er helt resuspendert. Ikke holde prøvene ut av isen i mer enn to minutter om gangen, og gå tilbake til is i minst 5 minutter før du tar ut fra isen igjen. Hold sfæroplastene ved 4 ° C (i opptil to dager) inntil brukt for panorering i trinn 4.
- Forberede de nødvendige buffere.
3. Immobilize målantigenet på magnetiske kuler
- Biotinylere mål-antigen in vivo i løpet av rekombinant produksjon i E. coli-celler. Alternativt kan du bruke kjemisk konjugering 25 eller kjøp target antigen som allerede er biotinylert, og gå videre til trinn 3.2.
- Legg 816 g bicin til 50 ml vann for å gi 10 x bicin buffer. Fortynne buffer til 1 x i destillert H2O og oppvarm til 50 ° C. Legg 14,7 mg biotin til 12 ml av den oppvarmede 1 x bicin buffer for å lage en biotin løsning som er 5 mM biotin i 10 mM Bicine-buffer. Oppbevar ved -20 ° C inntil nødvendig.
- Uttrykk og biotinylere målet protein ved hjelp av pAK400cb-BCCP plasmid 26, som tillater produksjon av målet antigen som en fusjon til biotin karboksyl bærerproteinet (BCCP).
MERK: E. coli-celler opprinnelig biotinylerte BCCP, eliminerer behovet for å rense og kjemisk biotinylere målproteinet før immobilisering på streptavidin-belagte kuler. De innfødte E. coli biotin ligase Bira er tilstrekkelig for biotinylating fusjonsproteinet.- Grow E. coli inneholdende det biotinylering plasmidet (med target-antigenet er satt inn som en fusjon til den N-terminale ende av BCCP) O / N i 15 til 18 timer i 5 ml LB-medium supplert med 20 ug / ml cm ved 37 ° C under risting ved 225 rpm.
- Måle OD ved 600 nm ved anvendelse av et spektrofotometer, og beregne volumet av kulturen nødvendig (V add) for å subkultur på en utgangs OD på 0,05 i 25 ml frisk LB-medium med 20 pg / ml Cm under anvendelse av ligningen: V legge = (0,05 x 25 ml) / (OD-600 til 0,05), hvor OD 600 er den optiske tetthet av O / N kultur og V legg er volumet av O / N kultur for å legge til den ferske LB. Subkultur og vokse til en OD på 0,5 til 0,8 et inkuberes ristemaskin ved 37 ° C og 225 rpm.
- Legg isopropyl β-D-1-tiogalaktopyranosid til en sluttkonsentrasjon på 100 uM og biotin til en endelig konsentrasjon på 5 uM. Indusere ekspresjon i et inkuberes ryster i 15 til 22 timer ved 20 ° C og 225 rpm.
- Høste bakteriene ved sentrifugering ved 4000 x g ved 4 ° C i 10 min. Fjern supernatanten. Oppbevar pellet ved -20 ° C inntil de er klare for bruk.
- Legg til1 ml av en cellelyse vaskemiddel pr 0,2 g av cellepelleten. Resuspender ved pipettering og forsiktig rotere i 20 minutter for å lysere cellene. Etter at lysering, sentrifuger ved 16 000 x g og 4 ° C i 20 min. Pipetter oppløselige lysat (supernatant) inn i et nytt 1,5 ml rør.
- Bruke en kolonne 3 kDa molekylvektsperre for å fjerne ikke-bundet biotin. Pipetter lysat inn i kolonnen, og sentrifuger ved 20 ° C i henhold til produsentens instruksjoner. Vask med 1 x PBS til biotin i lysatet ble fortynnet 100 ganger og volumet av den vaskede lysat er lik det opprinnelige volum av løsningen. Overfør lysatet til et nytt rør.
- Immobilisere det biotinylerte målantigen på streptavidin-belagte magnetiske kuler.
- Fremstille 1 x PBS og 1 x PBS med 0,1% (w / v) BSA som beskrevet i trinn 2.3.1.
- Forbered magnetiske kuler.
MERK: Dette krever bruk av en magnetisk separasjonsstativ.- resuspender streptavidin-belagte magnetiske kuler i originalbeholderen. Enten vortex i minst 30 sek eller roter i 5 min.
- Overfør 7-10 x 10 9 perler til et 1,5 ml rør.
MERK: Volum som kreves vil være avhengig av perlekonsentrasjonen levert av produsenten. - Plasser røret som inneholder kulene på magneten stativet i 2 min for å samle perlene på siden av røret. Med røret fremdeles på magneten, fjern forsiktig supernatanten ved å pipettere uten å forstyrre perlene.
- Å vaske, fjerne røret fra magneten, og resuspender kulene i 1 ml av 1 x PBS ved pipettering uten å generere bobler. Returnere røret til magneten i 2 min for å samle perlene, og fjern supernatanten forsiktig ved pipettering. Gjenta prosessen to ganger til for totalt tre vaskinger. Pass på at ingen væske som er igjen i røret etter siste vask.
- Tilsett lysat inneholdende den biotinylerte antigen til den magnetiske beads.
- Fjerne røret fra magneten og resuspender kulene i 1 ml lysat (fra trinn 3.1.5). Inkuber ved RT i 30 minutter under forsiktig rotasjon.
- Plasser røret på magneten i 3 minutter for å samle antigen-belagte kuler. Vask belagte perler fem ganger med 1 x PBS med 0,1% BSA på samme måte som beskrevet i trinn 3.2.2.3 til 3.2.2.4. Etter den siste vask, resuspendere kulene i 1 x PBS med 0,1% BSA opp til det samme volum anvendes i trinn 3.2.2.2.
- Dersom det immobiliserte mål-antigenet er stabilt ved 4 ° C, lagre de belagte perlene ved 4 ° C inntil det er behov for panning. Ellers, fortsett til trinn 4.
4. Skjermen scFv biblioteket ved å panorere mot Target Antigen (figur 4)

Figur 4. panorering (trinn 4). Antigen-belagte magnetiske kuler are inkuberes med sfaeroplaster uttrykker antistoffbibliotek varianter. Plasmid DNA fra kule-bundet sfæroplaster gjenvinnes og brukes til å generere en sublibrary, som er skjermet ved hjelp av ELISA-baserte sekundær skjerm. Tilsvarende protokoll trinnene er notert. Klikk her for å se en større versjon av dette tallet.
- Inkuber belagt perler med sfæroplaster.
- Bruke en sfæroplast å perle forhold på omtrent 5: 1. Tilsett 4 x 10 9 sfæroplaster og 8 x 10 8 perler til et sterilt 15 ml rør.
MERK: Anta at ingen celler ble tapt under spheroplasting prosessen, slik at konsentrasjonen er fortsatt 1 x 10 10 sfæroplaster / ml. - Tilsett 1 x PBS med 0,1% BSA for å bringe det totale volum til 4 ml. Delmengde i fire 1,5 ml rør med 1 ml hver. Inkuber reaksjonene ved 4 ° C i 5 timer under forsiktig rotasjon.
- Bruke en sfæroplast å perle forhold på omtrent 5: 1. Tilsett 4 x 10 9 sfæroplaster og 8 x 10 8 perler til et sterilt 15 ml rør.
- prepare listbundne sfæroplaster for polymerase-kjedereaksjon (PCR).
- Plasser panorering reaksjonsrørene på magnet for 3 min. Fjern supernatanten ved pipettering, og vaske kule-bundet sfæroplaster fire ganger med iskald 1 x PBS med 0,1% BSA på samme måte som beskrevet i trinn 3.2.2.3 til 3.2.2.4. Resuspender kule-bundet sfæroplaster i hvert rør i 25 mL av destillert H2O Oppbevar perlene ved -20 ° C eller gå videre til trinn 4.3.
- Utføre hel-plasmid PCR på kule-bundet sfæroplaster til å forsterke plasmider inneholdende gener for perle-bundne scFv.
- Skaff primere med følgende sekvenser: 5'CCAACTCTTTTTCCGAAGGTAACTG3 '(forover primer) og 5'TAGCTCTTGATCCGGCAAACAAA3' (revers primer).
MERK: Disse vil binde ende-til-ende på motsatte tråder av pIMD plasmid (figur 2) og er designet for å binde til et felles trekk ved pIMD, slik forsterkning vil skje uavhengig avscFv variant sekvens. - Fosforylere primerne.
MERK: Uten fosforylering, re-ligation vil ikke forekomme. Primere kan også bestilles med 5'-fosforylering, istedenfor å bruke dette fosforylering metoden i denne protokollen.- I et 0,5 ml rør, sette opp en fosforyleringsreaksjon for forover PCR-primer som er beskrevet i tabell 1. Gjenta denne fremgangsmåten for den reverse primer.
- Inkuber reaksjonene ved 37 ° C i 1 time. Deretter inkubere dem ved 65 ° C i 20 minutter for å deaktivere T4 polynukleotidkinase (PNK). Oppbevar fosforylerte primere ved -20 ° C.
- Utfør PCR.
- I en PCR-rør, fremstille PCR-reaksjonen som beskrevet i tabell 2.
MERK: Flere reaksjoner kan være forberedt på høyere yield. De ubrukte kule-bundet sfæroplastene kan oppbevares ved -20 ° C. - Varm PCR-reaksjonene ved 98 ° C i 15 minutter i en termosykler for å sikre fullstendig lysis av sfæroplaster. Fjern rørene fra termosykleren, og tilsett 0,5 mL av en high fidelity polymerase til hver. Returner rør til thermal cycler og kjøres ved hjelp av programmet som er beskrevet i tabell 3.
- Pool PCR-produktene etter behov. Oppbevar ved -20 ° C eller gå videre til trinn 4.4.
- I en PCR-rør, fremstille PCR-reaksjonen som beskrevet i tabell 2.
- Skaff primere med følgende sekvenser: 5'CCAACTCTTTTTCCGAAGGTAACTG3 '(forover primer) og 5'TAGCTCTTGATCCGGCAAACAAA3' (revers primer).
Tabell 1. PNK fosforyleringsreaksjon (trinn 4.3.2.1).
| reagens | Volum (mL) |
| Destillert H 2 O | 15 |
| 10 x T4 DNA-ligase reaksjonsbuffer | 2 |
| 100 mikrometer primer | 2 |
| T4 polynukleotidkinase (PNK) | 1 |
| reagens | Volum (mL) |
| Destillert H 2 O | 28.5 |
| 5x High-fidelity polymerase buffer | 10 |
| 10 mikrometer Fosforylert fremover primer | 2,5 |
| 10 mikrometer Fosforylert revers primer | 2,5 |
| 40 mM dNTP mix (10 mM av hver dNTP) | 1 |
| Perle-bundet sfæroplaster | 5 |
Tabell 3. PCR-programmet (trinn 4.3.3.2).
| Skritt | Temperatur (° C) | Tid (min: sek) | Antall sykluser |
| initial denaturering | 98 | 00:30 | 1 |
| denaturering | 98 | 00:10 | 35 |
| gløding | 69 | 00:30 | |
| Extension | 72 | 00:30 per kb | |
| endelig ekstensjon | 72 | 06:00 | 1 |
| Holde | 12 | Infinite | 1 |
- Re-sirkulær hele-plasmid PCR-produkter, og bruke ligert produkt å transformere MC4100 E. coli-celler.
- Rens PCR-produktet ved å kjøre PCR-reaksjonen på en agarosegel 23, farging av DNA i gelen 23, og ved hjelp av engel opprydding kit å rense lineariserte plasmid ved å følge instruksjonene gitt av produsenten. Måle konsentrasjonen ved hjelp av et spektrofotometer ved 260 nm. Oppbevar renset fragment ved -20 ° C inntil nødvendig, eller fortsette til trinn 4.4.2.
- Re-sirkulær plasmid fra PCR-produktet.
- For å forhindre intermolekylær ligering av PCR-produktet, utføre ligeringsreaksjonen med en lav konsentrasjon av en 27 ng / ul av PCR-produktet. Beregne volumet som er nødvendig for å fremstille en 800 pl ligeringsreaksjonen ved denne konsentrasjonen.
- Klargjør ringsreaksjonen på is. I et rør, tilsett volum beregnet i trinn 4.4.2.1 av PCR-produktet, 80 pl 10 x DNA-ligase-buffer og destillert H2O opp til 800 pl. Tilsett 4 pl av T4 DNA-ligase, og umiddelbart plassere rørene ved 16 ° C i et vannbad eller termosykler. Inkuber ved 16 ° CO / N for 14 til 18 timer. Oppbevar de ferdig ligation reaksjoner ved -20 ° Cinntil nødvendig, eller gå videre til trinn 4.4.3.
- Plasser ligeringsreaksjonen på en varmeblokk ved 65 ° C i 15 minutter for å varme-inaktivere DNA-ligase. Deretter bruker en mikrodialysemembran eller DNA opprydding kit til de-salt ligert DNA. Oppbevar ved 20 ° C eller gå videre til trinn 4.4.4.
- Bruk hele varme inaktivert, de-saltet ligation produktet til å transformere MC4100 E. coli-celler 23. Forbered glyserol aksjer, som beskrevet i trinn 1.3, av cellene som inneholder den resulterende panned sublibrary, og lagre aliquoter ved -80 ° C.
- Gjenta trinn 4 i sin helhet ved hjelp av en delmengde fra trinn 4.4.4 til å gjøre en andre panorering på sublibrary.
MERK: En andre panorering hjelper berike for bibliotek bestanddeler som binder godt til målet antigen 19.
5. Utfør en sekundær skjerm Bruke en Enzyme-linked immunosorbent assay Metode for å identifisere lovende Clones for ytterligere karakterisering (figur 5) </ P>

Figur 5. ELISA-baserte sekundær screening (trinn 5). (A) Bibliotek varianter fra sublibrary anriket under panorerings inokuleres i individuelle brønner i en kulturplate for vekst og ekspresjon. (B) En ELISA-plate ble belagt med målantigenet. (C) Biblioteket variantene blir screenet ved hjelp av ELISA-baserte sekundær skjerm som er beskrevet i protokollen. Ved analyse av data som oppnås fra den sekundære skjermen, er varianter av interesse valgt og karakterisert nærmere. Tilsvarende protokoll trinnene er notert. Klikk her for å se en større versjon av dette tallet.
- Tine en tube av den panned sublibrary (fra trinn 4.4.4) og plate på LB-agar-plater. Plate flere fortynningerved konsentrasjoner lave nok til å sikre individuelle kolonier (eksempel 10 2 - 10 6-doble fortynninger). Platene inkuberes i 15 til 18 timer ved 37 ° C. Oppbevar platene ved 4 ° C eller gå videre til trinn 5.2.
- Kultur og induserer kolonier fra panorert sublibrary. Utfør alle trinnene under sterile forhold. Bruk en multikanalpipette for trinn som involverer 96-brønners plater.
- Tilsett 200 pl LB med 20 ug / ml Cm inn i hver brønn av en rundbunnet 96-brønns kulturplate.
- Plukk en individuell koloni fra agar-plate med en pipettespiss, plasserer spissen i den første brønn i 96-brønns plate, og rør forsiktig å inokulere. Bruk en ny spiss for hver brønn. Inokuler en koloni i hver brønn. Som en kontroll, omfatte minst ett sterilitet kontroll godt med ingen koloni inokuleres.
- Gjenta trinn 5.2.1 og 5.2.2 for å vaksinere flere 96-brønners plater.
- Plasser 96-brønners plater på et mikroplaterister ved 310 omdreininger pr. Inkuber ved 376 C i 20 til 24 timer for å uttrykke scFv.
- For hver kulturplate fremstilt i trinn 5.2, belegge en 96-brønns ELISA-plate med målantigenet.
- Fortynn renset mål-antigen til en passende konsentrasjon (f.eks, 1 ug / ml til 4 ug / ml) i 1 x PBS for å gjøre beleggoppløsningen. Lage 5 ml beleggsløsning for hver 96-brønns plate.
MERK: Den passende konsentrasjon er avhengig av det spesifikke antigenet som blir brukt, og kan måtte justeres. - Tilsett 50 pl av den beleggende oppløsning til hver brønn av en 96-brønners høy-bindende klar polystyren ELISA-plate. Forsiktig på platen på stasjonære maskiner overflaten for å sikre at hele overflaten av hver brønn er belagt. Gjenta for hver plate. Inkuber platene ved 4 ° CO / N.
- Fortynn renset mål-antigen til en passende konsentrasjon (f.eks, 1 ug / ml til 4 ug / ml) i 1 x PBS for å gjøre beleggoppløsningen. Lage 5 ml beleggsløsning for hver 96-brønns plate.
- Replikere kolonier fra 96-brønners kulturskåler på agar-plater.
- Plasser en steril polystyren replikator inn i brønnene i en kulturplate for å samle inn en liten mengde av væskerid. heve portreplikator nøye og overføre til en 15 cm LB agar plate slik at alle tips er å berøre platen. Når væsken har overført, løfter portreplikator rett opp. Gjenta for hver kultur plate.
- Label agar plate med riktig orientering, slik at resultatene fra den sekundære skjermen i 96-brønns plate kan bli matchet med riktig replikert koloni på platen, hvis ytterligere karakterisering er ønsket. Vokse ved 37 ° C i 15 og 18 timer, og deretter lagres ved 4 ° C inntil behov.
- Utfør ELISA sekundære skjermen.
- Fremstille den blokkerende oppløsning ved å gjøre 2% (w / v) tørrmelk i 1 x PBS. Tømming av beleggsløsningen fra ELISA-platene. Tilsett 100 ul blokkeringsløsning til hver brønn. Inkuber ved romtemperatur i minst to timer, eller blokkere O / N ved 4 ° C.
- Tilberede vaskebufferen ved tilsetning av polysorbat 20 til en sluttkonsentrasjon på 0,05% i 1 x PBS. Gjør 250 ml per ELISA-plate.
- Tilsett 20 ul av enkonsentrerte cellelyse vaskemiddel til hver brønn på rundbunnet kulturplate, og inkuber dyrkingsplaten på en mikroplaterister ved romtemperatur i 15 til 20 min. Begynn lysis samtidig som blokkering av ELISA-plater er fullført, slik at den lysering og vaske trinn 5.5.4 kan utføres samtidig.
- Tøm blokkeringsløsning fra ELISA-platene. Vask de blokkerte ELISA-platene fire ganger med 200 ul vaskebuffer per brønn per vask. Tøm vaskebuffer fra brønnene.
- Overføre 50 ul fra hver brønn med cellelysering platen til den tilsvarende brønn i ELISA-platen, ved anvendelse av en ny spiss for hver brønn. Inkuber ELISA-platen ved RT i 1 til 2 timer.
- Klargjør antistoff løsning å oppdage innbundne scFvs.
- Bruke et pepperrot peroksidase (HRP) -konjugert primært antistoff som binder seg til FLAG-epitop tag smeltet til biblioteket scFv.
- Fortynn antistoffet til den passende fortynning til bruk i en ELISA (se leverandør & #39; s anbefalinger) i 2% (vekt / volum) tørrmelk i 0,05% polysorbat 20 i 1 x PBS. Forbered 5 ml for hver plate.
- Vask ELISA-platene fire ganger med vaskebuffer som beskrevet i trinn 5.5.4.
- Tilsett 50 pl av antistoffløsningen til hver brønn av ELISA-platen. Inkuber i 1 til 2 timer ved RT.
- Forbered HRP underlaget ved oppløsning av o-fenylendiamin (OPD) tabletter i destillert H 2 O per produsentens protokoll samtidig unngå lys. Forbered 20 ml per ELISA-plate.
- Fremstille 3 MH 2 SO 4 ved å fortynne konsentrert H SO 2 4 med destillert H2O etter behov. Forbered 5 ml pr ELISA-plate.
Forsiktig: H 2 SO 4 er en sterk syre. Sørg for å bruke egnet personlig verneutstyr. - Vask ELISA-platene fire ganger med vaskebuffer som beskrevet i trinn 5.5.4.
- Inkuber ELISA-plater med HRP-substrate.
- Tilsett 200 ul av HRP-substrat til hver brønn. For å minimere lyseksponering, legger underlaget til en ELISA-plate av gangen, og pakk med aluminiumsfolie før du går videre til neste plate. Inkuber platene i 30 til 60 minutter ved romtemperatur i mørke.
- Etter de første 30 min, sjekk platene for mørkere av substratet, og inkuber lenger om nødvendig for å visualisere utviklingen av farge.
- Tilsett 50 pl av 3 MH 2 SO 4 til hver brønn for å stanse reaksjonen. Ved hjelp av en annen spiss for hver brønn, bland løsningen i brønnene ved forsiktig pipettering opp og ned uten skumming. For konsistens og for å forhindre metning, tilsett H 2 SO 4 raskt og omhyggelig til alle de ELISA-plater før blanding av oppløsningen for hver plate.
- Mål absorbansen av løsningen i brønnene av hver plate ved 492 nm ved anvendelse av en plateleser.
- Analyser absorbans data for å identifisere scFv varianter som exhibdet lovende bindende signaler og karakterisere disse lovende scFvs. Velge scFv som oppviser absorbans signaler som er høyere enn bakgrunnssignalet og som er høyere enn det gjennomsnittlige signal på hver plate.
MERK: Absorbansen nivå vil være avhengig av egenskapene til antigenet og anti-FLAG-antistoff som benyttes, sammen med styrken av scFv-variantene som ble isolert i screening.
Representative Results
Det intracellulære proteinfolding kvalitetskontroll mekanismen for Tat bane i E. coli begrenser transport over den indre cellemembran til proteiner som er godt brettes i reduksjons cytoplasmisk miljø. Ved å overuttrykke en fusjon av et scFv til ssTorA signalsekvensen (signalsekvensen fra Tora protein, som naturlig transporteres av Tat sti 20), blir trans stoppet opp, noe som resulterer i fremvisning av scFv på den indre membran 19. Etter enzymatisk forstyrrelse av den ytre membran, er de viste antistoffer som er gjort tilgjengelig for screening for antigen-bindende aktivitet. Evnen til å dra nytte av Tat veien for scFv visning ble vist ved Karlsson et al., 19 (figur 6). ScFv antistoffer scFv13 og scFv13.R4 ble smeltet til enten innfødte ssTorA sekvens eller en modifisert ssTorA som mangler arginin-arginin rester par gjenkjent avTat veien. scFv13.R4 ble utviklet av Martineau et al. fra scFv13 gjennom fire runder med rettet evolusjon og er kjent for å kaste seg godt i cytoplasma 9. Denne scFv ble vist på den indre membran, men bare når den uttrykkes som en fusjon med det native ssTorA signalsekvens (figur 6). Derimot har det scFv13 ikke godt foldet cytoplasmisk 9, slik det vises ikke godt på den indre membran, uavhengig av signalsekvensen til hvilken den er kondensert. I tillegg, hvis det scFv ble uttrykt i celler som manglet den TatC protein, en viktig del av Tat maskineri 20,28, display ble ikke observert, og viser den viktige koblingen mellom indre membran-skjerm og Tat pathway. Disse resultater viser at bare proteiner som inneholder den Tat-signalpeptidet og som er korrekt foldet i cytoplasma er vist på den indre membran, slik at transport gjennom Tat vei til å virke som en skjerm for intracellulær folding.

Figur 6. Påvisning av scFv som vises på den indre membran. Strømningscytometri-analyse ble utført for å påvise visning av dårlig foldet scFv13 og godt foldet scFv13.R4 på den indre membran. scFv ble kondensert til opprinnelig ssTorA eller ssTorA (KK), hvor det Arg-Arg-par i ssTorA sekvensen ble modifisert til Lys-Lys. C-terminal FLAG epitop koder på de scFvs ble oppdaget med en fluorescein (FITC) konjugert anti-FLAG antistoff. Celler uten TatC protein (ΔtatC) og ssTorA-scFv13 uten FLAG tag ble testet som kontroller. M viser median fluorescens verdi. Gjengitt fra referanse 19 med tillatelse. Klikk her for å se en større versjon av dette tallet.
19. For å demonstrere dette, en feilutsatt PCR-bibliotek basert på scFv13, som har et lavt nivå av bindingsaffinitet for β-galaktosidase, ble panned mot målantigenet β-galaktosidase ved hjelp av displayet og panorering metoden beskrevet i protokollen. scFv 1-4 ble isolert etter en runde med mutagenese og panorering, og oppviste høyere bindingsaffinitet til p-galaktosidase enn scFv13 (figur 7A) og et høyere nivå av cytoplasmiske oppløselighet (figur 7B).
Et nytt bibliotek, basert på scFv 1-4, ble gjort ved hjelp utsatt for feil PCR, og panorering av andregenerasjons bibliotek motβ-galaktosidase ble utført ved anvendelse av en modifikasjon av den beskrevne protokoll. Panorering mot β-galaktosidase for den andre runde av utviklingen ble utført i nærvær av renset, oppløselig scFv 14 som en konkurrent for å øke sannsynligheten for å isolere kloner med høyere affinitet enn scFv 1-4. Etter denne andre runden av mutagenese og panorering, ble scFv 2-1 og scFv 2-3 isolert ved hjelp av ELISA-baserte sekundærscreening. Disse scFvs ikke bare utstilt høyere bindende affinitet for β-galaktosidase enn scFv13, men også utstilt bedre binding enn første runde klone scFv 1-4. scFv 2-1 oppviste β-galaktosidase binding sammenlignbar med den til scFv13.R4 (figur 7A). scFv 2-3 viser også en ytterligere økning i cytoplasma løselighet i forhold til scFv 14, fremhever samtidig prosjektering av løselighet og antigen-binding. Siden affinitet og løselig ekspresjon av scFv blir screenet for samtidig, er det mulig at en valgt scFv har modrere løselighet men høy binding eller vice versa. For eksempel, har scFv 2-1 lavere oppløselige uttrykk enn scFv 2-3, men det viser høyere bindingsaffinitet til p-galaktosidase.

Figur 7. målbindende og cytoplasmisk ekspresjon av scFv varianter isoleres ved anvendelse av indre membran-display. (A) scFv ble uttrykt i cytoplasma av E. coli-celler (f.eks., uten ssTorA signalsekvensen) med en hexahistidine (6 × -Hans) tag og renset ved hjelp av nikkel-nitrilotrieddiksyre spin-kolonner. Bindingen av de rensede scFv p-galaktosidase ble målt med en ELISA. Rensede scFv ble fylt på β-galaktosidase-belagte ELISA-plater, og de bundne scFv ble påvist med et anti-6 x -Hans antistoff. Dataene er et gjennomsnitt av seks replikater, og feilen linjen viser standard feil av gjennomsnittet.(B) De oppløselige og uoppløselige fraksjoner av cellelysatene fra celler som uttrykker scFv cytoplasmisk ble analysert ved en Western blot probet med et anti-6 x -Hans antistoff. Total proteinkonsentrasjon ble brukt til å normalisere lasting av prøvene. Gjengitt (A) og tilpasset (B) fra referanse 19 med tillatelse. Klikk her for å se en større versjon av dette tallet.
Discussion
Ingeniør antistoffer til cytoplasmisk aktivitet er en vanskelig oppgave på grunn av den reduserende miljø i cytoplasma, noe som hindrer dannelsen av stabiliserende disulfidbindinger 6,7. Dette forårsaker de fleste antistoffer til cytoplasmisk være inaktiv med mindre de er konstruert for stabilitet og oppløselighet i cytoplasma, i tillegg til å være konstruert for bindingsaffinitet. De eksisterende metoder for fag-display, bakteriell overflate display, og gjær overflatevisningsmetoder alle bruke den sekretoriske vei 14-16 for visning av konstruerte antistoffer, men disse fremgangsmåter har ingen midler for å ingeniør intracellulær folding. Antistoffer konstruert ved hjelp av indre-membran skjerm har forbedret cytoplasmisk stabilitet og oppløselighet fordi brette kvalitetskontroll av Tat vei hindrer translokasjon av antistoffer som er dårlig brettes og ustabile i cytoplasma. Denne metoden forenkler iterativ prosess med prosjektering intracellulære antistoffer for affinitet ennd oppløselighet, som de to eiendommene er konstruert i ett trinn. Selv om denne metoden er designet for å konstruere antistoffer med oppløselighet i reduksjons intracellulære miljø, kan det også anvendes på tekniske antistoffer til å fungere på ikke-reduserende betingelser, ettersom proteinene utviklet ved hjelp av denne metode opprettholde sin folding i det oksiderende miljøet i periplasmaet.
Selv om denne teknikken forenkler prosessen med å konstruere antistoffer med høy affinitet og høy cytoplasmatiske oppløselighet, flere begrensninger er viktig å vurdere når du bruker denne protokollen. Når du analyserer de sekundære skjermen ELISA-signaler for å identifisere lovende scFv varianter, er terskelen for kresne mellom potensielt interessante varianter og de som kanskje ikke utviser tilstrekkelig antigen-binding sannsynligvis ikke klart før etter flere kloner er blitt ytterligere karakterisert. Det er viktig å lete etter bedret binding i løpet av stam-antistoffet; derimot,et unormalt høyt signal kunne være en indikasjon på aviditet 29 eller aggregering effekter 30, en utfordring som ikke er unik for den indre membran-skjerm screening tilnærming. En viktig begrensning for å huske når du bruker denne protokollen er manglende evne til å gjenopprette sferoplaster etter panorering, som de er ukurant (upubliserte data). Dette nødvendiggjør DNA-amplifiseringen og transformasjon fremgangsmåte for å gjenopprette de antistoff-kodende plasmider.
Flere kritiske trinnene i protokollen muliggjør samtidig prosjektering av folding og binding av antistoffer. For screening for å være vellykket, må scFv-biblioteket blir screenet uttrykkes som en fusjon til den ssTorA signalpeptidet. Uten denne sekvensen, blir antistoffene ikke rettes til Tat reaksjonsveien og vil således ikke bli translokert til periplasmaet 19. I tillegg er det viktig at en C-terminal epitop tag er kondensert til antistoffene for å tillate påvisning av de viste antistoffer i hyllending analyser. Det er klart at E. coli stamme som brukes til å uttrykke scFvs må også ha den nødvendige Tat vei maskiner, men dette er sant av den brukte E. coli-stammer.
Endringer i denne protokollen er mulig å forbedre sitt potensial for å isolere antistoffer med de ønskede egenskaper. En subtraktiv panorering skritt kan være ferdig før panorering mot målet antigen å utarme scFv bibliotek av ikke-ønskede bestanddeler. Biblioteket sfæroplastene kan inkuberes med magnetiske kuler belagt med BCCP alene eller belagt med en ikke-ønsket protein, og sfæroplastene som binder til disse perler kan kastes før screening av de gjenværende ubundne sfæroplaster for binding til det ønskede mål. Som nevnt i de representative resultater, til en metode for å forbedre affiniteten av en isolert scFv er å inkludere et oppløselig konkurrent i panorering reaksjon for å konkurrere med de scFv vises på sfæroplastene. Fordi løselig kompetitor er et renset protein, ikke DNA er amplifisert fra det, slik at bare sekvensene til scFv vises på sfæroplastene vil bli gjenvunnet i PCR-reaksjonen. I tillegg kan denne metoden bli utvidet til å konstruere andre typer av antistoffer eller til ikke-antistoff-bindende proteiner.
E. coli indre membran skjermen er en kraftig plattform for ingeniør antistoffer med høy affinitet og høye nivåer av intracellulær oppløselighet. Denne fremgangsmåte er særlig egnet for effektiv prosjektering av antistoffer som virker på den intracellulære miljø. Disse intracellulære antistoffer er allerede utforsket som potensielle legemiddelselskap i en rekke felt, inkludert nevrodegenerative sykdommer, kreft og virale infeksjoner 31. Denne teknikken vil gjøre mer utbredt bruk av intracellulære antistoffer som verktøy for forskning og medisin i disse feltene, og alle andre felt hvor studere et protein mål in situ er ønsket.
Materials
| Name | Company | Catalog Number | Comments |
| scFv library | Varies | A suitable scFv library should be obtained from a commercial or academic source. | |
| MC4100 E. coli cells | Coli Genetic Stock Center | 6152 | Cells need to be chemically competent or electrocompetent, depending on the selected transformation method. |
| Glycerol | Fisher Scientific | BP229-4 | |
| Difco dehydrated culture media LB Broth, Miller (Luria-Bertani) | BD | 244610 | |
| Chloramphenicol (Cm) | Fisher Scientific | BP904-100 | |
| Sodium chloride (NaCl) | Fisher Scientific | BP358-1 | |
| Potassium chloride (KCl) | Fisher Scientific | BP366-500 | |
| Sodium phosphate, dibasic (Na2HPO4) | Fisher Scientific | BP332-500 | |
| Potassium phosphate, monobasic (KH2PO4) | Fisher Scientific | BP362-500 | |
| Bovine serum albumin (BSA) | Fisher Scientific | BP9706-100 | |
| Sucrose | Fisher Scientific | BP220-1 | |
| Tris base | Fisher Scientific | BP1521 | |
| Ethylenediaminetetraacetic acid (EDTA), 0.5 M | Fisher Scientific | BP2482-500 | |
| Magnesium chloride (MgCl2) | Fisher Scientific | BP214-500 | |
| Lysozyme | Sigma Aldrich | L3790-10X1ML | |
| Vortex mixer | VWR | 97043-564 | |
| Bicine | Fisher Scientific | BP2646100 | |
| D-Biotin | Fisher Scientific | BP232-1 | |
| Isopropyl β-D-1-thiogalactopyranoside | Fisher Scientific | BP1755-1 | |
| BugBuster Master Mix (cell lysis detergent) | EMD Millipore | 71456 | |
| Vivaspin 2 MWCO, 3,000 daltons | GE Healthcare Sciences | 28932240 | |
| Target antigen | Varies | N/A | Purified target antigen may be purchased or produced/purified. |
| Dynabeads MyOne Streptavidin T1 | Invitrogen | 65601 | |
| Dynamag-2 magnet | Invitrogen | 12321D | |
| Tube rotator | VWR | 13916-822 | |
| PCR primers | IDT | N/A | Primer sequences are as described in the protocol. |
| 10x T4 DNA ligase reaction buffer | New England BioLabs | B0202S | |
| T4 Polynucelotide kinase (PNK) | New England BioLabs | M0201S | Make sure the T4 ligase buffer used in the primer phosphorylation reaction contains 1 mM ATP. |
| 5x Phusion HF buffer pack | New England BioLabs | B0518S | |
| Deoxynucleotide (dNTP) solution mix, 10 mM each dNTP | New England BioLabs | N0447L | |
| Phusion DNA polymerase | New England BioLabs | M0530S | Other high-fidelity polymerases may be used as an alternative, but the annealing temperature in Table 3 must be adjusted. |
| C1000 Touch thermal cycler with dual 48/48 fast reaction module | Bio-Rad | 185-1148 | |
| Agarose | Promega | V3121 | |
| SYBR Safe DNA gel stain | Invitrogen | S33102 | |
| Wizard SV gel and PCR clean-up system | Promega | A9281 | |
| T4 DNA ligase | New England BioLabs | M0202S | |
| Microdialysis membrane filter | EMD Millipore | VSWP04700 | |
| Agar | BD | 214030 | |
| 96-well polystyrene round-bottom cell culture plates | VWR | 10062-902 | |
| Costar general polystyrene assay plate lids | Corning | 3931 | |
| Microtitre plate shaker | VWR | 12620-926 | |
| Costar 96 well EIA/RIA Easy Wash clear flat bottom polystyrene high bind microplate | Corning | 3369 | |
| Bel-blotter polycarbonate 96-well replicating tool | Bel-Art Products | 378760002 | |
| Instant nonfat dry milk | Quality Biological | A614-1000 | |
| Tween 20 (polysorbate 20) | Fisher Scientific | BP337-500 | |
| PopCulture reagent (concentrated cell lysis detergent) | EMD Millipore | 71092-3 | |
| Monoclonal ANTI-FLAG M2-Peroxidase(HRP) antibody produced in mouse | Sigma Aldrich | A8592 | |
| SigmaFast OPD | Sigma Aldrich | P9187-50SET | |
| Sulfuric acid (H2SO4), 10 N solution | Fisher Scientific | SA200-1 | |
| Reynolds Wrap aluminum foil | VWR | 89079-075 | |
| BioTek Epoch microplate spectrophotometer | Fisher Scientific | 11120570 |
References
- Biocca, S., Pierandrei-Amaldi, P., Campioni, N., Cattaneo, A. Intracellular immunization with cytosolic recombinant antibodies. Biotechnology (NY). 12 (4), 396-399 (1994).
- Chen, S. Y., Bagley, J., Marasco, W. A. Intracellular antibodies as a new class of therapeutic molecules for gene-therapy. Hum. Gene Ther. 5 (5), 595-601 (2008).
- Gargano, N., Biocca, S., Bradbury, A., Cattaneo, A. Human recombinant antibody fragments neutralizing human immunodeficiency virus type 1 reverse transcriptase provide an experimental basis for the structural classification of the DNA polymerase family. J Virol. 70 (11), 7706-7712 (1996).
- Mhashilkar, A. M., et al. Inhibition of HIV-1 Tat-mediated LTR transactivation and HIV-1 infection by anti-Tat single chain intrabodies. Embo J. 14 (7), 1542-1551 (1995).
- Strube, R. W., Chen, S. Y. Characterization of anti-cyclin E single-chain Fv antibodies and intrabodies in breast cancer cells: enhanced intracellular stability of novel sFv-F-c intrabodies. J. Immunol. Meth. 263 (1-2), 149-197 (2002).
- Mössner, E., Koch, H., Plückthun, A. Fast selection of antibodies without antigen purification: adaptation of the protein fragment complementation assay to select antigen-antibody pairs. J. Mol. Biol. 308 (2), 115-122 (2001).
- Wörn, A., et al. Correlation between in vitro stability and in vivo performance of anti-GCN4 intrabodies as cytoplasmic inhibitors. J Biol Chem. 275 (4), 2795-2803 (2000).
- Knappik, A., Plückthun, A. Engineered turns of a recombinant antibody improve its in vivo folding. Protein Eng. 8 (1), 81-89 (1995).
- Martineau, P., Jones, P., Winter, G. Expression of an antibody fragment at high levels in the bacterial cytoplasm. J Mol Biol. 280 (1), 117-127 (1998).
- Steipe, B., Schiller, B., Plückthun, A., Steinbacher, S. Sequence statistics reliably predict stabilizing mutations in a protein domain. J. Mol. Biol. 240 (3), 188-192 (1994).
- Daugherty, P. S. Protein engineering with bacterial display. Curr Opin Struct Biol. 17 (4), 474-480 (2007).
- Lener, M., et al. Diverting a protein from its cellular location by intracellular antibodies. Eur. J. Biochem. 267 (4), 1196-1205 (2000).
- Lynch, S. M., Zhou, C., Messer, A. An scFv intrabody against the nonamyloid component of α-synuclein reduces intracellular aggregation and toxicity. J. Mol. Biol. 377 (1), 136-147 (2008).
- Gai, S. A., Wittrup, K. D. Yeast surface display for protein engineering and characterization. Curr. Opin. Struc. Biol. 17 (4), 467-473 (2007).
- Kieke, M. C., et al. Selection of functional T cell receptor mutants from a yeast surface-display library. Proc. Natl. Acad. Sci. USA. 96 (10), 5651-5656 (1999).
- Steiner, D., Forrer, P., Stumpp, M. T., Pluckthun, A. Signal sequences directing cotranslational translocation expand the range of proteins amenable to phage display. Nat. Biotechnol. 24, 823-831 (2006).
- Pugsley, A. P. The complete general secretory pathway in gram-negative bacteria. Microbiol. Rev. 57 (1), 50-108 (1993).
- Rapoza, M. P., Webster, R. E. The filamentous bacteriophage assembly proteins require the bacterial SecA protein for correct localization to the membrane. J. Bacteriol. 175 (6), 1856-1859 (1993).
- Karlsson, A. J., et al. Engineering antibody fitness and function using membrane-anchored display of correctly folded proteins. J. Molec. Biol. 416 (1), 94-107 (2012).
- DeLisa, M. P., Tullman, D., Georgiou, G. Folding quality control in the export of proteins by the bacterial twin-arginine translocation pathway. Proc Natl Acad Sci U S A. 100 (10), 6115-6120 (2003).
- Fisher, A. C., Kim, W., DeLisa, M. P. Genetic selection for protein solubility enabled by the folding quality control feature of the twin-arginine translocation pathway. Protein Sci. 15 (3), 449-458 (2006).
- Maynard, J., Georgiou, G. Antibody engineering. Annu Rev Biomed Eng. 2, 339-376 (2000).
- Green, M. R., Sambrook, J. Molecular Cloning: A Laboratory Manual. 1, Fourth, Cold Spring Harbor Laboratory Press. (2012).
- Milo, R., Jorgensen, P., Moran, U., Weber, G., Springer, M. BioNumbers--the database of key numbers in molecular and cell biology. Nucleic Acids Res. 38, D750-D753 (2010).
- Hermanson, G. T. Bioconjugate Techniques. , Third, Elsevier/Academic Press. (2013).
- Tayapiwatana, C., Chotpadiwetkul, R., Kasinrerk, W. A novel approach using streptavidin magnetic bead-sorted in vivo biotinylated survivin for monoclonal antibody production. J Immunol Methods. 317 (1-2), 1-11 (2006).
- Zhu, G., Song, L., Lippard, S. J. Visualizing inhibition of nucleosome mobility and transcription by cisplatin-DNA interstrand crosslinks in live mammalian cells. Cancer Res. 73 (14), 4451-4460 (2013).
- Bogsch, E. G., et al. An essential component of a novel bacterial protein export system with homologues in plastids and mitochondria. J. Biol. Chem. 273, 18003-18006 (1998).
- Julian, M. C., et al. Co-evolution of affinity and stability of grafted amyloid-motif domain antibodies. Protein Eng. Des. Sel. 28 (10), 339-350 (2015).
- Garber, K. Bispecific antibodies rise again. Nat. Rev. Drug. Discov. 13 (11), 799-801 (2014).
- Marschall, A. L., Dübel, S., Böldicke, T. Specific in vivo knockdown of protein function by intrabodies. MAbs. 7 (6), 1010-1035 (2015).



