Summary
Das Ziel dieses Papier und Lehr-Video ist zu beschreiben, wie die Obduktion Schweinehirn und Hypophyse in einem intakten Zustand, geeignet für die anschließende makroskopische und histologische Analyse belichten und zu entfernen.
Abstract
Schweine haben in Großtier translationalen neurowissenschaftlichen Forschung als wirtschaftlich und ethisch möglich Ersatz für nichtmenschliche Primaten immer beliebter geworden. Die große Größe des Gehirn des Schweins ermöglicht die Verwendung von herkömmlich klinischem Gehirn Imager und der direkten Nutzung und Prüfung von neurochirurgischen Verfahren und Geräten aus der menschlichen Klinik. Weitere makroskopische und histologische Analyse erfordert jedoch postmortem Exposition des Schweins Zentralnervensystem (ZNS) und die anschließende Entfernung des Gehirns. Dies ist keine einfache Aufgabe, da das Schwein CNS durch einen dicken, knöchernen Schädels und der Wirbelsäule eingekapselt ist. Das Ziel dieses Papier und Lehr-Video ist zu beschreiben, wie die Obduktion Schweinehirn und die Hypophyse in einem intakten Zustand, geeignet für die anschließende makroskopische und histologische Analyse belichten und zu entfernen.
Introduction
Translationale Neurowissenschaften Studien bei Schweinen immer beliebter in den letzten zwei Jahrzehnten worden. Die große Größe des Schweinehirns ermöglicht die Verwendung von herkömmlich klinischen brain Imager und der unmittelbaren Nutzung und Prüfung von neurochirurgischen Verfahren und Geräten aus der menschlichen Klinik 1, 2, 3, 4, 5, 6, 7, 8. In den letzten 20 Jahren, Schweine, insbesondere Minipigs (zB minipig Göttingen), wurden verwendet , neuromodulatorischen Behandlungsmodalitäten, wie beispielsweise Stammzelltransplantation zu untersuchen; viraler Vektor Transfektion; und tiefe Hirnstimulation gerichtet gegen Parkinson - Krankheit, Übergewicht, Depression und Alzheimer Krankheit 2, 6,= "Xref"> 9, 10, 11, 12, 13, 14, 15, 16, 17. Dies wurde durch die Entwicklung von Stereotaxierahmen und chirurgische Ansätze folgte dem minipig CNS 3, 18, 19, 20, 21 zu manipulieren. Die eingeleiteten CNS Veränderungen in lebenden Tieren unter Verwendung von brain imaging (PET 10, 13, 22, 24 und MR 23), Zystometrie 11, 12, 25, Ganganalyse evaluiert17, neurologische Bewertung 9, 17 und Obduktion basierend auf der Histologie und stereologischen Analyse 14, 15, 17, 26, 27, 31. Jedoch erfordert postmortale Analyse die Belichtung und die Entfernung des Schweinehirns, das keine leichte Aufgabe ist, als ein dicker, knöcherner Schädel und ein faseriger dural das Schweinehirn abdeckt umgeben.
Das Ziel dieses Papiers und Lehr-Video ist zu beschreiben, wie die Obduktion Schweinehirn und Hypophyse können unter Verwendung von nicht-motorisierte chirurgische Instrumente in 15-20 min in einem intakten Zustand belichtet und entfernt werden. Das Lehr-Video und fotografische Abbildungen zeigen männlich minipigs (Alter: 6 Monate, Körpergewicht: 20-25 kg) für eine anatomische Studie über die minipig Hypophyse verwendet.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Tier Anästhesie und euthanesia wurden gemäß „Principles of Labortierhaltung“ (NIH Publikation Nr 86-23, überarbeitet 1985) und genehmigt vom dänischen Rat für Tierforschung Ethik durchgeführt.
1. Instrumente
- Sammeln Sie die Instrumente in dem Video dargestellt und in der Tabelle der Materialien aufgeführt.
2. Enthauptung
HINWEIS: Die Anästhesie wurde durch eine intramuskuläre Injektion von 5 ml Midazolam (5 mg / ml) und 5 ml Ketamin (25 mg / ml) induziert. 5-10 min später, als das Tier sediert tief war, wurde eine kanülierte Ohrvene und eine letale Überdosis (100 mg / kg Körpergewicht) von Natriumpentobarbital (200 mg / ml) wurde intravenös verabreicht. Um sicherzustellen , dass das Tier vollständig eingeschläfert wurde, wurde der Kammschmerzreflex , wie durch Ettrup et al getestet. (2011) 20. Komplette Euthanasie wurde wie beschrieben gewährleistet inDie Ethik - Aussage über und durch eine transkardialer Perfusion mit 5 l isotonischer Kochsalzlösung folgte, wie von Ettrup et al. (2011) 20. Alle zeigten Verfahren sind Obduktion durchgeführt, Ausschließen der Notwendigkeit, dass die Wohlfahrtsmaßnahmen notwendig für die Langzeit Anästhesie und postprocedural Überleben.
- Köpft das Schwein durch einen hohen Kreis cervikale Inzision, ein chirurgisches Skalpell, direkt unterhalb dem Unterkieferwinkel (1A).
- Immer noch mit dem chirurgischen Skalpell, weiterhin die Inzision ventral durch das weiche Gewebe des Halses einschließlich dem Larynx und die Speiseröhre, bis die knöcherne Wirbelsäule erreicht ist, etwa auf der Höhe des kraniozervikalen Übergangs.
- Voraus, um den Schnitt mit einem Chirurgisches Skalpell aus der vorderen Seite des kraniozervikalen Übergangs über dem anterioren Bogen von Atlas, und durch das vordere atlanto Membran, um dadurch den Spinalkanal Belichtungs- und das Rückenmark (1B). Gleichzeitig einen Assistenten bitten, den Schweinekörper vom Schwein Kopf zu ziehen, den Zugang zwischen der Schädelbasis und dem ersten Halswirbel zu erleichtern.
- Weiterhin den chirurgischen Schnitt durch den Duralsack und dem Rückenmark (1B). Besondere Vorsicht, um sicherzustellen, dass ein vollständiger Querschnitt des Rückenmarks erreicht wird.
HINWEIS: Bei Nichtbeachtung des vorhergehenden Schritt durchzuführen, in unerwünschtem Zuge auf das Rückenmark und Gehirn während der folgenden Schritte des Prozesses Dekapitation führen. - Zwangsweise erweitert den cranocervical Übergang an der Abschnittsebene (1C). Zur gleichen Zeit, verwenden, um das chirurgische Skalpell Abschnitt die restlichen Bänder atlanto das Gelenk zwischen dem Condylus occipitalis zu lösen und dem oberen artikulierten Prozess des Atlas. Trennt den Schweinekopf aus dem Körper.

Abbildung 1: Minipig Enthaupten. (A) Halsschnitt (Pfeil, Kieferwinkel). (B) durch die Incision atlanto Bänder und die Dura-Rückenmark umgibt (SC) an dem kraniozervikalen Übergang (C1, anteriore Bogen von Atlas; OC, occipitalen Kondylen). (C) Der hintere Teil des Gelenkes atlanto wird durch eine kraftvolle Erweiterung (Pfeile) auf der Abschnittsebene freigegeben. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
3. Schädelöffnung
- Positionieren Sie den Schweinekopf auf einem Tisch.
- Führte einen dorsalen Längsinzision mit einem chirurgischen Skalpell durch die Haut und das darunterliegende Weichgewebe von der Rückseite des Mauls, über den Scheitel des Kopfes, und nach unten durch den hinteren Teildie Okzipitalregion.
- Belichten des dorsalen und posterioren Teil des Schädels durch das Weichgewebe zu entfernen, um den anfänglichen Einschnitt mit einem chirurgischen Skalpell entfernt lateral.
- Lassen Sie den Schläfenmuskel bilateral aus dem Schädel (2A) mit einem chirurgischen Skalpell. Stellen Sie sicher, dass der hintere Hinterhauptsbein ist aus weichem Gewebe gereinigt.
- Verwenden Sie die posterior Eingang des Foramen Magnum okzipitalen Knochen mit einem Kerrison Knochenstanze und Knochen Rongeurs belichten und die Dura-bedeckten Cerebellum (2B) zu entfernen.
- Kehrt zu der freiliegenden vorderen Seite des Schädels und wählen einen Eintrittspunkt in dem Stirnbein, direkt vor den Augen. An diesem Punkt wird eine Knochenmeißel mit einem Hammer den Schädel eindringt und die Stirnhöhle (2C) eingegeben werden .
- Verwenden, um die Ausdehnung der Stirnhöhle das dorsoposterior Entfernen des äußeren Schädel Lamina mit einer Knochen-Rongeur oder Knochenstanze zu fördern und setzen die inneren, dünnenknöcherner Schädel Lamina das Cerebrum Belag (Figur 2D).
- Öffnet sanft den inneren knöchernen Schädel lamina ventral mit einem Hammer und einem Meißel Knochen zur Dura bedeckte Cerebrum (Abbildung 2E) zu belichten.
- Weiterhin die Knochenentfernung seitlich einen Knochen Meißel und einen Knochen - Rongeur durch die zeitliche und Scheitelbein , um das endgültige dorsoposterior Teil des Schädels freizugeben, der sich zwischen den bereits belichteten Teile der dura bedeckten Cerebrum und Cerebellum (Figur 2F).
HINWEIS: Es ist oft möglich, im letzten Schritt dieses Verfahrens, den Meißel zu verwenden, öffnen Sie die restlichen hinteren Schädelknochen von einer Seite zu brechen, so wie man eine Tür öffnet.
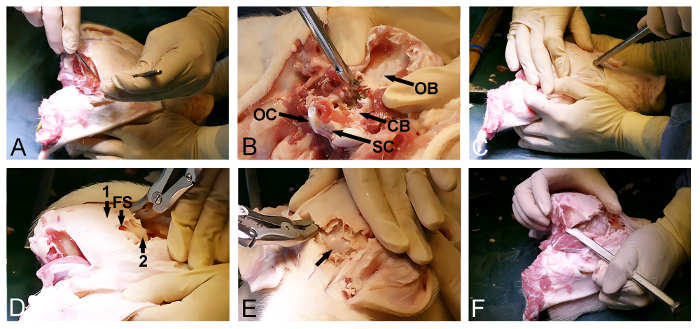
Abbildung 2: Minipig Schädelöffnung. (A) Die Exposition der dorsoposterior Schädeloberfläche, einschließlich der Entfernung des okzipitalen und temporalen Muskeln. (B) Entfernen des Hinterhauptbeins (CB, dura bedeckten Cerebellum; OB, okzipitalen Knochen; OC, occipitalen Kondylen, und SC, Rückenmark). (C) ein Hammer und ein Meißel Knochen verwendet , um den Schädel ventral zu durchdringen und die Stirnhöhle auf der Höhe der Augen ein. (D) Das Ausmaß der Stirnhöhle (FS) werden verwendet , um die äußeren dicken Schädelknochen (1) zu entfernen, eine inneren dünnen Knochenplättchen (2) , die die Cerebrum aussetzt. (E) Entfernen der dünnen Knochen Lamina, Freilegung der Dura bedeckten Cerebrum (Pfeil). (F) Schließlich wird ein Hammer und ein Knochenmeißel verwendet , um die ventral seitlich anschließen und die hinteren Schädelöffnungen. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
4. Gehirn Removal
- Verwenden chirurgische Zange der Dura heben und einen sanften Einschnitt nahe dem venösen Sinus sagittalis superior mit einem feinen Chirurgisches Skalpell (3A) zu erstellen.
- Verwenden Mikro Schere oder ein Dura-Messer weiter die Dura öffnen Abdecken der dorsale Oberfläche des Gehirns.
HINWEIS: Besondere Vorsicht ist geboten, wenn die Dura an das Klein tentorium (3B) entsprechende Entfernung, wie Erhaltung dieses dural Blattes wird nachfolgende Gehirnentfernung zu verhindern. - Platzieren Sie den Schweinekopf vertikal (3C).
- Verwenden , um die Knochenmeißel oder Dissektor die ventroanterior Cerebrum zur Freigabe durch stumpfe Dissektion des Riechkolbens aus dem Dura-bedeckten Boden der Schädelhöhle (Abbildung 3D).
- Verwenden , um ein feines Chirurgisches Skalpell Abschnitt des belichteten Chiasma (Figur 3E). Freizulegen, und den Abschnitt Hypophysenstiels und die oculomotor Nerven.
- Lassen Sie die ventrale brainstem durch die lo sectioningWer Hirnnerven (Abbildung 3F) mit einem feinen chirurgischen Skalpell. Sicherstellen , dass die duralen cerebellar tentorium vollständig eingeschnitten wurde (3B), da diese sonst durch durale Blatthirnstamm während des Freisetzungsprozesses geschnitten wird.

Abbildung 3: Minipig Hirnentfernung. (A) Dural Öffnung mit chirurgischer Pinzette und ein dura Messer. (B) Es muss vollständig genommen werden , um den Dural Blatt (Pfeil) einzuschneiden, zwischen Gehirn- und Cerebellum. (C) Der Schweinekopf positioniert ist , vertikal zur besseren Visualisierung der Schädelbasisstrukturen und damit die Schwerkraft in der beabsichtigten Verschiebung des Gehirns zu unterstützen. (D) Ein Dissektor oder ein Knochenmeißel wird verwendet , um den Riechkolben durch stumpfe Sektion von den Dura-covere zu entlastend Schädelbasis. (E) Die Präparation wird in einer posterioren Richtung entlang der Schädelbasis für die Belichtung und Sektionierung des Chiasma (Pfeil), infundibular Stiel und oculomotor Nerven fortgesetzt. (F) Das Gehirn Freisetzung wird mit dem Abschnitt der unteren Hirnnerven abgeschlossen , wie sie von der ventralen Oberfläche der brainstem abgehen (III, Oculomotorius; IV, Trochlearis; V, Trigeminus und VI, Abducens). Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
5. Hypophysen Removal
- Identifizieren Sie den Hypophysenstiel und seine Umgebung dural Blatt (die diapragma sellae) im Schädelboden (4A).
- Einzuschneiden die durale Blatt lateral den Hypophysenstiels ein feines chirurgisches Skalpell (4B) verwendet wird .
- Verwenden Sie einen Dissektor die Grube zu lösenuitary und hebt ihn aus der Hypophyse fossa (4C).

Abbildung 4: Minipig Hypophysen Entfernung. (A) Die Hypophyse fossa (*) in dem Schädelboden identifiziert (1, Bulbus olfactorius, 2, Chiasma; und PF, hintere Schädelgrube). (B) Die durale Abdeckung (sellar diagphragm, (Pfeil)) seitlich eingeschnitten. (C) Die Hypophyse (Pfeil) mit einem Dissektor freigegeben und aus der Hypophyse Fossa angehoben. Maßstabsbalken (AC) = 10 mm. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Um das Gewebematerial vor dem Austrocknen zu verhindern, wird empfohlen, das Gehirn und Hypophyse entfernt in einem Glas mit Fixativ oder isotonischer Kochsalzlösung gefüllt zu speichern, unmittelbar nach makroskopischer Analyse durchgeführt wurde. Das Gewebematerial kann in der Fixiermittel für Jahre gespeichert werden, während der Lagerung in isotonischer Kochsalzlösung, auch in einem Kühlschrank wird auf Gewebezerfall mit der Zeit führen.
Die Hypophyse entfernt auch durch Eintauchen wird in Trockeneis gekühlten Flüssigkeit 2-methylbutan unmittelbar eingefroren, während das intakte Schweinehirn zum direkten Gefrieren 28 zu groß ist. Stattdessen ist es empfehlenswert , das Schweinehirn zu schneiden, wie zuvor 28 gezeigt, in 9-15 mm dicke koronale parallel Gewebeplatten , die in toto eingefroren werden können und Kryostat Schnitt in 40 & mgr; m dicke Abschnitte 5, 18, 26, 28. Alternativ können spezifische Hirnareale von dem Abnehm intakten Gehirn oder in Scheiben geschnitten brain Bramme und vorzulegenden weiterer histologischer Verarbeitung nach Vibratom sectioning 30, Paraffin / Methacrylat - Einbettungs und Mikrotom sectioning 6, 17, 27 oder Einfrieren und Kryostat sectioning 6 frei seziert werden, 14, 15, 25. In unserer Einstellung werden die Schweineschlachtkörper schließlich in bestimmten Kunststoffbehälter gegeben und in einem speziellen Kühlraum gelagert, bis sie zu einer biologischen abbau Anlage gesammelt und transportiert werden.
Bei der Verwendung von nicht-motorisierten chirurgischen Werkzeugen (Tabelle von Materialien), die beschriebenen Technik (Figuren 1 g> - 3) ermöglicht, in etwa 15-20 min, bleiben die Entfernung der intakten Schweinehirn (Abbildung 5AB), während die abgetrennten Hirnnerven und Hypophyse zum Schädel Boden (4A) verbunden ist . Ebenso kann die Hypophyse einfach entfernt werden, intakt, nachdem das darüberliegende Gehirn entfernt und das durale sellar Membran (Figur 4 und 5C) freigibt .
Die sich ergebende Gehirn und / oder Hypophysen (Figur 5) kann anschließend auf makroskopische Analyse unterzogen werden , die, abgesehen von der direkten visuellen Inspektion, können Größe und Volumenmessungen 31 umfassen. Dies kann durch orientierte Schneiden in kleiner brain Brammen 28, 29 geeignet für die chemische Analyse und / oder weitere histologisches Präparat, Färbung und mikroskopische Analyse 6 folgen,s = "Xref"> 14, 15, 17, 25, 26, 27.

Abbildung 5: Das minipig Gehirn (A und B) und der Hypophyse (C). (A) , Gehirn, laterodorsal Ansicht (BS, brainstem; CB, Cerebellum, und CRB, Cerebrum). (B) Gehirn, ventral (BS, brainstem; CB, Cerebellum, und CRB, Cerebrum). (C) Pituitary, posterior Ansicht (AH, Adenohypophyse und NH, neurohypophyse). Maßstabsbalken (A und B) = 10 mm, (C) = 5 mm. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Die meisten experimentellen Neurowissenschaften Studien werden in kleinen Tierarten, wie Mäuse und Ratten durchgeführt, in denen den Zugang zum ZNS durch einen dünnen Schädel- und Dural-Dicke erleichtert wird. In größeren Versuchstieren , wie Schweine 1, 4, 8, Schafe 32, aber, und nicht-menschliche Primaten, erfordern die beträchtlichen Dicke dieser Strukturen , die die Verwendung von robusten Instrumenten (Tabelle von Materialien) und die richtigen Einspeisepunkte für Schädelknochenentfernung (Abbildung 2). Die Kenntnis der Beschränkungs dural Blätter (3 und 4) erforderlich ist, bevor das CNS zugegriffen werden kann , und das Gehirn sicher entfernt.
Es wird empfohlen, die Dura intakt während der Schädelknochenentfernung zu lassen, da dies das zugrunde liegende Gehirn vor Schäden zu schützen. Zurück transkardialer Fixierung 20 kann ebenfalls verhärten und slightly das Gehirn schrumpft, die Knochen und Dural Entfernungsprozess ermöglicht, mit mehr Leichtigkeit und Sicherheit durchgeführt werden. Eine Besonderheit des Schweins Schädels, im Gegensatz zu den Schafen und nicht-menschlichen Primaten, ist die fortschreitende Ausdehnung des Stirnhöhle mit dem Alter, das in den Schädelknochen - Entfernungsverfahren (2) , von Vorteil sein kann. Die vorgestellte Technik kann demnach auf allen großen Tierarten verwendet werden, aber nur bei Schweinen, vor allem denjenigen, die älter als 6 Monaten, wird die Stirnhöhle genug Hilfe zu leisten, in dem Schädelknochen Entfernungsprozess entwickelt werden. Schließlich vollständige Sektionierung des Rückenmarks während des Prozesses Dekapitation (1B) und die vollständigen Sektionierung des duralen cerebellar tentorium (3B) vor dem endgültigen Gehirn freisetzen , sind unbedingt erforderlich , um Folgeschäden an den Hirnstamm zu vermeiden.
In einigen Untersuchungen kann es vorteilhaft sein, einen Teil der rostralen zervikalen Rückenmark an das Gehirn angebracht zu haben.Dies kann durch Platzieren des anfänglichen Einschnitts Dekapitation (1A) mehr caudal auf dem Hals erhalten werden, die den Zugang zu dem Rückenmark durch eine Bandscheibe zervikalen anstelle des kraniozervikalen Übergangs, wie in dem aktuellen Video demonstriert. Die hintere Knochenentfernung wird dann von dem freiliegenden Schwanz Lamina beginnen. Abgesehen davon, wird die Technik ähnlich sein, so ist es wichtig , sich daran zu erinnern , dass das Rückenmark muss vollständig geschnitten werden , bevor das Abtrennen des Kopfes mit kraftvollen Erweiterung auf der Abschnittsebene abgeschlossen ist (Abbildung 1). Das derzeitige Verfahren ist auf nicht fixierten Tieren gezeigt, wie die tatsächliche Hintergrundstudie HPLC-Analyse des abgeleiteten Hypophysen notwendig gemacht. Beachten Sie jedoch, dass genau die gleiche Technik , die auf Tiere transkardial mit Paraformaldehyd 3, 5 fixiert eingesetzt wird, 14, 15, 16, 17, 18, 19, 20, 25, 26, 27, 28, 31, obwohl alle Verfahren in einem solchen Fall muss von einem Abzug 20 versehen , unter guter Belüftung durchgeführt werden. Die Wahl des nativen Dissektion Vergleich in toto -Fixierung und anschließende Präparation sollte daher lediglich abhängig von den erforderlichen Nachbearbeitungsverfahren (zB herkömmliche Histologie, Immunhistochemie, HPLC und FISH) 32.
Wie in den folgenden Abschnitten besprochen haben wir chirurgische Instrumente zu verwenden nichtmotorisierten bevorzugt. Der Schädel von Schweinen im Alter von über 1-2 Jahren kann jedoch sein, so robust, dass Schädelentfernung mit dem demonstriert Instruments nicht möglich ist, was die Verwendung von motorisierten Instrumenten wie Craniotome, oszillierende Sägen und elektrische Bohrer 32. In diesem Fall ist es immer noch empfohlen, die Protokollschritten oben angegeben zu folgen, damit die Vorteile des natürlich vorkommenden Schädel Einspeisepunkten und Stirnhöhle Entwicklung. Die vorgestellte vorderen Zugang zur Schädelbasis ist elegant und einfach, aber die beschriebene stumpfe Freigabe der Riechkolben muss ohne direkte visuelle Führung (3D), im Gegensatz zu den mehr posterior Freisetzung des Gehirns (Abbildung 3EF) durchgeführt werden. Die ventrale Teil der Riechkolben kann daher einen gewissen Grad an unkontrollierte Schäden erleiden, die nur vermieden werden können, wenn nötig, durch die vordere Schädelbasis Bohren ventral heraus zu den Leuchtmitteln, bevor der Lösevorgang eingeleitet wird. Beachten Sie, dass die Manipulation, insbesondere von nicht fixierten Hirngewebe während Schädelentfernung, wurde in der histologi führen angezeigt cal dunklen neuron Artefakts, die 33 bis falschen Schlüssen in neurotoxikologischen Studien führen kann.
Der Schädelknochen Entfernungsprozess kann auch mit Maschinen wie Craniotome, oszillierenden Sägen und elektrische Bohrer 32 durchgeführt werden. Diese können den Prozess beschleunigen, aber sie werden auch das Risiko von Schäden an den zugrunde liegenden neuralen Strukturen erhöhen. Solche Geräte können auch teuer sein und werden höchstwahrscheinlich zu den meisten Labors nicht zur Verfügung. Wir haben daher bevorzugt das derzeitige Verfahren zu demonstrieren , unter Verwendung von nicht-motorisierte chirurgische Geräte (Table of Materials) , die leicht zu erreichen und zu nutzen.
Die beschriebene und dargestellte Technik wird, wenn sie richtig verwendet wird , ermöglichen , die Belichtung und der Entfernung des postmortalen Schweinehirn, Hypophyse, und / oder zervikalen Rückenmark (5), in Gewebestücke führt , die für die weitere makroskopische Analyse gut geeignet sind ,"Xref"> 5, 6, 19, 26, 31, in dem Gehirn sectioning Brammen 28 und anschließende chemische Analyse und / oder Verarbeitung histologische 6, 14, 15, 16, 17, 25, 26, 27, 31.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Die Autoren haben nichts zu offenbaren.
Acknowledgments
Die Autoren erkennen dankbar die geschickte Unterstützung von Frau Trine W. Mikkelsen, Frau Lise M. Fitting, und das Personal an Påskehøjgaard. Das dänische Medical Research Council, die Lundbeck-Stiftung, und die Novo Nordisk Foundation finanziell unterstützten die Studie.
Materials
| Name | Company | Catalog Number | Comments |
| Heavy Scalpel Handle #4 | FST (Fine Science Tools) | 10008-13 | Good for skin incision and soft tissue removal |
| Non-Sterile Scalpel Blades #23 | FST | 10023-00 | |
| Scalpel Handle #7 | FST | 10007-12 | Optimal for dural incision and precision work |
| Non-Sterile Scalpel Blades #11 | FST | 10011-00 | |
| Surgical Forceps | FST | 11024-18 | The tip of the surgical forceps ensure a firm grip |
| Kerrison Bone Punch | Aesculap Neurosurgery | FF713R | Must be robust, bite size 3-5 mm |
| Bone Rongeur | Aesculap Neurosurgery | MD615 | Must be robust, bite size 15 x 5 mm |
| Bone Rongeur | Aesculap Neurosurgery | FO551R | Must be robust, bite size 25 x 15 mm |
| Bone Chisel | Lawton | 67-0335 | The size of the chisel head should not exceed 20 mm |
| Mallet (Hammer) | Millarco | 5624108 | Weigth 300 g, length 30 cm, head hit area size 2 x 2 cm |
| Micro-Scissor | FST | 14002-14 | |
| Dissector | Aesculap Neurosurgery | OL165R | |
| Göttingen minipigs | Ellegaard Göttingen Minipigs A/S, Denmark | ||
| Euthanimal | pentobarbital | ||
| Ketamine | Pfizer | ||
| Midazolam | Hameln Pharmaceuticals |
References
- Lind, M. N., Moustgaard, A., Jelsing, J., Vajta, G., Cumming, P., Hansen, A. K. The use of pigs in neuroscience: Modeling brain disorders. Neurosci Biobehav Rev. 31, 728-751 (2007).
- Bjarkam, C. R., et al. Neuromodulation in a minipig model of Parkinson disease. British J Neurosurg. 22 (Suppl. 1), S9-S12 (2008).
- Bjarkam, C. R., Cancian, G., Glud, A. N., Ettrup, K. S., Østergaard, L., Sørensen, J. C. MRI-guided stereotaxic targeting in pigs based on a stereotaxic localizer box fitted with an isocentric frame and use of SurgiPlan computer-planning software. J Neurosci Methods. 183 (2), 119-126 (2009).
- Sauleau, P., Lapouble, E., Val-Laillet, D., Malbert, C. H. The pig model in brain imaging and neurosurgery. Animal. 3 (8), 1138-1151 (2009).
- Bjarkam, C. R., et al. Safety and function of a new clinical intracerebral microinjection instrument for stem cells and therapeutics examined in the Göttingen minipig. Stereotact Funct Neurosurg. 88 (1), 56-63 (2010).
- Fjord-Larsen, L., et al. Long-term delivery of nerve growth factor by encapsulated cell biodelivery in the minipig basal forebrain. Mol Therapy. 18 (12), 2164-2172 (2010).
- Sørensen, J. C., et al. Development of neuromodulation treatments in a large animal model - Do neurosurgeons dream of electric pigs? Prog Brain Res. 194, 97-103 (2011).
- Dolezalova, D., et al. Pig models of neurodegenerative disorders: utilization in cell replacement-based preclinical safety and efficacy studies. J Comp Neurol. 522 (12), 2784-2801 (2014).
- Mikkelsen, M., Moller, A., Jensen, L. H., Pedersen, A., Harajehi, J. B., Pakkenberg, H. MPTP-induced Parkinsonism in minipigs: A behavioral, biochemical, and histological study. Neurotoxicol Teratol. 21, 169-175 (1999).
- Danielsen, E. H., et al. The DaNEX study of embryonic mesencephalic, dopaminergic tissue grafted to a minipig model of Parkinson's disease: Preliminary findings of effect of MPTP poisoning on striatal dopaminergic markers. Cell Transplant. 9 (2), 247-259 (2000).
- Dalmose, A., Bjarkam, C. R., Sørensen, J. C., Jørgensen, T. M., Djurhuus, J. C. Effects of high frequency deep brain stimulation on urine storage and voiding function in conscious minipigs. Neurourol Urodyn. 23 (3), 265-272 (2004).
- Dalmose, A., Bjarkam, C. R., Djurhuus, J. C. Stereotactic electrical stimulation of the pontine micturition center in the pig. Br J Urol. 95, 886-889 (2005).
- Andersen, F., Watanabe, H., Bjarkam, C. R., Danielsen, E. H., Cumming, P. The DaNeX Study Group. Pig brain stereotaxic standard space: Mapping of cerebral blood flow normative values and effect of MPTP-lesioning. Brain Res Bull. 66 (1), 17-29 (2005).
- Glud, A. N., et al. Direct gene transfer in the minipig CNS using stereotaxic lentiviral microinjections. Acta Neurobiol Exp. 70 (3), 1-8 (2010).
- Glud, A. N., et al. Direct MRI-guided stereotaxic viral mediated gene transfer of alpha-synuclein in the minipig CNS. Acta Neurobiol Exp. 71 (4), 508-518 (2011).
- Ettrup, K. S., Sørensen, J. C., Rodell, A., Alstrup, A. K. O., Bjarkam, C. R. Hypothalamic deep brain stimulation influences autonomic and limbic circuitry involved in the regulation of aggression and cardiocerebrovascular control in the minipig. Stereotact Funct Neurosurg. 90 (5), 281-291 (2012).
- Nielsen, M. S., et al. Continuous MPTP intoxication in the minipig results in chronic parkinsonian deficits. Acta Neurobiol Exp. 76, 198-210 (2016).
- Bjarkam, C. R., et al. A MRI-compatible stereotaxic localizer box enables high-precision stereotaxic procedures in pigs. J Neurosci Methods. 139 (2), 293-298 (2004).
- Bjarkam, C. R., Jorgensen, R. L., Jensen, K. N., Sunde, N. A. A., Sørensen, J. C. H. Deep brain stimulation electrode anchoring using BioGlue®, a protective electrode covering, and a titanium microplate. J Neurosci Methods. 168, 151-155 (2008).
- Ettrup, K. S., et al. Basic Surgical Techniques in the Minipig: Intubation, Transurethral Bladder Catheterization, Femoral Vessel Catheterization, and Transcardial Perfusion. J Vis Exp. (52), e2652 (2011).
- Ettrup, K. S., Tornøe, J., Sørensen, J. C., Bjarkam, C. R. A surgical device for minimally invasive implantation of experimental deep brain stimulation leads in large research animals. J Neurosci Methods. 200 (1), 41-46 (2011).
- Danielsen, E. H., et al. Positron emission tomography of living brain in minipigs and domestic pigs. Scand J Lab Anim Sci Suppl. 25 (1), 127-135 (1998).
- Røhl, L., et al. Time evolution of cerebral perfusion and ADC measured by MRI in a porcine stroke model. J Magn Reson Imaging. 15 (2), 123-129 (2002).
- Cumming, P., Gillings, N. M., Jensen, S. B., Bjarkam, C. R., Gjedde, A. Kinetics of the uptake and distribution of the dopamine D2/3 agonist (R)-N-[1-11C]n-propylnorapomorphine in brain of healthy and MPTP-poisoned Gottingen miniature pigs. Nucl Med Biol. 30 (5), 547-553 (2003).
- Jensen, K. N., Deding, D., Sørensen, J. C., Bjarkam, C. R. Long-term implantation of deep brain stimulation electrodes in the pontine micturition centre of the minipig. Acta Neurochir. 151 (7), 785-794 (2009).
- Rosendal, F., et al. Does chronic low dose treatment with ciclosporin influence the brain? A histopathological study in pigs. Transplantation Proc. 37 (8), 3305-3308 (2005).
- Nielsen, M. S., Sørensen, J. C., Bjarkam, C. R. The substantia nigra pars compacta of the minipig: An anatomical and stereological study. Brain Struct Funct. (4-5), 481-488 (2009).
- Sørensen, J. C., Bjarkam, C. R., Simonsen, C. Z., Danielsen, E., Geneser, F. A. Oriented sectioning of irregular tissue blocks in relation to computerized scanning modalities. Results from the domestic pig brain. J Neurosci Methods. 104, 93-98 (2000).
- Bjarkam, C. R., Pedersen, M., Sørensen, J. C. New strategies for embedding, orientation and sectioning of small brain specimens enable direct correlation to MR-images, brain atlases, or use of unbiased stereology. J Neurosci Methods. 108, 153-159 (2001).
- Bjarkam, C. R., Sørensen, J. C., Geneser, F. A. Distribution and morphology of serotonin-immunoreactive axons in the hippocampal region of the New Zealand white rabbit. I. Area dentata and hippocampus proper. Hippocampus. 13 (1), 21-37 (2003).
- Bjarkam, C. R., Glud, A. N., Orlowski, D., Sørensen, J. C., Palomero-Gallagher, N. The telencephalon of the minipig, cytoarchitecture and cortical surface anatomy. Brain Struct Funct. , e-pub ahead of print (2016).
- Boltze, J., Nitzsche, B., Geiger, K. D., Schoon, H. A. Histopathological investigation of different MCAO modalities and impact of autologous bone marrow mononuclear cell administration in an ovine stroke model. Transl Stroke Res. 2, 279-293 (2011).
- Jortner, B. S. The return of the dark neuron. A histological artifact complicating contemporary neurotoxicologic evaluation. Neurotoxicology. 27, 628-634 (2006).



