Summary
Bu kağıt ve öğretim videonun amacı ortaya çıkarmak ve daha sonraki makroskopik ve histolojik analiz için uygun bozulmamış bir halde, domuz beyin ve hipofiz bezi otopsi nasıl kaldırılacağı tanımlamaktır.
Abstract
Domuzlar insan olmayan primatlar için ekonomik ve etik açıdan uygun yerine büyük hayvan translasyonel sinirbilim araştırmalarında giderek daha popüler hale gelmiştir. domuzun büyük beyin boyutu geleneksel klinik beyin kameralar ve insan klinikten doğrudan kullanımı ve beyin cerrahisi prosedürleri ve ekipmanın test kullanımına izin verir. Daha fazla makroskopik ve histolojik analizi, ancak, domuz, merkezi sinir sistemi (CNS) ve daha sonra beyin çıkarılması postmortem maruz kalmayı gerektirir. Bu merkezi sinir sistemi kalın, kemik kafatası ve omurga ile kapsül olup domuz gibi kolay bir iş değildir. Bu kağıt ve öğretim videonun amacı açığa ve postmortem domuz beyni ve sonraki makroskopik ve histolojik analiz için uygun bozulmamış bir halde hipofiz bezini, nasıl kaldırılacağı tanımlamaktır.
Introduction
domuzlarda Translasyonal nörobilim çalışmaları son yirmi yılda giderek popüler hale gelmiştir. Domuz beyin büyük boyutlu klasik klinik beyin görüntüleyiciler ve doğrudan kullanımı ve insan klinik 1, 2, 3, 4, 5, 6, 7, 8 den nörocerrahi usul ve ekipman test kullanımını mümkün kılmaktadır. Son 20 yıl içinde, domuz, özellikle küçük domuzu (örneğin, Göttingen Minipig gibi), kök hücre transplantasyonu, nöromodülatör tedavi yöntemleri incelemek için kullanılmıştır; Viral vektör transfeksiyon; ve Parkinson hastalığı, obezite, depresyon ve Alzheimer hastalığı 2, 6 yönelik derin beyin uyarımı,= "xref"> 9, 10, 11, 12, 13, 14, 15, 16, 17. Bu MiniPig MSS 3, 18, 19, 20, 21 işlemek için stereotaksik ve cerrahi yaklaşımların geliştirilmesi takip edilmiştir. Tesis MSS değişiklikleri (PET 10, 13, 22, 24 ve MR 23), sistometrisi 11, 12, 25, beyin görüntüleme kullanılarak canlı hayvanlarda değerlendirilmiştir, yürüme analizi17, nörolojik değerlendirme 9, 17 ve histoloji ve stereolojik analizi 14, 15, 17, 26, 27, 31 temel ölüm sonrası inceleme. Bununla birlikte, ölüm sonrası analizi kalın, kemik kafatası ve domuz beyin çevreleyen kapsayan lifli bir dural olarak maruz kalma ve kolay bir iş değildir domuz beyin, kaldırılmasını gerektirir.
Bu kağıt ve öğretim videonun amacı postmortem domuz beyin ve hipofiz motorsuz cerrahi aletler kullanılarak 15-20 dakika içinde bozulmamış bir halde maruz ve kaldırılabilir nasıl tarif etmektir. MiniPig hipofiz bezi üzerinde anatomik bir çalışma için kullanılan öğretim video ve fotoğraf çizimler erkek domuzu (20-25 kg: 6 ay, vücut ağırlığı yaş) göstermektedir.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Hayvan anestezi ve euthanesia (NIH yayın sayılı 86-23, 1985 revize) ve Hayvan Araştırmaları Etik Danimarka Konseyi tarafından onaylanan "laboratuvar hayvan bakımı İlkeleri" uyarınca gerçekleştirilmiştir.
1. Araçlar
- Enstrümanlarını videoda sunulan ve Malzemelerin Tablo listelenen toplayın.
2. Decapitation
Not: Anestezi midazolam 5 mL (5 mg / mL) ve ketamin 5 ml (25 mg / ml) içeren bir intramüsküler enjeksiyon ile oluşturuldu. Hayvan derin sedasyon zaman 5-10 dakika sonra, bir kulak toplar damarına kanül takıldı ve sodyum pentobarbitalin letal doz (vücut ağırlığı 100 mg / kg) (200 mg / ml) damardan verilmiştir. Ettrup ve arkadaşları tarafından gösterildiği gibi hayvan tamamen ötenazi emin olmak için, interdijital ağrı refleks test edilmiştir. (2011) 20. açıklandığı gibi Komple euthanization sağlanmıştırEttrup ve arkadaşları tarafından gösterildiği gibi ve, izotonik tuzlu su, 5 L bir transcardial perfüzyon ile takip edilen etik bildirimi. (2011) 20. Bütün gösterilen işlemler, uzun süreli anestezi ve işlem sonrası hayatta kalması için gerekli olan sosyal önlemler ihtiyacını ortadan kaldırarak, otopsi yapılır.
- Sadece alt çene açı (Şekil 1A) altında, bir cerrahi bıçak kullanılarak, yüksek bir dairesel servikal kesiği ile domuz başını kesmek.
- kemik omurga yaklaşık kafatası-boyun birleşme seviyesinde, ulaşılana kadar yine cerrahi neşter ile, larenks, yemek borusu da dahil olmak üzere boyun, yumuşak doku yoluyla anterior kesi devam edin.
- (Atlas ön yay üzerinde, kafatası-boyun birleşme ön taraftan bir cerrahi bıçakla kesildi Advance ve anterior atlantooksipital membrandan ve böylece spinal kanal ve omurilik açığaŞekil 1B). Aynı anda kafa tabanı ve birinci boyun omuru arasında erişimi kolaylaştırmak için domuz kafasından uzakta domuz gövdesini çekmek için bir asistan isteyin.
- Dural kese ve omurilikte (Şekil 1B) üzerinden cerrahi kesi devam edin. Omuriliğin tam enine kesiti elde edilmesini sağlamak için özel dikkat gösterin.
NOT: decapitation işleminin aşağıdaki adımları sırasında omurilik ve beyin üzerinde istenmeyen çekiş yol açabilir önceki adımı gerçekleştirmek için başarısızlık. - Zorla bölüm seviyesinde (Şekil 1C) cranocervical birleşme uzanır. Aynı zamanda, oksipital kondil ve Atlas üst ifade işlemi arasındaki mafsal serbest bölümüne geri kalan atlantooksipital ligament cerrahi neşter kullanmak. Vücuttan domuz kafasını ayırın.

Şekil 1: MiniPig dekapitasyon. (A), boynu insizyonu (ok, mandibular açı). (OC, oksipital kondil C1 atlas ön kavis) atlantooksipital bağ ve kafatası-boyun birleşme yerinde dura çevrili omurilik (SC) ila (B) bir kesik. (C) atlantooksipital mafsal arka kısmı kesit düzeyinde güçlü bir uzantı (oklar) tarafından serbest bırakılır. Bu rakamın büyük halini görmek için buraya tıklayın.
3. Kafa Açma
- Bir masaya domuz kafasını yerleştirin.
- arka kısmından deri ve başının tepe üzerinde burnu arkasından, alttaki dokuların içinden bir cerrahi neşter ile dorsal boyuna yarık açarsa ve aşağıoksipital bölgesi.
- Cerrahi bir bisturi ile insizyon yanal yer yumuşak doku kaldırarak kafatası sırt ve arka parçası Açığa.
- Cerrahi bir bisturi ile kafatası (Şekil 2A) iki taraflı olarak zamansal kas bırakın. Posterior oksipital kemik, yumuşak doku temizlenir emin olun.
- Bir Kerrison kemik delme ve kemik rongeurs Oksipital kemiği kaldırmak ve dura kaplı serebellum (Şekil 2B) ortaya çıkarmak için foramen magnumun arka giriş kullanın.
- Sadece gözlerinin önünde, kafatasının maruz ön tarafına dönün ve frontal kemikte bir giriş noktası seçin. Bu noktada, kafatası nüfuz ve frontal sinüs (Şekil 2C) girmek için bir çekiç ile bir kemik keski.
- kemik rongeur veya kemik zımba dış kafatası tabakanın dorsoposterior kaldırılmasını ilerletmek için Frontal sinüs, kullanımda ve iç ince açığaSerebrumu (Şekil 2D) kapsayan kemik kafatası tabaka.
- Yavaşça dura kaplı Serebrumu (Şekil 2E) ortaya çıkarmak için bir çekiç ve keski ile kemik anterior iç kemik kafatası lamina açın.
- Yanal olarak dura kaplı beyin ve beyincik (Şekil 2F) daha önce maruz kalan parçanın arasına kafatası son dorsoposterior parçası, serbest bırakmak için temporal hem de parietal kemik içinden bir kemik keskisi ve kemik rongeur kullanarak kemik kaldırılmasını devam edin.
NOT: Bu prosedürün son adımı sırasında, sıklıkla mümkündür biri kapıyı açar gibi, bir taraftan açık kalan arka kafatası kemiğini kırmak için keski kullanmak.
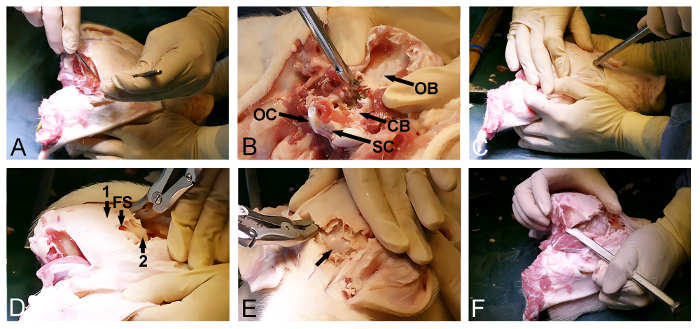
Şekil 2: MiniPig kafatası açma. (A) 'dorsoposterio maruz kalmasıoksipital ve temporal kas çıkarılması dahil olmak üzere R kafatası yüzeyi. Oksipital kemiğin (B) çıkarılması (CB dura kaplı serebellum; OB, oksipital kemik OC, oksipital kondil ve SC, omurilik). (C) Bir çekiç ve bir kemik keski öne kafatası nüfuz ve göz hizasında ön sinüse girmek için kullanılır. (D) Frontal sinüs (FS) derecesi, bir ince iç kemik tabaka (2) serebrum kaplama açığa (1) dış kalın kafatası kemiği kaldırmak için kullanılır. Dura kaplı Serebrumu (ok) maruz bırakılması, ince kemik tabakanın (E) çıkarılması. (F) Son olarak, bir çekiç ve keski kemik yanal olarak ön ve arka kafa açıklıkları bağlamak için kullanılır. Bu rakamın büyük halini görmek için buraya tıklayın.
4. Beyin Removark
- Dura kaldırın ve ince bir cerrahi neşter (Şekil 3A) kullanılarak damar üstün sagital sinüs hafif bir kesi yakın oluşturmak için cerrahi forseps.
- bundan başka, beyin dorsal yüzeyini kaplayan dura açmak için mikro makas veya Dura-bıçak kullanın.
Not: serebellar tentoryumu (Şekil 3B) 'e uygun dura çıkarılması, özel bir dikkat sonraki beyin kaldırılmasını önlemek bu dura yaprak sağlanması ve alınması gerekir. - Domuz kafası dik (Şekil 3C) yerleştirin.
- Kafa boşluğu (Şekil 3D) dura kaplı zeminden koku ampul künt diseksiyon sayesinde ventroanterior Serebrumu serbest bırakmak için, kemik keski veya dissektörü kullanın.
- Bölümüne maruz optik kiazma (Şekil 3E) ince bir cerrahi neşter kullanın. Hipofiz sapı Okülomotor sinirleri Açığa ve bölüm.
- lo kesit tarafından ventral beyin sapı serbest bırakınince bir cerrahi bisturi ile wer kranyal sinirler (Şekil 3F). Dural serebellar tentoryum tamamen (Şekil 3B) kesilmiştir bu dura yaprak aksi salma işlemi esnasında, beyin sapı yoluyla kesecek şekilde sağlanması.

Şekil 3: MiniPig beyin çıkarılması. Cerrahi forseps ve dura bıçakla (A) Dural açılışı. (B) Bakım tamamen beyin ve beyincik arasında yer alan dura yaprak (ok), kesilirken alınmalıdır. (C), domuz kafası kafa tabanı yapıları daha iyi görülebilmesi için ve yerçekimi beyin amaçlanan yer değiştirmesine yardımcı olmak için sırayla dikey olarak konumlandırılmıştır. (D), bir ayırıcı kesici veya bir kemik keski Dura-covere künt bölümü tarafından koku ampul rahatlatmak için kullanılırd kafa tabanı. (E) diseksiyon kiyazmanın (ok), infundibulum sap Okülomotor sinirlerin maruz kalma ve bölümlere ayırma için kafa tabanı boyunca bir posterior yönde devam edilir. Beyin sapı ventral yüzeyi yola gibi (F), beyin salma alt kranyal sinirlerinin bölümü ile tamamlandı (eden IV troklear sinir, III, Okülomotor sinir V, üçlü sinir ve VI, abdusens). Bu rakamın büyük halini görmek için buraya tıklayın.
5. Hipofiz Kaldırma
- Prolaktin ve kafatası kat (Şekil 4A) 'de çevresindeki dura yaprak (diapragma sella) belirlenmesi.
- Ince bir cerrahi neşter (Şekil 4B) ile hipofiz sapı dura yaprak yanal İnsizyon.
- çukur serbest bırakmak için bir dissektörü kullanınuitary ve hipofiz fossa (Şekil 4C) üzerinden kaldırın.

Şekil 4: MiniPig hipofiz çıkarılması. (A), hipofiz fossa (*) kafatası kat tanımlanır (1, koku ampul, 2, optik kiazma ve PF posterior fossa). (B), dura örtü (Sellar diagphragm, (ok)) yanal olarak kesilir. (C), hipofiz (ok) bir dissektör ile serbest bırakılır ve hipofiz fossa dışına çıkar. Ölçek çubuğu (AC), 10 mm =. Bu rakamın büyük halini görmek için buraya tıklayın.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
kurumasını doku malzeme önlemek için, sabitleştirici veya makroskopik analizi yapılmıştır hemen sonra izotonik tuzlu su ile dolu bir kavanoz içinde ayrılmıştır beyin ve hipofiz saklanması tavsiye edilir. doku materyali, izotonik tuzlu su depolama oysa yıl süreyle tespit sıvısı içerisinde depolanabilir da bir buzdolabı içinde zamanla doku çürümesine neden olur.
Sağlam domuzu beyin doğrudan dondurma 28 için çok büyük ise uzaklaştırıldı hipofiz doğrudan kuru buzla soğutulmuş bir sıvı 2-metilbütan içine daldırma ile hemen dondurulmuştur edilebilir. Bunun yerine, bir önceki toto içinde dondurulmuş ve 40 um kalınlığında kesitler 5, 18 içine kriyostat-kesitli olabilir 9-15 mm kalınlığında paralel koronal doku levhalar halinde, 28 gösterildiği gibi, domuz beyni dilim için tavsiye edilir, 26 28. Alternatif olarak, spesifik beyin alanları olabilir eksiyonu beyninden serbest parçalanmış ya da beyin levha dilimlenmiş ve kesit 30 kesit vibratome, parafin / metakrilat gömme ve mikrotomla kesit 6, 17, 27 ya da dondurma ve kriyostat 6 sonra daha histolojik işleme tabi, 14, 15, 25. Bizim ayarında, domuz leşleri nihayet belirtilen plastik kaplara yerleştirilir ve bunlar toplanır ve biyolojik küçültücü tesisine taşınır kadar özel bir soğuk depo odasında saklanır.
Motorsuz cerrahi araçlarının kullanımı (malzemelerin tablosu), tarif edilen teknik ile (Şekil 1 g> - 3) yaklaşık 15-20 dakika içinde, sağlar, sağlam domuz beyin (Şekil 5AB) çıkarılması, bölünmüş kranyal sinirler ve hipofiz kafatası yere bağlı halde kalır (Şekil 4A). Benzer şekilde, hipofiz sadece dura Sellar diyafram (Şekil 4 ve 5C) örten beyin kaldırılması ve serbest bırakıldıktan sonra, sağlam, uzaklaştırılabilir.
Elde edilen beyin ve / veya hipofiz (Şekil 5), daha sonra, ayrı olarak, doğrudan gözle, büyüklüğü ve hacmi ölçümleri 31 içerebilir makroskopik analizine tabi olabilir. Bu daha küçük beyin plaka 28 içine kesit yönlendirilmiş takip edilebilir kimyasal analiz ve / veya daha başka histolojik hazırlığı, boyama ve mikroskopik analiz 6 için uygun 29s = "xref"> 14, 15, 17, 25, 26, 27.

Şekil 5: MiniPig beyin (A ve B) ve hipofiz (C). (A), beyin, laterodorsal görünüşüdür (BS, beyin sapı CB, beyincik ve CRB, beyin). (B) beyin, ventral görünüş (BS, beyin sapı CB, beyincik ve CRB, beyin). (C), hipofiz, arka görünümü (AH adenohipofiz NH, Nörohipofizden). Ölçek çubuğu (A ve B), 10 mm, (C) = 5 mm =. Bu rakamın büyük halini görmek için buraya tıklayın.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
En çok deneysel nörolojik çalışmalar, CNS'ye erişim ince skull- ve dural-kalınlığıyla kolaylaştırılmaktadır fareler ve sıçanlar gibi küçük hayvan türleri, gerçekleştirilir. Bununla birlikte, domuz, 1, 4, 8, koyun 32 ve insan olmayan primatlar gibi daha büyük bir deney hayvanlarında, bu yapıların önemli kalınlığı kafatası kemik çıkarılması için güçlü bir araçlar (malzemelerin tablo) ve uygun bir giriş noktası (Şekil kullanılmasını gerektirmektedir 2). MSS erişilebilir önce dura yaprakları (Şekiller 3 ve 4) sınırlayan bilgisi gereklidir ve beyin güvenli bir şekilde çıkarılabilir.
Bu hasardan yatan beyin koruyacak gibi, kafatası kemik çıkarılması sırasında bozulmadan dura bırakmak önerilir. Önceki transcardial sabitleme 20 aynı şekilde sertleşmesine ve SLI olabilirghtly kemik ve dural giderme işlemi daha kolay ve güvenlik ile yapılmasına olanak sağlayan, beyin küçültmek. Domuz kafatasının bir özelliği, koyun ve insan olmayan primat aksine, kafatası kemik çıkarma işlemi (Şekil 2) de avantajlı olabilir yaşla Frontal sinüs, progresif açılımıdır. sunulan teknik buna göre tüm büyük hayvan türleri üzerinde kullanılabilir, fakat sadece domuzlar, özellikle daha eski 6 ay içinde, frontal sinüs kafatası kemik çıkarma işleminde yardım sağlamaya yeterli geliştirilecektir. Son olarak, dekapitasyon işlemi (Şekil 1B) ve son beyin yayınlanmadan önce dura serebellar tentoryumu (Şekil 3B) tam kesit sırasında omurilik tam kesit kesinlikle beyin sapı hasar görmesini engellemek için gereklidir.
Bazı çalışmalarda, beyin bağlı rostral servikal spinal kord bir parçası olması avantajlı olabilir.Geçerli video gösterildiği gibi, bu boyun daha kaudal ilk dekapitasyon kesi (Şekil 1A) yerleştirmek yerine, kafatası-boyun birleşme intervertebral servikal disk üzerinden omuriliğe erişim sağlayan elde edilebilir. Posterior kemik kaldırma sonra açıkta kaudal lamina başlamak zorunda kalacak. Bunun dışında, teknik benzer olacaktır, nedenle decapitation bölüm düzeyinde (Şekil 1) en güçlü uzantılı tamamlanmadan önce omurilik tamamen kesitli olması gerektiğini hatırlamak önemlidir. Gerçek dair araştırmalar türetilmiş hipofiz HPLC analizi gerektirdiği şekilde, mevcut işlem, sabitlenmemiş hayvanlar üzerinde gösterilmiştir. , Aynı teknik transkardiyal paraformaldehid 3, 5, 14, 15 ile sabitlenmiş, hayvanlar üzerinde kullanılan Bununla birlikte, dikkat
Bir sonraki paragraflarda açıklandığı gibi, biz motorsuz cerrahi aletler kullanmayı tercih etmişlerdir. 1-2 yaş üzeri domuz kafatası, ancak, sağlam olabilir göstermiştir instr ile kafatası kaldırmauments böyle craniotomes, salınım testereler ve elektrik matkap 32 olarak motorlu araçların kullanımını gerektiren, mümkündür. Bu durumda, hala bu şekilde doğal olarak oluşan kafatası giriş noktaları ve frontal sinüs gelişimi yararlanarak, yukarıda belirtilen protokol adımları izleyin tavsiye edilir. Kafa tabanına sunulan ön erişim zarif ve kolay, fakat koku ampul tarif künt bırakma beyinde (Şekil 3EF) daha arka salınımı aksine, doğrudan görsel rehberlik (Şekil 3D) olmadan yapılmalıdır. koku soğanı karın kısmı bu nedenle serbest bırakma işlemi başlatılmadan önce ampullere üzerinden ventral ön kafa tabanı delinerek, gerekirse sadece önlenebilir kontrolsüz hasar bir dereceye kadar meydana gelebilir. özellikle de kafatası çıkarılması sırasında sabitlenmemiş beyin dokusunun bir işlem,, histolojik sonuçlandığı işaret edilmiştir unutmayın neurotoxicological çalışmalarda 33 hatalı sonuçlara yol açabilir cal koyu nöron eser.
Kafatası kemik çıkarma işlemi, craniotomes, salınım testereler ve elektrik matkap 32 gibi makine ile gerçekleştirilebilir. Bunlar sürecini hızlandırmak olabilir, ama aynı zamanda altta yatan nöral yapılara hasar görme riskini arttıracaktır. Böyle ekipman da masraflı olabilir ve büyük olasılıkla en laboratuvarlara kullanılamaz. Bu nedenle, erişim ve kullanımı kolaydır motorsuz cerrahi ekipmanı (Malzemelerin Tablo) kullanarak geçerli prosedür göstermek için tercih etmişlerdir.
Uygun şekilde kullanıldığında tarif edilen ve gösterilen teknik, ayrıca, makroskopik analiz için uygun olduğu doku parçaları ile sonuçlanır, pozlama ve ölüm sonrası domuz beyni, hipofiz bezi uzaklaştırılmasını, ve / veya servikal spinal kord (Şekil 5) sağlayacaktırBeyin plaka 28 içine kesit "xref"> 5, 6, 19, 26, 31, ve daha sonra kimyasal analiz ve / veya histolojik işleme 6, 14, 15, 16, 17, 25, 26, 27, 31.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Yazarlar ifşa hiçbir şey yok.
Acknowledgments
Yazarlar minnettarlıkla Bayan Trine W. Mikkelsen ve usta yardımı, Montaj Bayan Lise M. ve Påskehøjgaard personeli kabul. Danimarkalı Tıbbi Araştırma Konseyi, Lundbeck Vakfı ve Novo Nordisk Vakfı maddi çalışmayı desteklemiştir.
Materials
| Name | Company | Catalog Number | Comments |
| Heavy Scalpel Handle #4 | FST (Fine Science Tools) | 10008-13 | Good for skin incision and soft tissue removal |
| Non-Sterile Scalpel Blades #23 | FST | 10023-00 | |
| Scalpel Handle #7 | FST | 10007-12 | Optimal for dural incision and precision work |
| Non-Sterile Scalpel Blades #11 | FST | 10011-00 | |
| Surgical Forceps | FST | 11024-18 | The tip of the surgical forceps ensure a firm grip |
| Kerrison Bone Punch | Aesculap Neurosurgery | FF713R | Must be robust, bite size 3-5 mm |
| Bone Rongeur | Aesculap Neurosurgery | MD615 | Must be robust, bite size 15 x 5 mm |
| Bone Rongeur | Aesculap Neurosurgery | FO551R | Must be robust, bite size 25 x 15 mm |
| Bone Chisel | Lawton | 67-0335 | The size of the chisel head should not exceed 20 mm |
| Mallet (Hammer) | Millarco | 5624108 | Weigth 300 g, length 30 cm, head hit area size 2 x 2 cm |
| Micro-Scissor | FST | 14002-14 | |
| Dissector | Aesculap Neurosurgery | OL165R | |
| Göttingen minipigs | Ellegaard Göttingen Minipigs A/S, Denmark | ||
| Euthanimal | pentobarbital | ||
| Ketamine | Pfizer | ||
| Midazolam | Hameln Pharmaceuticals |
References
- Lind, M. N., Moustgaard, A., Jelsing, J., Vajta, G., Cumming, P., Hansen, A. K. The use of pigs in neuroscience: Modeling brain disorders. Neurosci Biobehav Rev. 31, 728-751 (2007).
- Bjarkam, C. R., et al. Neuromodulation in a minipig model of Parkinson disease. British J Neurosurg. 22 (Suppl. 1), S9-S12 (2008).
- Bjarkam, C. R., Cancian, G., Glud, A. N., Ettrup, K. S., Østergaard, L., Sørensen, J. C. MRI-guided stereotaxic targeting in pigs based on a stereotaxic localizer box fitted with an isocentric frame and use of SurgiPlan computer-planning software. J Neurosci Methods. 183 (2), 119-126 (2009).
- Sauleau, P., Lapouble, E., Val-Laillet, D., Malbert, C. H. The pig model in brain imaging and neurosurgery. Animal. 3 (8), 1138-1151 (2009).
- Bjarkam, C. R., et al. Safety and function of a new clinical intracerebral microinjection instrument for stem cells and therapeutics examined in the Göttingen minipig. Stereotact Funct Neurosurg. 88 (1), 56-63 (2010).
- Fjord-Larsen, L., et al. Long-term delivery of nerve growth factor by encapsulated cell biodelivery in the minipig basal forebrain. Mol Therapy. 18 (12), 2164-2172 (2010).
- Sørensen, J. C., et al. Development of neuromodulation treatments in a large animal model - Do neurosurgeons dream of electric pigs? Prog Brain Res. 194, 97-103 (2011).
- Dolezalova, D., et al. Pig models of neurodegenerative disorders: utilization in cell replacement-based preclinical safety and efficacy studies. J Comp Neurol. 522 (12), 2784-2801 (2014).
- Mikkelsen, M., Moller, A., Jensen, L. H., Pedersen, A., Harajehi, J. B., Pakkenberg, H. MPTP-induced Parkinsonism in minipigs: A behavioral, biochemical, and histological study. Neurotoxicol Teratol. 21, 169-175 (1999).
- Danielsen, E. H., et al. The DaNEX study of embryonic mesencephalic, dopaminergic tissue grafted to a minipig model of Parkinson's disease: Preliminary findings of effect of MPTP poisoning on striatal dopaminergic markers. Cell Transplant. 9 (2), 247-259 (2000).
- Dalmose, A., Bjarkam, C. R., Sørensen, J. C., Jørgensen, T. M., Djurhuus, J. C. Effects of high frequency deep brain stimulation on urine storage and voiding function in conscious minipigs. Neurourol Urodyn. 23 (3), 265-272 (2004).
- Dalmose, A., Bjarkam, C. R., Djurhuus, J. C. Stereotactic electrical stimulation of the pontine micturition center in the pig. Br J Urol. 95, 886-889 (2005).
- Andersen, F., Watanabe, H., Bjarkam, C. R., Danielsen, E. H., Cumming, P. The DaNeX Study Group. Pig brain stereotaxic standard space: Mapping of cerebral blood flow normative values and effect of MPTP-lesioning. Brain Res Bull. 66 (1), 17-29 (2005).
- Glud, A. N., et al. Direct gene transfer in the minipig CNS using stereotaxic lentiviral microinjections. Acta Neurobiol Exp. 70 (3), 1-8 (2010).
- Glud, A. N., et al. Direct MRI-guided stereotaxic viral mediated gene transfer of alpha-synuclein in the minipig CNS. Acta Neurobiol Exp. 71 (4), 508-518 (2011).
- Ettrup, K. S., Sørensen, J. C., Rodell, A., Alstrup, A. K. O., Bjarkam, C. R. Hypothalamic deep brain stimulation influences autonomic and limbic circuitry involved in the regulation of aggression and cardiocerebrovascular control in the minipig. Stereotact Funct Neurosurg. 90 (5), 281-291 (2012).
- Nielsen, M. S., et al. Continuous MPTP intoxication in the minipig results in chronic parkinsonian deficits. Acta Neurobiol Exp. 76, 198-210 (2016).
- Bjarkam, C. R., et al. A MRI-compatible stereotaxic localizer box enables high-precision stereotaxic procedures in pigs. J Neurosci Methods. 139 (2), 293-298 (2004).
- Bjarkam, C. R., Jorgensen, R. L., Jensen, K. N., Sunde, N. A. A., Sørensen, J. C. H. Deep brain stimulation electrode anchoring using BioGlue®, a protective electrode covering, and a titanium microplate. J Neurosci Methods. 168, 151-155 (2008).
- Ettrup, K. S., et al. Basic Surgical Techniques in the Minipig: Intubation, Transurethral Bladder Catheterization, Femoral Vessel Catheterization, and Transcardial Perfusion. J Vis Exp. (52), e2652 (2011).
- Ettrup, K. S., Tornøe, J., Sørensen, J. C., Bjarkam, C. R. A surgical device for minimally invasive implantation of experimental deep brain stimulation leads in large research animals. J Neurosci Methods. 200 (1), 41-46 (2011).
- Danielsen, E. H., et al. Positron emission tomography of living brain in minipigs and domestic pigs. Scand J Lab Anim Sci Suppl. 25 (1), 127-135 (1998).
- Røhl, L., et al. Time evolution of cerebral perfusion and ADC measured by MRI in a porcine stroke model. J Magn Reson Imaging. 15 (2), 123-129 (2002).
- Cumming, P., Gillings, N. M., Jensen, S. B., Bjarkam, C. R., Gjedde, A. Kinetics of the uptake and distribution of the dopamine D2/3 agonist (R)-N-[1-11C]n-propylnorapomorphine in brain of healthy and MPTP-poisoned Gottingen miniature pigs. Nucl Med Biol. 30 (5), 547-553 (2003).
- Jensen, K. N., Deding, D., Sørensen, J. C., Bjarkam, C. R. Long-term implantation of deep brain stimulation electrodes in the pontine micturition centre of the minipig. Acta Neurochir. 151 (7), 785-794 (2009).
- Rosendal, F., et al. Does chronic low dose treatment with ciclosporin influence the brain? A histopathological study in pigs. Transplantation Proc. 37 (8), 3305-3308 (2005).
- Nielsen, M. S., Sørensen, J. C., Bjarkam, C. R. The substantia nigra pars compacta of the minipig: An anatomical and stereological study. Brain Struct Funct. (4-5), 481-488 (2009).
- Sørensen, J. C., Bjarkam, C. R., Simonsen, C. Z., Danielsen, E., Geneser, F. A. Oriented sectioning of irregular tissue blocks in relation to computerized scanning modalities. Results from the domestic pig brain. J Neurosci Methods. 104, 93-98 (2000).
- Bjarkam, C. R., Pedersen, M., Sørensen, J. C. New strategies for embedding, orientation and sectioning of small brain specimens enable direct correlation to MR-images, brain atlases, or use of unbiased stereology. J Neurosci Methods. 108, 153-159 (2001).
- Bjarkam, C. R., Sørensen, J. C., Geneser, F. A. Distribution and morphology of serotonin-immunoreactive axons in the hippocampal region of the New Zealand white rabbit. I. Area dentata and hippocampus proper. Hippocampus. 13 (1), 21-37 (2003).
- Bjarkam, C. R., Glud, A. N., Orlowski, D., Sørensen, J. C., Palomero-Gallagher, N. The telencephalon of the minipig, cytoarchitecture and cortical surface anatomy. Brain Struct Funct. , e-pub ahead of print (2016).
- Boltze, J., Nitzsche, B., Geiger, K. D., Schoon, H. A. Histopathological investigation of different MCAO modalities and impact of autologous bone marrow mononuclear cell administration in an ovine stroke model. Transl Stroke Res. 2, 279-293 (2011).
- Jortner, B. S. The return of the dark neuron. A histological artifact complicating contemporary neurotoxicologic evaluation. Neurotoxicology. 27, 628-634 (2006).



