Summary
Målet med dette papir og instruktions video er at beskrive, hvordan at blotlægge og fjerne den post mortem svinehjerne og hypofysen i en intakt tilstand, egnet til efterfølgende makroskopisk og histologisk analyse.
Abstract
Grise er blevet stadig mere populært i store dyr translationel neurovidenskab forskning som en økonomisk og etisk realistisk alternativ til ikke-menneskelige primater. Den store hjerne størrelse grisen tillader anvendelsen af konventionelle kliniske hjerne kameraer og direkte anvendelse og test af neurokirurgiske procedurer og udstyr fra den humane klinik. Yderligere makroskopisk og histologisk analyse kræver imidlertid post mortem eksponering af grisen centralnervesystemet (CNS) og efterfølgende hjerne fjernelse. Dette er ikke en let opgave, som grisen CNS er indkapslet af en tyk, benet kranium og rygsøjle. Målet med dette papir og instruktions video er at beskrive, hvordan at blotlægge og fjerne den post mortem svinehjerne og hypofysen i en intakt tilstand, egnet til efterfølgende makroskopisk og histologisk analyse.
Introduction
Translationelle neurovidenskab studier i svin er blevet mere og mere populær i løbet af de sidste to årtier. Den store størrelse af svinehjerne muliggør anvendelse af konventionelle kliniske hjerne kameraer og direkte anvendelse og test af neurokirurgiske procedurer og udstyr fra den humane klinik 1, 2, 3, 4, 5, 6, 7, 8. I de sidste 20 år, svin, især minigrise (fx, Gottingen minigrise), er blevet anvendt til at undersøge neuromodulatory behandlingsmodaliteter, såsom stamcelletransplantation; virusvektor transfektion; og dybhjemestimulation rettet mod Parkinsons sygdom, fedme, depression og Alzheimers sygdom 2, 6,= "xref"> 9, 10, 11, 12, 13, 14, 15, 16, 17. Dette er blevet fulgt af udviklingen af stereotaksiske og kirurgiske metoder til at manipulere smågris CNS 3, 18, 19, 20, 21. De anlagt CNS ændringer er blevet evalueret i levende dyr ved anvendelse brain imaging (PET 10, 13, 22, 24 og MR 23), cystometri 11, 12, 25, ganganalyse17, neurologisk evaluering 9, 17, og obduktion baseret på histologi og stereologiske analyse 14, 15, 17, 26, 27, 31. Imidlertid post mortem analyse kræver eksponering og fjernelse af svinehjerne, som ikke er en let opgave, som en tyk, benet kranium og et fibrøst dural dækker omgiver svinehjerne.
Målet med dette papir og instruktions video er at beskrive, hvordan den postmortem svinehjerne og hypofyse kan eksponeres og fjernes i en intakt tilstand i 15-20 min under anvendelse af ikke-motoriserede kirurgiske redskaber. Den instruktionsvideo og fotografiske illustrationer viser mandlige minigrise (alder: 6 måneder, legemsvægt: 20-25 kg), der anvendes til en anatomisk undersøgelse minigrise hypofysen.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Animal anæstesi og euthanesia blev udført i overensstemmelse med "Principper for laboratoriedyr pleje" (NIH publikation nr 86-23, revideret 1985) og godkendt af Dansk Råd for Animal Research Ethics.
1. instrumenter
- Saml de instrumenter, der præsenteres i videoen og opført i tabellen of Materials.
2. Decapitation
BEMÆRK: Anæstesi blev induceret ved en intramuskulær injektion af 5 ml af midazolam (5 mg / ml) og 5 ml ketamin (25 mg / ml). 5-10 min senere, når dyret var dybt bedøvet, blev en ørevene kanyleres og en dødelig overdosis (100 mg / kg legemsvægt) af natriumpentobarbital (200 mg / ml) blev givet intravenøst. At sikre, at dyret var fuldstændig aflivet, blev det interdigitale smerte refleks testet som vist ved Ettrup et al. (2011) 20. Komplet euthanization blev sikret som beskrevet iden etiske erklæring ovenfor og efterfulgt af en transkardial perfusion med 5 liter isotonisk saltvand, som påvist af Ettrup et al. (2011) 20. Alle de påviste procedurer udføres obduktion, udelukker behovet for velfærdsydelser nødvendige forholdsregler for langsigtet anæstesi og postprocedural overlevelse.
- Halshugge grisen ved en høj cirkulær cervikal incision, ved anvendelse af en kirurgisk skalpel, lige under kæbevinklen (figur 1A).
- Stadig med den kirurgiske skalpel fortsætte snittet anteriort gennem det bløde væv af halsen, herunder strubehovedet og spiserøret, indtil den benede rygsøjlen er nået, omtrent på niveau med den craniocervical krydset.
- Advance snittet med en kirurgisk skalpel fra den forreste side af craniocervical junction, over den forreste bue af atlas, og gennem den forreste atlantooccipital membranen og derved udsætte rygmarvskanalen og rygmarv (Figur 1B). Samtidig bede en assistent til at trække grisen krop væk fra grisen hovedet for at lette adgangen mellem kraniet base og den første halshvirvel.
- Fortsætte det kirurgiske snit gennem durasækken og rygmarv (figur 1B). Vær særlig omhyggelig med at sikre, at der opnås et komplet tværsnit af rygmarven.
BEMÆRK: Misligholdelse af forrige trin kan resultere i uønsket trækkraft på rygmarven og hjernen i løbet af de følgende trin i halshugning proces. - Kraftigt forlænge cranocervical krydset på hovedafdelingsniveau (figur 1C). Samtidig, bruge den kirurgiske skalpel til afsnittet de resterende atlantooccipital ledbånd at frigive forbindelsen mellem de occipitale kondyler, og øvre artikuleret processen med atlas. Adskil gris hoved fra kroppen.

Figur 1: smågris halshugning. (A) neck indsnit (pil, mandibular vinkel). (B) snit gennem atlantooccipital ledbånd og dura-omgivet rygmarv (SC) på craniocervical motorvej (C1, anterior bue af atlas, OC, occipital kondyl). (C) Den bageste del af atlantooccipital artikulation frigøres ved en kraftig forlængelse (pile) på afsnittet niveau. Klik her for at se en større version af dette tal.
3. Skull Åbning
- Placér gris hoved på et bord.
- Lav en dorsal langsgående snit med en kirurgisk skalpel gennem huden og det underliggende bløde væv fra bagsiden af snuden over toppunktet af hovedet, og ned gennem den bageste del afoccipital regionen.
- Udsætte dorsale og bageste del af kraniet ved at fjerne det bløde væv placeret lateralt for indledende indsnit med et kirurgisk skalpel.
- Slip Tindingmusklen bilateralt fra kraniet (figur 2A) med en kirurgisk skalpel. Sørg for, at den bageste nakkebenet er renset for blødt væv.
- Bruge den bageste indgangen til foramen magnum at fjerne nakkebenet med et Kerrison knogle slag- og knogle knogleafbiddere og eksponere dura-dækket cerebellum (figur 2B).
- Retur til udsatte forreste side af kraniet og vælg en indgang i den frontale knogler, lige foran øjnene. På dette tidspunkt, brug en knogle mejsel med en hammer til at trænge ind i kraniet og ind i frontal sinus (figur 2C).
- Brug omfanget af pandehulen at fremme dorsoposterior fjernelse af den ydre kraniet lamina med en knogle rongeur eller knogle hulning og eksponere den indre, tyndebenede kranium lamina dækker cerebrum (figur 2D).
- Åbn forsigtigt den indre benede kraniet lamina fortil med en hammer og en knogle mejsel at eksponere dura-dækket cerebrum (Figur 2E).
- Fortsætte fjernelsen knogle sideværts ved hjælp af en knogle mejsel og en knogle rongeur gennem den tidsmæssige og isseben for at frigive den sidste dorsoposterior del af kraniet, som ligger mellem de allerede udsatte dele af dura-dækket cerebrum og cerebellum (figur 2F).
BEMÆRK: Det er ofte muligt, under det sidste trin i denne procedure, for at bruge mejslen til at bryde åbne den resterende bageste kraniet fra den ene side, ligesom man åbner en dør.
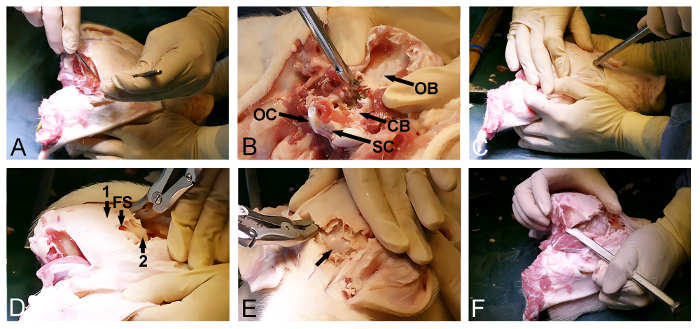
Figur 2: smågris skull åbning. (A) Eksponering af dorsoposterior kranium overflade, herunder fjernelse af occipital og tidsmæssige muskler. (B) Fjernelse af nakkebenet (CB, dura-dækket cerebellum, OB, occipital knogle; OC, occipital condylus og SC, rygmarv). (C) En hammer og en knogle mejsel bruges til at trænge ind i kraniet fortil og at indtaste den frontale sinus på niveau med øjnene. (D) Omfanget af det frontale sinus (FS) anvendes til at fjerne den ydre tykke kraniet (1), og udsætter en indre tynd knogle lamina (2), der dækker cerebrum. (E) Fjernelse af den tynde knogle lamina, udsætter dura-dækket cerebrum (pil). (F) Endelig er en hammer og en knogle mejsel bruges til sideværts forbinde den forreste og bageste kraniet åbninger. Klik her for at se en større version af dette tal.
4. Brain aftal
- Brug kirurgiske pincet til at løfte dura og skabe en blid indsnit tæt på venøse superior sagittale sinus anvendelse af en fin kirurgisk skalpel (figur 3A).
- Bruge mikro-saks eller en dura-kniv til yderligere at åbne dura dækker den dorsale overflade af hjernen.
BEMÆRK: Særlig omhu skal udvises forsigtighed ved fjernelse af dura svarende til cerebellar tentorium (figur 3B), som bevarelse af denne dural blad vil forhindre efterfølgende hjerne fjernelse. - Placer grisehoved vertikalt (figur 3C).
- Brug knoglen mejsel eller en dissektor til frigivelse af ventroanterior cerebrum ved stump dissektion af lugtekolben fra dura-dækket gulvet i kraniehulen (figur 3D).
- Bruge en fin kirurgisk skalpel til sektionen eksponerede optiske chiasm (figur 3E). Afsløre og afsnittet hypofysen stilk og oculomotor nerver.
- Slip ventrale hjernestammen ved sektionering af lower kranienerverne (figur 3F) med et fint kirurgisk skalpel. Sikre, at durale cerebellar tentorium blev fuldstændig indsnit (figur 3B), da dette dural blad ellers vil skære gennem hjernestammen under frigørelsen proces.

Figur 3: smågris hjerne fjernelse. (A) Dural åbning med kirurgiske pincet og en dura kniv. (B) Der skal udvises forsigtighed for helt incise den dural blad (pil), som ligger mellem cerebrum og cerebellum. (C) Grisen hoved er placeret lodret for bedre visualisering af kraniet basisstrukturer og for at tyngdekraften til at hjælpe med den tilsigtede forskydning af hjernen. (D) En dissektor eller en knogle mejsel bruges til at lindre lugtekolben ved stump afsnit fra dura-covered kraniet base. (E) Dissektionen fortsættes i en posterior retning langs kraniet base for eksponering og sektionering af den optiske chiasm (pil), infundibular stilk, og oculomotor nerver. (F) Hjernen frigivelse er afsluttet med det afsnit af de nedre kraniale nerver som de afviger fra det ventrale overflade af hjernestammen (III, oculomotor nerve IV, trochlear nerve V, trigeminal nerve og VI, abducens nerve). Klik her for at se en større version af dette tal.
5. Hypofyse Removal
- Identificere hypofysen stilk og dens omgivende dural blad (den diapragma sellae) i kraniet gulv (figur 4A).
- Incise dural blad lateralt til hypofysen stilk anvendelse af en fin kirurgisk skalpel (figur 4B).
- Brug en dissektor at frigive pituitary og løfte den ud af hypofyse fossa (figur 4C).

Figur 4: smågris hypofyse fjernelse. (A) Hypofyse fossa (*) identificeres i kraniet gulv (1, lugtekolben, 2, optik chiasm og PF, posterior kraniel fossa). (B) Den dural afdækning (Sellar diagphragm, (pil)) er indskåret lateralt. (C) Hypofysen (pil) frigives med en dissektor og løftes ud af hypofysen fossa. Målestokken (AC) = 10 mm. Klik her for at se en større version af dette tal.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
At forhindre vævet materiale tørrer ud, anbefales det at opbevare den fjernede hjerne og hypofyse i en krukke fyldt med fiksativ eller isotonisk saltvand umiddelbart efter at der er udført makroskopisk analyse. Vævet materiale kan opbevares i fiksativ i år, mens opbevaring i isotonisk saltopløsning, selv i et køleskab, vil føre til væv henfald med tiden.
Den fjernede hypofyse kan også fryses direkte ved nedsænkning i tør isafkølet flydende 2-methylbutan, hvorimod den intakte svinehjerne er for stort til direkte nedfrysning 28. Det anbefales i stedet at skære svinehjerne, som tidligere demonstreret 28, i 9-15 mm tykke parallelle koronale væv plader, der kan fryses i toto og kryostat-sektioneret i 40 um tykke snit 5, 18, 26, 28. Alternativt kan specifikke hjerneområder være frit dissekeret fra den fjernede intakt hjerne eller snittede hjerne plade og underkastes videre histologisk behandling efter vibratom sektionering 30, paraffin / methacrylat indlejring og mikrotom sektionering 6, 17, 27, eller frysning og kryostat sektionering 6, 14, 15, 25. I vores indstilling bliver svinekroppe sættes til sidst i specificerede plastbeholdere og lagres i en dedikeret kølerum, indtil de indsamles og transporteres til et biologisk nedbrydende facilitet.
Med brug af ikke-motoriserede kirurgiske redskaber (tabel af materialer), den beskrevne teknik (figur 1 g> - 3) gør det muligt, i ca. 15-20 min, fjernelse af den intakte svinehjerne (fig 5AB), mens de afhuggede kraniale nerver og hypofyse forblive forbundet til kraniet gulv (figur 4A). Ligeledes kan hypofysen simpelthen fjernes, intakt efter fjernelse af overliggende hjernen og frigivelse af den durale Sellar membran (figur 4 og 5C).
Den resulterende hjerne og / eller hypofyse (figur 5) kan efterfølgende indgives til makroskopisk analyse, at bortset fra direkte visuel inspektion, kan indbefatte størrelse og volumenmålinger 31. Dette kan efterfølges af orienteret sektionering i mindre hjerne plader 28, 29 er egnet til kemisk analyse og / eller yderligere histologisk præparat, farvning og mikroskopisk analyse 6,s = "xref"> 14, 15, 17, 25, 26, 27.

Figur 5: Smågris hjerne (A og B) og hypofyse (C). (A) Brain, laterodorsal visning (BS, hjernestammen, CB, cerebellum og CRB, cerebrum). (B) Brain, ventral visning (BS, hjernestammen, CB, cerebellum og CRB, cerebrum). (C) hypofyse, posterior view (AH, adenohypophysis og NH, neurohypophysis). Målestokken (A og B) = 10 mm, (C) = 5 mm. Klik her for at se en større version af dette tal.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Fleste eksperimentelle neurovidenskab undersøgelser udføres i små dyrearter, såsom mus og rotter, hvor adgang til CNS lettes af en tynd skull- og dural-tykkelse. Men i større forsøgsdyr som grise 1, 4, 8, får 32, og ikke-humane primater, den betydelige tykkelse af disse strukturer nødvendiggør anvendelsen af robuste instrumenter (table af materialer) og ordentlige indgange til kraniet fjernelse (Figur 2). Viden begrænse duremæssige blade (figur 3 og 4) er nødvendig, før CNS kan tilgås og hjernen fjernes sikkert.
Det anbefales at lade dura intakt under kraniet fjernelse, da dette vil beskytte den underliggende hjernen mod skader. Tidligere transcardial fiksering 20 kan ligeledes hærde og SLIghtly skrumpe hjernen, hvilket tillader knoglen og dural fjernelsesproces, der skal udføres med større lethed og sikkerhed. Et særligt træk ved grisen kraniet, i modsætning til får og ikke-human primat, er den gradvise udvidelse af den frontale sinus med alderen, hvilket kan være fordelagtigt i kraniet fjernelsesprocessen (figur 2). De præsenterede teknik kan derfor anvendes på alle store dyrearter, men kun i grise, især dem ældre end 6 måneder vil frontal sinus udvikles nok til at give støtte i kraniet fjernelsen. Endelig er fuldstændig skæring af rygmarven under halshugning proces (figur 1 B) og fuldstændig sektionering af den durale cerebellar tentorium (figur 3B) før den endelige hjerne frigivelse absolut nødvendig for at undgå efterfølgende skade på hjernestammen.
I nogle studier, kan det være fordelagtigt at have en del af den rostrale cervikalrygmarv fastgjort til hjernen.Dette kan opnås ved at anbringe den indledende halshugning indsnit (figur 1A) mere kaudalt på halsen, som giver adgang til rygmarven gennem en intervertebral nakken i stedet for den craniocervical krydset, som demonstreret i den aktuelle video. Fjernelsen bageste ben vil derefter nødt til at starte fra den eksponerede halefinnen lamina. Bortset fra dette, vil teknikken være ens, så det er vigtigt at huske, at rygmarven skal være helt sektioneret før halshugning er færdig med kraftig udvidelse på afsnittet niveau (figur 1). Den nuværende procedure påvises på ufikserede dyr, som den faktiske baggrund undersøgelse nødvendiggjorde HPLC-analyse af den afledte hypofyse. Bemærk dog, at den nøjagtige samme teknik anvendes på dyr transcardialt fikseret med paraformaldehyd 3, 5, 14, 15,
Som omtalt i de næste afsnit, har vi foretrak at bruge ikke-motoriserede kirurgiske værktøjer. Kraniet af svin over 1-2 år alderen kan imidlertid være så robust, at kraniet fjernelse med den påviste instruments ikke er mulig, hvilket nødvendiggør anvendelse af motoriserede instrumenter såsom kraniotomer, oscillerende save, og elektriske boremaskiner 32. I så fald anbefales det stadig at følge protokoltrin ovenfor angivne således udnytter de naturligt forekommende kranium indgangspunkter og udvikling frontal sinus. Den præsenterede anterior adgang til kraniet base er elegant og let, men den beskrevne stump frigivelse af de olfaktoriske pærer skal udføres uden direkte visuel vejledning (figur 3D), i modsætning til den mere bageste frigivelse af hjernen (figur 3EF). Den ventrale del af de olfaktoriske pærer kan derfor lide nogen grad af ukontrolleret skader, som kun kan undgås, hvis det er nødvendigt, ved at bore den forreste cranii ud ventrale til pærerne før frigivelse igangsættes. Bemærk, at manipulation, især af ikke-fikserede hjernevæv under kraniet fjernelse, er blevet angivet at resultere i histologi cal mørk neuron artefakt, hvilket kan føre til fejlagtige konklusioner i neurotoksikologiske undersøgelser 33.
Fjernelsesprocessen kraniet kan også udføres med maskiner ligesom kraniotomer, oscillerende save, og elektriske boremaskiner 32. Disse kan fremskynde processen, men de vil også øge risikoen for skader på de underliggende neurale strukturer. Sådant udstyr kan også være dyrt og vil højst sandsynligt være utilgængelige for de fleste laboratorier. Vi har derfor foretrukket at demonstrere den nuværende procedure ved hjælp af ikke-motoriseret kirurgisk udstyr (tabel of Materials), der er nemt at få adgang til og bruge.
Den beskrevne og illustrerede teknik vil, når de anvendes korrekt, muliggøre eksponeringen og fjernelse af postmortem svinehjerne, hypofyse, og / eller cervikale rygmarv (figur 5), hvilket resulterer i vævsstykker, der er velegnede til yderligere makroskopisk analyse"xref"> 5, 6, 19, 26, 31, sektionering i hjernen plader 28, og efterfølgende kemisk analyse og / eller histologisk bearbejdning 6, 14, 15, 16, 17, 25, 26, 27, 31.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Forfatterne har intet at afsløre.
Acknowledgments
Forfatterne anerkender med taknemmelighed den dygtige bistand fra fru Trine W. Mikkelsen, fru Lise M. Fitting, og personalet på Påskehøjgaard. Den danske Sundhedsvidenskabelige Forskningsråd, Lundbeckfonden og Novo Nordisk Fonden støttes økonomisk undersøgelsen.
Materials
| Name | Company | Catalog Number | Comments |
| Heavy Scalpel Handle #4 | FST (Fine Science Tools) | 10008-13 | Good for skin incision and soft tissue removal |
| Non-Sterile Scalpel Blades #23 | FST | 10023-00 | |
| Scalpel Handle #7 | FST | 10007-12 | Optimal for dural incision and precision work |
| Non-Sterile Scalpel Blades #11 | FST | 10011-00 | |
| Surgical Forceps | FST | 11024-18 | The tip of the surgical forceps ensure a firm grip |
| Kerrison Bone Punch | Aesculap Neurosurgery | FF713R | Must be robust, bite size 3-5 mm |
| Bone Rongeur | Aesculap Neurosurgery | MD615 | Must be robust, bite size 15 x 5 mm |
| Bone Rongeur | Aesculap Neurosurgery | FO551R | Must be robust, bite size 25 x 15 mm |
| Bone Chisel | Lawton | 67-0335 | The size of the chisel head should not exceed 20 mm |
| Mallet (Hammer) | Millarco | 5624108 | Weigth 300 g, length 30 cm, head hit area size 2 x 2 cm |
| Micro-Scissor | FST | 14002-14 | |
| Dissector | Aesculap Neurosurgery | OL165R | |
| Göttingen minipigs | Ellegaard Göttingen Minipigs A/S, Denmark | ||
| Euthanimal | pentobarbital | ||
| Ketamine | Pfizer | ||
| Midazolam | Hameln Pharmaceuticals |
References
- Lind, M. N., Moustgaard, A., Jelsing, J., Vajta, G., Cumming, P., Hansen, A. K. The use of pigs in neuroscience: Modeling brain disorders. Neurosci Biobehav Rev. 31, 728-751 (2007).
- Bjarkam, C. R., et al. Neuromodulation in a minipig model of Parkinson disease. British J Neurosurg. 22 (Suppl. 1), S9-S12 (2008).
- Bjarkam, C. R., Cancian, G., Glud, A. N., Ettrup, K. S., Østergaard, L., Sørensen, J. C. MRI-guided stereotaxic targeting in pigs based on a stereotaxic localizer box fitted with an isocentric frame and use of SurgiPlan computer-planning software. J Neurosci Methods. 183 (2), 119-126 (2009).
- Sauleau, P., Lapouble, E., Val-Laillet, D., Malbert, C. H. The pig model in brain imaging and neurosurgery. Animal. 3 (8), 1138-1151 (2009).
- Bjarkam, C. R., et al. Safety and function of a new clinical intracerebral microinjection instrument for stem cells and therapeutics examined in the Göttingen minipig. Stereotact Funct Neurosurg. 88 (1), 56-63 (2010).
- Fjord-Larsen, L., et al. Long-term delivery of nerve growth factor by encapsulated cell biodelivery in the minipig basal forebrain. Mol Therapy. 18 (12), 2164-2172 (2010).
- Sørensen, J. C., et al. Development of neuromodulation treatments in a large animal model - Do neurosurgeons dream of electric pigs? Prog Brain Res. 194, 97-103 (2011).
- Dolezalova, D., et al. Pig models of neurodegenerative disorders: utilization in cell replacement-based preclinical safety and efficacy studies. J Comp Neurol. 522 (12), 2784-2801 (2014).
- Mikkelsen, M., Moller, A., Jensen, L. H., Pedersen, A., Harajehi, J. B., Pakkenberg, H. MPTP-induced Parkinsonism in minipigs: A behavioral, biochemical, and histological study. Neurotoxicol Teratol. 21, 169-175 (1999).
- Danielsen, E. H., et al. The DaNEX study of embryonic mesencephalic, dopaminergic tissue grafted to a minipig model of Parkinson's disease: Preliminary findings of effect of MPTP poisoning on striatal dopaminergic markers. Cell Transplant. 9 (2), 247-259 (2000).
- Dalmose, A., Bjarkam, C. R., Sørensen, J. C., Jørgensen, T. M., Djurhuus, J. C. Effects of high frequency deep brain stimulation on urine storage and voiding function in conscious minipigs. Neurourol Urodyn. 23 (3), 265-272 (2004).
- Dalmose, A., Bjarkam, C. R., Djurhuus, J. C. Stereotactic electrical stimulation of the pontine micturition center in the pig. Br J Urol. 95, 886-889 (2005).
- Andersen, F., Watanabe, H., Bjarkam, C. R., Danielsen, E. H., Cumming, P. The DaNeX Study Group. Pig brain stereotaxic standard space: Mapping of cerebral blood flow normative values and effect of MPTP-lesioning. Brain Res Bull. 66 (1), 17-29 (2005).
- Glud, A. N., et al. Direct gene transfer in the minipig CNS using stereotaxic lentiviral microinjections. Acta Neurobiol Exp. 70 (3), 1-8 (2010).
- Glud, A. N., et al. Direct MRI-guided stereotaxic viral mediated gene transfer of alpha-synuclein in the minipig CNS. Acta Neurobiol Exp. 71 (4), 508-518 (2011).
- Ettrup, K. S., Sørensen, J. C., Rodell, A., Alstrup, A. K. O., Bjarkam, C. R. Hypothalamic deep brain stimulation influences autonomic and limbic circuitry involved in the regulation of aggression and cardiocerebrovascular control in the minipig. Stereotact Funct Neurosurg. 90 (5), 281-291 (2012).
- Nielsen, M. S., et al. Continuous MPTP intoxication in the minipig results in chronic parkinsonian deficits. Acta Neurobiol Exp. 76, 198-210 (2016).
- Bjarkam, C. R., et al. A MRI-compatible stereotaxic localizer box enables high-precision stereotaxic procedures in pigs. J Neurosci Methods. 139 (2), 293-298 (2004).
- Bjarkam, C. R., Jorgensen, R. L., Jensen, K. N., Sunde, N. A. A., Sørensen, J. C. H. Deep brain stimulation electrode anchoring using BioGlue®, a protective electrode covering, and a titanium microplate. J Neurosci Methods. 168, 151-155 (2008).
- Ettrup, K. S., et al. Basic Surgical Techniques in the Minipig: Intubation, Transurethral Bladder Catheterization, Femoral Vessel Catheterization, and Transcardial Perfusion. J Vis Exp. (52), e2652 (2011).
- Ettrup, K. S., Tornøe, J., Sørensen, J. C., Bjarkam, C. R. A surgical device for minimally invasive implantation of experimental deep brain stimulation leads in large research animals. J Neurosci Methods. 200 (1), 41-46 (2011).
- Danielsen, E. H., et al. Positron emission tomography of living brain in minipigs and domestic pigs. Scand J Lab Anim Sci Suppl. 25 (1), 127-135 (1998).
- Røhl, L., et al. Time evolution of cerebral perfusion and ADC measured by MRI in a porcine stroke model. J Magn Reson Imaging. 15 (2), 123-129 (2002).
- Cumming, P., Gillings, N. M., Jensen, S. B., Bjarkam, C. R., Gjedde, A. Kinetics of the uptake and distribution of the dopamine D2/3 agonist (R)-N-[1-11C]n-propylnorapomorphine in brain of healthy and MPTP-poisoned Gottingen miniature pigs. Nucl Med Biol. 30 (5), 547-553 (2003).
- Jensen, K. N., Deding, D., Sørensen, J. C., Bjarkam, C. R. Long-term implantation of deep brain stimulation electrodes in the pontine micturition centre of the minipig. Acta Neurochir. 151 (7), 785-794 (2009).
- Rosendal, F., et al. Does chronic low dose treatment with ciclosporin influence the brain? A histopathological study in pigs. Transplantation Proc. 37 (8), 3305-3308 (2005).
- Nielsen, M. S., Sørensen, J. C., Bjarkam, C. R. The substantia nigra pars compacta of the minipig: An anatomical and stereological study. Brain Struct Funct. (4-5), 481-488 (2009).
- Sørensen, J. C., Bjarkam, C. R., Simonsen, C. Z., Danielsen, E., Geneser, F. A. Oriented sectioning of irregular tissue blocks in relation to computerized scanning modalities. Results from the domestic pig brain. J Neurosci Methods. 104, 93-98 (2000).
- Bjarkam, C. R., Pedersen, M., Sørensen, J. C. New strategies for embedding, orientation and sectioning of small brain specimens enable direct correlation to MR-images, brain atlases, or use of unbiased stereology. J Neurosci Methods. 108, 153-159 (2001).
- Bjarkam, C. R., Sørensen, J. C., Geneser, F. A. Distribution and morphology of serotonin-immunoreactive axons in the hippocampal region of the New Zealand white rabbit. I. Area dentata and hippocampus proper. Hippocampus. 13 (1), 21-37 (2003).
- Bjarkam, C. R., Glud, A. N., Orlowski, D., Sørensen, J. C., Palomero-Gallagher, N. The telencephalon of the minipig, cytoarchitecture and cortical surface anatomy. Brain Struct Funct. , e-pub ahead of print (2016).
- Boltze, J., Nitzsche, B., Geiger, K. D., Schoon, H. A. Histopathological investigation of different MCAO modalities and impact of autologous bone marrow mononuclear cell administration in an ovine stroke model. Transl Stroke Res. 2, 279-293 (2011).
- Jortner, B. S. The return of the dark neuron. A histological artifact complicating contemporary neurotoxicologic evaluation. Neurotoxicology. 27, 628-634 (2006).



