Summary
इस पत्र और अनुदेशात्मक वीडियो के लक्ष्य को बेनकाब और एक अक्षुण्ण राज्य, बाद में स्थूल और ऊतकीय विश्लेषण के लिए उपयुक्त में पोस्टमार्टम सुअर मस्तिष्क और पिट्यूटरी ग्रंथि को निकालने का तरीका वर्णन करने के लिए है।
Abstract
सूअर गैर मानव प्राइमेट के लिए एक आर्थिक रूप से और नैतिकता की दृष्टि से व्यवहार्य विकल्प के रूप में बड़े पशु अनुवादकीय तंत्रिका विज्ञान अनुसंधान के क्षेत्र में तेजी से लोकप्रिय हो गए हैं। सुअर की बड़ी मस्तिष्क के आकार पारंपरिक नैदानिक मस्तिष्क imagers और प्रत्यक्ष उपयोग और मानव क्लिनिक से तंत्रिकाशल्यक प्रक्रियाओं और उपकरणों के परीक्षण के उपयोग की अनुमति देता है। इसके अलावा स्थूल और ऊतकीय विश्लेषण, तथापि, सुअर केंद्रीय तंत्रिका तंत्र (सीएनएस) और बाद में मस्तिष्क को हटाने का पोस्टमार्टम जोखिम की आवश्यकता है। यह एक आसान काम, सुअर के रूप में सीएनएस एक मोटी, बोनी खोपड़ी और मेरूदंड से समझाया गया है नहीं है। इस पत्र और अनुदेशात्मक वीडियो के लक्ष्य को बेनकाब और पोस्टमार्टम सुअर मस्तिष्क और एक अक्षुण्ण राज्य में पिट्यूटरी ग्रंथि, बाद में स्थूल और ऊतकीय विश्लेषण के लिए उपयुक्त निकालने का तरीका वर्णन करने के लिए है।
Introduction
सूअरों में अनुवादकीय तंत्रिका विज्ञान के अध्ययन के पिछले दो दशकों के दौरान तेजी से लोकप्रिय हो गए हैं। सुअर मस्तिष्क के बड़े आकार के पारंपरिक नैदानिक मस्तिष्क imagers और प्रत्यक्ष उपयोग और तंत्रिकाशल्यक प्रक्रियाओं और मानव क्लिनिक 1, 2, 3, 4, 5, 6, 7, 8 से उपकरणों की परीक्षण के उपयोग सक्षम बनाता है। पिछले 20 वर्षों में, सूअर, विशेष रूप से minipigs (जैसे, गौटिंगेन minipig), इस तरह के स्टेम सेल प्रत्यारोपण के रूप में neuromodulatory उपचार रूपरेखा, जांच करने के लिए इस्तेमाल किया गया है; वायरल वेक्टर अभिकर्मक; और गहरी मस्तिष्क उत्तेजना पार्किंसंस रोग मोटापा, अवसाद, और अल्जाइमर रोग 2, 6 की ओर निर्देशित,= "xref"> 9, 10, 11, 12, 13, 14, 15, 16, 17। यह stereotaxic और शल्य चिकित्सा के दृष्टिकोण के विकास के द्वारा minipig सीएनएस 3, 18, 19, 20, 21 में हेरफेर करने के पालन किया गया है। की शुरूआत की सीएनएस परिवर्तन ब्रेन इमेजिंग का उपयोग कर (पीईटी 10, 13, 22, 24 और एमआर 23), cystometry 11, 12, 25 जीवित पशुओं में मूल्यांकन किया गया है, चाल विश्लेषण17, मस्तिष्क संबंधी मूल्यांकन 9, 17, और ऊतक विज्ञान और stereological विश्लेषण 14, 15, 17, 26, 27, 31 के आधार पर शवपरीक्षा परीक्षा। हालांकि, पोस्टमार्टम विश्लेषण जोखिम और सुअर मस्तिष्क है, जो एक आसान काम नहीं है को हटाने, एक मोटी, बोनी खोपड़ी और एक रेशेदार सुअर मस्तिष्क के चारों ओर कवर Dural के रूप में की आवश्यकता है।
इस पत्र और अनुदेशात्मक वीडियो के लक्ष्य को कैसे पोस्टमार्टम सुअर मस्तिष्क और पिट्यूटरी गैर मोटर चालित शल्य उपकरण का उपयोग कर 15-20 मिनट में उजागर किया है और हटाया जा सकता है एक अक्षुण्ण राज्य में वर्णन करने के लिए है। minipig पिट्यूटरी ग्रंथि पर एक संरचनात्मक अध्ययन के लिए इस्तेमाल अनुदेशात्मक वीडियो और फोटो चित्र पुरुष minipigs (:: 6 महीने, वजन 20-25 किलो उम्र) दिखा।
Subscription Required. Please recommend JoVE to your librarian.
Protocol
पशु संज्ञाहरण और euthanesia (एनआईएच प्रकाशन सं 86-23, 1985 संशोधित) और पशु अनुसंधान नीतिशास्त्र के लिए डेनिश परिषद द्वारा अनुमोदित "प्रयोगशाला पशु देखभाल के सिद्धांत" के अनुसार किया गया था।
1. उपकरण
- उपकरणों वीडियो में प्रस्तुत किया और सामग्री की तालिका में सूचीबद्ध इकट्ठा।
2. सिरच्छेदन
नोट: संज्ञाहरण midazolam 5 एमएल (5 मिलीग्राम / एमएल) और ketamine 5 एमएल (25 मिलीग्राम / एमएल) के एक इंट्रामस्क्युलर इंजेक्शन द्वारा प्रेरित किया गया था। 5-10 मिनट के बाद, जब पशु गहरा बेहोश किया गया था, एक कान नस cannulated किया गया था और सोडियम pentobarbital की एक घातक अधिक मात्रा (100 मिग्रा / वजन की किग्रा) (200 मिलीग्राम / एमएल) नसों के द्वारा दिया गया था। यह सुनिश्चित करें कि जानवर पूरी तरह से euthanized किया गया था, इंटरडिजिटल दर्द पलटा के रूप में Ettrup एट अल द्वारा दिखाया गया परीक्षण किया गया था। (2011) 20। में वर्णित के रूप पूरा euthanization यह सुनिश्चित किया गया थानैतिकता बयान से ऊपर और के रूप में Ettrup एट अल द्वारा प्रदर्शन किया isotonic खारा के 5 एल के साथ एक transcardial छिड़काव के बाद,। (2011) 20। सभी का प्रदर्शन किया प्रक्रियाओं पोस्टमार्टम प्रदर्शन कर रहे हैं, लंबी अवधि के संज्ञाहरण और postprocedural अस्तित्व के लिए आवश्यक कल्याण सावधानियों के लिए की जरूरत प्रतिबंधित।
- एक उच्च परिपत्र ग्रीवा चीरा द्वारा सुअर सिर काटना, बस जबड़े कोण (चित्रा 1 ए) के नीचे एक शल्य चिकित्सा स्केलपेल का उपयोग कर,।
- फिर भी शल्य छुरी के साथ, चीरा पूर्व से गला और घेघा सहित गर्दन, के कोमल ऊतक के माध्यम से, जारी रखने के लिए जब तक बोनी मेरूदंड लगभग craniocervical जंक्शन के स्तर पर पहुंच गया है।
- craniocervical जंक्शन के पूर्वकाल की ओर से एक शल्य चिकित्सा स्केलपेल के साथ कटौती अग्रिम, एटलस के पूर्वकाल चाप से ऊपर, और पूर्वकाल atlantooccipital झिल्ली के माध्यम से है, जिससे रीढ़ की हड्डी में नहर और रीढ़ की हड्डी को उजागर (चित्रा 1 बी)। इसके साथ ही खोपड़ी आधार है और पहले ग्रीवा बांस के बीच पहुंच कम करने के लिए सुअर सिर से दूर सुअर शरीर को खींचने के लिए एक सहायक के लिए कहें।
- Dural थैली और रीढ़ की हड्डी (चित्रा 1 बी) के माध्यम से शल्य चीरा जारी रखें। यह सुनिश्चित करें कि रीढ़ की हड्डी की एक पूरी अनुप्रस्थ अनुभाग हासिल की है विशेष ख्याल रखना।
नोट: पिछले चरण कत्ल की प्रक्रिया के लिए निम्न चरण के दौरान रीढ़ की हड्डी और मस्तिष्क पर अवांछित कर्षण में हो सकता है प्रदर्शन करने में विफलता। - जबरदस्ती खंड स्तर (चित्रा 1C) पर cranocervical जंक्शन का विस्तार। इसी समय, पश्चकपाल condyles और एटलस के ऊपरी मुखर प्रक्रिया के बीच अभिव्यक्ति रिलीज करने के लिए शेष atlantooccipital स्नायुबंधन अनुभाग के लिए शल्य चिकित्सा स्केलपेल का उपयोग करें। शरीर से अलग करें सुअर सिर।

चित्र 1: Minipig कत्ल। (ए) गर्दन चीरा (तीर, जबड़े कोण)। (; OC, पश्चकपाल कंद सी 1, एटलस के पूर्वकाल चाप) (बी) atlantooccipital स्नायुबंधन और craniocervical जंक्शन पर ड्यूरा-घिरा रीढ़ की हड्डी (अनुसूचित जाति) के माध्यम से चीरा। (सी) atlantooccipital अभिव्यक्ति के पीछे भाग खंड स्तर पर एक सशक्त विस्तार (तीर) द्वारा जारी की है। यह आंकड़ा का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।
3. खोपड़ी उद्घाटन
- एक मेज पर सुअर सिर पर रखें।
- त्वचा और थूथन के पीछे, सिर के शीर्ष भर से अंतर्निहित कोमल ऊतकों के माध्यम से एक शल्य चिकित्सा स्केलपेल के साथ एक पृष्ठीय अनुदैर्ध्य चीरा करें, और नीचे के पीछे भाग के माध्यम सेपश्चकपाल क्षेत्र।
- मुलायम एक शल्य चिकित्सा स्केलपेल के साथ प्रारंभिक चीरा के लिए पार्श्व स्थित ऊतक को हटाने के द्वारा खोपड़ी के पृष्ठीय और पीछे भाग बेनकाब।
- खोपड़ी (चित्रा 2 ए) एक शल्य चिकित्सा स्केलपेल के साथ से द्विपक्षीय रूप से अस्थायी मांसपेशियों को छोड़ दें। सुनिश्चित करें कि पीछे पश्चकपाल हड्डी नरम ऊतक के साफ किया जाता है सुनिश्चित करें।
- एक Kerrison हड्डी पंच और अस्थि Rongeurs साथ पश्चकपाल हड्डी को हटाने और ड्यूरा से ढके सेरिबैलम (चित्रा 2 बी) को बेनकाब करने के रंध्र मैग्नम के पीछे प्रवेश द्वार का प्रयोग करें।
- खोपड़ी के संपर्क में पूर्वकाल पक्ष पर लौटें और ललाट की हड्डी में एक प्रविष्टि बिंदु का चयन, बस आँखों के सामने। इस बिंदु पर, खोपड़ी घुसना और ललाट साइनस (चित्रा 2C) में प्रवेश के लिए एक हथौड़ा के साथ एक हड्डी छेनी का उपयोग करें।
- एक हड्डी rongeur या हड्डी पंच के साथ बाहरी खोपड़ी लामिना का dorsoposterior हटाने को आगे बढ़ाने के ललाट साइनस की हद तक का प्रयोग करें और बेनकाब भीतरी, पतलीबोनी खोपड़ी लामिना मस्तिष्क (चित्रा 2 डी) को कवर।
- धीरे ड्यूरा से ढके मस्तिष्क (चित्रा 2 ई) का पर्दाफाश करने के लिए एक हथौड़ा और एक हड्डी छेनी से पूर्व से भीतरी बोनी खोपड़ी पटल खोलने।
- हड्डी हटाने जारी पार्श्व आदेश खोपड़ी के अंतिम dorsoposterior हिस्सा, ड्यूरा से ढके मस्तिष्क और सेरिबैलम (चित्रा 2F) की पहले से ही उजागर भागों के बीच स्थित जारी करने के लिए अस्थायी और पार्श्विका हड्डी के माध्यम से एक हड्डी छेनी और एक अस्थि rongeur का उपयोग कर।
नोट: यह, इस प्रक्रिया के अंतिम चरण के दौरान, अक्सर संभव है एक तरफ से खुला शेष पीछे खोपड़ी की हड्डी तोड़ने के लिए, एक एक दरवाजा खुलता है जैसे छेनी उपयोग करने के लिए।
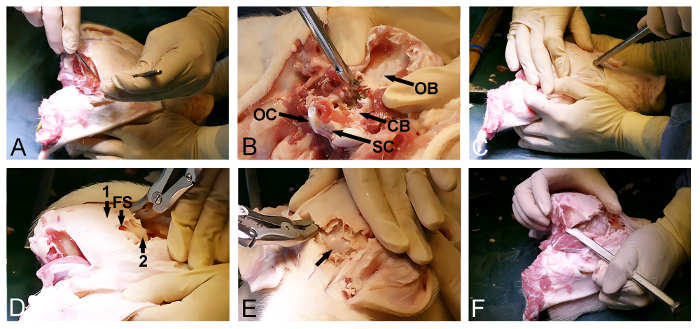
चित्र 2: Minipig खोपड़ी उद्घाटन। (ए) dorsoposterio के एक्सपोजरआर खोपड़ी की सतह, पश्चकपाल और लौकिक मांसपेशियों को हटाने के भी शामिल है। (बी) पश्चकपाल हड्डी को हटाया (सीबी, ड्यूरा से ढके सेरिबैलम; ओबी, पश्चकपाल हड्डी, OC, पश्चकपाल कंद, और अनुसूचित जाति, रीढ़ की हड्डी)। (ग) एक हथौड़ा और एक हड्डी छेनी पूर्व से खोपड़ी घुसना करने के लिए और आंखों के स्तर पर ललाट साइनस प्रवेश करने के लिए उपयोग किया जाता है। (डी) ललाट साइनस (एफएस) की हद तक, बाहरी मोटी खोपड़ी की हड्डी (1) निकालने के लिए किया उजागर एक आंतरिक पतली हड्डी पटल (2) मस्तिष्क को कवर किया जाता है। (ई) पतली हड्डी पटल को हटाया, ड्यूरा से ढके मस्तिष्क (तीर) को उजागर। (एफ) अंत में, एक हथौड़ा और एक हड्डी छेनी पार्श्व पूर्वकाल और पीछे खोपड़ी उद्घाटन कनेक्ट करने के लिए उपयोग किया जाता है। यह आंकड़ा का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।
4. मस्तिष्क removअल
- ड्यूरा उठा सकते हैं और एक ठीक शल्य छुरी (चित्रा 3 ए) का उपयोग कर शिरापरक बेहतर सैजिटल साइनस के लिए एक सौम्य चीरा पास बनाने के लिए शल्य चिकित्सा संदंश का प्रयोग करें।
- सूक्ष्म कैंची या एक ड्यूरा-चाकू का प्रयोग करें और आगे मस्तिष्क की पृष्ठीय सतह को कवर ड्यूरा खोलने के लिए।
नोट: विशेष ध्यान रखा जाना चाहिए जब ड्यूरा अनुमस्तिष्क tentorium (चित्रा 3 बी) के लिए इसी को दूर करने, इस Dural पत्ती के संरक्षण के बाद मस्तिष्क हटाने को रोकने जाएगा। - सुअर सिर खड़ी (चित्रा -3 सी) स्थित करें।
- कपाल गुहा (चित्रा 3 डी) की ड्यूरा से ढके मंजिल से घ्राण बल्ब की कुंद विच्छेदन से ventroanterior मस्तिष्क जारी करने के लिए हड्डी छेनी या एक चीड़फाड़ का प्रयोग करें।
- उजागर ऑप्टिक व्यत्यासिका (चित्रा 3E) अनुभाग के लिए एक ठीक शल्य छुरी का प्रयोग करें। बेनकाब और अनुभाग पिट्यूटरी डंठल और oculomotor नसों।
- लो सेक्शनिंग द्वारा उदर brainstem रिलीजwer कपाल नसों (चित्रा 3F) एक ठीक शल्य छुरी के साथ। सुनिश्चित करें कि Dural अनुमस्तिष्क tentorium पूरी तरह से छिन्न किया गया था (चित्रा 3 बी), के रूप में यह Dural पत्ती अन्यथा रिहाई की प्रक्रिया के दौरान मस्तिष्क के माध्यम से कट जाएगा।

चित्र 3: Minipig मस्तिष्क को हटाने। सर्जिकल संदंश और एक चाकू के साथ ड्यूरा (ए) Dural उद्घाटन। (बी) की देखभाल पूरी तरह से Dural पत्ती (तीर), मस्तिष्क और सेरिबैलम के बीच स्थित काटकर अलग कर देना लिया जाना चाहिए। (सी) सुअर सिर खड़ी खोपड़ी आधार संरचनाओं के बेहतर दृश्य के लिए और गुरुत्वाकर्षण मस्तिष्क के उद्देश्य से विस्थापन में सहायता करने के लिए आदेश में स्थिति में है। (डी) एक चीड़फाड़ या एक हड्डी छेनी ड्यूरा-covere से कुंद अनुभाग द्वारा घ्राण बल्ब राहत देने के लिए प्रयोग किया जाता हैघ खोपड़ी आधार। (ई) विच्छेदन जोखिम और ऑप्टिक व्यत्यासिका (तीर), गढ़े जैसा डंठल, और oculomotor नसों के सेक्शनिंग के लिए खोपड़ी आधार के साथ एक पीछे दिशा में जारी रहता है। (, और छठी अपवर्तनी तंत्रिका तृतीय, oculomotor तंत्रिका; चतुर्थ, घिरनी जैसा तंत्रिका; वी, त्रिपृष्ठी तंत्रिका) (एफ) मस्तिष्क रिहाई कम कपाल नसों के अनुभाग के साथ पूरा हो गया है के रूप में वे मस्तिष्क के उदर सतह से विदा। यह आंकड़ा का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।
5. पिट्यूटरी निकालना
- पिट्यूटरी डंठल और उसके आसपास के Dural पत्ती (diapragma sellae) खोपड़ी मंजिल (चित्रा 4 ए) में पहचानें।
- एक ठीक शल्य छुरी (चित्रा 4 बी) का उपयोग कर पिट्यूटरी डंठल को Dural पत्ती पार्श्व काटकर अलग कर देना।
- गड्ढे जारी करने के लिए एक चीड़फाड़ का प्रयोग करेंuitary और यह पिट्यूटरी खात (चित्रा 4C) से बाहर उठा।

चित्र 4: Minipig पिट्यूटरी हटाने। (ए) पिट्यूटरी खात (*) खोपड़ी मंजिल में पहचाना जाता है (1, घ्राण बल्ब, 2, ऑप्टिक व्यत्यासिका, और पीएफ, पीछे कपाल खात)। (बी) Dural कवर (sellar diagphragm, (तीर)) पार्श्व छिन्न है। (सी) पिट्यूटरी (तीर) एक चीड़फाड़ के साथ जारी किया और पिट्यूटरी खात से बाहर उठाया है। स्केल बार (एसी) 10 मिमी =। यह आंकड़ा का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
बाहर सूखने से ऊतक सामग्री रोकने के लिए, यह बंधक या isotonic खारा तुरंत बाद स्थूल विश्लेषण निष्पादित किया गया है के साथ भरा एक जार में हटाया मस्तिष्क और पिट्यूटरी स्टोर करने के लिए सिफारिश की है। ऊतक सामग्री साल के लिए बंधक में संग्रहित किया जा सकता है, जबकि isotonic खारा में भंडारण, यहां तक कि एक रेफ्रिजरेटर में, समय के साथ ऊतक क्षय को बढ़ावा मिलेगा।
हटाया पिट्यूटरी भी सीधे, सूखी बर्फ ठंडा तरल 2-methylbutane में विसर्जन से जमे हुए किया जा सकता है, जबकि बरकरार सुअर मस्तिष्क प्रत्यक्ष ठंड 28 के लिए बहुत बड़ा है। इसके बजाय, यह, सुअर मस्तिष्क स्लाइस के रूप में पहले से 28 का प्रदर्शन किया, 9-15 मिमी मोटी समानांतर कोरोनल ऊतक स्लैब कि टोटो में जमे हुए किया जा सकता है और 40 सुक्ष्ममापी मोटी वर्गों 5, 18 में cryostat-sectioned में सिफारिश की है, 26, 28। हटाया बरकरार मस्तिष्क से-विच्छेदित मुक्त या मस्तिष्क स्लैब कटा हुआ है और vibratome 30 सेक्शनिंग, पैराफिन / मेथाक्रिलेट एम्बेडिंग और सूक्ष्म सेक्शनिंग 6, 17, 27, या ठंड और cryostat सेक्शनिंग 6 के बाद आगे ऊतकीय प्रसंस्करण को प्रस्तुत वैकल्पिक रूप से, विशिष्ट मस्तिष्क क्षेत्रों हो सकता है, 14, 15, 25। हमारे स्थापना में, सुअर शवों अंत में निर्दिष्ट प्लास्टिक के कंटेनर में रखा और एक समर्पित कोल्ड स्टोरेज कमरे में जमा जब तक वे एकत्र और एक जैविक अपमानजनक सुविधा के लिए ले जाया जाता है कर रहे हैं।
गैर मोटर चालित शल्य औजारों के प्रयोग (सामग्री की तालिका), वर्णित तकनीक के साथ (आंकड़े 1 जी> - 3) सक्षम बनाता है, लगभग 15-20 मिनट में बरकरार सुअर मस्तिष्क (चित्रा 5AB) को हटाने, जबकि कटे कपाल नसों और पिट्यूटरी खोपड़ी मंजिल कनेक्ट रहना (चित्रा 4 ए)। इसी तरह, पिट्यूटरी बस, हटाया जा सकता है बरकरार, overlying मस्तिष्क को दूर करने और Dural sellar डायाफ्राम (चित्रा 4 और 5C) जारी करने के बाद।
जिसके परिणामस्वरूप मस्तिष्क और / या पिट्यूटरी (चित्रा 5) बाद में स्थूल विश्लेषण बताता है कि अलग प्रत्यक्ष दृश्य निरीक्षण से, आकार और मात्रा माप 31 शामिल हो सकते हैं करने के लिए प्रस्तुत किया जा सकता। इस छोटे मस्तिष्क स्लैब 28, में सेक्शनिंग उन्मुख द्वारा पीछा किया जा सकता है 29 रासायनिक विश्लेषण और / या आगे ऊतकीय तैयारी, धुंधला, और सूक्ष्म विश्लेषण 6 के लिए उपयुक्त,रों = "xref"> 14, 15, 17, 25, 26, 27।

चित्र 5: Minipig मस्तिष्क (ए और बी) और पीयूष (सी)। (ए) मस्तिष्क, laterodorsal दृश्य (बी एस, मस्तिष्क, सीबी, सेरिबैलम, और सीआरबी, मस्तिष्क)। (बी) के मस्तिष्क, उदर दृश्य (बी एस, मस्तिष्क, सीबी, सेरिबैलम, और सीआरबी, मस्तिष्क)। (सी) पिट्यूटरी, पीछे दृश्य (एएच, adenohypophysis और राष्ट्रीय राजमार्ग, neurohypophysis)। स्केल बार (ए और बी) 10 मिमी, (सी) = 5 मिमी =। यह आंकड़ा का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।
Subscription Required. Please recommend JoVE to your librarian.
Discussion
अधिकांश प्रयोगात्मक तंत्रिका विज्ञान के अध्ययन में इस तरह के चूहों और चूहों, जहां सीएनएस के लिए उपयोग एक पतली skull- और Dural-मोटाई द्वारा सुविधा है के रूप में छोटे जानवरों की प्रजातियों, में प्रदर्शन कर रहे हैं। हालांकि, सूअरों 1, 4, 8, भेड़ 32, और गैर मानव प्राइमेट जैसी बड़ी प्रयोगात्मक पशुओं में, इन संरचनाओं की काफी मोटाई मजबूत उपकरणों (सामग्री की तालिका) और उचित प्रवेश बिंदुओं खोपड़ी की हड्डी को हटाने के लिए (चित्रा के उपयोग जरूरी 2)। पहले सीएनएस पहुँचा जा सकता है Dural पत्ते (आंकड़े 3 और 4) को प्रतिबंधित करने के ज्ञान की आवश्यकता होती है और मस्तिष्क को सुरक्षित रूप से हटा दिया।
के रूप में इस नुकसान से अंतर्निहित मस्तिष्क की रक्षा करेगा यह ड्यूरा खोपड़ी की हड्डी को हटाने के दौरान बरकरार छोड़ने के लिए सिफारिश की है। पिछला transcardial निर्धारण 20 वैसे ही कठोर और एसएलआई सकता हैghtly मस्तिष्क सिकुड़ अनुमति हड्डी और Dural हटाने की प्रक्रिया अधिक आसानी और सुरक्षा के साथ किया जा करने के लिए। सुअर खोपड़ी का एक खास विशेषता यह है, भेड़ और गैर मानव पशु के विपरीत, उम्र के साथ ललाट साइनस, जो खोपड़ी की हड्डी को हटाने की प्रक्रिया (चित्रा 2) में लाभप्रद हो सकता है के प्रगतिशील विस्तार है। प्रस्तुत तकनीक के हिसाब से सभी बड़े जानवरों की प्रजातियों पर इस्तेमाल किया जा सकता है, लेकिन केवल सूअर, विशेष रूप से उन से अधिक उम्र के 6 महीनों में, ललाट साइनस खोपड़ी की हड्डी को हटाने की प्रक्रिया में सहायता प्रदान करने के लिए पर्याप्त विकसित किया जाएगा। अंत में, कत्ल प्रक्रिया (चित्रा 1 बी) और Dural अनुमस्तिष्क tentorium (चित्रा 3 बी) अंतिम मस्तिष्क रिलीज होने से पहले की पूरी सेक्शनिंग दौरान रीढ़ की हड्डी की पूरी सेक्शनिंग बिल्कुल आदेश मस्तिष्क के लिए बाद में नुकसान से बचने के लिए आवश्यक हैं।
कुछ अध्ययनों में, यह मस्तिष्क से जुड़ी व्याख्यान चबूतरे वाला ग्रीवा रीढ़ की हड्डी का एक हिस्सा है करने के लिए लाभप्रद हो सकता है।यह, गर्दन पर प्रारंभिक कत्ल चीरा (चित्रा 1 ए) अधिक दुमदारी रखने craniocervical जंक्शन के बजाय एक intervertebral ग्रीवा डिस्क के माध्यम से रीढ़ की हड्डी के लिए उपयोग की अनुमति देकर प्राप्त किया जा सकता के रूप में मौजूदा वीडियो में प्रदर्शन किया। पीछे की हड्डी को हटाने तो उजागर दुम पटल से शुरू करना होगा। इसके अलावा, तकनीक समान होगा, तो यह याद रखना महत्वपूर्ण है कि रीढ़ की हड्डी पूरी तरह से कत्ल खंड स्तर (चित्रा 1) में सशक्त विस्तार के साथ पूर्ण होने से पहले sectioned किया जाना चाहिए महत्वपूर्ण है। वर्तमान प्रक्रिया, unfixed जानवरों पर प्रदर्शित किया गया है के रूप में वास्तविक पृष्ठभूमि अध्ययन व्युत्पन्न पिट्यूटरी की एचपीएलसी विश्लेषण जरूरी हो। हालांकि, ध्यान रखें कि ठीक उसी तकनीक जानवरों transcardially paraformaldehyde 3, 5, 14, 15 के साथ उतारना चाहते पर प्रयोग किया जाता है,
के रूप में अगले पैराग्राफ में चर्चा की है, हम गैर मोटर चालित शल्य उपकरणों का उपयोग करने को प्राथमिकता दी है। 1-2 साल से ऊपर आयु वर्ग सूअरों की खोपड़ी, हालांकि, तो मजबूत हो सकता है कि प्रदर्शन किया निर्देप्राप्तगुम के साथ खोपड़ी को हटानेuments नहीं इस तरह के craniotomes, दोलन आरी, और बिजली के अभ्यास 32 के रूप में मोटर उपकरणों, के उपयोग की जरूरत महसूस संभव है। उस मामले में, यह अभी भी ऊपर संकेत प्रोटोकॉल चरणों का पालन करने के लिए है, जिससे प्राकृतिक रूप से उत्पन्न खोपड़ी प्रवेश द्वारों और ललाट साइनस विकास का लाभ लेने की सिफारिश की है। खोपड़ी आधार के समक्ष प्रस्तुत किया पूर्वकाल पहुँच सुरुचिपूर्ण और आसान है, लेकिन घ्राण बल्ब का वर्णन किया कुंद रिहाई मस्तिष्क (चित्रा 3EF) के और अधिक पीछे रिहाई के विपरीत प्रत्यक्ष दृश्य मार्गदर्शन (चित्रा 3 डी) के बिना किया जाना चाहिए,। घ्राण बल्ब के उदर भाग इसलिए है कि केवल, बचा जा सकता है, तो बल्ब के लिए बाहर उदर पूर्वकाल खोपड़ी आधार ड्रिलिंग से पहले रिहाई प्रक्रिया शुरू की है से, जरूरत अनियंत्रित क्षति के कुछ डिग्री पीड़ित हो सकता है। ध्यान दें कि हेरफेर, विशेष रूप से खोपड़ी को हटाने के दौरान unfixed मस्तिष्क के ऊतकों की, histologi में परिणाम की संकेत दिया गया है कैलोरी अंधेरा न्यूरॉन विरूपण साक्ष्य है, जो neurotoxicological पढ़ाई 33 में गलत निष्कर्ष हो सकता है।
खोपड़ी की हड्डी को हटाने की प्रक्रिया भी craniotomes, दोलन आरी, और बिजली के अभ्यास 32 की तरह मशीनरी के साथ किया जा सकता है। ये प्रक्रिया में तेजी लाने सकता है, लेकिन वे भी अंतर्निहित तंत्रिका संरचनाओं के क्षतिग्रस्त होने का खतरा बढ़ जाएगा। इस तरह के उपकरण भी महंगा हो सकता है और सबसे अधिक संभावना सबसे प्रयोगशालाओं में उपलब्ध नहीं होगा। इसलिए हम वर्तमान प्रक्रिया गैर मोटर चालित शल्य उपकरण (सामग्री की तालिका) का उपयोग और प्रयोग करने में आसान है कि का उपयोग कर प्रदर्शित करने के लिए पसंद करते हैं।
वर्णित है और सचित्र तकनीक, जब ठीक से इस्तेमाल किया,, जोखिम और पोस्टमार्टम सुअर मस्तिष्क, पिट्यूटरी को हटाने, और / या गर्भाशय ग्रीवा रीढ़ की हड्डी (चित्रा 5) सक्षम हो जाएगा ऊतक टुकड़े में जिसके परिणामस्वरूप है कि अच्छी तरह से आगे स्थूल विश्लेषण के लिए उपयुक्त हैं"xref"> 5, 6, 19, 26, 31, मस्तिष्क स्लैब 28 में सेक्शनिंग, और बाद में रासायनिक विश्लेषण और / या ऊतकीय प्रसंस्करण 6, 14, 15, 16, 17, 25, 26, 27, 31।
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
लेखकों के पास खुलासे के लिए कुछ भी नहीं है।
Acknowledgments
लेखकों आभार के साथ श्रीमती ट्राइन W मिककेल्सेन के कुशल सहायता, श्रीमती लिसे एम फिटिंग, और Påskehøjgaard में कर्मचारियों को स्वीकार करते हैं। डेनिश चिकित्सा अनुसंधान परिषद, लंडबेक फाउंडेशन, और नोवो नॉर्डिस्क फाउंडेशन आर्थिक रूप से अध्ययन का समर्थन किया।
Materials
| Name | Company | Catalog Number | Comments |
| Heavy Scalpel Handle #4 | FST (Fine Science Tools) | 10008-13 | Good for skin incision and soft tissue removal |
| Non-Sterile Scalpel Blades #23 | FST | 10023-00 | |
| Scalpel Handle #7 | FST | 10007-12 | Optimal for dural incision and precision work |
| Non-Sterile Scalpel Blades #11 | FST | 10011-00 | |
| Surgical Forceps | FST | 11024-18 | The tip of the surgical forceps ensure a firm grip |
| Kerrison Bone Punch | Aesculap Neurosurgery | FF713R | Must be robust, bite size 3-5 mm |
| Bone Rongeur | Aesculap Neurosurgery | MD615 | Must be robust, bite size 15 x 5 mm |
| Bone Rongeur | Aesculap Neurosurgery | FO551R | Must be robust, bite size 25 x 15 mm |
| Bone Chisel | Lawton | 67-0335 | The size of the chisel head should not exceed 20 mm |
| Mallet (Hammer) | Millarco | 5624108 | Weigth 300 g, length 30 cm, head hit area size 2 x 2 cm |
| Micro-Scissor | FST | 14002-14 | |
| Dissector | Aesculap Neurosurgery | OL165R | |
| Göttingen minipigs | Ellegaard Göttingen Minipigs A/S, Denmark | ||
| Euthanimal | pentobarbital | ||
| Ketamine | Pfizer | ||
| Midazolam | Hameln Pharmaceuticals |
References
- Lind, M. N., Moustgaard, A., Jelsing, J., Vajta, G., Cumming, P., Hansen, A. K. The use of pigs in neuroscience: Modeling brain disorders. Neurosci Biobehav Rev. 31, 728-751 (2007).
- Bjarkam, C. R., et al. Neuromodulation in a minipig model of Parkinson disease. British J Neurosurg. 22 (Suppl. 1), S9-S12 (2008).
- Bjarkam, C. R., Cancian, G., Glud, A. N., Ettrup, K. S., Østergaard, L., Sørensen, J. C. MRI-guided stereotaxic targeting in pigs based on a stereotaxic localizer box fitted with an isocentric frame and use of SurgiPlan computer-planning software. J Neurosci Methods. 183 (2), 119-126 (2009).
- Sauleau, P., Lapouble, E., Val-Laillet, D., Malbert, C. H. The pig model in brain imaging and neurosurgery. Animal. 3 (8), 1138-1151 (2009).
- Bjarkam, C. R., et al. Safety and function of a new clinical intracerebral microinjection instrument for stem cells and therapeutics examined in the Göttingen minipig. Stereotact Funct Neurosurg. 88 (1), 56-63 (2010).
- Fjord-Larsen, L., et al. Long-term delivery of nerve growth factor by encapsulated cell biodelivery in the minipig basal forebrain. Mol Therapy. 18 (12), 2164-2172 (2010).
- Sørensen, J. C., et al. Development of neuromodulation treatments in a large animal model - Do neurosurgeons dream of electric pigs? Prog Brain Res. 194, 97-103 (2011).
- Dolezalova, D., et al. Pig models of neurodegenerative disorders: utilization in cell replacement-based preclinical safety and efficacy studies. J Comp Neurol. 522 (12), 2784-2801 (2014).
- Mikkelsen, M., Moller, A., Jensen, L. H., Pedersen, A., Harajehi, J. B., Pakkenberg, H. MPTP-induced Parkinsonism in minipigs: A behavioral, biochemical, and histological study. Neurotoxicol Teratol. 21, 169-175 (1999).
- Danielsen, E. H., et al. The DaNEX study of embryonic mesencephalic, dopaminergic tissue grafted to a minipig model of Parkinson's disease: Preliminary findings of effect of MPTP poisoning on striatal dopaminergic markers. Cell Transplant. 9 (2), 247-259 (2000).
- Dalmose, A., Bjarkam, C. R., Sørensen, J. C., Jørgensen, T. M., Djurhuus, J. C. Effects of high frequency deep brain stimulation on urine storage and voiding function in conscious minipigs. Neurourol Urodyn. 23 (3), 265-272 (2004).
- Dalmose, A., Bjarkam, C. R., Djurhuus, J. C. Stereotactic electrical stimulation of the pontine micturition center in the pig. Br J Urol. 95, 886-889 (2005).
- Andersen, F., Watanabe, H., Bjarkam, C. R., Danielsen, E. H., Cumming, P. The DaNeX Study Group. Pig brain stereotaxic standard space: Mapping of cerebral blood flow normative values and effect of MPTP-lesioning. Brain Res Bull. 66 (1), 17-29 (2005).
- Glud, A. N., et al. Direct gene transfer in the minipig CNS using stereotaxic lentiviral microinjections. Acta Neurobiol Exp. 70 (3), 1-8 (2010).
- Glud, A. N., et al. Direct MRI-guided stereotaxic viral mediated gene transfer of alpha-synuclein in the minipig CNS. Acta Neurobiol Exp. 71 (4), 508-518 (2011).
- Ettrup, K. S., Sørensen, J. C., Rodell, A., Alstrup, A. K. O., Bjarkam, C. R. Hypothalamic deep brain stimulation influences autonomic and limbic circuitry involved in the regulation of aggression and cardiocerebrovascular control in the minipig. Stereotact Funct Neurosurg. 90 (5), 281-291 (2012).
- Nielsen, M. S., et al. Continuous MPTP intoxication in the minipig results in chronic parkinsonian deficits. Acta Neurobiol Exp. 76, 198-210 (2016).
- Bjarkam, C. R., et al. A MRI-compatible stereotaxic localizer box enables high-precision stereotaxic procedures in pigs. J Neurosci Methods. 139 (2), 293-298 (2004).
- Bjarkam, C. R., Jorgensen, R. L., Jensen, K. N., Sunde, N. A. A., Sørensen, J. C. H. Deep brain stimulation electrode anchoring using BioGlue®, a protective electrode covering, and a titanium microplate. J Neurosci Methods. 168, 151-155 (2008).
- Ettrup, K. S., et al. Basic Surgical Techniques in the Minipig: Intubation, Transurethral Bladder Catheterization, Femoral Vessel Catheterization, and Transcardial Perfusion. J Vis Exp. (52), e2652 (2011).
- Ettrup, K. S., Tornøe, J., Sørensen, J. C., Bjarkam, C. R. A surgical device for minimally invasive implantation of experimental deep brain stimulation leads in large research animals. J Neurosci Methods. 200 (1), 41-46 (2011).
- Danielsen, E. H., et al. Positron emission tomography of living brain in minipigs and domestic pigs. Scand J Lab Anim Sci Suppl. 25 (1), 127-135 (1998).
- Røhl, L., et al. Time evolution of cerebral perfusion and ADC measured by MRI in a porcine stroke model. J Magn Reson Imaging. 15 (2), 123-129 (2002).
- Cumming, P., Gillings, N. M., Jensen, S. B., Bjarkam, C. R., Gjedde, A. Kinetics of the uptake and distribution of the dopamine D2/3 agonist (R)-N-[1-11C]n-propylnorapomorphine in brain of healthy and MPTP-poisoned Gottingen miniature pigs. Nucl Med Biol. 30 (5), 547-553 (2003).
- Jensen, K. N., Deding, D., Sørensen, J. C., Bjarkam, C. R. Long-term implantation of deep brain stimulation electrodes in the pontine micturition centre of the minipig. Acta Neurochir. 151 (7), 785-794 (2009).
- Rosendal, F., et al. Does chronic low dose treatment with ciclosporin influence the brain? A histopathological study in pigs. Transplantation Proc. 37 (8), 3305-3308 (2005).
- Nielsen, M. S., Sørensen, J. C., Bjarkam, C. R. The substantia nigra pars compacta of the minipig: An anatomical and stereological study. Brain Struct Funct. (4-5), 481-488 (2009).
- Sørensen, J. C., Bjarkam, C. R., Simonsen, C. Z., Danielsen, E., Geneser, F. A. Oriented sectioning of irregular tissue blocks in relation to computerized scanning modalities. Results from the domestic pig brain. J Neurosci Methods. 104, 93-98 (2000).
- Bjarkam, C. R., Pedersen, M., Sørensen, J. C. New strategies for embedding, orientation and sectioning of small brain specimens enable direct correlation to MR-images, brain atlases, or use of unbiased stereology. J Neurosci Methods. 108, 153-159 (2001).
- Bjarkam, C. R., Sørensen, J. C., Geneser, F. A. Distribution and morphology of serotonin-immunoreactive axons in the hippocampal region of the New Zealand white rabbit. I. Area dentata and hippocampus proper. Hippocampus. 13 (1), 21-37 (2003).
- Bjarkam, C. R., Glud, A. N., Orlowski, D., Sørensen, J. C., Palomero-Gallagher, N. The telencephalon of the minipig, cytoarchitecture and cortical surface anatomy. Brain Struct Funct. , e-pub ahead of print (2016).
- Boltze, J., Nitzsche, B., Geiger, K. D., Schoon, H. A. Histopathological investigation of different MCAO modalities and impact of autologous bone marrow mononuclear cell administration in an ovine stroke model. Transl Stroke Res. 2, 279-293 (2011).
- Jortner, B. S. The return of the dark neuron. A histological artifact complicating contemporary neurotoxicologic evaluation. Neurotoxicology. 27, 628-634 (2006).



