Summary
本論文や教育ビデオの目標は、その後の肉眼および組織学的分析に適したそのままの状態で死後のブタの脳と下垂体を露出して削除する方法を説明することです。
Abstract
ブタは、ヒト以外の霊長類への経済的かつ倫理的に実現可能な代替品として大動物翻訳の神経科学研究でますます人気となっています。豚の大規模な脳の大きさは、従来の臨床脳イメージャーを使用すると、人間の診療所から脳神経外科手順および装置を直接使用してテストすることができます。さらに巨視的および組織学的分析は、しかし、豚、中枢神経系(CNS)の死後露光およびその後の脳の除去を必要とします。豚CNSが厚く、骨、頭蓋骨や脊柱によってカプセル化されているので、これは、簡単な作業ではありません。本論文や教育ビデオの目標は、死後のブタの脳とそれに続く肉眼および組織学的分析に適したそのままの状態で下垂体を露出して削除する方法を説明することです。
Introduction
ブタにおけるトランスレーショナル神経科学の研究では、過去20年間の間に、ますます人気となっています。ブタの脳の大サイズは、従来の臨床脳イメージャと直接使用及びヒト臨床1、2、3、4、5、6、7、8から神経外科手順および装置の試験の使用を可能にします。過去20年間で、豚、特にミニブタ( 例えば、ゲッティンゲンのミニブタ)、などの幹細胞移植などの神経調節治療法を、調べるために使用されています。ウイルスベクターのトランスフェクション。パーキンソン病、肥満、うつ病、およびアルツハイマー病2、6、に向けおよび脳深部刺激= "XREF"> 9、10、11、12、13、14、15、16、17。これは、ミニブタCNS 3、18、19、20、21を操作するために定位手術的アプローチの開発が続いてきました。制定CNSの変化は脳撮像(PET 10、13、22、24及びMR 23)、膀胱内圧測定11、12、25、歩行分析を用いて、生きた動物で評価されています17、神経学的評価9、17、及び組織学および立体解析14、15、17、26、27、31に基づいて死後検査。しかし、死後分析が厚く、骨の頭蓋骨と繊維状硬膜カバーは、豚の脳を囲むように、簡単な作業ではありません豚の脳の露出および除去を必要とします。
本論文や教育ビデオの目標は、死後のブタの脳と下垂体は、非電動式手術器具を使用して15〜20分で完全な状態で露出して除去することができる方法を記述することです。ミニブタ下垂体の解剖学的研究のために使用教育ビデオや写真のイラストは、オスのミニブタ(20〜25キロ:6ヶ月、体重、年齢)を示します。
Subscription Required. Please recommend JoVE to your librarian.
Protocol
動物の麻酔とeuthanesiaは(NIH公開番号86から23まで、1985年改訂)および動物研究倫理のためのデンマークの理事会で承認された「実験動物のケアの原則」に従って行われました。
1.楽器
- ビデオで提示楽器を収集し、 材料の表に記載されています。
2.斬首
注:麻酔は、ミダゾラムの5mLの(を5mg / mL)およびケタミンを5mLた(25mg / ml)を筋肉内注射することによって誘導しました。動物を深く鎮静されたときに、5~10分後に、耳静脈にカニューレを挿入し、ペントバルビタールナトリウムの致死過剰投与(体重の100mg / kgのは)(200ミリグラム/ mL)を静脈内投与しました。 Ettrup らによって示されるように、動物が完全に安楽死させたことを確実にするために、インターデジタル疼痛反射を試験しました。 (2011)20。で説明したように、完全な安楽死が確保されました倫理ステートメント上記とEttrup らによって実証されるように、等張生理食塩水の5 Lとtranscardial灌流、続い。 (2011)20。すべての立証手順は、長期的な麻酔と術後生存のために必要な福祉予防策の必要性を排除、死後に行われます。
- ちょうど下顎角( 図1A)の下、外科用メスを用いて、高い円形頸部切開によりブタを斬ります。
- 骨脊柱は約頭頸接合部のレベルに到達するまで、依然として外科用メスを用いて、喉頭及び食道を含む頸部の軟組織を通って前方切開を続けます。
- (アトラスの前方円弧上に、頭頸接合部の前側からの外科用メスで切断を進め、そして前方atlantooccipital膜を通って、それによって脊柱管および脊髄を露出図1B)。同時に、頭蓋底と第一頸椎の間のアクセスを容易にするために豚の頭から離れ豚の体を引っ張るためにアシスタントをお願いします。
- 硬膜嚢および脊髄( 図1B)を介して外科的切開を続けます。脊髄の完全な横断面が達成されることを保証するために特別に注意してください。
注:前の手順を実行に失敗すると、断頭プロセスの次のステップの間に、脊髄や脳に不要な牽引力になることがあります。 - 強制的セクションレベル( 図1C)にcranocervical接合を拡張します。これと同時に、後頭顆とアトラスの上部関節プロセスの間に関節を解放する部分に残りatlantooccipital靭帯を外科用メスを使用します。身体から豚の頭を区切ります。

図1:ミニブタ断頭。 (A)ネック切開(矢印、下顎角)。 (B)頭頸接合部におけるatlantooccipital靭帯および硬膜-囲ま脊髄(SC)を介して切開(C1、アトラスの前方アーク; OC、後頭顆)。 (C)atlantooccipital関節の後方部分は、セクションレベルで強制的伸長(矢印)によって解放されます。 この図の拡大版をご覧になるにはこちらをクリックしてください。
3.スカルオープニング
- テーブルの上に豚の頭を置きます。
- の後方部を介して皮膚と頭の頂点を超える鼻の奥から、根本的な軟部組織を通る外科用メスで背側縦切開を行い、そしてダウン後頭部。
- 外科用メスを用いて最初の切開の側方に位置する軟組織を除去することにより頭蓋骨の背側及び後方部分を露出させます。
- 外科用メスで頭蓋骨( 図2A)から両側頭筋を放出します。後部後頭部の骨が軟らかい組織を除去していることを確認します。
- ケリソン骨パンチと骨骨鉗子と後頭骨を除去し、硬膜に覆われ小脳( 図2B)を露出させるために大後頭孔の後方入口を使用します。
- ちょうど目の前で、頭蓋骨の露出前面側に戻り、前頭骨のエントリポイントを選択します。この時点で、頭蓋骨を貫通して前頭洞( 図2C)を入力するためにハンマーで骨チゼルを使用します。
- 薄い、骨の骨鉗子や骨パンチと外側の頭蓋骨のラミナのdorsoposterior除去を促進し、内部が露出するように前頭洞の範囲を使用します大脳( 図2D)を覆う骨頭蓋骨ラミナ。
- 穏やか硬膜覆われ大脳( 図2E)を露出させるためにハンマーや骨チゼルと前方内側骨頭蓋骨ラミナを開きます。
- 横硬膜に覆われ大脳および小脳( 図2F)の既に露出した部分の間に位置する頭蓋骨の最終dorsoposterior一部を解放するために時間と頭頂骨を通して骨チゼルおよび骨骨鉗子を使用して、骨の除去を続けます。
注:それは1がドアを開くと同じように、片側からの残りの後部頭蓋骨をこじ開けるためにノミを使用して、この手順の最後のステップの間に、しばしば可能です。
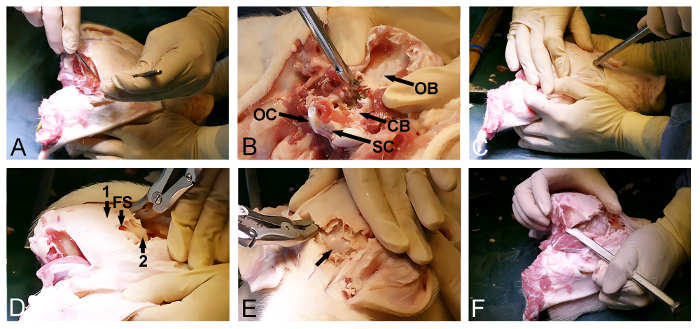
図2:ミニブタの頭蓋骨の開口部。 (A)dorsoposterioの露出を後頭部と時間の筋肉の除去を含むRの頭蓋骨の表面、。 (B)後頭骨の除去(CB、硬膜に覆われ小脳; OB、後頭骨; OC、後頭顆、およびSC、脊髄)。 (C)ハンマーと骨チゼルが前方頭蓋骨を貫通するように、目のレベルで前頭洞を入力するために使用されます。 (D)前頭洞(FS)の程度は、(2)大脳を覆うインナー薄い骨の薄層を露出する、(1)外側の厚い頭蓋骨を除去するために使用されます。薄い骨ラミナの(E)の除去、硬膜に覆われた大脳(矢印)を露出させます。 (F)最後に 、ハンマーと骨チゼルは、横方向に前方及び後方の頭蓋骨の開口部を接続するために使用されます。 この図の拡大版をご覧になるにはこちらをクリックしてください。
4.脳Removアル
- 硬膜を持ち上げ、微細外科用メス( 図3A)を用いて静脈上矢状静脈洞に近い穏やかな切開部を作成するために、外科用鉗子を使用します。
- さらに、脳の背側表面を覆う硬膜を開くために、マイクロシザーまたは硬膜ナイフを使用します。
注:小脳テント(図3B)に対応した硬膜を除去する際、この硬膜葉の保存は、後続の脳の除去を防止するように特別な注意が払わなければなりません。 - 豚の頭垂直( 図3C)を配置します。
- 頭蓋腔( 図3D)の硬膜に覆わ床から嗅球の鈍的切開によってventroanterior大脳を解放するために、骨チゼルまたはディセクタを使用します。
- 暴露視交叉( 図3E)セクションに細かい手術用メスを使用してください。下垂体茎と動眼神経を公開してセクション。
- LOを区切ることにより、腹側脳幹をリリース細かい手術用メスでWER脳神経( 図3F)。この硬膜葉が他の解放プロセス中に脳幹を切断れるように硬膜小脳テントを完全に、( 図3B)切開したことを確認してください。

図3:ミニブタの脳の除去。 (A)外科鉗子及び硬膜ナイフで硬膜開口。 (B)ケア完全大脳および小脳の間に位置する硬膜葉(矢印)を切開するように注意しなければなりません。 (C)ブタヘッドは、頭蓋底構造のよりよい視覚化のため、重力が脳の意図された変位に役立つようにするために垂直に配置されています。 (D)切開または骨チゼルは硬膜-covereから平滑部により嗅球を緩和するために使用されD頭蓋底。 (E)切開は、視交叉(矢印)、漏斗状茎、および動眼神経の露光及び切片のための頭蓋底に沿って後方方向に継続されます。 (; IV、滑車神経、III、動眼神経V、三叉神経、及びVIは、外転神経)は、脳幹の腹側表面から離れるように(F)は、脳の放出は、下部脳神経のセクションで完了する。 この図の拡大版をご覧になるにはこちらをクリックしてください。
5.下垂体除去
- 頭蓋骨床( 図4A)における下垂体茎及びその周辺硬膜葉(diapragmaのsellae)を識別する。
- 微細な外科用メス( 図4B)を使用して下垂体茎に硬膜葉横に切開。
- ピットを解放するために解剖器具を使用して、uitary及び下垂体窩( 図4C)から持ち上げ。

図4:ミニブタの下垂体除去。 (A)下垂体窩(*)は、頭蓋骨の床で識別され(1、嗅球; 2、光学視交叉;及びPF、後頭蓋窩)。 (B)硬膜被覆(トルコ鞍diagphragm、(矢印))を横方向に切開されます。 (C)下垂体(矢印)は、解剖器具を用いて放出され、下垂体窩の外に持ち上げられます。スケールバー(AC)は、10ミリ=。 この図の拡大版をご覧になるにはこちらをクリックしてください。
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
乾燥から組織材料を防止するためには、巨視的分析が行われた直後の固定剤又は等張食塩水で満たされたジャー中で除去し、脳および下垂体を保管することが推奨されます。組織材料は、等張食塩水に貯蔵に対し、年間の固定液に保存することができるにも冷蔵庫に、経時的に組織崩壊につながります。
無傷のブタの脳は直接凍結28に対して大きすぎる一方除去下垂体は、直接、ドライアイス冷却液2-メチルブタンに浸漬することによって凍結されてもよいです。その代わりに、それは以前にTOTOで凍結し、40μmの厚さの切片5、18にクライオスタットは、区分することができる9〜15ミリメートルの厚さの平行冠状組織スラブに、28を示されているように、ブタの脳をスライスすることが推奨され、 26、28。あるいは、特定の脳領域があることができる除去無傷の脳から自由切開または脳スラブをスライスして切片30を区画ビブラトーム、パラフィン/メタクリレート包埋及びミクロトーム切片6、17、27、または凍結クライオスタット6の後に、さらに、組織学的処理に提出し、 14、15、25。私たちの設定では、豚の死骸は、最終的には指定されたプラスチック製の容器に入れていると、彼らが収集した生物学的分解施設に輸送されるまでは、専用の冷蔵室に保存されています。
非電動手術ツールの使用(材料のテーブル)、記載された技術を持つ( 図1 G> -切断脳神経および下垂体は、頭蓋骨のフロア( 図4A)に接続されたまま3)、約15〜20分で、無傷のブタの脳( 図5AB)を除去することができます。同様に、下垂体は単に上層脳を除去し、硬膜トルコ鞍隔膜( 図4及び図5C)を放出した後、そのまま除去してもよいです。
得られた脳および/または下垂体( 図5)は 、その後、離れて直接目視検査から、サイズ及び容積測定31を含むことができる巨視的分析に供してもよいです。これは 、指向小さい脳スラブ28に区画することにより、化学分析および/またはさらなる組織学的調製、染色、および顕微鏡分析6適し29を追跡することができますS = "外部参照"> 14、15、17、25、26、27。

図5: ミニブタ脳(A及びB)と下垂体(C)。 (A)は、脳、laterodorsalビュー(BS、脳幹、CB、小脳、及びCRB、大脳)。 (B)は、脳、腹ビュー(BS、脳幹、CB、小脳、及びCRB、大脳)。 (C)下垂体、後方ビュー(AH、下垂体前葉及びNH、神経下垂体)。スケールバー(AおよびB)を10 mmであり、(C)= 5ミリメートル=。 この図の拡大版をご覧になるにはこちらをクリックしてください。
Subscription Required. Please recommend JoVE to your librarian.
Discussion
ほとんどの実験的神経科学の研究は、CNSへのアクセスが薄いskull-と硬膜の厚さによって促進されるマウスおよびラットのような小さな動物種、で実行されています。しかし、ブタ1、4、8、羊32、および非ヒト霊長類のような、より大きな実験動物において、これらの構造のかなりの厚さは、堅牢な器具(材料のテーブル)と頭蓋骨の骨の除去のための適切なエントリポイントの使用を必要とする( 図2)。 CNSにアクセスすることができ、脳を安全に削除する前に硬膜葉( 図3及び4)規制の知識が必要です。
損傷から基礎となる脳を保護するように、頭蓋骨の骨除去中に無傷で硬膜を残すことをお勧めします。前transcardial固定20も同様に硬化させ、SLIもghtly骨と硬膜除去プロセスをより簡単かつ安全に行うことができるように、脳を縮小。ブタ頭蓋骨の特別な特徴は、ヒツジ及び非ヒト霊長類とは対照的に、頭蓋骨除去プロセスにおいて有利であり得る加齢に伴う前頭洞、( 図2)の進行性の拡張です。提示技術はそれに応じて、すべての大型動物種に使用することができるが、唯一の豚、特に古いより6ヶ月で、前頭洞は、頭蓋骨の除去プロセスにおける援助を提供するために十分に開発されます。最後に、最終的な脳のリリース前硬膜小脳テント( 図3B)の断頭処理(図1B)および完全な切片中の脊髄の完全な切片が絶対脳幹の後の損傷を回避するために必要とされます。
いくつかの研究では、脳に添付吻側頸部の脊髄の一部を有することが有利であり得ます。これは、現在のビデオで示されているように、代わりに頭頸接合部の椎間頚椎椎間板を介して脊髄へのアクセスを許可する、首により尾側初期断頭切開( 図1A)を配置することによって得ることができます。後部骨の除去は、露出した尾ラミナから開始する必要があります。これとは別に、この技術は、類似するので、断頭は、セクションレベル( 図1)に強制的拡張で完了する前に、脊髄を完全に切断しなければならないことを覚えておくことが重要です。実際の背景調査を誘導下垂体のHPLC分析を必要としたように、現在の手順は、未定着の動物で実証されています。 、全く同じ技術を経パラホルムアルデヒド3、5、14、15に固定さ動物で使用されていること、しかし、注意してください
次の段落で説明したように、我々は、非電動式の手術器具を使用することが好ましいいます。 1-2歳以上の豚の頭蓋骨は、しかし、それほど強固であり得ることを実証しINSTRと頭蓋骨の除去umentsないようcraniotomes、振動鋸、及び電気ドリル32等の電動機器の使用を必要とすることが可能です。その場合、まだそれによって天然の頭蓋骨のエントリポイントおよび前頭洞開発を利用して、上記に示したプロトコル手順に従うことが推奨されます。頭蓋底への提示前のアクセスは、エレガントかつ簡単ですが、嗅球の説明鈍いリリースは、脳( 図3EF)のより後方のリリースとは対照的に、直接視線誘導( 図3D)なしで実行する必要があります。嗅球の腹の部分は、したがって、リリースプロセスが開始される前に、球根に出て腹側前頭蓋底を掘削することにより、必要な場合にのみ、回避することができ、制御されない損傷をある程度被る可能性があります。頭蓋骨の除去中、特に非固定脳組織の操作は、histologiをもたらすことが指摘されていることに注意してください神経毒性の研究33で誤った結論につながる可能性があり、暗いニューロンのアーティファクトを、CAL。
頭蓋骨除去プロセスはまたcraniotomes、振動鋸、及び電気ドリル32のような機械を用いて行うことができます。これらは、プロセスをスピードアップするかもしれないが、彼らはまた、根底にある神経構造への損傷のリスクを増加します。このような機器にもコストがかかることが、最も可能性の高いほとんどの研究室に使用できなくなります。そこでアクセスし、使用することが容易である非電動外科用器具( 材料の表 ) を使用して現在の手順を実証することが好ましいています。
適切に使用する説明および図示した技術は、さらに巨視的分析に適している組織片が得られ、死後ブタの脳、下垂体、および/または子宮頸部脊髄( 図5)の露出および除去を可能にします"外部参照"> 5、6、19、26、31、脳スラブ28、およびその後の化学分析および/または組織学的処理6、14、15、16、17、25、26、27、31にセクショニング。
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
著者は、開示することは何もありません。
Acknowledgments
著者は感謝の気持ちで夫人トリーン・W・ミッケルセン、夫人リセM.継手、およびPåskehøjgaardのスタッフの巧みな支援を認めます。デンマーク医学研究評議会、ルンドベック財団、ノボノルディスク財団が財政的に研究を支持しました。
Materials
| Name | Company | Catalog Number | Comments |
| Heavy Scalpel Handle #4 | FST (Fine Science Tools) | 10008-13 | Good for skin incision and soft tissue removal |
| Non-Sterile Scalpel Blades #23 | FST | 10023-00 | |
| Scalpel Handle #7 | FST | 10007-12 | Optimal for dural incision and precision work |
| Non-Sterile Scalpel Blades #11 | FST | 10011-00 | |
| Surgical Forceps | FST | 11024-18 | The tip of the surgical forceps ensure a firm grip |
| Kerrison Bone Punch | Aesculap Neurosurgery | FF713R | Must be robust, bite size 3-5 mm |
| Bone Rongeur | Aesculap Neurosurgery | MD615 | Must be robust, bite size 15 x 5 mm |
| Bone Rongeur | Aesculap Neurosurgery | FO551R | Must be robust, bite size 25 x 15 mm |
| Bone Chisel | Lawton | 67-0335 | The size of the chisel head should not exceed 20 mm |
| Mallet (Hammer) | Millarco | 5624108 | Weigth 300 g, length 30 cm, head hit area size 2 x 2 cm |
| Micro-Scissor | FST | 14002-14 | |
| Dissector | Aesculap Neurosurgery | OL165R | |
| Göttingen minipigs | Ellegaard Göttingen Minipigs A/S, Denmark | ||
| Euthanimal | pentobarbital | ||
| Ketamine | Pfizer | ||
| Midazolam | Hameln Pharmaceuticals |
References
- Lind, M. N., Moustgaard, A., Jelsing, J., Vajta, G., Cumming, P., Hansen, A. K. The use of pigs in neuroscience: Modeling brain disorders. Neurosci Biobehav Rev. 31, 728-751 (2007).
- Bjarkam, C. R., et al. Neuromodulation in a minipig model of Parkinson disease. British J Neurosurg. 22 (Suppl. 1), S9-S12 (2008).
- Bjarkam, C. R., Cancian, G., Glud, A. N., Ettrup, K. S., Østergaard, L., Sørensen, J. C. MRI-guided stereotaxic targeting in pigs based on a stereotaxic localizer box fitted with an isocentric frame and use of SurgiPlan computer-planning software. J Neurosci Methods. 183 (2), 119-126 (2009).
- Sauleau, P., Lapouble, E., Val-Laillet, D., Malbert, C. H. The pig model in brain imaging and neurosurgery. Animal. 3 (8), 1138-1151 (2009).
- Bjarkam, C. R., et al. Safety and function of a new clinical intracerebral microinjection instrument for stem cells and therapeutics examined in the Göttingen minipig. Stereotact Funct Neurosurg. 88 (1), 56-63 (2010).
- Fjord-Larsen, L., et al. Long-term delivery of nerve growth factor by encapsulated cell biodelivery in the minipig basal forebrain. Mol Therapy. 18 (12), 2164-2172 (2010).
- Sørensen, J. C., et al. Development of neuromodulation treatments in a large animal model - Do neurosurgeons dream of electric pigs? Prog Brain Res. 194, 97-103 (2011).
- Dolezalova, D., et al. Pig models of neurodegenerative disorders: utilization in cell replacement-based preclinical safety and efficacy studies. J Comp Neurol. 522 (12), 2784-2801 (2014).
- Mikkelsen, M., Moller, A., Jensen, L. H., Pedersen, A., Harajehi, J. B., Pakkenberg, H. MPTP-induced Parkinsonism in minipigs: A behavioral, biochemical, and histological study. Neurotoxicol Teratol. 21, 169-175 (1999).
- Danielsen, E. H., et al. The DaNEX study of embryonic mesencephalic, dopaminergic tissue grafted to a minipig model of Parkinson's disease: Preliminary findings of effect of MPTP poisoning on striatal dopaminergic markers. Cell Transplant. 9 (2), 247-259 (2000).
- Dalmose, A., Bjarkam, C. R., Sørensen, J. C., Jørgensen, T. M., Djurhuus, J. C. Effects of high frequency deep brain stimulation on urine storage and voiding function in conscious minipigs. Neurourol Urodyn. 23 (3), 265-272 (2004).
- Dalmose, A., Bjarkam, C. R., Djurhuus, J. C. Stereotactic electrical stimulation of the pontine micturition center in the pig. Br J Urol. 95, 886-889 (2005).
- Andersen, F., Watanabe, H., Bjarkam, C. R., Danielsen, E. H., Cumming, P. The DaNeX Study Group. Pig brain stereotaxic standard space: Mapping of cerebral blood flow normative values and effect of MPTP-lesioning. Brain Res Bull. 66 (1), 17-29 (2005).
- Glud, A. N., et al. Direct gene transfer in the minipig CNS using stereotaxic lentiviral microinjections. Acta Neurobiol Exp. 70 (3), 1-8 (2010).
- Glud, A. N., et al. Direct MRI-guided stereotaxic viral mediated gene transfer of alpha-synuclein in the minipig CNS. Acta Neurobiol Exp. 71 (4), 508-518 (2011).
- Ettrup, K. S., Sørensen, J. C., Rodell, A., Alstrup, A. K. O., Bjarkam, C. R. Hypothalamic deep brain stimulation influences autonomic and limbic circuitry involved in the regulation of aggression and cardiocerebrovascular control in the minipig. Stereotact Funct Neurosurg. 90 (5), 281-291 (2012).
- Nielsen, M. S., et al. Continuous MPTP intoxication in the minipig results in chronic parkinsonian deficits. Acta Neurobiol Exp. 76, 198-210 (2016).
- Bjarkam, C. R., et al. A MRI-compatible stereotaxic localizer box enables high-precision stereotaxic procedures in pigs. J Neurosci Methods. 139 (2), 293-298 (2004).
- Bjarkam, C. R., Jorgensen, R. L., Jensen, K. N., Sunde, N. A. A., Sørensen, J. C. H. Deep brain stimulation electrode anchoring using BioGlue®, a protective electrode covering, and a titanium microplate. J Neurosci Methods. 168, 151-155 (2008).
- Ettrup, K. S., et al. Basic Surgical Techniques in the Minipig: Intubation, Transurethral Bladder Catheterization, Femoral Vessel Catheterization, and Transcardial Perfusion. J Vis Exp. (52), e2652 (2011).
- Ettrup, K. S., Tornøe, J., Sørensen, J. C., Bjarkam, C. R. A surgical device for minimally invasive implantation of experimental deep brain stimulation leads in large research animals. J Neurosci Methods. 200 (1), 41-46 (2011).
- Danielsen, E. H., et al. Positron emission tomography of living brain in minipigs and domestic pigs. Scand J Lab Anim Sci Suppl. 25 (1), 127-135 (1998).
- Røhl, L., et al. Time evolution of cerebral perfusion and ADC measured by MRI in a porcine stroke model. J Magn Reson Imaging. 15 (2), 123-129 (2002).
- Cumming, P., Gillings, N. M., Jensen, S. B., Bjarkam, C. R., Gjedde, A. Kinetics of the uptake and distribution of the dopamine D2/3 agonist (R)-N-[1-11C]n-propylnorapomorphine in brain of healthy and MPTP-poisoned Gottingen miniature pigs. Nucl Med Biol. 30 (5), 547-553 (2003).
- Jensen, K. N., Deding, D., Sørensen, J. C., Bjarkam, C. R. Long-term implantation of deep brain stimulation electrodes in the pontine micturition centre of the minipig. Acta Neurochir. 151 (7), 785-794 (2009).
- Rosendal, F., et al. Does chronic low dose treatment with ciclosporin influence the brain? A histopathological study in pigs. Transplantation Proc. 37 (8), 3305-3308 (2005).
- Nielsen, M. S., Sørensen, J. C., Bjarkam, C. R. The substantia nigra pars compacta of the minipig: An anatomical and stereological study. Brain Struct Funct. (4-5), 481-488 (2009).
- Sørensen, J. C., Bjarkam, C. R., Simonsen, C. Z., Danielsen, E., Geneser, F. A. Oriented sectioning of irregular tissue blocks in relation to computerized scanning modalities. Results from the domestic pig brain. J Neurosci Methods. 104, 93-98 (2000).
- Bjarkam, C. R., Pedersen, M., Sørensen, J. C. New strategies for embedding, orientation and sectioning of small brain specimens enable direct correlation to MR-images, brain atlases, or use of unbiased stereology. J Neurosci Methods. 108, 153-159 (2001).
- Bjarkam, C. R., Sørensen, J. C., Geneser, F. A. Distribution and morphology of serotonin-immunoreactive axons in the hippocampal region of the New Zealand white rabbit. I. Area dentata and hippocampus proper. Hippocampus. 13 (1), 21-37 (2003).
- Bjarkam, C. R., Glud, A. N., Orlowski, D., Sørensen, J. C., Palomero-Gallagher, N. The telencephalon of the minipig, cytoarchitecture and cortical surface anatomy. Brain Struct Funct. , e-pub ahead of print (2016).
- Boltze, J., Nitzsche, B., Geiger, K. D., Schoon, H. A. Histopathological investigation of different MCAO modalities and impact of autologous bone marrow mononuclear cell administration in an ovine stroke model. Transl Stroke Res. 2, 279-293 (2011).
- Jortner, B. S. The return of the dark neuron. A histological artifact complicating contemporary neurotoxicologic evaluation. Neurotoxicology. 27, 628-634 (2006).



