Summary
Målet med dette papir, og instruksjonsvideo er å beskrive hvordan man avsløre og fjerne postmortem grisehjerne og hypofysen i en intakt tilstand, egnet for etterfølgende makroskopisk og histologisk analyse.
Abstract
Griser har blitt stadig mer populære i stor dyr translasjonell nevro forskning som en økonomisk og etisk gjennomførbart alternativ til ikke-menneskelige primater. Den store hjernestørrelse av pluggen tillater bruk av konvensjonelle kliniske hjerne kameraene og direkte bruk og testing av nevrokirurgiske prosedyrer og utstyr fra den humane klinikk. Videre makroskopisk og histologisk analyse krever imidlertid postmortem eksponering av pluggen sentralnervesystemet (CNS) og etterfølgende fjerning av hjernen. Dette er ikke en lett oppgave, som piggen CNS er innkapslet av en tykk, bony skalle og ryggsøylen. Målet med dette papir, og instruksjonsvideo er å beskrive hvordan man avsløre og fjerne postmortem grisehjerne og hypofysen i en intakt tilstand, egnet for etterfølgende makroskopisk og histologisk analyse.
Introduction
Translasjonsforskning nevrovitenskap studier i griser har blitt stadig mer populært i løpet av de siste to tiårene. Den store størrelsen på grisehjerne muliggjør bruk av konvensjonelle kliniske hjerne kameraene og direkte bruk og testing av nevrokirurgiske prosedyrer og utstyr fra den humane klinikk 1, 2, 3, 4, 5, 6, 7, 8. I de siste 20 årene, griser, spesielt minigriser (f.eks, Gottingen minigris), er blitt brukt til å undersøke neuromodulatory behandlingsformer, slik som stamcelletransplantasjon; viral vektor transfeksjon; og dyp hjernestimulasjon rettet mot Parkinsons sykdom, fedme, depresjon og Alzheimers sykdom 2, 6,= "xref"> 9, 10, 11, 12, 13, 14, 15, 16, 17. Dette er fulgt av en utvikling av stereotaksiske og kirurgiske tilnærminger for å manipulere marsvin CNS 3, 18, 19, 20, 21. Er blitt evaluert anlegges CNS endringer i levende dyr ved å bruke hjerneavbildning (PET 10, 13, 22, 24 og MR-23), cystometry 11, 12, 25, gangartanalyse17, neurologisk evaluering 9, 17, og post mortem undersøkelse basert på histologi og stereological analyse 14, 15, 17, 26, 27, 31. Imidlertid krever post mortem analyse eksponering og fjerning av grisehjerne, som er ikke en lett oppgave, som en tykk, bony skalle og et fibrøst dural dekker omgir grisehjerne.
Målet med dette papiret og instruksjonsvideo er å beskrive hvordan postmortem gris hjernen og hypofysen kan bli utsatt og fjernet i et intakt tilstand i 15-20 min ved hjelp av ikke-motoriserte kirurgiske verktøy. Instruksjonsvideoen og fotografiske illustrasjoner viser mannlige minigriser (alder: 6 måneder, kroppsvekt: 20-25 kg) som brukes for en anatomisk studie om minigris hypofysen.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Animal anestesi og euthanesia ble utført i henhold til "Prinsipper for forsøksdyr omsorg" (NIH publikasjon nr 86-23, revidert 1985) og godkjent av det danske Rådet for dyre forskningsetikk.
1. instrumenter
- Samle instrumentene som presenteres i videoen og oppført i tabell for materialteknologi.
2. halshogging
MERK: Anestesi ble indusert ved en intramuskulær injeksjon av 5 ml av midazolam (5 mg / ml) og 5 ml av ketamin (25 mg / ml). 5-10 min senere, da dyret var dypt bedøvet, ble en ørevene kanylert og en dødelig overdose (100 mg / kg kroppsvekt) av natriumpentobarbital (200 mg / ml) ble gitt intravenøst. For å sikre at dyret var helt avlivet, ble den interdigital smerte refleks testet som vist ved Ettrup et al. (2011) 20. Komplett euthanization ble sikret som beskrevet ietikk utsagnet ovenfor, og etterfulgt av en transcardial perfusjon med 5 liter isotonisk saltløsning, som demonstrert ved Ettrup et al. (2011) 20. Alle viste prosedyrer utføres post mortem, utelukker behovet for velferds forholdsregler som er nødvendige for langsiktig anestesi og spes overlevelse.
- Fremrykning piggen ved en høy sirkulær cervikalt snitt, ved anvendelse av en kirurgisk skalpell, like under kjeve vinkel (figur 1A).
- Fremdeles med kirurgisk skalpell, fortsetter snittet anteriorly gjennom det myke vevet i halsen, inkludert larynx og øsofagus, inntil den benete ryggsøylen er nådd, omtrent i nivå med den kraniocervikale krysset.
- Forhånd kuttet med en kirurgisk skalpell fra den fremre side av kraniocervikale krysset, over den fremre bue av atlas, og gjennom den fremre atlantooccipital membranen, for derved å eksponere i spinalkanalen og ryggmargen (Figur 1B). Samtidig spør en assistent til å trekke gris kroppen bort fra gris hode for å lette tilgangen mellom skallebasis og den første halsvirvelen.
- Fortsett kirurgiske innsnitt gjennom durasekken og ryggmargen (figur 1B). Ta spesielt vare for å sikre at en fullstendig tverrgående delen av ryggmargen er oppnådd.
MERK: Hvis du ikke utføre det forrige trinnet kan resultere i uønsket trekkraft på ryggmargen og hjernen under følgende trinnene i halshogging prosessen. - Kraftig forlenge cranocervical krysset ved seksjonen nivå (figur 1C). På samme tid, bruker kirurgisk skalpell til de gjenværende avsnitt atlantooccipital ligamenter for å frigjøre leddforbindelsen mellom occipital kondylene og den øvre artikulert prosessen med atlas. Separer den gris hodet fra kroppen.

Figur 1: marsvin dekapitasjon. (A) Neck innsnitt (pil, underkjevens vinkel). (B) Snitt gjennom atlantooccipital leddbånd og dura-omgitt ryggmarg (SC) ved kraniocervikale krysset (C1, fremre bue av atlas, OC, occipital knokkelen). (C) Den bakre del av atlantooccipital ledd frigjøres ved en kraftig forlengelse (piler) ved seksjonen nivå. Klikk her for å se en større versjon av dette tallet.
3. Skull Åpning
- Plasser gris hode på et bord.
- Foreta en dorsal langsgående innsnitt med en kirurgisk skalpell gjennom huden og det underliggende bløtvev fra baksiden av snuten, over toppunktet av hodet, og ned gjennom den bakre del avoccipital området.
- Utsette den dorsale og bakre del av hodet ved å fjerne det myke vevet som ligger sideveis til den første innsnitt med en kirurgisk skalpell.
- Slipp temporale muskelen bilateralt fra skallen (figur 2A) med en kirurgisk skalpell. Pass på at den bakre nakkeknøl er ryddet av bløtvev.
- Bruk bakre inngangen til foramen magnum for å fjerne bakhode bein med en Kerrison bein slag- og bein Rongeurs og utsette den dura dekket cerebellum (figur 2B).
- Gå tilbake til den eksponerte fremre side av hodeskallen, og velg en inngangspunkt i frontal bein, rett foran øynene. På dette punktet, bruker et ben meisel med en hammer for å trenge inn i hjerneskallen og går inn i frontal sinus (figur 2C).
- Bruk av omfanget av den frontale sinus til videre dorsoposterior fjerning av det ytre hodeskallen laminat med et ben rongeur eller ben slag og eksponere den indre, tynnebony skalle lamina som dekker storhjernen (figur 2D).
- Forsiktig for å åpne den indre bein skallen lamina anteriort med en hammer og meisel et ben for å eksponere dura dekket hjerne (figur 2E).
- Fortsett fjerning av ben i sideretning ved hjelp av et ben meisel og et ben rongeur gjennom den temporale og parietale ben for å frigjøre den endelige dorsoposterior del av skallen, som ligger mellom de allerede utsatte deler av dura dekket hjerne og cerebellum (figur 2F).
MERK: Det er ofte mulig, under det siste trinnet i denne prosedyren, for å bruke meisel for å bryte åpne de resterende bakre skallebenet fra en side, akkurat som en åpner en dør.
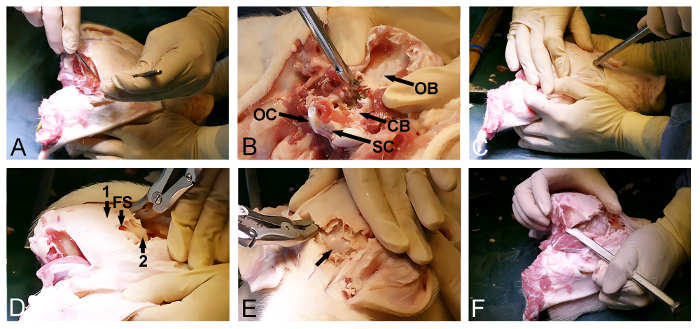
Figur 2: marsvin skalle åpning. (A) Eksponering av dorsoposterior skalleoverflaten, inkludert fjerning av occipital og tidsmessige muskler. (B) fjerning av den occipital ben (CB, dura dekket cerebellum, OB, occipital ben, OC, occipital knokkelen, og SC, ryggmarg). (C) En hammer og meisel et bein blir brukt til å trenge gjennom skallen anteriort og å gå inn i frontal sinus på nivå med øynene. (D) Omfanget av den frontale sinus (FS) brukes for å fjerne den ytre tykke hodeskallen (1), utsette en tynn indre ben plate (2) som dekker storhjernen. (E) Fjerning av den tynne ben lamina, utsette den dura dekket hjernen (pil). (F) Til slutt, en hammer og et ben meisel brukes til sideveis å koble fremre og bakre skallen åpninger. Klikk her for å se en større versjon av dette tallet.
4. Brain fjernelse aval
- Bruk kirurgisk pinsett til å løfte dura og skape en mild snitt nær venøse superior sagittal sinus med en fin kirurgisk skalpell (figur 3A).
- Bruke mikro-saks eller en dura-kniv for å åpne ytterligere dura som dekker den dorsale overflaten av hjernen.
MERK: Spesielle hensyn må tas ved fjerning dura som svarer til den cerebellar tentorium (figur 3B), som bevaring av dette dural blad vil hindre påfølgende hjerne fjerning. - Plasser gris hodet vertikalt (figur 3C).
- Bruk benet meisel eller et dissector å frigjøre ventroanterior hjernen ved sløv disseksjon av luktelappen fra dura-dekket etasje i kraniet (figur 3D).
- Bruk en fin kirurgisk skalpell til seksjon den eksponerte chiasma (figur 3E). Expose og § hypofysen stilken og oculomotor nerver.
- Slipp ventral hjernestammen ved seksjonering LOwer hjernenerver (figur 3F) med en fin kirurgisk skalpell. Kontroller at dural cerebellar tentorium ble helt snittet (figur 3B), da dette dural blad ellers vil skjære gjennom hjernestammen under frigjøringsprosessen.

Figur 3: minigris-hjerne fjerning. (A) Dural åpning med kirurgiske pinsetter og en dura kniv. (B) Man må passe på å fullstendig innsnittet dural blad (pil), som ligger mellom storhjernen og lillehjernen. (C) Piggen hodet er plassert vertikalt for bedre visualisering av skallen joner og for at tyngdekraften til å bistå i den tilsiktede forskyvning av hjernen. (D) En dissector eller et ben meisel brukes til å lindre luktelappen ved butt-seksjon fra dura-covered skallebasis. (E) Disseksjonen fortsettes i en bakre retning langs skallebasis for eksponering og snitting av chiasma (pil), infundibular stilken, og oculomotor nerver. (F) Hjernen frigivelse er ferdig med den delen av de nedre hjernenerver som de avviker fra den ventrale overflaten av hjernestammen (III, oculomotor nerve, IV, trochlear nerve; V, trigeminus, og VI, abducens nerve). Klikk her for å se en større versjon av dette tallet.
5. hypofyse Removal
- Identifisere hypofysen stilken og dens omgivende dural blad (den diapragma sellae) i skallen gulvet (figur 4A).
- Innsnittet dural blad sideveis til hypofysen stengel ved hjelp av en fin kirurgisk skalpell (figur 4B).
- Bruk en dissector å frigjøre pituitary og løfte den ut av hypofyse (Figur 4C).

Figur 4: minigris-hypofyse fjerning. (A) hypofyse (*) blir identifisert i skallen gulvet (1, olfaktorisk bulbus, 2, chiasma, og PF, bakre skallegrop). (B) Den dural belegget (sellar diagphragm, (pil)) blir radert sideveis. (C) Den hypofysen (pil) frigjøres med en dissector og løftes ut av hypofyse. Skala bar (AC) = 10 mm. Klikk her for å se en større versjon av dette tallet.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
For å hindre at vevet materiale fra å tørke ut, er det anbefalt å lagre fjernet hjerne og hypofyse i en krukke fylt med fikseringsmiddel eller isotonisk saltoppløsning umiddelbart etter makroskopisk analyse er blitt utført. Vevet materiale kan lagres i fiksativ i år, mens lagring i isotonisk saltoppløsning, selv i et kjøleskap, vil føre til vev nedbrytning med tiden.
Den fjernede hypofysen kan også være direkte frosset ved neddykking i tørris-avkjølt væske 2-metylbutan, mens den intakte grisehjerne er for stor for direkte fryse 28. I stedet, er det anbefalt å skjære grisehjerne, som tidligere påvist 28, inn i 9-15 mm tykke parallelle koronale vev plater som kan fryses in toto og kryostat-seksjonert i 40 um tykke seksjoner 5, 18, 26, 28. Alternativt kan spesifikke hjerneområder være fri-dissekert fra den fjernet intakte hjerne eller skiver hjerne plate og underlegges ytterligere histologisk behandling etter vibratome seksjonering 30, parafin / metakrylat innebygging og mikrotomen seksjonering 6, 17, 27, eller frysing og kryostaten seksjonering 6, 14, 15, 25. I våre omgivelser, er svineskrotter endelig plassert i bestemte plastbeholdere og lagret i et eget kjølerom inntil de blir samlet og transportert til et biologisk nedbrytende anlegg.
Med bruk av ikke-motorisert kirurgisk verktøy (tabell av materialer), den beskrevne teknikk (figurene 1 g> - 3) gjør det mulig, i omtrent 15-20 minutter, fjerning av det intakte grisehjerne (figur 5AB), mens de avkuttede hjernenerver og hypofysen forblir koblet til skallen gulvet (figur 4A). Likeledes kan hypofysen ganske enkelt fjernes, intakt, etter å ha fjernet overliggende hjernen og frigjøring av dural sellar membranen (figur 4 og 5 C).
Den resulterende hjernen og / eller hypofyse (figur 5) kan deretter sendes til makroskopiske analyse at, bortsett fra direkte visuell inspeksjon, kan omfatte størrelse og volummålinger 31. Dette kan bli etterfulgt av orientert oppdeling i mindre hjerne plater 28, 29 er egnet for kjemisk analyse og / eller ytterligere histologisk preparat, beising, og mikroskopisk analyse 6,s = "ekstern referanse"> 14, 15, 17, 25, 26, 27.

Figur 5: Den minigris-hjerne (A og B) og hypofysen (C). (A) Brain, laterodorsal vis (BS, hjernestammen, CB, cerebellum, og CRB, cerebrum). (B) Brain, ventral vis (BS, hjernestammen, CB, cerebellum, og CRB, cerebrum). (C) Pituitary, sett bakfra (AH, adenohypofysen og NH, neurohypophysis). Skalastolpe (A og B) = 10 mm, (C) = 5 mm. Klikk her for å se en større versjon av dette tallet.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
De fleste eksperimentelle nevro studier er utført på små dyrearter, slik som mus og rotter, hvor tilgang til CNS er tilrettelagt med en tynn skull- og dural-tykkelse. I større forsøksdyr som griser 1, 4, 8, sauer 32, og ikke-humane primater, den betraktelige tykkelse av disse strukturene nødvendiggjør bruk av robuste instrumenter (tabell av materialer) og riktig startpunkter for skallebenet fjerning (figur 2). Kjennskap til å begrense durale blader (figur 3 og 4) er nødvendig før CNS kan aksesseres og hjernen fjernes uten fare.
Det anbefales å la dura intakt under skallebenet fjerning, da dette vil beskytte det underliggende hjernen mot skade. Forrige transcardial fiksering 20 kan også stivne og SLIghtly krympe hjernen, slik at ben og dural fjerningsprosess som skal utføres enklere og med større sikkerhet. Et særtrekk av pluggen skallen, i motsetning til sau og ikke-menneskelige primater, er den progressive utvidelse av frontal sinus med alderen, noe som kan være fordelaktig i fjerningen hodeskallen (figur 2). Den presenterte teknikken kan følgelig anvendes på alle store dyrearter, men bare i barrer, særlig de eldre enn 6 måneder, vil den frontale sinus utvikles nok til å gi hjelpemiddel i prosessen skallebenet fjerning. Endelig er fullstendig seksjonering av ryggmargen i løpet av hodesnittprosessen (figur 1B) og fullstendig seksjonering av dural lillehjernen tentorium (figur 3B) før den endelige hjernen frigivelse absolutt nødvendig for å unngå etterfølgende skade på hjernestammen.
I noen studier, kan det være fordelaktig å ha en del av den rostrale cervical ryggmargen er festet til hjernen.Dette kan oppnås ved å plassere den første hodesnitt snittet (figur 1A) mer caudally på halsen, slik at tilgang til ryggmargen gjennom en mellomvirvel cervical platen i stedet for den kraniocervikale krysset, som demonstrert i det aktuelle video. Den bakre bein fjerning vil da måtte starte fra den eksponerte hale lamina. Bortsett fra dette, vil teknikken være like, så det er viktig å huske at ryggmargen må være helt seksjonert før halshogging er ferdig med kraftig utvidelse ved seksjon nivå (figur 1). Den nåværende fremgangsmåte er vist på fikserte dyr, som selve bakgrunn studie nødvendig HPLC-analyse av det avledede hypofysen. Vær imidlertid oppmerksom på at nøyaktig samme teknikken brukes på dyr transcardially fiksert med paraformaldehyde 3, 5, 14, 15,
Som omtalt i de neste avsnittene, har vi foretrukket å bruke ikke-motorisert kirurgiske verktøy. Det skalle av griser i alderen 1-2 år ovenfor kan imidlertid være så robust at skalle fjerning med den demonstrerte instruments ikke er mulig, hvilket nødvendiggjør bruk av motor instrumenter, for eksempel craniotomes, som oscillerer sager, og elektriske driller 32. I dette tilfelle anbefales det fremdeles å følge protokolltrinn som er angitt ovenfor, for derved å trekke fordel av de naturlig forekommende skalle inngangspunkter og frontal sinus utvikling. Den presenterte fremre adgang til skallebasis er elegant og enkel, men den beskrevne sløv frigivelse av olfactory pærer må utføres uten direkte visuell veiledning (figur 3D), i motsetning til den mer bakre frigivelse av hjernen (figur 3EF). Den ventrale del av olfactory knoller kan således tåle en viss grad av ukontrollert skader som bare kan unngås, hvis det er nødvendig, ved å bore den fremre skallebasis ut ventral til pærene før frigjøringsprosess innledes. Legg merke til at manipulering, særlig av ufiksert hjernevev i løpet av skallen fjernelse, er blitt antydet for å resultere i histologi cal mørk nevron gjenstand, som kan føre til feilaktige konklusjoner i neurotoxicological studier 33.
Prosessen skallebenet fjernelse kan også utføres med maskiner som craniotomes, som oscillerer sager, og elektriske driller 32. Disse kan fremskynde prosessen, men de vil også øke risikoen for skade på underliggende nevrale strukturer. Slikt utstyr kan også være kostbart og vil mest sannsynlig være utilgjengelig for de fleste laboratorier. Vi har derfor foretrukket å demonstrere den aktuelle prosedyren ved hjelp av ikke-motorisert kirurgisk utstyr (Table of Materials) som er lett å få tilgang til og bruke.
Den beskrevne og illustrerte teknikken vil, når den skal anvendes, gjøre det mulig for eksponering og fjerning av postmortem grisehjerne, hypofyse, og / eller cervical ryggmargen (figur 5), noe som resulterer i vev stykker som er godt egnet for videre analyse makroskopiske"xref"> 5, 6, 19, 26, 31, seksjonering inn i hjerne plater 28, og deretter kjemisk analyse og / eller histologiske bearbeiding 6, 14, 15, 16, 17, 25, 26, 27, 31.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Forfatterne har ikke noe å avsløre.
Acknowledgments
Forfatterne erkjenner med takknemlighet dyktige hjelp fra fru Trine W. Mikkelsen, fru Lise M. Montering, og personalet på Påskehøjgaard. Den danske Medical Research Council, Lundbeck Foundation, og Novo Nordisk Foundation finansielt støttet studien.
Materials
| Name | Company | Catalog Number | Comments |
| Heavy Scalpel Handle #4 | FST (Fine Science Tools) | 10008-13 | Good for skin incision and soft tissue removal |
| Non-Sterile Scalpel Blades #23 | FST | 10023-00 | |
| Scalpel Handle #7 | FST | 10007-12 | Optimal for dural incision and precision work |
| Non-Sterile Scalpel Blades #11 | FST | 10011-00 | |
| Surgical Forceps | FST | 11024-18 | The tip of the surgical forceps ensure a firm grip |
| Kerrison Bone Punch | Aesculap Neurosurgery | FF713R | Must be robust, bite size 3-5 mm |
| Bone Rongeur | Aesculap Neurosurgery | MD615 | Must be robust, bite size 15 x 5 mm |
| Bone Rongeur | Aesculap Neurosurgery | FO551R | Must be robust, bite size 25 x 15 mm |
| Bone Chisel | Lawton | 67-0335 | The size of the chisel head should not exceed 20 mm |
| Mallet (Hammer) | Millarco | 5624108 | Weigth 300 g, length 30 cm, head hit area size 2 x 2 cm |
| Micro-Scissor | FST | 14002-14 | |
| Dissector | Aesculap Neurosurgery | OL165R | |
| Göttingen minipigs | Ellegaard Göttingen Minipigs A/S, Denmark | ||
| Euthanimal | pentobarbital | ||
| Ketamine | Pfizer | ||
| Midazolam | Hameln Pharmaceuticals |
References
- Lind, M. N., Moustgaard, A., Jelsing, J., Vajta, G., Cumming, P., Hansen, A. K. The use of pigs in neuroscience: Modeling brain disorders. Neurosci Biobehav Rev. 31, 728-751 (2007).
- Bjarkam, C. R., et al. Neuromodulation in a minipig model of Parkinson disease. British J Neurosurg. 22 (Suppl. 1), S9-S12 (2008).
- Bjarkam, C. R., Cancian, G., Glud, A. N., Ettrup, K. S., Østergaard, L., Sørensen, J. C. MRI-guided stereotaxic targeting in pigs based on a stereotaxic localizer box fitted with an isocentric frame and use of SurgiPlan computer-planning software. J Neurosci Methods. 183 (2), 119-126 (2009).
- Sauleau, P., Lapouble, E., Val-Laillet, D., Malbert, C. H. The pig model in brain imaging and neurosurgery. Animal. 3 (8), 1138-1151 (2009).
- Bjarkam, C. R., et al. Safety and function of a new clinical intracerebral microinjection instrument for stem cells and therapeutics examined in the Göttingen minipig. Stereotact Funct Neurosurg. 88 (1), 56-63 (2010).
- Fjord-Larsen, L., et al. Long-term delivery of nerve growth factor by encapsulated cell biodelivery in the minipig basal forebrain. Mol Therapy. 18 (12), 2164-2172 (2010).
- Sørensen, J. C., et al. Development of neuromodulation treatments in a large animal model - Do neurosurgeons dream of electric pigs? Prog Brain Res. 194, 97-103 (2011).
- Dolezalova, D., et al. Pig models of neurodegenerative disorders: utilization in cell replacement-based preclinical safety and efficacy studies. J Comp Neurol. 522 (12), 2784-2801 (2014).
- Mikkelsen, M., Moller, A., Jensen, L. H., Pedersen, A., Harajehi, J. B., Pakkenberg, H. MPTP-induced Parkinsonism in minipigs: A behavioral, biochemical, and histological study. Neurotoxicol Teratol. 21, 169-175 (1999).
- Danielsen, E. H., et al. The DaNEX study of embryonic mesencephalic, dopaminergic tissue grafted to a minipig model of Parkinson's disease: Preliminary findings of effect of MPTP poisoning on striatal dopaminergic markers. Cell Transplant. 9 (2), 247-259 (2000).
- Dalmose, A., Bjarkam, C. R., Sørensen, J. C., Jørgensen, T. M., Djurhuus, J. C. Effects of high frequency deep brain stimulation on urine storage and voiding function in conscious minipigs. Neurourol Urodyn. 23 (3), 265-272 (2004).
- Dalmose, A., Bjarkam, C. R., Djurhuus, J. C. Stereotactic electrical stimulation of the pontine micturition center in the pig. Br J Urol. 95, 886-889 (2005).
- Andersen, F., Watanabe, H., Bjarkam, C. R., Danielsen, E. H., Cumming, P. The DaNeX Study Group. Pig brain stereotaxic standard space: Mapping of cerebral blood flow normative values and effect of MPTP-lesioning. Brain Res Bull. 66 (1), 17-29 (2005).
- Glud, A. N., et al. Direct gene transfer in the minipig CNS using stereotaxic lentiviral microinjections. Acta Neurobiol Exp. 70 (3), 1-8 (2010).
- Glud, A. N., et al. Direct MRI-guided stereotaxic viral mediated gene transfer of alpha-synuclein in the minipig CNS. Acta Neurobiol Exp. 71 (4), 508-518 (2011).
- Ettrup, K. S., Sørensen, J. C., Rodell, A., Alstrup, A. K. O., Bjarkam, C. R. Hypothalamic deep brain stimulation influences autonomic and limbic circuitry involved in the regulation of aggression and cardiocerebrovascular control in the minipig. Stereotact Funct Neurosurg. 90 (5), 281-291 (2012).
- Nielsen, M. S., et al. Continuous MPTP intoxication in the minipig results in chronic parkinsonian deficits. Acta Neurobiol Exp. 76, 198-210 (2016).
- Bjarkam, C. R., et al. A MRI-compatible stereotaxic localizer box enables high-precision stereotaxic procedures in pigs. J Neurosci Methods. 139 (2), 293-298 (2004).
- Bjarkam, C. R., Jorgensen, R. L., Jensen, K. N., Sunde, N. A. A., Sørensen, J. C. H. Deep brain stimulation electrode anchoring using BioGlue®, a protective electrode covering, and a titanium microplate. J Neurosci Methods. 168, 151-155 (2008).
- Ettrup, K. S., et al. Basic Surgical Techniques in the Minipig: Intubation, Transurethral Bladder Catheterization, Femoral Vessel Catheterization, and Transcardial Perfusion. J Vis Exp. (52), e2652 (2011).
- Ettrup, K. S., Tornøe, J., Sørensen, J. C., Bjarkam, C. R. A surgical device for minimally invasive implantation of experimental deep brain stimulation leads in large research animals. J Neurosci Methods. 200 (1), 41-46 (2011).
- Danielsen, E. H., et al. Positron emission tomography of living brain in minipigs and domestic pigs. Scand J Lab Anim Sci Suppl. 25 (1), 127-135 (1998).
- Røhl, L., et al. Time evolution of cerebral perfusion and ADC measured by MRI in a porcine stroke model. J Magn Reson Imaging. 15 (2), 123-129 (2002).
- Cumming, P., Gillings, N. M., Jensen, S. B., Bjarkam, C. R., Gjedde, A. Kinetics of the uptake and distribution of the dopamine D2/3 agonist (R)-N-[1-11C]n-propylnorapomorphine in brain of healthy and MPTP-poisoned Gottingen miniature pigs. Nucl Med Biol. 30 (5), 547-553 (2003).
- Jensen, K. N., Deding, D., Sørensen, J. C., Bjarkam, C. R. Long-term implantation of deep brain stimulation electrodes in the pontine micturition centre of the minipig. Acta Neurochir. 151 (7), 785-794 (2009).
- Rosendal, F., et al. Does chronic low dose treatment with ciclosporin influence the brain? A histopathological study in pigs. Transplantation Proc. 37 (8), 3305-3308 (2005).
- Nielsen, M. S., Sørensen, J. C., Bjarkam, C. R. The substantia nigra pars compacta of the minipig: An anatomical and stereological study. Brain Struct Funct. (4-5), 481-488 (2009).
- Sørensen, J. C., Bjarkam, C. R., Simonsen, C. Z., Danielsen, E., Geneser, F. A. Oriented sectioning of irregular tissue blocks in relation to computerized scanning modalities. Results from the domestic pig brain. J Neurosci Methods. 104, 93-98 (2000).
- Bjarkam, C. R., Pedersen, M., Sørensen, J. C. New strategies for embedding, orientation and sectioning of small brain specimens enable direct correlation to MR-images, brain atlases, or use of unbiased stereology. J Neurosci Methods. 108, 153-159 (2001).
- Bjarkam, C. R., Sørensen, J. C., Geneser, F. A. Distribution and morphology of serotonin-immunoreactive axons in the hippocampal region of the New Zealand white rabbit. I. Area dentata and hippocampus proper. Hippocampus. 13 (1), 21-37 (2003).
- Bjarkam, C. R., Glud, A. N., Orlowski, D., Sørensen, J. C., Palomero-Gallagher, N. The telencephalon of the minipig, cytoarchitecture and cortical surface anatomy. Brain Struct Funct. , e-pub ahead of print (2016).
- Boltze, J., Nitzsche, B., Geiger, K. D., Schoon, H. A. Histopathological investigation of different MCAO modalities and impact of autologous bone marrow mononuclear cell administration in an ovine stroke model. Transl Stroke Res. 2, 279-293 (2011).
- Jortner, B. S. The return of the dark neuron. A histological artifact complicating contemporary neurotoxicologic evaluation. Neurotoxicology. 27, 628-634 (2006).



