Summary
Este manuscrito descreve em vitro protocolos de vídeo microscopia para avaliar a função vascular nas artérias de resistência cerebral de rato. O manuscrito também descreve técnicas para avaliar a densidade de microvessel com perfusão de lectina e tecido fluorescente etiquetada usando Laser Doppler Flowmetry.
Abstract
Este protocolo descreve o uso da microscopia em vitro de televisão para avaliar a função vascular nas artérias de resistência cerebral isolada (e outros vasos) e descreve técnicas para avaliar a perfusão do tecido usando Laser Doppler Flowmetry (LDF ) e microvessel densidade utilizando fluorescente etiquetado lectina de Griffonia simplicifolia (GS1). Métodos atuais para o estudo isolaram artérias de resistência no transmural pressões encontradas na vivo e na ausência de células parenquimais influências fornecem uma ligação crítica entre estudos em vivo e informações obtidas a partir de molecular abordagens reducionistas que fornecem a limitada visão Integrativa respostas a nível de todo animal. LDF e técnicas para identificar seletivamente arteríolas e capilares com fluorescente-etiquetadas GS1 lectina fornecem soluções práticas para permitir que os investigadores estender os conhecimentos adquiridos em estudos de artérias de resistência isolada. Este documento descreve a aplicação destas técnicas para obter conhecimentos fundamentais da fisiologia vascular e patologia no rato como modelo experimental geral e em uma variedade de especializados geneticamente cepas de rato "designer" que podem fornecer importantes insights sobre a influência de genes específicos na importantes fenótipos vasculares. Utilizando essas abordagens experimentais valiosas em cepas de ratos desenvolvidas pela reprodução seletiva estratégias e novas tecnologias para a produção de modelos de gene nocaute no rato, vai expandir o rigor das instalações científicas desenvolvidas em modelos do rato nocaute e Estenda esse conhecimento para um modelo animal mais relevante, com um fundo fisiológico bem compreendido e aptidão para estudos fisiológicos devido ao seu tamanho maior.
Introduction
Os primeiros estudos da função vascular nas artérias utilizadas eletroduto artérias e em muitos casos, a aorta. Geração de força nas grandes artérias geralmente foi estudada por anexar um segmento de anel da artéria de um transdutor de força em um banho de tecido; no caso da aorta, por corte helicoidal tiras do navio para que as fibras musculares lisas foram orientadas na direcção longitudinal entre o ponto de fixação e o transdutor de força, para fornecer a melhor estimativa da força gerada pela contração do o músculo liso ao longo do eixo longitudinal. A técnica padrão para o corte de tiras helicoidais da aorta foi colocar uma vareta de vidro no lúmen do vaso, fazer um corte na parede do vaso no ângulo desejado, e espere até o fim da borda exposta da parede do vaso, como o corte foi estendido para produzir todo um faixa de helicoidal do navio. Nesse ponto, o lado endotelial do vaso era geralmente apagado para remover detritos antes de acoplar a tira de navio para o transdutor de força e submergindo a preparação em um oxigenado e temperatura controlada banho de tecido. Eventualmente, que a abordagem levou a uma das mais famosas e importantes descobertas na história da fisiologia por Furchgott e Zawadski1, ou seja, o papel do endotélio derivado fator relaxante (EDRF), posteriormente identificado como óxido nítrico, em regulação da função vascular. O evento crucial, levando a essa descoberta foi uma situação em que os investigadores mantiveram um endotélio intacto, evitando o contato do lado endotelial da artéria com superfícies estrangeiras, em notei que a tira da aorta não exibem o esperado contração de acetilcolina (ACh), mas em vez disso relaxado em resposta a ACh. Baseia essa observação, os investigadores desenvolveram uma preparação de "sanduíche" em que eles ligados a um segmento da aorta com um endotélio intacto (mas incapaz de gerar força contrátil) para uma faixa padrão helicoidal da aorta e convertido o ACh-induzido contração em um relaxamento.
Dois grandes avanços nesta área que são extensivamente usados hoje são o desenvolvimento de preparações para medir a força contrátil ativa na resistência de pequenas artérias2,3 (tais como aqueles no mesentério intestinal3 ) e canulados resistência artéria preparações4,5,6. Em um dos primeiros relatórios, Mulvany e Halpern3 descreveu a utilização da preparação de myograph de fio para estudar a força contrátil activa nas artérias de resistência isolada do mesentério intestinal de ratos de espontaneamente hipertensos (SHR) e normotensos controles WKY. Na sequência do desenvolvimento do sistema de myograph do fio, resistência canulado artéria preparações foram desenvolvidas para permitir estudos dos vasos mais perto na vivo condições4,5,6. Enquanto ambas as abordagens fornecem resultados valiosos, a preparação de artéria canulada tem as vantagens de mais eficazmente preservando intrínseca Tom ativo nas artérias; e permitindo que os investigadores a estudar ativas miogênico respostas a alterações nas respostas de pressão e navio transmural a mudanças na taxa de fluxo e tensão de cisalhamento endotelial (ver revisão por Halpern e Kelley6).
Dos principais objetivos do presente trabalho é descrever como a empregar a técnica time-honored de vídeo microscopia usando artérias de resistência isolada, canulados para obter informações precisas sobre os mecanismos que regulam o tônus ativo nestes crucial vasos, independentes das influências de células neurais, humoral ou parenquimatosa. Esta informação básica, empregando um modelo do rato padrão e exemplos de nossos estudos de novo geneticamente modificadas cepas de rato, irá fornecer o leitor com uma ideia dos tipos de insights sobre a função vascular que pode ser adquirida com televisão abordagens de microscopia, e que podem ser empregadas em estudos envolvendo qualquer controle e grupo experimental (s) de escolha do investigador, incluindo poderosos novos modelos de rato experimental produzido por endogamia seletiva e recentemente desenvolvido da genética técnicas de engenharia.
Graças à precisão das abordagens de microscopia de televisão, medição de mudanças de diâmetro em preparações de artéria canulada pode fornecer altamente valiosas informações sobre mecanismos endotélio-dependente e independente de endotélio de vascular relaxamento, bem como alterações importantes (e às vezes inesperadas) em mecanismos de controlo vascular, ocorrendo com hipertensão, dieta alta em sal e outras intervenções experimentais. Além disso, a medição de relações de pressão-diâmetro em isolado e canulado artérias de resistência que estão relaxadas màxima por tratamento com Ca2 +-livre solução ou uma droga farmacológica vasodilatador, permite que o investigador avaliar mudanças estruturais nas artérias devido à remodelação vascular e para calcular o passivo de tensão-deformação relacionamentos7 que pode fornecer importantes insights sobre as mudanças nas propriedades mecânicas passivas das artérias que podem afetar a função arterial independente de (ou além de) alterações nos mecanismos de controle ativo. Também é importante observar que as informações obtidas a partir de estudos das artérias de resistência isolada podem ser complementadas por informações obtidas utilizando LDF, um método prático para avaliar a perfusão do tecido a todo animal nível8,9 ,10, e por informações obtidas de avaliar a densidade de microvessel usando fluorescente etiquetado GS1 lectina, que vincula especificamente para partes de glicoproteína na membrana do porão de pequenas arteríolas e capilares11 , 12. o último método fornece uma estimativa altamente precisa da densidade de microvessel que não está sujeita as clássicas dificuldades em estimar a densidade de microvessel pela contagem de vasos na vivo, por exemplo, faltando não perfundidos vasos onde o fluxo sanguíneo é interrompido devido ao fechamento ativo das arteríolas. Quando usados em conjunto, estas abordagens podem fornecer uma visão importante para correlacionar alterações funcionais nas artérias de resistência isolada para alterações na perfusão do tecido a nível microcirculatory; e alguns exemplos do uso dessas abordagens valiosos em conjunto com técnicas de artéria canulada também serão fornecidos no presente manuscrito.
O presente trabalho centra-se na utilização de técnicas de vídeo microscopia para avaliar alterações vasculares nas artérias de outbreds ratos Sprague-Dawley. No entanto, é importante salientar que estas técnicas têm provado para ser altamente valioso na elucidação de alterações fenotípicas em cepas de ratos geneticamente modificados altamente especializado criadas por reprodução seletiva ou gene utilizando técnicas de edição. Neste manuscrito, proporcionamos exemplos de técnicas de microscopia como vídeo forneceram informações importantes sobre a função vascular em um número de rato valioso modelos, incluindo a variedade de rato, um rato puras de (SS) sal-sensíveis de Dahl que é o mais amplamente utilizado o modelo experimental para estudar os mecanismos de sal sensível hypertenson18,19,20,21,22,23; e ratos consomic criados por meio de reprodução seletiva de ratos SS com a cepa de rato marrom Noruega (BN) diferenciação de sal. Os painéis de rato consomic, cada cromossoma de rato a Noruega de Brown tem sido meio individualmente para o fundo genético26 de25,Dahl SS24,. Uso de painéis de rato consomic forneceu pistas valiosas sobre cromossomos específicos que contribuem para a sensibilidade de sal da pressão arterial e outros fenótipos, incluindo a reatividade vascular24,25,26 de27, ,28.
Estratégias de reprodução seletiva utilizando SS ratos e ratos consomic carregando cromossomos individuais de BN também permitiram a geração de cepas congenic estreitada com pequenos segmentos do meio de cromossomos individual Brown Noruega em SS Dahl genética fundo de22,29. Estes podem fornecer extremamente valiosos entrada em genes específicos ou estreitas regiões dos cromossomos que podem afetar a cruciais variáveis fisiológicas, tais como pressão arterial, dano renal e reatividade vascular22,29. Outra adição poderosa para a caixa de ferramentas genéticas do rato é o desenvolvimento de modelos de nocaute do gene do rato utilizando gene avançada técnicas, incluindo ZFNs, transcriptional activator-como-effector nucleases (TALENS) e mais recentemente CRISPR-Cas913 ,14,15,16,17. O advento dessas técnicas poderosas que permitem que os genes ao ser nocauteado no rato é um desenvolvimento extremamente importante porque gene nocaute estudos até à data utilizaram (e continuam a usar) ratos quase exclusivamente. Outro componente experimental no presente trabalho demonstra o valor da artéria canulada técnicas e vídeo microscopia para avaliar os mecanismos de controle fisiológico em ratos nocaute falta a transcrição de proteção antioxidante e célula mestre fator, fator nuclear (eritroide-derivado 2) - como - 2 (NRF2)30,31, que foram desenvolvidos usando tecnologia TALEN no fundo genético de Sprague-Dawley17. Esses experimentos, foram utilizadas em vitro vídeo microscopia técnicas para fornecer uma verificação funcional de perda do gene NRF2 e testar uma abordagem terapêutica potencialmente valiosa baseada em directo upregulation de antioxidante NRF2-mediada defesas. NRF-2 é de substancial importância terapêutica no combate à estresse oxidativo vascular em seres humanos, à luz dos resultados decepcionantes de ensaios clínicos envolvendo a administração direta de antioxidantes como as vitaminas C e E32.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
O Medical College de Wisconsin institucional Animal Care e Comissão de utilização (IACUC) aprovaram todos os protocolos descritos neste documento e todos os procedimentos estão em conformidade com o National Institutes of Health (NIH) escritório de laboratório Animal Welfare (OLAW) regulamentos.
1. preparação de soluções e câmara de navio
- Antes de realizar uma série de experiências, preparar 2L de 20 x solução concentrada de estoque de sal, consistindo de 278 g/L de NaCl; 14 g/L KCl; 11,52 g/L MgSO4. 7H2O; e 9,4 g/L de CaCl2. 2H2O. Também preparar 2L de 20 x concentrado regulador consistindo de 80,8 g/L NaHCO3 e 0,4 g/L EDTA, e 2 L de 20 x concentrado Ca2 +-livre solução consistindo de 281,6 g/L de NaCl; 14 g/L KCl e 11,52 g/L MgSO4. 7H2O.
Nota: 20 X soluções estoque pode ser armazenado em geladeira até o uso. - No dia do experimento, preparar 2 L de solução salina fisiológica (PSS) dos anos 20 x soluções estoque concentradas, como segue: Adicionar 100 mL de 20 x estoque de sal a 1.800 mL de água deionizada em um balão de Erlenmeyer de 2 L ou copo num prato motorizado agita. Adicionar 100 mL de 20 x depósito regulador enquanto desenroscada continuamente a solução com uma mistura de gases contendo 21% O2, 5% de CO2, contrapeso N2e mexendo com uma barra de agita magnética. Adicionar lentamente 0,28 g NaH2PO4 enquanto monitora o pH; ajuste conforme necessário para pH 7,4 adicionando gotas de solução de NaOH N 6,5 ou 6 N HCl de uma pipeta Pasteur. Depois que o PSS é preparada e o pH é ajustado, adicione 1,98 g de glicose para o PSS.
Nota: É importante lentamente adicionar o NaH2PO4 última enquanto monitora o pH do PSS porque a adição de NaH2PO4 para uma solução alcalina (pH > 7,4) poderiam formar um precipitado de fosfato de cálcio, conforme indicado pelo aparecimento de uma solução turva ou um precipitado branco no fundo do recipiente.
Nota: A composição final do PSS é 119 mM/L de NaCl; 4,7 mM/L KCl; 1,17 mM/L Mg2então4; 1,6 mM/L de CaCl2; 1,18 mM/L NaH2PO4; 24 mM/L NaHCO3; 0,03 mM/L EDTA; e glicose 5,5 mM/L. Embora a composição do PSS pode diferir entre laboratórios, esta receita é altamente adequada para manter o Tom vascular, função endotelial e respostas vasoativas agentes nas artérias de resistência isolada. - Para determinar o diâmetro máximo e para avaliar o Tom ativo na artéria, produzindo dilatação máxima da embarcação, preparar 500 mL de Ca2 +-free PSS pela adição de 25 mL da 20 X Ca2 +-livre de sal estoque para 450 mL de água desionizada , seguido de 25 mL de 20x do regulador em um frasco Erlenmeyer ou béquer semelhante para a etapa 1.2 supra. Adicione 0,07 g de NaH2PO4 a solução enquanto monitorar e ajustar o pH da solução. O Ca2 +-PSS livre é adicionado para o PSS reservatório e navio a câmara no final do experimento para evitar esgotar intracelular Ca2 + lojas que poderiam afetar a respostas de navio no PSS normal. Porque o Ca2 +-solução livre é adicionado ao final do experimento para produzir o máximo relaxamento das artérias, não há nenhuma necessidade de adicionar glicose para o PSS.
Nota: Quando concluir, a composição final do Ca2 +-PSS grátis é 120,6 mM/L de NaCl; 4,7 mM/L KCl; 1,17 mM/L Mg2então4; 1,18 mM/L NaH2PO4; 24 mM/L NaHCO3; 0 mM/L de CaCl2; e 0,03 mM/L EDTA.
Nota: Para muitos estudos que exigem dilatação máxima da artéria, um bloqueador de entrada de cálcio como o verapamil (1 µM) e/ou de um doador de óxido nítrico, tais como nitroprussiato de sódio (10 µM) pode ser adicionado à solução, além de retirar Ca2 + o PSS. - Manter o pH do PSS, PCO2e PO2por desenroscada continuamente o PSS fluindo para a câmara de navio em um banho de órgão padrão usado para estudar os anéis da aorta isoladas, intestinal músculo liso ou outros tecidos (Figura 1). Use sintético fluoropolímero de tetrafluoroetileno tubos para conectar o tanque de gás para o banho do órgão porque este tipo de tubo é impermeável, em contraste com muitas outras formas de tubos, por exemplo, látex de gás.
- Coloque um pequeno ar pedra ligada à mistura de gás de equilibração na câmara de navio para ajudar a manter a composição do gás PSS.
Nota: Respostas de navio para alterações em PO2 podem ser testadas por desenroscada o PSS na câmara de navio e luminal perfusato com misturas de gases contendo várias percentagens de O2, por exemplo, 21% O2, 10% O2, 5% O2 e 0% O2, com 5% CO2 e equilíbrio N233,34,35. Para maiores artérias com paredes mais grossas, onde a difusão de oxigênio para o centro da parede do vaso pode ser uma limitação, um percentual maior de oxigênio, por exemplo, 95% O2 pode ser usado. - Monitore a temperatura na câmara de navio estreitamente, como câmaras individuais podem variam em suas características de transferência de calor.
Nota: Muitas câmaras de navio comercialmente preparados utilizadas para estudos das artérias canuladas resistência utilizam uma bomba peristáltica para entregar PSS oxigenado de um reservatório de gás-equilibrado e fornecer controle muito preciso da temperatura do banho e da oxigenação do o PSS. - Coloque o PSS em um grande frasco de Mariotte (2 L), com uma rolha e o tubo de vidro central, para servir como um reservatório para entregar continuamente PSS para o banho de órgão que aquece e gás-se equilibra o PSS flui para a câmara de navio (figura 1A).
- Coloque a abertura do tubo de vidro central no frasco Mariotte no mesmo nível como o topo da PSS no banho de órgãos, para manter uma cabeça de pressão hidrostática constante para a entrega de PSS para o banho do órgão. Tubos de polietileno uso conectem a um vidro em forma de J ou tubo de plástico para entregar o PSS do frasco Mariotte para o banho do órgão.
- Para perfusão luminal (figura 1A), use tubos de polietileno para conectar a pipeta de influxo para um reservatório PSS, composto de uma seringa de plástico cc 60 elevado a uma posição que mantém a pressão de entrada desejado (geralmente 80 mmHg para estudos de rato cerebral Transdutor de artérias), medido com uma pressão conectado ao sistema através de uma torneira de passagem.
- Conectar-se a pipeta de saída para um tubo de polietileno para permitir que o PSS a fluir através do vaso em resposta a um gradiente de pressão e conectar a linha de saída para um reservatório semelhante ao reservatório de afluência. Use um conexão de transdutor de pressão e torneira semelhante para medir a pressão de saída.
Nota: Os procedimentos para o ajuste de pressão transmural e controlar o fluxo através do navio são descritos na seção 2, abaixo. - No final do experimento, lave a câmara, entrega linhas e sistemas de reservatórios com água destilada. Em intervalos frequentes, substituir as linhas de tubulação e entrega, limpas ou substituir as torneiras no sistema e submeter periodicamente qualquer vidro reservatórios PSS para uma lavagem ácida para impedir o crescimento de bactérias e outros microorganismos que causam contaminação e afetam a reatividade do navio.
2. canulado artéria preparação
- Anestesiar um rato Sprague-Dawley com 5% de isoflurano e manter a anestesia usando a classe médica de 1,5-2,5% oxigênio36. Em alternativa, administrar uma injeção intramuscular contendo cetamina (75,0 mg/kg), acepromazina (2,5 mg/kg) e xilazina (10,0 mg/kg); uma injeção intraperitoneal de pentobarbital (50-60 mg/kg); ou qualquer outro método aprovado de anestesia, dependendo em cima de protocolos e/ou preferências de investigador.
- Decapitar o rato sob anestesia profunda e remover o cérebro para estudos de artérias de resistência cerebral.
- Após a remoção do cérebro, cuidadosamente isolar a artéria cerebral média (MCA) (ou outras artérias de interesse, por exemplo, a artéria basilar ou artéria cerebral posterior)37,38. Para isolar os MCAs, coloca o cérebro em decúbito dorsal em um prato de Petri de vidro cheio de PSS gelada (Figura 2).
- Vannas para uso e uma pinça de ponta fina de Dumont #5 para excisar a MCA do cérebro. Limpe qualquer tecido de cérebro residual do MCA usando a pinça e transferir a artéria para uma câmara de temperatura controlada vaso contendo PSS como descrito anteriormente. 33 , 34 .
- Para transferir a artéria para a câmara de navio, pressione cuidadosamente o navio extirpado pela ACA ou segmento de artéria comunicante posterior e com cuidado, coloque-o na câmara.
Nota: Além do MCA, o sistema de embarcação canulado é apropriado para uma ampla variedade de preparações de pequena embarcação, incluindo o músculo esquelético resistência artérias33,39,40, artérias mesentérica resistência 38 , 41 , 42e grande (primeira ordem) arteríolas do músculo cremaster43, bem como arteríolas coronárias humanas e arteríolas humanas obtidas do tecido adiposo subcutâneo durante biópsia glútea44,45, 46,47. - Anexe a artéria para micropipeta a afluência puxando-o em direção a base da pipeta até a ponta avança no lúmen do MCA. Fixe a artéria na pipeta afluência, amarrando um laço preparado a partir de uma único filamento fibra anteriormente esmiuçada de suturas de 10-0 ao redor da artéria (figura 1B). Fixe a extremidade oposta do MCA para a pipeta de vazão apertando um segundo laço de sutura ao redor do navio (figura 1B).
Nota: Coloque os loops de sutura sobre as micropipetas antes da montagem do navio e posicioná-los próximo ao ponto final de fixação, permitindo-lhes ser facilmente deslizou sobre a artéria e garantiu rapidamente quando a embarcação estiver na posição, que minimiza o risco do artéria deslizando as pipetas.
Nota: Micropipetas são preparadas a partir de tubo capilar de vidro de borosilicato (2 mm de diâmetro externo, diâmetro interno de 1 mm; 10 cm de comprimento) usando um extrator de micropipeta vertical. Antes de ligar a artéria, coincidir com os diâmetros de ponta das micropipetas quanto possível para evitar incompatibilidades de resistência de entrada e saída no sistema de perfusão. - Depois que a artéria está firmemente ligada as micropipetas, use o micrômetro ligado ao titular da pipeta de afluência para esticar a artéria ao seu comprimento em situ .
- Amarre todos os ramos laterais com cadeias simples esmiuçadas de suturas de 10-0, a fim de manter uma pressão constante na artéria.
- Verificar a ausência de vazamentos, certificando-se que a pressão intraluminal (transmural) mantém-se constante após fechar temporariamente a pipeta de afluência. Amarrar todas as filiais ou verificar se há furos no vaso se a pressão cai. Restaure a perfusão após verificar que a pressão transmural permanece constante.
Nota: Canulação das artérias de resistência isolada requer prática e destreza manual. As principais precauções a serem observadas são evitar quebrar as pipetas e certifique-se que a artéria não deslizar fora da pipeta. É importante ser gentil com as artérias isoladas ao longo de todo o procedimento, como trauma, a nave pode danificar o endotélio e/ou interferir com o funcionamento normal do músculo liso vascular. - Medir o diâmetro interno da artéria usando uma configuração de vídeo microscopia (figura 1A), consistindo de uma câmera de vídeo anexado a um microscópio de dissecação e conectado a um micrômetro de vídeo e monitor de televisão (Figuras 1B, 1C). Isso permite que o observador para medir diâmetros de navio manualmente, colocando linhas de referência móvel na parede interna da artéria e, se desejado, na parede externa da artéria, bem como, para medir a espessura da parede do vaso.
Nota: Alguns micrômetros de vídeo oferecem rastreamento automático das dimensões da embarcação.
Nota: Calibrar o vídeo micrômetro com um micrômetro de palco do microscópio e a entrada e saída de transdutores de pressão com um manómetro de mercúrio (mmHg 0, 50 mmHg, 100 mmHg, 150 mmHg e 200 mmHg) entre experiências a fim de assegurar medições precisas de pressão de diâmetro e intraluminal.
Nota: A pressão transmural de controle padrão para experimentos de rato MCA é de 80 mmHg. Calibração para níveis de maior e menor pressão garante precisão para estudos de miogênico respostas às mudanças no transmural curvas de pressão-diâmetro de pressão e passiva nas artérias dilatadas màxima. - Ajuste a altura dos reservatórios de entrada e saída para manter a pressão transmural desejado em um nível constante. Elevar o reservatório de entrada por uma pequena quantidade (< 5 mmHg) e baixar o reservatório de escoamento pela mesma quantidade, mantém a pressão transmural média e cria o fluxo de perfusão no navio lúmen6.
Nota: Elevar o reservatório de afluência e baixar o reservatório de vazão por quantidades iguais mantém a mesma transmural média distendendo a pressão na artéria, mas gera um gradiente de pressão hidrostática que provoca o fluxo e a tensão de cisalhamento no vaso, permitindo o investigador para avaliar endotélio-dependente respostas às mudanças na tensão de cisalhamento intraluminal em diferentes grupos experimentais48. - Para avaliar respostas miogênico e navio respostas aos estímulos vasodilatador, certifique-se que a artéria apresenta um nível adequado de Tom ativo (cerca de 40%) antes do experimento. Descarte qualquer artérias falta Tom ativo, em repouso, com excepção dos navios, por exemplo, pequenas artérias mesentéricas que normalmente não exibem Tom descanso ativo.
Nota: Para os navios que normalmente não exibem Tom espontâneo, pre-se contraem as artérias de um montante equivalente utilizando um agonista vasoconstritor como norepinefrina ou fenilefrina. Uma boa abordagem para escolher a dose do agonista usado pre-constrição da artéria é utilizar uma dose de50 CE do agente vasoconstritor, por exemplo, noradrenalina41,42. No entanto, agentes farmacológicos vasoconstritor não devem ser aplicados para as artérias que apresentam Tom ativo espontânea sob condições de repouso. - Teste de reatividade do endotélio-dependente da artéria canulada resistência medindo diâmetros do navio durante a adição de concentrações crescentes de ACh (10-10 M-10-5 M) para a câmara de navio. Teste de sensibilidade de óxido nítrico do endotélio independente do músculo liso vascular medindo diâmetros do navio durante a adição de concentrações crescentes (10-10 M-10-5 M) do nitroprussiato de sódio de doador de óxido nítrico para o Câmara de navio.
Nota: Sensibilidade aos agentes vasoconstritor e outras agonistas de vasodilatador pode ser testada de forma semelhante, adicionando-se o aumento das concentrações do agonista para a câmara de navio.
Nota: Além de agentes vasoativas, várias drogas, inibidores e outros agentes farmacológicos podem ser adicionados ao banho de tecido e/ou para o perfusato luminal. Alterações em PO2 (bem como PCO2 e pH) podem ser seletivamente administradas para o lado endotelial ou extra-luminal da artéria por equilibração separada do perfusato luminal com uma pedra de ar ligada a uma mistura de gás calibrado diferente da mistura usada para equilibrar o PSS da tecido banho33,34,49. Miogênico respostas às mudanças na pressão transmural podem ser estudadas, fechando a pipeta de vazão e aumentando (ou diminuindo) a altura do reservatório de PSS ligado para o influxo pipeta49,50,51 para aumentar ou reduzir a pressão intraluminal. - Para testar o papel do endotélio na mediação de respostas de navio a estímulos específicos, remover o endotélio vascular e comparar respostas de navio para os estímulos na presença ou ausência do endotélio. Para remover o endotélio, solte cuidadosamente a artéria da pipeta vazão e perfundir lentamente o lúmen da artéria com um bólus de ar (0,5-1,0 mL). Após a perfusão de ar, restaure a perfusão de PSS para limpar os restos celulares antes de re-amarrar o navio para o escoamento de pipeta43.
Nota: Após o processo de denudação endotelial, é importante verificar que o endotélio é removido por meio de testes vasculares respostas para um agonista (geralmente ACh) conhecido por produzir vasodilatação dependente do endotélio nesse tipo de embarcação. No entanto, em certas condições patológicas, endotélio-dependente vasoconstritores são liberados, neste caso, é importante verificar que a resposta constritora é eliminada após a remoção endotelial. - No final do experimento, determine o diâmetro máximo da artéria pela adição de Ca2 +-livre PSS para o perfusato e superfusate. Calcular o ativo descanso (%) Tom como ((Dmax-Dresto) /Dmáx) x 100, ondemáxima D é o diâmetro máximo na presença de Ca2 +-livre solução e Dresto é o diâmetro de controle descanso.
Nota: As medições do diâmetro das artérias màxima relaxadas em diferentes grupos experimentais são valiosas em comparar Tom descanso ativo, remodelação estrutural (ou seja, alterações de diâmetro de parede espessura e lúmen) e propriedades mecânicas passivas (relações tensão-deformação calculada de diâmetros passivos em diferentes níveis de pressão transmural).
3. avaliação das respostas de fluxo sanguíneo Cerebral com LDF
- Anestesiar o animal com 5% de isoflurano e fixe o rato em um aparelho estereotáxica9,10.
- Manter o animal sob anestesia constante enquanto monitora a frequência da respiração, fim das marés de CO2e profundidade da anestesia com uma pitada de pés36.
- Fina cuidadosamente o crânio para translucidez usando uma broca dental de baixa velocidade e óleo mineral para fornecer o acoplamento óptico10. Tenha cuidado para evitar a geração de calor excessivo e evitar penetrando o osso.
Nota: Afinamento do crânio permite que a luz do laser para atingir o tecido subjacente e ser refletida de volta para a sonda para medir o efeito Doppler, a magnitude do que é determinada pelo número de partículas em movimento (ou seja, células vermelhas do sangue) e sua velocidade. - Fixar a sonda LDF em um micromanipulador e posicioná-lo diretamente sobre a área diluída do crânio. Durante o experimento, é muito importante impedir o movimento da sonda LDF ou a preparação em si, como o LDF é projetado para medir o fluxo em uma área restrita do tecido e é extremamente sensível a artefatos de movimento.
Nota: Qualquer movimento da sonda longe de sua posição inicial irá fornecer uma estimativa do fluxo de sangue em uma área diferente do tecido, impedindo as comparações. Enquanto LDF não fornece valores de fluxo absoluto e não é adequado para a comparação entre indivíduos, é uma maneira excelente de canaliza avaliar alterações na perfusão do tecido em resposta a intervenções experimentais em sujeitos individuais; e relativas mudanças no sinal LDF de valores de controle podem ser em média e em comparação com as alterações no sinal LDF de controle em outros grupos experimentais.
Nota: O LDF é uma abordagem conveniente para ganhar a introspecção em fatores regulando o fluxo de sangue ao nível da cama toda vascular em diferentes grupos experimentais8,9,10. Avaliação da perfusão do tecido com LDF fornece uma abordagem prática para assimilar os conhecimentos adquiridos com estudos de embarcação isolada em uma perspectiva de cama inteira. Salvo as diferenças regionais nos mecanismos de controle vascular entre artérias de resistência e a microcirculação, medições obtidas com LDF fornecem uma boa indicação de controle de fluxo de sangue de tecido geralmente é consistente com os resultados obtidos com preparações de artéria canulada.
4. avaliação da densidade de Microvessel do músculo esquelético com lectina GS1
- Retire o músculo cremaster um rato masculino por abrir o escroto com tesoura cirúrgica fina padrão e em seguida, usando uma pinça de Dumont #5 para agarrar o músculo.
Nota: Os músculos finos (por exemplo, o músculo cremaster, bem como dos dedos longus e tibial anteriores músculos extensores que são encontrados em ratos machos e fêmeas) são ideais para uso como todo monta para estudos de lectina, embora histológica seções podem ser usadas para tecidos mais grossos. - Retire o músculo cremaster o testículo usando um único corte. Coloque-o no PSS gelada e fixá-lo para fora em uma placa de Petri com um forro de elastômero de silicone na parte inferior para dentro da superfície. Tease delicadamente afastado do tecido conjuntivo usando fórceps Dumont #5.
- Enxagúe as amostras de músculo com 2 mL de tampão PSS e então mergulhe-os em rodamina-rotulado GS1 lectina (20 µ g/mL PSS) por 50 min em uma placa de cultura de células de 12 poços com 2 mL/bem que está embrulhado em papel de alumínio para eliminar a luz.
- Retire os tecidos da solução lectina, enxaguá-los três vezes no PSS com 5 min "lavar" incubação do sobre um roqueiro e montá-los em corrediças do microscópio. Certifique-se de incubar os tecidos no escuro e armazenar os slides no escuro para evitar a perda da fluorescência.
Nota: Se os slides não podem ser usados imediatamente, eles podem ser mantidos na geladeira sem perda de fluorescência. Para armazenamento prolongado, as lâminas podem ser mantidas no congelador para evitar deterioração11. - Avalie a densidade de microvessel pela contagem do número de intersecções do microvessels rotulado com linhas de grade gerada por computador, sobrepostas a imagem52, ou com uma sobreposição de grade clara sobreposta sobre o monitor sendo usado para ver os slides.
Nota: Abordagens de lectina GS1 têm sido utilizadas para demonstrar: rarefação microvascular induzida por sal53, o efeito protetor da prevenção sal induzida por supressão de angiotensina II em restaurar microvessel densidade em animais alimentados com sal17 ,53,,54; o papel de NRF2 mediando o efeito protetor da infusão de II angiotensina dose baixa para evitar microvessel rarefação em ratos alimentados com sal17; e também para avaliar o papel da angiotensina II na manutenção angiogênico respostas a estimulação crônica em sal alimentou ratos54,55. Uma das vantagens da técnica de lectina da GS1 é que ele pode ser usado para avaliar a densidade de microvessel nos mesmos animais utilizados para estudos de resistência canulado artérias ou LDF.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
In vitro microscopia das artérias canuladas resistência permite o estudo dos fatores que influenciam o Tom ativo na resistência de pequenas artérias (e maiores arteríolas) a normal na vivo pressões transmurais e na ausência de células parenquimais influências. Além de avaliar a reatividade dos navios aos vários estímulos de vasodilatador e vasoconstritor e miogênico respostas para elevação de pressão transmural no PSS normal, o Ca2 +-PSS gratuito pode ser adicionado ao perfusato e superfusate no final do o experimento para determinar a espessura de diâmetro e parede de máxima da embarcação. As último medições são altamente valiosas na avaliação a remodelação vascular, ou seja, alterações na proporção de parede/lúmen que pode ocorrer em resposta a alterações na pressão arterial ou administração de agentes farmacológicos. Medições do diâmetro dos vasos dilatados màxima do Ca2 +-PSS livre são úteis para calcular o Tom intrínseco como (Dmáx-D (resto) /Dmax) x 100, ondemáxima D e Dresto são o máximo (Ca2 +- livre de PSS) e descansando diâmetro (PSS), respectivamente, à pressão de equilíbrio de controle (geralmente 80 mmHg para MCA). Em nossa experiência, Tom ativo no MCA médias cerca 40% a uma pressão transmural de 80 mmHg. Medir o diâmetro das artérias dilatadas màxima também é uma forma prática de avaliar as propriedades mecânicas passivas dos vasos medindo o diâmetro das artérias em diferentes níveis de transmural distendendo pressão e utilizando os resultados para Calcule as relações tensão-deformação e outras propriedades mecânicas dos navios7,56.
A Figura 3 é uma representação esquemática de três estirpes estreitada congenic derivado do rato SS.13BN utilizando abordagens adicionais de reprodução seletiva. Nestas linhagens de rato, os segmentos cromossômicos também incluem o alelo de renina Noruega Brown (Ren1-BN) ou é corte apenas acima (Ren1-SSA) ou apenas abaixo (Ren1-SSB) o locus do gene da renina (mantendo assim o alelo de renina SS). Em que estudo29, o segmento cromossômico contendo o alelo de renina Brown Noruega continha apenas 25 genes.
A Figura 4 ilustra a resposta para o endotélio-dependente vasodilatador ACh (1 µM) no MCAs isolados de ratos Dahl SS machos e três estreitou cepas congenic mostradas na Figura 3. Uso combinado destes três estirpes de congenic que incluem (Ren1-BN) ou são cortadas acima (Ren1-SSA) ou abaixo o gene da renina (Ren1-SSB) limitado a região de interesse (ou seja, a área que circunda o locus do gene da renina) para aproximadamente 25 genes. Esses experimentos, os animais foram normotensos em alimentados um sal baixo (0,4% NaCl) dieta. Nesse estudo29 dependente do endotélio dilatação para ACh foi ausente na estirpe parental SS e em ambas as estirpes de congenic mantendo o alelo de renina SS, mas foi restaurado na estirpe congenic carregando o alelo de renina BN no fundo genético SS. Os resultados desse estudo apoiou as conclusões de estudos anteriores, utilizando SS.13BN consomic ratos57,58 e forneceu evidência forte essa disfunção endotelial está presente em ratos SS, mesmo quando eles são normotensos e alimentados com uma dieta pobre em sal. Tomadas juntas, que os resultados desses estudos29,57,58 suportam a hipótese que disfunção endotelial em ratos SS é devido à deficiente regulamento do gene da renina, resultando em exposição crônica a baixa níveis de angiotensina II no sangue.
Outro estudo59, resumidos na Figura 5, em comparação a resposta para o endotélio-dependente vasodilatador ACh no MCAs isolado (MCA) dos ratos Dahl SS machos e SS.5BN consomic ratos carregando cromossomo 5 (contendo genes Brown Noruega para várias isoformas do citocromo P450-4A ω-hidroxilase). Nesse estudo, os animais foram alimentados com um sal de qualquer baixo (0,4% NaCl) ou sal de alta (4% NaCl) dieta. Em contraste com a MCA de ratos SS, dilatação dependente do endotélio para ACh manteve-se no MCA de SS.5BN consomic ratos alimentados com dieta pobre em sal. Além disso (e em contraste com os resultados do SS.13BN consomic ratos57,58, ratos Sprague-Dawley33,39,40,de60e hamsters dourados 61), uma dieta alta em sal não conseguiu eliminar a dilatação ACh-induzido nos ratos SS.5BN , indicando que ω de CYP450-4A-hidroxilase e ácido hydroxyeicosatetraenoic-20 (20-HETE) são contribuinte importantes ao estresse oxidante vascular e endotelial disfunção em ratos SS e durante elevações na ingestão de sal em outras tensões. Do ponto de vista experimental, o fracasso da dieta sal elevado para eliminar dilatação endotélio-dependente de ACh fornece um exemplo de como estudos das artérias canuladas resistência podem produzir resultados inesperados que partem da sabedoria convencional e pode levar a uma nova compreensão dos mecanismos de controle complexo que afectam a função desses vasos crucial.
A Figura 6 mostra a resposta do MCA isolado de ACh (1 µM) no tipo selvagem e Nrf2(- / -) nocaute ratos alimentados uma dieta pobre em sal (0,4% NaCl), alta dieta de sal (4% NaCl), ou uma dieta alta em sal contendo um conhecido NRF2 ativador30,62 . Na ausência de estresse oxidativo induzido por sal, dilatação induzida por ACh foi semelhante em MCA do tipo selvagem e ratos de nocaute Nrf2(- / -) . Consistente com os resultados de estudos anteriores de ratos Sprague-Dawley, a dieta alta em sal eliminou dilatação induzida por ACh no tipo selvagem e em ratos de nocaute Nrf2(- / -) . Adição do indutor de NRF2 para a dieta alta em sal restaurado dilatação endotélio-dependente de ACh nos ratos tipo selvagem, mas não nos ratos Nrf2(- / -) , demonstrando a eliminação bem sucedida do gene Nrf2 nos ratos nocaute, e suportando o uso de up-reguladores de NRF2 como uma abordagem terapêutica para amenizar o estresse oxidativo vascular.
Figura 7 resume os resultados das medições de LDF comparando as respostas da microcirculação pial a progressiva redução na pressão arterial produzida por retiradas de volume de sangue sucessivas em ratos Sprague-Dawley mantidas em qualquer um sal normal (0,4% NaCl) dieta ou um sal de alto (4% NaCl) dieta por quatro semanas. Em contraste com ratos alimentados com uma dieta pobre em sal, ratos alimentados a exposição de dieta alta em sal uma deficiente capacidade de manter um fluxo de sangue constante durante reduções na pressão de perfusão, indicando que os mecanismos responsáveis pela autoregulação do fluxo sanguíneo cerebral são comprometida pela exposição de longo prazo para uma dieta alta em sal. Os resultados dessas experiências são consistentes com a presença de mecanismos de relaxamento vascular prejudicada nas artérias cerebrais isolados de ratos alimentados com sal60 e fornecem um bom exemplo de como as medições de LDF podem ser empregadas para apoiar e ampliar o conclusões dos estudos empregando artérias de resistência isolada ao nível da cama toda vascular.
Além de avaliar a função de resistência artéria usando artérias isoladas e perfusão do tecido usando laser Doppler flowmetry, a densidade de microvessel e angiogênico respostas a vários estímulos, tais como de estimulação muscular crônica54, 55 pode ser avaliada nos mesmos animais utilizando fluorescente-etiquetadas GS1 lectina, que se liga seletivamente para partes de glicoproteína na membrana do porão de arteríolas e capilares. A Figura 8 mostra lectina típica coloração no músculo cremaster ratos Sprague-Dawley alimentados uma dieta pobre em sal ou dieta alta em sal durante 2 semanas (nota a menor densidade de microvessels nos ratos alimentados sal elevados). Densidade de Microvessel é avaliada através da contagem das interseções das microvessels lectina-rotulado com uma grade de referência gerado por computador52e fornece um excelente método para avaliar angiogênico respostas54,55 ou para detectar e quantificar a perda de microvessels em condições tais como a hipertensão e a elevada ingestão de sal12,17,53.

Figura 1: In vitro a microscopia configuração empregada para estudar a resistência isolada, canulados artérias (A). A artéria canulada resistência amarrado para Micropipetas de vidro (B) e exibição de vídeo micrômetro mostrando a medição do diâmetro do lúmen em artéria canulada resistência (C). Barra de escala no painel B representa o diâmetro interno da artéria canulada (µm), e 125 µm em painel C é a exibição de vídeo da distância entre as linhas de referência móvel colocado manualmente nas paredes internas da artéria do observador realizando a experiência . Clique aqui para ver uma versão maior desta figura.

Figura 2: Diagrama esquemático do processo para isolar a artéria cerebral média do cérebro e preparando-a para canulação com as micropipetas. Clique aqui para ver uma versão maior desta figura.

Figura 3: Diagrama esquemático de cepas de rato estreitada congenic tendo pequenos segmentos do meio de cromossomo 13 Brown Noruega para o fundo genético sal sensível do Dahl. Segmentos cromossômicos ou contidos o alelo de renina Noruega Brown (Ren1-BN) ou são cortados acima (Ren1-SSA) ou abaixo (Ren1-SSB) o locus do gene da renina e, assim, conservar o alelo de renina SS. Esta figura foi modificada e reproduzida a partir de Durand et al 29 com permissão da American Physiological Society. Clique aqui para ver uma versão maior desta figura.

Figura 4: Resposta de isolados, canulados ratos de MCAs de SS e cepas de rato congenic (ilustradas na Figura 2) a acetilcolina 1 µM. Dados são expressos como diâmetro médio ±SEM de mudança (Δ µm) de diâmetro de controle antes da acetilcolina a descansar e são replotted de um estudo original por Durand et al 29 Clique aqui para ver uma versão maior desta figura.

Figura 5: Resposta de ratos de MCAs de SS isolados, canulados e SS.5BN consomic ratos a acetilcolina de 1 µM em animais alimentados com sal baixa (0,4% NaCl) ou sal de alta (4% NaCl) dieta. Dados são expressos como diâmetro médio ±SEM de mudança (Δ µm) de diâmetro de controle antes da acetilcolina a descansar e são replotted de um estudo original por Lukaszewicz et al 64 Clique aqui para ver uma versão maior desta figura.

Figura 6: Resposta à acetilcolina 1 µM no MCAs canulados, isolados de ratos de nocaute Nrf2(- / -) e controles de tipo selvagem alimentados com dieta pobre em sal (0,4% NaCl), alta dieta de sal (4% NaCl), ou dieta alta em sal contendo um conhecido NRF2 ativador30, 62. dados são expressos como diâmetro médio ±SEM de mudança (Δ µm) de diâmetro de controle antes da acetilcolina a descansar. Clique aqui para ver uma versão maior desta figura.

Figura 7: Fluxo sanguíneo cerebral avaliado por LDF a microcirculação pial. Ratos Sprague-Dawley, mantidos em uma dieta de sal elevada para quatro semanas exibiram um dano significativo na sua capacidade de manter constante do fluxo de sangue à medida que a pressão arterial foi reduzida em resposta a levantamentos de volume de sangue sucessivas. Dados são plotados como média por cento de controle ±SEM * p < 0.05 vs dieta pobre em sal na mesma pressão arterial média. Clique aqui para ver uma versão maior desta figura.
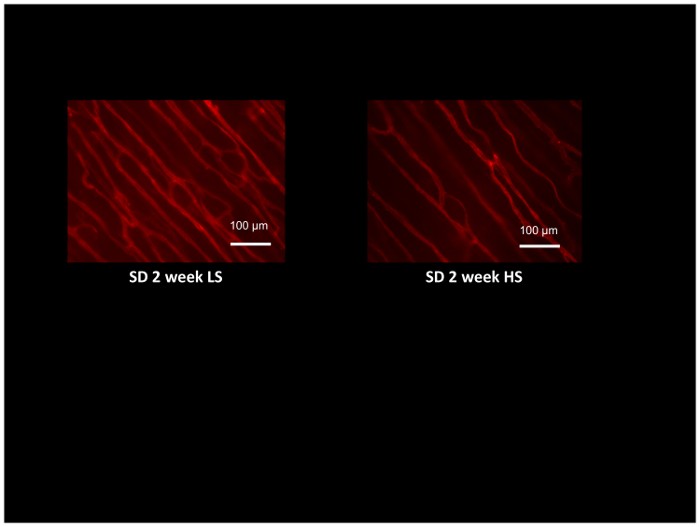
Figura 8: Micrografia de músculos cremáster de rato rotulado com rodamina-rotulado lectina de GS1 para identificar arteríolas e capilares para avaliação da densidade de microvessel. Músculos cremaster foram obtidos de ratos Sprague-Dawley alimentados baixo sal (LS; 0,4% NaCl) ou alta (HS:4% NaCl) dieta de sal por 2 semanas e demonstrar microvascular rarefação nos animais alimentados com HS comparados aos controles de LS. Barra de escala = 100 µm. clique aqui para ver uma versão maior desta figura.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Como observado na introdução, este artigo descreve o uso da microscopia de televisão e artéria resistência isolada se aproxima para avaliar a função vascular não só em modelos do rato padrão (como empregada no vídeo), mas também em altamente especializada geneticamente cepas de rato engenharia, que mostram o romance e insights poderosos que podem ser adquiridos utilizando essas abordagens. O uso destas técnicas poderosas para avaliar o tom de ativo e passivas propriedades mecânicas das artérias de resistência pequena podem fornecer informações importantes sobre um amplo espectro de mecanismos de controlo vascular, incluindo o Regulamento do endotélio-dependente de Tom ativo nas artérias de resistência, função de músculo liso vascular, sob condições normais e fisiopatológicas e propriedades passivas das artérias relacionadas à remodelação vascular e alterações na mecânica da parede vascular. Disfunção endotelial tem sido mostrada para ser um poderoso indicador de prognóstico de múltiplos eventos cardiovasculares adversos em seres humanos, incluindo morte cardiovascular relacionadas com63, e preparações de artéria canulada resistência são especialmente valiosas em detecção de disfunção endotelial e aumentar a nossa compreensão dos mecanismos de disfunção endotelial.
Para ilustrar a eficácia em vitro vídeo microscopia técnicas empregando artérias de resistência isolada, nós fornecidos exemplos do uso destas técnicas em ratos de Dahl sensível ao sal (SS) e na novela consomic cepas de ratos que apresentam um reduzido sal sensibilidade da pressão arterial em comparação com o de estirpe parental SS24. Esses estudos investigaram os mecanismos de controlo vascular relacionados com genes em dois cromossomos que são de particular interesse em contribuir para a sensibilidade de sal da pressão arterial e alterações vasculares em ratos SS. Esses cromossomos são cromossomo 13, carregando a renina gene18,22,29,57,58e o cromossoma 5, carregando genes para isoformas do CYP450-4A ω-hidroxilase64 ,,65— a enzima que sintetiza 20-HETE, que tem grandes efeitos na função renal e na reatividade vascular66,67,68. Outra adição recente e poderosa, a caixa de ferramentas genéticas do rato é o desenvolvimento de modelos de nocaute do gene do rato utilizando técnicas de edição avançada gene incluindo: ZFNs; transcriptional activator-como-effector nucleases (TALENS) e, mais recentemente, CRISPR-Cas913,14,15,16,17. In vitro a microscopia utilizando estas técnicas para estudar o MCAs isolados de um modelo do rato nocaute Nrf2(- / -) que não possui a crucial antioxidantes e fator de transcrição protetora celular NRF2, forneceu importantes e anteriormente desconhecido insight sobre os mecanismos de disfunção endotelial induzida por sal na ausência de uma elevada pressão17de sangue. Resultados específicos dos experimentos utilizando estes modelos do rato especializados são descritos em um número de anteriores relatórios17,29,57,58,59, 60 , 64 , 65 .
Embora seja evidente que estudos das artérias de resistência isolada, canulados são extremamente importantes na compreensão dos mecanismos que regulam a função desses vasos criticamente importante sob uma variedade de condições, é muito importante exercer uma número de precauções para assegurar que obtém resultados precisos e confiáveis. Enquanto artérias cerebrais e artérias de resistência de muitos outros leitos vasculares exibem Tom intrínseca, algumas artérias (nomeadamente as artérias mesentérica resistência) precisam ser previamente contratadas com vasoconstritores como a norepinefrina para avaliar respostas para estímulos de vasodilatador e mais precisamente para simular na vivo condições, onde os navios estão sob a influência de estímulos vasoconstritor neural e humoral, tais como norepinefrina liberada dos terminais nervosos adrenérgicos. Como tal, é importante estar familiarizado com as propriedades básicas das artérias para ser estudado, da literatura ou de cuidadosamente conduzido experimentos preliminares. Porque o endotélio desempenha um papel importante na regulação de grandes artérias, pequenas artérias e arteríolas na microcirculação, é essencial ter cautela para não danificar o endotélio durante o isolamento e a canulação da artéria. O teste clássico para a integridade do endotélio é a demonstração que ACh provoca a dilatação do recipiente. Uma ressalva é que, sob condições de estresse oxidativo, o endotélio do vaso pode estar intacto, mas vasodilatação para ACh está ausente porque níveis excessivos de superóxido limpam o óxido nítrico, impedindo a resposta do vasodilatador. Nesses casos, integridade endotelial pode ser verificada, repetindo a aplicação de ACh na presença de um limpador de superóxido como tempol, que deve restaurar a vasodilatação em resposta a ACh e outros estímulos vasodilatador endotélio-dependente. Além disso, em uma série de condições patológicas, o endotélio pode liberar substâncias que causam a contração das células de músculo liso vascular e a constrição da artéria; e em alguns casos, dilatação endotélio-dependente (ou constrição) é mediada através de outras substâncias como metabolitos da ciclo-oxigenase, H2O2, epoxygenase metabólitos, etc. O teste clássico para um vasodilatador endotélio-dependente ou substância vasoconstritora é demonstrar que a dilatação ou constrição da artéria é eliminada pela remoção endotelial. Finalmente, a identidade de várias substâncias de vasodilatador e vasoconstritor endotélio-dependente geralmente pode ser verificada pela administração de inibidores específicos ou catadores, tais como L-nome para inibir a óxido nítrico sintase, indometacina para inibir a formação de metabólitos da ciclo-oxigenase, catalase, eliminação de H2O2, inibidores de tromboxano sintase, inibidores de epoxygenase, e/ou antagonistas da via CYP450-4A/20-HETE.
Também é importante (e instrutivo) para quantificar a quantidade de ativo Tom no final do experimento por perfusing e superfusing da artéria com um Ca2 +-livre PSS, ou administrar uma dose máxima de um agente vasodilatador poderoso como a papaverina. Um nível típico de ativo descansando Tom no MCA, x 100 calculado como ((Dmax-Dresto) /Dmáx), é aproximadamente 40%, ondemáxima D e Dresto são o máximo (Ca2 +-free PSS) e descansando de diâmetro (PSS), respectivamente, à pressão de equilíbrio de controle (geralmente 80 mmHg para MCA). Vasos com significativamente menos ativo Tom ou artérias mostrando constrições segmentares ou dilatações são excluídos da análise, como esses sinais são indicativos de trauma para os vasos. Medição dos diâmetros das artérias dilatadas màxima de Ca2 +-solução livre também permite que o investigador avaliar as propriedades mecânicas passivas dos vasos por medição diâmetro arterial e calculista relações tensão-deformação durante sequenciais elevações na pressão transmural nos vasos dilatados màxima7,56. Essas relações de tensão-deformação passiva são facilmente obtidas e fornecem uma indicação valiosa de quaisquer alterações nas características mecânicas dos vasos.
Limpeza do pipetas, conectores e tubulação de abastecimento dos reservatórios é absolutamente crítica para experiências bem sucedidas. A este respeito, é importante lavar todas as soluções fora da tubulação após o experimento é concluído, e lavar e limpar o tecido banho, o tubo de entrega e todos os recipientes utilizados para armazenar, aquecem e gás-equilibrar o PSS antes de alcançar o navio Câmara. Torneiras e válvulas do sistema de entrega também devem ser limpos e alteradas periodicamente, como devem quaisquer tubos carregando PSS. Um sinal clássico de tubulação contaminada é uma névoa cinza gerada por fungos e bactérias; e essas mudanças são acompanhadas por perda da reatividade normal dos vasos sanguíneos devido a substâncias produzidas pela contaminação bacteriana. No entanto, a contaminação por bactérias e outros microorganismos ainda pode estar presente na ausência de qualquer evidência visível.
Acreditamos que o presente trabalho fornece um exemplo útil para o uso de técnicas consagradas pelo tempo que são excepcionalmente adequado para estudos das artérias muito importante resistência pequena de diferentes leitos vasculares. Quando combinado com abordagens padrão para avaliar a perfusão do tecido, tais como LDF e o método de lectina GS1 para avaliar a densidade de microvessel, em vitro vídeo microscopia das artérias canuladas resistência fornece dicas extremamente valiosa para o fatores que controlam a perfusão do tecido e como estas podem ser alteradas nos Estados de doença. Além de fornecer um meio poderoso para estudar os mecanismos fundamentais do músculo liso vascular e função endotelial em modelos do rato padrão, o uso de vídeo microscopia para estudar as artérias de resistência individual pode ser aplicado para outros modelos animais e artérias de resistência humana. A aplicação de vídeo microscopia das artérias de resistência isolada de novos modelos do rato geneticamente abre novas portas para a compreensão de alterações fenotípicas que ocorrem em resposta à alteração da função de uma multidão (e crescente lista) dos genes.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Os autores têm sem interesses financeiros concorrentes.
Acknowledgments
Os autores expressam seus sinceros agradecimentos Katie Fink e Lynn Dondlinger por sua inestimável ajuda na preparação deste manuscrito.
Suporte de Grant: NIH #R21-OD018309; #R56-HL065289; e #R01-HL128242.
Materials
| Name | Company | Catalog Number | Comments |
| SS Rat | Medical College of Wisconsin | SS/JHsd/Mcwi strain | Contact Dr. Aron Geurts (ageurts@mcw.edu) |
| SS.5BN Consomic Rat | Medical College of Wisconsin | SS-Chr 5BN/Mcwi strain | Contact Dr. Aron Geurts (ageurts@mcw.edu) |
| SS.13BN Consomic Rat | Medical College of Wisconsin | SS-Chr 13BN/Mcwi strain | Contact Dr. Aron Geurts (ageurts@mcw.edu) |
| Ren1-BN Congenic Rat | Medical College of Wisconsin | SS.BN-(D13hmgc41-D13)hmgc23/Mcwi strain | Contact Dr. Aron Geurts (ageurts@mcw.edu) |
| Ren1-SSA Congenic Rat | Medical College of Wisconsin | SS.BN-(D13rat77-D13rat105/Mcwi strain | Contact Dr. Aron Geurts (ageurts@mcw.edu) |
| Ren1-SSB Congenic Rat | Medical College of Wisconsin | SS.BN-(D13rat124-D13rat101/Mcwi strain | Contact Dr. Aron Geurts (ageurts@mcw.edu) |
| Nrf2(-/-) Knockout Rat and Wild Type Littermates | Medical College of Wisconsin | SD-Nfe212em1Mcwi strain | Contact Dr. Aron Geurts (ageurts@mcw.edu) |
| Low Salt Rat Chow (0.4% NaCl)-AIN-76A | Dyets, Inc. | 113755 | |
| High Salt Rat Chow (4% NaCl)-AIN-76A | Dyets, Inc. | 113756 | |
| Colorado Video Caliper | Colorado Video, Inc. | Model 308 | |
| Video Camera | Hitachi | KPM1AN | |
| Microscope | Olympus Life Science | CKX41 | |
| Television Monitor | Panasonic | WVBM1410 | |
| Pressure Transducers | Stoelting | 56360 | |
| Blood Pressure Display Unit | Stoelting | 50115 | |
| Cannulated Artery Chamber | Living Systems Instrumentation | CH-1 | Single vessel chamber for general use |
| Temperature Controller for Single Chamber | Living Systems Instrumentation | TC-09S | |
| Gas Dispersion Tube, Miniature,Straight | Living Systems Instrumentation | GD-MS | Provides aeration in the vessel bath |
| Gas Exchange Oxygenator, Miniature | Living Systems Instrumentation | OX | Allows gas exchange with perfusate |
| Laser-Doppler Flowmeter | Perimed | PeriFlux 5000 LDPM | |
| GS1 Lectin | Vector Labs | RL-1102 | |
| Glass Capillary Tubes for Micropipettes | Fredrich Haer Co. | 27-33-1 | 2 mm ODX1 mm ID |
| Verticle Pipette Puller | David Kopf Instruments | Model 700C | |
| Nylon suture material (10/0)-3 PLY | Ashaway Line and Twine Manufacturing Co. | 114-ANM-10 | Single strands of 3 ply nylon suture teased out for use on vessels |
| Dumont #5 Forceps-Inox | Fine Science Tools | 11254-20 | |
| Vannas Scissors | Fine Science Tools | 15003-08 | |
| Protandim | Protandim | NRF2 Inducer: Contact Dr. Joe McCord (JOE.MCCORD@UCDENVER.EDU) | |
| Sodium Chloride | Fisher Bioreagents | BP358-212 | |
| Sodium Bicarbonate | Fisher Chemical | S233-3 | |
| Dextrose (d-glucose) anhydrous | Fisher Chemical | D16-500 | |
| Magnesium Sulfate (MgSO4-7H2O) | Sigma Aldrich | M1880-500 G | |
| Calcium Chloride (CaCl2-2 H2O) | Sigma | C5080-500G | |
| Sodium Phosphate-Monobasic (NaH2PO4) | Sigma | S0751-500G | |
| Potassium Chloride (KCl) | Fisher Chemical | P217-500G | |
| Ethylenediaminetetraacetic acid disodium salt dihydrate (EDTA) | Sigma | ED255-500G |
References
- Furchgott, R. F., Zawadzki, J. V. The obligatory role of endothelial cells in the relaxation of arterial smooth muscle by acetylcholine. Nature. 288, 373-376 (1980).
- Bevan, J. A., Osher, J. V. A direct method for recording tension changes in the wall of small blood vessels in vitro. Agents Actions. 2, 257-260 (1972).
- Mulvany, M. J., Halpern, W. Contractile properties of small arterial resistance vessels in spontaneously hypertensive and normotensive rats. Circ. Res. 41, 19-26 (1977).
- Speden, R. N. The use of excised, pressurized blood vessels to study the physiology of vascular smooth muscle. Experientia. 41, 1026-1028 (1985).
- Osol, G., Halpern, W. Myogenic properties of cerebral blood vessels from normotensive and hypertensive rats. Am. J. Physiol. 249, H914-H921 (1985).
- Halpern, W., Kelley, M. In vitro methodology for resistance arteries. Blood Vessels. 28, 245-251 (1991).
- Feihl, F., Liaudet, L., Waeber, B. The macrocirculation and microcirculation of hypertension. Curr Hypertens Rep. 11, 182-189 (2009).
- Smits, G. J., Roman, R. J., Lombard, J. H. Evaluation of laser-Doppler flowmetry as a measure of tissue blood flow. J Appl Physiol. 61, 666-672 (1985).
- Hudetz, A. G., Roman, R. J., Harder, D. R. Spontaneous flow oscillations in the cerebral cortex during acute changes in mean arterial pressure. J Cereb Blood Flow Metab. 12, 491-499 (1992).
- Hudetz, A. G., Smith, J. J., Lee, J. G., Bosnjak, Z. J., Kampine, J. P. Modification of cerebral laser-Doppler flow oscillations by halothane, PCO2, and nitric oxide synthase blockade. Am J Physiol. 269, H114-H120 (1995).
- Hansen-Smith, F. M., Watson, L., Lu, D. Y., Goldstein, I. Griffonia simplicifolia I: fluorescent tracer for microcirculatory vessels in nonperfused thin muscles and sectioned muscle. Microvasc Res. 36, 199-215 (1988).
- Greene, A. S., Lombard, J. H., Cowley, A. W., Hansen-Smith, F. M. Microvessel changes in hypertension measured by Griffonia simplicifolia I lectin. Hypertension. 15, 779-783 (1990).
- Aitman, T., Dhillon, P., Geurts, A. M. A RATional choice for translational research? Dis Model Mech. 9, 1069-1072 (2016).
- Geurts, A. M., et al. Knockout rats via embryo microinjection of zinc-finger nucleases. Science. 325, 433 (2009).
- Geurts, A. M., et al. Generation of gene-specific mutated rats using zinc-finger nucleases. Methods Mol Biol. 597, 211-225 (2010).
- Geurts, A. M., Moreno, C. Zinc-finger nucleases: new strategies to target the rat genome. Clin Sci (Lond). 119, 303-311 (2010).
- Priestley, J. R., Kautenburg, K. E., Casati, M. C., Endres, B. T., Geurts, A. M., Lombard, J. H. The NRF2 knockout rat: a new animal model to study endothelial dysfunction, oxidant stress, and microvascular rarefaction. Am J Physiol Heart Circ Physiol. 310, H478-H487 (2016).
- Cowley, A. W., et al. Brown Norway chromosome 13 confers protection from high salt to consomic Dahl S rat. Hypertension. 37, 456-461 (2001).
- Rapp, J. P. Dahl salt-susceptible and salt-resistant rats. A review. Hypertension. 4, 753-763 (1982).
- Rapp, J. P., Wang, S. M., Dene, H. A genetic polymorphism in the renin gene of Dahl rats cosegregates with blood pressure. Science. 243, 542-544 (1989).
- Manning, R. D. Jr, Meng, S., Tian, N. Renal and vascular oxidative stress and salt-sensitivity of arterial pressure. Acta Physiol Scand. 179, 243-250 (2003).
- Moreno, C., et al. Multiple blood pressure loci on rat chromosome 13 attenuate development of hypertension in the Dahl S hypertensive rat. Physiol Genomics. 31, 228-235 (2007).
- Tobian, L., Lange, J., Iwai, J., Hiller, K., Johnson, M. A., Goossens, P. Prevention with thiazide of NaCl-induced hypertension in Dahl "S" rats. Evidence for a Na-retaining humoral agent in "S" rats. Hypertension. 1, 316-323 (1979).
- Mattson, D. L., et al. Chromosome substitution reveals the genetic basis of Dahl salt-sensitive hypertension and renal disease. Am J Physiol Renal Physiol. 295, F837-F842 (2008).
- Kunert, M. P., et al. Consomic strategies to localize genomic regions related to vascular reactivity in the Dahl salt-sensitive rat. Physiol Genomics. 26, 218-225 (2006).
- Cowley, A. W., Liang, M., Roman, R. J., Greene, A. S., Jacob, H. J. Consomic rat model systems for physiological genomics. Acta Physiol Scand. 181, 585-592 (2004).
- Kunert, M. P., Dwinell, M. R., Lombard, J. H. Vascular responses in aortic rings of a consomic rat panel derived from the Fawn Hooded Hypertensive strain. Physiol Genomics. 42A, 244-258 (2010).
- Liang, M., et al. Renal medullary genes in salt-sensitive hypertension: a chromosomal substitution and cDNA microarray study. Physiol Genomics. 8, 139-149 (2002).
- Durand, M. J., Moreno, C., Greene, A. S., Lombard, J. H. Impaired relaxation of cerebral arteries in the absence of elevated salt intake in normotensive congenic rats carrying the Dahl salt-sensitive renin gene. Am J Physiol Heart Circ Physiol. 299, H1865-H1874 (2010).
- Hybertson, B. M., Gao, B., Bose, S. K., McCord, J. M. Oxidative stress in health and disease: the therapeutic potential of Nrf2 activation. Mol Aspects Med. 32, 234-246 (2011).
- Itoh, K., et al. An Nrf2/small Maf heterodimer mediates the induction of phase II detoxifying enzyme genes through antioxidant response elements. Biochem Biophys Res Commun. 236, 313-322 (1997).
- Myung, S. K., et al. Efficacy of vitamin and antioxidant supplements in prevention of cardiovascular disease: systematic review and meta-analysis of randomised controlled trials. BMJ. 346, f10 (2013).
- Fredricks, K. T., Liu, Y., Lombard, J. H. Response of extraparenchymal resistance arteries of rat skeletal muscle to reduced PO2. Am J Physiol. 267, H706-H715 (1994).
- Fredricks, K. T., Liu, Y., Rusch, N. J., Lombard, J. H. Role of endothelium and arterial K+ channels in mediating hypoxic dilation of middle cerebral arteries. Am J Physiol. 267, H580-H586 (1994).
- Frisbee, J. C., Maier, K. G., Falck, J. R., Roman, R. J., Lombard, J. H. Integration of hypoxic dilation signaling pathways for skeletal muscle resistance arteries. Am J Physiol Regul Integr Comp Physiol. 283, R309-R319 (2002).
- Pavlov, T. S., Ilatovskaya, D. V., Palygin, O., Levchenko, V., Pochynyuk, O., Staruschenko, A. Implementing Patch Clamp and Live Fluorescence Microscopy to Monitor Functional Properties of Freshly Isolated PKD Epithelium. J Vis Exp. (103), (2015).
- Nelson, M. T., Conway, M. A., Knot, H. J., Brayden, J. E. Chloride channel blockers inhibit myogenic tone in rat cerebral arteries. J Physiol. 502 (Pt 2), 259-264 (1997).
- Brayden, J. E., Halpern, W., Brann, L. R. Biochemical and mechanical properties of resistance arteries from normotensive and hypertensive rats. Hypertension. 5, 17-25 (1983).
- Weber, D. S., Lombard, J. H. Elevated salt intake impairs dilation of rat skeletal muscle resistance arteries via ANG II suppression. Am J Physiol Heart Circ Physiol. 278, H500-H506 (2000).
- Weber, D. S., Lombard, J. H. Angiotensin II AT1 receptors preserve vasodilator reactivity in skeletal muscle resistance arteries. Am J Physiol Heart Circ Physiol. 280, H2196-H2202 (2001).
- Wang, J., Roman, R. J., Falck, J. R., de la Cruz, L., Lombard, J. H. Effects of high-salt diet on CYP450-4A omega-hydroxylase expression and active tone in mesenteric resistance arteries. Am J Physiol Heart Circ Physiol. 288, H1557-H1565 (2005).
- Raffai, G., et al. Modulation by cytochrome P450-4A omega-hydroxylase enzymes of adrenergic vasoconstriction and response to reduced PO2 in mesenteric resistance arteries of Dahl salt-sensitive rats. Microcirculation. 17, 525-535 (2010).
- Mishra, R. C., Wulff, H., Hill, M. A., Braun, A. P. Inhibition of Myogenic Tone in Rat Cremaster and Cerebral Arteries by SKA-31, an Activator of Endothelial KCa2.3 and KCa3.1 Channels. J Cardiovasc Pharmacol. 66, 118-127 (2015).
- Freed, J. K., Beyer, A. M., LoGiudice, J. A., Hockenberry, J. C., Gutterman, D. D. Ceramide changes the mediator of flow-induced vasodilation from nitric oxide to hydrogen peroxide in the human microcirculation. Circ Res. 115, 525-532 (2014).
- Beyer, A. M., Durand, M. J., Hockenberry, J., Gamblin, T. C., Phillips, S. A., Gutterman, D. D. An acute rise in intraluminal pressure shifts the mediator of flow-mediated dilation from nitric oxide to hydrogen peroxide in human arterioles. Am J Physiol Heart Circ Physiol. 307, H1587-H1593 (2014).
- Durand, M. J., et al. Vascular actions of angiotensin 1-7 in the human microcirculation: novel role for telomerase. Arterioscler Thromb Vasc Biol. 36, 1254-1262 (2016).
- Beyer, A. M., et al. Transition in the mechanism of flow-mediated dilation with aging and development of coronary artery disease. Basic Res Cardiol. 112, 5 (2017).
- Muller, J. M., Chilian, W. M., Davis, M. J. Integrin signaling transduces shear stress--dependent vasodilation of coronary arterioles. Circ Res. 80, 320-326 (1997).
- Liu, Y., Harder, D. R., Lombard, J. H. Interaction of myogenic mechanisms and hypoxic dilation in rat middle cerebral arteries. Am J Physiol Heart Circ Physiol. 283, H2276-H2281 (2002).
- Potocnik, S. J., et al. Endothelium-dependent vasodilation in myogenically active mouse skeletal muscle arterioles: role of EDH and K+ channels. Microcirculation. 16, 377-390 (2009).
- Harder, D. R. Pressure-dependent membrane depolarization in cat middle cerebral artery. Circ Res. 55, 197-202 (1984).
- Greene, A. S., Rieder, M. J. Measurement of vascular density. Methods Mol. Med. 51, 489-496 (2001).
- Hernandez, I., Cowley, A. W., Lombard, J. H., Greene, A. S. Salt intake and angiotensin II alter microvessel density in the cremaster muscle of normal rats. Am J Physiol. 263, H664-H667 (1992).
- Resende, M. M., Amaral, S. L., Moreno, C., Greene, A. S. Congenic strains reveal the effect of the renin gene on skeletal muscle angiogenesis induced by electrical stimulation. Physiol Genomics. 33, 33-40 (2008).
- Petersen, M. C., Munzenmaier, D. H., Greene, A. S. Angiotensin II infusion restores stimulated angiogenesis in the skeletal muscle of rats on a high-salt diet. Am J Physiol Heart Circ Physiol. 291, H114-H120 (2006).
- Frisbee, J. C., Weber, D. S., Liu, Y., DeBruin, J. A., Lombard, J. H. Altered structure and mechanics of skeletal muscle arteries with high-salt diet and reduced renal mass hypertension. Microvasc Res. 59, 323-328 (2000).
- Drenjancevic-Peric, I., Lombard, J. H. Introgression of chromosome 13 in Dahl salt-sensitive genetic background restores cerebral vascular relaxation. Am J Physiol Heart Circ Physiol. 287, H957-H962 (2004).
- Drenjancevic-Peric, I., Phillips, S. A., Falck, J. R., Lombard, J. H. Restoration of normal vascular relaxation mechanisms in cerebral arteries by chromosomal substitution in consomic SS.13BN rats. Am J Physiol Heart Circ Physiol. 289, H188-H195 (2005).
- Lukaszewicz, K. M., Paudyal, M. P., Falck, J. R., Lombard, J. H. Role of vascular reactive oxygen species in regulating cytochrome P450-4A enzyme expression in Dahl salt-sensitive rats. Microcirculation. 23, 540-548 (2016).
- Lombard, J. H., Sylvester, F. A., Phillips, S. A., Frisbee, J. C. High-salt diet impairs vascular relaxation mechanisms in rat middle cerebral arteries. Am J Physiol Heart Circ Physiol. 284, H1124-H1133 (2003).
- Priestley, J. R., et al. Reduced angiotensin II levels cause generalized vascular dysfunction via oxidant stress in hamster cheek pouch arterioles. Microvasc Res. 89, 134-145 (2013).
- Velmurugan, K., Alam, J., McCord, J. M., Pugazhenthi, S. Synergistic induction of heme oxygenase-1 by the components of the antioxidant supplement Protandim. Free Radic Biol Med. 46, 430-440 (2009).
- Widlansky, M. E., Gokce, N., Keaney, J. F., Vita, J. A. The clinical implications of endothelial dysfunction. J Am Coll Cardiol. 42, 1149-1160 (2003).
- Lukaszewicz, K. M., Falck, J. R., Manthati, V. L., Lombard, J. H. Introgression of Brown Norway CYP4A genes on to the Dahl salt-sensitive background restores vascular function in SS-5BN consomic rats. Clin Sci (Lond). 124, 333-342 (2013).
- Lukaszewicz, K. M., Lombard, J. H. Role of the CYP4A/20-HETE pathway in vascular dysfunction of the Dahl salt-sensitive rat. Clin Sci (Lond). 124, 695-700 (2013).
- Roman, R. J. P-450 metabolites of arachidonic acid in the control of cardiovascular function. Physiol Rev. 82, 131-185 (2002).
- Roman, R. J., Maier, K. G., Sun, C. W., Harder, D. R., Alonso-Galicia, M. Renal and cardiovascular actions of 20-hydroxyeicosatetraenoic acid and epoxyeicosatrienoic acids. Clin Exp Pharmacol. 27, 855-865 (2000).
- Roman, R. J., Alonso-Galicia, M. P-450 eicosanoids: A novel signaling pathway regulating renal function. News Physiol Sci. 14, 238-242 (1999).



