Summary
Este manuscrito describe en vitro protocolos video microscopia para evaluar la función vascular en las arterias de resistencia cerebral de rata. El manuscrito también describe técnicas para evaluar la densidad de microvessel con fluorescencia marcada perfusión lectinas y tejido mediante flujometría Doppler láser.
Abstract
Este protocolo describe el uso de la microscopia televisión en vitro para evaluar la función vascular en arterias aislada resistencia cerebral (y otros) y describe las técnicas para evaluar la perfusión del tejido usando Laser Doppler flujometría (LDF ) y densidad de microvasos utilizando fluorescencia etiquetada lectina Griffonia simplicifolia (GS1). Los métodos actuales para el estudio aislaron de las arterias de resistencia transmural presiones encontradas en vivo y en ausencia de células parenquimales influencias proporcionan un vínculo decisivo entre estudios en vivo e información obtenida de molecular enfoques reduccionistas que proporcionan la penetración limitada en respuestas integradoras a nivel de todo animal. LDF y técnicas para identificar selectivamente arteriolas y capilares con lectinas de GS1 marcada con fluorescencia ofrecen soluciones prácticas para permitir a los investigadores a ampliar el conocimiento obtenido de los estudios de las arterias de resistencia aislada. Este papel describe el uso de estas técnicas para obtener los conocimientos fundamentales de fisiología vascular y patología en la rata como modelo experimental general y en una variedad de especializado diseñado genéticamente cepas de ratas "diseñador" que pueden proporcionar penetración importante en la influencia de genes específicos en fenotipos vasculares importantes. Utilizando estas aproximaciones experimentales valiosos en cepas de ratas desarrolladas por cría selectiva estrategias y nuevas tecnologías para la producción de modelos de knockout del gen en la rata, se ampliará el rigor de los científicos locales desarrollado en modelos de ratón knockout y extender ese conocimiento a un modelo animal más relevante, con una formación fisiológica bien entendido y la idoneidad para estudios fisiológicos debido a su tamaño más grande.
Introduction
Los primeros estudios de la función vascular en las arterias del conducto arterias utilizadas y en muchos casos, la aorta. Generación de fuerza en las arterias grandes se estudió generalmente colocando un segmento de anillo de la arteria a un transductor de fuerza en un baño de tejido; en el caso de la aorta, por corte helicoidal tiras del barco para que las fibras de músculo liso fueron orientadas en una dirección longitudinal entre el punto de conexión y el transductor de fuerza, para proporcionar la mejor estimación de la fuerza generada por la contracción de el músculo liso a lo largo de su eje longitudinal. La técnica estándar para el corte de tiras helicoidales de aortas fue colocar una varilla de vidrio en el lumen del vaso, hacer un corte en la pared del vaso en el ángulo deseado y aferrarse al final del borde expuesto de la pared del vaso como el corte se extendió para producir toda una tira helicoidal del buque. En ese momento, el lado endotelial del vaso fue borrado general para eliminar la suciedad antes de colocar la tira del recipiente para el transductor de fuerza y sumergir la preparación en una oxigenada y temperatura controlada de baño tejido. Con el tiempo, que enfoque condujo a uno de los descubrimientos más famosos e importantes en la historia de la fisiología por Furchgott y fueron1, es decir, el papel del endotelio derivado factor relajante (EDRF), posteriormente identificado como óxido nítrico, en regulación de la función vascular. El evento crucial hacia ese descubrimiento fue una situación en la que los investigadores mantienen un endotelio intacto evitando el contacto del lado endotelial de la arteria con las superficies exteriores y notó que la franja aórtica no mostró el esperado contracción a acetilcolina (ACh), pero en su lugar relajado en respuesta a la ACh. Basado en esa observación, los investigadores desarrollaron una preparación de "sandwich" en el que une un segmento aórtico con un endotelio intacto (pero incapaz de generar la fuerza contráctil) a una franja helicoidal estándar de aorta y convirtieron la ACh inducida contracción en una relajación.
Dos importantes avances en esta área que son ampliamente utilizados hoy son el desarrollo de los preparativos para medir fuerza contráctil activo en pequeña resistencia arterias2,3 (como en el mesenterio intestinal3 ) y canulados resistencia arteria preparados4,5,6. En uno de los informes más tempranos, Mulvany y Halpern3 describe el uso de la preparación de miógrafo de alambre para el estudio de la fuerza contráctil activa en arterias de resistencia aislada desde el mesenterio intestinal de las ratas espontáneamente hipertensas (SHR) y normotensos controles WKY. Tras el desarrollo del sistema wire miógrafo, canulado resistencia arteria preparaciones fueron desarrolladas para permitir estudios de los vasos en vivo condiciones4,5,6. Mientras que ambos métodos proporcionan resultados valiosos, la preparación de arteria canulado tiene las ventajas añadidas de más eficazmente preserva tono activo intrínseco en las arterias; y permitiendo a los investigadores estudiar activadas miógenas respuestas a los cambios en las respuestas de presión y vaso transmural a cambios en la tasa de flujo y esfuerzo cortante endotelial (ver revisión por Halpern y Kelley6).
Un objetivo principal del presente trabajo es describir cómo emplear la técnica ancestral de la microscopia video usando las arterias de resistencia aislada, canulado para obtener información precisa sobre los mecanismos que regulan el tono activo en estos cruciales vasos, independientes de influencias de la célula neuronal, humoral o parenquimatosa. Esta información básica, empleando un modelo de rata estándar y ejemplos de nuestros estudios de nuevo genéticamente diseñado cepas de ratas, proporcionará al lector una idea de los tipos de las ideas sobre la función vascular que puede ser adquirida con la televisión enfoques de la microscopia, y que pueden emplearse en estudios que incluyeron cualquier control y grupos experimentales el investigador elegir, incluyendo poderosos nuevos modelos experimentales rata producida por endogamia selectiva y recién desarrollado genética técnicas de ingeniería.
Gracias a la precisión de televisión métodos de microscopía, medición de los cambios de diámetro en preparaciones de arteria canulado puede proporcionar información muy valiosa sobre mecanismos endotelio-dependientes y endotelio-independiente de vascular relajación, así como alteraciones importantes (y a veces inesperadas) en los mecanismos de control vascular que ocurre con la hipertensión, dieta alta en sal y otras intervenciones experimentales. Además, medición de las relaciones de presión diámetro en aislado y canulados arterias de resistencia que máximo se relajan por el tratamiento con Ca2 +-libre solución o un fármaco vasodilatador farmacológico, permite al investigador evaluar cambios estructurales en las arterias debido a la remodelación vascular y para el cálculo de las relaciones de tensión pasiva7 que puede proporcionar la penetración importante en los cambios en las propiedades mecánicas pasivas de las arterias que pueden afectar la función arterial independiente de (o además de) los cambios en los mecanismos de control activo. También es importante tener en cuenta que información obtenida de los estudios de las arterias de resistencia aislada puede completarse con información obtenida utilizando LDF, un método práctico para evaluar la perfusión del tejido en el nivel animal entero8,9 ,10, y por información obtenida de la evaluación de la densidad de microvasos utilizando fluorescencia con lectinas de GS1, que específicamente se une a moléculas de la glicoproteína en la membrana basal de las arteriolas y los capilares pequeños11 , 12. el último método proporciona una estimación muy precisa de la densidad de microvasos que no está sujeto a las clásicas dificultades en estimar la densidad de microvessel contando barcos en vivo, por ejemplo falta sin perfusión recipientes donde el flujo sanguíneo se detiene debido al cierre activo de las arteriolas. Cuando se utilizan juntos, estos enfoques pueden proporcionar la penetración importante para correlacionar alteraciones funcionales en las arterias de resistencia aislada a los cambios en la perfusión del tejido a nivel microcirculatorio; y algunos ejemplos del uso de los enfoques valiosos en conjunción con técnicas de cannulated arteria también serán proporcionados en el presente manuscrito.
El presente trabajo se centra en el uso de técnicas de microscopia video para evaluar cambios vasculares en las arterias de ratas Sprague-Dawley exogámica. Sin embargo, es importante tener en cuenta que estas técnicas han demostrado para ser muy valiosa en la aclaración de alteraciones fenotípicas en cepas de rata genéticamente altamente especializado creadas por cría selectiva o gen mediante técnicas de edición. En este manuscrito, nos proporcionan ejemplos de técnicas de microscopía de vídeo han proporcionado información importante sobre la función vascular en un número de rata valiosos modelos, incluyendo la cepa Dahl sensible a la sal (SS) rata, una rata endogámicas que es el más ampliamente utiliza el modelo experimental para estudiar los mecanismos de sal sensibles hypertenson18,19,20,21,22,23; y ratas de consomic creadas a través de cría selectiva de las ratas de la SS con la sal-insensible cepa de rata marrón Noruega (BN). En los paneles de la rata de consomic, cada cromosoma de la rata marrón ha sido río individualmente en el fondo genético Dahl SS24,25,26 . Uso de paneles de rata consomic ha proporcionado pistas valiosas en cuanto a cromosomas específicos que contribuyen a la sal sensibilidad de la presión arterial y otros fenotipos, como la reactividad vascular24,25,26 ,27,28.
Estrategias de crianza selectiva utilizando SS ratas y ratas de consomic llevar cromosomas BN individuales también han permitido la generación de tensiones congenic estrechas con pequeños segmentos de cada río de cromosomas marrón Noruega en la SS de Dahl genética Fondo22,29. Estos proporcionar valiosísimo entrada en genes específicos o reducir las regiones de los cromosomas que pueden afectar las variables fisiológicas cruciales, como la presión arterial, daño renal y reactividad vascular22,29. Otra potente adición a la caja de herramientas genética de rata es el desarrollo de modelos de ratón gene knockout utilizando avanzado gene incluyendo ZFNs, nucleasas activador-como-efector transcripcionales (TALENS), técnicas de edición y más recientemente CRISPR-Cas913 ,14,15,16,17. El advenimiento de estas poderosas técnicas que permiten a los genes a ser noqueado en la rata es un desarrollo sumamente importante porque gene knockout estudios hasta la fecha han utilizado (y seguirán usando) ratones casi exclusivamente. Otro componente experimental en el presente artículo demuestra el valor de arteria canulado técnicas y video microscopia para evaluar los mecanismos de control fisiológico en ratas knockout que carecen la transcripción protección antioxidante y la célula principal factor, factor nuclear (derivados del eritroide 2) - como - 2 (NRF2)30,31, que fueron desarrollados utilizando tecnología TALEN en ratas Sprague-Dawley genética17. En aquellos experimentos en vitro microscopia video se utilizaron técnicas para proporcionar verificación funcional de la pérdida del gen NRF2 y poner a prueba un enfoque terapéutico potencialmente valioso basado en directo upregulation de antioxidantes NRF2-mediada defensas. NRF-2 es de sustancial importancia terapéutica en la lucha contra el estrés oxidativo vascular en seres humanos, a la luz de los decepcionantes resultados de ensayos clínicos con administración directa de antioxidantes como las vitaminas C y E32.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
El Medical College de Wisconsin institucional Animal Care y el Comité uso (IACUC) aprobó todos los protocolos descritos en este documento y todos los procedimientos son en cumplimiento de la oficina de institutos nacionales de salud (NIH) de bienestar de animales de laboratorio (OLAW) reglamentos.
1. preparación de soluciones y la cámara del buque
- Antes de realizar una serie de experimentos, preparar 2 L de 20 x concentrado solución madre de sal que consta de 278 g/L de NaCl; 14 g/L KCl; Contabilidad 11,52 MgSO4. 7H2O; y 9,4 g/L CaCl2. 2H2O. También preparar 2 L de 20 x concentrado existencias consisten en 80,8 g/L de NaHCO3 y 0.4 g/L EDTA y 2 L de 20 x concentran Ca2 +-solución libre de 281,6 g/L de NaCl; 14 g/L KCl y 11,52 g/L MgSO4. 7H2O.
Nota: 20 X soluciones madre pueden almacenarse en el refrigerador hasta su uso. - En el día del experimento, preparar 2 L de solución salina fisiológica (PSS) de 20 x concentradas soluciones como sigue: Añadir 100 mL de 20 x acción sal a 1.800 mL de agua desionizada en un matraz Erlenmeyer de 2 L o vaso en un plato motorizado de agitación. Añadir 100 mL de existencias x 20 mientras que equilibra continuamente la solución con una mezcla de gas que contiene 21% de O2, 5% CO2, equilibrio N2y revolviendo con una barra de agitación magnética. Lentamente Añadir 0,28 g NaH2PO4 vigilando el pH; ajustes necesarios a pH 7,4 añadiendo gotas de HCl N 6 o 6.5 solución de NaOH N de una pipeta Pasteur. Después el PSS se prepara y se ajusta el pH, añadir 1,98 g de glucosa al PSS.
Nota: Es importante agregar lentamente el NaH2PO4 último vigilando el pH del PSS porque la adición de NaH2PO4 a una solución alcalina (pH > 7,4) podría formar un precipitado de fosfato de calcio, como se indica en la aspecto de una solución turbia o un precipitado blanco en el fondo del recipiente.
Nota: La composición final del PSS es 119 mM/L de NaCl; 4,7 mM/L KCl; 1,17 mM/L Mg2por4; 1,6 mM/L CaCl2; 1.18 m m/L NaH2PO4; 24 mM/L NaHCO3; 0,03 mM/L EDTA; y 5,5 mM/L glucosa. Aunque la composición de la PSS puede diferir entre laboratorios, esta receta es muy adecuada para mantener el tono vascular, la función endotelial y las respuestas a agentes vasoactivos en las arterias de resistencia aislada. - Para determinar el diámetro máximo y evaluar tono activo en la arteria produciendo dilatación máxima de la embarcación, preparar 500 mL de Ca2 +-libre PSS añadiendo 25 mL de la 20 X Ca2 +-libre stock sal a 450 mL de agua desionizada , seguido de 25 mL de 20 x existencias en un matraz Erlenmeyer o recipiente similar al paso 1.2 anterior. Añadir 0,07 g de NaH2PO4 a la solución de monitoreo y ajuste el pH de la solución. El Ca2 +-gratis PSS se añade a la cámara de depósito y el recipiente PSS al final del experimento para evitar el agotamiento intracelular Ca2 + tiendas que podrían afectar las respuestas vaso normal PSS. Porque el Ca2 +-solución gratuita se añade al final del experimento para producir máxima relajación de las arterias, no es necesario agregar glucosa al PSS.
Nota: Cuando termine, la composición final de la Ca2 +-gratis PSS es 120,6 mM/L de NaCl; 4,7 mM/L KCl; 1,17 mM/L Mg2por4; 1.18 m m/L NaH2PO4; 24 mM/L NaHCO3; 0 mM/L CaCl2; y 0,03 mM/L EDTA.
Nota: Para muchos estudios que requieren la máxima dilatación de la arteria, un bloqueador de la entrada de calcio como el verapamilo (1 μm) o un donante de óxido nítrico como el nitroprusiato de sodio (10 μm) puede agregarse a la solución, además de eliminar Ca2 + del PSS. - Mantener el pH del PSS, PO2y PCO2continuamente equilibrando el PSS que fluye en el compartimiento del recipiente en un baño de órgano estándar utilizado para el estudio de anillos de aorta aislados del músculo liso intestinal y otros tejidos (figura 1). Uso sintético fluoropolímero de tetrafluoroetileno tubería para conectar el tanque de gas para el baño de órgano debido a que este tipo de tubería es gas impermeable, en contraste con muchas otras formas de tubería, por ejemplo, látex.
- Lugar una piedra de aire pequeño conectado a la mezcla de gas de equilibrio en la cámara del buque para ayudar a mantener la composición del gas PSS.
Nota: Las respuestas vaso cambios en PO2 pueden comprobarse por equilibrar el PSS en el compartimiento de la embarcación y solución luminal con mezclas de gases que contengan diferentes porcentajes de O2, por ejemplo, 21% O2, 10% O2, 5% O2 y 0% O2, con 5% CO2 y el equilibrio N233,34,35. De grandes arterias con paredes más gruesas, donde la difusión de oxígeno en el centro de la pared del vaso puede ser una limitación, puede usarse un porcentaje mayor de oxígeno, por ejemplo, 95% O2 . - Monitoree la temperatura en la cámara de la nave de cerca, como las cámaras pueden variar en sus características de transferencia de calor.
Nota: Muchos compartimientos del recipiente preparado comercialmente utilizadas para los estudios de las arterias de resistencia canulado utilicen una bomba peristáltica para proporcionan PSS oxigenada de un depósito de gas-equilibrado y preciso control de temperatura del baño y la oxigenación de el PSS. - Coloque el PSS en un frasco de Mariotte (2 L) grande, con un tapón y el tubo de cristal central para servir como un reservorio para entregar continuamente PSS en el baño de órgano que calienta y gas-equilibra el PSS que fluye en el compartimiento de la embarcación (figura 1A).
- Coloque la abertura del centro del tubo de vidrio en la botella de Mariotte en el mismo nivel que la parte superior de la PSS en el baño de órgano, para mantener una cabeza de presión hidrostática constante para entrega de PSS en el baño de órgano. Tubería de polietileno de uso conectado a un cristal en forma de J o tubo de plástico para entregar el PSS de la botella de Mariotte en el baño de órgano.
- Para perfusión luminal (figura 1A), usar tubería de polietileno para conectar la pipeta de entrada a un depósito PSS, compuesto por un 60 cc jeringa de plástico elevados a una posición que mantiene la presión de entrada deseada (generalmente 80 mmHg para estudios cerebrales de la rata transductor de las arterias), medido con una presión conectado al sistema mediante una llave de paso.
- Conectar la pipeta de salida para un tubo de polietileno para permitir que el PSS fluya a través de los vasos en respuesta a un gradiente de presión y conectar la línea de salida a un depósito similar al depósito de entrada. Utilice una conexión de transductor de presión y llave de paso similar para medir la presión de salida.
Nota: Procedimientos para el ajuste de la presión transmural y el control de flujo a través de la nave se describen en la sección 2, a continuación. - Al final del experimento, enjuague bien la cámara, las líneas de suministro y sistemas de depósito con agua destilada. A intervalos frecuentes, sustituir las líneas de tubería y entrega, limpiamos o reemplazar los grifos del sistema de y someter periódicamente cualquier depósitos de vidrio PSS a un lavado ácido para evitar el crecimiento de bacterias y otros microorganismos que causan contaminación y afectar la reactividad de los vasos.
2. preparación de arteria canulado
- Anestesiar una rata Sprague-Dawley con 5% isoflurano y mantener la anestesia, uso de oxígeno de grado médico de 1.5-2.5%36. Alternativamente, administrar una inyección intramuscular con acepromazina (2,5 mg/kg) y ketamina (75,0 mg/kg) y xilacina (10.0 mg/kg); una inyección intraperitoneal de pentobarbital (50-60 mg/kg); o cualquier otro método aprobado de la anestesia, dependiendo de los protocolos o preferencias del investigador.
- Decapitar la rata bajo anestesia profunda y quitar el cerebro para estudios de las arterias de resistencia cerebral.
- Después del retiro del cerebro, aislar cuidadosamente la arteria cerebral media (MCA) (o en otras arterias de interés p. ej., arteria basilar y arteria cerebral posterior)37,38. Para aislar el MCAs, coloque el cerebro supina en caja Petri de vidrio llenado de helado PSS (figura 2).
- Utilice tijeras Vannas y unas pinzas de punta fina de Dumont #5 para el MCA en el cerebro. Limpie cualquier tejido cerebral residual de la MCA usando el fórceps y transferir la arteria a una cámara de buque controlado de temperatura que contiene PSS como se describió anteriormente. 33 , 34 .
- Para transferir la arteria a la cámara de la nave, Coloque suavemente el recipiente suprimido por el ACA o el segmento de la arteria comunicante posterior y coloque con cuidado en la cámara.
Nota: Además de la MCA, el sistema de vaso canulado es conveniente para una amplia variedad de preparaciones de vaso pequeño, incluyendo músculo esquelético la resistencia arterias33,39,40, las arterias mesentérica resistencia 38 , 41 , 42y grande (primer orden) arteriolas del músculo cremáster43, así como humanas arteriolas coronarias y arteriolas humanas obtenidas de tejido adiposo subcutáneo durante la biopsia glúteos44,45, 46,47. - Conecte la arteria a la micropipeta de entrada tirando de él hacia la base de la pipeta hasta la punta de los avances en el lumen de la MCA. Asegure la arteria en la pipeta de entrada atando un lazo elaborado de una fibra de filamento solo bromeó antes de 10-0 suturas alrededor de la arteria (figura 1B). Sujete el extremo opuesto de la MCA a la pipeta de salida apretando un segundo lazo de sutura alrededor de la embarcación (figura 1B).
Nota: Coloque los lazos de la sutura en las Micropipetas antes de montar el recipiente y colocar cerca del punto final de conexión, permitiendo que se desliza fácilmente sobre la arteria y aseguró rápidamente cuando el buque está en posición, que reduce al mínimo el riesgo de la arteria deslizamiento las pipetas.
Nota: Micropipetas están preparados de tubo capilar de vidrio de borosilicato (diámetro exterior 2 mm; 1 mm de diámetro interior y 10 cm de largo) utilizando un tirador vertical micropipeta. Antes de instalar la arteria, coincide con el diámetro de la punta de las Micropipetas tan cerca como sea posible para evitar los desajustes de la resistencia de entrada y salida en el sistema de perfusión. - Después de que la arteria está firmemente ligada a las micropipetas, utilizar el micrómetro conectado al titular de la pipeta de entrada para estirar la arteria a su longitud en situ .
- Ate las ramas laterales con cadenas simples burlas de suturas 10-0 para mantener una presión constante en la arteria.
- Verificar la ausencia de fugas por asegurarse de que la presión intramural (transmural) permanece constante después de cerrar temporalmente la pipeta de entrada. Ate las sucursales o comprobar los orificios en el vaso si la presión baja. Restaurar la perfusión después de comprobar que la presión transmural permanece constante.
Nota: La canulación de las arterias de resistencia aislada requiere práctica y destreza manual. Las principales precauciones que deben observarse son para evitar romper las pipetas y para asegurarse de que la arteria no se salga con las pipetas. Es importante ser suave con las arterias aisladas a lo largo de todo el procedimiento, como trauma al recipiente que puede dañar el endotelio o interferir con la función normal del músculo liso vascular. - Mida el diámetro interno de la arteria usando una configuración de video microscopía (figura 1A) que consiste en una cámara de vídeo conectada a un microscopio de disección y conectado a un micrómetro de vídeo y monitor de televisión (figuras 1B, 1C). Esto permite que el observador medir diámetros de recipiente manualmente colocando líneas de referencia movible en la pared interna de la arteria y, si lo desea, en la pared externa de la arteria, con el fin de medir el espesor de la pared de recipiente.
Nota: Algunos micrómetros videos ofrecen seguimiento automático de dimensiones de la embarcación.
Nota: Calibrar el video micrómetro con un micrómetro de microscopio y a la entrada y salida de los transductores de presión con un manómetro de mercurio (mmHg 0 50 mmHg, 100 mmHg, 150 mmHg y 200 mmHg) entre los experimentos para asegurar medidas precisas de presión diámetro e intramural.
Nota: La presión transmural de control estándar para los experimentos MCA de rata es de 80 mmHg. Calibración de niveles de presión superior e inferior asegura exactitud para estudios de respuestas miógenas cambios en transmural curvas de presión diámetro presión y pasivo en las arterias dilatadas máximo. - Ajuste la altura de los embalses de entrada y salida para mantener la presión transmural deseada en un nivel constante. Aumentar el depósito de entrada por una pequeña cantidad (< 5 mmHg) y disminuir el depósito de salida por la misma cantidad mantienen la presión transmural media y crea flujo de perfusión del vaso lumen6.
Nota: El depósito de flujo de subida y bajada del depósito de salida por cantidades iguales mantiene el mismo transmural de media presión en la arteria de distensión, pero genera un gradiente de presión hidrostática que causa flujo y esfuerzo cortante en el recipiente, permitiendo la investigador para evaluar respuestas dependiente del endotelio a los cambios en tensión de esquileo intramural en diferentes grupos experimentales48. - Para evaluar las respuestas miógenas y buque respuestas a estímulos vasodilatadores, asegúrese de que la arteria presenta un nivel adecuado de tono activado (aproximadamente el 40%) antes del experimento. Deseche cualquier arterias que carece del tono activo en reposo con la excepción de los buques, por ejemplo, pequeñas arterias mesentéricas que normalmente no presentan tono reposo activo.
Nota: Para los buques que no exhiben normalmente tono espontáneo, pre-constriñen las arterias por una cantidad equivalente utilizando a un agonista de vasoconstrictores como la noradrenalina o fenilefrina. Una buena aproximación a la elección de la dosis de agonista usado para la constricción de la arteria es utilizar una dosis de50 CE del agente vasoconstrictor, por ejemplo, norepinefrina41,42. Sin embargo, vasoconstrictores farmacológica no deben aplicarse a las arterias que presentan tono espontáneo activo en condiciones de reposo. - Prueba de reactividad dependiente del endotelio de la arteria de cannulated resistencia mediante la medición de diámetros de vasos durante la adición del aumento de concentraciones de ACh (10-10 M-10-5 M) a la cámara del buque. Prueba el óxido nítrico endotelio-independiente de la sensibilidad del músculo liso vascular por la medición de diámetros de vasos durante la adición de aumento de las concentraciones (10-10 M-10-5 M) del nitroprusiato de sodio donantes de óxido nítrico a la cámara de la nave.
Nota: Sensibilidad a vasoconstrictores y otros agonistas vasodilatador puede probarse de forma similar mediante la adición de concentraciones crecientes del agonista a la cámara del buque.
Nota: Además de agentes vasoactivos, diversos fármacos, los inhibidores y otros agentes farmacológicos pueden agregarse al baño tejido o a la solución de luminal. Cambios en PO2 (así como de la PCO2 y pH) pueden ser selectivamente administradas al lado endotelial o el extra luminal de la arteria por equilibrado independiente de la solución luminal con una piedra de aire conectada a una mezcla de gas calibrado diferente de la mezcla que se utiliza para equilibrar el PSS en el tejido baño33,34,49. Miógenas respuestas a los cambios en la presión transmural pueden ser estudiadas por la pipeta de salida de cierre y aumentar (o disminuir) la altura del embalse PSS conectado a la entrada pipeta49,50,51 a aumentar o disminuir la presión intraluminal. - Para probar el papel del endotelio en la mediación de las respuestas de buque a estímulos específicos, retire el endotelio vascular y comparar respuestas de buque a los estímulos en la presencia o ausencia de endotelio. Para quitar el endotelio, desate cuidadosamente la arteria de la pipeta de salida y lentamente perfusión el lumen de la arteria con un bolo de aire (0.5-1.0 mL). Después de la perfusión de aire, restaurar la perfusión PSS para despejar los detritos celulares antes de volver a amarrar el buque a la pipeta de salida43.
Nota: Siguiendo el procedimiento de denudación endotelial, es importante verificar que el endotelio se ha quitado examinando las respuestas vasculares a un agonista (generalmente ACh) conocidos por producir vasodilatación dependiente de endotelio en ese tipo de buque. Sin embargo, en ciertas condiciones patológicas, se liberan vasoconstrictores dependiente del endotelio, en cuyo caso, es importante verificar que la respuesta de constrictor se elimina después del retiro endotelial. - Al final del experimento, determinar el diámetro máximo de la arteria mediante la adición de Ca2 +-libre PSS a la solución y superfusate. Calcular el tono reposo activo (%) como ((Dmax-Dresto) /DMax.) x 100, dondemax D es el diámetro máximo en presencia de Ca2 +-libre solución y Dresto es el diámetro de control descanso.
Nota: Las mediciones del diámetro de arterias máximo relajadas en los diferentes grupos experimentales son útiles comparando el tono de reposo activo, remodelación estructural (es decir, cambios de diámetro de pared grueso y lumen) y propiedades mecánicas pasivas (relaciones de tensión calculan de pasivos diámetros en los diferentes niveles de la presión transmural).
3. evaluación de las respuestas de flujo sanguíneo Cerebral con LDF
- Anestesiar los animales con 5% isoflurano y asegure la rata en un aparato estereotáxicas9,10.
- Mantener el animal bajo anestesia constante monitoreo frecuencia respiratoria final marea CO2y profundidad de la anestesia con un pellizco del dedo del pie del36.
- Delgado cuidadosamente el cráneo a translucidez con un taladro dental de baja velocidad y aceite mineral que aporta acoplamiento óptico10. Tenga cuidado para evitar generar calor excesivo y evitar penetrar el hueso.
Nota: Adelgazamiento del cráneo permite que la luz láser hacia el tejido subyacente y reflejarse hacia la punta de prueba para medir el cambio Doppler, la magnitud de la que se determina por el número de partículas móviles (es decir, células de sangre rojas) y su velocidad. - Asegure la sonda LDF en un micromanipulador y colocarlo directamente sobre el área adelgazado del cráneo. Durante el experimento, es muy importante prevenir el movimiento de la sonda LDF o la preparación, como la FDL está diseñado para medir el flujo en un área restringida del tejido y es extremadamente sensible a los artefactos de movimiento.
Nota: Cualquier movimiento de la sonda de su posición inicial proporcionará una estimación del flujo de sangre en un área diferente del tejido, que las comparaciones. LDF no proporciona valores de flujo absoluta y no es conveniente para la comparación entre sujetos, es una manera excelente de forma no invasiva evaluar cambios en la perfusión del tejido en respuesta a las intervenciones experimentales en sujetos individuales; y cambios relativos en señal de LDF de valores de control pueden ser un promedio y en comparación a los cambios en la señal LDF de control en otros grupos experimentales.
Nota: LDF es un método conveniente para profundizar en los factores de regulación del flujo sanguíneo a nivel de la cama todo vascular en diferentes grupos experimentales8,9,10. Evaluación de la perfusión del tejido con LDF proporciona un enfoque práctico para asimilar los conocimientos a base de estudios de vasos aislados en una perspectiva de la cama entera. Salvo las diferencias regionales en los mecanismos de control vascular entre las arterias de resistencia y la microcirculación, las mediciones obtenidas con LDF proporcionan una buena indicación de control de flujo de sangre del tejido que es generalmente consistente con los resultados obtenidos con preparaciones de arteria canulado.
4. evaluación de la densidad de Microvessel de músculo esquelético con lectinas de GS1
- Quitar el músculo del cremaster de una rata macho por corte abierto del escroto con tijeras quirúrgicas finas estándar y utilizando unas pinzas Dumont #5 para agarrar el músculo.
Nota: Los músculos finos (por ejemplo, el músculo cremaster, así como el extensor digitorum longus y tibialis anteriores músculos que se encuentran en las ratas machos y hembras) son ideales para uso como todo se monta para los estudios de lectinas, aunque histológica secciones pueden utilizarse para tejidos más gruesos. - Quitar el músculo del cremaster del testículo con un solo corte. Ponga en PSS helada y él hacia fuera en una placa Petri con un revestimiento de elastómero de silicona en la parte inferior dentro de la superficie. Tease suavemente lejos del tejido conectivo con unas pinzas Dumont #5.
- Enjuagar las muestras de músculo con 2 mL de tampón PSS y luego sumergirlos en lectinas GS1 marcado con rodamina (PSS de 20 μg/mL) durante 50 minutos en una placa de cultivo celular 12-bien con 2 mL/bien que se envuelve en papel de aluminio para excluir la luz.
- Retire los tejidos de la solución de lectinas, enjuáguelos tres veces en PSS con incubaciones de "lavado" de 5 min en un eje de balancín y montar en portaobjetos de microscopio. Asegúrese de que al incubar los tejidos en el oscuro y guardar las diapositivas en la oscuridad para evitar la pérdida de fluorescencia.
Nota: Si las diapositivas no se puede utilizar inmediatamente, puede mantenerse en el refrigerador sin pérdida de la fluorescencia. Para un almacenamiento prolongado, las diapositivas pueden ser guardadas en un congelador para evitar deterioro11. - Evaluar la densidad de microvessel contando el número de intersecciones de los microvessels marcadas con líneas de cuadrícula generada por ordenador superpuestas sobre la imagen52, o con un recubrimiento de rejilla transparente superpuestas sobre el monitor que se utiliza para ver las diapositivas.
Nota: Se han utilizado enfoques de lectinas de GS1 para demostrar: rarefacción microvascular inducida por la sal53, el efecto protector de prevención sal inducida por la supresión de angiotensina II en la restauración de la densidad de microvasos en animales alimentados con sal17 ,53,54; el papel de NRF2 mediando el efecto protector de la infusión de II de angiotensina de dosis baja para prevenir la rarefacción de microvasos en consumieron sal17; y también para evaluar el papel de la angiotensina II en el mantenimiento de angiogenic respuestas a la estimulación muscular crónica en sal alimentó ratas54,55. Una de las ventajas de la técnica de lectinas de GS1 es que puede utilizarse para evaluar la densidad de microvasos en los mismos animales utilizados para estudios de las arterias de resistencia canulado o LDF.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
In vitro la microscopia de las arterias de resistencia canulado permite el estudio de los factores que influyen en el tono activo en arterias de resistencia pequeña (y más grandes arteriolas) normal en vivo la presión transmural y en la ausencia de células de parénquima influencias. Además de evaluar la reactividad de los vasos a varios estímulos vasodilatadores y vasoconstrictores y respuestas miógenas a elevación de la presión transmural en PSS normal, la Ca2 +-gratis PSS pueden agregarse a la solución y superfusate al final de el experimento para determinar el buque máximo diámetro y espesor de pared. Las medidas de este último son altamente valiosas en la evaluación de remodelado vascular, es decir, cambios en la relación pared/lumen que puede ocurrir en respuesta a los cambios en la presión sanguínea o la administración de agentes farmacológicos. Las mediciones del diámetro de los vasos dilatados máximo en Ca2 +-gratis PSS son útiles para calcular el tono intrínseco como ((D -Dmaxresto) /DMax.) x 100, donde la Dmax y Dresto encuentran lo maximo (Ca2 +- libre de PSS) y diámetro (PSS), respectivamente, a la presión de equilibrio de control (generalmente 80 mmHg para MCA). En nuestra experiencia, tono activo en el MCA es alrededor de 40% a una presión transmural de 80 mmHg. Medir el diámetro de las arterias dilatadas máximo es también una forma práctica para evaluar las propiedades mecánicas pasivas de los vasos midiendo el diámetro de las arterias en diferentes niveles de transmural presión de distensión y el uso de los resultados a calcular las relaciones de tensión y otras propiedades mecánicas de los vasos7,56.
Figura 3 es una representación esquemática de tres cepas de estrechamiento congenic derivado de la rata SS.13BN utilizando enfoques adicionales de cría selectiva. En estas cepas de ratas, los segmentos cromosómicos tampoco incluyen el alelo marrón Noruega de renina (Ren1-BN) o está cortada justo por encima (Ren1-SSA) o bien justo por debajo (Ren1-SSB) el locus del gen de renina (así reteniendo el alelo de renina SS). En el estudio29, el segmento cromosómico que contiene el alelo de renina marrón Noruega contiene 25 genes.
Figura 4 ilustra la respuesta a la vasodilatador dependiente del endotelio ACh (1 μm) en MCAs aislados de ratas Dahl SS macho y los tres se redujo tensiones congenic se muestra en la figura 3. Uso combinado de estas tres tensiones congenic que incluyen (Ren1-BN) o se cortan justo por encima (Ren1-SSA) o debajo de gen de la renina (Ren1-SSB) limita la región de interés (es decir, el área que rodea el lugar geométrico del gene de renina) a unos 25 genes. En estos experimentos, los animales eran normotensos y alimentó una sal baja (0,4% NaCl) dieta. En que la dilatación dependiente del endotelio29 de estudio a ACh era ausente en la cepa parental de SS y en las cepas de congenic conservando el alelo de la renina de SS, pero fue restaurada en la tensión congenic llevan el alelo de renina BN en el fondo genético de la SS. Los resultados de ese estudio apoya los hallazgos de estudios anteriores utilizando SS.13BN consomic ratas57,58 y proporciona fuerte evidencia que la disfunción endotelial está presente en las ratas de la SS, incluso cuando son normotensos y alimentados con una dieta baja en sal. Tomado junto, que los resultados de esos estudios29,57,58 apoyan la hipótesis de que la disfunción endotelial en ratas SS es debido a la regulación deteriorada del gen de renina, dando por resultado la exposición crónica a bajas niveles de angiotensina II en la sangre.
Otro estudio59, resumido en la figura 5, en comparación con la respuesta a la vasodilatador dependiente del endotelio ACh en MCAs aislado (MCA) de ratas Dahl SS macho y SS.5BN consomic las ratas llevan cromosoma 5 (que contiene genes marrón Noruega para diversas isoformas de citocromo P450 4A ω-hidroxilasa). En ese estudio, los animales fueron alimentados ya sea una sal baja (0,4% NaCl) o sal alta (4% NaCl) dieta. En contraste con el MCA de ratas SS, dilatación dependiente de endotelio a ACh fue mantenida en MCA de las SS.5BN consomic las ratas alimentadas con dieta baja en sal. Además, (y en contraste con resultados de SS.13BN consomic ratas57,58, Sprague-Dawley ratas33,39,40,60y hámsters dorados 61), una dieta alta en sal no ha podido eliminar la dilatación inducida por ACh en las ratas SS.5BN , indicando eso ω-hidroxilasa de CYP450-4A y ácido 20-hidroxieicosatetraenóicos (20-HETE) son importantes contribuyentes al estrés oxidante vascular y endotelial disfunción en las ratas de la SS y elevaciones en la ingesta de sal en otras cepas. Desde una perspectiva experimental, el fracaso de la dieta alta en sal para eliminar la dilatación dependiente del endotelio a ACh proporciona un ejemplo de cómo los estudios de las arterias de resistencia canulado pueden producir resultados inesperados que parten de la sabiduría y podría conducir a una nueva comprensión de los mecanismos de control complejas que afectan a la función de estos vasos cruciales.
La figura 6 muestra la respuesta de MCA aislado a ACh (1 μm) de tipo salvaje y Nrf2(- / -) nocaut en ratas alimentadas con una dieta baja en sal (0.4% NaCl), alta dieta de sal (4% NaCl), o una dieta alta en sal que contiene un conocido NRF2 activador30,62 . En ausencia de estrés oxidativo inducido por la sal, la dilatación inducida por ACh fue similar en MCA de tipo salvaje y las ratas knockout Nrf2(- / -) . De acuerdo con los resultados de estudios anteriores de ratas Sprague-Dawley, la dieta alta en sal había eliminado dilatación inducida por ACh tipo salvaje y las ratas knockout Nrf2(- / -) . Además del NRF2 inductor a la dieta alta en sal restauran la dilatación dependiente del endotelio a ACh en las ratas de tipo salvaje, pero no en las ratas Nrf2(- / -) , demostrando la eliminación exitosa del gen Nrf2 en las ratas knockout, y apoyar el uso de up-reguladores de NRF2 como acercamiento terapéutico para mejorar el estrés oxidativo vascular.
Figura 7 resume los resultados de las mediciones de LDF comparando las respuestas de la microcirculación pial a la progresiva reducción de la presión arterial producido por retiros de volumen de sangre sucesivas en ratas Sprague-Dawley en cualquiera una sal normal (0.4% NaCl) dieta o una sal alta (4% NaCl) dieta durante cuatro semanas. En contraste con las ratas alimentadas con una dieta baja en sal, ratas alimentadas con la exposición de la dieta alta en sal una habilidad deteriorada para mantener un flujo constante de sangre durante las reducciones en la presión de perfusión, indicando que los mecanismos de autorregulación de flujo cerebral de la sangre en peligro por la exposición a largo plazo a una dieta alta en sal. Los resultados de esos experimentos son consistentes con la presencia de mecanismos de alteración de relajación vascular en arterias cerebrales aisladas de ratas alimentados con sal60 y proporcionan un buen ejemplo de cómo las mediciones FDL pueden ser empleadas para apoyar y ampliar la resultados de los estudios que emplean las arterias de resistencia aislada al nivel de la cama vascular todo.
Además de evaluar la función de resistencia de la arteria usando arterias aisladas y perfusión del tejido mediante flujometría Láser-Doppler, la densidad de microvessel y angiogénicos respuestas a varios estímulos como crónica muscular estimulación54, 55 puede evaluarse en los mismos animales utilizando lectinas de GS1 marcada con fluorescencia, que se une selectivamente a moléculas de la glicoproteína en la membrana basal de las arteriolas y capilares. La figura 8 muestra lectinas típica tinción en el músculo del cremaster de ratas Sprague-Dawley alimentadas una dieta baja en sal o una dieta alta en sal durante 2 semanas (tenga en cuenta la menor densidad de microvasos en las ratas alimentadas sal alta). Densidad de microvasos es evaluado contando las intersecciones de microvasos lectina-etiquetado con una referencia generada por computadora red52y proporciona un método excelente para evaluar angiogénicos respuestas54,55 , o detectar y cuantificar la pérdida de microvasos en condiciones como la hipertensión y la ingesta de sal elevada12,17,53.

Figura 1: In vitro la microscopia video instalación empleada para el estudio de las arterias de resistencia aislada, canulado (A). Arteria de Cannulated resistencia ligada a Micropipetas de vidrio (B) y pantalla de video micrómetro mostrando la medición del diámetro del lumen en arteria resistencia canulado (C). Barra de escala en el Panel B representa el diámetro interno de la arteria canulado (μm), y 125 μm en C Panel es la pantalla de la distancia entre las líneas de referencia movible colocado manualmente en las paredes internas de la arteria por el observador llevar a cabo el experimento . Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Diagrama esquemático del procedimiento de aislamiento de la arteria cerebral media del cerebro y prepararlo para la canulación con las Micropipetas. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Diagrama esquemático de las cepas de rata congenic estrechada con pequeños segmentos de Río de cromosoma 13 Noruega marrón en el fondo genético de Dahl de sal sensible. Segmentos cromosómicos contiene el alelo marrón Noruega de renina (Ren1-BN) o se cortan justo por encima (Ren1-SSA) o justo debajo (Ren1-SSB) el locus del gen de renina y retener así el alelo de renina SS. Esta figura ha sido modificada y reproducido de Durand et al. 29 con el permiso de la American Physiological Society. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Respuesta de aislados, canulados ratas MCAs de SS y tensiones de la rata de la Congénicos (ilustradas en la figura 2) a acetilcolina 1 μm. Datos se expresan como ±SEM de cambio (Δ μm) de diámetro promedio de descanso diámetro de control antes de la acetilcolina y se volver de un original estudio de Durand et al. 29 Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Respuesta de ratas MCAs de SS aisladas, canuladas y SS.5BN consomic ratas a acetilcolina 1 μm en animales alimentados bajo en sal (0.4% NaCl) o sal alta (4% NaCl) dieta. Datos se expresan como ±SEM de cambio (Δ μm) de diámetro promedio de descanso diámetro de control antes de la acetilcolina y se volver un estudio original por fuentes et al. 64 Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Respuesta a acetilcolina 1 μm en MCAs canulados, aislados de ratas knockout Nrf2(- / -) y controles de tipo salvaje alimentados con dieta baja en sal (0.4% NaCl), alta dieta de la sal (4% NaCl), o dieta alta en sal que contiene un conocido NRF2 activador30, 62. los datos se expresan como ±SEM de cambio (Δ μm) de diámetro promedio de descanso diámetro de control antes de la acetilcolina. Haga clic aquí para ver una versión más grande de esta figura.

Figura 7: Flujo de sangre cerebral evaluado por LDF en la microcirculación pial. Ratas Sprague-Dawley mantenidas en una dieta alta en sal para cuatro semanas exhibió un deterioro significativo en su capacidad para mantener constante flujo de sangre como la presión arterial se redujo en respuesta al retiro del volumen de sangre sucesivas. Datos se representan como porcentaje promedio del control ±SEM * p < 0.05 vs dieta baja en sal en la misma presión arterial media. Haga clic aquí para ver una versión más grande de esta figura.
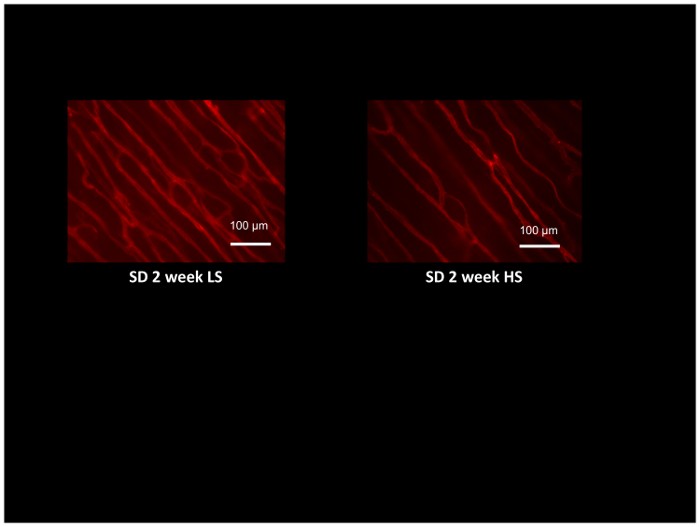
Figura 8: Micrografía de rata músculos del cremáster con lectinas de GS1 marcado con rodamina identificar arteriolas y tubos capilares para la evaluación de la densidad de microvasos. Músculos del cremáster se obtuvieron de las ratas de Sprague-Dawley alimentadas bajo en sal (LS; 0.4% NaCl) o sal (HS:4% NaCl) dieta para 2 semanas y demostrar la rarefacción microvascular en los animales alimentados con HS comparados a los controles de la LS. Barra de escala = 100 μm. haga clic aquí para ver una versión más grande de esta figura.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Como se señaló en la introducción, este trabajo describe el uso de la microscopia de la televisión y aislada resistencia arteria enfoques para evaluar la función vascular no sólo en modelos de ratón estándar (como en el video), pero también en altamente especializados genéticamente cepas de ingeniería rata, que muestra la novela y poderosas ideas que pueden ser adquiridas utilizando estos enfoques. El uso de estas poderosas técnicas para evaluar el tono activo y pasivos propiedades mecánicas de las arterias de resistencia pequeña pueden proporcionar información importante sobre un amplio espectro de mecanismos de control vascular incluyendo la regulación dependiente de endotelio de tono activo en arterias de resistencia, función del músculo liso vascular bajo condiciones normales y fisiopatológicas y propiedades pasivas de las arterias relacionadas con remodelado vascular y cambios en la mecánica de la pared vascular. La disfunción endotelial ha demostrado ser un poderoso indicador pronóstico de múltiples eventos cardiovasculares adversos en los seres humanos incluyendo muerte cardiovascular relacionada con63y canulado resistencia arteria preparaciones son especialmente valiosas en detección de disfunción endotelial y el aumento de nuestra comprensión de los mecanismos de la disfunción endotelial.
Para ilustrar la efectividad de en vitro microscopia video técnicas que emplean las arterias de resistencia aislada, nos proporciona ejemplos del uso de estas técnicas en ratas de Dahl sensible a la sal (SS) y en novela consomic cepas de ratas que exhiben una reducción sal sensibilidad de la presión arterial en comparación con la cepa parental de SS24. Los estudios investigaron los mecanismos de control vascular relacionado con los genes en los cromosomas de dos que son de particular interés en contribuir a la sal sensibilidad de la presión arterial y alteraciones vasculares en la rata de SS. Los cromosomas son el cromosoma 13, llevando la renina gen18,22,29,57,58y el cromosoma 5, portadores de genes para isoformas del CYP450-4A ω-hidroxilasa64 ,65, la enzima que sintetiza 20-HETE, que tiene importantes efectos en la función renal y en la reactividad vascular66,67,68. Otra adición reciente y de gran alcance a la caja de herramientas genética de rata es el desarrollo de modelos de ratón gene knockout utilizando técnicas de edición avanzadas gene incluyendo: ZFNs; nucleasas de activador-como-efector transcripcionales (TALENS) y más recientemente CRISPR Cas913,14,15,16,17. In vitro la microscopia video utilizando estas técnicas para estudiar MCAs aislados de un modelo de ratas knockout Nrf2(- / -) que carece de los antioxidantes cruciales y factor de transcripción protectora celular NRF2, ha proporcionado importantes y previamente desconocido penetración en los mecanismos de la disfunción endotelial inducida por la sal en la ausencia de una elevada sangre presión17. Resultados específicos de experimentos utilizando estos modelos de rata especializados se describen en una serie de anteriores informes17,29,57,58,59, 60 , 64 , 65 .
Si bien resulta claro que los estudios de arterias aisladas, canulado resistencia son extremadamente valiosos en la comprensión de los mecanismos de regulación de la función de estos vasos críticamente importantes en una variedad de condiciones, es muy importante tener una número de precauciones para garantizar la obtención de resultados precisos y confiables. Mientras que las arterias cerebrales y arterias de la resistencia de muchos otros camas vasculares exhiben intrínseco tono, algunas arterias (en particular las arterias mesentérica resistencia) necesitan ser previamente contratado con vasoconstrictores como la noradrenalina para evaluar las respuestas a estímulo vasodilatador y más exactamente simular en vivo condiciones, donde los vasos están bajo la influencia de estímulos neurales y humorales vasoconstrictores, como noradrenalina de terminales nerviosos adrenérgicos. Como tal, es importante estar familiarizado con las propiedades básicas de las arterias a estudiar, ya sea desde la literatura o de cuidadosamente realizado experimentos preliminares. Ya que el endotelio desempeña un papel importante en la regulación de las grandes arterias, pequeñas arterias y arteriolas en la microcirculación, es esencial tener cuidado para no dañar el endotelio durante la canulación de la arteria y del aislamiento. La prueba clásica para la integridad del endotelio es la demostración que la ACh causa dilatación de los vasos. Una salvedad es que, bajo condiciones de estrés oxidativo, el endotelio del vaso puede estar intacto, pero existe vasodilatación a ACh debido a niveles excesivos de superóxido limpian el óxido nítrico prevención de la respuesta vasodilatadora. En esos casos, la integridad endotelial puede ser verificada mediante la repetición de la aplicación de ACh en presencia de un carroñero de superóxido como tempol, que debe restablecer la vasodilatación en respuesta a la ACh y otros estímulos vasodilatador dependiente del endotelio. También, en un número de condiciones patológicas, el endotelio puede liberar sustancias que causan la contracción de las células de músculo liso vascular y estrechamiento de la arteria; y en algunos casos, la dilatación dependiente del endotelio (o constricción) está mediada por otras sustancias como metabolitos de la ciclooxigenasa, H2O2, metabolitos epoxygenase, etcetera. La prueba clásica para una sustancia vasoconstrictor o vasodilatador dependiente del endotelio es demostrar que la dilatación o constricción de la arteria es eliminado por el retiro endotelial. Finalmente, la identidad de diversas sustancias vasodilatadoras y vasoconstrictoras de dependiente del endotelio generalmente puede determinarse por la administración de inhibidores específicos o carroñeros, como el L-NAME para inhibir el óxido nítrico sintasa, la indometacina para inhibir la formación de metabolitos de la ciclooxigenasa, catalasa para compactar H2O2, inhibidores de la tromboxano sintasa, epoxygenase los inhibidores o antagonistas de la vía CYP450-4A/20-HETE.
También es importante (y aleccionador) para cuantificar la cantidad de activos de tono al final del experimento perfundiendo y superfusing la arteria con el Ca2 +-libre de PSS, o administrar una dosis máxima de un agente vasodilatador potente como papaverina. Un nivel típico de activos tono en el MCA, x 100 calculado como ((Dmax-Dresto) /DMax.), es aproximadamente el 40%, donde la Dmax y Dresto encuentran lo maximo (Ca2 +-libre PSS) y diámetro (PSS), respectivamente, en el control equilibrado de presión (generalmente 80 mmHg para MCA). Vasos con arterias demostrando constricción segmentaria o dilataciones o tono sustancialmente menos activos quedan excluidos del análisis, como estos signos son indicativos de traumatismo en los vasos. Medición de los diámetros de las arterias dilatadas máximo en Ca2 +-solución gratuita también permite al investigador evaluar las propiedades mecánicas pasivas de los vasos de diámetro arterial medición y cálculo de las relaciones tensión-deformación durante secuenciales elevaciones en la presión transmural en los vasos dilatados máximo7,56. Estas relaciones de tensión pasiva se obtienen fácilmente y proporcionan una indicación valiosa de cualquier cambio en las características mecánicas de los vasos.
Limpieza de las pipetas, conectores y tubería de suministro de los embalses es absolutamente crítico para experimentos exitosos. En este sentido, es importante lavar todas las soluciones de la tubería después de completa el experimento, y para enjuagar y limpiar el tejido baño, la tubería de entrega, todos los depósitos utilizados para almacenar, calienten y gas-equilibren el PSS antes de llegar a la nave cámara. Grifos y válvulas en el sistema de entrega también deben limpiarse y cambiar periódicamente, como cualquier tubería que PSS. Un signo clásico de tubería contaminada es una neblina gris generada por hongos y bacterias; y esos cambios se acompañan de pérdida de la reactividad normal de los vasos sanguíneos debido a sustancias producidas por la contaminación bacteriana. Sin embargo, la contaminación por bacterias y otros microorganismos todavía puede estar presente en ausencia de cualquier evidencia visible.
Creemos que el presente documento proporciona un ejemplo útil para el uso de técnicas tradicionales que se adaptan excepcionalmente bien para los estudios de las arterias de resistencia pequeña importante de camas vasculares diferentes. Cuando se combina con métodos estándar para evaluar la perfusión del tejido, como el método de lectinas de GS1 para evaluar la densidad de microvessel, LDF en vitro video microscopia de las arterias de resistencia canulado proporciona información muy valiosa sobre la factores que controlan la perfusión de tejido y cómo éstos pueden ser alterados en Estados de enfermedad. Además de proporcionar un poderoso medio para el estudio de los mecanismos fundamentales de músculo liso vascular y la función endotelial en modelos de ratón estándar, el uso de la microscopia video para estudiar las arterias de resistencia individual puede ser aplicado a otros modelos animales y a arterias de resistencia humana. La aplicación de la microscopia video de arterias de resistencia aislada de nuevos modelos de ratón modificados genéticamente abre nuevas puertas para entender cambios fenotípicos que se producen en respuesta a la alteración de la función de una multitud y lista cada vez mayor de genes.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Los autores tienen intereses financieros que compiten.
Acknowledgments
Los autores expresan su sincero agradecimiento a Katie Fink y Lynn Dondlinger por su inestimable asistencia en la preparación de este manuscrito.
Apoyo de la beca: NIH #R21-OD018309; #R56-HL065289; y #R01-HL128242.
Materials
| Name | Company | Catalog Number | Comments |
| SS Rat | Medical College of Wisconsin | SS/JHsd/Mcwi strain | Contact Dr. Aron Geurts (ageurts@mcw.edu) |
| SS.5BN Consomic Rat | Medical College of Wisconsin | SS-Chr 5BN/Mcwi strain | Contact Dr. Aron Geurts (ageurts@mcw.edu) |
| SS.13BN Consomic Rat | Medical College of Wisconsin | SS-Chr 13BN/Mcwi strain | Contact Dr. Aron Geurts (ageurts@mcw.edu) |
| Ren1-BN Congenic Rat | Medical College of Wisconsin | SS.BN-(D13hmgc41-D13)hmgc23/Mcwi strain | Contact Dr. Aron Geurts (ageurts@mcw.edu) |
| Ren1-SSA Congenic Rat | Medical College of Wisconsin | SS.BN-(D13rat77-D13rat105/Mcwi strain | Contact Dr. Aron Geurts (ageurts@mcw.edu) |
| Ren1-SSB Congenic Rat | Medical College of Wisconsin | SS.BN-(D13rat124-D13rat101/Mcwi strain | Contact Dr. Aron Geurts (ageurts@mcw.edu) |
| Nrf2(-/-) Knockout Rat and Wild Type Littermates | Medical College of Wisconsin | SD-Nfe212em1Mcwi strain | Contact Dr. Aron Geurts (ageurts@mcw.edu) |
| Low Salt Rat Chow (0.4% NaCl)-AIN-76A | Dyets, Inc. | 113755 | |
| High Salt Rat Chow (4% NaCl)-AIN-76A | Dyets, Inc. | 113756 | |
| Colorado Video Caliper | Colorado Video, Inc. | Model 308 | |
| Video Camera | Hitachi | KPM1AN | |
| Microscope | Olympus Life Science | CKX41 | |
| Television Monitor | Panasonic | WVBM1410 | |
| Pressure Transducers | Stoelting | 56360 | |
| Blood Pressure Display Unit | Stoelting | 50115 | |
| Cannulated Artery Chamber | Living Systems Instrumentation | CH-1 | Single vessel chamber for general use |
| Temperature Controller for Single Chamber | Living Systems Instrumentation | TC-09S | |
| Gas Dispersion Tube, Miniature,Straight | Living Systems Instrumentation | GD-MS | Provides aeration in the vessel bath |
| Gas Exchange Oxygenator, Miniature | Living Systems Instrumentation | OX | Allows gas exchange with perfusate |
| Laser-Doppler Flowmeter | Perimed | PeriFlux 5000 LDPM | |
| GS1 Lectin | Vector Labs | RL-1102 | |
| Glass Capillary Tubes for Micropipettes | Fredrich Haer Co. | 27-33-1 | 2 mm ODX1 mm ID |
| Verticle Pipette Puller | David Kopf Instruments | Model 700C | |
| Nylon suture material (10/0)-3 PLY | Ashaway Line and Twine Manufacturing Co. | 114-ANM-10 | Single strands of 3 ply nylon suture teased out for use on vessels |
| Dumont #5 Forceps-Inox | Fine Science Tools | 11254-20 | |
| Vannas Scissors | Fine Science Tools | 15003-08 | |
| Protandim | Protandim | NRF2 Inducer: Contact Dr. Joe McCord (JOE.MCCORD@UCDENVER.EDU) | |
| Sodium Chloride | Fisher Bioreagents | BP358-212 | |
| Sodium Bicarbonate | Fisher Chemical | S233-3 | |
| Dextrose (d-glucose) anhydrous | Fisher Chemical | D16-500 | |
| Magnesium Sulfate (MgSO4-7H2O) | Sigma Aldrich | M1880-500 G | |
| Calcium Chloride (CaCl2-2 H2O) | Sigma | C5080-500G | |
| Sodium Phosphate-Monobasic (NaH2PO4) | Sigma | S0751-500G | |
| Potassium Chloride (KCl) | Fisher Chemical | P217-500G | |
| Ethylenediaminetetraacetic acid disodium salt dihydrate (EDTA) | Sigma | ED255-500G |
References
- Furchgott, R. F., Zawadzki, J. V. The obligatory role of endothelial cells in the relaxation of arterial smooth muscle by acetylcholine. Nature. 288, 373-376 (1980).
- Bevan, J. A., Osher, J. V. A direct method for recording tension changes in the wall of small blood vessels in vitro. Agents Actions. 2, 257-260 (1972).
- Mulvany, M. J., Halpern, W. Contractile properties of small arterial resistance vessels in spontaneously hypertensive and normotensive rats. Circ. Res. 41, 19-26 (1977).
- Speden, R. N. The use of excised, pressurized blood vessels to study the physiology of vascular smooth muscle. Experientia. 41, 1026-1028 (1985).
- Osol, G., Halpern, W. Myogenic properties of cerebral blood vessels from normotensive and hypertensive rats. Am. J. Physiol. 249, H914-H921 (1985).
- Halpern, W., Kelley, M. In vitro methodology for resistance arteries. Blood Vessels. 28, 245-251 (1991).
- Feihl, F., Liaudet, L., Waeber, B. The macrocirculation and microcirculation of hypertension. Curr Hypertens Rep. 11, 182-189 (2009).
- Smits, G. J., Roman, R. J., Lombard, J. H. Evaluation of laser-Doppler flowmetry as a measure of tissue blood flow. J Appl Physiol. 61, 666-672 (1985).
- Hudetz, A. G., Roman, R. J., Harder, D. R. Spontaneous flow oscillations in the cerebral cortex during acute changes in mean arterial pressure. J Cereb Blood Flow Metab. 12, 491-499 (1992).
- Hudetz, A. G., Smith, J. J., Lee, J. G., Bosnjak, Z. J., Kampine, J. P. Modification of cerebral laser-Doppler flow oscillations by halothane, PCO2, and nitric oxide synthase blockade. Am J Physiol. 269, H114-H120 (1995).
- Hansen-Smith, F. M., Watson, L., Lu, D. Y., Goldstein, I. Griffonia simplicifolia I: fluorescent tracer for microcirculatory vessels in nonperfused thin muscles and sectioned muscle. Microvasc Res. 36, 199-215 (1988).
- Greene, A. S., Lombard, J. H., Cowley, A. W., Hansen-Smith, F. M. Microvessel changes in hypertension measured by Griffonia simplicifolia I lectin. Hypertension. 15, 779-783 (1990).
- Aitman, T., Dhillon, P., Geurts, A. M. A RATional choice for translational research? Dis Model Mech. 9, 1069-1072 (2016).
- Geurts, A. M., et al. Knockout rats via embryo microinjection of zinc-finger nucleases. Science. 325, 433 (2009).
- Geurts, A. M., et al. Generation of gene-specific mutated rats using zinc-finger nucleases. Methods Mol Biol. 597, 211-225 (2010).
- Geurts, A. M., Moreno, C. Zinc-finger nucleases: new strategies to target the rat genome. Clin Sci (Lond). 119, 303-311 (2010).
- Priestley, J. R., Kautenburg, K. E., Casati, M. C., Endres, B. T., Geurts, A. M., Lombard, J. H. The NRF2 knockout rat: a new animal model to study endothelial dysfunction, oxidant stress, and microvascular rarefaction. Am J Physiol Heart Circ Physiol. 310, H478-H487 (2016).
- Cowley, A. W., et al. Brown Norway chromosome 13 confers protection from high salt to consomic Dahl S rat. Hypertension. 37, 456-461 (2001).
- Rapp, J. P. Dahl salt-susceptible and salt-resistant rats. A review. Hypertension. 4, 753-763 (1982).
- Rapp, J. P., Wang, S. M., Dene, H. A genetic polymorphism in the renin gene of Dahl rats cosegregates with blood pressure. Science. 243, 542-544 (1989).
- Manning, R. D. Jr, Meng, S., Tian, N. Renal and vascular oxidative stress and salt-sensitivity of arterial pressure. Acta Physiol Scand. 179, 243-250 (2003).
- Moreno, C., et al. Multiple blood pressure loci on rat chromosome 13 attenuate development of hypertension in the Dahl S hypertensive rat. Physiol Genomics. 31, 228-235 (2007).
- Tobian, L., Lange, J., Iwai, J., Hiller, K., Johnson, M. A., Goossens, P. Prevention with thiazide of NaCl-induced hypertension in Dahl "S" rats. Evidence for a Na-retaining humoral agent in "S" rats. Hypertension. 1, 316-323 (1979).
- Mattson, D. L., et al. Chromosome substitution reveals the genetic basis of Dahl salt-sensitive hypertension and renal disease. Am J Physiol Renal Physiol. 295, F837-F842 (2008).
- Kunert, M. P., et al. Consomic strategies to localize genomic regions related to vascular reactivity in the Dahl salt-sensitive rat. Physiol Genomics. 26, 218-225 (2006).
- Cowley, A. W., Liang, M., Roman, R. J., Greene, A. S., Jacob, H. J. Consomic rat model systems for physiological genomics. Acta Physiol Scand. 181, 585-592 (2004).
- Kunert, M. P., Dwinell, M. R., Lombard, J. H. Vascular responses in aortic rings of a consomic rat panel derived from the Fawn Hooded Hypertensive strain. Physiol Genomics. 42A, 244-258 (2010).
- Liang, M., et al. Renal medullary genes in salt-sensitive hypertension: a chromosomal substitution and cDNA microarray study. Physiol Genomics. 8, 139-149 (2002).
- Durand, M. J., Moreno, C., Greene, A. S., Lombard, J. H. Impaired relaxation of cerebral arteries in the absence of elevated salt intake in normotensive congenic rats carrying the Dahl salt-sensitive renin gene. Am J Physiol Heart Circ Physiol. 299, H1865-H1874 (2010).
- Hybertson, B. M., Gao, B., Bose, S. K., McCord, J. M. Oxidative stress in health and disease: the therapeutic potential of Nrf2 activation. Mol Aspects Med. 32, 234-246 (2011).
- Itoh, K., et al. An Nrf2/small Maf heterodimer mediates the induction of phase II detoxifying enzyme genes through antioxidant response elements. Biochem Biophys Res Commun. 236, 313-322 (1997).
- Myung, S. K., et al. Efficacy of vitamin and antioxidant supplements in prevention of cardiovascular disease: systematic review and meta-analysis of randomised controlled trials. BMJ. 346, f10 (2013).
- Fredricks, K. T., Liu, Y., Lombard, J. H. Response of extraparenchymal resistance arteries of rat skeletal muscle to reduced PO2. Am J Physiol. 267, H706-H715 (1994).
- Fredricks, K. T., Liu, Y., Rusch, N. J., Lombard, J. H. Role of endothelium and arterial K+ channels in mediating hypoxic dilation of middle cerebral arteries. Am J Physiol. 267, H580-H586 (1994).
- Frisbee, J. C., Maier, K. G., Falck, J. R., Roman, R. J., Lombard, J. H. Integration of hypoxic dilation signaling pathways for skeletal muscle resistance arteries. Am J Physiol Regul Integr Comp Physiol. 283, R309-R319 (2002).
- Pavlov, T. S., Ilatovskaya, D. V., Palygin, O., Levchenko, V., Pochynyuk, O., Staruschenko, A. Implementing Patch Clamp and Live Fluorescence Microscopy to Monitor Functional Properties of Freshly Isolated PKD Epithelium. J Vis Exp. (103), (2015).
- Nelson, M. T., Conway, M. A., Knot, H. J., Brayden, J. E. Chloride channel blockers inhibit myogenic tone in rat cerebral arteries. J Physiol. 502 (Pt 2), 259-264 (1997).
- Brayden, J. E., Halpern, W., Brann, L. R. Biochemical and mechanical properties of resistance arteries from normotensive and hypertensive rats. Hypertension. 5, 17-25 (1983).
- Weber, D. S., Lombard, J. H. Elevated salt intake impairs dilation of rat skeletal muscle resistance arteries via ANG II suppression. Am J Physiol Heart Circ Physiol. 278, H500-H506 (2000).
- Weber, D. S., Lombard, J. H. Angiotensin II AT1 receptors preserve vasodilator reactivity in skeletal muscle resistance arteries. Am J Physiol Heart Circ Physiol. 280, H2196-H2202 (2001).
- Wang, J., Roman, R. J., Falck, J. R., de la Cruz, L., Lombard, J. H. Effects of high-salt diet on CYP450-4A omega-hydroxylase expression and active tone in mesenteric resistance arteries. Am J Physiol Heart Circ Physiol. 288, H1557-H1565 (2005).
- Raffai, G., et al. Modulation by cytochrome P450-4A omega-hydroxylase enzymes of adrenergic vasoconstriction and response to reduced PO2 in mesenteric resistance arteries of Dahl salt-sensitive rats. Microcirculation. 17, 525-535 (2010).
- Mishra, R. C., Wulff, H., Hill, M. A., Braun, A. P. Inhibition of Myogenic Tone in Rat Cremaster and Cerebral Arteries by SKA-31, an Activator of Endothelial KCa2.3 and KCa3.1 Channels. J Cardiovasc Pharmacol. 66, 118-127 (2015).
- Freed, J. K., Beyer, A. M., LoGiudice, J. A., Hockenberry, J. C., Gutterman, D. D. Ceramide changes the mediator of flow-induced vasodilation from nitric oxide to hydrogen peroxide in the human microcirculation. Circ Res. 115, 525-532 (2014).
- Beyer, A. M., Durand, M. J., Hockenberry, J., Gamblin, T. C., Phillips, S. A., Gutterman, D. D. An acute rise in intraluminal pressure shifts the mediator of flow-mediated dilation from nitric oxide to hydrogen peroxide in human arterioles. Am J Physiol Heart Circ Physiol. 307, H1587-H1593 (2014).
- Durand, M. J., et al. Vascular actions of angiotensin 1-7 in the human microcirculation: novel role for telomerase. Arterioscler Thromb Vasc Biol. 36, 1254-1262 (2016).
- Beyer, A. M., et al. Transition in the mechanism of flow-mediated dilation with aging and development of coronary artery disease. Basic Res Cardiol. 112, 5 (2017).
- Muller, J. M., Chilian, W. M., Davis, M. J. Integrin signaling transduces shear stress--dependent vasodilation of coronary arterioles. Circ Res. 80, 320-326 (1997).
- Liu, Y., Harder, D. R., Lombard, J. H. Interaction of myogenic mechanisms and hypoxic dilation in rat middle cerebral arteries. Am J Physiol Heart Circ Physiol. 283, H2276-H2281 (2002).
- Potocnik, S. J., et al. Endothelium-dependent vasodilation in myogenically active mouse skeletal muscle arterioles: role of EDH and K+ channels. Microcirculation. 16, 377-390 (2009).
- Harder, D. R. Pressure-dependent membrane depolarization in cat middle cerebral artery. Circ Res. 55, 197-202 (1984).
- Greene, A. S., Rieder, M. J. Measurement of vascular density. Methods Mol. Med. 51, 489-496 (2001).
- Hernandez, I., Cowley, A. W., Lombard, J. H., Greene, A. S. Salt intake and angiotensin II alter microvessel density in the cremaster muscle of normal rats. Am J Physiol. 263, H664-H667 (1992).
- Resende, M. M., Amaral, S. L., Moreno, C., Greene, A. S. Congenic strains reveal the effect of the renin gene on skeletal muscle angiogenesis induced by electrical stimulation. Physiol Genomics. 33, 33-40 (2008).
- Petersen, M. C., Munzenmaier, D. H., Greene, A. S. Angiotensin II infusion restores stimulated angiogenesis in the skeletal muscle of rats on a high-salt diet. Am J Physiol Heart Circ Physiol. 291, H114-H120 (2006).
- Frisbee, J. C., Weber, D. S., Liu, Y., DeBruin, J. A., Lombard, J. H. Altered structure and mechanics of skeletal muscle arteries with high-salt diet and reduced renal mass hypertension. Microvasc Res. 59, 323-328 (2000).
- Drenjancevic-Peric, I., Lombard, J. H. Introgression of chromosome 13 in Dahl salt-sensitive genetic background restores cerebral vascular relaxation. Am J Physiol Heart Circ Physiol. 287, H957-H962 (2004).
- Drenjancevic-Peric, I., Phillips, S. A., Falck, J. R., Lombard, J. H. Restoration of normal vascular relaxation mechanisms in cerebral arteries by chromosomal substitution in consomic SS.13BN rats. Am J Physiol Heart Circ Physiol. 289, H188-H195 (2005).
- Lukaszewicz, K. M., Paudyal, M. P., Falck, J. R., Lombard, J. H. Role of vascular reactive oxygen species in regulating cytochrome P450-4A enzyme expression in Dahl salt-sensitive rats. Microcirculation. 23, 540-548 (2016).
- Lombard, J. H., Sylvester, F. A., Phillips, S. A., Frisbee, J. C. High-salt diet impairs vascular relaxation mechanisms in rat middle cerebral arteries. Am J Physiol Heart Circ Physiol. 284, H1124-H1133 (2003).
- Priestley, J. R., et al. Reduced angiotensin II levels cause generalized vascular dysfunction via oxidant stress in hamster cheek pouch arterioles. Microvasc Res. 89, 134-145 (2013).
- Velmurugan, K., Alam, J., McCord, J. M., Pugazhenthi, S. Synergistic induction of heme oxygenase-1 by the components of the antioxidant supplement Protandim. Free Radic Biol Med. 46, 430-440 (2009).
- Widlansky, M. E., Gokce, N., Keaney, J. F., Vita, J. A. The clinical implications of endothelial dysfunction. J Am Coll Cardiol. 42, 1149-1160 (2003).
- Lukaszewicz, K. M., Falck, J. R., Manthati, V. L., Lombard, J. H. Introgression of Brown Norway CYP4A genes on to the Dahl salt-sensitive background restores vascular function in SS-5BN consomic rats. Clin Sci (Lond). 124, 333-342 (2013).
- Lukaszewicz, K. M., Lombard, J. H. Role of the CYP4A/20-HETE pathway in vascular dysfunction of the Dahl salt-sensitive rat. Clin Sci (Lond). 124, 695-700 (2013).
- Roman, R. J. P-450 metabolites of arachidonic acid in the control of cardiovascular function. Physiol Rev. 82, 131-185 (2002).
- Roman, R. J., Maier, K. G., Sun, C. W., Harder, D. R., Alonso-Galicia, M. Renal and cardiovascular actions of 20-hydroxyeicosatetraenoic acid and epoxyeicosatrienoic acids. Clin Exp Pharmacol. 27, 855-865 (2000).
- Roman, R. J., Alonso-Galicia, M. P-450 eicosanoids: A novel signaling pathway regulating renal function. News Physiol Sci. 14, 238-242 (1999).



