Summary
这篇手稿描述了体外大鼠脑阻力动脉血管功能的视频显微术。该手稿还描述了用激光多普勒血荧光标记凝集素和组织灌注评价微血管密度的技术。
Abstract
该协议描述了使用在体外电视显微镜来评估孤立的脑阻力动脉 (和其他血管) 的血管功能, 并描述了使用激光多普勒血组织灌注的评价技术 () 和微血管密度利用荧光标记的加纳单叶(GS1) 凝集素。目前的方法研究孤立阻力动脉在壁压力遇到在体内和在缺乏实质细胞的影响提供了一个关键的联系之间的体内研究和信息获得的分子简化的方法, 提供有限的洞察力的整体反应在整个动物的水平。荧光标记的 GS1 凝集素有选择地识别动脉和毛细血管的方法, 提供了切实可行的解决方案, 使调查人员能够扩大从孤立阻力动脉的研究中获得的知识。本文介绍了这些技术在大鼠血管生理学和病理学基础知识中的应用, 作为一个一般的实验模型, 并在各种专门的基因工程 "设计" 大鼠菌株, 可以提供重要的洞察力特定基因对重要血管表型的影响。利用这些有价值的实验方法, 在大鼠的选育策略和新技术的培育下, 建立基因敲除模型, 将扩大在挖空小鼠模型中开发的科学前提的严谨性, 并将这一知识扩展到一个更相关的动物模型中, 因为它的尺寸较大, 具有很好的生理背景和生理研究的适用性。
Introduction
动脉血管功能的最早研究利用导管动脉, 在许多情况下是主动脉。通过将动脉环段附着在组织浴中的力传感器上, 对大动脉的力产生进行了研究;在主动脉的情况下, 通过切割血管的螺旋条, 使平滑肌纤维在附着点和力传感器之间的纵向方向上定向, 以提供由收缩产生的力的最佳估计沿其纵轴的平滑肌肉。切割脉螺旋条的标准技术是在容器的流明处放置一根玻璃棒, 在容器壁上以所需的角度进行切割, 并在容器壁的外露边缘的一端保持, 因为切口被延伸以产生整个螺旋带的船只。在这一点上, 血管的内皮侧通常被涂抹, 以去除碎片之前, 连接到力传感器的船只带和淹没准备在一个氧和温度控制组织浴。最终, 这种方法导致了在生理学史上最著名和最重要的发现之一, Furchgott 和 Zawadski1, 即内皮衍生舒张因子 (EDRF) 的作用, 后来被确定为一氧化氮, 在调节血管功能。导致这一发现的关键事件是, 在这种情况下, 研究者通过避免动脉与外表面的内皮侧接触来维持完整的内皮, 并注意到主动脉带没有表现出预期收缩到乙酰胆碱, 但在反应中松弛。根据这一观察, 调查人员研制了一种 "三明治" 制剂, 在其中将主动脉段与一个完整的内皮细胞 (但不能产生收缩力) 连接到主动脉的标准螺旋带, 并转化为收缩成一个放松。
今天广泛使用的两个主要进展是在小阻力动脉中测量主动收缩力的准备工作的发展2,3 (如肠道肠系膜上的那些)3) 和空心阻力动脉准备4,5,6。在最早的一份报告中, Mulvany 和 Halpern3描述了使用金属丝 myograph 的制备方法, 研究自发性高血压大鼠 (SHR) 肠肠系膜上孤立阻力动脉的主动收缩力, 并正常 WKY 控制。在导线 myograph 系统的发展之后, 空心抵抗动脉准备被开发了允许研究更接近在体内情况4,5,6。 虽然这两种方法都提供了有价值的结果, 但空心动脉的制备具有更有效地保持动脉内固有活动张力的优点;并允许研究人员对壁压力和血管反应对流速和内皮剪切力变化的影响进行活性的肌源反应 (参见 Halpern 和凯利6的回顾)。
本论文的主要目的是描述如何使用孤立的, 空心阻力动脉的视频显微术的时间, 以获得准确的信息, 有关的机制, 调节主动语气在这些关键血管, 独立于神经、体液或实质细胞的影响。这一基本信息, 使用一个标准的大鼠模型和我们的研究新的基因工程大鼠菌株的例子, 将提供给读者一个关于血管功能的见解类型的想法, 可以获得与电视显微镜方法, 可用于研究涉及任何控制和实验组的研究者的选择, 包括强大的新的实验大鼠模型的选择性近亲繁殖和新发展的遗传工程技术。
由于电视显微镜方法的精确度, 测量空心动脉的直径变化可为血管内皮依赖性和内皮独立机制提供极有价值的信息。放松, 以及在高血压、高盐饮食和其他实验干预的血管控制机制中发生的重要 (有时是意想不到的) 改变。此外, 测量的压力-直径关系的孤立和空心阻力的动脉, 最大限度地放宽了治疗的 Ca2 +免费的解决方案或药理血管扩张药物, 使调查员评估血管重塑和计算被动应力-应变关系的动脉结构变化7可以提供重要的洞察力改变动脉的被动机械特性, 从而影响动脉功能独立于 (或除了) 主动控制机制的变化。还必须指出的是, 从隔离的阻力动脉的研究中获得的信息可以补充利用获得的信息, 这是一种评估整个动物级别组织灌注的实用方法8,9 ,10, 以及通过使用荧光标记的 GS1 凝集素来评估微血管密度所获得的信息, 这特别结合了小动脉和毛细血管基底膜的糖蛋白基11,12. 后一种方法提供了一个高度准确的微血管密度的估计, 不受传统的困难, 在估计微血管密度通过计数血管的在体内, 例如失踪非灌注由于动脉主动闭合而导致血流停止的血管。如果一起使用, 这些方法可以提供重要的洞察力相关的功能改变的孤立阻力动脉的变化, 组织灌注在微循环水平;在本手稿中还将提供一些使用这些有价值的方法与空心动脉技术结合的例子。
本文主要研究利用视频显微镜技术对 outbred 大大鼠动脉血管的变化进行评价。然而, 重要的是要注意, 这些技术已证明是非常宝贵的, 以阐明表型变化的高度专业化的基因工程大鼠选育或基因编辑使用的技术。在这篇手稿中, 我们提供的例子, 视频显微技术如何提供了重要信息的血管功能, 在许多有价值的大鼠模型, 包括达尔盐敏感 (SS) 大鼠-一个近交系大鼠菌株, 是最广泛的用实验模型研究了盐敏 hypertenson 的机理18、19、20、21、22、23;和 consomic 大鼠通过选择性选育 SS 大鼠与盐不敏感的棕色挪威 (BN) 大鼠品系。在 consomic 鼠板中, 来自棕挪威鼠的每一个染色体都被单独渗入到达尔 SS24,25,26遗传背景。使用 consomic 鼠板提供了宝贵的线索, 关于特定的染色体, 有助于盐敏感性血压和其他表型, 包括血管反应性24,25,26 ,27,28。
利用 ss 大鼠和携带个别 BN 染色体的 consomic 大鼠的选择性育种策略, 也使同类菌株的小片段渗入到达尔 ss 遗传背景22,29。这些可以提供非常有价值的输入对特定的基因或染色体的狭窄区域, 可以影响关键的生理变量, 如血压, 肾脏损害, 和血管活性22,29。大鼠基因工具箱的另一个强大的补充是利用先进的基因编辑技术, 包括 ZFNs, 转录激活剂类似效应核酸 (TALENS), 最近 CRISPR-Cas913 ,14,15,16,17。这些强大的技术的问世, 使基因被淘汰的老鼠是一个非常重要的发展, 因为基因剔除研究迄今已使用 (并继续使用) 小鼠几乎完全。本论文的另一项实验研究表明, 空心动脉技术和视频显微术对无主抗氧化剂和细胞保护转录的击倒大鼠的生理控制机制有价值因子, 核因子 (红-衍生 2) 样-2 (NRF2)30,31, 这是利用塔伦技术在大遗传背景17中开发的。在这些实验中,体外视频显微镜技术用于提供 NRF2 基因丢失的功能验证, 并在 NRF2-mediated 抗氧化剂直接上调的基础上测试一种潜在的有价值的治疗方法。防御.NRF-2 在对抗血管氧化应激方面具有重要的治疗作用, 因为临床试验的结果令人失望, 例如维生素 C 和 E32直接管理抗氧化剂。
Subscription Required. Please recommend JoVE to your librarian.
Protocol
威斯康星医学院动物护理和使用委员会 (IACUC) 批准了本文所述的所有协议, 所有程序都符合国家卫生研究院 (NIH) 实验室动物福利办公室 (OLAW)条例.
1. 溶液和容器室的制备
- 在进行一系列实验之前, 准备 2 l 20x 浓盐溶液, 由278克/L 氯化钠组成;14克/升氯化钾;11.52 克/升 MgSO4.7H2O;和9.4 克/L CaCl2.2H2O。还准备2升的20x 集中缓冲库存, 由80.8 克/升 NaHCO3和0.4 克/l EDTA 组成, 2 l 的20x 集中的 Ca2 +的股票解决方案由281.6 克/l 氯化钠组成;14克/升氯化钾, 11.52 克/升 MgSO4.7H2O。
注: 20X 库存解决方案可存储在冰箱中, 直到使用。 - 在实验的当天, 从20x 集中库存溶液中制备 2 l 的生理盐溶液 (PSS), 如下所示: 将100毫升的20x 盐库存添加到1800毫升的去离子水中, 在一个2升锥形烧瓶或一个机动搅拌盘上的烧杯中。添加100毫升的20x 缓冲库存, 同时不断均衡的解决方案与气体混合物包含 21% O2, 5% CO2, 平衡 N2, 并搅拌它与磁性搅拌棒。在监测 pH 值时, 慢慢地添加 0.28 g NaH2PO4 ;根据需要对 pH 值7.4 进行调整, 从巴斯德吸管中加入6氮 HCl 或 6.5 n 氢氧化钠溶液。在 pss 准备好并调整 pH 值后, 将1.98 克葡萄糖添加到 pss 中。
注意: 在监测 PSS ph 值时, 必须缓慢添加 NaH2po4 , 因为在碱性溶液 (ph > 7.4) 中加入 NaH2po4可以形成磷酸钙沉淀, 如在容器底部有一个混浊的溶液或白色沉淀的外观。
注: PSS 的最终组成为119毫米/升氯化钠;4.7 毫米/升氯化钾;1.17 毫米/升 Mg2, 因此4;1.6 mM/升 CaCl2;1.18 mM/升 NaH2PO4;24 mM/升 NaHCO3;0.03 毫米/升 EDTA;和5.5 毫米/升葡萄糖。虽然 PSS 的组成可以在实验室之间有所不同, 但这一食谱非常适合于维持血管张力, 内皮功能, 和对血管活性物质的反应, 在孤立的阻力动脉。 - 为了确定最大的直径, 并通过产生最大的血管扩张来评估动脉内的活动音调, 通过将 20X ca 的25毫升2 +的盐量添加到450毫升的去离子水中, 准备500毫升的 ca2 +释放 PSS。, 后跟25毫升的20x 缓冲储存在一个锥形烧瓶或烧杯类似于步骤1.2 以上。在监控和调整解决方案的 pH 值时, 将0.07 克 NaH2PO4添加到解决方案中。在实验结束时, 将 ca2个无的 pss 添加到 pss 库和容器室, 以避免耗尽在正常 pss 中可能影响容器响应的胞内 ca2 +存储。由于在实验结束时添加了 Ca2 +-免费解决方案, 以产生最大程度的动脉松弛, 因此不需要向 PSS 添加葡萄糖。
注: 当完成后, Ca2 +的最终组成为120.6 毫米/升氯化钠;4.7 毫米/升氯化钾;1.17 毫米/升 Mg2, 因此4;1.18 mM/升 NaH2PO4;24 mM/升 NaHCO3;0 mM/升 CaCl2;和0.03 毫米/升 EDTA。
注: 对于许多需要最大动脉扩张的研究, 除了从 PSS 中移除 Ca2 +之外, 还可以在解决方案中添加一个钙进入阻滞剂, 如维拉帕米 (1 µM) 和/或一氧化氮供体 (如硝普钠 (10 µM))。 - 保持 PO2、不正常情况下的2和 pss 的 pH 值, 持续均衡在标准的器官浴中流入血管室的 pss, 用于研究孤立的主动脉环、肠道平滑肌或其他组织 (图 1)。使用合成氟聚合物的四氟乙烯油管连接气罐到器官浴, 因为这种类型的油管是气体不透水, 与许多其他形式的油管,例如, 乳胶。
- 在容器室中放置一个连接到平衡气体混合物的小型空气石, 以帮助维持 PSS 气体成分。
注: 船只对 PO2变化的反应可以通过均衡容器室中的 PSS 和腔液的气体混合物进行测试, 其中含有不同百分比的 O2,例如, 21% o2, 10% o2, 5% o2, 和 0% O2, 具有 5% CO2和平衡 N233,34,35。对于较厚的动脉, 如果将氧气扩散到血管壁的中心可能是一个限制, 更高的氧气百分比,例如, 95% O2可以使用。 - 密切监视容器内的温度, 因为单个腔室的传热特性可能会有所不同。
注: 用于研究空心阻力动脉的许多商用导管室利用蠕动泵从气平衡油藏输送含氧 PSS, 并提供非常精确的浴温和氧的控制PSS。 - 将 pss 放在一个大 (2 升) 马里奥特瓶中, 用塞子和中央玻璃管作为蓄水池, 将 pss 源源不断地送到加热和气体均衡的机构浴中, 使 pss 流入容器室 (图 1A)。
- 将中央玻璃管的开口放在马里奥特瓶中, 与 pss 在风琴浴中的顶部一样, 保持恒定的静水压头, 以便将 pss 送到器官浴中。使用连接到 J 型玻璃或塑料管的聚乙烯导管将 PSS 从马里奥特瓶中送到器官浴中。
- 对于腔灌注 (图 1A), 使用聚乙烯导管将流入的吸管连接到一个由60毫升塑料注射器组成的 PSS 油藏, 它的位置可维持所需的流入压力 (通常为研究大鼠大脑的80柱。动脉), 测量用一个压力传感器连接到系统通过一个塞。
- 将流出的吸管连接到聚乙烯管, 使 PSS 能够通过容器来响应压力梯度, 并将流出线连接到类似流入水库的水库。使用类似的塞和压力传感器连接来测量流出压力。
注: 下面2节描述了设置壁压力和通过容器控制流量的程序。 - 在实验结束时, 用蒸馏水彻底冲洗房间、输送管线和储水池系统。在频繁的时间间隔内, 更换油管和输送线, 清洁或更换系统中的三通, 并周期性地将任何玻璃 PSS 储油层置于酸洗中, 以防止细菌和其他引起污染的微生物生长,影响船只的反应性。
2. 空心动脉的制备
- 麻醉一大5% 异氟醚的大鼠, 用 1.5-2.5% 的医用级氧36维持麻醉。另外, 管理肌肉注射氯胺酮 (75.0 毫克/千克), 乙酰 (2.5 毫克/千克), 和嗪 (10.0 毫克/千克);腹腔注射戊巴比妥 (50-60 毫克/千克);或任何其他认可的麻醉方法, 取决于协议和/或调查者的喜好。
- 斩首深麻醉下的大鼠, 取出脑血管进行脑阻力研究。
- 在切除大脑后, 仔细地隔离中动脉 (MCA) (或其他感兴趣的动脉,如, 基底动脉或后脑动脉)37,38。为了隔离 MCAs, 将大脑仰卧在一个充满冰冷 PSS 的玻璃培养皿中 (图 2)。
- 使用 Vannas 剪刀和一个 #5 精尖钳, 从大脑中切除 MCA。 使用镊子从 MCA 中清除任何残留的脑组织, 并将动脉转移到装有 PSS 的温度控制容器室, 如前所述。33,34 .
- 将动脉转移到血管室, 用 ACA 或后向交流动脉段轻轻握住切除血管, 并小心地将其放入会议厅。
注: 除 MCA 外, 中空血管系统适用于各种小血管的制备, 包括骨骼肌阻力动脉33、39、40、肠系膜阻力动脉38,41,42, 和大 (一阶) 的睾肌的动脉43, 以及人冠状动脉和人动脉从皮下脂肪组织的臀部活检中获得44,45, 46,47。 - 将动脉连接到流入的微, 把它拉向吸管底座, 直到尖端进入 MCA 的流明。在流入的吸管上固定动脉, 通过结扎从10-0 条缝合线 (图 1B) 的单链纤维制成的环。通过在容器周围拧紧第二个缝合环 (图 1B), 将 MCA 的另一端固定到流出吸管上。
注: 将缝合环放在 micropipettes 上, 然后将其放置在靠近最后的附着点处, 使它们容易滑过动脉, 并在血管就位时迅速获得保护, 从而使动脉滑出管。
注: Micropipettes 是由硼硅酸盐玻璃毛细管 (2 毫米外径; 1 毫米内径; 10 厘米长) 用立式微拉拔器制成。在连接动脉之前, 尽量匹配 micropipettes 的尖端直径, 以防止灌注系统中流入和流出阻力的不匹配。 - 在动脉被安全地绑在 micropipettes 上后, 使用与流入吸管支架相连的千分尺将动脉伸展至其原位长度。
- 从10-0 条缝合线上的单绞线系住所有的侧支, 以便在动脉中保持恒定的压力。
- 通过确保在临时关闭流入吸管后的腔内 (壁) 压力保持恒定, 验证是否存在泄漏。如果压力下降, 在船上系上任何树枝或检查洞。恢复灌注后, 验证壁压力保持恒定。
注: 隔离阻力动脉插管需要人工灵巧和练习。要注意的主要预防措施是避免破坏管, 并确保动脉不会滑出管。在整个手术过程中, 对孤立的动脉进行轻柔的处理是很重要的, 因为血管的创伤会损害血管平滑肌的内皮和/或干扰正常功能。 - 使用视频显微镜设置 (图 1A) 测量动脉内径, 它由连接在解剖显微镜上的摄像机组成, 并连接到视频千分尺和电视显示器 (数字 1B, 1C)。这样, 观察者就可以通过在动脉的内壁上放置可移动的参考线, 以及如果需要, 在动脉的外壁上, 测量船只的直径, 以便测量容器壁厚。
注: 一些视频千分尺提供船舶尺寸的自动跟踪。
注: 在实验之间用显微镜级千分尺和流入流出压力传感器 (0 柱、50柱、100柱、150柱和200柱) 校准视频千分尺, 以确保准确测量容器直径和腔内压力。
注: 大鼠 MCA 实验的标准控制壁压力为80柱。较高和较低压力水平的校准确保了研究壁压力和最大扩张动脉内被动压力-直径曲线的肌源反应的准确性。 - 调整流入和流出油藏的高度, 以保持所需的壁压力恒定水平。以少量 (< 5 柱) 来提高流入水库的数量, 并以同样的量来降低流出油藏, 维持平均壁压力, 并在容器流明6中产生灌注流。
注: 提高流入油藏和降低流出库的等量量, 保持了动脉内相同的平均壁扩张压力, 但产生了静水压力梯度, 导致血管内的流动和剪应力, 使研究人员对不同实验组的腔内剪应力变化的内皮依赖性反应进行评估48。 - 为了评估肌源性反应和血管舒张刺激的反应, 确保动脉在实验前表现出适当的活动音水平 (大约 40%)。丢弃任何缺乏活动音的动脉, 除了血管,例如, 小肠系膜动脉通常不表现出活跃的休息音。
注: 对于通常不具有自发色调的血管, 使用收缩激动剂, 如去甲肾上腺素或肾上腺素, 预先收缩动脉的当量。选择用于预收缩动脉的激动剂剂量的一个好方法是利用 EC50剂量的收缩剂,如, 去甲肾上腺素41,42。然而, 在静止状态下, 药物收缩剂不应用于表现自发活动音的动脉。 - 通过测量血管直径在增加乙酰胆碱浓度 (10-10 M–10-5 M) 到容器室的过程中, 测试空心阻力动脉的内皮依赖性反应。在增加浓度 (10-10 M–10-5 M) 的情况下测量血管平滑肌的内皮独立一氧化氮敏感性容器室。
注意: 对收缩剂和其他血管扩张性激动药的敏感性可以通过在容器腔中加入增加的浓度来测试类似的方式。
注: 除血管活性物质外, 各种药物、抑制剂和其他药理制剂均可添加到组织浴和/或腔液。PO2 (以及腔的2和 pH 值) 的变化可以通过腔液的分离平衡和与标定的气体混合物的空气石进行选择性地对动脉的内皮侧或额外的外侧进行选择管理。不同于在组织浴中用于平衡 PSS 的混合物33,34,49。通过关闭流出管并提高 (或降低) 连接到流入吸管的 PSS 油藏的高度 (49,50,51 , 可以研究对壁压力变化的肌反应。增加或减少腔内压力。 - 为了测试内皮在调节血管对特定刺激的反应中的作用, 去除血管内皮, 并在内皮存在或缺失的情况下比较血管的反应。为了去除血管内皮, 小心地从流出的吸管中松开动脉, 用空气丸 (0.5-1.0 毫升) 慢慢灌注动脉腔。经空气灌流后, 恢复 PSS 灌注, 清除细胞碎片, 然后再将容器重新绑到流出液管43。
注意: 在内皮剥脱术后, 重要的是要通过检测血管反应 (通常为乙酰胆碱) 来验证内皮细胞, 以产生血管内皮依赖性血管舒张。然而, 在某些病理条件下, 内皮依赖性收缩被释放, 在这种情况下, 它是重要的, 以验证在血管内皮切除后的大蟒反应消除。 - 在实验结束时, 通过在液和 superfusate 上添加 Ca2 +无 PSS, 确定动脉的最大直径。计算活动休眠音 (%) 为 (d最大-drest)/d最大) x 100, 其中 dmax是存在于 Ca2 +无解决方案中的最大直径, drest是静止控制直径。
注: 不同实验组的最大松弛动脉直径测量在比较活动休眠音、结构重塑 (即、壁厚和流明直径的变化) 和被动机械性能方面有价值(应力-应变关系计算从被动直径在不同水平的壁压力)。
3. 对脑血流反应的评价
- 用5% 异氟醚麻醉动物, 在立体定向仪中保护鼠,9,10。
- 在监测呼吸频率, 结束潮汐 CO2, 麻醉深度和脚趾掐36的情况下, 保持动物在恒定的麻醉状态。
- 小心薄颅骨半透明使用低速牙科钻和矿物油提供光耦合10。注意避免产生过多的热量, 避免穿透骨头。
注意: 颅骨变薄允许激光照射到底层组织, 并反射回探针以测量多普勒位移, 其大小由移动粒子 (即, 红细胞) 的数量决定。他们的速度。 - 在微的地方保护自卫探针, 并将其直接放置在头骨的稀疏区域。在实验中, 这是非常重要的, 以防止运动的自卫的探针或准备本身, 因为防御系统的设计, 以测量流量在一个限制区域的组织和对运动文物非常敏感。
注意: 探针的任何移动从它的最初的位置将提供估计血液流动在组织的不同的区域, 排除比较。虽然非没有提供绝对的流量值, 也不适合在实验对象之间进行比较, 但它是一个很好的方法来评估组织灌注的变化, 以响应个别学科的试验性干预;从控制值可以平均和相对变化的自卫队信号从控制在其他实验组的变化。
注意: 在不同实验组的整个血管床层的血流量的调节因素中, "自卫队" 是一个方便的方法8,9,10。组织灌注的评价提供了一个切实可行的方法, 吸收从孤立的船只研究的知识, 以整个床的角度。除非在阻力动脉和微循环之间的血管控制机制上存在区域差异, 否则, 用自卫法获得的测量结果可以很好地表明组织的血流量控制, 这通常与获得空心动脉的准备。
4. GS1 凝集素对骨骼肌微血管密度的评价
- 用标准精细的手术剪刀切开阴囊, 然后用 #5 钳抓住肌肉, 从雄性大鼠身上取出睾肌肉。
注意: 瘦肌肉 (例如, 睾肌, 以及在雄性和雌性大鼠中发现的伸肌腱长长和胫骨前肌) 都适合用作凝集素研究的整体支架, 尽管组织学切片可用于较厚的组织。 - 使用单切口从睾丸中取出睾肌。将它放在冰冷的 PSS 中, 并将其固定在一个培养皿中, 在底部内表面有硅胶弹性体衬里。用 #5 钳将结缔组织轻轻地梳理掉。
- 用2毫升缓冲的 PSS 冲洗肌肉样本, 然后将它们浸泡在罗丹明标记的 GS1 凝集素 (20 µg/毫升 pss) 中, 在12井细胞培养板中50分钟, 用铝箔包裹的2毫升/井, 以排除光。
- 从凝集素溶液中取出组织, 在 PSS 中冲洗三次, 用5分钟的 "洗涤" 孵化在摇杆上, 然后将其贴在显微镜幻灯片上。确保在黑暗中孵育组织, 并在黑暗中存储幻灯片, 以防止失去荧光。
注意: 如果不能立即使用幻灯片, 可以将它们保存在冰箱中, 而不会丢失荧光。对于长时间存储, 可以将幻灯片保存在冰箱中以防止损坏11。 - 通过在图像52上叠加计算机生成的网格线, 或者在用于查看幻灯片的监视器上叠加一个清晰的网格叠加, 来计算微血管密度。
注: GS1 凝集素方法已被用来证明: 盐诱导微血管稀疏53, 预防盐诱导血管紧张肽 II. 抑制盐喂养动物微血管密度的保护作用17 ,53,54;NRF2 介导低剂量血管紧张素 II. 在预防盐喂养大鼠微血管稀疏中的保护作用17;并评价血管紧张素 II 在维持盐大鼠慢性肌肉刺激血管生成反应中的作用54,55。GS1 凝集素技术的一个优势是, 它可以用来评估微血管密度在相同的动物用于研究空心阻力动脉或自卫。
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
体外空心阻力动脉显微镜允许研究影响小阻力动脉 (和大动脉) 在正常的体内壁压力和缺乏实质细胞的主动音的因素影响.除了评估在正常 pss 中对壁压力升高的各种血管扩张剂和收缩刺激和肌源反应的反应性外, 还可以在液和 superfusate 中添加 Ca2 +-免费的 pss。试验确定了最大容器直径和壁厚。后者的测量是非常有价值的评估血管重塑,即, 改变的墙壁/流明比, 可能发生的反应血压的变化或管理的药理药物。在 Ca2 +-自由 PSS 中最大扩张血管直径的测量对于计算固有色调很有用 ((d最大-drest)/d最大) x 100, 其中, dmax和 drest的最大值是 (Ca2 +自由 pss) 和静息直径 (pss), 分别在控制平衡压力 (通常为 MCA 80 柱)。在我们的经验中, MCA 的活跃音调在壁80柱的压力下平均约40%。测量最大扩张动脉的直径也是一种实用的方法, 通过测量不同水平壁扩张压力下的动脉直径来评价血管的被动力学性能, 并利用结果计算容器的应力-应变关系和其他机械性能7,56。
图 3是由 SS 13BN大鼠使用其他选择性育种方法的三窄同类菌株的示意图表示。在这些大鼠菌株中, 染色体片段要么包括棕挪威肾素等位基因 (Ren1-BN), 要么被切断略高于 (Ren1-SSA) 或略低于 (Ren1-SSB) 肾素基因所在地 (从而保留 SS 肾素等位点)。在该研究中,29, 含有棕挪威肾素等位基因的染色体片段只包含了25。
图 4说明了从雄性达尔 SS 大鼠中分离出来的 MCAs 中内皮依赖性血管扩张剂乙酰胆碱 (1 µM) 的反应, 以及图 3中显示的三窄同类菌株。这三同类菌株的联合使用, 其中包括 (Ren1-BN) 或被切断略高于 (Ren1-SSA) 或以下 (Ren1-SSB) 肾素基因限制了感兴趣的区域 (即, 围绕肾素基因所在地的区域) 到大约25基因。在这些实验中, 这些动物被正常并喂食低盐 (0.4% NaCl) 的饮食。在这项研究中,29内皮依赖性的扩张到乙酰胆碱是缺席 ss 父母应变和在两个同类菌株保留 ss 肾素等位基因, 但恢复了在同类菌株携带的 BN 肾素等位基因在 ss 遗传背景。该研究的结果支持了早期研究的结果, 利用 ss. 13BN consomic 鼠5758 , 并提供了强有力的证据, 表明内皮功能障碍存在于 ss 大鼠, 即使它们是正常和喂低盐饮食。一起, 这些研究的结果29,57,58支持假设 SS 大鼠的内皮功能紊乱是由于肾素基因受损的调节, 导致慢性暴露于低血中血管紧张素 II 水平。
另一项研究59, 在图 5中进行了总结, 比较了从雄性达尔 ss 大鼠和 ss 中分离的 MCAs (MCA) 中内皮依赖性血管舒张因子的反应. 5BN consomic 大鼠携带染色体 5 (含棕褐色挪威基因用于细胞色素 P450-4A ω-羟化酶的各种异构体。在这项研究中, 动物喂食低盐 (0.4% nacl) 或高盐 (4% nacl) 的饮食。与 ss 大鼠的 mca 相比, 血管内皮依赖性舒张功能在 mca 中维持. 5BN consomic 大鼠喂养低盐饮食。另外, (和与结果对比从 SS. 13BN consomic 鼠57,58, 大鼠33,39,40,60和金黄地鼠61), 高盐饮食未能消除乙酰胆碱诱导的扩张在 SS. 5BN鼠, 表明 CYP450-4A ω羟化酶和 20-hydroxyeicosatetraenoic 酸 (20-安嘉睿) 是重要的贡献者血管氧化剂应激和内皮SS 大鼠和其他品系膳食盐摄入量升高时的功能障碍。从实验的角度来看, 高盐饮食的失败, 以消除内皮依赖性扩张到乙酰胆碱提供了一个例子, 如何研究空心阻力动脉可以产生意想不到的结果, 背离了传统的智慧和可能会导致对影响这些关键容器功能的复杂控制机制的新理解。
图 6显示了分离的 MCA 对野生类型的乙酰胆碱 (1 µM) 的响应, 以及Nrf2(-) 挖空大鼠喂食低盐饮食 (0.4% NaCl), 高盐饮食 (4% NaCl), 或高盐饮食含有已知的 NRF2 激活剂30,62.在缺乏盐诱导的氧化应激, 乙酰胆碱诱导的扩张是类似的 MCA 从野生类型和Nrf2(-/) 淘汰赛大鼠。与早期研究的结果大大鼠, 高盐饮食消除了乙酰胆碱诱导的扩张野生类型和在Nrf2(-/) 淘汰赛大鼠。添加 NRF2 诱导剂的高盐饮食恢复了内皮依赖性扩张到乙酰胆碱在野生型大鼠, 但不是在Nrf2(-) 鼠, 演示成功地消除了Nrf2基因在淘汰赛大鼠,并支持使用 NRF2 上调节剂作为一种治疗方法来改善血管氧化应激。
图 7总结了脑膜微循环对大大鼠连续血容量提取后动脉血压的影响, 并对其进行了比较。正常食盐 (0.4% nacl) 饮食或高盐 (4% nacl) 饮食四周。与喂食低盐饮食的老鼠相比, 喂食高盐饮食的老鼠表现出在灌注压力降低时保持恒定血流的能力受损, 这表明脑血流调节的机制是长期暴露在高盐饮食中的危害。这些实验的结果与盐喂养大鼠的孤立脑动脉血管松弛机制的存在是一致的60并提供了一个很好的例子, 说明如何使用自卫测量来支持和扩展研究发现, 采用孤立的阻力动脉到整个血管床的水平。
除了用激光多普勒血评价动脉和组织灌注的阻力动脉功能外, 对各种刺激如慢性肌肉刺激的微血管密度和血管生成反应54,55可以用荧光标记的 GS1 凝集素在相同的动物中进行评估, 在小动脉和毛细血管基底膜上选择性地结合糖蛋白基。图 8显示了大大鼠低盐饮食或高盐饮食喂养2周的睾肌的典型凝集素染色 (注意高盐喂养大鼠的微血管密度较低)。通过计算凝集素标记微血管的交叉点, 用计算机生成的参考网格52对微血管密度进行评估, 并提供了一种极好的方法来评估血管形成反应54、55或检测和量化在高血压和高膳食食盐摄入量等条件下微血管的丢失12,17,53。

图 1:体外用于研究孤立、空心阻力动脉 (A) 的视频显微镜设置。空心阻力动脉绑在玻璃 micropipettes (B) 和视频千分尺显示测量空心阻力动脉流明直径 (C)。面板 B 中的刻度线代表空心动脉 (µm) 的内径, 而 C 组中的125µm 是由观察者进行实验, 以手动方式放置在动脉内壁上的可移动参考线之间的距离的视频显示.请单击此处查看此图的较大版本.

图 2:从脑中分离大脑中动脉的过程示意图, 并准备用 micropipettes。请单击此处查看此图的较大版本.

图 3:窄同类大鼠菌株的示意图, 有小段棕色挪威染色体13渗入进入达尔盐敏感的遗传背景。染色体片段或者包含褐色挪威肾素等位基因 (Ren1-BN) 或被切除略高于 (Ren1-SSA) 或略低于 (Ren1-SSB) 肾素基因所在地, 从而保留 SS 肾素等位基因。此图已从杜兰德et al.中进行了修改和重印29具有美国生理学协会的许可。请单击此处查看此图的较大版本.

图 4:SS 大鼠和同类大鼠的孤立、空心 MCAs 的反应 (如图 2所示) 为1µM 乙酰胆碱。数据被表示为平均直径变化 (Δµm) ±SEM 从休息控制直径在乙酰胆碱之前, 并且是 replotted 从原始的研究由杜兰德et al.29请单击此处查看此图的较大版本.

图 5:ss 大鼠和 ss. 5BN consomic 大鼠对1µM 乙酰胆碱的反应, 喂食低盐 (0.4% nacl) 或高盐 (4% nacl) 饮食的动物。数据被表示为平均直径变化 (Δµm) ±SEM 从休息控制直径在乙酰胆碱之前, 并且是 replotted 从原始的研究由 Lukaszewicz et al.64请单击此处查看此图的较大版本.

图 6:对1µM 乙酰胆碱的反应在孤立, 空心 MCAs 的Nrf2(-) 淘汰赛大鼠和野生类型控制美联储低盐饮食 (0.4% 氯化钠), 高盐饮食 (4% nacl), 或高盐饮食含有已知的 NRF2 激活剂30, 62. 数据被表示为平均直径变化 (Δµm) ±SEM 从休息控制直径在乙酰胆碱之前。请单击此处查看此图的较大版本.

图 7:脑膜微循环评价的脑血流。在高盐饮食中维持四周的大大鼠表现出在维持血流量恒定的能力方面有很大的缺陷, 因为动脉血压的下降是由于连续的血容量减少。数据被绘制为平均控制百分比±SEM p < 0.05 与低盐饮食在相同的平均动脉压力。请单击此处查看此图的较大版本.
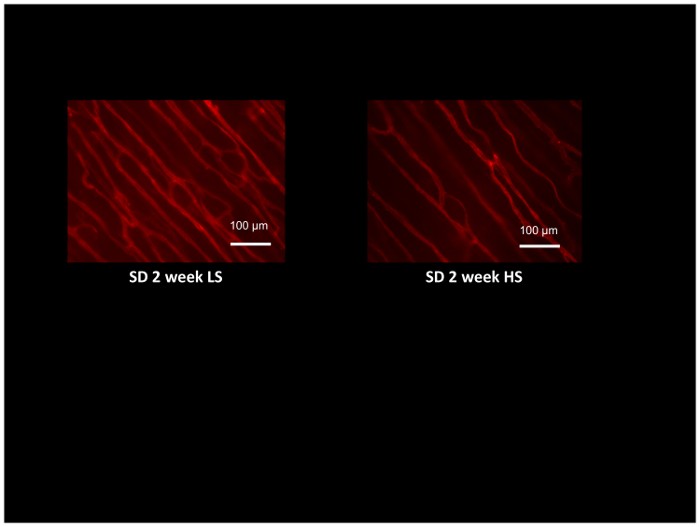
图 8:用罗丹明标记的 GS1 凝集素标记的大鼠睾肌肉的显微图像来识别小动脉和毛细血管, 以评估微血管密度。睾的肌肉是从大大鼠喂养低盐 (LS; 0.4% NaCl) 或高盐 (HS:4%nacl) 饮食2周, 并证明微血管稀疏在 HS 喂养动物与 LS 控制。缩放栏 = 100 µm.请单击此处查看此图的较大版本.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
正如导言中所指出的, 本文介绍了电视显微镜和孤立阻力动脉的方法, 以评估血管功能不仅在标准大鼠模型 (在视频中使用), 而且在高度专门化的基因工程大鼠菌株, 这表明了小说和强大的洞察力, 可以得到利用这些方法。利用这些强大的技术来评估小阻力动脉的主动音和被动力学特性, 可以提供关于多种血管控制机制的重要信息, 包括内皮依赖性调节在正常和病理生理条件下, 血管平滑肌功能与血管重塑和血管壁力学变化有关。内皮功能障碍已被证明是一个强有力的预后指标的多个不良心血管事件的人, 包括心血管相关死亡63, 和空心阻力动脉准备是特别有价值的检测内皮功能障碍, 增强我们对内皮功能障碍机制的认识。
为了说明体外使用隔离阻力动脉的视频显微技术的有效性, 我们提供了在达尔盐敏感 (SS) 大鼠和新的 consomic 大鼠菌株中应用这些技术的例子, 并展示了减少血压的盐敏感性与 SS 父母压力的对比24。这些研究探讨了与两个染色体上的基因有关的血管控制机制, 它们对促进血压的盐敏感性和血管改变有特别的意义。这些染色体是13号染色体, 携带肾素基因18,22,29,57,58, 和染色体 5, 携带 CYP450-4A ω-羟化酶的异构体的基因64 ,65-合成 20-安嘉睿的酶, 对肾脏功能和血管反应性有重大影响6667,68。另外一个最近和强大的大鼠遗传工具箱是利用先进的基因编辑技术开发大鼠基因敲除模型, 包括: ZFNs;转录激活剂类似效应核酸 (TALENS), 最近的 CRISPR-Cas913,14,15,16,17。体外视频显微镜利用这些技术研究孤立的 MCAs 从Nrf2(-) 淘汰赛鼠模型缺乏关键的抗氧化剂和细胞保护转录因子 NRF2, 提供了重要的和以前未知的洞察机制的盐诱导内皮功能障碍在没有升高的血压17。利用这些专门的大鼠模型进行实验的具体结果描述了一些以前的报告17,29,57,58,59,60,64,65.
显然, 研究孤立的, 空心阻力动脉是非常宝贵的, 以了解机制的功能, 调节这些重要的船舶在各种条件下, 这是非常重要的, 以行使预防措施的数量, 以确保获得准确和可靠的结果。而许多其他血管床的脑动脉和阻力动脉表现出固有的音调, 一些动脉 (特别是肠系膜阻力动脉) 需要与收缩, 如去甲肾上腺素预收缩, 以评估反应血管扩张刺激, 并更准确地模拟在体内条件下, 其中的船只是在神经和体液收缩刺激的影响, 如去甲肾上腺素释放的肾上腺素能神经终端。因此, 重要的是要熟悉的基本性质, 要研究的动脉, 无论是从文献或从仔细进行初步实验。由于内皮在调节大动脉、小动脉和微循环中起着重要作用, 所以必须小心谨慎, 以避免在动脉隔离和插管时损伤内皮细胞。经典的血管内皮完整性测试是乙酰胆碱引起血管扩张的证明。一个警告是, 在氧化应激条件下, 血管内皮可能是完好的, 但舒张到乙酰胆碱是缺席的, 因为过量的超氧化物清除的一氧化氮, 防止扩张剂的反应。在这些情况下, 血管内皮完整性可以通过重复乙酰胆碱在超氧化物清除剂 (如 tempol) 中的应用来验证, 这将恢复血管舒张反应, 以回应乙酰胆碱和其他内皮依赖性血管舒张刺激。此外, 在一些病理条件下, 内皮能释放导致血管平滑肌细胞收缩和动脉狭窄的物质;在某些情况下, 内皮依赖性扩张 (或收缩) 通过其他物质介导, 如环氧合酶代谢, H2O2, epoxygenase 代谢物,等。对内皮依赖性血管扩张剂或收缩物质的经典测试是证明血管内皮细胞的清除消除了动脉的扩张或收缩。最后, 各种内皮依赖性血管扩张剂和收缩物质的身份一般可以通过管理特定的抑制剂或清道夫来确定, 例如 L 名称来抑制一氧化氮合酶, 消炎痛抑制形成环氧合代谢物, 过氧化氢酶清除 H2O2, 血栓合成酶抑制剂, epoxygenase 抑制剂, 和/或拮抗剂的 CYP450-4A/20-HETE 通路。
在实验结束时, 通过灌注和 superfusing 动脉与 Ca2 +-自由 PSS, 或管理一个功能强大的血管扩张剂如罂粟碱的最大剂量来量化活动音调的数量也很重要 (并且具有指导意义)。一个典型的活跃休息音的水平在 MCA, 计算为 (d最大-drest)/d最大) x 100, 约为 40%, 其中 D最大和 drest是最大 (Ca2 +无 pss) 和休息直径 (pss),分别在控制平衡压力 (通常为 MCA 的80柱)。具有极少活跃的音调或动脉显示节段性约束或伸缩的血管被排除在分析之外, 因为这些迹象表明血管受到了创伤。在 Ca2 +-自由溶液中最大扩张动脉直径的测量还允许研究者通过测量动脉直径和计算应力-应变关系来评估血管的被动力学性能在壁压力的连续海拔期间在最大地膨胀的船7,56。这些被动应力-应变关系很容易得到, 并提供了一个有价值的迹象, 任何变化的机械特性的船舶。
管、连接器和管道的清洁对于成功的实验来说绝对是至关重要的。在这方面, 重要的是要冲洗所有的解决方案的油管后, 实验完成, 并冲洗和清洁的组织浴, 输送管, 和所有水库用于储存, 温暖, 和气体平衡的 PSS 之前到达船舶庭.在输送系统中的三通和阀门也应定期清洗和更换, 以及任何带 PSS 的油管。污染油管的一个典型标志是霉菌和细菌产生的灰霾;这些变化伴随着由于细菌污染所产生的物质而导致的血管正常反应性的丧失。然而, 由于没有任何明显的证据, 细菌和其他微生物的污染仍然存在。
我们认为, 本文件提供了一个有用的例子, 利用时间的技术, 特别适合研究不同血管床的所有重要的小阻力动脉。当结合标准的方法来评估组织灌注, 如自卫和 GS1 凝集素方法评价微血管密度,体外中空阻力动脉的视频显微镜提供了极有价值的洞察控制组织灌注的因素, 以及它们在疾病状态下的变化。除了提供一种强有力的方法来研究标准大鼠模型中血管平滑肌和内皮功能的基本机制外, 利用视频显微镜研究个体阻力动脉可以应用于其他动物模型, 并人类阻力动脉。新型基因工程大鼠隔离阻力动脉的影像学应用打开了新的门, 以了解因基因的改变而出现的表型变化。
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
作者没有相互竞争的金融利益。
Acknowledgments
作者衷心感谢凯蒂. 芬克和林恩 Dondlinger 在准备这份手稿方面的宝贵帮助。
补助金支持: NIH #R21-OD018309;#R56 HL065289;还有 #R01 HL128242
Materials
| Name | Company | Catalog Number | Comments |
| SS Rat | Medical College of Wisconsin | SS/JHsd/Mcwi strain | Contact Dr. Aron Geurts (ageurts@mcw.edu) |
| SS.5BN Consomic Rat | Medical College of Wisconsin | SS-Chr 5BN/Mcwi strain | Contact Dr. Aron Geurts (ageurts@mcw.edu) |
| SS.13BN Consomic Rat | Medical College of Wisconsin | SS-Chr 13BN/Mcwi strain | Contact Dr. Aron Geurts (ageurts@mcw.edu) |
| Ren1-BN Congenic Rat | Medical College of Wisconsin | SS.BN-(D13hmgc41-D13)hmgc23/Mcwi strain | Contact Dr. Aron Geurts (ageurts@mcw.edu) |
| Ren1-SSA Congenic Rat | Medical College of Wisconsin | SS.BN-(D13rat77-D13rat105/Mcwi strain | Contact Dr. Aron Geurts (ageurts@mcw.edu) |
| Ren1-SSB Congenic Rat | Medical College of Wisconsin | SS.BN-(D13rat124-D13rat101/Mcwi strain | Contact Dr. Aron Geurts (ageurts@mcw.edu) |
| Nrf2(-/-) Knockout Rat and Wild Type Littermates | Medical College of Wisconsin | SD-Nfe212em1Mcwi strain | Contact Dr. Aron Geurts (ageurts@mcw.edu) |
| Low Salt Rat Chow (0.4% NaCl)-AIN-76A | Dyets, Inc. | 113755 | |
| High Salt Rat Chow (4% NaCl)-AIN-76A | Dyets, Inc. | 113756 | |
| Colorado Video Caliper | Colorado Video, Inc. | Model 308 | |
| Video Camera | Hitachi | KPM1AN | |
| Microscope | Olympus Life Science | CKX41 | |
| Television Monitor | Panasonic | WVBM1410 | |
| Pressure Transducers | Stoelting | 56360 | |
| Blood Pressure Display Unit | Stoelting | 50115 | |
| Cannulated Artery Chamber | Living Systems Instrumentation | CH-1 | Single vessel chamber for general use |
| Temperature Controller for Single Chamber | Living Systems Instrumentation | TC-09S | |
| Gas Dispersion Tube, Miniature,Straight | Living Systems Instrumentation | GD-MS | Provides aeration in the vessel bath |
| Gas Exchange Oxygenator, Miniature | Living Systems Instrumentation | OX | Allows gas exchange with perfusate |
| Laser-Doppler Flowmeter | Perimed | PeriFlux 5000 LDPM | |
| GS1 Lectin | Vector Labs | RL-1102 | |
| Glass Capillary Tubes for Micropipettes | Fredrich Haer Co. | 27-33-1 | 2 mm ODX1 mm ID |
| Verticle Pipette Puller | David Kopf Instruments | Model 700C | |
| Nylon suture material (10/0)-3 PLY | Ashaway Line and Twine Manufacturing Co. | 114-ANM-10 | Single strands of 3 ply nylon suture teased out for use on vessels |
| Dumont #5 Forceps-Inox | Fine Science Tools | 11254-20 | |
| Vannas Scissors | Fine Science Tools | 15003-08 | |
| Protandim | Protandim | NRF2 Inducer: Contact Dr. Joe McCord (JOE.MCCORD@UCDENVER.EDU) | |
| Sodium Chloride | Fisher Bioreagents | BP358-212 | |
| Sodium Bicarbonate | Fisher Chemical | S233-3 | |
| Dextrose (d-glucose) anhydrous | Fisher Chemical | D16-500 | |
| Magnesium Sulfate (MgSO4-7H2O) | Sigma Aldrich | M1880-500 G | |
| Calcium Chloride (CaCl2-2 H2O) | Sigma | C5080-500G | |
| Sodium Phosphate-Monobasic (NaH2PO4) | Sigma | S0751-500G | |
| Potassium Chloride (KCl) | Fisher Chemical | P217-500G | |
| Ethylenediaminetetraacetic acid disodium salt dihydrate (EDTA) | Sigma | ED255-500G |
References
- Furchgott, R. F., Zawadzki, J. V. The obligatory role of endothelial cells in the relaxation of arterial smooth muscle by acetylcholine. Nature. 288, 373-376 (1980).
- Bevan, J. A., Osher, J. V. A direct method for recording tension changes in the wall of small blood vessels in vitro. Agents Actions. 2, 257-260 (1972).
- Mulvany, M. J., Halpern, W. Contractile properties of small arterial resistance vessels in spontaneously hypertensive and normotensive rats. Circ. Res. 41, 19-26 (1977).
- Speden, R. N. The use of excised, pressurized blood vessels to study the physiology of vascular smooth muscle. Experientia. 41, 1026-1028 (1985).
- Osol, G., Halpern, W. Myogenic properties of cerebral blood vessels from normotensive and hypertensive rats. Am. J. Physiol. 249, H914-H921 (1985).
- Halpern, W., Kelley, M. In vitro methodology for resistance arteries. Blood Vessels. 28, 245-251 (1991).
- Feihl, F., Liaudet, L., Waeber, B. The macrocirculation and microcirculation of hypertension. Curr Hypertens Rep. 11, 182-189 (2009).
- Smits, G. J., Roman, R. J., Lombard, J. H. Evaluation of laser-Doppler flowmetry as a measure of tissue blood flow. J Appl Physiol. 61, 666-672 (1985).
- Hudetz, A. G., Roman, R. J., Harder, D. R. Spontaneous flow oscillations in the cerebral cortex during acute changes in mean arterial pressure. J Cereb Blood Flow Metab. 12, 491-499 (1992).
- Hudetz, A. G., Smith, J. J., Lee, J. G., Bosnjak, Z. J., Kampine, J. P. Modification of cerebral laser-Doppler flow oscillations by halothane, PCO2, and nitric oxide synthase blockade. Am J Physiol. 269, H114-H120 (1995).
- Hansen-Smith, F. M., Watson, L., Lu, D. Y., Goldstein, I. Griffonia simplicifolia I: fluorescent tracer for microcirculatory vessels in nonperfused thin muscles and sectioned muscle. Microvasc Res. 36, 199-215 (1988).
- Greene, A. S., Lombard, J. H., Cowley, A. W., Hansen-Smith, F. M. Microvessel changes in hypertension measured by Griffonia simplicifolia I lectin. Hypertension. 15, 779-783 (1990).
- Aitman, T., Dhillon, P., Geurts, A. M. A RATional choice for translational research? Dis Model Mech. 9, 1069-1072 (2016).
- Geurts, A. M., et al. Knockout rats via embryo microinjection of zinc-finger nucleases. Science. 325, 433 (2009).
- Geurts, A. M., et al. Generation of gene-specific mutated rats using zinc-finger nucleases. Methods Mol Biol. 597, 211-225 (2010).
- Geurts, A. M., Moreno, C. Zinc-finger nucleases: new strategies to target the rat genome. Clin Sci (Lond). 119, 303-311 (2010).
- Priestley, J. R., Kautenburg, K. E., Casati, M. C., Endres, B. T., Geurts, A. M., Lombard, J. H. The NRF2 knockout rat: a new animal model to study endothelial dysfunction, oxidant stress, and microvascular rarefaction. Am J Physiol Heart Circ Physiol. 310, H478-H487 (2016).
- Cowley, A. W., et al. Brown Norway chromosome 13 confers protection from high salt to consomic Dahl S rat. Hypertension. 37, 456-461 (2001).
- Rapp, J. P. Dahl salt-susceptible and salt-resistant rats. A review. Hypertension. 4, 753-763 (1982).
- Rapp, J. P., Wang, S. M., Dene, H. A genetic polymorphism in the renin gene of Dahl rats cosegregates with blood pressure. Science. 243, 542-544 (1989).
- Manning, R. D. Jr, Meng, S., Tian, N. Renal and vascular oxidative stress and salt-sensitivity of arterial pressure. Acta Physiol Scand. 179, 243-250 (2003).
- Moreno, C., et al. Multiple blood pressure loci on rat chromosome 13 attenuate development of hypertension in the Dahl S hypertensive rat. Physiol Genomics. 31, 228-235 (2007).
- Tobian, L., Lange, J., Iwai, J., Hiller, K., Johnson, M. A., Goossens, P. Prevention with thiazide of NaCl-induced hypertension in Dahl "S" rats. Evidence for a Na-retaining humoral agent in "S" rats. Hypertension. 1, 316-323 (1979).
- Mattson, D. L., et al. Chromosome substitution reveals the genetic basis of Dahl salt-sensitive hypertension and renal disease. Am J Physiol Renal Physiol. 295, F837-F842 (2008).
- Kunert, M. P., et al. Consomic strategies to localize genomic regions related to vascular reactivity in the Dahl salt-sensitive rat. Physiol Genomics. 26, 218-225 (2006).
- Cowley, A. W., Liang, M., Roman, R. J., Greene, A. S., Jacob, H. J. Consomic rat model systems for physiological genomics. Acta Physiol Scand. 181, 585-592 (2004).
- Kunert, M. P., Dwinell, M. R., Lombard, J. H. Vascular responses in aortic rings of a consomic rat panel derived from the Fawn Hooded Hypertensive strain. Physiol Genomics. 42A, 244-258 (2010).
- Liang, M., et al. Renal medullary genes in salt-sensitive hypertension: a chromosomal substitution and cDNA microarray study. Physiol Genomics. 8, 139-149 (2002).
- Durand, M. J., Moreno, C., Greene, A. S., Lombard, J. H. Impaired relaxation of cerebral arteries in the absence of elevated salt intake in normotensive congenic rats carrying the Dahl salt-sensitive renin gene. Am J Physiol Heart Circ Physiol. 299, H1865-H1874 (2010).
- Hybertson, B. M., Gao, B., Bose, S. K., McCord, J. M. Oxidative stress in health and disease: the therapeutic potential of Nrf2 activation. Mol Aspects Med. 32, 234-246 (2011).
- Itoh, K., et al. An Nrf2/small Maf heterodimer mediates the induction of phase II detoxifying enzyme genes through antioxidant response elements. Biochem Biophys Res Commun. 236, 313-322 (1997).
- Myung, S. K., et al. Efficacy of vitamin and antioxidant supplements in prevention of cardiovascular disease: systematic review and meta-analysis of randomised controlled trials. BMJ. 346, f10 (2013).
- Fredricks, K. T., Liu, Y., Lombard, J. H. Response of extraparenchymal resistance arteries of rat skeletal muscle to reduced PO2. Am J Physiol. 267, H706-H715 (1994).
- Fredricks, K. T., Liu, Y., Rusch, N. J., Lombard, J. H. Role of endothelium and arterial K+ channels in mediating hypoxic dilation of middle cerebral arteries. Am J Physiol. 267, H580-H586 (1994).
- Frisbee, J. C., Maier, K. G., Falck, J. R., Roman, R. J., Lombard, J. H. Integration of hypoxic dilation signaling pathways for skeletal muscle resistance arteries. Am J Physiol Regul Integr Comp Physiol. 283, R309-R319 (2002).
- Pavlov, T. S., Ilatovskaya, D. V., Palygin, O., Levchenko, V., Pochynyuk, O., Staruschenko, A. Implementing Patch Clamp and Live Fluorescence Microscopy to Monitor Functional Properties of Freshly Isolated PKD Epithelium. J Vis Exp. (103), (2015).
- Nelson, M. T., Conway, M. A., Knot, H. J., Brayden, J. E. Chloride channel blockers inhibit myogenic tone in rat cerebral arteries. J Physiol. 502 (Pt 2), 259-264 (1997).
- Brayden, J. E., Halpern, W., Brann, L. R. Biochemical and mechanical properties of resistance arteries from normotensive and hypertensive rats. Hypertension. 5, 17-25 (1983).
- Weber, D. S., Lombard, J. H. Elevated salt intake impairs dilation of rat skeletal muscle resistance arteries via ANG II suppression. Am J Physiol Heart Circ Physiol. 278, H500-H506 (2000).
- Weber, D. S., Lombard, J. H. Angiotensin II AT1 receptors preserve vasodilator reactivity in skeletal muscle resistance arteries. Am J Physiol Heart Circ Physiol. 280, H2196-H2202 (2001).
- Wang, J., Roman, R. J., Falck, J. R., de la Cruz, L., Lombard, J. H. Effects of high-salt diet on CYP450-4A omega-hydroxylase expression and active tone in mesenteric resistance arteries. Am J Physiol Heart Circ Physiol. 288, H1557-H1565 (2005).
- Raffai, G., et al. Modulation by cytochrome P450-4A omega-hydroxylase enzymes of adrenergic vasoconstriction and response to reduced PO2 in mesenteric resistance arteries of Dahl salt-sensitive rats. Microcirculation. 17, 525-535 (2010).
- Mishra, R. C., Wulff, H., Hill, M. A., Braun, A. P. Inhibition of Myogenic Tone in Rat Cremaster and Cerebral Arteries by SKA-31, an Activator of Endothelial KCa2.3 and KCa3.1 Channels. J Cardiovasc Pharmacol. 66, 118-127 (2015).
- Freed, J. K., Beyer, A. M., LoGiudice, J. A., Hockenberry, J. C., Gutterman, D. D. Ceramide changes the mediator of flow-induced vasodilation from nitric oxide to hydrogen peroxide in the human microcirculation. Circ Res. 115, 525-532 (2014).
- Beyer, A. M., Durand, M. J., Hockenberry, J., Gamblin, T. C., Phillips, S. A., Gutterman, D. D. An acute rise in intraluminal pressure shifts the mediator of flow-mediated dilation from nitric oxide to hydrogen peroxide in human arterioles. Am J Physiol Heart Circ Physiol. 307, H1587-H1593 (2014).
- Durand, M. J., et al. Vascular actions of angiotensin 1-7 in the human microcirculation: novel role for telomerase. Arterioscler Thromb Vasc Biol. 36, 1254-1262 (2016).
- Beyer, A. M., et al. Transition in the mechanism of flow-mediated dilation with aging and development of coronary artery disease. Basic Res Cardiol. 112, 5 (2017).
- Muller, J. M., Chilian, W. M., Davis, M. J. Integrin signaling transduces shear stress--dependent vasodilation of coronary arterioles. Circ Res. 80, 320-326 (1997).
- Liu, Y., Harder, D. R., Lombard, J. H. Interaction of myogenic mechanisms and hypoxic dilation in rat middle cerebral arteries. Am J Physiol Heart Circ Physiol. 283, H2276-H2281 (2002).
- Potocnik, S. J., et al. Endothelium-dependent vasodilation in myogenically active mouse skeletal muscle arterioles: role of EDH and K+ channels. Microcirculation. 16, 377-390 (2009).
- Harder, D. R. Pressure-dependent membrane depolarization in cat middle cerebral artery. Circ Res. 55, 197-202 (1984).
- Greene, A. S., Rieder, M. J. Measurement of vascular density. Methods Mol. Med. 51, 489-496 (2001).
- Hernandez, I., Cowley, A. W., Lombard, J. H., Greene, A. S. Salt intake and angiotensin II alter microvessel density in the cremaster muscle of normal rats. Am J Physiol. 263, H664-H667 (1992).
- Resende, M. M., Amaral, S. L., Moreno, C., Greene, A. S. Congenic strains reveal the effect of the renin gene on skeletal muscle angiogenesis induced by electrical stimulation. Physiol Genomics. 33, 33-40 (2008).
- Petersen, M. C., Munzenmaier, D. H., Greene, A. S. Angiotensin II infusion restores stimulated angiogenesis in the skeletal muscle of rats on a high-salt diet. Am J Physiol Heart Circ Physiol. 291, H114-H120 (2006).
- Frisbee, J. C., Weber, D. S., Liu, Y., DeBruin, J. A., Lombard, J. H. Altered structure and mechanics of skeletal muscle arteries with high-salt diet and reduced renal mass hypertension. Microvasc Res. 59, 323-328 (2000).
- Drenjancevic-Peric, I., Lombard, J. H. Introgression of chromosome 13 in Dahl salt-sensitive genetic background restores cerebral vascular relaxation. Am J Physiol Heart Circ Physiol. 287, H957-H962 (2004).
- Drenjancevic-Peric, I., Phillips, S. A., Falck, J. R., Lombard, J. H. Restoration of normal vascular relaxation mechanisms in cerebral arteries by chromosomal substitution in consomic SS.13BN rats. Am J Physiol Heart Circ Physiol. 289, H188-H195 (2005).
- Lukaszewicz, K. M., Paudyal, M. P., Falck, J. R., Lombard, J. H. Role of vascular reactive oxygen species in regulating cytochrome P450-4A enzyme expression in Dahl salt-sensitive rats. Microcirculation. 23, 540-548 (2016).
- Lombard, J. H., Sylvester, F. A., Phillips, S. A., Frisbee, J. C. High-salt diet impairs vascular relaxation mechanisms in rat middle cerebral arteries. Am J Physiol Heart Circ Physiol. 284, H1124-H1133 (2003).
- Priestley, J. R., et al. Reduced angiotensin II levels cause generalized vascular dysfunction via oxidant stress in hamster cheek pouch arterioles. Microvasc Res. 89, 134-145 (2013).
- Velmurugan, K., Alam, J., McCord, J. M., Pugazhenthi, S. Synergistic induction of heme oxygenase-1 by the components of the antioxidant supplement Protandim. Free Radic Biol Med. 46, 430-440 (2009).
- Widlansky, M. E., Gokce, N., Keaney, J. F., Vita, J. A. The clinical implications of endothelial dysfunction. J Am Coll Cardiol. 42, 1149-1160 (2003).
- Lukaszewicz, K. M., Falck, J. R., Manthati, V. L., Lombard, J. H. Introgression of Brown Norway CYP4A genes on to the Dahl salt-sensitive background restores vascular function in SS-5BN consomic rats. Clin Sci (Lond). 124, 333-342 (2013).
- Lukaszewicz, K. M., Lombard, J. H. Role of the CYP4A/20-HETE pathway in vascular dysfunction of the Dahl salt-sensitive rat. Clin Sci (Lond). 124, 695-700 (2013).
- Roman, R. J. P-450 metabolites of arachidonic acid in the control of cardiovascular function. Physiol Rev. 82, 131-185 (2002).
- Roman, R. J., Maier, K. G., Sun, C. W., Harder, D. R., Alonso-Galicia, M. Renal and cardiovascular actions of 20-hydroxyeicosatetraenoic acid and epoxyeicosatrienoic acids. Clin Exp Pharmacol. 27, 855-865 (2000).
- Roman, R. J., Alonso-Galicia, M. P-450 eicosanoids: A novel signaling pathway regulating renal function. News Physiol Sci. 14, 238-242 (1999).



