Summary
Dieses Manuskript beschreibt in Vitro Videomikroskopie Protokolle für die Bewertung der Gefäßfunktion in Ratte zerebralen Widerstand Arterien. Das Manuskript beschreibt auch Techniken für die Bewertung der kapilläre Dichte mit Gewebekulturen beschrifteten Lektine und Gewebe Perfusion mit Laser-Doppler-Flowmetry.
Abstract
Dieses Protokoll beschreibt die Verwendung von in-vitro- Fernsehen Mikroskopie auszuwertende Gefäßfunktion in isolierte zerebrale Widerstand Arterien (und andere Schiffe) und beschreibt Techniken für die Bewertung der Gewebedurchblutung mit Laser Doppler Flowmetry (LDF ) und kapilläre Dichte Nutzung Eindringmittel beschriftet Griffonia Simplicifolia (GS1) Lektin. Aktuelle Methoden zur Untersuchung isoliert Widerstand Arterien an Transmural Druck begegnet in Vivo und in Ermangelung von parenchymatösen Zelle Einflüsse stellen ein wichtiges Bindeglied zwischen in-Vivo -Studien und Erkenntnissen aus molekularen reduktionistische Ansätze, die begrenzten in integrative Antworten auf die ganze Ebene Einblick. LDF und Techniken, um selektiv Arteriolen und Kapillaren mit Gewebekulturen beschriftet GS1 Lektin identifizieren bieten praktische Lösungen für Ermittler, die Erkenntnisse aus Studien der isolierten Widerstand Arterien erweitern können. Dieses Whitepaper beschreibt die Anwendung dieser Techniken, grundlegende Kenntnisse der vaskulären Physiologie und Pathologie in der Ratte als allgemeines experimentelles Modell zu gewinnen, und in einer Vielzahl von spezialisierten gentechnisch verändert "Designer" Ratte-Stämme, die bieten kann wichtige Erkenntnisse über den Einfluss bestimmter Gene auf wichtige vaskulären Phänotypen. Nutzen diese wertvolle experimentelle Ansätze in der Ratte Stämme durch selektive Zuchtstrategien und neue Technologien für die Herstellung von gen-Knockout-Modelle bei der Ratte entwickelt dehnt die strenge der wissenschaftlicher Räumlichkeiten in Knockout-Maus-Modellen entwickelt und Dieses Wissen zu mehr relevanten Tiermodell, mit einem gut verständlichen physiologischen Hintergrund und Eignung für physiologische Untersuchungen aufgrund seiner Größe zu erweitern.
Introduction
Die frühesten Studien der Gefäßfunktion in Arterien verwendet Conduit Arterien und in vielen Fällen die Aorta. Krafterzeugung in großen Arterien wurde in der Regel untersucht, durch das Anbringen eines Ring-Segments der Arterie zu einem Kraftaufnehmer in einem Gewebe-Bad; bei der Aorta Streifen durch Schneiden spiralförmige des Schiffes, so dass der glatten Muskelfasern in Längsrichtung zwischen den Punkt der Anlage und der Kraftaufnehmer, zu den besten Schätzwert für die Kraft, die durch Kontraktion der orientiert waren die glatte Muskulatur entlang seiner Längsachse. Die Standardtechnik für das Schneiden von spiralförmigen Streifen der Hauptschlagadern war, legen Sie einen Glasstab in das Lumen des Gefäßes, machen Sie einen Schnitt in der Gefäßwand im gewünschten Winkel und halten bis zum Ende der exponierte Kante der Gefäßwand, wie der Schnitt verlängert wurde, um ein Ganzes zu produzieren spiralförmigen Streifen des Schiffes. Zu diesem Zeitpunkt die endotheliale Seite des Schiffes war in der Regel ausgelöscht, um Ablagerungen zu entfernen, vor Befestigung des Schiff-Streifens zu Kraftaufnehmers und Eintauchen der Vorbereitung in Sauerstoff und Temperatur gesteuert Gewebe Bad. Schließlich, dass Ansatz zu einem der bekanntesten und wichtigsten Entdeckungen in der Geschichte der Physiologie von Furchgott und Zawadski1, nämlich die Rolle des Endothels führte abgeleitet entspannende Faktor (EFRE), anschließend identifiziert als Stickstoffmonoxid, in Regulierung der Gefäßfunktion. Das entscheidende Ereignis zu dieser Entdeckung war eine Situation, in der die Ermittler eine intakte Endothel durch Vermeidung des Kontakts der endothelialen Seite der Arterie mit ausländischen Oberflächen beibehalten, und bemerkte, dass der Aorta Streifen nicht die erwarteten aufweisen, Kontraktion von Acetylcholin (ACh), aber stattdessen entspannt als Reaktion auf ACh. Basierend auf dieser Beobachtung, die Ermittler entwickelt eine "Sandwich"-Vorbereitung, in der sie eine Aorten-Segment mit einem intakten Endothel (aber nicht in der Lage, Kontraktionskraft zu generieren) angebracht, zu einem standard spiralförmigen Streifen der Aorta und konvertiert die ACh-induzierte Kontraktion in eine Entspannung.
Zwei bedeutende Fortschritte auf diesem Gebiet, das heute weitgehend benutzt werden sind die Entwicklung von Präparaten Messen aktiv Kontraktionskraft in kleinen Widerstand Arterien2,3 (z. B. im Darm Mesenterium3 ) und kanülierte Widerstand Arterie Vorbereitungen4,5,6. In einer der frühesten Berichte, Mulvany und Halpern3 beschriebenen Verwendung der Draht Myograph Zubereitung, aktive Kontraktionskraft in isolierten Widerstand Arterien aus dem Darm Mesenterium spontan Hypertensive Ratten (SHR) zu studieren und normotonen WKY Kontrollen. Im Anschluss an die Entwicklung des Systems der Draht Myograph waren kanülierte Widerstand Arterie Präparate entwickelt, um Studien der Schiffe näher, die in Vivo Bedingungen4,5,6zu ermöglichen. Während beide Ansätze wertvolle Ergebnisse zu liefern, hat die kanülierte Arterie Vorbereitung die zusätzlichen Vorteile von mehr effektiv Erhaltung intrinsische aktiv Ton in den Arterien; und so die Ermittler, aktive myogen Reaktionen auf Veränderungen im Transmural Druck und Schiff Reaktionen auf Veränderungen in der Durchflussmenge und endotheliale Schubspannung zu studieren (siehe Beitrag von Halpern und Kelley6).
Ein wesentliches Ziel der vorliegenden Arbeit soll beschreiben, wie die altehrwürdige Technik der Videomikroskopie mit isolierten, kanülierte Widerstand Arterien um genaue Informationen über die Mechanismen zu gewinnen, die aktiv Ton in dieser entscheidenden Regeln beschäftigen Schiffe, unabhängig von Einflüssen der neuronalen, humorale oder parenchymatösen Zelle. Diese Basisinformationen, mit einem standard Rattenmodell und Beispiele aus unseren Studien von neu genetisch engineered Ratte Stämme, vermitteln dem Leser eine Vorstellung von den Arten der Erkenntnisse bezüglich Gefäßfunktion, die mit dem Fernsehen gewonnen werden können Mikroskopie-Ansätze und die eingesetzt werden können, in Studien mit jeder Kontrolle und experimentelle Gruppe(n) der Ermittler zu wählen, darunter mächtige neue experimentelle Ratte Modelle produziert durch gezielte Inzucht und neu entwickelte genetische Engineering-Techniken.
Dank der Präzision des Fernsehens Mikroskopie Ansätze bieten Messung von Durchmesserwechsel kanülierte Arterie Vorbereitungen sehr wertvolle Informationen über Endothel-abhängigen und Endothel-unabhängige Mechanismen der vaskulären Entspannung, als auch wichtige (und manchmal unerwartete) Veränderungen der vaskulären Kontrollmechanismen, die mit Bluthochdruck, hohe salzarme Kost und andere experimentellen Interventionen. Darüber hinaus Messung von Druck-Durchmesser Beziehungen in isoliert und kanülierte Widerstand Arterien, die durch die Behandlung mit Ca2 +maximal entspannt sind-freie Lösung oder eine pharmakologische gefäßerweiternde Medikament, ermöglicht es den Prüfer bewerten strukturelle Veränderungen in den Arterien durch vaskuläre remodeling und passive Spannungs-Dehnungs-Beziehungen-7 zu berechnen, die wichtige Erkenntnisse Änderungen in die passive mechanische Eigenschaften der Arterien bieten kann, die arterielle Funktion beeinflussen können unabhängig von (oder zusätzlich zu) ändert sich der aktive Kontrollmechanismen. Es ist auch wichtig zu beachten, dass Erkenntnisse aus Studien der isolierten Widerstand Arterien durch Informationen, die Verwendung von LDF, eine praktische Methode für die Bewertung der Gewebedurchblutung an das ganze Tier Level8,9 ergänzt werden können ,10, und durch kapilläre Dichte mit Gewebekulturen gekennzeichneten GS1 Lektin Bewertung gewonnenen Informationen, die spezifisch bindet an Glykoprotein Moieties in der Basalmembran der kleinen Arteriolen und Kapillaren11 , 12. letztere Methode ermöglicht eine sehr genaue Schätzung kapilläre Dichte, die nicht die klassische Schwierigkeiten bei der Abschätzung der kapilläre Dichte durch Schiffe in Vivo, z. B. fehlende nicht durchblutet zählen unterliegt Schiffe, wo die Durchblutung durch aktive Schließung der Arteriolen gestoppt ist. Wenn Sie zusammen verwendet, bieten diese Ansätze wichtige Erkenntnisse zum funktionelle Veränderungen in isolierten Widerstand Arterien zu Veränderungen der Gewebedurchblutung Ebene der mikrozirkulatorischen korrelieren; und einige Beispiele für die Verwendung dieser wertvolle Ansätze in Verbindung mit kanülierte Arterie Techniken erhalten Sie auch in der vorliegenden Handschrift.
Der vorliegende Beitrag konzentriert sich auf die Verwendung von Techniken der Videomikroskopie, vaskuläre Veränderungen in den Arterien von fremd-Sprague-Dawley Ratten zu bewerten. Es ist jedoch wichtig zu beachten, dass diese Techniken sehr wertvoll in Aufklärung phänotypische Veränderungen in hochspezialisierten gentechnisch Ratte Stämme erstellt durch selektive Züchtung oder gen Bearbeitung mit Hilfe von Techniken bewährt haben. In diesem Manuskript stellen wir Beispiele dafür, wie video Mikroskopiertechniken wichtige Informationen bezüglich Gefäßfunktion in einer Reihe von wertvollen Rat zur Verfügung gestellt haben-Modelle, darunter die Dahl Salz-Sensitive (SS) Ratte-eine Inzucht Ratte Belastung, die die am weitesten verbreitete ist experimentelles Modell verwendet untersuchen die Mechanismen von Salz sensible Hypertenson18,19,20,21,22,23; und Consomic Ratten durch selektive Züchtung von SS Ratten mit dem Salz-unempfindliche braun Norwegen (BN) Ratte Stamm erstellt. Jedes Chromosom aus Braun Norwegen Ratte wurde in der Consomic-Ratte-Panels Introgressed einzeln in den Dahl SS24,25,26 genetischen Hintergrund. Verwendung von Consomic Ratte Platten lieferte wertvolle Hinweise auf bestimmten Chromosomen, die Salz Empfindlichkeit der Blutdruck und anderen Phänotypen, darunter vaskuläre Reaktivität24,25,26 beitragen ,27,28.
Selektive Zuchtstrategien nutzen SS Ratten und Consomic Ratten tragen einzelne BN Chromosomen konnten auch die Generation der verengten Congenic Stämme mit kleinen Segmenten der einzelnen braun Norwegen Chromosomen Introgressed in die genetische Dahl-SS Hintergrund22,29. Diese können extrem wertvollen input auf bestimmte Gene oder schmale Regionen der Chromosomen, die entscheidende physiologischen Variablen, z. B. Blutdruck, Nierenschädigung und vaskuläre Reaktivität22,29beeinflussen können. Eine weitere leistungsstarke Ergänzung zu der Ratte genetische Toolbox ist die Entwicklung von Ratte gen Knockout Modelle nutzen fortschrittliche gen Bearbeitung Techniken einschließlich ZFN, transcriptional Aktivator-artigen-Effektor Nukleasen (TALENS), und zuletzt CRISPR-Cas913 ,14,15,16,17. Das Aufkommen dieser mächtigen Techniken, mit denen Gene bei der Ratte geschlagen werden können ist eine immens wichtige Entwicklung, weil gen Knockout Studien bisher verwendet haben (und weiterhin verwenden) Mäuse fast ausschließlich. Eine weitere experimentelle Komponente in der vorliegenden Arbeit zeigt die Bedeutung von kanülierte Arterie Techniken und Videomikroskopie, physiologische Kontrollmechanismen bei Knockout Ratten fehlt die master Antioxidans und Zelle schützende Transkription zu bewerten Faktor, nukleare Faktor (2 erythroiden abgeleitet) - wie - 2 (NRF2)30,31, die mit TALEN Technologie in Sprague-Dawley genetischen Hintergrund17entwickelt wurden. In-vitro- Videomikroskopie Techniken wurden in diesen Experimenten Verlust des Gens NRF2 funktionale nachzuweisen und einen potentiell wertvollen therapeutischen Ansatz basierend auf direkte Hochregulation von NRF2-vermittelten Antioxidans zu testen verwendet. Abwehrkräfte. NRF-2 ist der erhebliche therapeutische Bedeutung Bekämpfung vaskulären oxidativen Stress in den Menschen angesichts der enttäuschenden Ergebnisse der klinischen Studien mit direkten Verwaltung von Antioxidantien wie Vitamine C und E32.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Das Medical College of Wisconsin institutionelle Animal Care und Nutzung Committee (IACUC) genehmigt alle Protokolle, die in diesem Dokument beschriebenen und alle Verfahren sind in Übereinstimmung mit den National Institutes of Health (NIH) Büro des Labor Tier Wohlfahrt (OLAW) Vorschriften.
1. Vorbereitung der Lösungen und Schiff Kammer
- Bereiten Sie vor der Durchführung einer Reihe von Experimenten, 2 L 20 x konzentrierte Salzlösung Lager bestehend aus 278 g/L NaCl; 14 g/L KCl; 11,52 g/L MgSO4. 7H2O; und 9,4 g/L CaCl2. 2H2O. Bereiten Sie auch 2 L 20 x konzentrierte Ausgleichslagers bestehend aus 80,8 g/L Nahco33 und 0,4 g/L EDTA und 2 L 20 X konzentrierte sich Ca2 +-kostenlose Stammlösung bestehend aus 281,6 g/L NaCl; 14 g/L KCl und 11,52 g/L MgSO4. 7H2O.
Hinweis: 20 X Stammlösungen können bis zum Gebrauch im Kühlschrank aufbewahrt werden. - Am Tag des Experiments vorbereiten 2 L einer physiologischen Salzlösung (PSS) von 20 x konzentrierte Stammlösungen wie folgt: 1.800 mL entionisiertem Wasser in einem 2 L Erlenmeyerkolben oder Becherglas auf einer motorisierten rühren Platte 100 mL 20 x Salz Aktie hinzufügen. 100 mL 20 X Ausgleichslagers hinzufügen, während kontinuierlich Äquilibrierung der Lösung mit einem Gasgemisch mit 21 % O2, 5 % CO2, balance, N2, und rühren es mit einer magnetischen Rührstab. Fügen Sie langsam 0,28 g NaH2PO4 während der Überwachung des pH-Wertes; einstellen Sie durch Hinzufügen von Tropfen 6 N HCl oder 6,5 N NaOH-Lösung aus einer Pasteurpipette wie nötig, um pH 7.4. Nachdem die PSS vorbereitet ist und der pH-Wert wird eingestellt, Hinzufügen der PSS 1,98 g Glukose.
Hinweis: Es ist wichtig, langsam NaH2PO4 zuletzt hinzugefügt, während der Überwachung des pH-Wert der PSS, weil die Zugabe von NaH2PO4 um eine alkalische Lösung (pH > 7.4) könnte einen Calcium-Phosphat-Niederschlag bilden, wie durch die Darstellung der eine trübe Lösung oder einen weißen Niederschlag in den Boden des Behälters.
Hinweis: Die endgültige Zusammensetzung der PSS ist 119 mM/L NaCl; 4,7 mM/L KCl; 1,17 mM/L Mg2SO4; 1,6 mM/L CaCl2; 1,18 mM/L NaH2PO4; 24 mM/L Nahco33; 0,03 mM/L EDTA; und 5,5 mM/L Glucose. Obwohl sich die Zusammensetzung der PSS Labors unterscheiden kann, eignet sich dieses Rezept für die Aufrechterhaltung der Gefäßtonus, Endothelfunktion und Reaktionen auf vasoaktive Agenten in isolierten Widerstand Arterien. - Um den maximalen Durchmesser zu bestimmen und aktive Ton in der Arterie zu bewerten, indem Sie produzieren maximale Ausdehnung des Schiffes, bereiten Sie 500 mL Ca2 +-freie PSS durch Zugabe von 25 mL 20 X Ca2 +-Salz bestand bis 450 mL entionisiertem Wasser frei , gefolgt von 25 mL 20 x Ausgleichslagers in einen Erlenmeyerkolben oder Becherglas ähnlich 1.2 oben Schritt. Fügen Sie 0,07 g NaH2PO4 während der Überwachung und Anpassung der pH-Wert der Lösung der Projektmappe hinzu. Die Ca2 +-kostenlose PSS wird hinzugefügt, um die PSS Reservoir und Schiff Kammer am Ende des Experiments zu vermeiden, zum Abbau der intrazellulärer Ca2 + Läden, die Schiff Antworten in normalen PSS beeinträchtigen könnten. Weil die Ca2 +-kostenlose Lösung wird hinzugefügt, am Ende des Experiments, maximale Entspannung der Arterien, zu produzieren, besteht keine Notwendigkeit der PSS Glukose hinzu.
Hinweis: Wenn abgeschlossen, die endgültige Zusammensetzung des Ca2 +-kostenlose PSS ist 120,6 mM/L NaCl; 4,7 mM/L KCl; 1,17 mM/L Mg2SO4; 1,18 mM/L NaH2PO4; 24 mM/L Nahco33; 0 mM/L CaCl2; und 0,03 mM/L EDTA.
Hinweis: Für viele Studien erfordern maximale Ausdehnung der Arterie, kann ein Calcium-Eintrag-Blocker wie Verapamil (1 µM) und/oder ein Stickoxid-Spender wie Natrium Nitroprusside (10 µM) die Lösung zusätzlich zur Entfernung von Ca2 + aus der PSS hinzugefügt werden. - Pflegen Sie die PO-2, PCO2und pH von der PSS, indem kontinuierlich Äquilibrierung der PSS fließt in die Gefäß-Kammer in einem standard Orgel Bad zur Untersuchung der isolierten Aorta Ringe, Darm Glattmuskel oder anderen Geweben (Abbildung 1). Verwenden Sie synthetische Fluorpolymer Tetrafluorethylen Schlauch, um den Gas-Tank zum Orgel-Bad zu verbinden, weil diese Art von Schläuchen Gas undurchlässige, im Gegensatz zu vielen anderen Formen der Schläuche, z.B., Latex.
- Legen Sie eine kleine Luft Stein an das Gleichgewichtherstellung-Gas-Gemisch in der Schiff-Kammer zur Aufrechterhaltung die PSS Gaszusammensetzung angeschlossen.
Hinweis: Schiff Reaktionen auf Veränderungen im PO2 können getestet werden, indem die Äquilibrierung der PSS in das Gefäß Kammer und luminalen Perfusat mit Gasgemischen mit verschiedenen Anteilen von O2, z.B.21 % O2, 10 % O2, 5 % O2 , und 0 % O2mit 5 % CO2 und Balance N233,34,35. Für die größeren Arterien mit dickere Wände, wo Diffusion von Sauerstoff in der Mitte der Gefäßwand eine Einschränkung sein kann, kann ein höherer Anteil an Sauerstoff, z.B., 95 % O2 verwendet werden. - Verfolgen Sie die Temperatur in der Kammer Schiff aufmerksam, wie einzelne Kammern in ihre Hitze Übertragungsverhalten variieren.
Hinweis: Viele kommerziell zubereiteten Schiff Kammern für Studien der kanülierte Widerstand Arterien verwendet nutzen eine peristaltische Pumpe liefern sauerstoffreiches PSS aus einem Gas-equilibriert Reservoir und sehr präzise Steuerung der Badtemperatur und Sauerstoffversorgung der die PSS. - Legen Sie die PSS in eine große Flasche (2 L) Mariotte, mit einem Stopfen und zentrale Glasrohr, dienen als Reservoir kontinuierlich PSS in der Orgel-Bad schaffen, erwärmt und Gas-gestalten die PSS fließt in die Gefäß-Kammer (Abbildung 1A).
- Legen Sie die Öffnung des zentralen Glasrohrs Mariotte Flaschenpost auf dem gleichen Niveau wie die Spitze der PSS in der Orgel-Badewanne, weiterhin einen konstanten hydrostatischen Druck-Kopf für die Lieferung von PSS in der Orgel-Bad. Verwendung-Polyethylen-Schlauch verbunden zu einem J-förmigen Glas oder Kunststoff-Rohr, die PSS von Mariotte-Flasche in der Orgel-Bad zu liefern.
- Verwenden Sie für luminalen Perfusion (Abbildung 1A) Polyethylen-Schlauch anschließen die Zufluss Pipette ein PSS-Reservoir, bestehend aus einem 60 cc Kunststoffspritze erhöht, um eine Position, die die gewünschte Zufluss Druck (in der Regel 80 MmHg für Studien der Ratte zerebralen hält (Arterien), gemessen mit einem Druck-Wandler über einen Absperrhahn an das System angeschlossen.
- Verbinden Sie die Abfluss-Pipette mit Polyethylenschlauch zu PSS durch das Schiff als Reaktion auf ein Druckgefälle fließen zu lassen, und schließen Sie die Abfluss-Leitung zu einem Reservoir ähnlich dem Zufluss Reservoir. Verwenden Sie eine ähnliche Absperrhahn und Druck Wandler-Verbindung zum Abfluss Druck messen.
Hinweis: Verfahren für die Festlegung Transmural Druck und Durchfluss durch das Schiff zu kontrollieren sind in Abschnitt 2 beschrieben. - Am Ende des Experiments spülen Sie gründlich die Kammer, Förderleitungen und Reservoir Systeme mit destilliertem Wasser. In kurzen Abständen, ersetzen Sie die Schläuche und Lieferung Zeilen, sauber oder ersetzen die Hähne im System und in regelmäßigen Abständen unterziehen jedes Glas PSS Stauseen eine Säurewäsche zu verhindern das Wachstum von Bakterien und anderen Mikroorganismen, die Verunreinigungen verursachen und beeinflussen Sie Schiff-Reaktivität.
(2) kanülierte Arterie Vorbereitung
- Ein Sprague-Dawley Ratten mit 5 % Isofluran zu betäuben und Aufrechterhaltung der Narkose mit 1,5-2,5 % medizinischem Sauerstoff36. Alternativ zu verwalten eine intramuskuläre Injektion mit Ketamin (75,0 mg/kg), Acepromazine (2,5 mg/kg) und Xylazin (10,0 mg/kg); eine intraperitoneale Injektion von Pentobarbital (50-60 mg/kg); oder eine andere anerkannte Methode der Anästhesie, Protokolle und/oder Ermittler Vorlieben abhängig.
- Die Ratte Tiefe Narkose zu enthaupten und das Gehirn für Studien der zerebralen Widerstand Arterien zu entfernen.
- Nach der Entnahme des Gehirns, sorgfältig zu isolieren, die mittlere zerebrale Arterie (MCA) (oder anderen Arterien von Interesse, z.B., a. basilaris oder hinteren zerebralen Arterie)37,38. Isolieren der MCAs, platzieren Sie das Gehirn in einem Glas Petrischale Rückenlage gefüllt mit eiskalten PSS (Abbildung 2).
- Verwenden Sie Vannas Schere und einer feinen Spitze Pinzette Dumont Nr. 5 um die MCA aus dem Gehirn Verbrauchsteuern. Reinigen Sie alle verbleibenden Gehirngewebe von der MCA mit der Pinzette und übertragen Sie die Arterie auf eine Temperatur-kontrollierten Gefäß-Kammer mit PSS wie zuvor beschrieben. 33 , 34 .
- Um die Arterie der Schiff-Kammer zu übertragen, halten Sie sanft dem ausgeschnittenen Behälter durch die ACA oder posterior kommunizierende Arterie Segment und legen Sie es vorsichtig in die Kammer.
Hinweis: Neben der MCA eignet sich das kanülierte Gefässsystem für eine Vielzahl von kleinen Schiff Vorbereitungen, einschließlich der Skelettmuskulatur Widerstand Arterien33,39,40, mesenterialen Widerstand Arterien 38 , 41 , 42und große (Erstbestellung) Arteriolen des Cremaster Muskel43, sowie menschliche koronare Arteriolen und menschlichen Arteriolen subkutanem Fettgewebe entnommen, während gluteal Biopsie44,45, 46,47. - Legen Sie die Arterie auf Zufluss Mikropipette ziehen sie in Richtung der Pipette-Basis, bis die Spitze in das Lumen der MCA Fortschritte. Sichern Sie die Arterie auf der Zufluss Pipette durch das Binden einer Schleife aus eine Einzelstrang-Faser, die zuvor gehänselt von 10-0 Nähte um die Arterie (Abbildung 1 b) vorbereitet. Sichern Sie das gegenüberliegende Ende des MCA, der Abfluss-Pipette durch eine zweite Naht Schleife um das Schiff (Abbildung 1 b) anziehen.
Hinweis: Legen Sie die Naht Schleifen auf Mikropipetten vor dem Einbau des Schiffes und positionieren sie in der Nähe der letzte Punkt der Anlage, so dass sie leicht über der Arterie rutschte und schnell gesichert, wenn das Schiff in Position ist, die Minimierung des Risikos der Arterie der Pipetten abrutschen.
Hinweis: Mikropipetten werden zubereitet aus Borosilikatglas Kapillare Schläuche (2 mm Durchmesser, 1 mm Innendurchmesser, 10 cm lang) mit einem vertikalen Mikropipette Abzieher. Vor dem Anbringen der Arterie, entsprechen Sie die Spitze Durchmesser der Mikropipetten so eng wie möglich um Fehlanpassungen des zu- und Abflusses Widerstandes in der Perfusion System zu verhindern. - Nachdem die Arterie an der Mikropipetten sicher gebunden ist, verwenden Sie das Mikrometer an den Zufluss Pipette Halter verbunden, um die Arterie zur in Situ Länge zu Strecken.
- Binden Sie alle Seitenäste mit Einzelsträngen gehänselt von 10-0 Nähte um einen konstanten Druck in der Arterie zu erhalten.
- Überprüfen Sie das Fehlen von Lecks, indem sichergestellt wird, dass der Intraluminal (Transmural) Druck konstant bleibt, nach dem Zufluss Pipette vorübergehend schließen. Binden Sie keine Äste oder für Löcher in das Schiff überprüfen Sie, ob der Druck abfällt. Wiederherstellen Sie, Perfusion, nachdem Sie sich vergewissert, dass die Transmural Druck konstant bleibt.
Hinweis: Kanülierung der isolierten Widerstand Arterien erfordert handwerkliches Geschick und Übung. Die wichtigsten Vorsichtsmaßnahmen zu beachten sind, zu vermeiden, brechen die Pipetten und um sicherzustellen, dass die Arterie der Pipetten nicht abrutschen. Es ist wichtig, sanft mit den isolierten Arterien während des gesamten Verfahrens zu sein, da Trauma des Schiffes Endothel beschädigt werden kann und/oder stören die normale Funktion der vaskulären glatten Muskulatur. - Messen Sie den Innendurchmesser der Arterie mit einer Videomikroskopie Setup (Abbildung 1A) bestehend aus einer Videokamera an einen sezierenden Mikroskop befestigt und mit einem video Mikrometer und TV-Monitor (Zahlen 1 b, 1 C) verbunden. Dies ermöglicht den Betrachter, Schiffs Durchmesser manuell zu messen, indem man bewegliche Referenzlinien auf der Innenwand der Arterie und, falls gewünscht, an der Außenwand der Arterie als auch um Schiff Wandstärke messen.
Hinweis: Einige video Mikrometer bieten automatische Verfolgung von Behälterabmessungen.
Hinweis: Kalibrieren Sie das video Mikrometer mit einem Mikroskop Bühne Mikrometer und den Zufluss und Abfluss Druckaufnehmer mit einem Quecksilber-Manometer (0 MmHg, 50 MmHg 100 MmHg, 150 MmHg und 200 MmHg) zwischen Experimente um genaue Messungen zu versichern Durchmesser und Intraluminal Behälterdruck.
Hinweis: Die standard-Steuerelement Transmural Ratte MCA Experimente kann 80 MmHg. Kalibrierung für höhere und niedrigere Druckstufen gewährleistet Genauigkeit für Studien der myogen Reaktionen auf Veränderungen im Transmural Druck und Passive Druck-Durchmesser-Kurven in maximal geweitete Arterien. - Passen Sie die Höhe der zu- und Abfluss Stauseen, gewünschte Transmural Druck auf einem konstanten Niveau zu halten. Der Zufluss Reservoir um einen kleinen Betrag (< 5 MmHg) heben und senken von Abfluss-Reservoir um den gleichen Betrag hält den mittleren Transmural Druck und schafft Perfusion fließen in das Gefäß Lumen6.
Hinweis: Das Zufluss-Reservoir heben und senken der Abfluss-Reservoir durch gleiche Mengen behält die gleiche mittlere Transmural Appetithemmer Druck in der Arterie, aber erzeugt einen hydrostatischen Druckgradienten, die Strömung und Schubspannung im Behälter, verursacht so dass die Ermittler, Endothel-abhängigen Reaktionen auf Veränderungen im Intraluminal Schubspannung in verschiedenen Versuchsgruppen48zu bewerten. - Myogen Antworten und Schiff Reaktionen auf gefäßerweiternde Reize zu bewerten, stellen Sie sicher, dass die Arterie ein angemessenes Niveau der aktiven Ton (ca. 40 %) vor dem Experiment zeigt. Entsorgen Sie alle Arterien fehlt aktiv Ton in Ruhe mit Ausnahme von Schiffen, z.B., kleine mesenterialen Arterien, die nicht normalerweise aktiv ruhenden Ton ausstellen.
Hinweis: Für Schiffe, die nicht normalerweise spontan Ton ausstellen, Pre verengen Sie sich die Arterien durch eine äquivalente Menge nutzt einen Vasokonstriktor Agonisten wie Noradrenalin oder Phenylephrin. Ein guter Ansatz um die Wahl der Dosis der Agonist verwendet, um die Arterie verengen sich vorab ist eine EC50 Dosis des Vasokonstriktor Agenten, z.B.Noradrenalin41,42zu nutzen. Jedoch sollte pharmakologische Vasokonstriktor Agenten nicht auf Arterien angewendet werden, die spontan aktiv Ton unter Ruhe-Bedingungen aufweisen. - Endothel-abhängige Reaktivität der kanülierte Widerstand Arterie durch Messung Schiffs Durchmesser während der Zugabe von steigenden Konzentrationen von ACh zu testen (10-10 m-10-5 M) an die Gefäß-Kammer. Endothel-unabhängige Stickoxid-Empfindlichkeit von vaskulären glatten Muskelzellen durch Messung Schiffs Durchmesser während der Zugabe von steigenden Konzentrationen (10-10 m-10-5 M) von der Stickoxid-Spender Natrium Nitroprusside, Testen der Schiff-Kammer.
Hinweis: Empfindlichkeit Vasokonstriktor Agenten und anderen gefäßerweiternden Agonisten kann in ähnlicher Weise geprüft werden, indem das Schiff Kammer steigende Konzentrationen von Agonisten hinzufügen.
Hinweis: Neben vasoaktive Agenten können verschiedene Medikamente, Inhibitoren und andere pharmakologische Wirkstoffe in das Gewebe-Bad und/oder an der luminalen Perfusat hinzugefügt werden. Veränderungen in der PO-2 (sowie PCO2 und pH-Wert) können selektiv der endothelialen oder Extra-luminalen Seite der Arterie durch separate Gleichgewichtherstellung der luminalen Perfusat mit einem Luftstein verbunden mit einem kalibrierten Gasgemisch verabreicht werden anders als die Mischung verwendet, um die PSS Gewebe Bad33,34,49equilibrate. Myogen Reaktionen auf Veränderungen im Transmural Druck können studiert werden, schließen die Abfluss-Pipette und zu erhöhen (oder senken) die Höhe der PSS-Reservoir verbunden, der Zufluss Pipette49,50,51 , erhöhen Sie oder reduzieren Sie Intraluminal Druck. - Um die Rolle des Endothels bei der Vermittlung Schiff Reaktionen auf bestimmte Reize zu testen, entfernen Sie das vaskuläre Endothel und vergleichen Sie Schiff Reaktionen auf diese Reize in das Vorhandensein oder Fehlen des Endothels zu. Um das Endothel zu entfernen, die Arterie aus der Abfluss-Pipette vorsichtig lösen und das Lumen der Arterie mit einer Luft-Bolus langsam perfundieren (0,5-1,0 mL). Wiederherstellen Sie nach Luft Perfusion PSS Durchblutung um die Zelltrümmer zu löschen, bevor das Schiff zu den Abfluss Pipette43neu zu binden.
Hinweis: Nach dem Endothel Denudation Verfahren ist es wichtig zu überprüfen, ob das Endothel entfernt ist, durch die Prüfung vaskulärer Reaktionen auf ein Agonist (in der Regel ACh) bekannt, die Endothel-abhängige Vasodilatation in diesem Schiffstyp zu produzieren. Jedoch sind in bestimmten pathologischen Bedingungen Endothel-abhängige Vasokonstriktoren veröffentlicht, in welchem Fall ist es wichtig zu überprüfen, ob die Constrictor Antwort entfällt nach einer endothelialen Entfernung. - Am Ende des Experiments bestimmen den maximalen Durchmesser der Arterie durch Zugabe von Ca2 +-PSS Perfusat und Superfusate frei. Berechnen Sie aktiv ruhenden Ton (%) als ((Dmax-DRest) / dmax) x 100, wo Dmax ist der maximale Durchmesser im Beisein von Ca2 +-kostenlose Lösung und DRest ist der ruhende Kontrolle Durchmesser.
Hinweis: Durchmesser Messungen maximal entspannt Arterien in verschiedenen Versuchsgruppen sind wertvolle Vergleich aktiv ruhenden Ton, strukturelle Umgestaltung (d. h., Änderungen im Wand-Dicke und Lumen-Durchmesser) und passive mechanische Eigenschaften (Spannungs-Dehnungs-Beziehungen aus passiven Durchmesser auf verschiedenen Ebenen der Transmural Druck berechnet).
3. Bewertung der Cerebral Blood Flow Antworten mit LDF
- Betäuben Sie das Tier mit 5 % Isofluran zu und sichern Sie die Ratte in einer stereotaktischen Apparat9,10.
- Halten Sie das Tier unter konstanten Anästhesie während der Überwachung, Atemfrequenz, Ende Gezeiten-CO2und die Tiefe der Narkose mit einer Zehe Prise36.
- Sorgfältig dünne Schädel, Transluzenz mit einem Zahnbohrer niedriger Drehzahl und Mineralöl, optische Kopplung10bereitzustellen. Seien Sie vorsichtig, vermeiden übermäßigen Hitze erzeugen und zu vermeiden, den Knochen eindringen.
Hinweis: Ausdünnung des Schädels kann das Laserlicht, das darunter liegende Gewebe zu erreichen und zum die Sonde reflektiert werden, um die Dopplerverschiebung messen die Größe durch die Anzahl der beweglichen Teilchen (z.B. rote Blutkörperchen bestimmt wird) und Ihre Geschwindigkeit. - Sichern Sie die LDF-Sonde in einem Mikromanipulator und positionieren Sie es direkt über die ausgedünnte Bereich des Schädels. Während des Experiments ist es sehr wichtig, Bewegung der LDF-Sonde oder die Zubereitung selbst, zu verhindern, da die LDF zur Messung des Durchflusses in einem begrenzten Gebiet des Gewebes dient und extrem empfindlich gegenüber Bewegungsartefakte ist.
Hinweis: Jede Bewegung der Sonde Weg von seiner Ausgangsposition erhalten eine Schätzung des Blutflusses in einem anderen Bereich des Gewebes, Vergleiche ausschließt. Während LDF keine absolute Flow-Werten bietet und eignet sich nicht für den Vergleich zwischen Themen, ist es eine hervorragende Möglichkeit, nicht-invasiv Änderungen in Gewebedurchblutung in Reaktion auf experimentelle Interventionen in einzelnen Fächern zu bewerten; und relative Änderungen in LDF-Signal vom Control-Werte können im Durchschnitt und im Vergleich zu Änderungen in LDF-Signal von Kontrolle in anderen Versuchsgruppen.
Hinweis: LDF ist ein passender Ansatz Einblick in Faktoren Blutfluss auf der Ebene des gesamten vaskulären Bettes in verschiedenen Versuchsgruppen8,9,10zu regulieren. Bewertung der Gewebedurchblutung mit LDF bietet einen praktischen Ansatz um Erkenntnisse aus isolierten Behälter Studien relativiert eine ganze Bett zu assimilieren. Abgesehen von regionalen Unterschiede der vaskulären Kontrollmechanismen Widerstand Arterien und die Mikrozirkulation geben Messungen mit LDF Aufschluss über die Gewebe Blut der Steuerung des Datenflusses, die Ergebnisse, die mit in der Regel entspricht kanülierte Arterie Vorbereitungen.
4. Bewertung des skelettartigen Muskels kapilläre Dichte mit GS1 Lektin
- Entfernen des Cremaster-Muskels von einer männlichen Ratte durch schneiden den Hodensack mit standard feine chirurgische Schere geöffnet und dann mit einer Pinzette Dumont Nr. 5, um den Muskel zu erfassen.
Hinweis: Dünne Muskeln (z.B.der Cremaster-Muskel, sowie die m.digitorum Longus und m. Tibialis anterioren Streckmuskeln, die bei männlichen und weiblichen Ratten gefunden werden) für den Einsatz eignen sich ideal als Ganzes für Lektin Studien, steigt zwar histologischen Abschnitte können für dickere Gewebe verwendet werden. - Entfernen Sie den Cremaster-Muskel aus dem Hoden mit einem einzigen Schnitt. Legen sie im eiskalten PSS und Heften Sie es heraus in einer Petrischale mit einem Silikon-Elastomer-Futter auf dem Boden im inneren Oberfläche. Sanft zu necken Weg Bindegewebe mit Dumont Nr. 5 Pinzette.
- Spülen Sie die Muskel-Proben mit 2 mL gepufferten PSS und dann tauchen sie in Rhodamin beschriftet GS1 Lektin (20 µg/mL PSS) für 50 min. in einem 12-Well Kultur Zellplatte mit 2 mL/gut ist, eingewickelt in Alufolie, Licht auszuschließen.
- Das Gewebe aus der Lektin-Projektmappe entfernen, spülen Sie sie dreimal in PSS mit 5 min "waschen" Inkubationen auf einer Wippe, und klebe sie auf Objektträger. Achten Sie darauf, das Gewebe im Dunkeln inkubieren und speichern die Folien in der Dunkelheit, Verlust der Fluoreszenz zu verhindern.
Hinweis: Wenn die Folien sofort verwendet werden können, können sie in den Kühlschrank ohne Verlust der Fluoreszenz gehalten werden. Für längere Lagerung können die Folien in einer Tiefkühltruhe Verschlechterung11zu verhindern gehalten werden. - Bewerten Sie kapilläre Dichte durch zählen der Anzahl der Schnittpunkte von beschrifteten Mikrogefäßen mit Computer-generierten Rasterlinien überlagert Bild52oder mit einem klaren Raster-Overlay überlagert den Monitor verwendet wird, um die Folien anzeigen.
Hinweis: GS1 Lektin Ansätze verwendet wurden, um zu demonstrieren: Salz-induzierte mikrovaskuläre Verdünnung53, die schützende Wirkung von Salz zu verhindern induzierte Angiotensin-II-Unterdrückung bei der Wiederherstellung der kapilläre Dichte in Salz gefütterten Tiere17 ,53,54; die Rolle von NRF2 vermitteln die schützende Wirkung der niedrigen Dosis Angiotensin II Infusion kapilläre Verdünnung in Salz gefütterten Ratten17zu verhindern; und auch um die Rolle von Angiotensin II bei der Aufrechterhaltung der angiogenen Reaktionen auf chronische Muskelstimulation in Salz zugeführt Ratten54,55. Ein Vorteil der GS1-Lektin-Technik ist, dass es verwendet werden kann, kapilläre Dichte in die gleichen Tiere für Studien der kanülierte Widerstand Arterien oder LDF verwendet zu beurteilen.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
In-vitro- Mikroskopie der kanülierte Widerstand Arterien ermöglicht die Untersuchung von Einflussfaktoren auf aktive Ton in kleinen Widerstand Arterien (und größeren Arteriolen) bei normalen in Vivo Transmural drücken und bei fehlender parenchymatösen Zelle beeinflusst. Neben der Beurteilung der Reaktivität der Schiffe auf verschiedene gefäßerweiternde und vasokonstriktorische Reize und myogen Antworten auf Transmural Druck Erhebung im normalen PSS, die Ca2 +-kostenlose PSS Perfusat und Superfusate am Ende hinzugefügt werden können der Versuch, die maximale Schiffs Durchmesser und Wandstärke bestimmen. Diesen Messungen sind sehr wertvoll bei der Beurteilung der vaskulären Umbau, d. h., Änderungen in der Wand/Lumen-Verhältnis, das als Reaktion auf Änderungen im Blutdruck oder Verabreichung von pharmakologischen Wirkstoffen auftreten können. Messung des Durchmessers der maximal geweiteten Gefäße in Ca2 +-kostenlose PSS sind nützlich, um berechnen inneren Ton als ((Dmax-DRest) / dmax) x 100, wo Dmax und DRest das Maximum (Ca2 +- kostenlose PSS) und Durchmesser (PSS), bzw. bei Gleichgewichtherstellung Steuerdruck (in der Regel 80 MmHg für MCA) ruht. Nach unserer Erfahrung im Durchschnitt aktiv Ton in der MCA rund 40 % bei einem Transmural Druck von 80 MmHg. Messung des Durchmessers von maximal geweitete Arterien ist auch eine praktische Möglichkeit, die passive mechanischen Eigenschaften der Schiffe zu bewerten, durch Messung der Durchmesser der Arterien auf verschiedenen Ebenen der Transmural Appetithemmer Druck und unter Verwendung der Ergebnisse zu berechnen Sie Spannungs-Dehnungs-Beziehungen und andere mechanischen Eigenschaften der Schiffe7,56.
Abbildung 3 ist eine schematische Darstellung der drei verengten Congenic Stämme von SS.13Mrd Ratte unter Verwendung zusätzlicher Auslesezüchtung Ansätze abgeleitet. In diese Ratte-Stämme die chromosomalen Segmente sind entweder braun Norwegen Renin Allel (Ren1-BN) oder sind Cut-off-knapp über (Ren1-SSA) oder knapp (Ren1-SSB) Renin-gen-Locus (somit den Erhalt der SS Renin Allel). In dieser Studie29, der chromosomale Segment mit braun Norwegen Renin Allel enthalten nur 25 Gene.
Abbildung 4 zeigt die Reaktion auf die Endothel-abhängige gefäßerweiternde ACh (1 µM) in isolierten MCAs von männlichen Dahl SS Ratten und die drei verengte Congenic Stämme in Abbildung 3dargestellt. Kombinierte Verwendung dieser drei Congenic-Stämme, die entweder enthalten (Ren1-BN) oder oberhalb (Ren1-SSA) abgeschnitten werden oder unter (Ren1-SSB) der Renin-gen des Interessenbereichs (d.h. das Gebiet rund um den Renin-gen-Locus) auf ca. 25 Gene beschränkt. In diesen Experimenten, die Tiere waren normotonen und eine wenig Salz zugeführt (0,4 % NaCl) Diät. In dieser Studie29 Endothel-abhängige Dilatation, ACh war abwesend in der SS elterliche Belastung und in beide die Congenic Stämme, die Beibehaltung der SS Renin Allel, aber in der Congenic Belastung tragen das BN Renin Allel in der SS genetischen Hintergrund restauriert wurde. Die Ergebnisse dieser Studie unterstützt die Ergebnisse früherer Studien unter Verwendung SS.13BN Consomic Ratten57,58 und starke Hinweise, dass endothelialen Dysfunktion ist in SS Ratten, selbst wenn sie normotonen sind und eine salzarme Diät gefüttert. Zusammen, die Ergebnisse dieser Studien29,57,58 unterstützen der Hypothese, dass endothelialen Dysfunktion in SS Ratten ist aufgrund eingeschränkter Verordnung des Renin-Gens, wodurch chronische Exposition gegenüber niedrig Ebenen von Angiotensin II im Blut.
Eine andere Studie59, zusammengefasst in Abbildung 5, gegenüber der Reaktion auf die Endothel-abhängige gefäßerweiternde ACh in isolierten MCAs (MCA) von männlichen Dahl SS Ratten und SS.5BN Consomic Ratten Chromosom 5 (mit braun Norwegen Gene tragen für verschiedene Isoformen von Cytochrom P450-4A ω-Hydroxylase). In dieser Studie wurden die Tiere entweder eine wenig Salz gefüttert (0,4 % NaCl) oder hohen Salz (4 % NaCl) Diät. Im Gegensatz zu der MCA von SS Ratten wurde Endothel abhängige Dilatation, ACh MCA aus der SS.5BN Consomic Ratten salzarme Diät gehalten. Darüber hinaus (und im Gegensatz zu Ergebnissen von SS.13BN Consomic Ratten57,58, Sprague-Dawley Ratten33,39,40,60und Goldhamster 61), eine hohe salzarme Kost gescheitert, ACh-induzierte Dilatation in der SS.5BN -Ratten, die darauf hinweist, dass CYP450-4A ω-Hydroxylase zu beseitigen und 20-Hydroxyeicosatetraenoic Säure (20-HETE) sind wichtige Mitwirkende zu vaskulären oxidativen Stress und endotheliale Dysfunktion in SS Ratten und bei Erhebungen in diätetische Salzkonsum in anderen Stämmen. Aus Sicht der experimentellen das Scheitern der hohen salzarme Kost, Endothel-abhängige Dilatation, ACh zu beseitigen zeigt beispielhaft, wie Studien der kanülierte Widerstand Arterien unerwartete Ergebnisse produzieren können, die von konventionellen Weisheit abzuweichen und ein neues Verständnis von komplexen Kontrollmechanismen, die die Funktion dieser wichtigen Gefäße beeinträchtigen könnten.
Abbildung 6 zeigt die Reaktion des isolierten MCA, ACh (1 µM) in Wildtyp und Nrf2(- / -) Knockout Ratten gefüttert eine salzarme Diät (0,4 % NaCl), hohe Salz-Diät (4 % NaCl), oder eine hohe salzarme Kost mit einem bekannten NRF2 Aktivator30,62 . In Ermangelung einer Salz-induzierten oxidativen Stress ähnelte ACh-induzierte Dilatation in MCA von Wildtyp und Nrf2(- / -) Ko-Ratten. Einklang mit den Ergebnissen früherer Studien von Sprague-Dawley Ratten, beseitigt die hohen salzarme Kost ACh-induzierte Dilatation in Wildtyp und Nrf2(- / -) Ko-Ratten. Zugabe von NRF2-Induktor, der hohe salzarme Kost restauriert Endothel-abhängige Dilatation, ACh, bei den Wildtyp-Ratten, aber nicht in die Nrf2(- / -) Ratten, zeigen erfolgreiche Beseitigung von Nrf2 -gen in die Ko-Ratten, und Unterstützung des Einsatzes von NRF2 Up-Regler als therapeutischer Ansatz zur vaskulären oxidativen Stress zu lindern.
Abbildung 7 fasst die Ergebnisse der LDF Messungen vergleichen der Antworten der pial Mikrozirkulation auf progressive Senkung des arteriellen Blutdrucks produziert von aufeinanderfolgenden Blut Volumen Abhebungen in Sprague-Dawley Ratten entweder beibehalten ein normales Salz (0,4 % NaCl) Diät oder einem hohen Salz (4 % NaCl) Diät für vier Wochen. Im Gegensatz zu Ratten eine salzarme Diät Ratten gefüttert dem hohe salzarme Kost Exponat eine beeinträchtigte Fähigkeit, pflegen einen konstanten Blutfluss während der Rückgang der Perfusionsdruck, darauf hinweist, dass die Mechanismen für cerebral Blood Flow Selbstregelung verantwortlich sind beeinträchtigt durch die langfristige Exposition gegenüber einer hohen salzarme Kost. Die Ergebnisse dieser Experimente stehen im Einklang mit der Anwesenheit von beeinträchtigt vaskuläre Entspannung Mechanismen in isolierten Hirnarterien Salz gefütterten Ratten60 und bieten ein gutes Beispiel dafür, wie LDF Messungen eingesetzt werden können, zu unterstützen und erweitern die Ergebnisse von Studien mit isolierten Widerstand Arterien auf das Niveau des gesamten vaskulären Bettes.
Neben der Auswertung Widerstand Arterie Funktion Verwendung von isolierten Arterien und Gewebedurchblutung mittels Laser-Doppler-Flowmetry, die kapilläre Dichte und angiogenen Reaktionen auf verschiedene Reize wie z. B. chronischen Muskel Stimulation54, 55 kann ausgewertet werden, in die gleichen Tiere nutzen Eindringmittel beschriftet GS1 Lectin, das selektiv an Glykoprotein Moieties in der Basalmembran der Arteriolen und Kapillaren bindet. Abbildung 8 zeigt typische Lektin Färbung in der Cremaster-Muskel von Sprague-Dawley Ratten eine salzarme Kost oder hohe salzarme Kost für 2 Wochen (man beachte die geringere Dichte von Mikrogefäßen im hohen Salz gefütterten Ratten). Kapilläre Dichte bemisst sich durch die Schnittpunkte der Lektin-Label Mikrogefäßen mit einer computergenerierten Referenz Raster52zählen und bietet eine hervorragende Methode um angiogenen Antworten54,55 zu bewerten oder zu Erkennung und Quantifizierung des Verlust von Mikrogefäßen bei Erkrankungen wie Bluthochdruck und erhöhte diätetische Salzkonsum12,17,53.

Abbildung 1: In-vitro- Videomikroskopie Einrichtung beschäftigt, isoliert, kanülierte Widerstand Arterien (A) zu studieren. Kanülierte Widerstand Arterie gebunden an Glas Mikropipetten (B) und video Mikrometer Anzeige Messung des Durchmessers der Lumen in kanülierte Widerstand Arterie (C). Maßstabsleiste im Diagramm B repräsentiert den Innendurchmesser der kanülierte Arterie (µm) und 125 µm im Panel C ist die Videoanzeige des Abstandes zwischen den beweglichen Referenzlinien platziert manuell an den Innenwänden der Arterie durch den Betrachter, die Durchführung des Experiments . Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2: Schematische Darstellung des Verfahrens zur Isolierung der mittleren zerebralen Arterie aus dem Gehirn und Kanülierung mit den Mikropipetten vorbereiten. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 3: Schematische Darstellung der verengten Congenic Ratte Stämme mit kleinen Segmenten von Braun Norwegen Chromosom 13 Introgressed in den Dahl Salz sensiblen genetischen Hintergrund. Chromosomalen Segmente enthalten das Braun Norwegen Renin Allel (Ren1-BN) oder oberhalb (Ren1-SSA) abgeschnitten oder knapp unter (Ren1-SSB) Renin-gen-Locus und damit das SS Renin Allel. Diese Zahl wurde modifiziert und nachgedruckt von Durand Et al. 29 mit freundlicher Genehmigung von der American Physiological Society. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 4: Antwort von isolierten, kanülierte MCAs SS Ratten und Congenic Ratte Stämme (siehe Abbildung 2), 1 µM Acetylcholin. Daten werden als mittlere Durchmesser ändern (Δ µm) ±SEM von Ruhestellung Kontrolle Durchmesser vor dem Acetylcholin ausgedrückt und sind von einer Originalarbeit von Durand Et Al. replotted 29 Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 5: Antwort von isolierten, kanülierte MCAs SS Ratten und SS.5BN Consomic Ratten auf 1 µM Acetylcholin bei Tieren gefüttert wenig Salz (0,4 % NaCl) oder hohen Salz (4 % NaCl) Diät. Daten werden als mittlere Durchmesser ändern (Δ µm) ±SEM von Ruhestellung Kontrolle Durchmesser vor dem Acetylcholin ausgedrückt und sind von einer Originalarbeit von Lukaszewicz Et Al. replotted 64 Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 6: Antwort auf 1 µM Acetylcholin in isolierten, kanülierte MCAs von Nrf2(- / -) Ko-Ratten und Wildtyp-Steuerelemente gefüttert salzarme Kost (0,4 % NaCl), hohe Salz-Diät (4 % NaCl), oder hohe salzarme Kost mit einem bekannten NRF2-Aktivator30, 62. Daten werden als mittlere Durchmesser ändern (Δ µm) ±SEM von Ruhestellung Kontrolle Durchmesser vor dem Acetylcholin ausgedrückt. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 7: Zerebrale Blutfluss in die pial Mikrozirkulation von LDF bewertet. Sprague-Dawley Ratten gepflegt auf einem hohen salzarme Kost für vier Wochen stellte eine erhebliche Beeinträchtigung in ihrer Fähigkeit, Blut fließen konstant zu halten, wie arterieller Blutdruck als Reaktion auf aufeinanderfolgenden Blut Volumen Auszahlungen reduziert wurde. Daten sind als Mittelwert Prozent der Kontrolle ±SEM geplottet * p < 0,05 vs. salzarme Kost gleichzeitig arterielle Mitteldruck. Bitte klicken Sie hier für eine größere Version dieser Figur.
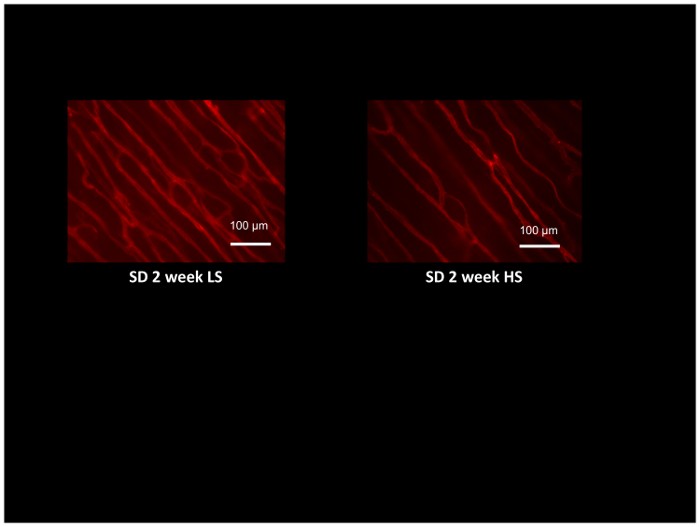
Abbildung 8: Schliffbild der Ratte Cremaster Muskeln beschriftet mit Rhodamin beschriftet GS1 Lektin, Arteriolen und Kapillaren zur Beurteilung der kapilläre Dichte zu identifizieren. Cremaster Muskeln stammen aus Sprague-Dawley Ratten wenig Salz (LS; 0,4 % NaCl) "oder" hoch Salz (HS:4 % NaCl) Ernährung für 2 Wochen, und mikrovaskuläre Verdünnung in den HS-gefütterten Tieren im Vergleich zu LS Kontrollen zu demonstrieren. Maßstabsleiste = 100 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Wie in der Einleitung erwähnt, dieses Paper beschreibt die Verwendung von Fernsehen Mikroskopie und isolierten Widerstand Arterie Ansätze zur Bewertung der Gefäßfunktion nicht nur in standard Ratte-Modellen (wie im Video), aber auch in hochspezialisierten genetisch veränderter Ratte Stämme, die zeigen, das neuartige und leistungsfähige Einsichten, die unter Verwendung dieser Ansätze gewonnen werden können. Die Verwendung dieser leistungsfähigen Techniken, aktive Ton zu bewerten und passiv mechanischen Eigenschaften des kleinen Widerstand Arterien liefern wichtige Informationen über ein breites Spektrum des vaskulären Kontrollmechanismen einschließlich der Endothel-abhängigen Regulierung der aktive Ton in Widerstand Arterien vaskulären glatten Muskelzellen Funktion unter normalen und pathophysiologischen Bedingungen und passive Eigenschaften der Arterien im Zusammenhang mit vaskulären remodeling und ändert sich in der Gefäßwand Mechanik. Endothelialen Dysfunktion hat gezeigt, dass ein leistungsfähiges prognostische Indikator für mehrere kardiovaskuläre Nebenwirkungen beim Menschen, die unter anderem im Zusammenhang mit Herz-Kreislauf-Tod63und kanülierte Widerstand Arterie Vorbereitungen sind besonders wertvoll in Erkennung von endothelialen Dysfunktion und erhöht unser Verständnis der Mechanismen der endothelialen Dysfunktion.
Um die Wirksamkeit von in-vitro- Videomikroskopie Techniken mit isolierten Widerstand Arterien zu veranschaulichen, haben wir Beispiele für die Verwendung dieser Techniken in Dahl Salz empfindlich (SS) Ratten und neuartige Consomic Ratte-Stämme, die eine reduzierte aufweisen Salz Empfindlichkeit der Blutdruck im Vergleich zu den SS elterlichen Belastung24. Diese Studien untersucht vaskulären Kontrollmechanismen im Zusammenhang mit Genen auf beiden Chromosomen, die in einen Beitrag zu Salz Empfindlichkeit des Blutdruckes und vaskuläre Veränderungen in der SS Ratte von besonderem Interesse sind. Diese Chromosomen sind Chromosom 13, tragen die Renin gen18,22,29,57,58, und Chromosom 5, mit Genen für Isoformen von CYP450-4A ω-Hydroxylase64 ,65— das Enzym, das 20-HETE, synthetisiert hat große Auswirkungen auf die Nierenfunktion und vaskuläre Reaktivität66,67,68. Eine weitere aktuelle und leistungsfähige Ergänzung zur Ratte genetische Toolbox ist die Entwicklung von Ratte gen Knockout Modelle nutzen fortschrittliche gen Schnitttechniken einschließlich: ZFN; transcriptional Aktivator-artigen-Effektor Nukleasen (TALENS), und zuletzt CRISPR-Cas913,14,15,16,17. In-vitro- Videomikroskopie nutzen diese Techniken um isolierte MCAs aus einem Nrf2(- / -) Ko-Rattenmodell zu studieren, die die entscheidenden antioxidative und Zelle schützenden Transkriptionsfaktor NRF2, fehlen wichtige bereitgestellt hat und bisher unbekannte Einblicke in die Mechanismen der Salz-induzierten endothelialen Dysfunktion in Ermangelung einer erhöhten Blut Druck17. Konkrete Ergebnisse der Experimente, die unter Verwendung dieser speziellen Ratte-Modelle werden in einer Reihe von früheren Berichte17,29,57,58,59, beschrieben. 60 , 64 , 65 .
Obwohl klar ist, dass Studien isoliert, kanülierte Widerstand Arterien in das Verständnis der Mechanismen zur Regulierung der Funktion dieser kritisch wichtige Schiffe unter verschiedensten Bedingungen extrem wertvoll sind, es ist sehr wichtig zur Ausübung einer Reihe von Vorkehrungen um sicherzustellen, dass genaue und zuverlässige Ergebnisse erzielt werden. Während Hirnarterien und Widerstand Arterien von vielen anderen vaskulären Betten innere Ton aufweisen, müssen einige Arterien (insbesondere mesenterialen Widerstand Arterien) mit Vasokonstriktoren wie Noradrenalin vorab vergeben werden um Antworten zu bewerten gefäßerweiternde Reize, und mehr genau simulieren in Vivo Bedingungen, wo die Schiffe unter dem Einfluss von neuronalen und humorale vasokonstriktorische Reize wie Noradrenalin aus adrenergen Nervenenden freigesetzt werden. Als solche, es ist wichtig, vertraut mit den grundlegenden Eigenschaften der Arterien untersucht werden, entweder aus der Literatur oder aus Vorversuchen sorgfältig durchgeführt. Weil das Endothel eine wichtige Rolle spielt bei der Regulierung der großen Arterien, kleinen Arterien und Arteriolen in der Mikrozirkulation, gilt es vorsichtig zu beschädigen das Endothel in Isolation und Kanülierung der Arterie. Der klassische Test für Endothel Integrität ist der Beweis, dass ACh Gefäß Dilatation verursacht. Ein Nachteil ist, dass unter Bedingungen des oxidativen Stresses, das Endothel Schiff intakt sein kann, aber Vasodilatation, ACh fehlt weil hohe Mengen an Superoxid die Stickoxid verhindert die gefäßerweiternde Reaktion abzufangen. In diesen Fällen kann endothelialer Integrität überprüft werden, durch die Wiederholung der ACh-Anwendungdes in der Gegenwart eine Superoxid-Schnitzeljagd wie Tempol, die Vasodilatation ACh und andere Reize der Endothel-abhängigen gefäßerweiternde wiederhergestellt werden soll. Auch kann in einer Reihe von pathologischen Zuständen des Endothels Substanzen freigeben, die Kontraktion von vaskulären glatten Muskelzellen und Verengung der Arterie führen; und in einigen Fällen Endothel-abhängige Dilatation (oder Einengung) über andere Substanzen wie Cyclooxygenase Metaboliten, H2O2, Epoxygenase Metaboliten usw.vermittelt wird. Der klassische Test für ein Endothel-abhängige gefäßerweiternde oder Vasokonstriktor Stoff soll zeigen, dass die Erweiterung oder Verengung der Arterie durch Endothelzellen entfernen entfällt. Schließlich kann die Identität verschiedener Endothel-abhängige gefäßerweiternde und vasokonstriktorische Substanzen in der Regel durch die Gabe von spezifischen Inhibitoren oder Radikalfänger, wie L-NAME, Stickoxid-Synthase, Indometacin, hemmen hemmen ermittelt werden die Bildung von Cyclooxygenase Metaboliten, Katalase, H2O2, Thromboxan-Synthase-Hemmer, Epoxygenase-Inhibitoren und/oder Antagonisten des CYP450-4A/20-HETE-Signalwegs aufräumen.
Es ist auch wichtig (und lehrreich) um zu quantifizieren die Menge der aktiven Ton am Ende des Experiments durch Vorrichtung und superfusing die Arterie mit einer Ca2 +-freie PSS, oder verwalten Sie eine maximale Dosis von einem mächtigen gefäßerweiternde Mittel wie Papaverine. Ein typisches Maß an aktiven ruhen Ton in der MCA, als ((Dmax-DRest) / dmax) berechnete X 100 ist ungefähr 40 %, wo Dmax und DRest das Maximum (Ca2 +-kostenlose PSS) und Durchmesser (PSS), bzw. bei der Kontrolle Gleichgewichtherstellung Druck (in der Regel 80 MmHg für MCA). Schiffe mit wesentlich weniger aktiv Ton oder Arterien zeigen segmentale Verengungen oder Streckungen sind von der Analyse ausgeschlossen sowie jene Zeichen bezeichnend für Trauma zu den Gefäßen. Messung der Durchmesser maximal geweitete Arterien in Ca2 +-freie Lösung ermöglicht auch die Ermittler, die passive mechanischen Eigenschaften der Schiffe durch Messung arteriellen Durchmesser und Berechnung des Spannungs-Dehnungs-Beziehungen zu bewerten während sequenzielle Höhen Transmural Druckerhöhung im maximal geweiteten Gefäße7,56. Diese passive Spannungs-Dehnungs-Beziehungen sind leicht zu erhalten und bieten einen wertvollen Hinweis auf Änderungen der mechanischen Eigenschaften der Schiffe.
Sauberkeit der Pipetten, Anschlüsse und Schläuche liefern die Stauseen ist absolut entscheidend für erfolgreiche Experimente. In diesem Zusammenhang ist es wichtig, alle Lösungen aus dem Schlauch zu spülen, nachdem das Experiment abgeschlossen ist, und zum Spülen und reinigen Sie das Gewebe Bad, der Lieferung Schlauch und alle Behälter zur Speicherung, warm, und Gas-equilibrate PSS vor Erreichen des Schiffes Kammer. Hähne und Ventile im Liefersystem sollte ebenfalls gereinigt und in regelmäßigen Abständen geändert werden, da Schläuche PSS tragen sollte. Ein klassischen Zeichen von kontaminierten Schläuche ist einen grauen Dunst von Schimmel und Bakterien erzeugt; und diese Veränderungen werden begleitet durch Verlust der normalen Reaktivität der Blutgefäße durch Substanzen, die durch die bakterielle Kontamination. Kontamination durch Bakterien und andere Mikroorganismen kann jedoch immer noch ohne irgendwelche sichtbaren Anzeichen vorhanden.
Wir glauben, dass der vorliegende Beitrag bietet ein hilfreiche Beispiel für den Einsatz von bewährten Techniken, die besonders geeignet für Studien der so wichtigen kleinen Widerstand Arterien der verschiedenen vaskulären Betten sind. In Kombination mit Standardmethoden für die Bewertung der Gewebedurchblutung, wie LDF und der GS1-Lektin-Methode zur Bewertung der kapilläre Dichte, in-vitro- Videomikroskopie kanülierte Widerstand Arterien bietet äußerst wertvolle Einblicke in die Faktoren, die Gewebedurchblutung und wie diese bei Krankheitszuständen verändert werden können. Neben der Bereitstellung ein mächtiges Mittel, um grundlegende Mechanismen der vaskulären glatten Muskelzellen und endotheliale Funktion im standard Ratte Modelle zu studieren, kann der Einsatz von video-Mikroskopie, individuelle Widerstand Arterien zu studieren um anderen Tiermodellen und angewendet werden menschlichen Widerstand Arterien. Die Anwendung der Videomikroskopie der isolierten Widerstand Arterien Roman gentechnisch Ratte Modelle öffnet neue Türen für das Verständnis der phänotypischer Veränderungen, die als Reaktion auf veränderte Funktion einer Vielzahl (und immer größer werdende Liste) von Genen auftreten.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Die Autoren haben keinen finanziellen Interessenkonflikt.
Acknowledgments
Die Autoren äußern ihren aufrichtigen Dank Katie Fink und Lynn Dondlinger für ihre unschätzbare Hilfe bei der Vorbereitung dieser Handschrift.
Zuschuss: NIH #R21-OD018309; #R56-HL065289; und #R01-HL128242.
Materials
| Name | Company | Catalog Number | Comments |
| SS Rat | Medical College of Wisconsin | SS/JHsd/Mcwi strain | Contact Dr. Aron Geurts (ageurts@mcw.edu) |
| SS.5BN Consomic Rat | Medical College of Wisconsin | SS-Chr 5BN/Mcwi strain | Contact Dr. Aron Geurts (ageurts@mcw.edu) |
| SS.13BN Consomic Rat | Medical College of Wisconsin | SS-Chr 13BN/Mcwi strain | Contact Dr. Aron Geurts (ageurts@mcw.edu) |
| Ren1-BN Congenic Rat | Medical College of Wisconsin | SS.BN-(D13hmgc41-D13)hmgc23/Mcwi strain | Contact Dr. Aron Geurts (ageurts@mcw.edu) |
| Ren1-SSA Congenic Rat | Medical College of Wisconsin | SS.BN-(D13rat77-D13rat105/Mcwi strain | Contact Dr. Aron Geurts (ageurts@mcw.edu) |
| Ren1-SSB Congenic Rat | Medical College of Wisconsin | SS.BN-(D13rat124-D13rat101/Mcwi strain | Contact Dr. Aron Geurts (ageurts@mcw.edu) |
| Nrf2(-/-) Knockout Rat and Wild Type Littermates | Medical College of Wisconsin | SD-Nfe212em1Mcwi strain | Contact Dr. Aron Geurts (ageurts@mcw.edu) |
| Low Salt Rat Chow (0.4% NaCl)-AIN-76A | Dyets, Inc. | 113755 | |
| High Salt Rat Chow (4% NaCl)-AIN-76A | Dyets, Inc. | 113756 | |
| Colorado Video Caliper | Colorado Video, Inc. | Model 308 | |
| Video Camera | Hitachi | KPM1AN | |
| Microscope | Olympus Life Science | CKX41 | |
| Television Monitor | Panasonic | WVBM1410 | |
| Pressure Transducers | Stoelting | 56360 | |
| Blood Pressure Display Unit | Stoelting | 50115 | |
| Cannulated Artery Chamber | Living Systems Instrumentation | CH-1 | Single vessel chamber for general use |
| Temperature Controller for Single Chamber | Living Systems Instrumentation | TC-09S | |
| Gas Dispersion Tube, Miniature,Straight | Living Systems Instrumentation | GD-MS | Provides aeration in the vessel bath |
| Gas Exchange Oxygenator, Miniature | Living Systems Instrumentation | OX | Allows gas exchange with perfusate |
| Laser-Doppler Flowmeter | Perimed | PeriFlux 5000 LDPM | |
| GS1 Lectin | Vector Labs | RL-1102 | |
| Glass Capillary Tubes for Micropipettes | Fredrich Haer Co. | 27-33-1 | 2 mm ODX1 mm ID |
| Verticle Pipette Puller | David Kopf Instruments | Model 700C | |
| Nylon suture material (10/0)-3 PLY | Ashaway Line and Twine Manufacturing Co. | 114-ANM-10 | Single strands of 3 ply nylon suture teased out for use on vessels |
| Dumont #5 Forceps-Inox | Fine Science Tools | 11254-20 | |
| Vannas Scissors | Fine Science Tools | 15003-08 | |
| Protandim | Protandim | NRF2 Inducer: Contact Dr. Joe McCord (JOE.MCCORD@UCDENVER.EDU) | |
| Sodium Chloride | Fisher Bioreagents | BP358-212 | |
| Sodium Bicarbonate | Fisher Chemical | S233-3 | |
| Dextrose (d-glucose) anhydrous | Fisher Chemical | D16-500 | |
| Magnesium Sulfate (MgSO4-7H2O) | Sigma Aldrich | M1880-500 G | |
| Calcium Chloride (CaCl2-2 H2O) | Sigma | C5080-500G | |
| Sodium Phosphate-Monobasic (NaH2PO4) | Sigma | S0751-500G | |
| Potassium Chloride (KCl) | Fisher Chemical | P217-500G | |
| Ethylenediaminetetraacetic acid disodium salt dihydrate (EDTA) | Sigma | ED255-500G |
References
- Furchgott, R. F., Zawadzki, J. V. The obligatory role of endothelial cells in the relaxation of arterial smooth muscle by acetylcholine. Nature. 288, 373-376 (1980).
- Bevan, J. A., Osher, J. V. A direct method for recording tension changes in the wall of small blood vessels in vitro. Agents Actions. 2, 257-260 (1972).
- Mulvany, M. J., Halpern, W. Contractile properties of small arterial resistance vessels in spontaneously hypertensive and normotensive rats. Circ. Res. 41, 19-26 (1977).
- Speden, R. N. The use of excised, pressurized blood vessels to study the physiology of vascular smooth muscle. Experientia. 41, 1026-1028 (1985).
- Osol, G., Halpern, W. Myogenic properties of cerebral blood vessels from normotensive and hypertensive rats. Am. J. Physiol. 249, H914-H921 (1985).
- Halpern, W., Kelley, M. In vitro methodology for resistance arteries. Blood Vessels. 28, 245-251 (1991).
- Feihl, F., Liaudet, L., Waeber, B. The macrocirculation and microcirculation of hypertension. Curr Hypertens Rep. 11, 182-189 (2009).
- Smits, G. J., Roman, R. J., Lombard, J. H. Evaluation of laser-Doppler flowmetry as a measure of tissue blood flow. J Appl Physiol. 61, 666-672 (1985).
- Hudetz, A. G., Roman, R. J., Harder, D. R. Spontaneous flow oscillations in the cerebral cortex during acute changes in mean arterial pressure. J Cereb Blood Flow Metab. 12, 491-499 (1992).
- Hudetz, A. G., Smith, J. J., Lee, J. G., Bosnjak, Z. J., Kampine, J. P. Modification of cerebral laser-Doppler flow oscillations by halothane, PCO2, and nitric oxide synthase blockade. Am J Physiol. 269, H114-H120 (1995).
- Hansen-Smith, F. M., Watson, L., Lu, D. Y., Goldstein, I. Griffonia simplicifolia I: fluorescent tracer for microcirculatory vessels in nonperfused thin muscles and sectioned muscle. Microvasc Res. 36, 199-215 (1988).
- Greene, A. S., Lombard, J. H., Cowley, A. W., Hansen-Smith, F. M. Microvessel changes in hypertension measured by Griffonia simplicifolia I lectin. Hypertension. 15, 779-783 (1990).
- Aitman, T., Dhillon, P., Geurts, A. M. A RATional choice for translational research? Dis Model Mech. 9, 1069-1072 (2016).
- Geurts, A. M., et al. Knockout rats via embryo microinjection of zinc-finger nucleases. Science. 325, 433 (2009).
- Geurts, A. M., et al. Generation of gene-specific mutated rats using zinc-finger nucleases. Methods Mol Biol. 597, 211-225 (2010).
- Geurts, A. M., Moreno, C. Zinc-finger nucleases: new strategies to target the rat genome. Clin Sci (Lond). 119, 303-311 (2010).
- Priestley, J. R., Kautenburg, K. E., Casati, M. C., Endres, B. T., Geurts, A. M., Lombard, J. H. The NRF2 knockout rat: a new animal model to study endothelial dysfunction, oxidant stress, and microvascular rarefaction. Am J Physiol Heart Circ Physiol. 310, H478-H487 (2016).
- Cowley, A. W., et al. Brown Norway chromosome 13 confers protection from high salt to consomic Dahl S rat. Hypertension. 37, 456-461 (2001).
- Rapp, J. P. Dahl salt-susceptible and salt-resistant rats. A review. Hypertension. 4, 753-763 (1982).
- Rapp, J. P., Wang, S. M., Dene, H. A genetic polymorphism in the renin gene of Dahl rats cosegregates with blood pressure. Science. 243, 542-544 (1989).
- Manning, R. D. Jr, Meng, S., Tian, N. Renal and vascular oxidative stress and salt-sensitivity of arterial pressure. Acta Physiol Scand. 179, 243-250 (2003).
- Moreno, C., et al. Multiple blood pressure loci on rat chromosome 13 attenuate development of hypertension in the Dahl S hypertensive rat. Physiol Genomics. 31, 228-235 (2007).
- Tobian, L., Lange, J., Iwai, J., Hiller, K., Johnson, M. A., Goossens, P. Prevention with thiazide of NaCl-induced hypertension in Dahl "S" rats. Evidence for a Na-retaining humoral agent in "S" rats. Hypertension. 1, 316-323 (1979).
- Mattson, D. L., et al. Chromosome substitution reveals the genetic basis of Dahl salt-sensitive hypertension and renal disease. Am J Physiol Renal Physiol. 295, F837-F842 (2008).
- Kunert, M. P., et al. Consomic strategies to localize genomic regions related to vascular reactivity in the Dahl salt-sensitive rat. Physiol Genomics. 26, 218-225 (2006).
- Cowley, A. W., Liang, M., Roman, R. J., Greene, A. S., Jacob, H. J. Consomic rat model systems for physiological genomics. Acta Physiol Scand. 181, 585-592 (2004).
- Kunert, M. P., Dwinell, M. R., Lombard, J. H. Vascular responses in aortic rings of a consomic rat panel derived from the Fawn Hooded Hypertensive strain. Physiol Genomics. 42A, 244-258 (2010).
- Liang, M., et al. Renal medullary genes in salt-sensitive hypertension: a chromosomal substitution and cDNA microarray study. Physiol Genomics. 8, 139-149 (2002).
- Durand, M. J., Moreno, C., Greene, A. S., Lombard, J. H. Impaired relaxation of cerebral arteries in the absence of elevated salt intake in normotensive congenic rats carrying the Dahl salt-sensitive renin gene. Am J Physiol Heart Circ Physiol. 299, H1865-H1874 (2010).
- Hybertson, B. M., Gao, B., Bose, S. K., McCord, J. M. Oxidative stress in health and disease: the therapeutic potential of Nrf2 activation. Mol Aspects Med. 32, 234-246 (2011).
- Itoh, K., et al. An Nrf2/small Maf heterodimer mediates the induction of phase II detoxifying enzyme genes through antioxidant response elements. Biochem Biophys Res Commun. 236, 313-322 (1997).
- Myung, S. K., et al. Efficacy of vitamin and antioxidant supplements in prevention of cardiovascular disease: systematic review and meta-analysis of randomised controlled trials. BMJ. 346, f10 (2013).
- Fredricks, K. T., Liu, Y., Lombard, J. H. Response of extraparenchymal resistance arteries of rat skeletal muscle to reduced PO2. Am J Physiol. 267, H706-H715 (1994).
- Fredricks, K. T., Liu, Y., Rusch, N. J., Lombard, J. H. Role of endothelium and arterial K+ channels in mediating hypoxic dilation of middle cerebral arteries. Am J Physiol. 267, H580-H586 (1994).
- Frisbee, J. C., Maier, K. G., Falck, J. R., Roman, R. J., Lombard, J. H. Integration of hypoxic dilation signaling pathways for skeletal muscle resistance arteries. Am J Physiol Regul Integr Comp Physiol. 283, R309-R319 (2002).
- Pavlov, T. S., Ilatovskaya, D. V., Palygin, O., Levchenko, V., Pochynyuk, O., Staruschenko, A. Implementing Patch Clamp and Live Fluorescence Microscopy to Monitor Functional Properties of Freshly Isolated PKD Epithelium. J Vis Exp. (103), (2015).
- Nelson, M. T., Conway, M. A., Knot, H. J., Brayden, J. E. Chloride channel blockers inhibit myogenic tone in rat cerebral arteries. J Physiol. 502 (Pt 2), 259-264 (1997).
- Brayden, J. E., Halpern, W., Brann, L. R. Biochemical and mechanical properties of resistance arteries from normotensive and hypertensive rats. Hypertension. 5, 17-25 (1983).
- Weber, D. S., Lombard, J. H. Elevated salt intake impairs dilation of rat skeletal muscle resistance arteries via ANG II suppression. Am J Physiol Heart Circ Physiol. 278, H500-H506 (2000).
- Weber, D. S., Lombard, J. H. Angiotensin II AT1 receptors preserve vasodilator reactivity in skeletal muscle resistance arteries. Am J Physiol Heart Circ Physiol. 280, H2196-H2202 (2001).
- Wang, J., Roman, R. J., Falck, J. R., de la Cruz, L., Lombard, J. H. Effects of high-salt diet on CYP450-4A omega-hydroxylase expression and active tone in mesenteric resistance arteries. Am J Physiol Heart Circ Physiol. 288, H1557-H1565 (2005).
- Raffai, G., et al. Modulation by cytochrome P450-4A omega-hydroxylase enzymes of adrenergic vasoconstriction and response to reduced PO2 in mesenteric resistance arteries of Dahl salt-sensitive rats. Microcirculation. 17, 525-535 (2010).
- Mishra, R. C., Wulff, H., Hill, M. A., Braun, A. P. Inhibition of Myogenic Tone in Rat Cremaster and Cerebral Arteries by SKA-31, an Activator of Endothelial KCa2.3 and KCa3.1 Channels. J Cardiovasc Pharmacol. 66, 118-127 (2015).
- Freed, J. K., Beyer, A. M., LoGiudice, J. A., Hockenberry, J. C., Gutterman, D. D. Ceramide changes the mediator of flow-induced vasodilation from nitric oxide to hydrogen peroxide in the human microcirculation. Circ Res. 115, 525-532 (2014).
- Beyer, A. M., Durand, M. J., Hockenberry, J., Gamblin, T. C., Phillips, S. A., Gutterman, D. D. An acute rise in intraluminal pressure shifts the mediator of flow-mediated dilation from nitric oxide to hydrogen peroxide in human arterioles. Am J Physiol Heart Circ Physiol. 307, H1587-H1593 (2014).
- Durand, M. J., et al. Vascular actions of angiotensin 1-7 in the human microcirculation: novel role for telomerase. Arterioscler Thromb Vasc Biol. 36, 1254-1262 (2016).
- Beyer, A. M., et al. Transition in the mechanism of flow-mediated dilation with aging and development of coronary artery disease. Basic Res Cardiol. 112, 5 (2017).
- Muller, J. M., Chilian, W. M., Davis, M. J. Integrin signaling transduces shear stress--dependent vasodilation of coronary arterioles. Circ Res. 80, 320-326 (1997).
- Liu, Y., Harder, D. R., Lombard, J. H. Interaction of myogenic mechanisms and hypoxic dilation in rat middle cerebral arteries. Am J Physiol Heart Circ Physiol. 283, H2276-H2281 (2002).
- Potocnik, S. J., et al. Endothelium-dependent vasodilation in myogenically active mouse skeletal muscle arterioles: role of EDH and K+ channels. Microcirculation. 16, 377-390 (2009).
- Harder, D. R. Pressure-dependent membrane depolarization in cat middle cerebral artery. Circ Res. 55, 197-202 (1984).
- Greene, A. S., Rieder, M. J. Measurement of vascular density. Methods Mol. Med. 51, 489-496 (2001).
- Hernandez, I., Cowley, A. W., Lombard, J. H., Greene, A. S. Salt intake and angiotensin II alter microvessel density in the cremaster muscle of normal rats. Am J Physiol. 263, H664-H667 (1992).
- Resende, M. M., Amaral, S. L., Moreno, C., Greene, A. S. Congenic strains reveal the effect of the renin gene on skeletal muscle angiogenesis induced by electrical stimulation. Physiol Genomics. 33, 33-40 (2008).
- Petersen, M. C., Munzenmaier, D. H., Greene, A. S. Angiotensin II infusion restores stimulated angiogenesis in the skeletal muscle of rats on a high-salt diet. Am J Physiol Heart Circ Physiol. 291, H114-H120 (2006).
- Frisbee, J. C., Weber, D. S., Liu, Y., DeBruin, J. A., Lombard, J. H. Altered structure and mechanics of skeletal muscle arteries with high-salt diet and reduced renal mass hypertension. Microvasc Res. 59, 323-328 (2000).
- Drenjancevic-Peric, I., Lombard, J. H. Introgression of chromosome 13 in Dahl salt-sensitive genetic background restores cerebral vascular relaxation. Am J Physiol Heart Circ Physiol. 287, H957-H962 (2004).
- Drenjancevic-Peric, I., Phillips, S. A., Falck, J. R., Lombard, J. H. Restoration of normal vascular relaxation mechanisms in cerebral arteries by chromosomal substitution in consomic SS.13BN rats. Am J Physiol Heart Circ Physiol. 289, H188-H195 (2005).
- Lukaszewicz, K. M., Paudyal, M. P., Falck, J. R., Lombard, J. H. Role of vascular reactive oxygen species in regulating cytochrome P450-4A enzyme expression in Dahl salt-sensitive rats. Microcirculation. 23, 540-548 (2016).
- Lombard, J. H., Sylvester, F. A., Phillips, S. A., Frisbee, J. C. High-salt diet impairs vascular relaxation mechanisms in rat middle cerebral arteries. Am J Physiol Heart Circ Physiol. 284, H1124-H1133 (2003).
- Priestley, J. R., et al. Reduced angiotensin II levels cause generalized vascular dysfunction via oxidant stress in hamster cheek pouch arterioles. Microvasc Res. 89, 134-145 (2013).
- Velmurugan, K., Alam, J., McCord, J. M., Pugazhenthi, S. Synergistic induction of heme oxygenase-1 by the components of the antioxidant supplement Protandim. Free Radic Biol Med. 46, 430-440 (2009).
- Widlansky, M. E., Gokce, N., Keaney, J. F., Vita, J. A. The clinical implications of endothelial dysfunction. J Am Coll Cardiol. 42, 1149-1160 (2003).
- Lukaszewicz, K. M., Falck, J. R., Manthati, V. L., Lombard, J. H. Introgression of Brown Norway CYP4A genes on to the Dahl salt-sensitive background restores vascular function in SS-5BN consomic rats. Clin Sci (Lond). 124, 333-342 (2013).
- Lukaszewicz, K. M., Lombard, J. H. Role of the CYP4A/20-HETE pathway in vascular dysfunction of the Dahl salt-sensitive rat. Clin Sci (Lond). 124, 695-700 (2013).
- Roman, R. J. P-450 metabolites of arachidonic acid in the control of cardiovascular function. Physiol Rev. 82, 131-185 (2002).
- Roman, R. J., Maier, K. G., Sun, C. W., Harder, D. R., Alonso-Galicia, M. Renal and cardiovascular actions of 20-hydroxyeicosatetraenoic acid and epoxyeicosatrienoic acids. Clin Exp Pharmacol. 27, 855-865 (2000).
- Roman, R. J., Alonso-Galicia, M. P-450 eicosanoids: A novel signaling pathway regulating renal function. News Physiol Sci. 14, 238-242 (1999).



