Summary
Un protocole de dépistage efficace est présenté pour l’identification de petites molécules qui favorisent la différenciation astroglials dans les cellules souches glioblastome (CSS). L’analyse est basée sur un journaliste de différenciation de cellules souches selon laquelle l’expression de la GFP améliorée (eGFP) est entraînée par le promoteur GFAP humain.
Abstract
Glioblastome (GBM) est la tumeur cérébrale primaire plus meurtrières et les plus courants chez les adultes, causant environ 14 000 décès chaque année aux États-Unis seulement. Durée médiane de survie après le diagnostic est inférieure à 15 mois avec une chimiothérapie témozolomide, rayonnement et résection chirurgicale maximale. Les défis inhérents à développer des traitements plus efficaces de GBM sont devenus de plus en plus clairs et incluent son effraction inflexible, sa résistance aux traitements standard, sa complexité génétique et moléculaire adaptabilité et sous-populations de GBM cellules avec similitudes phénotypiques des cellules souches normales, ci-après désigné comme des cellules souches glioblastome (CSS). Parce que les CSS sont requises pour la progression et la croissance tumorale, la thérapie axée sur la différenciation représente une modalité de traitement viable pour ces tumeurs incurables.
Le protocole suivant décrit une collection de procédures visant à établir un criblage à haute plateforme visant à l’identification de petites molécules qui favorisent la différenciation astroglials GSC. Au cœur du système est une protéine fibrillaire acide gliale (GFAP) différenciation journaliste-construction. Le protocole contient les procédures générales suivantes : (1) établir des lignes de GSC différenciation journaliste ; (2) essais/validation de la pertinence du reporter à la capacité d’auto-renouvellement/clonogéniques GSC ; et (3) haute capacité-cytométrie de dépistage des drogues.
La plateforme de criblage fournit une approche simple et peu coûteuse pour identifier des petites molécules qui favorisent la différenciation des CGV. De plus, l’utilisation des bibliothèques de médicaments approuvés par la FDA détient le potentiel pour l’identification d’agents qui peuvent être réutilisés plus rapidement. Aussi, les thérapies qui favorisent la différenciation des cellules souches du cancer sont censés agissent en synergie avec les traitements actuels de « norme de diligence » qui auraient dû être divulgués afin de cibler et éliminer principalement plus de cellules différenciées du cancer.
Introduction
Des études récentes ont montré que les tumeurs contiennent une petite population de cellules, appelées les cellules souches du cancer (CSC) ou les cellules tumorales qui lance, qui sont responsables de la progression tumorale, métastase et résistance aux traitements chimio - et radio 1, 2. la présence de cellules souches cancéreuses et leurs progénitures plus différenciées au sein de tumeurs est considéré comme un facteur important favorisant l’hétérogénéité intratumorale et représente donc un obstacle majeur dans le traitement de cancers3. Hiérarchie de cellule de tumeur, fournie par la théorie des cellules souches du cancer, a inspiré l’élaboration de nouvelles stratégies pour traiter les cancers 4. Une approche pour cibler les cellules souches cancéreuses consiste à identifier et à inhiber les voies de signalisation qui sont connus pour être requis pendant le développement embryonnaire de l’organe atteint. En effet, nous et autres avons déjà publié plusieurs documents décrivant le besoin continu de cellules souches-pertinentes signalisation voies neurales Sonic Hedgehog et l’encoche dans le glioblastome5,6,7. Ce travail a contribué à solidifier la raison d’être de plusieurs essais cliniques de GBM. Une deuxième approche pour cibler les cellules souches cancéreuses est de promouvoir leur différenciation. Cette approche a reçu beaucoup d’aide en raison des résultats favorables des études précliniques et cliniques dans le traitement de la leucémie aiguë promyélocytaire avec acides rétinoïque (ATRA, un analogue de la vitamine A). Ici ATRA a été trouvé pour retirer le bloc de maturation et favoriser le cancer de la différenciation cellulaire8. Plus récemment, Piccirillo et ses collègues ont démontré avec élégance que BMP-4 favorise la différenciation GSC dans les astrocytes avec anti-MBG importants effets in vitro et in vivo9.
La justification de cette étude est basée sur une approche de « l’ingénierie inversée » afin de cibler les CGV. Compte tenu de la grande hétérogénéité présente dans GBM et avec mauvaise différenciation étant l’une des principales caractéristiques du cancer, nous avons demandé si nous pourrions promouvoir un phénotype plus favorable - différenciation dans un état semblable au astrocyte. Ici, nous n’avons pas de connaissance préalable des voies de signalisation qui maintiennent des CSS dans un échantillon donné de tumeur mais plutôt pour objectif d’obtenir un phénotype souhaité (par exemple les positivité GFAP).
Ce rapport décrit les procédures utilisées pour établir la GSC différenciation journaliste-lignes de la transduction des cultures GSC-enrichi à la sélection clonale de GSC. Les glioblastome Neurosphère lignes utilisées ont été créés au laboratoire du professeur Angelo Vescovi provenant de patients avec un diagnostic de glioblastome primaire à l’hôpital San Raffaele - Milano, Italie. Ces lignes ont été largement étudiées dans plusieurs publications 6,10,11,12,13,14. Il est fortement recommandé que les personnes qui s’intéressent à la mise en œuvre de ces techniques dans leur laboratoire juger de la pertinence du reporter à capacité d’auto-renouvellement de cellules souches du cancer dans les cellules qu’ils envisagent d’étudier (Ceci est vrai pour n’importe quel journaliste). Un protocole détaillé pour l’un des essais clonogéniques in vitro acceptés dans le domaine est fourni pour accomplir ce15,16. Enfin, un protocole détaillé décrivant l’utilisation des lignes journaliste différenciation dans un dépistage de drogues de cytométrie en flux-basée est fourni à la fin. De note, de même pour le système de différenciation astroglials décrit ici, nous avons avec succès établi et validé des lignes de journaliste de GSC intégrant un journaliste (différenciation neuronale) de MAP2:GFP. Par conséquent, les méthodologies de décrivent dans ce papier peut être appliquée à l’étude de la différenciation cellulaire dans diverses lignées cellulaires.
Certains chiffres dans ce rapport se trouve dans une publication récente : « bésylate d’Atracurium et autres agents bloquants neuromusculaires promouvoir la différenciation astroglials et appauvrissent glioblastoma cellules souches18.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Remarque : Astroglials et systèmes de journaliste lentivirus neuronale ont été achetés sous forme de préparations des gènes pré-emballés, concentré. Connaissance de base de la technique de cytométrie en flux est nécessaire. Aussi, pour une pleine utilisation du présent protocole l’utilisateur doit accéder à un cytomètre de flux avec une capacité de haut débit (accepte les plaques à 96 puits comme source de l’échantillon).
1. des gènes système transcriptionnelle
Remarque : Dans toutes les analyses de cytométrie en flux, utilisez cellules parentales, non-transduites, ou vecteur-transduites (non fluorescent) cellules permettant d’établir la fluorescence de la ligne de base. Notez également que, dans toutes les étapes où trituration mécanique s’impose, Soyez doux. Trituration sévère peut tuer un nombre significatif des CSS fragiles et influencer les résultats de cytométrie de flux.
- Plaque de 1 x 106 cellules dans 2 mL de milieu de culture complet cellules souches neurales dans une plaque multiwell-6.
- Transduce cellules en ajoutant journaliste lentivirus à une multiplicité d’infection (moi) égale à 5.
- Ajouter 2 µL de polybrene pour une concentration finale de 8 µg/mL.
- Incuber les cellules à 37 ° C et 5 % de CO2 pendant la nuit.
- Le lendemain, remplacer le milieu de croissance pour supprimer les virus non lié. Replacez la plaque dans l’incubateur à 37 ° C et 5 % de CO2 et incuber pendant 24 h.
- Récolte de 0,5 mL du volume total ; faire tourner les cellules à 360 x g pendant 5 min à température ambiante dans un tube conique de 15 mL et éliminer le surnageant par aspiration. Ajouter 0,5 mL de milieu de croissance fraîche cellules souches neurales pour les cellules restantes et remettez la plaque dans l’incubateur pour la poursuite de l’expansion.
- Ajouter 200 µL de réactif de dissociation et incuber pendant 5 min à 37 ° C.
- Dissocier les cellules en doucement pipetage de haut en bas.
NOTE : Trituration dure peut entraîner la mort significative de CSS, dissociation complète est habituellement obtenue après 20 - 30 fois. - Pour minimiser la fixation des cellules ou agrégation, ajoutez 800 µL de Hank Balanced Salt Solution (HBSS) pour un volume final de 1 mL.
- Transférer 200 µL de chaque suspension de cellules à un puits d’une plaque multiwell-96.
- Pour cette procédure, utilisez un cytomètre de benchtop avec capacité de plaque à 96 puits équipé d’un laser bleu pour l’excitation et la capacité de détecter la protéine fluorescente verte. Effectuer des analyse en cytométrie en flux au moins 10 000 cellules viables pour chaque acquisition.
- Déterminer le pourcentage de cellules positives à GFP par cytométrie en flux.
2. subclone sélection, Expansion et Validation
- Cellules de plaque dans 100 µL de milieu de cellules souches neurales à une densité de 0,7 cellules / puits d’une plaque multiwell-96.
- La culture des clones pendant 11 jours à 37 ° C et 5 % de CO2. Cette étape est fortement dépendante de type de cellule et nécessitera probablement une adaptation basée sur la lignée cellulaire utilisée. En règle générale, une sphère de diamètre ≥ 100 µm est une bonne indication de la présence de clonogéniques CSS dans le neurospheres.
- À l’aide d’un microscope à fluorescence équipé d’un filtre FITC, marquer les puits qui contiennent un seul Neurosphère où ~ 1 à 5 % des cellules est séropositifs au GFP.
NOTE : Déterminer que le pourcentage exact de cellules positives GFP n’est pas trop critique à ce stade. Chacun des sous-clones évaluera plus tard par cytométrie en flux. Cette étape est effectuée afin de réduire le total nombre de clones à analyser en mettant l’accent sur les neurospheres qui proviennent d’indifférencié, GFAP-négatif, GSC. - Développez clones sélectionnés reporter jusqu'à ce qu’il y a un nombre suffisant de cellules pour l’analyse par cytométrie en flux. Un Sub confluent puits d’une plaque de 6-multiwell contenant ≤ 1.5x105 cellules/mL devrait fournir un nombre suffisant de cellules.
Remarque : Une procédure détaillée pour l’isolement et l’expansion de la CSS est disponible 17.
3. détermination de l’Expression GFAP:GFP par cytométrie en flux
- Récolter une partie aliquote de cellules (0,5 mL) chaque clone de journaliste et de non-transduites témoins pour déterminer le pourcentage exact de cellules positives GFP. Compte tenu des clones de journaliste qui contiennent des cellules positives GFP ~ 1-5 %.
- Tourner les cellules à 360 x g pendant 5 min à température ambiante et éliminer le surnageant par aspiration.
- Ajouter 200 µL de réactif de dissociation cellulaire à chaque boulette et incuber les tubes dans un bain d’eau réglé à 37 ° C.
- Triturer les cellules doucement afin d’obtenir une suspension monocellulaire (généralement entre 20 à 30 fois).
- Pour minimiser la fixation des cellules ou agrégation, ajouter 800 µL HBSS dans un volume final de 1 mL.
- Transférer 200 µL / puits d’une plaque de 96-multiwell de chaque suspension de cellules.
- Pour cette procédure, utilisez un cytomètre de benchtop avec capacité de plaque à 96 puits. Effectuer des analyse en cytométrie en flux au moins 10 000 cellules viables pour chaque acquisition.
4. ELDA autorenouvellement test pour évaluer la capacité clonogéniques
Remarque : Pour les contrôles, parentales, non-transduites, tant que GFP-expression cellules transduites-lentivirus, devraient servir à déterminer le potentiel clonogénique relative des lignes journaliste GSC différenciation des cultures de GSC original d'où ils ont été dérivé.
- Dissocier la différenciation-journaliste sous-clones dans des suspensions de cellules individuelles comme décrit ci-dessus.
- Cellules de plaque plaques 96-multiwell dans 100 µL de milieux de croissance complète les cellules souches neurales au densité comprise entre 5 et 500 cellules / puits.
- Incuber les cellules pendant 9 à 11 jours à 37 ° C et 5 % de CO2.
- Marquer des puits positifs en visualisation directe des neurospheres sous un microscope optique. Un puits doit considérer comme « positif » s’il contient au moins un seul Neurosphère grand.
- Branchez les données : total des puits analysés et le nombre de puits positifs à l’aide de l’interface en ligne de ELDA disponible à http://bioinf.wehi.edu.au/software/elda/index.html.
5. médicaments bibliothèque Dilution préparation
- Enlever les plaques de la bibliothèque de stockage à-80 ° C, couvrir avec du papier aluminium (protéger les composés sensibles à la lumière). Décongeler pendant environ 30 min à une heure à température ambiante.
- Utiliser une pipette multicanaux à 12 canaux pour diluer les composés de bibliothèque à 0,2 mM dans un milieu complet cellules souches neurales. Diluer le DMSO à 10 % dans le milieu
Remarque : La concentration finale de DMSO doit être 0,1 % lorsqu’il est ajouté aux cellules. La toxicité peut entraîner une concentration plus élevée de DMSO dans la culture. Pour cette raison, il est recommandé de tester la sensibilité de DMSO dans la lignée cellulaire utilisée, avant le traitement. - Utilisez le DMSO comme excipient pour traiter les cellules qui que se trouvent dans les colonnes de gauche et à droite de chaque assiette (colonnes 1 et 12 ; Wells A à H).
- Recouvrir les plaques de bibliothèque dilué avec du papier aluminium et retour des planches originales de la bibliothèque au congélateur-80 ° C pour le stockage à long terme.
6. drug Screen
Remarque : Les cellules traitées DMSO devraient servir pour régler bloquant la fluorescence de la ligne de base.
- Plaque 5 x 103 cellules dans une plaque multiwell-96 à 99 µL de milieu de culture complet cellules souches neurales.
- À l’aide d’une pipette multicanaux à 12 canaux, traiter les cellules avec des composés de bibliothèque dilué à une concentration finale de 2 µM (1 µL de drogue de 0,2 mM à 99 µL de suspension cellulaire) ou avec le DMSO (contrôle). Incuber les boîtes pendant 72 h à 37 ° C et 5 % de CO2.
- À l’aide d’une pipette multicanaux à 12 canaux ajouter 150 µL de réactif de dissociation cellulaire dans chaque puits et incuber pendant 20 min à 37 ° C.
- Dissocier les cellules en trituration doucement avec une pipette multicanaux à 12 canaux, jusqu'à ce que la suspension monocellulaire est atteint (généralement entre 20 à 30 fois). La quantité de temps nécessaire de dissocier complètement les neurospheres variera entre lignes de GSC. Alors que le réactif de dissociation cellulaire recommandée (voir documentation) est sans danger et incubation jusqu'à 45 minutes n’avait aucun effet sur la viabilité de plusieurs souches de GSC, vérifier pour chaque ligne de GSC qui serviront au dépistage.
Remarque : Le volume final de chaque bien doit être à peu près 250 µL (100 µL de la suspension cellulaire + 150 µL de réactif de dissociation cellulaire). - Déterminer le pourcentage de cellules exprimant le journaliste GFAP:GFP par cytométrie en flux. Utilisez la stratégie de blocage standard. Tout d’abord, tracer des éparpillements avant et latéraux pour avoir une idée générale de la taille des cellules et la viabilité. Puis placez un portail sur la population viable de cellules individuelles. Il s’agit de la population pour laquelle la fluorescence verte (eGFP) sera déterminée. Tout composé qu’entraîne une augmentation du pourcentage de GFP-positifs cellules par plus de trois écarts-types pour le contrôle (DMSO-traitée) est considérée comme positive « hit ». Ce seuil doit être ajusté selon l’application spécifique et la rigueur voulue.
Remarque : Pour le haut débit écran est recommandé à l’aide d’un simple sous-clone de journaliste de GSC. Après le succès d’identification, chaque coup doit être validé contre sous-clones journaliste supplémentaires de la même ligne de GSC. Pour accroître la confiance pour vrais hits est également recommander essais composés contre le journaliste sous-clones isolées de différents GSC neurospheres lignes.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Trois lignes indépendantes neurospheres dérivé de patient étaient transduites avec le journaliste astroglials de lentivirus codant pour un protéine fluorescente verte (GFP) fondue dans le cadre avec une cassette de résistance Zeocin et entraînés par l’élément humain du promoteur GFAP ( Figure 1). Prochaines clones individuels ont été isolés par l’ensemencement de 0,7 cellules / puits dans une plaque 96 puits (Figure 2), elle a été suivie de détermination de cytométrie en flux du pourcentage de cellules exprimant la GFP (Figure 3). Neurosphère clones, dérivées de cellules individuelles, contenant plus de 5 % des cellules positives GFP sont appelées GL (GFAP faible) alors que les clones contenant ≥ 75 % GFP cellules positives sont dénommés GH (GFAP élevé) et sont censées être plus différenciés par rapport à la GL sous-clones (Figure 4).
Pour identifier les agents et les voies qui pourraient contrôler la différenciation astroglials en CSS, un dépistage de drogues de petites molécules à l’aide de deux bibliothèques de NIH Collection clinique a été réalisé. Les cellules ont été traitées pour 72 heures avec 727 agents de bibliothèque de la collection clinique du NIH I et II, établie à une concentration de 2 µM ou un volume égal de DMSO comme un contrôle. L’effet de ces agents a été testé sur la viabilité cellulaire dans tous nos patient GBM Neurosphère lignées dérivées à des concentrations allant de 0,2 µM à 20 µM, avant le dépistage des drogues. La concentration utilisée dans le présent protocole a permis d’identifier des composés qui ont été capables d’induire la différenciation astroglials et en même temps, il réduit les effets toxiques potentiellement hors-cible en raison des concentrations plus élevées de médicaments.
Après incubation, nous avons déterminé le pourcentage de cellules exprimant le journaliste GFAP-GFP par cytométrie en flux. Niveaux de référence pour la viabilité et le pourcentage de cellules GFP-positives ont été déterminées au moins trois puits pour chaque plaque de bibliothèque, et un succès positif a été déterminé comme une augmentation du pourcentage de cellules positives à GFP de trois écarts sur la ligne de base (DMSO) et un seuil minimum de 25 % des cellules positives GFP. Nous avons recensé 12 médicaments qui induisent une augmentation suffisante de la population de GFP-positifs (tableau 1).
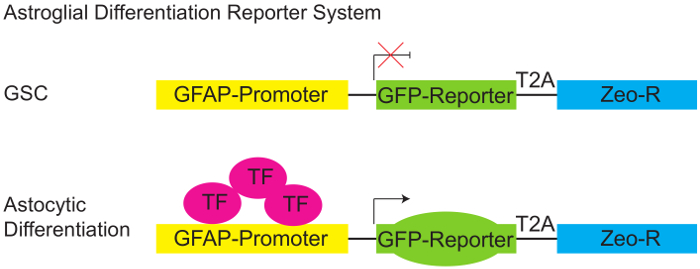
Figure 1 : Différenciation astroglials système.
Diagramme schématique du journaliste GFAP:GFP pGreenZeo. CSS n’expriment pas la combinaison appropriée des facteurs de transcription nécessaires pour activer le promoteur de la protéine fibrillaire acide gliale (GFAP) et par conséquent n’exprimera pas GFP (panneau supérieur). Toutefois, lorsque les facteurs de transcription appropriée sont présents (par exemple quand les cellules acquièrent un destin astroglials - différencier) le promoteur GFAP devenue actif et les cellules exprimera le reporter GFP (panneau inférieur). (CGC - cellules souches de gliomes, éditeur de liens T2A-protéine, Zeo-R - Zeocin gène de résistance, TF - facteur de transcription). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 2 : Astroglials différenciation - sélection sous-clone.
Photos représentatives du HSR-GBM1 GSC sous-clones exprimant des niveaux faibles (GL) ou des niveaux élevés (GH) de la journaliste de GFAP:GFP à l’aide de la microscopie en fluorescence (40 X grossissement est indiqué). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 3 : Cytométrie de flux pour la détermination de la Fluorescence verte.
HSR-GBM1 dérivé de patient Neurosphère ligne était transduite avec lentivirus journaliste GFAP:GFP et sous-clones multiples ont été sélectionnés basés sur l’expression de la GFP en initiant la Neurosphère-cellule et confirmé par cytométrie en flux. Ces clones ont été nommées GL (GFAP faible) ou GH (GFAP élevé). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 4 : Caractérisation fonctionnelle de HSR-GBM1 GFAP:GFP subclones.
Sous-clones GL sont plus clonogéniques in vitro comme indiqué par l’augmentation des fréquences de GSC qui sont mesurés par l’extrême limitation Dilution analyse (ELDA). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
| Nom | Multiplication dans les cellules + GFP | Description | Barrière hémato-encéphalique | Probabilité de drogue Banque |
| Vinorelbine | 8.97 | Chimiothérapie anti mitotique | - | 0,88 |
| Diphénoxylate | 13.89 | Antidiarrhéique | + | 0,96 |
| Lomerizine | 10.89 | Bloqueur des canaux calciques / cérébral vasodilatateur | NA | NA |
| Phenprobamate | 10,73 | Anxiolytiques / Muscle relaxant, à action centrale | NA | NA |
| 6-Azauridine | 15 h 07 | Antimétabolite / Antiviral | NA | NA |
| Irinotécan | 14.14 | Topisomerase j’ai inhibiteur | + | 0,63 |
| Bésylate d’Atracurium | 8.16 | Relaxant musculaire squelettique non | + | 0,93 |
| Glimépiride | 8,75 | Antidiabétiques | + | 0,73 |
| Hexachlorophène | 9.83 | Antiseptique | + | 0,92 |
| Digoxine | 8.23 | Glycoside cardiotonique | - | 0,72 |
| Flécaïnide | 10 | Agent anti-arythmie | + | 0,86 |
| Nisoldipine | 5.05 | Bloqueur des canaux calciques | - | 0,95 |
Tableau 1 : Petites molécules induisant l’expression de la journaliste GFAP-GFP en HSR-GBM1 GL-1
Composés de douze trouvées à augmenter de manière significative le pourcentage de cellules exprimant le GFP (multiplication apparaît) et satisfait aux critères rigoureux de ≥ 3 écarts-types au-dessus de la ligne de base, les cellules traitées DMSO et avec pas moins de 25 % GFP-positive des cellules. La capacité et la probabilité d’un agent donné à traverser la barrière hémato-encéphalique (drogue Banque (−). Abréviation : NA (information non disponible).
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Alors que la plupart des études précédentes de CSS portés principalement sur les marqueurs qui définissent leur, dans cette étude, nous avons décidé d’adopter l’approche inverse. Nous nous concentrons principalement sur les descendances différenciées générés par CSS (par exemple, les cellules exprimant astroglials et marqueurs neurones). Nous démontrons l’utilisation d’un médicament à haut débit basés sur les cellules contrôle système, qui repose sur l’expression humaine GFAP promoteur dépendant de GFP. Toutes les expériences ont été réalisées en utilisant des lignées de cellules de glioblastome Neurosphère dérivé de patient. Un protocole détaillé décrivant l’isolement et l’expansion de ces lignes est décrite dans Galli et al.17.
Le système nous aidé non seulement à l’identification de petites molécules qui sont capables d’induire la différenciation cellulaire des CSS, mais aussi nous a aidés à déterminer sans équivoque que l’expression du marqueur de différenciation astroglials GFAP détermine la capacité de clonogénique de cellules individuelles de GBM en comparant les fréquences de GSC. Le dosage de ELDA a été développé par Yifang Hu et Gordon K. Smyth. Nous encourageons les lecteurs à lire le manuscrit pour une compréhension approfondie des forces et des faiblesses dosage15. La formation de colonies marquant l’étape est fortement dépendante de type de cellule et nécessitera probablement une adaptation basée sur la lignée cellulaire utilisée. En outre, en règle générale, nous utilisons sphère diamètre ≥100 µm comme une bonne indication que le Neurosphère a été émis par un clonogéniques GSC.
Par ailleurs, la drogue, nous décrivons ici de système de contrôle permet l’identification de nouvelles voies (spécifiquement les transports de l’acétylcholine et le calcium) qui sont nécessaires pour maintenir le CSS dans l’État indifférencié (voir tableau 1). La concentration initiale de la drogue peut varier en fonction sur la ligne de bibliothèque et de la cellule utilisée. Aussi, le temps nécessaire à la différenciation cellulaire peut avoir besoin d’ajustement. En outre, tumorigène validation des hits de drogue nécessite une initiation de tumeurs in vivo assay 18.
Potentiellement une limitation mineure de cette technique est que la différenciation spontanée se produit inévitablement dans toute culture de cellules souches enrichi, et ce phénomène tend à augmenter avec le nombre de passages dans la culture et diffère entre différents sous-clones. En effet, nous avons observé une différenciation spontanée dans notre sous-clones généralement après passage 15. Par conséquent, nous avons limité nos analyses de différenciation aux cultures à des numéros de passage n’excédant ne pas cinq.
Peut-être le point le plus critique dans cette méthodologie consiste donc à garder un passage in vitro des présentes CGV au minimum et lorsque vous travaillez en vitro, à maintenir la densité de culture inférieure 1.5x105 cellules/mL. En outre, il est fortement recommandé que chaque médicament « hit » est validé contre sous-clones journaliste supplémentaires de la même ligne de GSC, ainsi que, contre le journaliste sous-clones isolés de différents dérivés de patient GSC neurospheres lignes. Cela augmentera la confiance qu’un véritable « coup » est à portée de main.
La polyvalence de la méthodologie décrite dans le présent protocole robuste renforce la valeur thérapeutique d’une différenciation des cellules souches du cancer d’origine médicamenteuse et devrait permettre d’identifier de nouveaux médicaments comme de possibles nouvelles stratégies thérapeutiques pour GBM et autres tumeurs. Enfin, le dosage peut être optimisé pour être utilisé avec non néoplasique des cellules souches neurales, autres types de cancer et avec des journalistes de la différenciation des différents.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Les auteurs n’ont rien à divulguer.
Acknowledgments
Ce travail a été partiellement prises en charge par le NIH R01CA187780.
Materials
| Name | Company | Catalog Number | Comments |
| ESGRO Complete Accutase | EMD Millipore | SF006 | |
| Dimethyl Sulfoxide (DMSO) | Sigma Aldrich | D2650 | |
| HBSS (Hank's Balanced Salt Solution) | Sigma Aldrich | H6648 | |
| Human GFAP Differentiation Reporter (pGreenZeo, Virus) | SBI (System Biosciences) | SR10015VA-1 | |
| 50 ml sterile disposable reagent reservoirs | Corning | 4870 | |
| 6 well plate | Thermo Fisher Scientific | 130184 | |
| 96 well plate | Falcon | 353072 | |
| Biolite T25 cm² Flask Vented | Thermo Fisher Scientific | 130189 | |
| Biolite T75 cm² Flask Vented | Thermo Fisher Scientific | 130190 | |
| 15 ml Centrifuge tubes | Celltreat | 229411 | |
| 1.5ml Microcentrifuge tubes | Fisher Scientific | 05-408-129 | |
| Ovation Multi Channel Pipette, 12 Channel, 0.5 - 20uL | VistaLab Technologies | 1060-0020 | |
| Ovation Multi Channel Pipette, 12 Channel, 5-250uL | VistaLab Technologies | 1060-0250 | |
| Multi 12-channel pipette tips 25 μl | VistaLab Technologies | 4060-1002 | |
| Multi 12-channel pipette tips 250 μl | VistaLab Technologies | 4060-9025 | |
| Guava easyCyte 5HT Benchtop Flow Cytometer | EMD Millipore | 0500-4005 | |
| NIH Clinical Collections 1 and 2 small molecule libraries | Evotec | ||
| Name | Company | Catalog Number | Comments |
| For the preparation of neural stem cell media (500 mL) | Final concentration | ||
| BSA | GoldBio.com | A-421-250 | 0.20% |
| DMEM/F12 10X | Corning | 90-091-PB | 1X |
| Heparin sodium salt | Sigma Aldrich | H3149 | 0.0002% |
| HEPES 1M | Sigma Aldrich | H4036 | 5.4 mM |
| Insulin-Transferrin- Selenium (ITS -G) (100X) | Life Technologies | 41400-045 | 1X |
| NaHCO3 | Sigma Aldrich | S-5761 | 14.5 mM |
| Penicillin-Streptomycin (10,000 U/mL) 100X | Gibco | 15140-122 | 1X |
| Progesterone | Sigma Aldrich | P8783 | 16 nM |
| Putrescine | Sigma Aldrich | P5780 | 4.8 µM |
| Basic FGF (FGF2), Human | GoldBio | 1140-02-50 | 10 ng/ml |
| EGF, Human | GoldBio | 1150-04-100 | 20 ng/ml |
| Bottle-Top Filter, 150ml, 33mm, 0.22um, Pes, S, Ind | Corning | 431160 | Use to filter sterlize media |
References
- Maher, E. A., et al. Malignant glioma: genetics and biology of a grave matter. Genes Dev. 15 (11), 1311-1333 (2001).
- Bonavia, R., Inda, M. M., Cavenee, W. K., Furnari, F. B. Heterogeneity maintenance in glioblastoma: a social network. Cancer Res. 71 (12), 4055-4060 (2011).
- Bao, S., et al. Glioma stem cells promote radioresistance by preferential activation of the DNA damage response. Nature. 444 (7120), 756-760 (2006).
- Sul, J., Fine, H. A. Malignant gliomas: new translational therapies. Mt Sinai J Med. 77 (6), 655-666 (2010).
- Bar, E. E., Chaudhry, A., Farah, M. H., Eberhart, C. G. Hedgehog signaling promotes medulloblastoma survival via Bc/II. Am J Pathol. 170 (1), 347-355 (2007).
- Chu, Q., Orr, B. A., Semenkow, S., Bar, E. E., Eberhart, C. G. Prolonged inhibition of glioblastoma xenograft initiation and clonogenic growth following in vivo Notch blockade. Clin Cancer Res. 19 (12), 3224-3233 (2013).
- Schreck, K. C., et al. The Notch target Hes1 directly modulates Gli1 expression and Hedgehog signaling: a potential mechanism of therapeutic resistance. Clin Cancer Res. 16 (24), 6060-6070 (2010).
- Warrell, R. P. Jr, et al. Differentiation therapy of acute promyelocytic leukemia with tretinoin (all-trans-retinoic acid). N Engl J Med. 324 (20), 1385-1393 (1991).
- Piccirillo, S. G., et al. Bone morphogenetic proteins inhibit the tumorigenic potential of human brain tumour-initiating cells. Nature. 444 (7120), 761-765 (2006).
- Bar, E. E., et al. Cyclopamine-mediated hedgehog pathway inhibition depletes stem-like cancer cells in glioblastoma. Stem Cells. 25 (10), 2524-2533 (2007).
- Bar, E. E., Lin, A., Mahairaki, V., Matsui, W., Eberhart, C. G. Hypoxia increases the expression of stem-cell markers and promotes clonogenicity in glioblastoma neurospheres. Am J Pathol. 177 (3), 1491-1502 (2010).
- Kahlert, U. D., et al. CD133/CD15 defines distinct cell subpopulations with differential in vitro clonogenic activity and stem cell-related gene expression profile in in vitro propagated glioblastoma multiforme-derived cell line with a PNET-like component. Folia Neuropathol. 50 (4), 357-368 (2012).
- Lim, K. S., et al. Inhibition of monocarboxylate transporter-4 depletes stem-like glioblastoma cells and inhibits HIF transcriptional response in a lactate-independent manner. Oncogene. 33 (35), 4433-4441 (2014).
- Kahlert, U. D., et al. ZEB1 Promotes Invasion in Human Fetal Neural Stem Cells and Hypoxic Glioma Neurospheres. Brain Pathol. 25 (6), 724-732 (2014).
- Hu, Y., Smyth, G. K. ELDA: extreme limiting dilution analysis for comparing depleted and enriched populations in stem cell and other assays. J Immunol Methods. 347 (1-2), 70-78 (2009).
- Meyer, M., et al. Single cell-derived clonal analysis of human glioblastoma links functional and genomic heterogeneity. Proc Natl Acad Sci U S A. 112 (3), 851-856 (2015).
- Galli, R., et al. Isolation and characterization of tumorigenic, stem-like neural precursors from human glioblastoma. Cancer Res. 64 (19), 7011-7021 (2004).
- Spina, R., Voss, D. M., Asnaghi, L., Sloan, A., Bar, E. E. Atracurium Besylate and other neuromuscular blocking agents promote astroglial differentiation and deplete glioblastoma stem cells. Oncotarget. 7 (1), 459-472 (2016).



