Summary
神経膠芽腫幹細胞 (GSCs) のグリア分化を促進する小さい分子の同定の効率的なスクリーニングのプロトコルが表示されます。アッセイは、人間の GFAP プロモーターによって強化された GFP (eGFP) の式を駆動するという幹細胞分化記者に基づいています。
Abstract
膠芽腫 (GBM) は、成人では、米国だけで毎年約 14,000 人が死亡を引き起こす最も一般的なと最も致命的な原発性脳腫瘍です。診断後生存期間の中央値は、最大の外科的切除、放射線とテモゾロマイド化学療法と 15 ヶ月未満です。糸球体基底膜のより効果的な治療の開発に固有の課題がますます明らかになり、その不屈の侵襲性、標準治療への抵抗、遺伝的複雑性と分子適応性、および糸球体基底膜のサブポピュレーションを含む正常幹細胞に表現型の類似性を持つ細胞以下神経膠芽腫幹細胞 (GSCs) といいます。GSCs は腫瘍の増殖・進展に必須なので、分化基づかせていた療法はこれらの難治性の腫瘍のための実行可能な治療法を表します。
次のプロトコルは、高スループット スクリーニング ・ GSC グリア分化を促進する小さい分子の同定を目的としたプラットフォームを確立する手順のコレクションを記述します。システムのコアではグリア線維性酸性蛋白 (GFAP) 分化記者-構成要素です。プロトコルには、次の一般的な手順が含まれています: (1) GSC 分化記者ライン; の確立(2) テスト/検証記者 GSC 自己更新/クローン形成能力との関連性(3) の大容量フローサイトメトリーによる薬剤のスクリーニング。
スクリーニング プラットフォームは、GSCs の分化を促進する小さい分子を識別するために簡単かつ安価な方法を提供します。さらに、FDA 承認薬の図書館の利用はより急速に再利用することができますエージェントの識別の可能性を保持しています。また、癌幹細胞の分化を促進する治療法は、ターゲットし、主により分化したがん細胞を排除している現在の「ケアの標準」治療と相乗的働くと予想されます。
Introduction
最近の研究は、腫瘍が小さい人口を含む示されているがん幹細胞 (CSCs) または腫瘍幹細胞と呼ばれる細胞の腫瘍の進行、転移、化学療法やラジオ療法1,への抵抗に責任があります。2。 癌幹細胞と腫瘍内の区別された後代の存在性の促進の重要な要因である、従って癌3の治療の主要なハードルを表します。癌幹細胞理論によって提供される腫瘍細胞階層は、 4癌を治療するために新たな戦略の開発を触発しています。癌幹細胞をターゲットに 1 つのアプローチは、識別し、影響を受ける臓器の萌芽期の開発中に必要なことがわかっているシグナル伝達経路を阻害します。確かに、私たちと他の人まで神経幹細胞に関連するシグナル伝達経路ソニック ・ ザ ・ ヘッジホッグとノッチ膠芽腫5,6,7での継続的な要件を説明する複数のペーパーを発行しています。この作品はいくつか糸球体基底膜の臨床試験のための理論的根拠を確固たるものにしました。癌幹細胞をターゲットに 2 番目のアプローチは、分化を促進するためです。このアプローチは、レチノイン酸 (ATRA、ビタミン A アナログ) と急性前骨髄球性白血病の治療に臨床および臨床研究から多くの良好な結果のためのサポートを受けています。ここで ATRA が成熟のブロックを削除し、8がん細胞の分化を促進する見つかりました。もっと最近、Piccirillo と同僚エレガントな示されている BMP 4 が GSC 重要な抗 GBM の効果生体外でそして生体内9アストロ サイト分化を促進すること。
現在の研究のための理論的根拠は、GSCs をターゲットに「逆工学」アプローチに基づいています。広大な不均一性癌の特徴の一つである貧困層の分化と糸球体基底膜の存在を考えるとかどうか、我々 はより有利な表現型 - アストロ サイトのような状態への分化を促進できると聞きました。ここでは、指定された腫瘍標本の GSCs を維持するが、むしろ所望の表現型 (例えば GFAP 陽性) の実現を目指し信号経路の事前の知識がありません。
このレポートでは、行を確立 GSC 分化記者-GSC 濃縮文化の伝達から GSC 栄養系選抜するための手順について説明します。使用される膠芽腫 neurosphere ラインは病院サンラッファ - ミラノ、イタリアで膠芽腫の診断で患者から教授アンジェロ Vescovi の研究所で確立されました。これらの行が盛んでいくつか出版物6,10、11,12,13,14。研究室では、これらのテクニックを実装することに興味がある人がレポーター検討していく細胞のがん幹細胞自己複製能力との関連性を決定することを強くお勧めします (これは任意の記者にも当てはまります)。フィールドで受け入れの in vitroクローンのアッセイのための詳しいプロトコルは、この15,16を達成するために提供しています。最後に、最後にフローサイトメトリーによる薬剤スクリーンの分化記者ラインの利用を記述する詳細なプロトコルが提供されます。注記のうち、同様にグリア分化のシステムが、ここで説明するが正常に設立し、GSC 記者行 MAP2:GFP (神経分化) 報道記者の統合を検証します。したがって、方法論は、この記述する紙、様々 な細胞に細胞分化の研究に適用できます。
いくつかの報告ではこの数字は最近の出版物で見つけることができます:"アトラクリウムベシル酸注射アンプルやその他の神経筋遮断剤グリア分化を促進し、神経膠芽腫幹細胞18を使い果たします。
Subscription Required. Please recommend JoVE to your librarian.
Protocol
注: グリアと神経レンチ レポーター系事前包装された、集中のレンチ ウイルス製剤として購入されました。流れの cytometry 技術の基本的な知識が必要です。また、このプロトコルの完全な使用のため、ユーザーは、フローサイト、(96 ウェルのプレートをサンプル ソースとして受け入れる)、高処理能力へのアクセスを必要があります。
1. レンチ ウイルスの転写レポーター システム
注: すべての流れのフローサイトメトリーによる解析で親、非導入細胞やベクトル導入 (非蛍光性) 細胞の確立に使用基準蛍光。また、なお、機械製粉が、呼び出されているすべての手順で穏やかなこと。過酷な製粉できる壊れやすい GSCs の重要な数を殺すし、流れの cytometry の結果に影響を与えます。
- 6 汚損プレートの完全な神経幹細胞成長培地 2 mL に 1 x 10 の6セルをプレートします。
- 多様性感染症 (moi) 5 に等しいレンチ記者を追加してセルを変換します。
- 8 μ G/ml の最終濃度の polybrene の 2 μ L を追加します。
- 37 ° C と 5% の CO2のセルを一晩インキュベートします。
- 次の日は、成長媒体の非連結のウイルスを削除するを置き換えます。37 ° C、5% CO2インキュベーターにプレートを置き、24 時間インキュベートします。
- 収穫総量; 0.5 mLスピン ・ ダウン 15 mL の円錐管、室温で 5 分間 360 x g でセルと上清を吸引により除去します。残りのセルに新鮮な神経幹細胞用成長培地の 0.5 mL を追加し、継続的な拡大のためのインキュベーターにプレートを戻ります。
- 解離試薬 200 μ L を追加し、37 ° C で 5 分間インキュベート
- 上下に軽くピペッティングにより細胞を分離します。
メモ: GSCs の重要な殺害の過酷な製粉があります、完全な解離は通常 20 - 30 回後達成されます。 - 細胞接着または集計を最小限に抑える、800 μ L のハンクのバランスの取れた塩ソリューション (HBSS) 1 mL の最終的なボリュームを追加します。
- 96 汚損プレートのウェルに各細胞懸濁液 200 μ L を転送します。
- この手順では、励起のための青色レーザーと緑色蛍光タンパク質の検出の機能を備えています 96 ウェル プレート機能を備えた卓上フローサイトを使用します。各獲得のため、少なくとも 10,000 の生菌とフローサイトメトリーによる解析を実行します。
- フローサイトメトリーによる GFP 陽性細胞の割合を決定します。
2. subclone 選択、拡張、および検証
- 100 μ L 96 汚損プレートのウェルあたり 0.7 セルの密度で神経幹細胞中の細胞。
- 文化は、37 ° C、5% CO2で 11 日間のクローンします。この手順は非常に細胞のタイプに依存し、使用セルの行に基づいて調整が必要になります。一般的なルールとして球直径 ≥ 100 μ は、神経幹細胞のクローン GSCs の存在の良い指標です。
- FITC フィルターを搭載した蛍光顕微鏡を使用すると、1 〜 5% の細胞が GFP 陽性を単一 neurosphere を含まれている井戸をマークします。
注: は、GFP 陽性細胞の正確な割合はこの時点であまりにも重要ではないを決定します。フローサイトメトリーによるそれぞれのサブクローンの後で評価されます。このステップは合計を減らすために実行によって発信された神経幹細胞に重点を置いて分析するクローン数未分化、GFAP 負 GSC。 - フローサイトメトリーによる解析のための細胞の十分な数がないと、選択した記者のクローンを展開します。≤ 1.5x105セル/mL を含む 6 汚損プレートのサブ合流井戸は、十分な細胞数を提供しなければなりません。
メモ: 分離と GSCs の拡張のための詳細な手順は、利用可能な17です。
3 フローサイトメトリーによる GFAP:GFP の発現の定量法
- 各記者のクローンおよび GFP 陽性細胞の正確な割合を決定するためのコントロールの非導入からセル (0.5 mL) の因数を収穫します。1 ~ 5 %gfp 陽性細胞を含む記者クローンを検討しています。
- 室温で 5 分間 360 x g でセルをスピンし、吸引により上清を除去します。
- 各ペレットの細胞解離試薬 200 μ L を追加し、37 ° C に設定水お風呂でチューブを孵化させなさい
- 優しく (20 〜 30 倍) の間に通常単一細胞懸濁液を達成するために細胞をカップ刻んだ。
- 細胞接着または集計を最小限に抑える、800 μ L HBSS を 1 mL の最終巻に追加します。
- 各細胞懸濁液から 200 μ L/96 汚損プレートのウェルを転送します。
- この手順では、96 ウェル プレート機能を備えた卓上フローサイトを使用します。各獲得のため、少なくとも 10,000 の生菌とフローサイトメトリーによる解析を実行します。
4. エルダ自己更新アッセイ クローン能力を評価するには
注: コントロールの両方親非導入し同様、gfp 発現するレンチ ウイルス導入細胞、必要がありますに使用するされたの元の GSC 文化に GSC 分化記者行の相対的なクローンの可能性を判断します。派生します。
- 上記のように単一細胞懸濁液に分化記者サブクローンを切り離して考えます。
- ウェルあたり 5 と 500 セルまでのセル密度で完全な神経幹細胞成長媒体の 100 μ L 96 汚損プレート プレート細胞。
- 37 ° C、5% CO2で 9 〜 11 日のセルを孵化させなさい。
- 光学顕微鏡による神経幹細胞の直接可視化によって肯定的な井戸を獲得します。井戸は、「肯定的」少なくとも 1 つの大きい neurosphere が含まれている場合考慮されなければなりません。
- データをプラグイン: 分析の井戸および http://bioinf.wehi.edu.au/software/elda/index.html でエルダ オンライン インターフェイスを使用して肯定的な井戸の数を合計します。
5. 医薬品ライブラリ希釈調剤
- -80 ° c のストレージからライブラリ プレートを取り、アルミ箔でカバー (光に敏感な化合物を保護する)。室温で 1 時間に約 30 分間解凍します。
- 12 ch マルチ チャンネル pipettor を使用して、完全な神経幹細胞培地で 0.2 mm ライブラリ化合物を希釈します。DMSO を培地に 10% に希釈します。
注: DMSO の最終濃度は、0.1% のセルに追加するときをする必要があります。毒性文化の DMSO 濃度より高い可能性があります。この理由は、治療の前に、使用細胞ラインで DMSO への感受性をテストすることをお勧めします。 - 車両制御として DMSO を使用して、各プレート (1 および 12 の列の左と右の列のセルを扱う井戸 A H から)。
- カバーをアルミ箔希薄ライブラリ プレート、およびライブラリの原版を長期保存のため-80 ° C のフリーザーに戻る。
6. 薬剤スクリーン
注: DMSO 処理細胞はベースライン蛍光を設定し、調整してゲートに使用必要があります。
- 99 μ L 完全な神経幹細胞用成長培地の中の 96 汚損プレートにプレート 5 x 103セル。
- 12 ch マルチ チャンネル pipettor を使用して、セルと 2 μ M (1 μ L の細胞懸濁液の 99 μ L に 0.2 mM 薬剤) の最終濃度に希釈ライブラリ化合物または DMSO (コントロール) を扱います。37 ° C、5% CO2で 72 時間プレートを孵化させなさい。
- 12 ch マルチ チャンネル pipettor を使用して各ウェルに細胞解離試薬の 150 μ L を追加し、37 ° C で 20 分間インキュベート
- (通常の 20 〜 30 倍) 単一細胞懸濁液を達成するまで優しく 12 ch マルチ チャンネル pipettor と triturating によって細胞を分離します。完全に神経幹細胞を分離するに必要な時間の量は、GSC ラインによって異なります。推奨される細胞解離試薬 (材料を参照) は、安全な 45 分間インキュベーション テスト複数の GSC 行の生存率に影響はなかったし、スクリーニングで使用する GSC 各行を確認します。
注: それぞれの最終巻もする必要があります約 250 μ L (細胞懸濁液を 100 μ l 添加 + 細胞解離試薬の 150 μ L)。 - フローサイトメトリーによる GFAP:GFP レポーターを発現する細胞の割合を決定します。標準的なゲートの戦略を使用します。まず、セルのサイズと生存率の一般的な感覚を得る前方と側面に飛び散るをプロットします。次に実行可能な単一セル人口のゲートを置きます。これは蛍光グリーン (eGFP) が決定される人口です。GFP 陽性の割合の増加の結果が制御を 3 つ以上の標準偏差による細胞混合物は、肯定的な「ヒット」として考慮される (DMSO 処理)このしきい値は、特定のアプリケーションおよび目的の逼迫によると調整する必要があります。
注: 高スループットの画面使用は推奨単一 GSC 記者 subclone。次のヒットの識別、各ヒットは同じ GSC ラインから追加記者サブクローンに対して検証しなければなりません。真のヒットの信頼性を高めるためにもオススメ ライン別 GSC 神経幹細胞から分離された記者サブクローンに対する化合物のテストします。
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
3 つの独立した患者由来の神経幹細胞ラインが Zeocin 抵抗カセットとフレームではの溶ける緑色蛍光蛋白質 (GFP) のエンコーディング レンチ グリア記者増殖型、人間 GFAP プロモーター要素 (によって駆動図 1)。96 well プレート (図 2) の井戸あたり 0.7 セルをめっきで隔離された個々 の次のクローンは、これ流れフローサイトメトリーによる GFP (図 3) を発現する細胞の割合が続いた。≤5 %gfp 陽性細胞を含む単一の細胞由来 Neurosphere クローンと呼ばれます GL (GFAP 低) 75 %gfp 陽性細胞を含むクローンが GH (GFAP 高) と呼ばれます、GL に比べてより区別されるべきであります。サブクローン (図 4)。
エージェントと GSCs のグリア分化を制御が経路を識別するために 2 つの NIH 臨床コレクション ライブラリを使用して低分子薬剤スクリーンを行った。セルは、NIH 臨床コレクションから 727 ライブラリ エージェントと 72 時間 I および II、2 μ M の濃度またはコントロールとして DMSO の等しいボリュームで設定のために扱われました。これらの薬剤の効果は、すべてのラインで私たち患者由来 GBM neurosphere 0.2 μ M に至る創薬スクリーニングの前に、20 μ M の濃度で細胞生存率でテストされました。グリア分化誘導できた化合物を識別することができましたこのプロトコルと同時に使用濃度、薬物濃度が高いため潜在的ターゲットを毒性を最小化。
次の孵化、フローサイトメトリーによる GFAP GFP レポーターを発現する細胞の割合を決定されます。各ライブラリ版の少なくとも 3 つの井戸で生存率および GFP 陽性細胞の割合を基準に決定され、肯定的なヒットが終わるベースライン (DMSO) 3 つの標準偏差の GFP 陽性細胞の割合の増加として決定されました。25 %gfp 陽性細胞の最小しきい値。GFP 陽性人口 (表 1) の十分な増加を誘発される 12 の薬を同定しました。
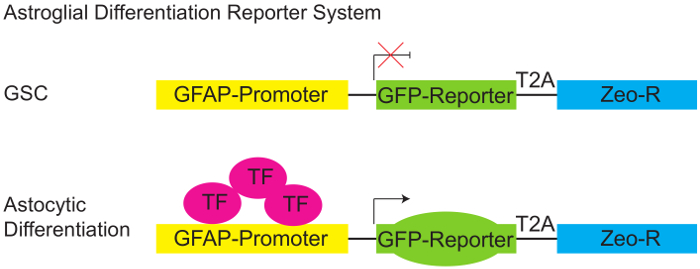
図 1: グリア分化レポーター システム。
PGreenZeo GFAP:GFP レポーターの模式図。GSCs 転写因子グリア線維性酸性蛋白 (GFAP) プロモーターをアクティブにする必要の適切な組み合わせを表現しない、したがって GFP (上部パネル) を表現できません。ただし、適切な転写因子が存在 (細胞のグリア運命 - 取得時など区別) GFAP プロモーターがアクティブになり、細胞が GFP レポーター (底板) を表明します。(GSC - 神経膠腫幹細胞、T2A タンパク質リンカー、ゼオ-R を-Zeocin 抵抗性遺伝子、TF - トランスクリプション要因)。この図の拡大版を表示するのにはここをクリックしてください。

図 2: グリア分化 - Subclone 選択。
低レベル (GL) や蛍光顕微鏡を用いた GFAP:GFP 記者の高レベル (GH) を表現する HSR GBM1 GSC サブクローンの代表的な写真 (40 倍の倍率を示します)。この図の拡大版を表示するのにはここをクリックしてください。

図 3: フローサイトメトリー緑の蛍光性の決定のため。
HSR GBM1 患者由来 neurosphere ラインだった GFAP:GFP 記者レンチ ウイルスを導入し、複数サブクローンは neurosphere を開始するセルの GFP 発現に基づいて、フローサイトメトリーによる確認を選択しました。これらのクローンは、GL (GFAP 低) または GH (GFAP 高) にちなんで名付けられました。この図の拡大版を表示するのにはここをクリックしてください。

図 4: HSR GBM1 GFAP:GFP の機能解析 subclones します。
GL サブクローンよりクローンは体外で極端な制限する希釈解析 (エルダ) によって測定した GSC の周波数の増加によって示される。この図の拡大版を表示するのにはここをクリックしてください。
| 名 | GFP + 細胞は倍に増加 | 説明 | 血液脳関門 | 薬物銀行確率 |
| ビノレルビン | 8.97 | 抗有糸分裂化学療法 | - | 0.88 |
| あるジフェ ノキシレート | 13.89 | 下痢止め薬 | + | 0.96 |
| ロメリジン | 10.89 | カルシウム チャネルのブロッカー/脳血管拡張薬 | NA | NA |
| Phenprobamate | 10.73 | 抗不安薬の筋弛緩剤、一元的に演技 | NA | NA |
| 6 Azauridine | 15.07 | 麦類/抗ウイルス剤 | NA | NA |
| イリノテカン | 14.14 | Topisomerase 私阻害剤 | + | 0.63 |
| アトラクリウムベシル酸注射アンプル | 8.16 | Nondepolarizing 骨格筋弛緩剤 | + | 0.93 |
| グリメピリド | 8.75 | 抗糖尿病薬 | + | 0.73 |
| ヘキサクロロフェン | 9.83 | 防腐剤 | + | 0.92 |
| ジゴキシン | 8.23 | 強心配糖体 | - | 0.72 |
| フレカイニド | 10 | 抗不整脈剤 | + | 0.86 |
| ニソルジピン | 5.05 | カルシウム チャネルのブロッカー | - | 0.95 |
表 1: 小分子誘導 GFAP GFP レポーター式 HSR GBM1 GL-1
GFP 発現細胞の割合が大幅に増加する 12 化合物が見つかりません (倍の増加を示す) も 25 %gfp 陽性細胞と終わるベースライン、DMSO 処理細胞、3 標準偏差の厳しい条件を満たすと。血液脳関門 (薬物銀行 (−) を横断する能力と指定されたエージェントの確率。略称: NA (情報は利用できません)。
Subscription Required. Please recommend JoVE to your librarian.
Discussion
それらを定義するマーカーに主に焦点を当てた GSCs の以前の研究のほとんどは、この研究しました逆のアプローチを取ること。GSCs (例えば、グリアと神経細胞のマーカーを発現する細胞) によって生成される差別化された後代に主に着目します。高スループットの細胞を用いた薬剤のスクリーニングの GFP の人間の GFAP プロモーター依存表現に基づくシステムの使用率を示します。すべての実験は患者由来 neurosphere 膠芽腫細胞株を利用して行った。分離し、これらの行の拡大を記述する詳細なプロトコルは、ガリら17で説明されます。
システム GSCs の細胞分化を誘導することができるが、またグリア分化マーカー GFAP の発現を決定することをはっきりと決定することができましたする小分子の同定で私たちを支援するだけでなく、GSC の周波数を比較することによって個々 の GBM 細胞のクローン化可能容量です。エルダ アッセイは、アダムスコミュニケーション胡とゴードン ・ k ・ スミスによって開発されました。読者は、15のアッセイの長所と短所の詳細な理解のための原稿を読むことをお勧め。ステップの得点コロニー形成は細胞のタイプに依存では高いと使用セルの行に基づいて調整が必要になります。また、一般的なルールとして、neurosphere がクローン化可能 GSC によって発信されたよい徴候と球径 ≥100 μ m を使用します。
また、薬剤のスクリーニングのシステムご紹介可能 GSCs、未分化状態を維持するために必要な新規経路 (具体的にはアセチルコリンとカルシウム輸送) の同定 (表 1 参照)。開始の薬物濃度は利用ライブラリとセルの行に基づいて異なる場合があります。また、細胞の分化に必要な時間は、調整を必要があります。さらに、生体内で腫瘍開始アッセイ18薬物ヒットの発癌性の検証が必要です。
可能性のあるこの技法のマイナーな制限、分化が必然的に幹細胞濃縮文化で発生この現象は文化の通路の数とともに増加する傾向があるし、個々 のサブクローン間で異なります。確かに、自発的分化で見ました私たちサブクローン一般的に 15 の通過後。したがって、我々 は 5 つを超えない通路番号で文化に差別化分析を限られました。
したがって、おそらくこの方法論で最も重要なポイントは最小限に、これらの GSCs に生体外で、作業するときの体外継を維持する 1.5x105セル/mL 以下文化密度を維持します。さらに、ラインの異なる患者由来 GSC 細胞から同じ GSC ラインから追加記者サブクローンに対して、記者のサブクローンを検証「ヒット」各薬剤が分離を強くお勧めします。これは真の「ヒット曲」は手で自信を高めます。
この堅牢なプロトコルで説明されている方法論の多様性は、薬剤誘発性癌幹細胞分化の治療上の価値を強化し、糸球体基底膜と他の腫瘍のための潜在的な新規治療戦略として新薬を識別するに役立つはず。最後に、アッセイは、非腫瘍性の神経幹細胞、その他のがんの種類とは異なる分化記者に使用される最適化可能性があります。
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
著者が明らかに何もありません。
Acknowledgments
この作品は、NIH の R01CA187780 で部分的にサポートされています。
Materials
| Name | Company | Catalog Number | Comments |
| ESGRO Complete Accutase | EMD Millipore | SF006 | |
| Dimethyl Sulfoxide (DMSO) | Sigma Aldrich | D2650 | |
| HBSS (Hank's Balanced Salt Solution) | Sigma Aldrich | H6648 | |
| Human GFAP Differentiation Reporter (pGreenZeo, Virus) | SBI (System Biosciences) | SR10015VA-1 | |
| 50 ml sterile disposable reagent reservoirs | Corning | 4870 | |
| 6 well plate | Thermo Fisher Scientific | 130184 | |
| 96 well plate | Falcon | 353072 | |
| Biolite T25 cm² Flask Vented | Thermo Fisher Scientific | 130189 | |
| Biolite T75 cm² Flask Vented | Thermo Fisher Scientific | 130190 | |
| 15 ml Centrifuge tubes | Celltreat | 229411 | |
| 1.5ml Microcentrifuge tubes | Fisher Scientific | 05-408-129 | |
| Ovation Multi Channel Pipette, 12 Channel, 0.5 - 20uL | VistaLab Technologies | 1060-0020 | |
| Ovation Multi Channel Pipette, 12 Channel, 5-250uL | VistaLab Technologies | 1060-0250 | |
| Multi 12-channel pipette tips 25 μl | VistaLab Technologies | 4060-1002 | |
| Multi 12-channel pipette tips 250 μl | VistaLab Technologies | 4060-9025 | |
| Guava easyCyte 5HT Benchtop Flow Cytometer | EMD Millipore | 0500-4005 | |
| NIH Clinical Collections 1 and 2 small molecule libraries | Evotec | ||
| Name | Company | Catalog Number | Comments |
| For the preparation of neural stem cell media (500 mL) | Final concentration | ||
| BSA | GoldBio.com | A-421-250 | 0.20% |
| DMEM/F12 10X | Corning | 90-091-PB | 1X |
| Heparin sodium salt | Sigma Aldrich | H3149 | 0.0002% |
| HEPES 1M | Sigma Aldrich | H4036 | 5.4 mM |
| Insulin-Transferrin- Selenium (ITS -G) (100X) | Life Technologies | 41400-045 | 1X |
| NaHCO3 | Sigma Aldrich | S-5761 | 14.5 mM |
| Penicillin-Streptomycin (10,000 U/mL) 100X | Gibco | 15140-122 | 1X |
| Progesterone | Sigma Aldrich | P8783 | 16 nM |
| Putrescine | Sigma Aldrich | P5780 | 4.8 µM |
| Basic FGF (FGF2), Human | GoldBio | 1140-02-50 | 10 ng/ml |
| EGF, Human | GoldBio | 1150-04-100 | 20 ng/ml |
| Bottle-Top Filter, 150ml, 33mm, 0.22um, Pes, S, Ind | Corning | 431160 | Use to filter sterlize media |
References
- Maher, E. A., et al. Malignant glioma: genetics and biology of a grave matter. Genes Dev. 15 (11), 1311-1333 (2001).
- Bonavia, R., Inda, M. M., Cavenee, W. K., Furnari, F. B. Heterogeneity maintenance in glioblastoma: a social network. Cancer Res. 71 (12), 4055-4060 (2011).
- Bao, S., et al. Glioma stem cells promote radioresistance by preferential activation of the DNA damage response. Nature. 444 (7120), 756-760 (2006).
- Sul, J., Fine, H. A. Malignant gliomas: new translational therapies. Mt Sinai J Med. 77 (6), 655-666 (2010).
- Bar, E. E., Chaudhry, A., Farah, M. H., Eberhart, C. G. Hedgehog signaling promotes medulloblastoma survival via Bc/II. Am J Pathol. 170 (1), 347-355 (2007).
- Chu, Q., Orr, B. A., Semenkow, S., Bar, E. E., Eberhart, C. G. Prolonged inhibition of glioblastoma xenograft initiation and clonogenic growth following in vivo Notch blockade. Clin Cancer Res. 19 (12), 3224-3233 (2013).
- Schreck, K. C., et al. The Notch target Hes1 directly modulates Gli1 expression and Hedgehog signaling: a potential mechanism of therapeutic resistance. Clin Cancer Res. 16 (24), 6060-6070 (2010).
- Warrell, R. P. Jr, et al. Differentiation therapy of acute promyelocytic leukemia with tretinoin (all-trans-retinoic acid). N Engl J Med. 324 (20), 1385-1393 (1991).
- Piccirillo, S. G., et al. Bone morphogenetic proteins inhibit the tumorigenic potential of human brain tumour-initiating cells. Nature. 444 (7120), 761-765 (2006).
- Bar, E. E., et al. Cyclopamine-mediated hedgehog pathway inhibition depletes stem-like cancer cells in glioblastoma. Stem Cells. 25 (10), 2524-2533 (2007).
- Bar, E. E., Lin, A., Mahairaki, V., Matsui, W., Eberhart, C. G. Hypoxia increases the expression of stem-cell markers and promotes clonogenicity in glioblastoma neurospheres. Am J Pathol. 177 (3), 1491-1502 (2010).
- Kahlert, U. D., et al. CD133/CD15 defines distinct cell subpopulations with differential in vitro clonogenic activity and stem cell-related gene expression profile in in vitro propagated glioblastoma multiforme-derived cell line with a PNET-like component. Folia Neuropathol. 50 (4), 357-368 (2012).
- Lim, K. S., et al. Inhibition of monocarboxylate transporter-4 depletes stem-like glioblastoma cells and inhibits HIF transcriptional response in a lactate-independent manner. Oncogene. 33 (35), 4433-4441 (2014).
- Kahlert, U. D., et al. ZEB1 Promotes Invasion in Human Fetal Neural Stem Cells and Hypoxic Glioma Neurospheres. Brain Pathol. 25 (6), 724-732 (2014).
- Hu, Y., Smyth, G. K. ELDA: extreme limiting dilution analysis for comparing depleted and enriched populations in stem cell and other assays. J Immunol Methods. 347 (1-2), 70-78 (2009).
- Meyer, M., et al. Single cell-derived clonal analysis of human glioblastoma links functional and genomic heterogeneity. Proc Natl Acad Sci U S A. 112 (3), 851-856 (2015).
- Galli, R., et al. Isolation and characterization of tumorigenic, stem-like neural precursors from human glioblastoma. Cancer Res. 64 (19), 7011-7021 (2004).
- Spina, R., Voss, D. M., Asnaghi, L., Sloan, A., Bar, E. E. Atracurium Besylate and other neuromuscular blocking agents promote astroglial differentiation and deplete glioblastoma stem cells. Oncotarget. 7 (1), 459-472 (2016).



