Summary
Um protocolo de triagem eficiente é apresentado para a identificação de pequenas moléculas que promovem a diferenciação de Ralevic em células-tronco glioblastoma (GSCs). O ensaio baseia-se em um repórter de diferenciação de células-tronco no qual a expressão da GFP reforçada (eGFP) é conduzida pelo promotor GFAP humano.
Abstract
Glioblastoma (GBM) é o tumor cerebral primário mais comum e mais letal em adultos, causando cerca de 14.000 mortes a cada ano só nos EUA. Sobrevida média após o diagnóstico é menor que 15 meses com quimioterapia máxima de temozolomide, radiação e ressecção cirúrgica. Os desafios inerentes ao desenvolvimento de tratamentos mais eficazes de GBM tornaram-se cada vez mais claros e incluem sua invasividade inflexível, sua resistência aos tratamentos padrão, sua complexidade genética e molecular adaptabilidade e subpopulações de GBM células com semelhanças fenotípicas de células-tronco normais, doravante conhecido como glioblastoma as células-tronco (GSCs). Porque GSCs são necessários para o crescimento do tumor e progressão, terapia baseada em diferenciação representa uma modalidade de tratamento viável para estas Neoplasias incuráveis.
O seguinte protocolo descreve uma coleção de procedimentos para estabelecer um alto throughput plataforma vista a identificação de pequenas moléculas que promovem a diferenciação de GSC Ralevic de triagem. No núcleo do sistema é uma proteína ácida fibrilar glial (GFAP) repórter-construção de diferenciação. O protocolo contém os seguintes procedimentos gerais: (1) estabelecer linhas de repórter GSC diferenciação; (2) testar/validar a relevância do repórter, a capacidade de autorenovação / clonogenic GSC; e triagem de drogas de alta capacidade-citometria de fluxo com base (3).
A plataforma de triagem fornece uma abordagem simples e barata para identificar pequenas moléculas que promovem a diferenciação de GSCs. Além disso, a utilização de bibliotecas de drogas FDA-approved possui o potencial para a identificação dos agentes que pode ser reaproveitado mais rapidamente. Também, terapias que promovem a diferenciação de células-tronco de câncer são esperadas para trabalhar em sinergia com a atual terapias "padrão de cuidados" que foram mostradas para atacar e eliminar as células do câncer diferenciado principalmente mais.
Introduction
Estudos recentes têm mostrado que os tumores contêm uma pequena população de células, denominadas células-tronco câncer (CSCs) ou células de tumor-iniciando, que são responsáveis pela progressão do tumor, metástase e resistência à quimioterapia e radio-terapias 1, 2. a presença de câncer células-tronco e suas progênies mais diferenciados dentro de tumores é considerada fator importante promover a heterogeneidade intratumoral e, portanto, representa um grande obstáculo no tratamento de câncer3. Hierarquia de células de tumor, fornecida pela teoria de células-tronco do câncer, inspirou o desenvolvimento de novas estratégias para tratar cancros 4. Uma abordagem para o direcionamento de câncer células-tronco é identificar e inibir vias de sinalização que são conhecidas por serem necessárias durante o desenvolvimento embrionário do órgão afetado. Na verdade, nós e os outros anteriormente publicaram vários artigos descrevendo a exigência em curso para as células-tronco-relevantes sinalização vias neurais Sonic Hedgehog e entalhe em glioblastoma5,6,7. Este trabalho tem ajudado no solidificando a justificativa para vários ensaios clínicos de GBM. Uma segunda abordagem para o direcionamento de câncer células-tronco é promover a sua diferenciação. Esta abordagem tem recebido muito apoio devido os resultados favoráveis de estudos pré-clínicos e clínicos no tratamento da leucemia promielocítica aguda com ácidos retinoico (ATRA, um análogo da vitamina A). Aqui ATRA foi encontrado para remover o bloco de maturação e promover câncer de diferenciação celular8. Mais recentemente, Piccirillo e colegas elegantemente mostraram que BMP-4 promove a diferenciação de GSC em astrócitos com anti-GBM significativos efeitos in vitro e in vivo9.
A justificativa para o estudo atual é baseada em uma abordagem de "engenharia invertida" para segmentação GSCs. Dada a vasta heterogeneidade presente em GBM e com pobre diferenciação, sendo uma das marcas registradas do câncer, pedimos que se nós poderia promover um fenótipo mais favorável - diferenciação em um estado de astrocyte. Aqui, não temos conhecimento prévio dos caminhos sinalização que manter GSCs em uma amostra de determinado tumor mas prefiro visam alcançar um fenótipo desejado (por exemplo, positividade GFAP).
Este relatório descreve os procedimentos utilizados para estabelecer o GSC diferenciação repórter-linhas da transdução de culturas GSC-enriquecido a Seleção clonal de GSC. Estabeleceram-se as linhas de neurosphere de glioblastoma usadas no laboratório do Professor Angelo Vescovi de pacientes com diagnóstico de glioblastoma primário no Hospital San Raffaele - Milano, Itália. Estas linhas têm sido muito estudadas em várias publicações 6,10,11,12,13,14. É altamente recomendado que os indivíduos que estão interessados em implementar estas técnicas em seu laboratório determinam a relevância do repórter, a capacidade de auto-renovação de células-tronco de câncer nas células eles planejam estudar (isto é verdadeiro para qualquer repórter). Um protocolo detalhado para um dos ensaios clonogenic em vitro aceitados no campo é fornecido para realizar este15,16. Finalmente, um protocolo detalhado descrevendo a utilização das linhas de repórter de diferenciação em um teste de drogas baseada em citometria de fluxo é fornecido no final. Da nota, da mesma forma para o sistema de diferenciação de Ralevic descrito aqui, nós temos com sucesso estabelecido e validado linhas de repórter GSC integrando um repórter (diferenciação neuronal) de MAP2:GFP. Portanto, as metodologias descrevem neste livro pode ser aplicado para estudar a diferenciação celular em várias linhagens de células.
Algumas das figuras neste relatório podem ser encontradas em uma recente publicação: "Atracurium Besylate e outro agentes de bloqueio neuromuscular promover a diferenciação de Ralevic e empobrecem o glioblastoma as células-tronco18.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Nota: Sistemas de repórter de lentivirus neuronal e Ralevic foram comprados como preparações de Lentivirus pré-embalados, concentradas. Conhecimento básico da técnica de citometria de fluxo é necessário. Também, para um uso completo do presente protocolo o usuário terá acesso a um citômetro de fluxo com capacidade de produção elevada (aceita placas de 96 poços como fonte de exemplo).
1. Lentivirus repórter Transcriptional sistema
Nota: Em todas as análises de fluxo cytometric, use células parentais, não-transfectadas, ou vetor-transfectadas (não fluorescente) para o estabelecimento da fluorescência de base. Além disso, observe que em todas as etapas onde a trituração mecânica é chamada para, seja gentil. Trituração dura pode matar um número significativo dos GSCs frágil e influenciar os resultados de citometria de fluxo.
- Placa 1 x 106 células em 2 mL do meio de crescimento de células-tronco neurais completa em uma placa de 6-multiwell.
- Transduce células adicionando repórter lentivirus em uma multiplicidade de infecção (moi) igual a 5.
- Adicione 2 µ l de polybrene para uma concentração final de 8 µ g/mL.
- Incube as celulas em 37 ° C e 5% de CO2 durante a noite.
- No dia seguinte, substitua o meio de crescimento para remover vírus desacoplado. Coloque a placa de volta na incubadora a 37 ° C e 5% de CO2 e incubar por 24 h.
- Colheita de 0,5 mL do volume total; Gire para baixo as células a 360 x g durante 5 min à temperatura ambiente em um tubo cônico de 15 mL e remover o sobrenadante por aspiração. Adicionar 0,5 mL do meio de crescimento de novas células-tronco neurais para as células restantes e devolve a chapa para a incubadora para expansão contínua.
- Acrescente 200 µ l de reagente de dissociação e incube por 5 min a 37 ° C.
- Dissocia as células pipetando delicadamente acima e para baixo.
Nota: Trituração dura pode resultar em morte significativa de GSCs, dissociação completa é geralmente alcançada após 20 - 30 vezes. - Para minimizar a fixação da célula ou agregação, adicione 800 µ l de Hank está equilibrado sal solução (HBSS) para um volume final de 1 mL.
- Transferi 200 µ l de cada suspensão de células para um poço de uma placa de 96-multiwell.
- Para este procedimento, use um citômetro de fluxo de bancada com capacidade de placa de 96 poços, equipada com um laser azul para excitação e com a capacidade de detectar a proteína verde fluorescente. Realizar análise de fluxo cytometric pelo menos 10.000 células viáveis para cada aquisição.
- Determine a porcentagem de células GFP-positivo por citometria de fluxo.
2. subclone seleção, expansão e validação
- Células de placa em 100 µ l de células-tronco neurais médio em uma densidade de 0,7 células por poço de uma placa de 96-multiwell.
- Cultura de clones durante 11 dias a 37 ° C e 5% de CO2. Esta etapa é altamente dependente do tipo de célula e provavelmente exigirá um ajuste com base na linha de celulares usada. Como regra geral, uma esfera de diâmetro ≥ 100 µm é uma boa indicação da presença de clonogenic GSCs no neurospheres.
- Usando um microscópio fluorescente, equipado com um filtro FITC, marca os poços que contêm uma única neurosphere onde ~ 1-5% das células é GFP-positivo.
Nota: Determinar o percentual exato de células GFP-positivo não é demasiado crítico neste ponto. Cada um dos subclones mais tarde será avaliado por citometria de fluxo. Esta etapa é realizada para reduzir o total número de clones a serem analisados com ênfase na neurospheres que se originam por indiferenciado, GFAP-negativo, GSC. - Expanda o repórter selecionado clones até que haja um número suficiente de células para análise por citometria de fluxo. Um poço sub confluente da placa contendo ≤ 1.5x105 células/mL 6-multiwell deve fornecer um número suficiente de células.
Nota: Um procedimento detalhado para o isolamento e a expansão de GSCs é disponível 17.
3. a determinação da expressão GFAP:GFP por citometria de fluxo
- Recolher uma alíquota de células (0,5 mL) de cada clone de repórter e controles não-transfectadas para determinar o percentual exato de células GFP-positivo. Considerando os clones de repórter que contêm as células GFP-positivo de ~ 1-5%.
- Girar as células a 360 x g durante 5 min à temperatura ambiente e retire o sobrenadante por aspiração.
- Cada pellet, adicionar 200 µ l de reagente de dissociação de célula e incubar os tubos num banho de água situado a 37 ° C.
- Triture as células delicadamente para obter uma suspensão de célula única (geralmente entre 20 a 30 vezes).
- Para minimizar a fixação da célula ou agregação, adicione 800 µ l HBSS até um volume final de 1 mL.
- Transferi 200 µ l por alvéolo de uma placa de 96-multiwell de cada suspensão de células.
- Para este procedimento, use um citômetro de fluxo de bancada com capacidade de placa de 96 poços. Realizar análise de fluxo cytometric pelo menos 10.000 células viáveis para cada aquisição.
4. ELDA auto-renovação ensaio para avaliar a capacidade de Clonogenic
Nota: Para controles, tanto dos pais, não transfectadas, bem como expressando GFP células transfectadas de lentivirus, deve ser usado para determinar o potencial de clonogenic relativa das linhas repórter GSC diferenciação para as culturas de GSC originais do qual foram derivada.
- Dissocia a diferenciação-repórter subclones em suspensões de célula única conforme descrito acima.
- Células de placa em placas de 96-multiwell em 100 µ l de meio de crescimento de células-tronco neurais completa em densidades de célula variando entre 5 e 500 células por poço.
- Incube as células 9 a 11 dias a 37 ° C e 5% de CO2.
- Ponto positivos poços por visualização direta dos neurospheres sob um microscópio de luz. Um bem deve ser considerado "positivo" se ele contém pelo menos um único grande neurosphere.
- Conecte os dados: total poços analisados e o número de poços positivos usando a interface online de ELDA disponível em http://bioinf.wehi.edu.au/software/elda/index.html.
5. drogas biblioteca diluição preparação
- Remover placas de biblioteca de armazenamento a-80 ° C, cubra com papel alumínio (proteger compostos sensíveis à luz). Descongelar por aproximadamente 30 min a uma hora em temperatura ambiente.
- Use uma pipeta multicanal 12 canais para diluir os compostos de biblioteca para 0,2 mM no meio de células-tronco neurais completa. DMSO diluído a 10% em média de crescimento
Nota: A concentração final de DMSO deve ser 0,1% quando adicionada às células. Uma maior concentração de DMSO na cultura pode resultar em toxicidade. Por este motivo, é aconselhável testar a sensibilidade de DMSO em linhagem celular usada, antes do tratamento. - Usar o DMSO como controle de veículo para tratar células encontradas nas colunas esquerdas e direita de cada placa (colunas 1 e 12; Poços da a H).
- Cobrir as placas de biblioteca diluídos com folha de alumínio e retornar as chapas originais da biblioteca para o freezer-80 ° C para armazenamento a longo prazo.
6. drug Screen
Nota: Células tratada com DMSO devem ser usadas para definir a fluorescência de base e ajustar gating.
- Placa de 5 x 103 células em uma placa de 96-multiwell em 99 µ l de meio de cultura de células-tronco neurais completa.
- Usando uma pipeta multicanal 12 canais, trate as células com compostos de biblioteca diluído a uma concentração final de 2 µM (1 µ l de droga de 0,2 mM em 99 µ l de suspensão de células) ou com DMSO (controle). Incube as placas por 72 h a 37 ° C e 5% de CO2.
- Usando uma pipeta multicanal 12 canais adicionar 150 µ l de reagente de dissociação de celular a cada poço e incube por 20 min a 37 ° C.
- Dissocia as células por moer suavemente com uma pipeta multicanal 12 canais até alcançar a suspensão de célula única (geralmente entre 20 a 30 vezes). A quantidade de tempo necessária para dissociar neurospheres completamente irá variar entre linhas GSC. Enquanto o eritrócito recomendada de dissociação (ver materiais) é seguro e incubação por até 45 minutos não teve efeito sobre viabilidade em várias linhas de GSC testadas, verifique-se para cada linha de GSC para ser utilizado na triagem.
Nota: O volume final em cada bem deve ser aproximadamente 250 µ l (100 µ l de suspensão de células + 150 µ l de reagente de dissociação celular). - Determine a porcentagem de células expressando o repórter GFAP:GFP por citometria de fluxo. Padrão de uso da estratégia de retenção. Primeiro, trama para a frente e lateral espalha-se para ter uma noção geral do tamanho da célula e a viabilidade. Em seguida, coloque um portão na população viável de célula única. Isso é a população para a qual será determinada fluorescência verde (eGFP). Qualquer composto que resulta em um aumento da percentagem de GFP-positivo células por mais de três desvios-padrão sobre controle (DMSO-tratada) é considerada como um positivo "hit". Este limiar deve ser ajustado de acordo com a aplicação específica e o rigor desejado.
Nota: Para o alto throughput tela recomenda-se usando um único subclone de repórter de GSC. Após a identificação de ocorrência, cada batida deve ser validada contra subclones de repórter adicionais da mesma linha GSC. Para aumentar a confiança para verdadeiros hits é também recomendar testes compostos contra repórter subclones isolaram de diferentes GSC neurospheres linhas.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Três linhas independentes neurospheres paciente-derivados foram transfectadas com o repórter Ralevic de lentivirus codificação para uma proteína verde fluorescente (GFP) fundida em-frame com uma gaveta de resistência Zeocin e conduzidas pelo elemento humano para a promotora GFAP ( Figura 1). Próximo clones individuais foram isolados por chapeamento 0,7 células por poço em um prato bem 96 (Figura 2), este foi seguido por determinação cytometric do fluxo da percentagem de células expressando GFP (Figura 3). Clones de neurosphere, derivados de células únicas, contendo células de GFP-positivo ≤ 5% são referidos como GL (Low GFAP) enquanto clones contendo ≥75% GFP células positivas são referidos como GH (GFAP alta) e são considerados para ser mais diferenciada em comparação com o GL subclones (Figura 4).
Para identificar agentes e vias que podem controlar a diferenciação de Ralevic em GSCs, realizou-se uma tela de drogas da pequeno-molécula usando duas bibliotecas de NIH coleção clínica. As células foram tratadas por 72 horas com 727 agentes biblioteca da coleção NIH clínica I e II, fixada em uma concentração de 2 µM ou um volume igual de DMSO como um controle. O efeito destes agentes foi testado na viabilidade celular em todos os nossas paciente-derivado GBM neurosphere linhas em concentrações que variam de 0,2 µM a 20 µM, antes da apresentação da droga. A concentração utilizada neste protocolo permitida-nos identificar compostos que foram capazes de induzir a diferenciação de Ralevic e ao mesmo tempo, ele minimizado efeitos tóxicos potencialmente fora do alvo, devido às altas concentrações da droga.
Após incubação, determinamos a percentagem de células expressando o repórter GFAP-GFP por citometria de fluxo. Linhas de base para a viabilidade e a percentagem de células GFP-positivos foram determinadas pelo menos três poços para cada placa de biblioteca, e um sucesso positivo foi determinado como um aumento da percentagem de células GFP-positivo de três desvios padrão ao longo da linha de base (DMSO) e um limite mínimo de 25% células positivas de GFP. Nós identificamos 12 drogas que induziu suficiente aumento na população de GFP-positivo (tabela 1).
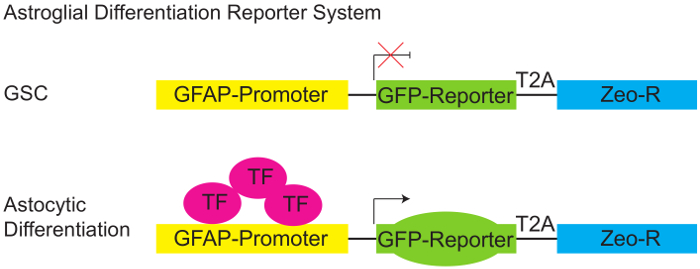
Figura 1: Sistema de repórter de diferenciação Ralevic.
Diagrama esquemático do repórter de GFAP:GFP de pGreenZeo. GSCs não expressam a combinação adequada de factores de transcrição necessários para ativar o promotor proteína ácida fibrilar glial (GFAP) e, portanto, não expressarão GFP (painel superior). No entanto, quando os fatores de transcrição adequadas estão presentes (por exemplo, quando as células adquirem um destino Ralevic - diferenciar) o promotor GFAP torna-se ativo, e as células expressarão o repórter GFP (painel inferior). (GSC - célula-tronco Glioma, vinculador T2A-proteína, Zeo-R - Zeocin gene de resistência, TF - fator de transcrição). Clique aqui para ver uma versão maior desta figura.

Figura 2: Ralevic diferenciação - seleção Subclone.
Fotos representativas do HSR-GBM1 GSC subclones expressando baixos níveis (GL) ou níveis elevados (GH) do repórter GFAP:GFP usando microscopia de fluorescência (ampliação de X 40 é mostrado). Clique aqui para ver uma versão maior desta figura.

Figura 3: Citometria de fluxo para a determinação de fluorescência verde.
HSR-GBM1 neurosphere paciente-derivado de linha foi transfectada com GFAP:GFP lentivirus de repórter e vários subclones foram selecionados com base na expressão de GFP na neurosphere iniciando-célula e confirmada por citometria de fluxo. Estes clones foram nomeados ou GL (Low GFAP) ou GH (GFAP alta). Clique aqui para ver uma versão maior desta figura.

Figura 4: Caracterização funcional de HSR-GBM1 GFAP:GFP subclones.
Subclones GL são mais clonogenic em vitro como indicado pelo aumento de frequências de GSC que são medidas pelo extremo do análise de diluição limitando (ELDA). Clique aqui para ver uma versão maior desta figura.
| Nome | Aumento de vezes no GFP + células | Descrição | Barreira hemato-encefálica | Drogas banco probabilidade |
| Vinorelbina | 8.97 | Quimioterapia antimitótica | - | 0,88 |
| Difenoxilato | 13,89 | Prebarados contra | + | 0,96 |
| Lomerizine | 10.89 | Bloqueador de canal de cálcio cerebral vasodilatador | AT | AT |
| Phenprobamate | 10,73 | Ansiolítico / muscular relaxante, ação central | AT | AT |
| 6-Azauridine | 15.07 | Antimetabolite / Antiviral | AT | AT |
| Irinotecano | 14,14 | Topisomerase eu inibidor | + | 0,63 |
| Besilato de atracúrio | 8.16 | Relaxante muscular esquelético despolarizantes | + | 0.93 |
| Glimepiride | 8,75 | Antidiabético | + | 0,73 |
| Hexaclorofeno | 9.83 | Anti-séptico | + | 0,92 |
| Digoxin | 8.23 | Cardiotônicas glicosídeo | - | 0.72 |
| Flecainida | 10 | Agente antiarritmia | + | 0.86 |
| Nisoldipine | 5.05 | Bloqueador dos canais de cálcio | - | 0,95 |
Tabela 1: Pequenas moléculas de indução de expressão de GFAP-GFP repórter no HSR-GBM1 GL-1
Doze foram encontrados para aumentar a percentagem de células GFP-expressando significativamente (aumento de vezes é mostrado) e conheceu os critérios rigorosos de desvios-padrão ≥3 ao longo da linha de base, as células tratadas DMSO e com não menos de 25% GFP-positivo de células. A habilidade e a probabilidade de um determinado agente para atravessar a barreira hemato-encefálica (droga banco (−). Abreviação: At (informação não disponível).
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Enquanto a maioria dos estudos anteriores de GSCs centradas-se principalmente os marcadores que os definem, neste estudo decidimos tomar a abordagem inversa. Focamos principalmente em progênies diferenciadas gerados pelo GSCs (por exemplo, células expressando marcadores neuronais e Ralevic). Aqui vamos demonstrar a utilização de uma sistema, que é baseado na expressão humana do promotor-dependente GFAP de GFP de despistagem de drogas baseada em célula alto throughput. Todos os experimentos foram realizados utilizando linhas de células de glioblastoma paciente-derivado neurosphere. Um protocolo detalhado descrevendo o isolamento e a expansão dessas linhas é descrito em Galli et al.17.
O sistema não só ajudou-na identificação de pequenas moléculas que são capazes de induzir a diferenciação celular de GSCs, mas também nos ajudaram a determinar inequivocamente que a expressão do marcador de diferenciação Ralevic GFAP determina o clonogenic capacidade de células individuais do GBM, comparando as frequências de GSC. O ensaio de ELDA foi desenvolvido por Yifang Hu e Gordon K. Smyth. Os leitores são encorajados a ler o manuscrito para um conhecimento profundo sobre o ensaio pontos fortes e limitações15. A formação da colônia marcando passo é altamente dependente do tipo de célula e provavelmente exigirá um ajuste com base na linha de celulares usada. Além disso, como regra geral, usamos a esfera diâmetro ≥100 µm como uma boa indicação de que o neurosphere foi originado por um clonogenic GSC.
Além disso, a sistema que descrevemos aqui de despistagem de drogas permite a identificação de novela caminhos (especificamente acetilcolina e cálcio de transporte) que são obrigados a manter GSCs no estado indiferenciado (ver tabela 1). A concentração inicial da droga pode variar com base na linha de biblioteca e célula utilizada. Além disso, o tempo necessário para a diferenciação celular pode precisar de ajuste. Além disso, a oncogenicidade validação dos hits de drogas requer uma iniciação de tumor na vivo do ensaio 18.
Potencialmente uma menor limitação dessa técnica é que diferenciação espontânea ocorre inevitavelmente em qualquer cultura de células-tronco enriquecida, e este fenômeno tende a aumentar com o número de passagens em cultura e difere entre subclones individuais. Com efeito, observamos diferenciação espontânea em nossas subclones geralmente após passagem 15. Portanto, reduzimos nossas análises de diferenciação de culturas em números de passagem não superior a cinco anos.
Portanto, talvez o mais ponto crítico nesta metodologia é manter in-vitro passagem destas GSCs ao mínimo e ao trabalhar em vitro, para manter a densidade de cultura abaixo 1.5x105 células/mL. Além disso, é altamente recomendável que cada droga "bater" é validado contra subclones de repórter adicionais da mesma linha GSC, bem como, contra o repórter subclones isoladas de diferentes derivados de paciente GSC neurospheres linhas. Isso aumentará a confiança de que um verdadeiro "hit" está à mão.
A versatilidade da metodologia descrita neste protocolo robusto reforça o valor terapêutico de uma diferenciação de células-tronco de câncer induzido e deve ajudar na identificação de novas drogas como potenciais novas estratégias terapêuticas para GBM e outros tumores. Finalmente, o ensaio pode ser otimizado para ser usado com células-tronco neurais não-neoplásicos, outros tipos de câncer e com repórteres de diferentes de diferenciação.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Os autores não têm nada para divulgar.
Acknowledgments
Este trabalho foi parcialmente apoiado pela NIH R01CA187780.
Materials
| Name | Company | Catalog Number | Comments |
| ESGRO Complete Accutase | EMD Millipore | SF006 | |
| Dimethyl Sulfoxide (DMSO) | Sigma Aldrich | D2650 | |
| HBSS (Hank's Balanced Salt Solution) | Sigma Aldrich | H6648 | |
| Human GFAP Differentiation Reporter (pGreenZeo, Virus) | SBI (System Biosciences) | SR10015VA-1 | |
| 50 ml sterile disposable reagent reservoirs | Corning | 4870 | |
| 6 well plate | Thermo Fisher Scientific | 130184 | |
| 96 well plate | Falcon | 353072 | |
| Biolite T25 cm² Flask Vented | Thermo Fisher Scientific | 130189 | |
| Biolite T75 cm² Flask Vented | Thermo Fisher Scientific | 130190 | |
| 15 ml Centrifuge tubes | Celltreat | 229411 | |
| 1.5ml Microcentrifuge tubes | Fisher Scientific | 05-408-129 | |
| Ovation Multi Channel Pipette, 12 Channel, 0.5 - 20uL | VistaLab Technologies | 1060-0020 | |
| Ovation Multi Channel Pipette, 12 Channel, 5-250uL | VistaLab Technologies | 1060-0250 | |
| Multi 12-channel pipette tips 25 μl | VistaLab Technologies | 4060-1002 | |
| Multi 12-channel pipette tips 250 μl | VistaLab Technologies | 4060-9025 | |
| Guava easyCyte 5HT Benchtop Flow Cytometer | EMD Millipore | 0500-4005 | |
| NIH Clinical Collections 1 and 2 small molecule libraries | Evotec | ||
| Name | Company | Catalog Number | Comments |
| For the preparation of neural stem cell media (500 mL) | Final concentration | ||
| BSA | GoldBio.com | A-421-250 | 0.20% |
| DMEM/F12 10X | Corning | 90-091-PB | 1X |
| Heparin sodium salt | Sigma Aldrich | H3149 | 0.0002% |
| HEPES 1M | Sigma Aldrich | H4036 | 5.4 mM |
| Insulin-Transferrin- Selenium (ITS -G) (100X) | Life Technologies | 41400-045 | 1X |
| NaHCO3 | Sigma Aldrich | S-5761 | 14.5 mM |
| Penicillin-Streptomycin (10,000 U/mL) 100X | Gibco | 15140-122 | 1X |
| Progesterone | Sigma Aldrich | P8783 | 16 nM |
| Putrescine | Sigma Aldrich | P5780 | 4.8 µM |
| Basic FGF (FGF2), Human | GoldBio | 1140-02-50 | 10 ng/ml |
| EGF, Human | GoldBio | 1150-04-100 | 20 ng/ml |
| Bottle-Top Filter, 150ml, 33mm, 0.22um, Pes, S, Ind | Corning | 431160 | Use to filter sterlize media |
References
- Maher, E. A., et al. Malignant glioma: genetics and biology of a grave matter. Genes Dev. 15 (11), 1311-1333 (2001).
- Bonavia, R., Inda, M. M., Cavenee, W. K., Furnari, F. B. Heterogeneity maintenance in glioblastoma: a social network. Cancer Res. 71 (12), 4055-4060 (2011).
- Bao, S., et al. Glioma stem cells promote radioresistance by preferential activation of the DNA damage response. Nature. 444 (7120), 756-760 (2006).
- Sul, J., Fine, H. A. Malignant gliomas: new translational therapies. Mt Sinai J Med. 77 (6), 655-666 (2010).
- Bar, E. E., Chaudhry, A., Farah, M. H., Eberhart, C. G. Hedgehog signaling promotes medulloblastoma survival via Bc/II. Am J Pathol. 170 (1), 347-355 (2007).
- Chu, Q., Orr, B. A., Semenkow, S., Bar, E. E., Eberhart, C. G. Prolonged inhibition of glioblastoma xenograft initiation and clonogenic growth following in vivo Notch blockade. Clin Cancer Res. 19 (12), 3224-3233 (2013).
- Schreck, K. C., et al. The Notch target Hes1 directly modulates Gli1 expression and Hedgehog signaling: a potential mechanism of therapeutic resistance. Clin Cancer Res. 16 (24), 6060-6070 (2010).
- Warrell, R. P. Jr, et al. Differentiation therapy of acute promyelocytic leukemia with tretinoin (all-trans-retinoic acid). N Engl J Med. 324 (20), 1385-1393 (1991).
- Piccirillo, S. G., et al. Bone morphogenetic proteins inhibit the tumorigenic potential of human brain tumour-initiating cells. Nature. 444 (7120), 761-765 (2006).
- Bar, E. E., et al. Cyclopamine-mediated hedgehog pathway inhibition depletes stem-like cancer cells in glioblastoma. Stem Cells. 25 (10), 2524-2533 (2007).
- Bar, E. E., Lin, A., Mahairaki, V., Matsui, W., Eberhart, C. G. Hypoxia increases the expression of stem-cell markers and promotes clonogenicity in glioblastoma neurospheres. Am J Pathol. 177 (3), 1491-1502 (2010).
- Kahlert, U. D., et al. CD133/CD15 defines distinct cell subpopulations with differential in vitro clonogenic activity and stem cell-related gene expression profile in in vitro propagated glioblastoma multiforme-derived cell line with a PNET-like component. Folia Neuropathol. 50 (4), 357-368 (2012).
- Lim, K. S., et al. Inhibition of monocarboxylate transporter-4 depletes stem-like glioblastoma cells and inhibits HIF transcriptional response in a lactate-independent manner. Oncogene. 33 (35), 4433-4441 (2014).
- Kahlert, U. D., et al. ZEB1 Promotes Invasion in Human Fetal Neural Stem Cells and Hypoxic Glioma Neurospheres. Brain Pathol. 25 (6), 724-732 (2014).
- Hu, Y., Smyth, G. K. ELDA: extreme limiting dilution analysis for comparing depleted and enriched populations in stem cell and other assays. J Immunol Methods. 347 (1-2), 70-78 (2009).
- Meyer, M., et al. Single cell-derived clonal analysis of human glioblastoma links functional and genomic heterogeneity. Proc Natl Acad Sci U S A. 112 (3), 851-856 (2015).
- Galli, R., et al. Isolation and characterization of tumorigenic, stem-like neural precursors from human glioblastoma. Cancer Res. 64 (19), 7011-7021 (2004).
- Spina, R., Voss, D. M., Asnaghi, L., Sloan, A., Bar, E. E. Atracurium Besylate and other neuromuscular blocking agents promote astroglial differentiation and deplete glioblastoma stem cells. Oncotarget. 7 (1), 459-472 (2016).



