ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
ويرد هنا تدفق الخلوي طريقة لتحديد الكمية نشاط السامة للخلايا من الخلايا القاتلة الطبيعية البشرية.
Abstract
ضمن نظام المناعة الفطرية، لمفاوية المستجيب المعروفة باسم خلايا (ناغورني كاراباخ) القاتل الطبيعية تلعب دوراً أساسيا في الدفاع المضيف ضد الخلايا الشاذة، وعلى وجه الخصوص القضاء على الأورام وفيروسي إصابة الخلايا. حوالي 30 من عيوب monogenic المعروفة، جنبا إلى جنب مع مجموعة كبيرة من الحالات المرضية الأخرى، يسبب نقص الخلية ناغورني كاراباخ الوظيفية أو الكلاسيكية، يظهر في انخفاض أو غياب النشاط السامة للخلايا. وتاريخيا، كانت قد أجرت التحقيق سيتوتوكسيسيتي مع أساليب المشعة، ومرهقة ومكلفة ويحتمل أن تكون خطرة. توضح هذه المقالة المطبقة سريرياً، تبسيط تدفق الخلوي طريقة لقياس نشاط ناغورني كاراباخ الخلايا السامة للخلايا. في هذا التحليل، خلايا الدم المحيطية وحيدات النوى (ببمكس) أو المنقي الاستعدادات خلية ناغورني كاراباخ المحتضنة شارك في نسب مختلفة مع خط خلية ورم المستهدف من المعروف أن حساسة إلى ناغورني كاراباخ بوساطة الخلايا سيتوتوكسيسيتي (نككك). الخلايا المستهدفة المسماة مسبقاً مع صبغة فلورسنت للسماح بالتمييز ضدهم من خلايا المستجيب (ناغورني كاراباخ الخلايا). بعد فترة الحضانة، يتم تحديد الخلايا الهدف قتل بوصمة حمض النووي، الذي يتخلل الخلايا الميتة على وجه التحديد. هذا الأسلوب هو قابلة للتشخيص وتطبيقات البحوث سواء، بفضل قدرات متعددة المعلمة التدفق الخلوي، ميزة إضافية يحتمل أن يتيح إجراء تحليل أعمق من ناغورني كاراباخ خلية النمط الظاهري ووظيفة.
Introduction
الخلايا (ناغورني كاراباخ) القاتل الطبيعية مجموعة فرعية متطورة من الإنسان الفطرية لمفاوية المشاركة حاسمة في القضاء على الخلايا المصابة فيروسي وتحول الخلايا الأخرى المسببة للأمراض التهديدات 1،2. ناغورني كاراباخ خلية حبيبات الحال البيت البروتينات السامة للخلايا، مثل بيرفورين وجرانزيميس. عند التنشيط، ناغورني كاراباخ الخلايا تشكل تفاعل معقد مع أهدافها المعروفة باسم المشبك المناعية، حيث يتم الإفراج عن هذه الجزيئات عن محلياً، مما أدى إلى تحلل الخلية الهدف المباشر والمبرمج، إلى جانب الإفراج عن سيتوكين وتشيموكيني وفي نهاية المطاف في استحثاث التهابات الدولة 1،،من34.
ناغورني كاراباخ خلية التنشيط ينطوي على سلسلة معقدة من تفعيل والمثبطة التفاعلات بين ناغورني كاراباخ الخلايا مستقبلات ويغاندس أعرب على سطح الخلايا المستهدفة، وتشكيل نظام محكم تنظيم. واحدة من أهم درس آليات تفعيل الخلية ناغورني كاراباخ هو "الذات المفقودة". في الواقع، عدم الكشف عن فئة أنا الرئيسية histocompatibility المعقد (MHC)، أو جزيئات مستضد (هلا) الكريات البيض البشرية، على المصابين أو تحول الخلايا المشغلات ناغورني كاراباخ خلية سيتوتوكسيسيتي. الورم والخلايا المصابة بالفيروسات عموما downregulate الخلية هذه المستضدات هربا من الحصانة T الخلية بوساطة، وبذلك أصبحت ناغورني كاراباخ الابتدائي الأهداف 1،،من34.
يتم تصنيف تقييم الدالة cell ناغورني كاراباخ أساسا إلى تحبب أو سيتوتوكسيسيتي فحوصات. ومع ذلك، فحوصات تحبب، مثل تدفق سيتوميتريك الكشف عن علامة تحبب المرتبطة CD107a، فقط إرشادية ناغورني كاراباخ خلية التنشيط وليس من وظيفتها في نهاية المطاف، قتل مباشرة من الخلايا الهدف 5،6،،من78. ومن ثم، اجتذب هذا القيد المحققين لفحوصات سيتوتوكسيسيتي كبديل أكثر دلالة وأكثر مباشرة.
منذ فترة طويلة "المعيار الذهبي" لتقييم الخلية بوساطة نشاط السامة للخلايا من خلايا تي وناغورني كاراباخ هو فحص الإصدار الكروم (CRA). CRA ينطوي على تسمية الخلايا المستهدفة مع 51Cr إشعاعيا وتفرخ لهم المشاركة مع خلايا المستجيب. هذا التحليل غارق في مبدأ أن تحلل الخلية يؤدي إلى الإفراج عن البروتين زمنياً 51Cr في المادة طافية، الذي يمكن أن يقاس بالعد غاما. هذا الفحص، بينما فعالة، وإشكالية بالنسبة لمجموعة متنوعة من الأسباب: ارتفاع تكاليف المواد ومعالجة والتخلص من المشعة 51Cr وعفوية الإفراج عن 51Cr وتوحيد صعبة--مما يجعل من غير العملي تماما 9،10.
منذ ذلك الحين وضعت عددا من الاختبارات غير المشعة، التي تشمل العلامات الفلورية والإفراج عن إنزيم، وحتى الإضاءة الحيوية، كبدائل لطعنة 11،12،،من1314. يصف لنا هنا تدفق الخلوي طريقة لقياس ناغورني كاراباخ الخلايا السامة للخلايا نشاط في الخلايا الهدف K562 بسيطة وحساسة، واستنساخه. خلايا K562 هي خط خلية اريثروليوكيميك بشرية مع انخفاض التعبير عن فئة هلا أنا والتعبير المتزايد من يغاندس لمستقبلات أكتيفاتوري في ناغورني كاراباخ، مما يجعلهم عرضه بشكل خاص إلى ناغورني كاراباخ الخلية بوساطة سيتوتوكسيسيتي 15. في هذا التحليل، K562 الخلايا المسماة مسبقاً مع كاربوكسيفلوريسسين اسيتات سوكسينيميديل إستر (CFSE) ومثقف شارك في نسب مختلفة مع أما خلايا الدم المحيطية وحيدات النوى (ببمكس) أو تنقيته ناغورني كاراباخ الخلايا 1. كفسي هو صبغة فلورسنت مستقرة وملزمة البروتين يسمح تمييز الخلايا المستهدفة من المستجيب ناغورني كاراباخ الخلايا 16،17. بعد الحضانة المشتركة، وصمة عار حمض النووي، على وجه التحديد تتخلل غشاء الخلايا الميتة، يستخدم لتحديد الخلايا الهدف قتل (انظر الجدول للمواد). ثم تكتسب العينات في سيتوميتير تدفق لتحديد النسبة المئوية للميت (أي، وصمة عار +) كفسي + الخلايا المستهدفة.
يمكن استخدام هذا الفحص كفحص تشخيصي روتيني monogenic العيوب التي تؤثر في حجرة خلية ناغورني كاراباخ، التي يوجد منها حوالي 30 العيوب المعروفة يسبب عوز خلية ناغورني كاراباخ الوظيفية أو الكلاسيكية، وليمفوهيستيوسيتوسيس هيموفاجوسيتيك الابتدائي أو الثانوي. كما أنها مفيدة للتحقيق في نشاط الخلية ناغورني كاراباخ في المرضى مع القوباء المتكررة، وشديدة العدوى الفيروسية، لتقييم إعادة تشكيل المناعة بعد زرع الخلايا المكونة للدم أو وظيفة immunomodulatory العلاج 18،،من1920، ومجموعة كبيرة من تطبيقات البحوث الأساسية.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
قبل إعداد المقايسة، المستحسن جداً أن يتم تقييم محتوى الخلية ناغورني كاراباخ في السكان المستجيب للاختيار. ويبين الشكل 1 تلطيخ CD56 نموذجية قبل (أزرق فاتح) وبعد تخصيب خلية ناغورني كاراباخ (أحمر). ناغورني كاراباخ الخلايا تتألف يصل إلى 15% ببمكس وينبغي أن يكون على الأقل 80 ٪ نقية بعد تخصيب اليورانيوم.
تحليل تدفق سيتوميتريك في هذا التحليل ينطوي على الكشف عن معلمتين: كفسي، يمكن اكتشافها في نفس القناة فيتك؛ ووصمة عار خلية ميتة، يمكن اكتشافها في نفس القناة آسيا والمحيط الهادئ (الشكل 2 أ، ب). وبعد الحصول على البيانات، يتم استخدام استراتيجية النابضة في الشكل 2 لتحليل البيانات. الميت (أي خلية ميتة وصمة عار +) K562 الخلايا المستهدفة هي بوابات الخروج من كفسي + السكان، توفير % من قتل الخلايا ضمن السكان المستهدفين.
مراقبة الشروط أهمية حاسمة في ضمان فعالية الإنزيم نفسه ومكوناته منفصلة. من أجل التحليل اعتبارها صالحة، ينبغي أن يتوقع ما يلي في ظروف السيطرة (6-8): استهداف الخلايا فقط (شرط 6) ينبغي أن يسفر عن موت الخلية < 15% (الشكل 3A). لا توجد إشارة كفسي ينبغي الكشف عنها للمستجيب الخلايا فقط (الحالة 7)، وينبغي أن يكون موت الخلية < 5% (الشكل 3B). توين بوساطة قتل الخلايا المستهدفة (شرط 8)، ينبغي أن يكون موت الخلية > 85% (الشكل 3).
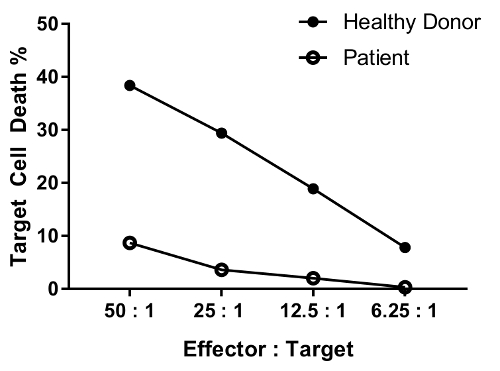
يتوقع مريض بخلل في وظيفة الخلية ناغورني كاراباخ أدى إلى خفض النشاط قتل في معظم أو اختبار كل النسب مقارنة صحة فرد. الموازية للمانحين صحي وخلايا المريض في الشكل 4 يبين الحد التفاضلي، كبير في موت الخلية المستهدفة مع تناقص نسبة الخلية المستهدفة المستجيب.

رقم 1: تقييم لمحتوى الخلية ناغورني كاراباخ داخل السكان المستجيب. مجموع ببمكس (أزرق فاتح) الرسم البياني الممثل بعد تلطيخ أو تنقية الخلايا ناغورني كاراباخ (أحمر) ل CD56. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

رقم 2: استراتيجية للكشف عن الخلايا الهدف النابضة. A) يتم تعيين البوابة الأولى في مؤامرة فيتك-A/SSC-أ. هي بوابات الخلايا K562 كأحداث كفسي +. ب) الخلايا K562 الميت (أي وصمة إيجابية لخلية الميت) هي بوابات في المؤامرة APC-A/SSC-أ اللاحقة ضمن السكان الخلية المستهدفة كفسي +. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

الشكل 3: بيانات تمثيلية لمراقبة ظروف. أ) النسبة المئوية للخلية ميتة وصمة عار + K562 الخلايا داخل بوابة كفسي + (النابضة الاستراتيجية كما هو الحال في الشكل 2) في حالة 6 (الخلايا الهدف فقط)-مراقبة سلبية لموت الخلايا K562. ب) كفسي وخلية ميتة وصمة عار الكشف في حالة 7 (المستجيب الخلايا فقط--مجموع ببمكس). ج) النسبة المئوية للخلية ميتة وصمة عار + K562 الخلايا داخل بوابة كفسي + (النابضة الاستراتيجية كما هو الحال في الشكل 2) في حالة 8 (الخلايا الهدف + توين)-مراقبة إيجابية لموت الخلايا K562. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

الشكل 4: بيانات تمثيلية لتخفيف تأثير مختلف نسبة الخلية المستهدفة المستجيب. نسب خلية المستجيب: الهدف اختبار كما يلي: 50: 1، 25: 1؛ 12.5:1؛ 6.25:1. البيانات هي الخلفية (شرط #6)-إزالة. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
| عينة | الشرط | المستجيب (ه): الهدف (T) |
| ببمكس | 1-إيجابية التحكم ناغورني كاراباخ خلية سيتوتوكسيسيتي | إيل-2 + 50:1 |
| 2 | 50:1 | |
| 3 | 25:1 | |
| 4 | 12.5: 1 | |
| 5 | 6.25: 1 | |
| 6 | تي فقط | |
| 7-السلبية السيطرة للموت K562 | ه فقط | |
| 8-إيجابية تحكم للموت K562 | T + توين | |
| ناغورني كاراباخ الخلايا (تنقية) | 1-إيجابية التحكم ناغورني كاراباخ خلية سيتوتوكسيسيتي | إيل-2 + 5:1 |
| 2 | 5:1 | |
| 3 | 2.5: 1 | |
| 4 | 1.25: 1 | |
| 5 | 0.625: 1 | |
| 6 | تي فقط | |
| 7-السلبية السيطرة للموت K562 | ه فقط | |
| 8-إيجابية تحكم للموت K562 | T + توين |
الجدول 1
Subscription Required. Please recommend JoVE to your librarian.
Discussion
الأسلوب الموصوفة هنا يوفر بديلاً واضحة وفعالة من حيث التكلفة للمقايسة الإفراج عن الجمهورية التشيكية التقليدية 51لتقييم نشاط ناغورني كاراباخ الخلايا السامة للخلايا. هذا الأسلوب هو حساس واستنساخه، وأقل استهلاكاً للوقت من الأساليب القياسية السابقة، مثل اللجنة السويسرية للطعون، ويمكن استخدامها على حد سواء سريرية وبحوث التطبيقات.
بينما يعمل المقايسة مع مجموع ببمكس والمخصب ناغورني كاراباخ الخلايا، خيار استخدام ببمكس دون الحاجة إلى تنقية السكان خلية فائدة كبيرة عند التعامل مع كميات صغيرة من الدم التي تم جمعها أو خلايا نوعية قليلة أو فقيرة من عينات المرضى. يستخدم هذا الفحص فقط كفسي وخلية ميتة الاستبعاد بقاء وصمة عار. تبحث في هذين المعيارين وحدها يقدم معلومات موجزة وكافية لأغراض التشخيص، مع فائدة إضافية من لا تتطلب المزيد من التعويضات في تحليل تدفق سيتوميتريك.
يمكن أيضا استخدام هذا الأسلوب لدراسة بيولوجيا الخلية الأساسية في ناغورني كاراباخ واختبار العلاجات المستهدفة للخلية ناغورني كاراباخ رواية. وفي هذا الصدد، قدرات الاتساع سيتوميتيرس تدفق إدخال عنصر لا تقدر بثمن من براعة لهذا التحليل، السماح لتحليل مولتيباراميتير ناغورني كاراباخ الخلايا ونشاطها ليس ممكناً في السابق مع فحوصات مثل اللجنة السويسرية للطعون. تتوفر البديلة خلية تتبع والأصباغ البقاء، الاستشعاع في القنوات الأخرى، لتلبية احتياجات المحققين.
هذا البروتوكول هو الأمثل للاستخدام مع ناغورني كاراباخ تنميط الخلية الهدف خط الخلية K562. ومع ذلك، يمكن تكييفه مع خطوط الخلايا الهدف تعليق البديلة بدرجات متفاوتة من الحساسية إلى ناغورني كاراباخ الخلية سيتوتوكسيسيتي، مثل HL-60، داودي، U937 وراجي. وفي هذا الصدد، من المهم ملاحظة قد يكون تركيز صبغة الفلورسنت والأمصال المستخدمة خلال وسم الخلية الهدف الأمثل لكل خط الخلية المستهدفة، كخطوط الخلايا المختلفة قد يستغرق التسمية الفلورسنت بطريقة مختلفة، ولكل سيتوميتير التدفق. بينما عادة ما يوصي بتجنب استخدام المصل أثناء وضع العلامات، اخترنا تبريد طفيف بنسبة 0.5 في المائة FBS لسببين. أولاً، أنه يساعد على الحد من الإجهاد الخلية المستهدفة وهكذا وصمة عار الخلفية؛ ثانيا، أن يجلب إشارة كفسي ضمن النطاق المناسب للكشف عن سيتوميتير تدفق لدينا دون الحاجة إلى التعديلات إعدادات اليومية، مما يساعد في إمكانية تكرار نتائج للمقايسة. قد تتضمن الاختلافات البروتوكول الإضافي اختبار نسب E:T مختلفة وأوقات الاحتضان التكيف مع المقايسة لتفعيل مختلف الظروف. تاريخيا تراوحت مدة ثقافة المشارك المستجيب والخلايا المستهدفة لاختبار سيتوتوكسيسيتي ناغورني كاراباخ ح 4-16، على الرغم من أن فترات أطول تميل إلى أن تسفر عن زيادة الإفراج عفوية 9،16. في أسلوبنا، حضانة أطول قد كما يؤدي فقدان الفلورسنت وسم بالخلايا المستهدفة بسبب القتل أو الانتشار، كما هي تضعف هذه الأصباغ الفلورية عند انقسام الخلية. وهكذا، إينكوبيشنز في النهاية السفلي من الإطار الزمني المفضل عموما وأنها لا ينبغي أن تتجاوز بين عشية وضحاها حضانة 6،،من1622.
من المهم الإحاطة علما التي متغيرات محتملة يمكن أن تؤثر نتائج هذا الفحص. في تجربتنا، الخلايا الهدف K562 حساسية خاصة للتغيرات في درجات الحرارة. ولذلك، الخلايا K562 لا ينبغي المبردة ولكن بدلاً من ذلك تحفظ في درجة حرارة الغرفة أو وضعها في هوميديفيد CO2 حاضنة في 37 درجة مئوية قبل استخدامها. ولنفس السبب، ينبغي الكواشف جميع لدرجات الحرارة المناسبة كما هو مبين في البروتوكول. هي معلمة أخرى تؤثر على هذه الخلايا سرعة الطرد المركزي، والتي ينبغي أن تخفض إلى تقليل الإجهاد الخلوية. وعلاوة على ذلك، قصر الوقت الفاصل بين إعداد المستجيب/الهدف والبدء الحضانة المشتركة إلى أقل من 30 دقيقة أمر ضروري لضمان النشاط القصوى القتل والاعتداء في إمكانية تكرار نتائج. وبالمثل، كما كفسي إشارة قوية عموما، دقيقة بيبيتينج، خلط السليم من الخلايا وحضانة دقيقة الوقت عند وضع العلامات وتبريد ذات أهمية حاسمة لضمان الاتساق في تلطيخ. وأخيراً، ناغورني كاراباخ الخلايا السامة للخلايا القدرة هو متغير جداً حتى في الأشخاص الأصحاء ويتأثر بعدد من العوامل، بما في ذلك مرحلة النمو والجنس والعمر والوزن 23،24،25- وبالإضافة إلى ذلك، تصل إلى 30% ضوابط صحية عرض تخفيض كبير أو فقدان تام للقدرة السامة للخلايا إذا اختبرت أكثر من 24 ساعة بعد رسم الدم. لذلك، من المستحسن ببمكس استخدام تنقية طازجة أو ناغورني كاراباخ الخلايا كلما كان ذلك ممكناً.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
الكتاب يعلن أي تعارض للمصالح المالية.
Acknowledgments
نود أن نشكر نارسيسو جيل، مركز إيمونوجينيتيكس، وجامعة كاليفورنيا لمساعدتها مع إعداد مخطوطة.
Materials
| Name | Company | Catalog Number | Comments |
| Phosphate-buffered Saline (1x, w/o Ca2+ and Mg2+) | Corning (Cellgro) | 21-040-CM | |
| Ficoll-Paque PLUS | GE Healthcare | 17-1440-02 | |
| Tween-20 | Sigma | BP337-100 | |
| RPMI 1640 Media | Corning (Cellgro) | 10-040-CV | |
| Heat-inactivated Fetal Bovine Serum | Omega Scientific | FB-02 | |
| Penicillin Streptomycin | Life Technologies | 15140-163 | Stock solution at 10,000 U/mL |
| IL-2 | R&D Systems | 202-IL-050 | Lyophilized from a 0.2 μm filtered solution in Acetonitrile and TFA with BSA as a carrier protein. Reconstitute with 500 ul at 100 μg/mL in sterile 100 mM Acetic Acid containing at least 0.1% bovine serum albumin (2.1x10E6 IU/ml) |
| K562 Cells | ATCC | CCL-243 | Cancer cell line |
| T-75 cell culture flasks | Corning | 431464 | |
| CFSE cell proliferation kit | Life Technologies (CellTrace) | C34554 | Reconstitute I vial with 18 ul DMSO to prepare a 5mM stock solution. Do not freeze/thaw. |
| Sytox Red | Life Technologies | S34859 | Stock solution is provided at 5 μM in 1 mL DMSO. The DMSO solution may be subjected to multiple freeze-thaw cycles without reagent degradation. |
| Sodium/lithium heparin blood collection tubes | BD | 02-687-95 | |
| U-bottom 96-well plate | Corning | CLS3897 | |
| Serological pipettes | BD Falcon | ||
| Polystyrene round-bottom tubes (5mL) | BD Falcon | 14959-5 | |
| 50 mL polypropylene conical tube | BD Falcon | 352070 | |
| 15 mL polypropylene conical tube | BD Falcon | 352097 | |
| Reagent reservoir | USA Scientific | 2321-2230 | |
| Human NK cell enrichment cocktail | StemCell Technologies (RosetteSep) | 15065 |
References
- Iannello, A., Debbeche, O., Samarani, S., Ahmad, A. Antiviral NK cell responses in HIV infection: I. NK cell receptor genes as determinants of HIV resistance and progression to AIDS. J Leukoc Biol. 84 (1), 1-26 (2008).
- Caligiuri, M. A. Human natural killer cells. Blood. 112 (3), 461-469 (2008).
- Topham, N. J., Hewitt, E. W. Natural killer cell cytotoxicity: how do they pull the trigger? Immunology. 128 (1), 7-15 (2009).
- Warren, H. S., Smyth, M. J. NK cells and apoptosis. Immunol Cell Biol. 77 (1), 64-75 (1999).
- Tognarelli, S., Jacobs, B., Staiger, N., Ullrich, E. Flow Cytometry-based Assay for the Monitoring of NK Cell Functions. J Vis Exp. (116), (2016).
- Somanchi, S. S., McCulley, K. J., Somanchi, A., Chan, L. L., Lee, D. A. A Novel Method for Assessment of Natural Killer Cell Cytotoxicity Using Image Cytometry. PLoS One. 10 (10), e0141074 (2015).
- Alter, G., Malenfant, J. M., Altfeld, M. CD107a as a functional marker for the identification of natural killer cell activity. J Immunol Methods. 294 (1-2), 15-22 (2004).
- Atkinson, E. A., Gerrard, J. M., Hildes, G. E., Greenberg, A. H. Studies of the mechanism of natural killer (NK) degranulation and cytotoxicity. J Leukoc Biol. 47 (1), 39-48 (1990).
- Kim, G. G., Donnenberg, V. S., Donnenberg, A. D., Gooding, W., Whiteside, T. L. A novel multiparametric flow cytometry-based cytotoxicity assay simultaneously immunophenotypes effector cells: comparisons to a 4 h 51Cr-release assay. J Immunol Methods. 325 (1-2), 51-66 (2007).
- Kane, K. L., Ashton, F. A., Schmitz, J. L., Folds, J. D. Determination of natural killer cell function by flow cytometry. Clin Diagn Lab Immunol. 3 (3), 295-300 (1996).
- Jang, Y. Y., et al. An improved flow cytometry-based natural killer cytotoxicity assay involving calcein AM staining of effector cells. Ann Clin Lab Sci. 42 (1), 42-49 (2012).
- Korzeniewski, C., Callewaert, D. M. An enzyme-release assay for natural cytotoxicity. J Immunol Methods. 64 (3), 313-320 (1983).
- Karimi, M. A., et al. Measuring cytotoxicity by bioluminescence imaging outperforms the standard chromium-51 release assay. PLoS One. 9 (2), e89357 (2014).
- Oppenheim, D. E., et al. Glyco-engineered anti-EGFR mAb elicits ADCC by NK cells from colorectal cancer patients irrespective of chemotherapy. Br J Cancer. 110 (5), 1221-1227 (2014).
- West, W. H., Cannon, G. B., Kay, H. D., Bonnard, G. D., Herberman, R. B. Natural cytotoxic reactivity of human lymphocytes against a myeloid cell line: characterization of effector cells. J Immunol. 118 (1), 355-361 (1977).
- Jedema, I., van der Werff, N. M., Barge, R. M., Willemze, R., Falkenburg, J. H. New CFSE-based assay to determine susceptibility to lysis by cytotoxic T cells of leukemic precursor cells within a heterogeneous target cell population. Blood. 103 (7), 2677-2682 (2004).
- Lecoeur, H., Fevrier, M., Garcia, S., Riviere, Y., Gougeon, M. L. A novel flow cytometric assay for quantitation and multiparametric characterization of cell-mediated cytotoxicity. J Immunol Methods. 253 (1-2), 177-187 (2001).
- Carotta, S. Targeting NK Cells for Anticancer Immunotherapy: Clinical and Preclinical Approaches. Front Immunol. 7, 152 (2016).
- Mandal, A., Viswanathan, C. Natural killer cells: In health and disease. Hematol Oncol Stem Cell Ther. 8 (2), 47-55 (2015).
- Rezvani, K., Rouce, R. H. The Application of Natural Killer Cell Immunotherapy for the Treatment of Cancer. Front Immunol. 6, 578 (2015).
- Angelo, L. S., et al. Practical NK cell phenotyping and variability in healthy adults. Immunol Res. 62 (3), 341-356 (2015).
- Zons, P., et al. Comparison of europium and chromium release assays: cytotoxicity in healthy individuals and patients with cervical carcinoma. Clin Diagn Lab Immunol. 4 (2), 202-207 (1997).
- Yovel, G., Shakhar, K., Ben-Eliyahu, S. The effects of sex, menstrual cycle, and oral contraceptives on the number and activity of natural killer cells. Gynecol Oncol. 81 (2), 254-262 (2001).
- Laue, T., et al. Altered NK cell function in obese healthy humans. BMC Obes. 2, 1 (2015).
- Hazeldine, J., Lord, J. M. The impact of ageing on natural killer cell function and potential consequences for health in older adults. Ageing Res Rev. 12 (4), 1069-1078 (2013).
Tags
علم المناعة، المسألة 126، القاتل الطبيعية، خلية ناغورني كاراباخ، سيتوتوكسيسيتي، وتحلل الخلية، الخلية قتل، K562، والتدفق الخلوي، الإفراج عن الكروم، ناغورني كاراباخ الخلية سيتوتوكسيسيتي، كفسيErratum
Formal Correction: Erratum: A Flow Cytometry-Based Cytotoxicity Assay for the Assessment of Human NK Cell Activity
Posted by JoVE Editors on 09/10/2017.
Citeable Link.
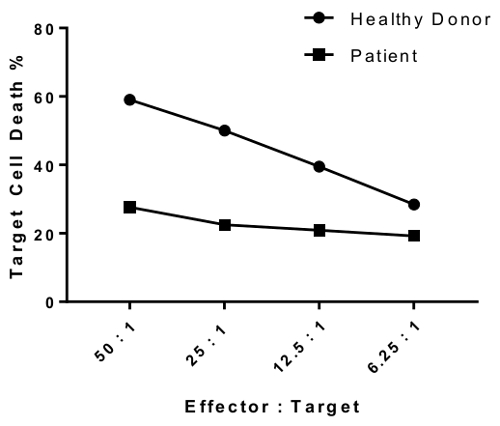
An erratum was issued for: A Flow Cytometry-Based Cytotoxicity Assay for the Assessment of Human NK Cell Activity. Figure 4 has been corrected to show background-corrected data.
Figure 4 was corrected from:
to: