ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
Eine Flow Cytometry basierende Methode quantitativ bestimmen die zytotoxische Aktivität des menschlichen natürliche Killerzellen wird hier angezeigt.
Abstract
Innerhalb des angeborenen Immunsystems spielen Effektor-Lymphozyten, die sogenannten natürlichen killer (NK)-Zellen eine wesentliche Rolle in der Wirt Verteidigung gegen anomale Zellen, insbesondere Beseitigung Tumor und viral infizierte Zellen. Ca. 30 bekannten monogenen Defekte, zusammen mit einer Vielzahl von anderen pathologischen Zuständen verursachen entweder funktionelle oder klassische NK Zelle Mangel, manifestiert sich in reduziert oder fehlend zytotoxische Aktivität. In der Vergangenheit wurde Zytotoxizität mit radioaktiven Methoden untersucht die mühsam, teuer und potenziell gefährlich sind. Dieser Artikel beschreibt eine optimierte, klinisch einsetzbaren Flow Cytometry basierende Methode um zytotoxische NK-Zell-Aktivität zu quantifizieren. In diesem Test sind peripheren mononukleären Zellen (PBMCs) oder gereinigte NK Zelle Vorbereitungen Co inkubierten bei unterschiedlichen Verhältnissen eine Ziel-Tumor-Zell-Linie bekannt, empfindlich gegen NK zellvermittelte Zytotoxizität (NKCC) sein. Die Zielzellen sind bereits beschriftet mit einem Fluoreszenzfarbstoff ermöglicht ihre Diskriminierung aus den Effektorzellen (NK-Zellen). Nach der Inkubationszeit sind getöteten Zielzellen durch eine Nukleinsäure-Fleck, identifiziert, die speziell die abgestorbenen Zellen durchdringt. Diese Methode ist geeignet, um sowohl Diagnose- und Anwendungen in der Forschung und, Dank an die Multiparameter-Fähigkeiten der Durchflusszytometrie, hat den zusätzlichen Vorteil der potenziell ermöglicht eine tiefere Analyse der NK Zelle Phänotyp und Funktion.
Introduction
Natürliche killer (NK)-Zellen sind eine anspruchsvolle Teilmenge der menschlichen angeborenen Lymphozyten kritisch beteiligt bei der Beseitigung von viral infizierte Zellen, transformierten Zellen und anderen pathogenen Bedrohungen 1,2. NK-Zellen lytische Granulat Haus zytotoxische Proteine, wie Perforin und Granzyme. Nach der Aktivierung NK-Zellen bilden ein komplexes Zusammenspiel mit ihren Zielen bekannt als immunologische Synapse, wobei diese Zytolyse Moleküle lokal freigesetzt werden, was direkte Ziel Zelle Lysis und Apoptose, zusammen mit Freisetzung von Zytokinen und Chemokin und letztlich in der Induktion von einem entzündlichen Zustand 1,3,4.
NK-Zell-Aktivierung beinhaltet eine komplexe Reihe von Aktivierung und hemmende Interaktionen zwischen NK Zell-Rezeptoren und Liganden auf der Oberfläche der Zielzellen, bilden ein streng regulierte System ausgedrückt. Einer der am besten untersuchten Mechanismen der NK-Zell-Aktivierung ist das "fehlende selbst". In der Tat, fehlende Erkennung der Klasse, die ich major Histocompatibility complex (MHC) oder human Leukocyte Antigen (HLA) Moleküle auf infiziert oder Zellen Trigger NK Zelle Zytotoxizität umgewandelt. Tumor und Virus-infizierten Zellen in der Regel Downregulate diese Antigene T zellvermittelte Immunität, so zum primären NK entkommen Zelle Ziele 1,3,4.
Bewertung der NK-Zell-Funktion ist in erster Linie in Degranulation oder Zytotoxizität kategorisiert Assays. Degranulation Assays, wie die Strömung durchflusszytometrischen Erkennung des Degranulation-assoziierten Markers CD107a, sind jedoch nur Richtwerte der NK-Zell-Aktivierung und nicht ihre ultimative Funktion, die direkte Tötung von Ziel Zellen 5,6,7,8. Daher hat diese Einschränkung Ermittler Zytotoxizität Assays als mehr erzählen und direktere Alternative geschenkt.
Die langjährigen "Goldstandard" für die Beurteilung der zellvermittelten zytotoxische Aktivität von T- und NK-Zellen ist die Chrom-Release-Assay (CRA). CRA beinhaltet radioaktiv Kennzeichnung von Zielzellen mit 51Cr und Bebrüten sie gemeinsam mit Effektorzellen. Dieser Assay ist durchdrungen von dem Grundsatz, dass diese Zelle lyse in der Version des proteingebundenen 51Cr in der Überstand ergibt sich die durch Gamma zählen gemessen werden kann. Dieser Assay, während wirksam, ist für eine Vielzahl von Gründen problematisch: hohe Materialkosten, Handhabung und Entsorgung von radioaktiven 51Cr, spontane Freisetzung von 51Cr und schwierigen Standardisierung - so dass es insgesamt unpraktisch 9,10.
Eine Reihe von nicht-radioaktiven Assays mit fluoreszierenden Kennzeichnung, Enzymfreisetzung und sogar Biolumineszenz, wurden seitdem als Alternativen zum CRA 11,12,13,14entwickelt. Wir beschreiben hier eine Flow Cytometry basierende Methode zur Messung der NK Zelle zytotoxische Aktivität auf K562 Zielzellen, einfache, sensitive und reproduzierbar ist. K562-Zellen sind eine menschliche Erythroleukemic Zelle Linie mit reduzierten Expression von HLA Klasse I und erhöhten Ausdruck von Liganden für activatory NK-Rezeptoren, wodurch sie besonders anfällig für NK zellvermittelte Zytotoxizität 15. In diesem Assay K562 Zellen vorab mit Carboxyfluorescein Diacetat Succinimidyl Ester (CFSE-) gekennzeichnet sind und Co kultiviert in verschiedenen Verhältnissen mit entweder peripheren mononukleären Blutzellen (PBMCs) oder NK-Zellen 1gereinigt. CFSE ist eine stabile, Proteinbindung Fluoreszenzfarbstoff, der Diskriminierung von Zielzellen von Effektor NK Zellen 16,17erlaubt. Nach der Co Inkubation dient ein Nukleinsäure-Fleck, speziell durchdringt die Membran von abgestorbenen Zellen, getöteten Zielzellen identifizieren (siehe Tabelle der Materialien). Die Proben werden dann auf einem Durchflusszytometer zu bestimmen, den Anteil der Toten (d. h. Fleck +) erworben CFSE-+ Zielzellen.
Dieser Test kann verwendet werden als diagnostische Reihenuntersuchung für monogene Mängel beeinträchtigen die NK Zellkompartiment, davon gibt es etwa 30 bekannte Mängel verursacht entweder funktionelle oder klassische NK-Zelle-Mangel, und bei primären oder sekundären Hemophagocytic Lymphohistiocytosis. Es ist auch sinnvoll, NK-Zell-Aktivität bei Patienten mit wiederkehrenden, schweren viralen Herpesinfektionen, Immunrekonstitution nach hämatopoetischer Stammzelltransplantation oder Post immunmodulatorische Therapie 18,19,20, bewerten und für eine Vielzahl von Anwendungen in der grundlegenden Forschung zu untersuchen.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Vor der Inbetriebnahme der Assay empfiehlt es sehr, dass NK Zellinhalt in der Effektor Bevölkerung Wahl beurteilt werden. Abbildung 1 zeigt eine typische CD56 Färbung vor (hellblau) und nach (rot) NK Zelle Bereicherung. NK-Zellen sollte bestehen aus bis zu 15 % der PBMCs und mindestens 80 % rein nach der Bereicherung.
Durchflusszytometrischen Analyse in diesem Assay umfasst Erkennung von zwei Parameter: CFSE, nachweisbar in den gleichen Kanal wie FITC; und eine tote Zelle Fleck, im gleichen Kanal wie APC (Abb. 2AB) nachweisbar. Nach der Datenerfassung wird die gating-Strategie in Abbildung 2 verwendet, um Daten zu analysieren. Toten (z.B. tote Zelle Fleck +) K562-Ziel-Zellen werden aus der CFSE-+ Bevölkerung, für die % der getöteten Zellen innerhalb der Zielpopulation angespritzt.
Kontrolle Bedingungen sind entscheidend für die Gewährleistung der Wirksamkeit des Tests selbst und seiner Einzelkomponenten. In Reihenfolge für den Test als gültig betrachtet werden, die folgenden erwartet werden sollte, bei der Kontrolle (6-8): Zellen nur (Zustand 6) sollte im Zelltod führen < 15 % (Abb. 3A). Kein CFSE--Signal sollte erkannt werden, für Effektor nur (Zustand 7 Zellen), und Zelltod sollte < 5 % (Abb. 3 b). Tween-vermittelten Tötung von Zielzellen (Bedingung 8), Zelltod sollte > 85 % (Abbildung 3).
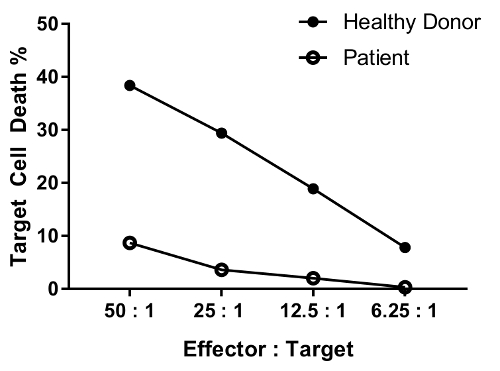
Ein Patient mit Defekt in der NK-Zell-Funktion wird voraussichtlich Tötung Aktivität in den meisten verringert haben oder alle Kennzahlen im Vergleich zu einem gesunden Menschen getestet. Die parallele von gesunden Spendern und Patientenzellen in Abbildung 4 zeigt differential, deutliche Reduzierung Ziel Zelltod mit abnehmender Effektor-Zielquote Zelle.

Abbildung 1: Bewertung der NK Zelleninhalt innerhalb der Bevölkerung Effektor. Repräsentative Histogramm nach dem Färben total PBMCs (hellblau) oder NK-Zellen (rot) für CD56 gereinigt. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2: Strategie zur Erkennung von Zielzellen Gating. A) das erste Tor befindet sich in einem FITC-A/SSC-A-Grundstück. K562-Zellen werden als CFSE-+ Veranstaltungen angespritzt. B) Tote K562 Zellen (d. h. positiv für tote Zelle färben) werden in der nachfolgenden APC-A/SSC-A Handlung innerhalb der CFSE-+ Zelle Zielpopulation angespritzt. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 3: repräsentative Daten für Kontrolle Bedingungen. (A) Anteil der Toten Zelle Fleck + K562 Zellen innerhalb des CFSE-+ Gates (gating Strategie wie in Abbildung 2) Zustand 6 (nur Zielzellen) - negativ-Kontrolle für K562 Zelltod. B) CFSE- und tote Zelle färben-Erkennung in Bedingung 7 (Effektor Zellen nur - total PBMCs). C) Anteil der Toten Zelle Fleck + K562 Zellen innerhalb des CFSE-+ Gates (gating Strategie wie in Abbildung 2) Zustand 8 (Zielzellen + Tween) - Positivkontrolle für K562 Zelltod. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 4: repräsentative Daten für den Verwässerungseffekt der verschiedenen Effektor Zellen-Zielquote. Die Effektor: Ziel-Zelle-Verhältnisse getestet sind wie folgt: 50: 1, 25: 1; 12,5: 1; 6.25:1. Daten sind Hintergrund (Bedingung #6)-entfernt. Bitte klicken Sie hier für eine größere Version dieser Figur.
| Probe | Zustand | Effektor (E): Ziel (T) |
| PBMCs | 1 - Positivkontrolle für NK Zelle Zytotoxizität | 50:1 + IL-2 |
| 2 | 50: 1 | |
| 3 | 25: 1 | |
| 4 | 12,5: 1 | |
| 5 | 6.25: 1 | |
| 6 | T nur | |
| 7 - negativ-Kontrolle für K562 Tod | E nur | |
| 8 - Positivkontrolle für K562 Tod | T + Tween | |
| NK-Zellen (gereinigt) | 1 - Positivkontrolle für NK Zelle Zytotoxizität | 5:1 + IL-2 |
| 2 | 5: 1 | |
| 3 | 2,5: 1 | |
| 4 | 1,25: 1 | |
| 5 | 0,625: 1 | |
| 6 | T nur | |
| 7 - negativ-Kontrolle für K562 Tod | E nur | |
| 8 - Positivkontrolle für K562 Tod | T + Tween |
Tabelle 1
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Die hier beschriebene Methode bietet eine einfache und kostengünstige Alternative zu den traditionellen 51Cr Release Assay zytotoxische NK-Zell-Aktivität zu bewerten. Diese Methode ist empfindlich, reproduzierbare und weniger zeitaufwändig als die bisherigen Standardmethoden wie CRA, und eignet sich für beide klinischen und Forschung Anwendungen.
Während des Tests mit insgesamt PBMCs und angereicherte NK-Zellen arbeitet, ist die Option PBMCs Zellpopulationen zu reinigen ohne die Notwendigkeit zu verwenden ein großer Vorteil beim Umgang mit Kleinmengen gesammelte Blut oder Paar oder schlechte Qualität Zellen von Patienten Proben. Dieser Assay nutzt nur CFSE- und tote Zelle Ausgrenzung Lebensfähigkeit Fleck. Betrachtet man diese beiden Parameter allein informiert prägnant und ausreichend zu diagnostischen Zwecken, mit dem zusätzlichen Vorteil der weitere Entschädigung in durchflusszytometrischen Analyse nicht erforderlich.
Diese Methode kann auch verwendet werden, grundlegende NK-Zell-Biologie zu studieren und testen neue NK Zelle gezielte Therapien. In dieser Hinsicht stellen die ständig wachsenden Möglichkeiten der fließen Cytometers wertvollen Bestandteil der Vielseitigkeit dieser Assay, zulassend multiparameter Analyse von NK-Zellen und ihre Tätigkeit nicht früher möglich mit Tests wie CRA. Alternative Zelle tracking und Lebensfähigkeit Farbstoffe, fluoreszierend in anderen Kanälen stehen die Ermittler Bedürfnisse zu erfüllen.
Dieses Protokoll ist für die Verwendung mit der prototypischen NK Zelle Ziel K562 Zelllinie optimiert. Es kann jedoch an alternativen Fangleinen Ziel Zelle mit unterschiedlichem Grad an Sensibilität für NK Zelle Zytotoxizität, wie HL-60, Daudi, U937 und Raji angepasst. In diesem Zusammenhang ist es wichtig zu beachten, dass die Konzentration von fluoreszierenden Farbstoff und Serum während Ziel Zelle Kennzeichnung verwendet möglicherweise für jede Zelllinie Ziel optimiert werden wie verschiedene Zelllinien das fluoreszierende Label anders und für jedes Durchflusszytometer nehmen könnte. Während es in der Regel zu vermeiden, mit Serum während Kennzeichnung empfohlen wird, entschieden wir uns zum leichten abschrecken mit 0,5 % des FBS aus zwei Gründen. Erstens hilft es Ziel Zelle Stress zu reduzieren und somit Hintergrund Flecken; Zweitens bringt es CFSE-Signal in den entsprechenden Bereich der Erkennung von unserem Durchflusszytometer ohne tägliche Einstellungen Anpassungen, so hilft in der Reproduzierbarkeit des Assays. Zusatzprotokolls Variationen beinhalten Tests verschiedener E:T Verhältnisse und Inkubationszeiten Assay unterschiedliche Aktivierung Bedingungen anzupassen. Die Dauer der Kokultur Effektor und Zielzellen, NK Zytotoxizität zu testen hat historisch von 4-16 h, reichten, obwohl längere Zeit tendenziell erhöhten spontane Freisetzung 9,16zur Folge haben. In unserer Methode könnte längere Inkubationszeit auch Verlust von Leuchtstofflampen, die Kennzeichnung durch die Zielzellen durch Tötung oder Verbreitung, führen, da diese Fluoreszenz-Farbstoffen auf Zellteilung verdünnt werden. So Inkubationen in das untere Ende des Zeitfensters werden in der Regel bevorzugt und sie über Nacht Inkubation 6,16,22nicht überschreiten.
Es ist wichtig, zur Kenntnis zu nehmen, von denen Variablen das Ergebnis dieses Tests beeinträchtigen können. Nach unserer Erfahrung sind die Zielzellen K562 besonders empfindlich auf Temperaturschwankungen. Daher K562-Zellen nicht gekühlt, sondern eher bei Raumtemperatur aufbewahrt oder platziert in einem befeuchteten CO2 Inkubator bei 37 ° C vor ihrer Verwendung. Aus dem gleichen Grund sollten alle Reagenzien zu den entsprechenden Temperaturen gebracht werden, wie im Protokoll angezeigt. Ein weiterer Parameter beeinflussen diese Zellen ist die Zentrifugation Geschwindigkeit, die reduziert werden sollte, um zellulären Stress zu minimieren. Darüber hinaus unbedingt begrenzen die Verzögerungszeit zwischen Effektor/Target-Vorbereitung und dem Beginn der Co Inkubation auf weniger als 30 min gewährleisten maximale Tötung Aktivität und assay Reproduzierbarkeit. Ebenso wie CFSE-Signal in der Regel robust ist, genaues pipettieren, richtige Mischung von Zellen und präzise Inkubationszeit Zeit beim etikettieren und abschrecken um Einheitlichkeit in der Färbung von entscheidender Bedeutung sind. Zu guter Letzt zytotoxischen Fähigkeit der NK-Zelle ist sehr variabel, auch bei gesunden Personen und ist beeinflusst durch eine Reihe von Faktoren, einschließlich der Entwicklungsstufe, Geschlecht, Alter und Gewicht 23,24,25. Zudem bis zu 30 % der gesunden Kontrollpersonen zeigen Sie eine signifikante Reduktion oder vollständiger Verlust der zytotoxischen Fähigkeit wenn länger als 24 Stunden nach der Blutabnahme getestet. Daher empfiehlt es sich, Verwendung frisch gereinigt PBMCs oder NK Zellen, wann immer möglich.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Die Autoren erklären keine finanziellen Interessenkonflikte.
Acknowledgments
Wir möchten Jill Narciso, UCLA Immungenetik Center, danke für ihre Unterstützung bei der Vorbereitung der Handschrift.
Materials
| Name | Company | Catalog Number | Comments |
| Phosphate-buffered Saline (1x, w/o Ca2+ and Mg2+) | Corning (Cellgro) | 21-040-CM | |
| Ficoll-Paque PLUS | GE Healthcare | 17-1440-02 | |
| Tween-20 | Sigma | BP337-100 | |
| RPMI 1640 Media | Corning (Cellgro) | 10-040-CV | |
| Heat-inactivated Fetal Bovine Serum | Omega Scientific | FB-02 | |
| Penicillin Streptomycin | Life Technologies | 15140-163 | Stock solution at 10,000 U/mL |
| IL-2 | R&D Systems | 202-IL-050 | Lyophilized from a 0.2 μm filtered solution in Acetonitrile and TFA with BSA as a carrier protein. Reconstitute with 500 ul at 100 μg/mL in sterile 100 mM Acetic Acid containing at least 0.1% bovine serum albumin (2.1x10E6 IU/ml) |
| K562 Cells | ATCC | CCL-243 | Cancer cell line |
| T-75 cell culture flasks | Corning | 431464 | |
| CFSE cell proliferation kit | Life Technologies (CellTrace) | C34554 | Reconstitute I vial with 18 ul DMSO to prepare a 5mM stock solution. Do not freeze/thaw. |
| Sytox Red | Life Technologies | S34859 | Stock solution is provided at 5 μM in 1 mL DMSO. The DMSO solution may be subjected to multiple freeze-thaw cycles without reagent degradation. |
| Sodium/lithium heparin blood collection tubes | BD | 02-687-95 | |
| U-bottom 96-well plate | Corning | CLS3897 | |
| Serological pipettes | BD Falcon | ||
| Polystyrene round-bottom tubes (5mL) | BD Falcon | 14959-5 | |
| 50 mL polypropylene conical tube | BD Falcon | 352070 | |
| 15 mL polypropylene conical tube | BD Falcon | 352097 | |
| Reagent reservoir | USA Scientific | 2321-2230 | |
| Human NK cell enrichment cocktail | StemCell Technologies (RosetteSep) | 15065 |
References
- Iannello, A., Debbeche, O., Samarani, S., Ahmad, A. Antiviral NK cell responses in HIV infection: I. NK cell receptor genes as determinants of HIV resistance and progression to AIDS. J Leukoc Biol. 84 (1), 1-26 (2008).
- Caligiuri, M. A. Human natural killer cells. Blood. 112 (3), 461-469 (2008).
- Topham, N. J., Hewitt, E. W. Natural killer cell cytotoxicity: how do they pull the trigger? Immunology. 128 (1), 7-15 (2009).
- Warren, H. S., Smyth, M. J. NK cells and apoptosis. Immunol Cell Biol. 77 (1), 64-75 (1999).
- Tognarelli, S., Jacobs, B., Staiger, N., Ullrich, E. Flow Cytometry-based Assay for the Monitoring of NK Cell Functions. J Vis Exp. (116), (2016).
- Somanchi, S. S., McCulley, K. J., Somanchi, A., Chan, L. L., Lee, D. A. A Novel Method for Assessment of Natural Killer Cell Cytotoxicity Using Image Cytometry. PLoS One. 10 (10), e0141074 (2015).
- Alter, G., Malenfant, J. M., Altfeld, M. CD107a as a functional marker for the identification of natural killer cell activity. J Immunol Methods. 294 (1-2), 15-22 (2004).
- Atkinson, E. A., Gerrard, J. M., Hildes, G. E., Greenberg, A. H. Studies of the mechanism of natural killer (NK) degranulation and cytotoxicity. J Leukoc Biol. 47 (1), 39-48 (1990).
- Kim, G. G., Donnenberg, V. S., Donnenberg, A. D., Gooding, W., Whiteside, T. L. A novel multiparametric flow cytometry-based cytotoxicity assay simultaneously immunophenotypes effector cells: comparisons to a 4 h 51Cr-release assay. J Immunol Methods. 325 (1-2), 51-66 (2007).
- Kane, K. L., Ashton, F. A., Schmitz, J. L., Folds, J. D. Determination of natural killer cell function by flow cytometry. Clin Diagn Lab Immunol. 3 (3), 295-300 (1996).
- Jang, Y. Y., et al. An improved flow cytometry-based natural killer cytotoxicity assay involving calcein AM staining of effector cells. Ann Clin Lab Sci. 42 (1), 42-49 (2012).
- Korzeniewski, C., Callewaert, D. M. An enzyme-release assay for natural cytotoxicity. J Immunol Methods. 64 (3), 313-320 (1983).
- Karimi, M. A., et al. Measuring cytotoxicity by bioluminescence imaging outperforms the standard chromium-51 release assay. PLoS One. 9 (2), e89357 (2014).
- Oppenheim, D. E., et al. Glyco-engineered anti-EGFR mAb elicits ADCC by NK cells from colorectal cancer patients irrespective of chemotherapy. Br J Cancer. 110 (5), 1221-1227 (2014).
- West, W. H., Cannon, G. B., Kay, H. D., Bonnard, G. D., Herberman, R. B. Natural cytotoxic reactivity of human lymphocytes against a myeloid cell line: characterization of effector cells. J Immunol. 118 (1), 355-361 (1977).
- Jedema, I., van der Werff, N. M., Barge, R. M., Willemze, R., Falkenburg, J. H. New CFSE-based assay to determine susceptibility to lysis by cytotoxic T cells of leukemic precursor cells within a heterogeneous target cell population. Blood. 103 (7), 2677-2682 (2004).
- Lecoeur, H., Fevrier, M., Garcia, S., Riviere, Y., Gougeon, M. L. A novel flow cytometric assay for quantitation and multiparametric characterization of cell-mediated cytotoxicity. J Immunol Methods. 253 (1-2), 177-187 (2001).
- Carotta, S. Targeting NK Cells for Anticancer Immunotherapy: Clinical and Preclinical Approaches. Front Immunol. 7, 152 (2016).
- Mandal, A., Viswanathan, C. Natural killer cells: In health and disease. Hematol Oncol Stem Cell Ther. 8 (2), 47-55 (2015).
- Rezvani, K., Rouce, R. H. The Application of Natural Killer Cell Immunotherapy for the Treatment of Cancer. Front Immunol. 6, 578 (2015).
- Angelo, L. S., et al. Practical NK cell phenotyping and variability in healthy adults. Immunol Res. 62 (3), 341-356 (2015).
- Zons, P., et al. Comparison of europium and chromium release assays: cytotoxicity in healthy individuals and patients with cervical carcinoma. Clin Diagn Lab Immunol. 4 (2), 202-207 (1997).
- Yovel, G., Shakhar, K., Ben-Eliyahu, S. The effects of sex, menstrual cycle, and oral contraceptives on the number and activity of natural killer cells. Gynecol Oncol. 81 (2), 254-262 (2001).
- Laue, T., et al. Altered NK cell function in obese healthy humans. BMC Obes. 2, 1 (2015).
- Hazeldine, J., Lord, J. M. The impact of ageing on natural killer cell function and potential consequences for health in older adults. Ageing Res Rev. 12 (4), 1069-1078 (2013).
Tags
Immunologie Ausgabe 126 natürliche Killer NK-Zellen Zytotoxizität Zelle Lysis Zelle töten K562 Durchflusszytometrie Chrom Release NK Zelle Zytotoxizität CFSE-Erratum
Formal Correction: Erratum: A Flow Cytometry-Based Cytotoxicity Assay for the Assessment of Human NK Cell Activity
Posted by JoVE Editors on 09/10/2017.
Citeable Link.
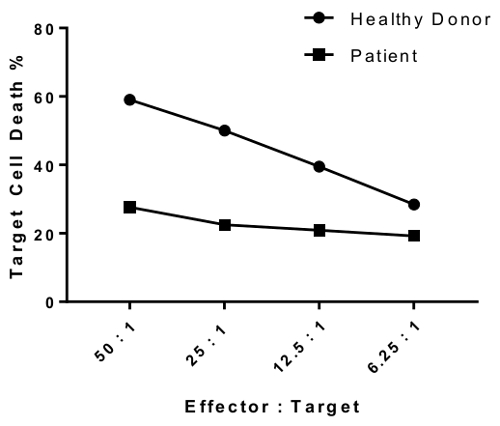
An erratum was issued for: A Flow Cytometry-Based Cytotoxicity Assay for the Assessment of Human NK Cell Activity. Figure 4 has been corrected to show background-corrected data.
Figure 4 was corrected from:
to: