ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
En flyt cytometri-basert metode å avgjøre kvantitativt cytotoksiske aktiviteten til menneskets naturlige drepe celler er vist her.
Abstract
Innenfor det medfødte immunsystemet spille effektor lymfocyttene kalles naturlig morderen celler (NK) en viktig rolle i vert forsvar mot avvikende celler, spesielt å eliminere tumoral og virally infiserte celler. Ca 30 kjent monogenic feil, sammen med en rekke andre pathological betingelser, forårsake funksjonelle eller klassisk NK celle mangel, manifestert i redusert eller fraværende cytotoksiske aktivitet. Historisk har cytotoksisitet blitt undersøkt med radioaktive metoder, som er tunge, dyre og potensielt farlige. Denne artikkelen beskriver en strømlinjeformet, klinisk gjeldende flyt cytometri-basert metode for å kvantifisere NK celle cytotoksiske aktivitet. I denne analysen, perifert blod mononukleære celler (PBMCs) eller renset NK celle forberedelser er co inkubert på ulike forhold med en mål svulst celle linje kjent for å være følsomme for NK celle-mediert cytotoksisitet (NKCC). Målcellene er forhåndsinnstilte merket med et fluorescerende farge slik at diskriminering fra Effektor celler (celler NK). Etter inkubasjonstiden, er drepte målcellene identifisert av en nukleinsyre flekk, hvilke spesielt gjennomsyrer døde celler. Denne metoden er mottakelig for både diagnose og forskning og, takket være flere parameter egenskapene til flowcytometri, har den ekstra fordelen av potensielt en dypere analyse av NK celle fenotypen og funksjon.
Introduction
Naturlig morderen celler (NK) er et sofistikert delsett av menneskelig medfødte lymfocytter kritisk involvert i eliminasjon av virally infiserte celler, forvandlet celler og andre sykdomsframkallende trusler 1,2. NK celle lytisk granulater huset cytotoksiske proteiner, som perforin og granzymes. Ved aktivering, NK celler danner et komplekst samspill med sine mål kjent som immunologiske synapse, der disse cytolytic molekyler lokalt slippes, direkte målet cellen lyse og apoptose, sammen med cytokin og chemokine og til slutt i innledningen av en provoserende staten 1,3,4.
NK celle aktivering innebærer en omfattende rekke aktivering og hemmende interaksjoner mellom NK celle reseptorer og ligander uttrykt på overflaten av målcellene, danner et strengt regulert system. En av de mest studerte mekanismene av NK celle aktivering er "mangler selv". Faktisk mangel på deteksjon av klassen jeg major histocompatibility kompleks (MHC), eller menneskelig leukocytter antigen (HLA) molekyler, på infisert eller forvandlet celler utløsere NK celle cytotoksisitet. Svulsten og virus-infiserte celler generelt downregulate disse antigener å unnslippe T celle-mediert immunitet, ble dermed primære NK celle mål 1,3,4.
Vurdering av NK celle funksjon er primært kategorisert i omfatter degranulering eller cytotoksisitet analyser. Omfatter degranulering analyser, for eksempel flyt cytometric gjenkjenning av omfatter degranulering-assosiert merket CD107a, er imidlertid bare indikativ av NK celle aktivering og ikke deres ultimate funksjon, direkte drapet på målet celler 5,6,7,8. Derfor har denne begrensningen trukket etterforskere til cytotoksisitet analyser som en mer forteller og mer direkte alternativ.
Lang tid "gull standard" for å vurdere celle-mediert cytotoksiske aktivitet både T og NK celler er krom utgivelsen analysen (CRA). CRA innebærer radioactively merking av målcellene med 51Cr og co rugende dem med Effektor celler. Denne analysen er gjennomsyret av prinsippet at cellen lysis resulterer i utgivelsen av protein-bundet 51Cr i nedbryting, som kan måles ved gamma teller. Denne analysen, mens effektive, er problematisk for en rekke årsaker: høy materialkostnader, håndtering og deponering av radioaktivt 51Cr, spontane utgivelsen av 51Cr og vanskelig standardisering - gjør det helt upraktisk 9,10.
En rekke ikke-radioaktivt analyser, med fluorescerende merking, enzym utgivelsen og selv bioluminescens, har siden blitt utviklet som alternativer til CRA 11,12,13,14. Her beskriver vi en flyt cytometri-basert metode for måling av NK celle cytotoksiske aktivitet på K562 målet celler som er enkel, følsom og reproduserbar. K562 cellene er en menneskelig erythroleukemic celle linje med redusert uttrykk for HLA klasse jeg og økt uttrykk for ligander for activatory NK reseptorer, noe som gjør dem spesielt utsatt for NK celle-mediert cytotoksisitet 15. I denne analysen, K562 celler pre merket med carboxyfluorescein diacetate succinimidyl ester (CFSE) og co kultivert på ulike prosenter med enten perifert blod mononukleære celler (PBMCs) eller renset NK celler 1. CFSE er en stabil, protein-bindende fluorescerende farge som lar diskriminering av målet celler effektor NK celler 16,17. Etter den co inkubering brukes en nukleinsyre flekk, spesielt gjennomsyre membran av døde celler, til å identifisere drept målcellene (se tabell av materialer). Prøvene er deretter ervervet på en flyt cytometer å finne ut prosentandelen av døde (dvs. flekken +) CFSE + målcellene.
Denne analysen kan brukes som en rutinemessig diagnostiske screening for monogenic feil påvirker NK celle rommet, som det er ca 30 kjent feilene forårsaker funksjonelle eller klassisk NK celle mangel, og for primær eller sekundær hemophagocytic lymphohistiocytosis. Det er også nyttig å undersøke NK celle aktivitet hos pasienter med tilbakevendende, alvorlig herpes virusinfeksjoner, evaluere immune rekonstituering etter blodkreft cellen transplantasjon eller innlegget immunmodulerende terapi 18,19,20, og for en rekke grunnleggende forskning.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Før analysen, er det sterkt anbefalt at NK celleinnholdet vurderes i befolkningen effektor av valget. Figur 1 viser en typisk CD56 flekker før (lys blå) og etter (rød) NK celle berikelse. NK celler utgjør opptil 15% av PBMCs og bør være minst 80% ren etter berikelse.
Flow cytometric analyse i denne analysen omfatter påvisning av to parametere: CFSE, i samme kanal som FITC; og en døde celle flekk, i samme kanal som APC (figur 2AB). Etter datainnsamling brukes gating strategien i figur 2 til å analysere data. Døde (dvs. døde celle flekken +) K562 målcellene er gated av CFSE + befolkningen, gir % drept celleområde i målgruppen.
Kontroll er viktig å sikre effektiviteten av analysen selv og separate komponenter. For at analysen skal være gyldig, bør følgende forventes i kontroll forhold (6-8): målet celler bare (tilstand 6) skal resultere i celledød < 15% (figur 3A). Ingen CFSE signalet skal oppdages Effektor celler bare (tilstand 7), og celledød skal < 5% (figur 3B). Tween-mediert drapet på målcellene (tilstand 8), celledød bør være > 85% (Figur 3 c).
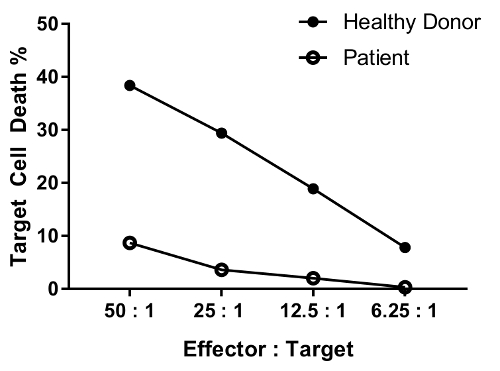
En pasient med feil i NK celle-funksjonen forventes å har redusert drapet aktivitet på de fleste eller alle prosenter testet sammenlignet med en frisk person. Parallell frisk donor og pasienten celler i Figur 4 viser differensial, betydelig reduksjon i målet celledød med minkende effektor-målet cellen forholdet.

Figur 1: vurdering av NK celleinnholdet i befolkningen effektor. Representant histogrammet etter farging totalt PBMCs (lys blå) eller renset NK celler (rød) for CD56. Klikk her for å se en større versjon av dette tallet.

Figur 2: Gating strategi for påvisning av målcellene. A) første porten ligger i et FITC-/ SSC AA plott. K562 celler er gated som CFSE + hendelser. B) døde K562 celler (dvs. positive for død celle flekker) er gated in påfølgende APC-/ SSC AA handlingen i CFSE + celle målgruppen. Klikk her for å se en større versjon av dette tallet.

Figur 3: representant data for kontroll forhold. A) andelen døde celle flekken + K562 celler i CFSE + porten (gating strategi som i figur 2) i betingelse 6 (målet celler bare) - negativ kontroll for K562 celledød. B) CFSE og død celle flekken gjenkjenning i tilstand 7 (Effektor celler-totalt PBMCs). C) andelen døde celle flekken + K562 celler i CFSE + porten (gating strategi som i figur 2) i tilstand 8 (målcellene + mellom) - positive kontroll for K562 celledød. Klikk her for å se en større versjon av dette tallet.

Figur 4: representant dataene for fortynning effekten av ulike effektor-målet cellen forholdet. Effektor: målet cellen forholdstallene testet er som følger: 50:1, 25: 1; 12.5: 1; 6.25:1. Data er bakgrunn (betingelse #6)-fjernet. Klikk her for å se en større versjon av dette tallet.
| Eksempel | Tilstand | Effektor (E): Mål (T) |
| PBMCs | 1 - positiv kontroll for NK celle cytotoksisitet | 50:1 + IL-2 |
| 2 | 50: 1 | |
| 3 | 25: 1 | |
| 4 | 12.5: 1 | |
| 5 | 6.25: 1 | |
| 6 | T bare | |
| 7 - negativ kontroll for K562 død | E bare | |
| 8 - positiv kontroll for K562 død | T + Tween | |
| NK celler (renset) | 1 - positiv kontroll for NK celle cytotoksisitet | 5:1 + IL-2 |
| 2 | 5: 1 | |
| 3 | 2.5: 1 | |
| 4 | 1.25: 1 | |
| 5 | 0.625: 1 | |
| 6 | T bare | |
| 7 - negativ kontroll for K562 død | E bare | |
| 8 - positiv kontroll for K562 død | T + Tween |
Tabell 1
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Metoden beskrevet her gir en enkel og kostnadseffektiv alternativ til tradisjonelle 51Cr utgivelsen analysen å vurdere NK celle cytotoksiske aktivitet. Denne metoden er sensitiv, reproduserbare og mindre tidkrevende enn tidligere standard metoder, som CRA, og kan brukes til både klinisk forskning programmer.
Mens analysen fungerer med både total PBMCs og beriket NK celler, er bruke PBMCs uten behov for å rense celle populasjoner en stor fordel når du arbeider med små mengder samlet blod eller få eller dårlig kvalitet celler fra pasienter prøver. Denne analysen bruker bare CFSE og død celle utelukkelse levedyktighet flekken. Ser på disse to parametere alene gir konsis og tilstrekkelig informasjon for diagnoseformål, med fordelen av ikke krever ytterligere kompensasjon i flyt cytometric analyse.
Denne metoden kan også brukes til å studere grunnleggende NK cellebiologi og teste romanen NK celle-målrettet terapi. I denne forbindelse innføre voksende egenskapene til flyt cytometers en uvurderlig del av allsidigheten til denne analysen, tillater for multiparameter analyse av NK celler og deres aktivitet ikke tidligere mulig med analyser som CRA. Alternative celle sporing og levedyktighet fargestoffer, fluorescing i andre kanaler, er tilgjengelig for å møte den etterforskere behov.
Denne protokollen er optimalisert for bruk med prototypiske NK celle målet K562 cellen linje. Det kan imidlertid være tilpasset alternativ suspensjon målet cellelinjer med varierende grad av følsomhet for NK celle cytotoksisitet, som HL-60, Daudi, U937 og Raji. I denne forbindelse er det viktig å merke seg at konsentrasjonen av fluorescerende fargestoff og serum under målet cellen merking kan ha til å være optimalisert for hver målet cellen linje, som forskjellige linjer kan ta opp fluorescerende etiketten annerledes, og for hver flyt cytometer. Mens det er vanligvis anbefalt å unngå å bruke serum under merking, valgte vi liten slukker med 0,5% av FBS av to grunner. Først hjelper det å redusere målet cellen stress og dermed bakgrunn flekken; andre bringer det CFSE signal i riktig utvalg av deteksjon av våre flyt cytometer uten daglige innstillinger justeringer, dermed hjelpe reproduserbarhet til analysen. Tilleggsprotokollen variasjoner kan inkluderer forskjellige E:T prosenter og inkubasjon ganger å tilpasse analysen annerledes aktivisering forhold. Varigheten av co kultur effektor og målcellene teste NK cytotoksisitet har historisk varierte 4-16 h, men lengre perioder tendens til å resultere i økt spontan utgivelsen 9,16. I vår metode, kan lengre inkubasjon også resultere i tap av fluorescerende merking av målcellene på grunn av mordene eller spredning, som disse fluorescerende fargestoffer er utvannet på cellen divisjon. Dermed incubations i den nedre enden av tidsvinduet foretrekkes vanligvis, og de bør ikke overstige overnatting inkubasjon 6,16,22.
Det er viktig å merke som variabler kan påvirke utfallet av denne analysen. I vår erfaring er K562 målcellene spesielt følsomme overfor temperaturendringer. Derfor bør K562 cellene ikke nedkjølt, men heller holdt ved romtemperatur eller plassert i en fuktet CO2 inkubator på 37 ° C før bruk. Av samme grunn, skal reagenser bringes til den riktige temperaturen som angitt i protokollen. En annen parameter påvirker disse cellene er hastigheten fra sentrifugering som skal reduseres til minimere mobilnettet stress. Videre er begrense forsinkelse mellom effektor/target forberedelse og starten av den co inkubering til mindre enn 30 min avgjørende for å sikre maksimal drapet aktivitet og analysen reproduserbarhet. På samme måte som CFSE signalet er generelt robust, nøyaktig pipettering, riktig blanding av celler og presis inkubasjon tid når merking og slukker er avgjørende for å sikre konsekvens i den flekker. Til slutt, NK celle cytotoksiske evne er svært variabel i friske individer og påvirkes av en rekke faktorer, inkludert utviklingsstadiet, kjønn, alder og vekt 23,24,25. I tillegg opp til 30% av sunn kontroller Vis en betydelig reduksjon eller fullstendig tap av cytotoksiske hvis testet mer enn 24 timer etter blod tegne. Det anbefales derfor å bruk ferske renset PBMCs eller NK celler når mulig.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Forfatterne erklærer ingen konflikter av økonomisk interesse.
Acknowledgments
Vi vil gjerne takke Jill Narciso, UCLA Immunogenetics Center, for henne hjelp manuskriptet forberedelser.
Materials
| Name | Company | Catalog Number | Comments |
| Phosphate-buffered Saline (1x, w/o Ca2+ and Mg2+) | Corning (Cellgro) | 21-040-CM | |
| Ficoll-Paque PLUS | GE Healthcare | 17-1440-02 | |
| Tween-20 | Sigma | BP337-100 | |
| RPMI 1640 Media | Corning (Cellgro) | 10-040-CV | |
| Heat-inactivated Fetal Bovine Serum | Omega Scientific | FB-02 | |
| Penicillin Streptomycin | Life Technologies | 15140-163 | Stock solution at 10,000 U/mL |
| IL-2 | R&D Systems | 202-IL-050 | Lyophilized from a 0.2 μm filtered solution in Acetonitrile and TFA with BSA as a carrier protein. Reconstitute with 500 ul at 100 μg/mL in sterile 100 mM Acetic Acid containing at least 0.1% bovine serum albumin (2.1x10E6 IU/ml) |
| K562 Cells | ATCC | CCL-243 | Cancer cell line |
| T-75 cell culture flasks | Corning | 431464 | |
| CFSE cell proliferation kit | Life Technologies (CellTrace) | C34554 | Reconstitute I vial with 18 ul DMSO to prepare a 5mM stock solution. Do not freeze/thaw. |
| Sytox Red | Life Technologies | S34859 | Stock solution is provided at 5 μM in 1 mL DMSO. The DMSO solution may be subjected to multiple freeze-thaw cycles without reagent degradation. |
| Sodium/lithium heparin blood collection tubes | BD | 02-687-95 | |
| U-bottom 96-well plate | Corning | CLS3897 | |
| Serological pipettes | BD Falcon | ||
| Polystyrene round-bottom tubes (5mL) | BD Falcon | 14959-5 | |
| 50 mL polypropylene conical tube | BD Falcon | 352070 | |
| 15 mL polypropylene conical tube | BD Falcon | 352097 | |
| Reagent reservoir | USA Scientific | 2321-2230 | |
| Human NK cell enrichment cocktail | StemCell Technologies (RosetteSep) | 15065 |
References
- Iannello, A., Debbeche, O., Samarani, S., Ahmad, A. Antiviral NK cell responses in HIV infection: I. NK cell receptor genes as determinants of HIV resistance and progression to AIDS. J Leukoc Biol. 84 (1), 1-26 (2008).
- Caligiuri, M. A. Human natural killer cells. Blood. 112 (3), 461-469 (2008).
- Topham, N. J., Hewitt, E. W. Natural killer cell cytotoxicity: how do they pull the trigger? Immunology. 128 (1), 7-15 (2009).
- Warren, H. S., Smyth, M. J. NK cells and apoptosis. Immunol Cell Biol. 77 (1), 64-75 (1999).
- Tognarelli, S., Jacobs, B., Staiger, N., Ullrich, E. Flow Cytometry-based Assay for the Monitoring of NK Cell Functions. J Vis Exp. (116), (2016).
- Somanchi, S. S., McCulley, K. J., Somanchi, A., Chan, L. L., Lee, D. A. A Novel Method for Assessment of Natural Killer Cell Cytotoxicity Using Image Cytometry. PLoS One. 10 (10), e0141074 (2015).
- Alter, G., Malenfant, J. M., Altfeld, M. CD107a as a functional marker for the identification of natural killer cell activity. J Immunol Methods. 294 (1-2), 15-22 (2004).
- Atkinson, E. A., Gerrard, J. M., Hildes, G. E., Greenberg, A. H. Studies of the mechanism of natural killer (NK) degranulation and cytotoxicity. J Leukoc Biol. 47 (1), 39-48 (1990).
- Kim, G. G., Donnenberg, V. S., Donnenberg, A. D., Gooding, W., Whiteside, T. L. A novel multiparametric flow cytometry-based cytotoxicity assay simultaneously immunophenotypes effector cells: comparisons to a 4 h 51Cr-release assay. J Immunol Methods. 325 (1-2), 51-66 (2007).
- Kane, K. L., Ashton, F. A., Schmitz, J. L., Folds, J. D. Determination of natural killer cell function by flow cytometry. Clin Diagn Lab Immunol. 3 (3), 295-300 (1996).
- Jang, Y. Y., et al. An improved flow cytometry-based natural killer cytotoxicity assay involving calcein AM staining of effector cells. Ann Clin Lab Sci. 42 (1), 42-49 (2012).
- Korzeniewski, C., Callewaert, D. M. An enzyme-release assay for natural cytotoxicity. J Immunol Methods. 64 (3), 313-320 (1983).
- Karimi, M. A., et al. Measuring cytotoxicity by bioluminescence imaging outperforms the standard chromium-51 release assay. PLoS One. 9 (2), e89357 (2014).
- Oppenheim, D. E., et al. Glyco-engineered anti-EGFR mAb elicits ADCC by NK cells from colorectal cancer patients irrespective of chemotherapy. Br J Cancer. 110 (5), 1221-1227 (2014).
- West, W. H., Cannon, G. B., Kay, H. D., Bonnard, G. D., Herberman, R. B. Natural cytotoxic reactivity of human lymphocytes against a myeloid cell line: characterization of effector cells. J Immunol. 118 (1), 355-361 (1977).
- Jedema, I., van der Werff, N. M., Barge, R. M., Willemze, R., Falkenburg, J. H. New CFSE-based assay to determine susceptibility to lysis by cytotoxic T cells of leukemic precursor cells within a heterogeneous target cell population. Blood. 103 (7), 2677-2682 (2004).
- Lecoeur, H., Fevrier, M., Garcia, S., Riviere, Y., Gougeon, M. L. A novel flow cytometric assay for quantitation and multiparametric characterization of cell-mediated cytotoxicity. J Immunol Methods. 253 (1-2), 177-187 (2001).
- Carotta, S. Targeting NK Cells for Anticancer Immunotherapy: Clinical and Preclinical Approaches. Front Immunol. 7, 152 (2016).
- Mandal, A., Viswanathan, C. Natural killer cells: In health and disease. Hematol Oncol Stem Cell Ther. 8 (2), 47-55 (2015).
- Rezvani, K., Rouce, R. H. The Application of Natural Killer Cell Immunotherapy for the Treatment of Cancer. Front Immunol. 6, 578 (2015).
- Angelo, L. S., et al. Practical NK cell phenotyping and variability in healthy adults. Immunol Res. 62 (3), 341-356 (2015).
- Zons, P., et al. Comparison of europium and chromium release assays: cytotoxicity in healthy individuals and patients with cervical carcinoma. Clin Diagn Lab Immunol. 4 (2), 202-207 (1997).
- Yovel, G., Shakhar, K., Ben-Eliyahu, S. The effects of sex, menstrual cycle, and oral contraceptives on the number and activity of natural killer cells. Gynecol Oncol. 81 (2), 254-262 (2001).
- Laue, T., et al. Altered NK cell function in obese healthy humans. BMC Obes. 2, 1 (2015).
- Hazeldine, J., Lord, J. M. The impact of ageing on natural killer cell function and potential consequences for health in older adults. Ageing Res Rev. 12 (4), 1069-1078 (2013).
Tags
Immunologi problemet 126 naturlig killer NK celle cytotoksisitet celle lysis celle drap K562 flowcytometri krom utgivelse NK celle cytotoksisitet CFSEErratum
Formal Correction: Erratum: A Flow Cytometry-Based Cytotoxicity Assay for the Assessment of Human NK Cell Activity
Posted by JoVE Editors on 09/10/2017.
Citeable Link.
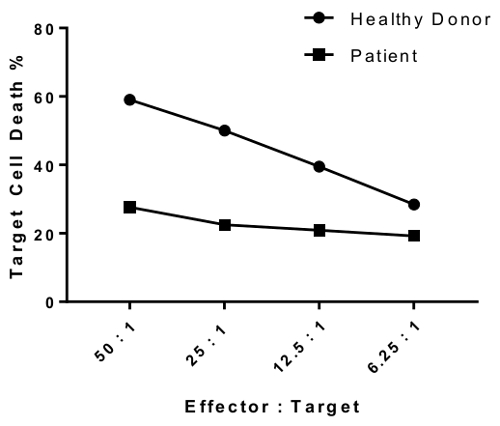
An erratum was issued for: A Flow Cytometry-Based Cytotoxicity Assay for the Assessment of Human NK Cell Activity. Figure 4 has been corrected to show background-corrected data.
Figure 4 was corrected from:
to: