ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
Um método baseado em citometria de fluxo para determinar quantitativamente a atividade citotóxica de células humanas de assassino natural é mostrado aqui.
Abstract
Dentro do sistema imunológico inato, linfócitos efetores conhecidos como natural killer (NK) células desempenham um papel essencial na defesa do hospedeiro contra células aberrantes, eliminando especificamente tumoral e Viralmente infectado as células. Aproximadamente 30 defeitos conhecidos monogénicas, juntamente com uma série de outras condições patológicas, causam ou funcional ou clássica NK célula deficiência, manifestando-se na reduzida ou ausente atividade citotóxica. Historicamente, a citotoxicidade foi investigada com métodos radioativos, que são complicados, caros e potencialmente perigosos. Este artigo descreve um método baseado em citometria de fluxo aerodinâmico, clinicamente aplicável para quantificar a atividade citotóxica das células NK. Neste ensaio, células mononucleares de sangue periférico (PBMC) ou purificadas preparações de células NK são co incubadas em diferentes proporções com uma linhagem de células de tumor alvo conhecida por ser sensível a citotoxicidade mediada por células do NK (NKCC). As células alvo são previamente rotuladas com uma tintura fluorescente para permitir sua discriminação das células efetoras (células NK). Após o período de incubação, as células alvo morto são identificadas por uma mancha de ácido nucleico, que permeia especificamente as células mortas. Este método é passível de diagnóstico e aplicações de pesquisa tanto, graças às capacidades multi-parâmetros de citometria de fluxo, tem a vantagem adicional de potencialmente permitindo uma análise mais profunda do fenótipo de células NK e função.
Introduction
Assassino naturais (NK) células são um subconjunto de sofisticada de linfócitos inatos humanos criticamente envolvidos na eliminação de células infectadas Viralmente, células transformadas e outras ameaças patogênicos 1,2. Grânulos líticas de célula NK citotóxicas proteínas, tais como a perforina e granzymes de casa. Após a ativação, células NK formam uma complexa interação com seus alvos conhecido como sinapse imunológica, através do qual estas moléculas citolíticas localmente são liberadas, resultando na lise de célula alvo direto e apoptose, juntamente com a liberação de citocinas e chemokine e, finalmente, na indução de um inflamatório estado 1,3,4.
Ativação de células NK envolve uma complexa cadeia de ativando e inibitórias interações entre NK celulares receptores e ligantes expressados na superfície das células alvo, formando um sistema rigidamente regulamentado. Um dos mais estudados mecanismos de ativação de células NK é o self"desaparecido". Na verdade, falta de detecção de classe que eu major complexo de histocompatibilidade (MHC), ou moléculas de antigénios (HLA) de leucócitos humanos, na infectado ou transformado a citotoxidade de células NK de células gatilhos. Tumor e células infectadas por vírus geralmente downregulate estes antígenos para escapar a imunidade mediada por células T, tornando-se assim o principal NK células alvos 1,3,4.
Avaliação da função de célula NK principalmente é categorizada em degranulação ou citotoxicidade ensaios. No entanto, ensaios de degranulação, como detecção de fluxo cytometric do marcador degranulação associada CD107a, são apenas indicativos de ativação de células NK e não de sua função final, o abate direto de alvo células 5,6,7,8. Portanto, essa limitação tem atraído investigadores ensaios de citotoxicidade como uma alternativa mais revelador e mais direta.
O velho "padrão ouro" para avaliar a atividade citotóxica mediada por células de células T e NK tanto é o ensaio de liberação de cromo (CRA). CRA envolve radioactivamente rotulagem das células alvo com 51Cr e co, incubando-os com células efetoras. Este ensaio é rica em princípio que esse lysis da pilha resulta na liberação de proteínas 51Cr para o sobrenadante, que pode ser medido pela contagem de gama. Neste ensaio, ao mesmo tempo eficaz, é problemático para uma variedade de razões: elevados custos de material, manipulação e eliminação de radioativo 51Cr, liberação espontânea de 51Cr e difícil padronização - tornando-se completamente impraticável 9,10.
Um número de ensaios não-radioativo, envolvendo rotulagem fluorescente, liberação de enzima e bioluminescência mesmo, desde que foram desenvolvido como alternativas ao CRA 11,12,13,14. Descrevemos aqui um método baseado em citometria de fluxo para medição de NK célula atividade citotóxica sobre células-alvo K562 que é simples, sensível e reprodutível. Células k562 são eu e expressão aumentada de ligantes para receptores NK activatory, que os torna particularmente suscetível a de citotoxicidade mediada por células NK 15, uma célula humana erythroleukemic linha com reduzida expressão da classe HLA. Neste ensaio, células K562 pre-são rotuladas com carboxyfluorescein diacetato succinimidil éster (CFSE) e co cultivadas em várias relações com qualquer células mononucleares de sangue periférico (PBMC) ou purificado de células NK 1. CFSE é um corante fluorescente estável, proteína ligadora que permite a discriminação das células alvo do efetor NK células 16,17. Após a incubação co, uma mancha de ácido nucleico, especificamente que permeiam a membrana das células mortas, é usada para identificar as células alvo morto (veja a tabela de materiais). As amostras são então adquiridas em um citômetro de fluxo para determinar a percentagem de mortos (i.e., mancha +) CFSE + nas células-alvo.
Este ensaio pode ser usado como uma rotina diagnóstica triagem para defeitos monogénicas afetando o compartimento de célula NK, que são aproximadamente 30 defeitos conhecidos causando funcional ou clássica deficiência de células NK, e para hemophagocytosis hemofagocítica primário ou secundário. Também é útil investigar a atividade das células NK em pacientes com infecções virais herpes recorrente, grave, para avaliar a reconstituição imunológica após transplante de células hematopoiéticas ou post imuno terapia 18,19,20e para uma série de aplicações de pesquisa básica.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Antes de configurar o ensaio, é altamente recomendável que o conteúdo da célula NK ser avaliadas na população efetora de escolha. A Figura 1 mostra uma típica coloração de CD56 antes (luz azul) e depois o enriquecimento de célula NK (vermelho). Células NK compreendem até 15% de PBMC e devem ser pelo menos 80% puro depois de enriquecimento.
Análise de fluxo cytometric neste ensaio envolve a deteção de dois parâmetros: CFSE, detectável no mesmo canal FITC; e uma mancha de célula morta, detectável no mesmo canal APC (Figura 2AB). Após a aquisição de dados, a estratégia associada na Figura 2 é usada para analisar os dados. Nas células-alvo K562 mortos (i.e., células mortas mancha +) estão fechadas fora CFSE + população, fornecendo a % de células mortas dentro da população-alvo.
Condições de controle são cruciais no sentido de garantir a eficácia do ensaio propriamente dito e seus componentes separados. Em ordem para o ensaio ser considerado válido, o seguinte deve ser esperado nas condições de controle (6-8): única (condição 6) deve resultar em morte celular de células-alvo < 15% (Figura 3A). Nenhum sinal CFSE deve ser detectado por efetoras células única (condição 7), e morte celular deve ser < 5% (Figura 3B). Para a matança da interpolação de células alvo (condição 8), a morte celular deve ser > 85% (Figura 3).
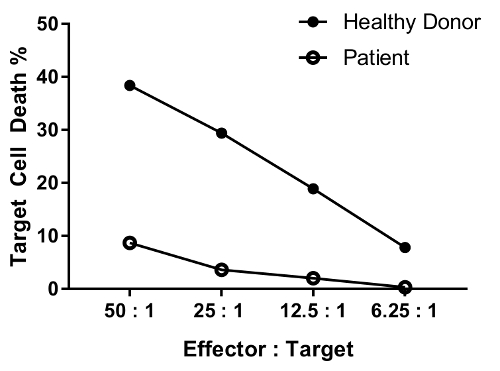
Um paciente com defeito na função de célula NK é esperado para reduziram a atividade de matança no máximo ou rácios todos testaram em comparação com um indivíduo saudável. O paralelo de doadores saudáveis e pacientes células na Figura 4 mostra o diferencial, significativa redução na morte de célula alvo com diminuindo a proporção de células efetoras-alvo.

Figura 1: avaliação de conteúdo de célula NK no seio da população effector. Histograma representativa após coloração total PBMCs (azul claro) ou purificado de células NK (vermelhas) para CD56. Clique aqui para ver uma versão maior desta figura.

Figura 2: Gating estratégia para a deteção das células alvo. A) o portão inicial é definido em uma trama de FITC-um/SSC. Células k562 são bloqueadas como CFSE + eventos. B) células K562 morto (isto é, positivo para células mortas mancha) são bloqueadas na trama do APC/SSC um subsequente dentro a populacao de celula alvo CFSE +. Clique aqui para ver uma versão maior desta figura.

Figura 3: dados representativos para as condições de controle. A) percentagem de células mortas mancha + K562 células dentro do portão CFSE + (retenção de estratégia, como ilustrado na Figura 2) em condição 6 (células alvo apenas) - controlo negativo pela morte de células K562. B) CFSE e célula morta mancham deteção em condição 7 (efetoras células apenas - PBMCs totais). C) percentagem de células mortas mancha + K562 células dentro do portão CFSE + (retenção de estratégia, como ilustrado na Figura 2) em condição 8 (células-alvo + Tween) - controle positivo pela morte de células K562. Clique aqui para ver uma versão maior desta figura.

Figura 4: dados representativos para o efeito de diluição do rácio de células efetoras-alvo diversos. Os rácios de células efetoras: alvo testados são os seguintes: 50: 1, 25: 1; 12.5:1; 6.25:1. dados são fundo (condição #6)-removido. Clique aqui para ver uma versão maior desta figura.
| Amostra | Condição | Efetor (E): Alvo (T) |
| PBMC | 1 - controle positivo para citotoxicidade de células NK | 50:1 + IL-2 |
| 2 | 50: 1 | |
| 3 | 25: 1 | |
| 4 | 12.5: 1 | |
| 5 | 6.25: 1 | |
| 6 | Só T | |
| 7 - controle negativo para morte K562 | E só | |
| 8 - positivo controle pela morte K562 | T + Tween | |
| Células NK (purificadas) | 1 - controle positivo para citotoxicidade de células NK | 5:1 + IL-2 |
| 2 | 5: 1 | |
| 3 | 2.5: 1 | |
| 4 | 1.25: 1 | |
| 5 | 0.625: 1 | |
| 6 | Só T | |
| 7 - controle negativo para morte K562 | E só | |
| 8 - positivo controle pela morte K562 | T + Tween |
Tabela 1
Subscription Required. Please recommend JoVE to your librarian.
Discussion
O método descrito aqui fornece uma alternativa simples e econômica para o ensaio de libertação tradicionais 51Cr para avaliar a atividade citotóxica das células NK. Esse método é menos demorado do que os métodos padrão anteriores, como CRA, sensível e reprodutível e pode ser usado para ambos clínicos e aplicações de pesquisa.
Enquanto o ensaio funciona com totais PBMCs e enriquecido de células NK, a opção de usar PBMCs sem a necessidade de purificar a populações de células é um grande benefício ao lidar com pequenos volumes de sangue coletado ou células de poucos ou de má qualidade das amostras dos pacientes. Este ensaio utiliza apenas CFSE e mancha de viabilidade de exclusão de célula morta. Olhando para estes dois parâmetros sozinhos fornece informações sucintas e suficientes para fins de diagnóstico, com a vantagem de não exigir mais compensação em análise de fluxo cytometric.
Esse método também pode ser usado para estudar biologia básica de célula NK e testar novas terapias de células-alvo NK. A este respeito, os recursos deexpansão de citômetros introduzir um elemento inestimável de versatilidade para este ensaio, permitindo a multiparâmetro análise de células NK e sua atividade não era possível anteriormente com ensaios como CRA. Celular alternativo de controle e viabilidade de corantes, fluoresce em outros canais, estão disponíveis para atender às necessidades dos investigadores.
Este protocolo é otimizado para uso com o alvo de célula NK prototípico linhagem de células K562. No entanto, pode ser adaptado para linhas de células alvo de suspensão alternativos com diferentes graus de sensibilidade a citotoxicidade de células NK, como HL-60, Daudi, U937 e Ribeiro. A este respeito, é importante observar que a concentração do corante fluorescente e do soro utilizado durante a rotulagem de célula de destino pode ter que ser otimizado para cada linha de célula de destino, como linhas celulares diferentes podem levar a etiqueta fluorescente de forma diferente e para cada citômetro de fluxo. Enquanto normalmente recomenda-se evitar o uso de soro durante a rotulagem, optou-se por ligeira têmpera com 0,5% de FBS por duas razões. Primeiro, ajuda a reduzir o estresse de célula de destino, e assim manchar o fundo; em segundo lugar, traz sinal CFSE ao alcance de detecção de nosso citômetro de fluxo apropriado sem a necessidade de ajustes de configurações diárias, auxiliando assim na reprodutibilidade do ensaio. Variações de protocolo adicional podem incluir testes E:T diferentes proporções e tempos de incubação para adaptar o ensaio para condições diferentes de ativação. A duração da cultura co de efetoras e células de destino para teste de citotoxicidade NK tem historicamente variou entre 4-16 h, apesar de períodos mais longos tendem a resultar em aumento espontâneo lançamento 9,16. Em nosso método, incubação mais também pode resultar em perda de fluorescente rotulagem pelas células alvo devido à matança ou proliferação, como estes corantes fluorescentes são diluídos sobre divisão celular. Assim, a incubação na parte inferior da janela de tempo é geralmente preferidas e eles não devem exceder a incubação overnight 6,16,22.
É importante tomar nota de que variáveis potencialmente podem afetar o resultado deste teste. Em nossa experiência, as células-alvo K562 são especialmente sensíveis às mudanças de temperatura. Portanto, as células K562 devem não ser refrigeradas mas prefiro mantidas em temperatura ou colocadas numa incubadora umidificada CO2 a 37 ° C, antes da sua utilização. Pela mesma razão, todos os reagentes devem ser trazidos para as temperaturas adequadas conforme indicado no protocolo. Outro parâmetro que afectam estas células é a velocidade de centrifugação, que deve ser reduzida para minimizar o estresse celular. Além disso, limitar o tempo de retardo entre a preparação do efetor/alvo e o início da incubação co a menos de 30 min é essencial para garantir a atividade máxima de matança e do ensaio de reprodutibilidade. Da mesma forma, como sinal CFSE é geralmente robusto, pipetagem precisos, mistura adequada de células e precisa incubação tempo quando rotulagem e têmpera são cruciais para garantir a consistência na coloração. Finalmente, NK células citotóxica habilidade é altamente variável, mesmo em indivíduos saudáveis e é influenciada por uma série de fatores, incluindo o grau de desenvolvimento, sexo, idade e peso 23,24,25. Além disso, acima de 30% dos controles sadios exibir uma redução significativa ou perda completa da capacidade citotóxica se testado mais de 24 horas após o empate do sangue. Portanto, é recomendável a utilização recém purificada PBMCs ou NK células sempre que possível.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Os autores não declaram nenhum conflito de interesse financeiro.
Acknowledgments
Gostaríamos de agradecer a Jill Narciso, centro de Imunogenética de UCLA, pela sua assistência com a preparação do manuscrito.
Materials
| Name | Company | Catalog Number | Comments |
| Phosphate-buffered Saline (1x, w/o Ca2+ and Mg2+) | Corning (Cellgro) | 21-040-CM | |
| Ficoll-Paque PLUS | GE Healthcare | 17-1440-02 | |
| Tween-20 | Sigma | BP337-100 | |
| RPMI 1640 Media | Corning (Cellgro) | 10-040-CV | |
| Heat-inactivated Fetal Bovine Serum | Omega Scientific | FB-02 | |
| Penicillin Streptomycin | Life Technologies | 15140-163 | Stock solution at 10,000 U/mL |
| IL-2 | R&D Systems | 202-IL-050 | Lyophilized from a 0.2 μm filtered solution in Acetonitrile and TFA with BSA as a carrier protein. Reconstitute with 500 ul at 100 μg/mL in sterile 100 mM Acetic Acid containing at least 0.1% bovine serum albumin (2.1x10E6 IU/ml) |
| K562 Cells | ATCC | CCL-243 | Cancer cell line |
| T-75 cell culture flasks | Corning | 431464 | |
| CFSE cell proliferation kit | Life Technologies (CellTrace) | C34554 | Reconstitute I vial with 18 ul DMSO to prepare a 5mM stock solution. Do not freeze/thaw. |
| Sytox Red | Life Technologies | S34859 | Stock solution is provided at 5 μM in 1 mL DMSO. The DMSO solution may be subjected to multiple freeze-thaw cycles without reagent degradation. |
| Sodium/lithium heparin blood collection tubes | BD | 02-687-95 | |
| U-bottom 96-well plate | Corning | CLS3897 | |
| Serological pipettes | BD Falcon | ||
| Polystyrene round-bottom tubes (5mL) | BD Falcon | 14959-5 | |
| 50 mL polypropylene conical tube | BD Falcon | 352070 | |
| 15 mL polypropylene conical tube | BD Falcon | 352097 | |
| Reagent reservoir | USA Scientific | 2321-2230 | |
| Human NK cell enrichment cocktail | StemCell Technologies (RosetteSep) | 15065 |
References
- Iannello, A., Debbeche, O., Samarani, S., Ahmad, A. Antiviral NK cell responses in HIV infection: I. NK cell receptor genes as determinants of HIV resistance and progression to AIDS. J Leukoc Biol. 84 (1), 1-26 (2008).
- Caligiuri, M. A. Human natural killer cells. Blood. 112 (3), 461-469 (2008).
- Topham, N. J., Hewitt, E. W. Natural killer cell cytotoxicity: how do they pull the trigger? Immunology. 128 (1), 7-15 (2009).
- Warren, H. S., Smyth, M. J. NK cells and apoptosis. Immunol Cell Biol. 77 (1), 64-75 (1999).
- Tognarelli, S., Jacobs, B., Staiger, N., Ullrich, E. Flow Cytometry-based Assay for the Monitoring of NK Cell Functions. J Vis Exp. (116), (2016).
- Somanchi, S. S., McCulley, K. J., Somanchi, A., Chan, L. L., Lee, D. A. A Novel Method for Assessment of Natural Killer Cell Cytotoxicity Using Image Cytometry. PLoS One. 10 (10), e0141074 (2015).
- Alter, G., Malenfant, J. M., Altfeld, M. CD107a as a functional marker for the identification of natural killer cell activity. J Immunol Methods. 294 (1-2), 15-22 (2004).
- Atkinson, E. A., Gerrard, J. M., Hildes, G. E., Greenberg, A. H. Studies of the mechanism of natural killer (NK) degranulation and cytotoxicity. J Leukoc Biol. 47 (1), 39-48 (1990).
- Kim, G. G., Donnenberg, V. S., Donnenberg, A. D., Gooding, W., Whiteside, T. L. A novel multiparametric flow cytometry-based cytotoxicity assay simultaneously immunophenotypes effector cells: comparisons to a 4 h 51Cr-release assay. J Immunol Methods. 325 (1-2), 51-66 (2007).
- Kane, K. L., Ashton, F. A., Schmitz, J. L., Folds, J. D. Determination of natural killer cell function by flow cytometry. Clin Diagn Lab Immunol. 3 (3), 295-300 (1996).
- Jang, Y. Y., et al. An improved flow cytometry-based natural killer cytotoxicity assay involving calcein AM staining of effector cells. Ann Clin Lab Sci. 42 (1), 42-49 (2012).
- Korzeniewski, C., Callewaert, D. M. An enzyme-release assay for natural cytotoxicity. J Immunol Methods. 64 (3), 313-320 (1983).
- Karimi, M. A., et al. Measuring cytotoxicity by bioluminescence imaging outperforms the standard chromium-51 release assay. PLoS One. 9 (2), e89357 (2014).
- Oppenheim, D. E., et al. Glyco-engineered anti-EGFR mAb elicits ADCC by NK cells from colorectal cancer patients irrespective of chemotherapy. Br J Cancer. 110 (5), 1221-1227 (2014).
- West, W. H., Cannon, G. B., Kay, H. D., Bonnard, G. D., Herberman, R. B. Natural cytotoxic reactivity of human lymphocytes against a myeloid cell line: characterization of effector cells. J Immunol. 118 (1), 355-361 (1977).
- Jedema, I., van der Werff, N. M., Barge, R. M., Willemze, R., Falkenburg, J. H. New CFSE-based assay to determine susceptibility to lysis by cytotoxic T cells of leukemic precursor cells within a heterogeneous target cell population. Blood. 103 (7), 2677-2682 (2004).
- Lecoeur, H., Fevrier, M., Garcia, S., Riviere, Y., Gougeon, M. L. A novel flow cytometric assay for quantitation and multiparametric characterization of cell-mediated cytotoxicity. J Immunol Methods. 253 (1-2), 177-187 (2001).
- Carotta, S. Targeting NK Cells for Anticancer Immunotherapy: Clinical and Preclinical Approaches. Front Immunol. 7, 152 (2016).
- Mandal, A., Viswanathan, C. Natural killer cells: In health and disease. Hematol Oncol Stem Cell Ther. 8 (2), 47-55 (2015).
- Rezvani, K., Rouce, R. H. The Application of Natural Killer Cell Immunotherapy for the Treatment of Cancer. Front Immunol. 6, 578 (2015).
- Angelo, L. S., et al. Practical NK cell phenotyping and variability in healthy adults. Immunol Res. 62 (3), 341-356 (2015).
- Zons, P., et al. Comparison of europium and chromium release assays: cytotoxicity in healthy individuals and patients with cervical carcinoma. Clin Diagn Lab Immunol. 4 (2), 202-207 (1997).
- Yovel, G., Shakhar, K., Ben-Eliyahu, S. The effects of sex, menstrual cycle, and oral contraceptives on the number and activity of natural killer cells. Gynecol Oncol. 81 (2), 254-262 (2001).
- Laue, T., et al. Altered NK cell function in obese healthy humans. BMC Obes. 2, 1 (2015).
- Hazeldine, J., Lord, J. M. The impact of ageing on natural killer cell function and potential consequences for health in older adults. Ageing Res Rev. 12 (4), 1069-1078 (2013).
Tags
Imunologia edição 126 assassino natural célula NK citotoxicidade lise celular celular matando K562 citometria de fluxo liberação de cromo citotoxicidade de células NK CFSEErratum
Formal Correction: Erratum: A Flow Cytometry-Based Cytotoxicity Assay for the Assessment of Human NK Cell Activity
Posted by JoVE Editors on 09/10/2017.
Citeable Link.
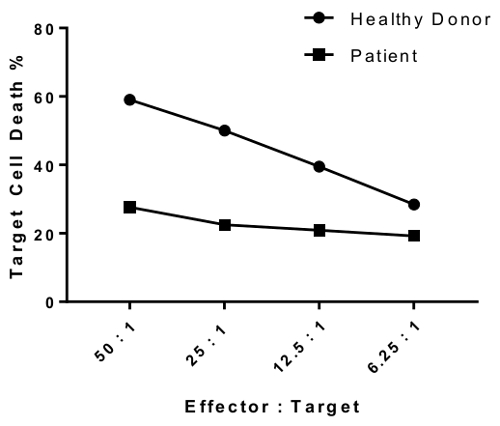
An erratum was issued for: A Flow Cytometry-Based Cytotoxicity Assay for the Assessment of Human NK Cell Activity. Figure 4 has been corrected to show background-corrected data.
Figure 4 was corrected from:
to: