Summary
Eine Behandlungsprotokoll Hochdurchsatz-kalte physikalische Plasma von Flüssigkeiten und Zellen wird angezeigt. Es beinhaltet die Einrichtung verschiedener Fördergas Kompositionen für Plasma-Zündung, Messung der Plasma-Emissionsspektren und die anschließende Analyse von Flüssigkeiten und Zellaktivität nach Plasmabehandlung.
Abstract
In Plasmamedizin gelten ionisierte Gase mit Temperaturen nahe dem vertebrate Systeme für Zellen und Gewebe. Kalten Plasmen erzeugen reaktive Spezies bekannt, Redox regulieren biologische Prozesse in Gesundheit und Krankheit. Vorklinische und klinische Beweise deuten auf die wohltuende Wirkung der Plasmabehandlung bei der Heilung von chronischen Geschwür der Haut. Andere Themen, wie Plasma Krebsbehandlung, sind zunehmend Beachtung. Plasma medizinischer Forschung erfordert interdisziplinäres Fachwissen in Physik, Chemie und Biomedizin. Ein Ziel der Plasmaforschung soll Plasma-behandelten Zellen in einer Vielzahl von spezifischen Anwendungen zu charakterisieren. Dazu gehören z. B. Zellzahl und Lebensfähigkeit, zelluläre Oxidation, mitochondriale Aktivität, Zytotoxizität und Modus des Zelltods, Zellzyklus-Analyse, Zelle Oberfläche Marker Ausdruck und Cytokine Freigabe. Diese Studie beschreibt die Grundausstattung und Workflows für solche Forschung in Plasma Biomedizin erforderlich. Es beschreibt den ordnungsgemäßen Betrieb der ein Plasmastrahl der Atmosphärendruck Argon, insbesondere Überwachung seiner grundlegenden Emissionsspektren und Futtermittel Gas-Einstellungen, um reaktive Spezies Ausgabe zu modulieren. Mit einem Präzisions-Xyz-Tisch und Computer-Software, ist der Jet in Millisekunde Genauigkeit die Hohlräume der 96-Well-Platten im Mikrometer-Präzision für maximale Reproduzierbarkeit schwebte. Nachgeschalteten Assays für die Flüssigkeitsanalyse Redox-aktive Moleküle werden angezeigt, und Zielzellen sind Plasma behandelt. Insbesondere werden Melanomzellen in eine effiziente Abfolge von verschiedenen aufeinander folgenden Tests aber mit den gleichen Zellen analysiert: Messung der Stoffwechselaktivität, gesamten Zellbereich und Oberfläche Marker Ausdruck der Calreticulin, ein Molekül wichtig für die immunogen Zelltod der Krebszellen. Diese Tests Abrufen von Content-reiche biologische Informationen zu Plasmaeffekte aus einer einzigen Platte. Insgesamt beschreibt dieser Studie die wesentlichen Schritte und Protokolle für Plasma medizinische Forschung.
Introduction
Reaktive Spezies sind wichtige Redox Regler in Krankheit, einschließlich abnorme Wundheilung1 und Krebs. 2 wichtig ist, sind diese Arten in der Pathologie als auch seine therapeutische Auflösung beteiligt. 3 , 4 körperliche kaltes Plasma ist ein ionisiertes Gas, das reaktive Spezies von vielen Arten vertreibt. 5 seit dem Aufkommen der sogenannten kalten Plasmen, die am Körper Temperatur6betreiben, können kalte Plasmen auf Zellen und Gewebe ohne thermischen Schaden angewendet werden. Durch den Nachweis der Wirksamkeit und sichere Anwendung der Plasma-Geräte in der präklinischen und klinischen Beobachtungen, erhielten drei Akkreditierung als Medizinprodukte in Deutschland. 7 vor allem in Bezug auf genotoxische, mehrere Studien haben keine mutagene Ereignisse mit dem ersten Gerät, ein atmosphärischer Druck Argon Plasma Jet gezeigt. 8 , 9 , 10 die anderen beiden Geräte sind sogenannte dielektrische Barriere Entladungen (DBD), die über ein anderes Prinzip als Plasmastrahl zu betreiben. Insbesondere ermöglichen Düsen für skalpellartige Behandlung von Oberflächen und Hohlräume, während DBD Plasmen in der Behandlung größer, aber eher flach Gewebe Bereichen effizient sind. Nutzung von zellulären Redox signaling11, ist das Ziel der Technik Plasma erzeugt reaktiven Spezies für biomedizinische Anwendungen zu nutzen. 12 eine besonders vielversprechende Anwendung von klinischen Plasmatherapie ist die Unterstützung der Wundheilung. 13 , 14 , 15 im übrigen Plasma zeigte sich in Tiermodellen Krebs auswirken. 16 , 17 , 18
Vor dem Überprüfen der Wirksamkeit und Sicherheit von Plasmaanwendungen in Tiermodellen oder sogar Menschen, standardisiert, in-vitro- Forschung muss mit Plasma Geräte durchgeführt werden. Diese Experimente sind unerlässlich für Plasmaanwendungen zu erkunden und um die Mechanismen bei der Arbeit zu umreißen. Darüber hinaus ist Grundlagenforschung erforderlich, um den Einfluss der Zusammensetzung des reaktiven Spezies und nachfolgende biologische Wirkungen zu verstehen. Diese Studie zeigt, wie Plasma in biomedizinischen Forschung besser verstehen und kontrollieren ihre Auswirkungen auf die Zellen integriert werden kann. Es beschreibt die Stimmung der feed Gaszusammensetzung, Überwachung von reaktiven Spezies Ausgabe, Anwendungen von Plasma Flüssigkeiten, Zellen, Gewebe und die daraus resultierende chemische und biologische Ergebnisse. Darüber hinaus sind Beispiele, die auf die Standardisierung der Plasmabehandlung und nachgelagerte biologische Assays, mit einem Schwerpunkt auf Plasma medizinische Forschung in 96-Well Platten anweisen. Dieser Ansatz hat deutliche Vorteile: ich) Minimierung der Anzahl der Zellen pro Zustand, Reagenz Kosten und Arbeitsaufwand beträgt pro Probe; (II) in Höhe von größerer Genauigkeit der Ergebnisse als doppelte oder dreifacher Behandlungen mit Leichtigkeit einrichten können; und Iii) Erleichterung der nahtlose nachgelagerten Prüfung in 96-Well-Format Platte Leser, Bildgebung und Flow Cytometry Experimente.
Protocol
(1) Plasma Arten Überwachung und Behandlung Setup
-
Plasma-Arten, die Überwachung
- Verwenden Sie ein Plasmastrahl Atmosphärendruck und maximal zwei Normliter pro Minute Gas Flussmittel zu ernähren.
- Senkrecht zur Achse Plume positionieren des Jets vor eine optische Emission-Spektralphotometer und Rekord Fotoemission und Wellenlänge (200-1.000 nm) mit Software gewidmet.
- Mischen Sie 0,5 % aus Stickstoff oder Sauerstoff zu trockene oder feuchte Fördergas (5 %).
- Wiederholen Sie die optische Emission-Spektroskopie für jedes Gas-Zustand.
- Analysieren Sie mit Software zur grafischen Darstellung von Daten geeignet.
-
Plasma-Behandlung-setup
- Den Jet in eine Computer-gesteuerte Xyz-Tabelle zu beheben.
- Die Position der Brunnen zu identifizieren und erzeugen ein Computer-Skript, um die Jet trat an den Tisch, mit den entsprechenden Behandlungszeiten oberhalb der Mitte jedes gut bewegen.
- Fügen Sie 104 von jeder Art von anhaftenden Säugerzellen in 100 µL kompletten Zellkulturmedium (RPMI1640 mit 10 % FCS, 2 % Glutamin und 1 % Penicillin/Streptomycin) in mehreren Brunnen unter einem Laminar-Flow-Haube.
- Können Sie zelluläre Adhäsion über Nacht bei 37 ° C in eine feuchte Atmosphäre mit 5 % Kohlendioxid auftreten.
- Behandlung der Zellen mit Plasma für 20 s in verschiedenen Höhen (z-Achse) Abständen von 250 µm.
- Fügen Sie 25 µL Propidium Jodid in Zellkulturmedium in jede Vertiefung.
- Bild der Zellen unter dem Mikroskop bestimmte Höhe bestimmen, die Zelle Nekrose durch das Futter nicht dazu veranlassen, wird gas das Nährmedium auf die Zellen beiseite schieben.
Hinweis: Für längere Behandlungszeiten identifizieren Sie, flüssige Verdampfung in dieser bestimmten Höhe im Plasma auf und off-Modus, indem Wägeplatte vor und nach der Plasmabehandlung zu identifizieren, die Menge der Mikroliter Doubledistilled Wasser erforderlich, wiederherzustellen osmotische Homöostase in den behandelten Vertiefungen. - Bereiten Sie eine endgültige Protokoll für die Xyz-Tabelle mit entsprechenden Behandlungszeiten (hier: 20 s, 40 s, 60 s Plasma und 60 s-Gas-Control) und Positionen gut und bereit Mehrkanal-Pipetten und Stauseen für liquid Handling von 96-Well Platten in nachfolgenden Tests.
2. Analyse der reaktiven Hauptkomponenten in plasmabehandelte Flüssigkeiten
-
Analyse von plasmabehandelte Wasserstoffperoxid
- 100 µL der Phosphat-gepufferte Kochsalzlösung (PBS) mit Plasma in dreifacher Ausfertigung in 96-Well-Bodenplatten zu behandeln.
- Bereiten Sie einen master-Mix durch Laden von 100 µL PBS mit 10 U Meerrettich Peroxidase und 5 µM Wasserstoffperoxid Erkennung Reagenz (ausreichend für eine gut; entsprechend skalieren).
- Jedes gut 95 µL des master-Mix hinzufügen.
Hinweis: Die vorherige Schritt sollte durchgeführt werden unter einer sauberen Werkbank oder in einem Raum getrennt von der der Plasmaquelle Umgebungsluft Ozon kann die Empfindlichkeit des Tests zu verringern. - Bereiten Sie in einer separaten Platte eine zweifache Verdünnungsreihen von Wasserstoffperoxid in PBS mit einer oberen Konzentration von 100 µM in 100 µL PBS vor.
- Brunnen mit der Erkennung-Reagenz fügen Sie 5 µL von Proben oder Wasserstoffperoxid Standards hinzu.
- Gehören Sie Brunnen mit Erkennung Reagenz nur für Hintergrundabzug nach dem Auslesen.
- Inkubieren Sie die Platte in der Dunkelheit für 15 min bei Raumtemperatur.
- Platzieren Sie die Platte in der Mikrotestplatte Leser Fluoreszenz bei λex 535 nm und λEm 590 nm zu messen.
Hinweis: Wenn hohe Peroxide-Konzentrationen in den Proben zu erwarten sind, die Probenverdünnung erhöht werden muss oder Lesungen müssen getan werden, mit kürzeren Inkubationszeiten Sättigung des Tests zu vermeiden. - Subtrahieren Sie leere Werte aus allen Proben, berechnen der Peroxid Standardkurve und unbekannten Probe Peroxid Konzentrationen von dieser Grundlinie Kurve zu quantifizieren.
-
Analyse der plasmabehandelte Nitrit
- 100 µL PBS mit Plasma in dreifacher Ausfertigung in Plattboden 96well Platten zu behandeln.
- Bereiten Sie eine master-Mix von Nitrit Erkennung Lösung durch Zugabe von 1 µL Reagenz Quantifizierung zu 99 µL Doubledistilled Wasser (ausreichend für eine gut; entsprechend skalieren).
- Eine klare, Plattboden 96well Platte 100 µL pro Bohrloch hinzufügen. Scale-up für die Anzahl der Bohrungen benötigt.
- Bereiten Sie eine Verdünnungsreihe von Nitrit Standards im Doubledistilled Wasser.
- Die master-Mix in 96well Platten 10 µL Standards bzw. Proben hinzufügen.
- Inkubieren Sie die Platte in der Dunkelheit für 10 min bei Raumtemperatur.
- Fügen Sie 5 µL Entwicklerlösung Nitrit Quantifizierung in jede Vertiefung.
- Fluoreszenz in einer Mikrotestplatte Leser bei λex 365 nm und λEm 450 nm zu lesen.
- Subtrahieren Sie leere Werte aus allen Proben, berechnen der Standardkurve Nitrit und unbekannten Probe Nitrit-Konzentrationen von dieser Grundlinie Kurve zu quantifizieren.
-
Analyse der plasmabehandelte Superoxid
- Machen Sie einen master-Mix von oxidierten Cytochrom (1 mg/mL) und Katalase (20 µg/mL) mit PBS-Puffer.
- Die Brunnen von einer klaren, flach-Boden 96-Well-Platte 100 µL der master-Mix hinzufügen.
- Die master-Mix mit Plasma in dreifacher Ausfertigung pro Behandlung Zustand zu behandeln.
- Lesen Sie die Extinktion bei 550 nm mit einer Mikrotestplatte Reader; darstellen Sie diese Daten grafisch.
- Berechnen Sie die Höhe der Superoxid erzeugt mit Hilfe der molaren Aussterben Koeffizient von Cytochrom C und die Länge der Lichtweg Flüssigkeit in einen Brunnen.
(3) die biologische Reaktion von Zellen Plasma ausgesetzt
-
Multidimensionale Auslesen der Plasma-behandelten Zellen: Stoffwechselaktivität
- Verwenden Sie eine laminare Strömung Kapuze für alle der folgenden Verfahren.
- 104 Samenzellen (B16 murinen Melanom) in 100 µL ergänzt voll Zellkulturmedium pro Bohrloch in 96-Well-Bodenplatten.
- Erlauben Sie zellulare Adhäsion über Nacht bei 37 ° C in die feuchte Atmosphäre des Inkubators mit 5 % Kohlendioxid.
- Anhand der Xyz-Tabelle, Brunnen mit Plasma oder Gas allein nach einem vordefinierten Schema zu behandeln, und die Zellen wieder in den Brutkasten für 20 h hinzufügen.
Hinweis: Bei Bedarf ausziehen Sie Überstände nach 20 h, extrazelluläre Produkte zu analysieren; danach 100 µL frisches Medium hinzufügen. - Fügen Sie in jede Vertiefung 25 µL Zellkulturmedium mit 500 µM Resazurin (Endkonzentration 100 µM) hinzu; bereiten Sie drei Brunnen mit Resazurin allein im Zellkulturmedium ohne Zellen für Hintergrundabzug vor.
- 3 h im Inkubator inkubieren.
- Fluoreszenz bei λex 535 nm und λEm 590 nm in einem Mikrotestplatte-Reader zu lesen.
- Subtrahieren Sie Hintergrundfluoreszenz aus allen Proben und normalisieren Sie Daten zur Kontrollwerte.
-
Multidimensionale Auslesen der Plasma-behandelten Zellen: Bildanalyse
- Die well-Platte aus 3.1.7 und verwerfen Sie überstand.
- Fügen Sie 100 µL der Frischzellen-Kulturmedium mit 1 µg/mL Propidium Jodid hinzu.
- Legen Sie die Platte unter dem Mikroskop mit einer motorisierten Bühne zu jedem Bild.
Hinweis: Imaging Details hängen die experimentelle Frage; Hier wurde ein 20 X Objektiv in einem High-Content-imaging-Gerät verwendet, um 3 x 3 Gesichtsfelder in jede Vertiefung in ein Hellfeld-Kanal, digital Phase Kontrast Kanal und Fluoreszenz (Propidium Jodid) Kanal, unter Verwendung geeigneter Anregungslicht und Emission zu lesen Filter. - Verwendung quantitative Bildanalyse-Software bestimmen die cytosolische Gesamtfläche in digitale Phase kontrastreiche Bilder von allen Gesichtsfelder abgebildet in jede Vertiefung.
Hinweis: Analysieren Sie weitere Parameter, wenn gewünscht, zum Beispiel die Anzahl der lebensfähigen oder toten Zellen oder mitochondriale Aktivität mit dedizierten Flecken. Wenn andere Flecken verwenden als in dieser Arbeit beschrieben, achten Sie darauf, dass Fluoreszenz Flecken für Mikroskopie verwendet mit der Fluorochromes in nachfolgende Flow Cytometry Experimente verwendet nicht spektral überlappen. - Die Daten grafisch darstellen, und falls gewünscht, für die Korrelation mit den Werten für die metabolische Aktivität testen.
-
Multidimensionale Auslesen der Plasma-behandelten Zellen: Flow Cytometry
- Verwenden Sie für diese Analyse der well-Platte aus Schritt 3.2.5.
- Den Überstand verwerfen und waschen zweimal mit 200 µL PBS, enthält Kalzium und Magnesium (0,9 mM und 0,5 mM, beziehungsweise).
Hinweis: Fix und/oder permeabilize Zellen in diesem Stadium für weitere biologische anzeigen in diesem Beitrag, wie die Färbung des intrazellulären Antigen oder Zellzyklus Analyse nicht behandelt. - Fügen Sie in jede Vertiefung 50 µL PBS mit Calcium und Magnesium, 50 ng/mL Anti-Maus Calreticulin monoklonaler Antikörper enthält.
- 15 min. im Inkubator inkubieren.
- Waschen zweimal mit 200 µL voll Zellkulturmedium ergänzt und verwerfen Sie die Flüssigkeit in der Platte.
- Jedes gut 100 µL der Zelle Ablösung Lösung hinzu, und 20 min in den Brutschrank inkubieren.
- Verwenden Sie einen anderen Satz von ungefärbten B16 Zellen in Suspension Fluss durchflusszytometrischen Übernahme Protokoll, gating, Strategie, und Gewinne und Spannungen von Photodetektoren einrichten.
- Laden Sie die Platte in einem Durchflusszytometer mit einem Auto-Sampler für 96-Well Platten ausgestattet.
- Erwerben Sie ein Minimum von 1.000 Zellen in der Forward und Side Scatter Bevölkerung meist verbunden mit entwicklungsfähigen Zellen.
- Verwenden Sie Software, die speziell für die Analyse der Durchflusszytometrie, .fcs Dateien zu die Bevölkerung von Interesse, Tor und bestimmen Sie der mittlere Fluoreszenzintensität von Calreticulin.
- Daten grafisch darstellen, und falls gewünscht, testen für die Korrelation mit den Werten für metabolische Aktivität, Bildgebung und/oder Oxidationsmittel Ablagerung erhalten.
Representative Results
In dieser Studie wurde ein optimierte Workflow für die medizinische Forschung über die Auswirkungen von Plasma beschrieben. Der multidisziplinäre Ansatz hier verwendete analysiert das grundlegende optische Emission-Profil des Plasmastrahls, reaktive Hauptkomponenten in der Flüssigkeit und der biologischen Reaktionen der Zellen mit Plasma (Abbildung 1) behandelt.
Um diesen Workflow durchführen zu können, waren eine Reihe von Komponenten nötig, um die Plasmaquelle (Abbildung 2) ordnungsgemäß einzurichten. Die verschiedenen Gasen (hier vor allem Argon, Sauerstoff und Stickstoff) zugeführt und durch mehrere mass Flow Controller gesteuert wurden. Ein zentraler Bereich wurde verwendet, um Digital Massendurchflussregler zu vorgegebenen Fördergas Fluten anpassen. Um spezifische Fördergas Kompositionen zu erzielen, wurden die Gase physisch gemischt Nutzung ein Panel von Ventilen, die Gase aus mehreren Massendurchflussregler (Abb. 2A) kombiniert. Die Plasmaquelle wurde eingeschaltet, und das Plasma Abwasser eingerichtet vor einem USB-Spektralphotometer (Abbildung 2B) mit einem optischen Bereich von 200 nm bis 1.000 nm. Für die Behandlung von Flüssigkeiten und Zellen beschrieb ein effizienter Workflow mit 96-Well Platten. Multi-gut Speisen fanden statt mit einem Kunststoffrahmen, die fixiert wurde auf der Grundplatte mit Einfügungen auf seiner aufgeprägten Löcher (Abbildung 2C) abgestimmt. Die gesamte Einrichtung wurde unter einem Laminar-Flow-Haube (Abbildung 2D) gelegt. Dieses Setup enthalten eine Xyz-Tabelle, die Hand Stück des Plasmastrahls montiert war. Die Motorsteuerung Elemente können außerhalb der Bank befinden, wenn diese ausreichend große Kabelanschlüsse von und zu der Xyz-Tabelle hat. Wichtig ist, die Tabelle war computergesteuerte und kann programmiert werden, dass den Jet auf die Mitte von jedem Bohrloch Mikrometer genau für den gewünschten Zeitraum zu zeigen. Darüber hinaus war die Startposition (wie in unserem Setup gut A1) (Abb. 2E) frei gewählt. Zusammen mit der Kunststoffplatte Inhaber erlaubt dies für eine reproduzierbare Plasmabehandlung mit täglichen Abweichungen ausschließlich im Zusammenhang mit der Einrichtung der flüssigen und biologische Experimente.
Optische Emission-Spektroskopie (OES) wurde verwendet, um verschiedene Gipfel verbunden mit reaktiven Plasma Komponenten in verschiedenen Fördergas Bedingungen(Abbildung 3)folgen. Zum Beispiel das zweite positive System von Stickstoff mit Gipfeln von 330 nm bis 380 nm vertreten-reaktivem Stickstoff-Spezies und der Peak bei 309 nm vertreten-Hydroxyl-radikale (Pfeil in Abbildung 3). Argon-Gas allein erhöhte sich gegenüber der Anwesenheit von Stickstoff-Arten mit einer Mischung aus Stickstoff in das Fördergas während die Zugabe von Sauerstoff oder Feuchtigkeit vermindert oder, bzw. reduziert. Im Gegensatz dazu war die Anwesenheit von Hydroxyl-radikale mit Sauerstoff oder Stickstoff verringert aber deutlich erhöht, wenn befeuchtete Argon als Fördergas verwendet wurde. Für die Plasmabehandlung von Flüssigkeiten, die Verdunstung verursacht durch die Argon-Gas und Argon-Plasma bestimmt war erste (Abbildung 3B). Wichtig ist, beide Bedingungen nicht ähnliche Ergebnisse weil Plasma auch Auswirkungen auf die Temperatur ausübt. Im Einklang mit der OES-Ergebnisse der Hydroxyl-radikale Wasserstoffperoxid Ablagerung deutlich verringert mit Sauerstoff oder Stickstoff Beimischung aber mit befeuchteten Fördergas (Abb. 3C) erhöht. Darüber hinaus führte die Zugabe von Stickstoff auf das Fördergas zu deutlich höheren Nitritkonzentrationen im Vergleich zu Argon Plasma behandelt Flüssigkeiten (Abbildung 3D). Dieser Workflow könnte auch eingesetzt werden, um den Einfluss des Plasmas auf Flüssigkeiten mit unterschiedlicher Zusammensetzung zu untersuchen. Wasserstoff-Peroxid-Konzentrationen schien beispielsweise unabhängig vom Vorhandensein von fetalen Kälberserum in PBS und RPMI1640 Zellkulturmedium (Abbildung 3E) werden. In den gleichen Proben verringert das Vorhandensein von Serum Nitritkonzentrationen in PBS und Zelle Kulturmedium im Vergleich zu nicht-Serum enthält (Abbildung 3F). Die meisten Superoxid entstand in den trockenen Argon Gasbedingungen mit Sauerstoff oder Stickstoff Beimengungen erheblich abschrecken Superoxid-Generation, mit Ausnahme der befeuchteten Argon-Sauerstoffplasma (Abbildung 3G).
Für die Plasmabehandlung von Zellen in mehreren gut Speisen wurde die Platte enthaltende Zellen am Vortag ausgesät aus dem Inkubator entfernt und hinzugefügt, um die Kunststoff-Halter. Ein programmierter Behandlung Muster angewendet wurde, Verdunstung kompensiert wurde und die Platte wieder in den Brutkasten für 20 h beachten Sie, dass nach diesem Inkubation Zelle Kultur Überstände konnte in ein neues, leeres 96-Well-Platte gesammelt und gespeichert wurden bei platziert wurde- 80 ° C für die Beurteilung der interessierenden Proteine. Als nächstes wurde die Zellen jedes gut Resazurin hinzugefügt. Umsatz von nicht-fluoreszierende Resazurin zu fluoreszierenden Resorufin wurde nur durch aktiven NADPH erzeugenden Enzymen erleichtert und war mit insgesamt Stoffwechselaktivität (Abb. 4A) korreliert. Fluoreszenz-Intensitäten waren ähnlich wie die visuelle Wahrnehmung der Platte und zytotoxische Wirkung von längerer Plasmabehandlung (Abbildung 4B) angegeben. Befeuchteten Gasbedingungen waren eher schädlich als Trockengas Bedingungen. Die gleichen Zellen in der Platte wurden für weitere nachgelagerte Assays eingesetzt. Zellen in der Platte wurden mikroskopisch untersucht (Abb. 4C). Mit imaging-Software, wurden mehrere Brunnen der Platte für den qualitativen Vergleich (Abbildung 4D) untersucht. Software erlaubt die Quantifizierung der Gesamtfläche von Zellen innerhalb der Gesichtsfelder erworben in jedem gut abgedeckt und die daraus resultierenden Daten wurden zur jeweiligen Steuerelemente (Abbildung 4E) normalisiert. Eine Abnahme der gesamten Zellbereich verzeichnete die Plasmaproben Behandlung, vor allem mit der befeuchteten Fördergas Bedingungen. Nach dem Imaging, wurden die Zellen gewaschen, gefärbt mit Calreticulin Anti-Maus-Antikörper, losgelöst und mit Durchflusszytometrie (Abbildung 4F) analysiert. Bedeuten Sie Fluoreszenz-Intensität von Calreticulin Färbung in lebensfähige Zellen (Abb. 4G) wurden berechnet und im Vergleich zwischen Proben (Abbildung 4H). Plasmabehandlung induziert eine Hochregulation von Calreticulin auf murinen Melanom Zelloberfläche, die das Plasma Behandlungszeit mit trockenen Fördergas Bedingungen angewendet entsprach. Für befeuchtet Fördergas Bedingungen, 20 s und 40 s Behandlung induziert eine stärkere Calreticulin Exposition im Vergleich zu den tödlicher 60 s Behandlungszeit. Dies deutet darauf hin, dass gab es eine nicht-lineare Regulierung des Calreticulin Exposition in Bezug auf die Menge an Antioxidantien eingeführt, um die Zellen.
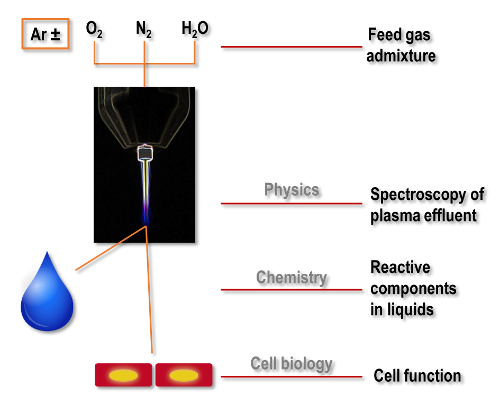
Abbildung 1 : Workflow Plasma medizinischer Forschung aus der Physik, Biologie. Die reaktive Spezies Ausgabe des Plasmastrahls Atmosphärendruck Argon ist durch Modulation das Fördergas abgestimmt. Ausgewählte Moleküle in der Gasphase Plasma werden durch Spektroskopie überwacht. Das Plasma wird verwendet, um Flüssigkeiten zu behandeln und untersuchen Oxidationsmittel Ablagerung. Zellen in Mikrotiterplatten kultiviert plasmabehandelte und biologische Ablesung durchgeführt. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2 : Einrichtung der Plasma Forschung Bank. (A) verschiedene Gase aus rostfreiem Stahl, die Rohre sind in mehrere Massendurchflussregler, die gesteuert werden über einen zentralen Bereich getrieben. Die Zusammensetzung der einzelnen Fördergas wird gemischt, danach mit einem Panel von Ventilen. (B) einige reaktive Komponenten des Plasmas mit optische Emission-Spektroskopie um zu untersuchen, Unterschiede zwischen verschiedenen Fördergas Kompositionen überwacht werden können. (C) für Hochdurchsatz-Plasmaforschung, 96-Well-Mikrotiterplatten verwendet werden. Um eine konstante, die Ausgangspunkt für programmierbare und automatische Plasma-Behandlung zu gewährleisten, wird die Platte in einen Positionsrahmen garantiert die gleiche absolute Position der Platten von Tag zu Tag hinzugefügt. (D) ist der Plasmastrahl auf einer computergesteuerten Xyz-Tabelle befindet sich unter einem Laminar-Flow-Haube fixiert. Alle 96 genauen Standorte und die Verweilzeit des Plasmas über jedes ist gut geschrieben in eine Programmdatei, die Bewegung der Plasmaquelle zu führen. Das Hauptgehäuse der Plasmastrahl Apparat sowie die Motorsteuerungen befinden sich in unmittelbarer Nähe. (E) automatisiert Plasmabehandlung einer 96-Well-Platte. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 3 : Plasmastrahl und Flüssigkeit Analyse. (A) optische Emission-Spektroskopie von verschiedenen Fördergas Bedingungen wird angezeigt. Das zweite positive System von Stickstoff (330 nm bis 380 nm) erhöht mit Beimischung von Stickstoff, abwesend bei Sauerstoff-Beimischung, und befeuchtete Argon (Lefthand Paneele) deutlich reduziert wurde. Der Höhepunkt der Hydroxyl-Radikale im 309 nm (Pfeil) in Stickstoff und Sauerstoff Bedingungen zurückgegangen aber deutlich erhöht mit befeuchteten Argon, Argon-Gas allein gegenüber. (B) Gas Exposition von Flüssigkeiten zur Verdampfung führt. Die Höhe der Verdunstung pro Bohrloch in einer 96well-Platte nach Behandlung mit Plasma und Argon Gas allein wurde durch die Wägeplatte vor und nach der Behandlung mit einer feinen Skala bestimmt. Verdunstung in Plasmatreated Proben war höher, dass Argon Gastreated Proben verglichen. (C) Generierung von Wasserstoffperoxid in Plasmatreated Flüssigkeiten zu einem gewissen Grad mit dem 309 nm Höhepunkt der Hydroxyl-radikale in (A) korreliert. Feuchte (5 %) Argon-Plasma erhöht Peroxide Konzentrationen etwa 4fold. (D) Nitrit wurde erhöht, wenn Stickstoff, um das Fördergas hinzugefügt wurde, und dieser Effekt wurde mit befeuchteten Argon-Plasma erhöht. Die Zugabe von Sauerstoff reduziert Nitrit Generation jedoch nicht signifikant. (E, F) Wasserstoff-Peroxid und Nitrit-Konzentration zeigt sich in verschiedenen Arten von Flüssigkeiten, nämlich RPMI1640 Zellkulturmedium mit (R10F) und ohne (R0F) sowie PBS mit und ohne fetalen Kälberserum (FCS). Peroxide Ebenen unterscheiden nicht zwischen verschiedenen Medien (E) während Nitrit Ebenen in Anwesenheit des Serums deutlich zurückgegangen waren. (G) Superoxid Produktion war am höchsten für trockene Argon-Gas Gas; Futtermittel Beimischung von Stickstoff, Sauerstoff oder befeuchtete Argon gab untere Superoxid-Ablagerung in der Flüssigkeit. Daten (B-G) sind die Mittel + SEM von zwei bis drei Experimenten. Statistische Analyse wurde durchgeführt (C, D) Verwendung von Einweg Varianzanalyse vergleicht man ganze Gruppen Mittel des trockenen oder feuchten Fördergas Bedingungen gegen das jeweilige Steuerelement (** p < 0,01; *** p < 0,001). Darüber hinaus wurden Argon Gas nur Plasma Bedingungen verglichen mit ganze Gruppe bedeuten und der t-Test (### p < 0,001). Weitere statistische Analyse (F) erfolgte mittels t-Test vergleicht man die Werte der einzelnen Plasmabehandlung und mittlerer Zustand in den Proben mit FCS und ohne FCS (* p < 0,05; ** p < 0,01); auch FCS oder nicht-FCS enthaltenden Lösungen innerhalb jedes Plasma Behandlungszeit mit dem t-Test verglichen wurden (# p < 0,05; ## p < 0,001). Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 4 : Plasmabehandlung und ihre Auswirkungen auf Zellen. (A) Zellen wurden Plasma ausgesetzt und Resazurin wurde hinzugefügt, nach 20 h Stoffwechselaktivität zu beurteilen. (B) Tätigkeit war in Plasmatreated Proben im Vergleich zu Gas Kontrollen signifikant verringert. Eine deutliche Abnahme wurde mit Befeuchtung das Fördergas gesehen, während Zusatz von Sauerstoff oder Stickstoff zu Toxizität in beide trocken und feucht Argon Gasbedingungen führt. (C) Propidium Jodid (PI)-haltigem Medium wurde hinzugefügt. (D) eine Übersicht zeigt der Brunnen der Platte mit digitalen Phasenkontrast (orange) repräsentieren die cytosolische Fraktion jeder Zelle und PI (grün), abgestorbene Zellen zu identifizieren. Imaging-Tools erlaubt die Quantifizierung der Gesamtfläche im Sichtfeld jedes gut mit Zellen bedeckt. (F) Zellen wurden anschließend gewaschen und mit Antikörper oder andere Zellenmarkierungen zur Charakterisierung der biologischen Plasmaeffekte mit Durchflusszytometrie inkubiert. (G) Gating Strategien waren beschäftigt und Markeranalyse wurde durchgeführt und zwischen Proben verglichen. Daten angezeigt (B, E, H) bezeichnen die Mittel + SEM aus je einem Vertreter der drei unabhängigen Experimenten. Maßstabsleiste = 200 µm (D). Statistischen Vergleich erfolgte mit zwei-Wege-Analyse von Abweichungen (B, H) vergleicht man, für jede Bedingung Gas jedes Plasmabehandlung auf seine jeweiligen Gassteuerung (* p < 0,05; ** p < 0,01; *** p < 0,001). Darüber hinaus die Werte für jede Bedingung der Stickstoff oder Sauerstoff Zusatzmittel wurden im Vergleich zu Werten von Argon Gasplasma für trockene und Feuchte Bedingungen getrennt (zwei-Wege-Analyse von Abweichungen; ### p < 0,001). Bitte klicken Sie hier für eine größere Version dieser Figur.
Discussion
Grundlagenforschung ist von grundlegender Bedeutung für die Entwicklung eines Verständnisses der Wirksamkeit und Mechanismen zugrunde liegenden Plasmamedizin in präklinischen und klinischen Forschung. Grundlagenforschung fördert auch die Untersuchung von neuen Anwendungen für Behandlungen. Während nun feststeht, dass Plasmen ihre biologischen Wirkungen über Erzeugung von reaktivem Sauerstoff und Stickstoff Arten19vermitteln, gibt es noch drei große Herausforderungen auf dem Gebiet. Erstens sind die Arten wichtig? Dies kann teilweise durch Modulation Fördergas Zusammensetzung von Plasmen mit optischen Diagnostik und biologische anzeigen beantwortet werden. 20 Zweitens welche Auswirkungen kann in biologischen Zielen wie Zellen gesehen werden? Dies ist, zumindest teilweise, adressiert Zellexperimente Kultur und eine Reihe von Tests. In eukaryotischen Zellen Effekte sind pleiotrope einschließlich Zellzyklus Festnahme21, Apoptose22, Nekrose23, und Haut Zelle Anregung24,25,26, sowie eine Unterstützung oder Abnahme der Zelle Motilität oder metabolische Aktivität27,28,29. Die dritte Herausforderung in Bezug auf diese pleiotrope Effekte, soll Schlüsselmoleküle zu identifizieren, die die zelluläre Reaktion auf Plasma-abgeleitete Oxidantien zu erklären, verschiedene Effekte, die oft in verschiedenen Zelltypen gesehen bestimmen. Kann dies durch Omics Techniken30,31,32 und/oder oben oder Herabregulation der Zielgene mit SiRNA (Redox) Signalisierung Inhibitoren, Antioxidantien sowie antioxidative Enzyme und Modulation der der Plasma des reaktiven Spezies Ausgabe. 33 , 34 , 35 daher sind optimierte Assay Protokolle erforderlich, größere Sample-Sets mit einer großen Anzahl von Iterationen zu testen.
Diese Studie ist ein Beispiel für einen effizienten experimentelle Workflow, von der Physik, Biologie, für Plasma medizinische Forschung im Hinblick auf die genannten Herausforderungen. Informationen zu den technischen Aspekten der Plasmaquelle und Plasmaerzeugung wurden vor beschrieben. 36 , 37 , 38 alle diese Tests werden durchgeführt in 96well Platten, die eine Reihe von Vorteilen hat. Zum Beispiel können Proben wie Zelle Kultur Überstände problemlos vom Assay zur Sammlung Platten zu untersuchen, zum Beispiel Proteinkonzentrationen durch Enzym-verbunden-Immunosorbentprobe-Assay durchgeführt werden. Wenn wissenschaftlicher Ausrüstung in der Lage, des Lesens direkt aus 96-Brunnen verfügbar ist, ein solches Vorgehen minimiert die Kosten pro Probe und Handsontime und maximiert die Ergebnisse durch multiplexing verschiedene Assays aus derselben Probe. Die Verwendung von Mehrkanal Pipetten zusätzlich beschleunigt Probenbehandlung. Im Prinzip kann der hier beschriebenen Test auch durchgeführt werden mit gut Plattenformate mit größeren Durchmessern gut, obwohl dies zusätzliche Pipettieren Schritte in andere Rohre und Behälter für nachgeschaltete Assays erfordern würde. Kleinere Teller-Typen wie 384well Platten, stellen jedoch die Geometrie geeignet für biomedizinische Plasmaforschung mit Düsen mit großen Fördergas Fluten. Insbesondere kann nicht garantiert werden, dass nur einzelne aber nicht neben Brunnen während einer Behandlung betroffen sind.
Flüssigkeitsanalyse unbedingt Arten Ablagerung durch das Plasma zu untersuchen. In Expertenanalysen kann eine parallele Setup der verschiedenen Assays Plasmatreated Flüssigkeiten in Bezug auf verschiedene Oxidantien zur gleichen Zeit charakterisieren. Das Multiplexen ermöglicht ein differenziertes Bild der Plasmaderived Arten zu entwickeln. Die beschriebene Vorgehensweise ist hochsensibel, Wasserstoff-Peroxid Konzentrationen39, zu untersuchen, das ist oft notwendig, aber nicht immer ausreichend Plasmaeffekte erklären. 40 , 41 , 42 biologisch relevante Effekte können auch in Flüssigkeiten mit einem Glutathion-Assay nicht enthalten hier bewertet werden. 43 der spezifischen Nitrit Test wird über konventionelle Griess-Assays aufgrund 10fold höhere Empfindlichkeit Assay (Daten nicht gezeigt) dringend empfohlen. Plasmatreated Flüssigkeiten können auch für die Bildung von hypochlorige Säure mit DTNB-Assay untersucht werden. Doch bisherige Ergebnisse keinen Hinweis auf die Bildung dieser Art mit unserer Plasmaquelle. 19 , 39 , 44 nach Plasmabehandlung beendet hat, findet Arten Verschlechterung im Laufe der Zeit. Nitrit reagiert auf Nitrat; Wasserstoffperoxid wird auch im Laufe der Zeit verbraucht. Diese Prozesse werden jedoch mehrere Stunden dauern. 35 Cytochrom C Absorption ist über mehrere Stunden als auch stabil. Daher, wenn Prozesse innerhalb der ersten 30 min nach der Behandlung auftreten, Variation in Konzentrationen von langlebigen Arten, die hier beschrieben sind vernachlässigbar. Allerdings muss darauf geachtet werden bei der Untersuchung bestimmter Arten von Medien (z. B.Dulbeccos geändert Eagle Medium) als Zutaten bis zu 90 % Peroxid innerhalb von 1 h (Daten nicht gezeigt) Aufräumen kann führt zu einer Unterschätzung der Plasma Peroxid Ablagerung in Flüssigkeiten.
Eine Multiplex-Assays präsentiert reicht von der Untersuchung Stoffwechselaktivität über Zellbereich (Morphologie) Zelle Oberfläche Marker Ausdruck. Eine Kombination aus diesen Tests kann interessante Ergebnisse zeigen. Zum Beispiel haben wir zuvor in THP1 Monozyten gezeigt, dass metabolische Aktivität und Zelle zählt nicht in einer linearen Weise nach Exposition gegenüber Plasma sinken. 45 Rather, mit zunehmender Dauer der Plasma-Behandlung, wurden Zellen beobachtet, die vergrößert wurden und hatte eine höhere mitochondriale Masse, wodurch höhere Stoffwechselrate auf Percell Basis. Die Kombination von multiplate Leser, Mikroskopie und Durchflusszytometrie Multiplexe im wesentlichen Informationen über zelluläre Reaktionen nach Plasmabehandlung. In Melanomzellen konzentrieren wir uns hier auf zytotoxische Effekte und ihre Immunogenität von Calreticulin vermittelt. 46 im Prinzip können viele andere Fragen mit diesem Ansatz verbindet Stoffwechselaktivität mit Bildgebung und Flow Cytometry Ergebnissen richten. Zum Beispiel kann Zelldifferenzierung (z. B. Makrophagen Polarisation), Mitochondrien-Membran Potenzial, Zellzyklus-Analyse, Zelle Motilität, Biomechanik oder Micronucleus-Bildung für die Analyse der Genotoxizität auch untersucht werden Plasma-behandelten Zellen. Multicolor Durchflusszytometrie ermöglicht noch mehr Anwendungen in unterschiedlichen Zellpopulationen zur gleichen Zeit. Dazu gehören zum Beispiel die Analyse von den Status der Phosphorylierung von Signalproteinen wie Transkriptionsfaktoren, mRNA Quantifizierung, Messung der intrazellulären Zytokinen und/oder Bewertung von insgesamt reduzierten Thiole auf eine einzelne Zelle. Biologisch relevante Zusatzinformationen, die für jede Probe ist hilft bei der Weiterentwicklung von das Bild der Redox Plasmaeffekte, aktuellen und zukünftigen Plasmaanwendungen besser zu verstehen.
Disclosures
Die Autoren haben nichts preisgeben.
Acknowledgments
Finanzierung durch das Bundesministerium für Bildung und Forschung (BMBF Zuschuss Zahlen 03Z22DN11 und 03Z22DN12) ist dankbar anerkannt.
Materials
| Name | Company | Catalog Number | Comments |
| accutase | BioLegend | 423201 | |
| amplex Ultra Red detection kit (includes horse-radish peroxidase and H2O2) | Thermo | A36006 | |
| argon gas | Air Liquide | N50 | |
| B16F10 murine melanoma cells | ATCC | CRL-6475 | |
| catalase | Sigma | C30 | |
| cell culture incubator | Binder | CB210 | |
| cell culture plastic | NUNC | 156545 | |
| cytochrome c, oxidized | Sigma | C2037 | |
| data analysis | GraphPad software | prism 7.03 | |
| fetal bovine serum | Sigma | batch-tested | |
| fine scale | any with resolution of 0.01mg | ||
| flow cytometer | Beckman-Coulter | CytoFlex S | |
| flow cytometry data analysis | Beckman-Coulter | Kaluza 1.5a | |
| Glutamine | Sigma | G7513 | |
| imaging quantification software | PerkinElmer | Harmony 4.5 | |
| laminar flow hood | Thermo | Maxisafe 2020 | |
| mass flow controller | MKS | G-series | |
| Measure-iT nitrite detection kit | Thermo | M36051 | |
| microscope | PerkinElmer | Operetta CLS | |
| optical emssion spectroscopy | Avantes | AvaSpec-DDDD-2-USB2 | |
| penicilin/streptomycin | Thermo | 15140122 | |
| pipettes | Eppendorf/Brand | single/multi chanel | |
| plate reader | Tecan | M200pro | |
| propidium iodide | BioLegend | 421301 | |
| resazurin | VWR | B21187.06 | |
| RPMI1640 cell culture media | PanbioTech | P04-16500 | |
| xyz table | CNC step | HIGH-Z S-400/T |
References
- Sen, C. K. The general case for redox control of wound repair. Wound Repair Regen. 11 (6), 431-438 (2003).
- Acharya, A., Das, I., Chandhok, D., Saha, T. Redox regulation in cancer: a double-edged sword with therapeutic potential. Oxid Med Cell Longev. 3 (1), 23-34 (2010).
- Sen, C. K. Wound healing essentials: let there be oxygen. Wound Repair Regen. 17 (1), 1-18 (2009).
- Cui, X. Reactive oxygen species: the achilles' heel of cancer cells. Antioxid Redox Signal. 16 (11), 1212-1214 (2012).
- Graves, D. B. The emerging role of reactive oxygen and nitrogen species in redox biology and some implications for plasma applications to medicine and biology. Journal of Physics D-Applied Physics. 45 (26), 263001 (2012).
- Weltmann, K. D., et al. Atmospheric-pressure plasma sources: Prospective tools for plasma medicine. Pure Appl Chem. 82 (6), 1223-1237 (2010).
- Bekeschus, S., Schmidt, A., Weltmann, K. -D., von Woedtke, T. The plasma jet kINPen - A powerful tool for wound healing. Clinical Plasma Medicine. 4 (1), 19-28 (2016).
- Wende, K., et al. Risk assessment of a cold argon plasma jet in respect to its mutagenicity. Mutat Res Genet Toxicol Environ Mutagen. 798-799, 48-54 (2016).
- Kluge, S., et al. Investigating the Mutagenicity of a Cold Argon-Plasma Jet in an HET-MN Model. PLoS One. 11 (9), 0160667 (2016).
- Schmidt, A., et al. One Year Follow-Up Risk Assessment in SKH-1 Mice and Wounds Treated with an Argon Plasma Jet. Int J Mol Sci. 18 (4), 868 (2017).
- Hanschmann, E. M., Godoy, J. R., Berndt, C., Hudemann, C., Lillig, C. H. Thioredoxins, glutaredoxins, and peroxiredoxins--molecular mechanisms and health significance: from cofactors to antioxidants to redox signaling. Antioxid Redox Signal. 19 (13), 1539-1605 (2013).
- Weltmann, K. D., von Woedtke, T. Plasma medicine-current state of research and medical application. Plasma Phys Controlled Fusion. 59 (1), 014031 (2017).
- Metelmann, H. R., et al. Experimental Recovery of CO2-Laser Skin Lesions by Plasma Stimulation. Am J Cosmet Surg. 29 (1), 52-56 (2012).
- Brehmer, F., et al. Alleviation of chronic venous leg ulcers with a hand-held dielectric barrier discharge plasma generator (PlasmaDerm((R)) VU-2010): results of a monocentric, two-armed, open, prospective, randomized and controlled trial (NCT01415622). J Eur Acad Dermatol Venereol. 29 (1), 148-155 (2015).
- Isbary, G., et al. Successful and safe use of 2 min cold atmospheric argon plasma in chronic wounds: results of a randomized controlled trial. Br J Dermatol. 167 (2), 404-410 (2012).
- Brulle, L., et al. Effects of a non thermal plasma treatment alone or in combination with gemcitabine in a MIA PaCa2-luc orthotopic pancreatic carcinoma model. PLoS One. 7 (12), 52653 (2012).
- Mirpour, S., et al. Utilizing the micron sized non-thermal atmospheric pressure plasma inside the animal body for the tumor treatment application. Sci Rep. 6, 29048 (2016).
- Utsumi, F., et al. Effect of indirect nonequilibrium atmospheric pressure plasma on anti-proliferative activity against chronic chemo-resistant ovarian cancer cells in vitro and in vivo. PLoS One. 8 (12), 81576 (2013).
- Jablonowski, H., von Woedtke, T. H. Research on plasma medicine-relevant plasma-liquid interaction: What happened in the past five years. Clinical Plasma Medicine. 3 (2), 42-52 (2015).
- Reuter, S., et al. From RONS to ROS: Tailoring Plasma Jet Treatment of Skin Cells. Ieee Transactions on Plasma Science. 40 (11), 2986-2993 (2012).
- Gherardi, M., et al. Atmospheric Non-Equilibrium Plasma Promotes Cell Death and Cell-Cycle Arrest in a Lymphoma Cell Line. Plasma Processes and Polymers. 12 (12), 1354-1363 (2015).
- Bundscherer, L., et al. Viability of human blood leucocytes compared with their respective cell lines after plasma treatment. Plasma Medicine. 3 (1-2), 71-80 (2013).
- Hirst, A. M., et al. Low-temperature plasma treatment induces DNA damage leading to necrotic cell death in primary prostate epithelial cells. Br J Cancer. 112 (9), 1536-1545 (2015).
- Arndt, S., et al. Effects of cold atmospheric plasma (CAP) on ss-defensins, inflammatory cytokines, and apoptosis-related molecules in keratinocytes in vitro and in vivo. PLoS One. 10 (3), 0120041 (2015).
- Korolov, I., Fazekas, B., Szell, M., Kemeny, L., Kutasi, K. The effect of the plasma needle on the human keratinocytes related to the wound healing process. Journal of Physics D-Applied Physics. 49 (3), 035401 (2016).
- Schmidt, A., von Woedtke, T., Bekeschus, S. Periodic Exposure of Keratinocytes to Cold Physical Plasma: An In Vitro Model for Redox-Related Diseases of the Skin. Oxid Med Cell Longev. 2016, Harmful and Beneficial Role of ROS (HBR) 9816072 (2016).
- Schmidt, A., Bekeschus, S., von Woedtke, T., Hasse, S. Cell migration and adhesion of a human melanoma cell line is decreased by cold plasma treatment. Clinical Plasma Medicine. 3 (1), 24-31 (2015).
- Kalghatgi, S., Friedman, G., Fridman, A., Clyne, A. M. Endothelial cell proliferation is enhanced by low dose non-thermal plasma through fibroblast growth factor-2 release. Ann Biomed Eng. 38 (3), 748-757 (2010).
- Schmidt, A., Bekeschus, S., Wende, K., Vollmar, B., von Woedtke, T. A cold plasma jet accelerates wound healing in a murine model of full-thickness skin wounds. Exp Dermatol. 26 (2), 156-162 (2017).
- Wende, K., et al. Proteomic Tools to Characterize Non-Thermal Plasma Effects in Eukaryotic Cells. Plasma Medicine. 3 (1-2), 81-95 (2013).
- Schmidt, A., et al. Redox-regulation of activator protein 1 family members in blood cancer cell lines exposed to cold physical plasma-treated medium. Plasma Processes and Polymers. 13 (12), 1179-1188 (2016).
- Landsberg, K., et al. Use of Proteomics to Investigate Plasma-Cell Interactions. Plasma Medicine. 1 (1), 55-63 (2011).
- Xu, D., et al. Intracellular ROS mediates gas plasma-facilitated cellular transfection in 2D and 3D cultures. Sci Rep. 6, 27872 (2016).
- Ishaq, M., et al. Atmospheric gas plasma-induced ROS production activates TNF-ASK1 pathway for the induction of melanoma cancer cell apoptosis. Mol Biol Cell. 25 (9), 1523-1531 (2014).
- Winter, J., et al. Tracking plasma generated H2O2 from gas into liquid phase and revealing its dominant impact on human skin cells. Journal of Physics D-Applied Physics. 47 (28), 285401 (2014).
- Dunnbier, M., et al. Ambient air particle transport into the effluent of a cold atmospheric-pressure argon plasma jet investigated by molecular beam mass spectrometry. Journal of Physics D-Applied Physics. 46 (43), 435203 (2013).
- Schmidt-Bleker, A., Bansemer, R., Reuter, S., Weltmann, K. -D. How to produce an NOx- instead of Ox-based chemistry with a cold atmospheric plasma jet. Plasma Processes and Polymers. 13 (11), 1120-1127 (2016).
- Weltmann, K. D., et al. Atmospheric Pressure Plasma Jet for Medical Therapy: Plasma Parameters and Risk Estimation. Contributions to Plasma Physics. 49 (9), 631-640 (2009).
- Bekeschus, S., et al. Hydrogen peroxide: A central player in physical plasma-induced oxidative stress in human blood cells. Free Radic Res. 48 (5), 542-549 (2014).
- Girard, P. M., et al. Synergistic Effect of H2O2 and NO2 in Cell Death Induced by Cold Atmospheric He Plasma. Sci Rep. 6, 29098 (2016).
- Bekeschus, S., et al. Neutrophil extracellular trap formation is elicited in response to cold physical plasma. J Leukoc Biol. 100 (4), 791-799 (2016).
- Girard, F., et al. Formation of reactive nitrogen species including peroxynitrite in physiological buffer exposed to cold atmospheric plasma. Rsc Advances. 6 (82), 78457-78467 (2016).
- Bekeschus, S., von Woedtke, T., Kramer, A., Weltmann, K. -D., Masur, K. Cold Physical Plasma Treatment Alters Redox Balance in Human Immune Cells. Plasma Medicine. 3 (4), 267-278 (2013).
- Wende, K., et al. Identification of the biologically active liquid chemistry induced by a nonthermal atmospheric pressure plasma jet. Biointerphases. 10 (2), 029518 (2015).
- Bekeschus, S., et al. Redox Stimulation of Human THP-1 Monocytes in Response to Cold Physical Plasma. Oxid Med Cell Longev. 2016, 5910695 (2016).
- Obeid, M., et al. Calreticulin exposure dictates the immunogenicity of cancer cell death. Nat Med. 13 (1), 54-61 (2007).



