Summary
Elektroimpedansspektroskopi (EIS) av arter som genomgår reversibel oxidation eller reduktion i lösning användes för bestämning av konstanter av oxidation eller reduktion.
Abstract
Elektroimpedansspektroskopi (EIS) användes för avancerad karakterisering av organiska elektroaktiva föreningar tillsammans med cyklisk voltametri (CV). När det gäller snabbt reversibel elektrokemiska processer påverkas nuvarande huvudsakligen av diffusionshastighet, som är det långsammaste och begränsande steget. EIS är en kraftfull teknik som möjliggör separat analys av arrangerar av kostnad överföring som har olika AC frekvensrespons. Förmågan att metoden användes för att extrahera värdet av kostnad överföring motstånd, som kännetecknar andelen avgift exchange på gränssnittet elektrod-lösning. Tillämpningen av denna teknik är brett, från biokemi upp till organisk elektronik. I detta arbete presenterar vi metoden för analys av organiska föreningar av optoelektroniska tillämpningar.
Introduction
Redox är elektroaktiva föreningen en viktig parameter som kännetecknar dess förmåga att genomgå oxidation eller reduktion processer och förutse dess beteende i närvaro av starka oxiderande eller reduktionsmedel eller enligt tillämpad potential. De flesta elektrokemiska metoder kan dock bara att kvalitativt beskriva kineticsen av redox processen. Bland olika elektrokemiska tekniker som används för redox aktiva föreningar, är karakterisering cyklisk voltametri (CV) den mest rådande metoden för snabb och tillräcklig elektrokemisk karaktärisering av olika lösliga arter1, 2,3. CV tekniken har breda program, t.ex., energinivåer anseende4,5,6, avgift bärare analysen stöds av spektroskopier7,8, 9 , 10, upp till ytmodifieringar11,12,13. Som varje metod, CV är inte perfekt och för att öka användbarheten och kvaliteten på resultaten, anslutningen med en annan spektroskopisk teknik är viktigt. Presenterar redan vi flera utredningar där elektrokemisk impedans spektroskopi (EIS) tekniken var sysselsatta14,15,16 , men i detta arbete, vi avsåg att visa steg för steg hur man förstärka CV tekniken av EIS.
EIS utsignalen består av två parametrar: reella och imaginära delar av impedans som funktion av frekvens17,18,19,20. Det ger uppskattning av flera parametrar som är ansvarig för kostnad överföring via gränssnittet elektrod-lösning: dubbla lager kapacitans, lösning motstånd, kostnad överföring motstånd, diffusion impedans och andra parametrar beroende på system undersökt. Kostnad överföring motståndet var ett objekt av hög uppmärksamhet eftersom denna parameter är direkt relaterad till de redox konstanten. Även om oxidation och reduktion hastighetskonstanterna beräknas i lösning, kan de allmänt karaktärisera förmågan hos en förening för laddning utbyte. EIS anses vara en avancerad elektrokemiska teknik som kräver djupgående matematiska förståelse. Dess huvudsakliga principer beskrivs i moderna elektrokemi litteratur17,18,19,20,21,22,23.
Protocol
1. grundläggande förberedelse av elektrokemiska Experiment
- Förbered 4 mL av en fungerande lösning innehållande 0,1 mol∙L−1 Bu4NBF4 och 0,001 mol∙L−1 undersökt organisk förening genom att lägga till beräknade mängder fast pulver till 4 mL diklormetan i ett litet kärl eller ett provrör. Med 2,8-bis(3,7-dibutyl-10H-phenoxazin-10-yl) dibenso [b, d] tiopen-S, S-koldioxid (Molmassa 802 g∙mol−1), väga 3.208 mg av denna förening och 0.1645 g Bu4NBF4.
- Fyll en 3 mL elektrokemisk cell med 2 mL lösning med pipett. Den återstående delen av lösningen kommer att behövas senare för impedans mätning och reproducera resultaten.
- Polska en skiva arbetselektroden för 1 mm diameter platina (WE) för 30 s med en putsduk fuktas av flera droppar av aluminiumoxid flytgödsel. Gnugga den plana ytan av skivan elektroden med en bit tyg monterad på en orörlig stöd (t.ex. petriskål) genom att tillämpa måttligt tryck.
- Skölj elektroden med destillerat vatten tre gånger att ta bort aluminiumoxid partiklar.
- Glödga en counter elektrod (CE, platina tråd) i en butan brännare flamma. Sätt försiktigt platina tråd i en flamma för mindre än 1 s och snabbt ta bort när det börjar rodnad Undvik smältning.
Obs: CE yta är inte fastställd men måste vara mycket högre än ytan av arbetselektroden. I det här fallet impedans av arbetande elektroden gränssnitt skulle ha större inverkan på totala systemets impedans och skulle tillåta undantag counter elektrod impedans från behandling.- Glödga en referenselektrod (RE, silvertråd) i butan brännare lågan på samma sätt.
- Sätt alla tre elektroder (arbetande, räknare och) i en cell att undvika ömsesidig kontakt och ansluta till motsvarande potentiostat kablar markerade som vi, CE och RE. Infoga en gas att leverera tube ansluten med argon gas flaska för ytterligare avluftning.
- Öppna gasventilen och avlufta lösningen av bubblande argon genom lösningen för 20 min. nära gasventilen före mätning.
2. preliminär karakterisering av cyklisk voltametri (CVA)
- Registrera CVA arbetslösning inom en potentiell spänner från −2.0 V till + 2,0 V och skanna hastighet 100 mV∙s−1.
- Starta programmet cyklisk voltametri i programvaran potentiostat.
- Välj 0,0 V som potentiella initialvärde, −2.0 V som minimal potential, + 2,0 V som maximal skanning potential, 100 mV∙s−1 som scanning hastighet. Övriga parametrar är valfria.
- Klicka på knappen Starta.
Observera: En typisk voltamogrammen presenteras i figur 1.
- Bestämma potentiella värdet från den CVA erhålls. Observera de potentiella värdena när maxima av positiv (anodisk topp) och negativa (katodiskt topp) ström visas och beräkna medelvärdet.
- Tillsätt 10 mg Ferrocen av spatel i arbetslösning och avlufta det av argon bubblande för 5 min. Detta är nödvändigt för att blanda och fullständig upplösning av Ferrocen läggs.
Obs: Ferrocen beloppet är inte exakt. Men skulle att lägga till mindre än 1 mg eller mer än 20 mg komplicera uppskattning av equilibriumen potentiella. - Registrera CVA arbetslösning inom potentiella spänna från −1.0 V till 1,0 V och skanna hastighet 100 mV∙s−1. En liten vändbar topp på Ferrocen visas som visas i figur 1.
- Avgöra det potentiella värdet av Ferrocen reversibel oxidation från den CVA erhålls. Observera de potentiella värdena när maxima av positiv (anodisk topp) och negativa (katodiskt topp) ström visas och beräkna medelvärdet.
- Sätta en annan del av den lösning som beretts vid steg 1,1 in i cellen och rengör elektroderna genom att upprepa proceduren som beskrivs i 1.2-1.7.
3. registrering av impedans spektrum
Obs: Ett exempel på inställningarna i programvara visas i figur 2. någon annan programvara eller enhet kan också användas. Setup arrangemanget kan dock variera i olika programvara, även om de viktigaste principerna är desamma. Använda EIS i en trappa-läge, dvs potentiostatic spectra registreras automatiskt efter varandra.
- I programvaran väljer du en potentiella rad 0,2 V som täcker den vändbara toppen i CVA. Exempel: En reversibel oxidation topp upptäcktes på CV på 0,7 V. Den potentiella omfånget för CV bör sedan från 0,6 V 0,8 V. Spektra blir registrerade hos tillväxten för 0,01 V, dvs på 0,61 V, 0,62 V, etc.
- Registrera det EIS automatiska mätning förfarandet under följande förhållanden rådde.
- Ange följande input värden: inledande potentiella 0,6 V; Avsluta eventuella 0,8 V. potentiell ökning: 0,01 V; Frekvensområde: från 10 kHz genom 100 Hz; Hur många frekvenser i logaritmisk skala: 20; vänta en stund mellan spektra: 5 s, ac spänning amplitud 10 mV, minimal 2 åtgärder per frekvens.
- Klicka på knappen Starta.
Obs: I så fall 21 spectra, vardera innehållande 41 frekvens poäng kommer att erhållas. Den typiska uppsättningen automatiskt registrerade spectra presenteras i figur 3.
4. analys av impedans spektrum
- Starta programmet EIS spektralanalysator.
- Ladda ner skalan genom att välja fil | Öppna.
- I fönstret övre högra sub konstruera en EEG genom att använda vänster/höger musklick för att välja serien eller parallell anslutning och nödvändigt inslag i den sammanhangsberoende menyn: C - kondensator, R - motstånd, W - Warburg element. Starta från den enklaste kretsen (bild 5c).
- Välj minimal och maximal startvärdena för parametrar av vänster-mus-Klicka tabellceller och mata in värden: C1 - 1∙10-7 till 1∙10-8, R1 - från 2000 till 100, R2 - från 1000 till 100, Aw - från 50000 till 10000.
- Passar modellen genom att välja modell | Passar. Upprepa proceduren flera gånger (vanligtvis ca 5 gånger) tills de beräknade värdena inte längre ändra. Parametervärden visas i en tabell i det övre vänstra sub-fönstret.
- Kontrollera parameterfel visas i den sista kolumnen i tabellen. Om ett fel av en parameter överskrider 100%, betyder att parametern inte är nödvändigt för en krets. I så fall prova en annan motsvarande krets.
Obs: Om man försöker passa en experimentell spektrum som motsvarar till den enkla kretsen (bild 5c) av en mer komplicerad krets (figur 5en), då fel av onödiga ytterligare parametrar W och R3 skulle vara betydligt hög. - Kontrollera värdena för r2(parametriska) och r2(amplitud) presenteras i det lägre rätt sub-fönstret. Om de överskrider gränsen 1∙10−2, upprepa de förfaranden 4.2−4.5 använder en annan motsvarande elektriska krets (EEG) (figur 5).
- Upprepa proceduren 4.1-4,7 för alla spektra registrerade
- För varje spektrum analyseras, skriv ner det beräknade värdet av kostnad överföring motstånd och motsvarande potential spektrumet var registrerade på.
5. beräkning av Redox konstanter
- Sätta värden av beräknad omvänd kostnad överföring motståndet kontra potential. En typisk potentiella tomt på omvänd kostnad överföring motstånd för reversibel processen presenteras i figur 6.
- Öppna ett tomt ark av kalkylprogram.
- Manuellt ange värdena för potentialer och motsvarande värden för omvänd överföring motstånd i kolumnerna A och B.
- Markera området A1:B21 och välja Infoga | Diagram | Pekade av musen för att klicka i menyn aktivitet.
- Pricka in värdena i en teoretiskt fungera som beräknas av formeln (1) på samma tomt. Använd konstanta värden: F = 96485 C∙mol−1, c0 = 0.01 mol∙−1, z = 1, R = 8.314 J∙mol−1∙K−1, α = 0,5, T - omgivningstemperatur. Använd tidigare uppskattade värdet (3.1) E0.
 (1)
(1) (2)
(2)
där Rct−1 är inverterade värdet av kostnad överföring motstånd normaliserade yta; z- antal elektroner överförs i ett steg (accepteras lika 1); F- Faradays konstant; c 0- koncentration av undersökta förening; Α - kostnad överföring koefficienten (accepterat att vara lika 0,5); E- elektrod potential. parametern θ infördes för att förenkla den slutliga formeln avseende E och Rct.- Kopiera den första kolumnen i värden (potentiella värden) i samma blad i kolumn D.
- Ange de konstanta värdena av F, c0, z, R, α, T, E0, k0 värvning ovan i cellerna C1:C8. Använda värden E0 = 0, k0 = 1∙10−5.
- Ange formel (2) för att beräkna θ i cell E1: = EXP($C$1*$C$3/($C$4*$C$6)*(D1-$C$7)).
- Kopiera formeln till cellerna E2:E21 genom att välja E1, Kopiera, att välja olika E2:E21 och klicka på Klistra in.
- Ange formel (1) i cell F1: = $C$8*$C$1^2*$C$3^2/($C$4*$C$6)*$C$2*E1^(1-$C$5)/(1+E1).
- Kopiera formeln till cellerna F2:F21 genom att välja F1, Kopiera, att välja olika F2:F21 och klicka på Klistra in.
- Vänster klicka på grafen byggt på steg 5.1, Välj Välj data, sedan Lägg till och lägger till ny uppsättning data genom att ange D1:D21 som x sortiment och F1:F21 som y intervall.
Obs: Två grafer: experimentella och simulerade automatiskt markeras med olika färger visas på en samordna tomt.
- Optimera funktionen teoretiska (1) för att fir experimentella data av varierande värden för jämvikt potentiella (E0) och normalskattesatsen konstant (k0), att vara parametern target.
Obs: Ändra värden i celler C7 (E0) och C8 (k0) skulle omedelbart orsaka förändring av simulerade grafen.- Ändra värdena i cell C7 och C8 manuellt för att uppnå jämställdhet mellan experimentell och simulerade graf.
Obs: Ändra E0 flyttar kortstjälkade kurvan längs x -axeln. Förändring av k0 styr höjden av bell-liknande kurvan. Således kan variera dessa två enda parametrar användas för att hitta en teoretisk modell som motsvarar experimentella resultat (figur 6). Parametern α (1) kontroller symmetri av teoretiska topp. Emellertid i verkliga system kan asymmetri orsakas av förekomsten av sida-processen snarare än av α. Eftersom det påverkar k0 resultatvärdet rekommenderar vi inte att manipulera α värde och lämna den så att det motsvarar 0,5.
- Ändra värdena i cell C7 och C8 manuellt för att uppnå jämställdhet mellan experimentell och simulerade graf.
Representative Results
Det första steget är cyklisk voltametri karakterisering presenteras i figur 1. Tillämpningen av EIS var framgångsrika när föreningar genomgick den snabbt reversibel elektrokemisk processen. Sådant beteende observerades ofta inte för organiska föreningar men organiska föreningar som har electroconductivity i ett fast tillstånd befanns vara ett bra exemplar för elektrokemisk kinetiska utredning. En sådan organisk förening visas i infällt i figur 1.
Registrering av impedans spectra genomfördes enligt experimentella inställningarna (figur 2), och typiska raw resulterande data visas i figur 3. Analys av impedans spectra genomfördes med hjälp av särskild programvara24. Fönstret öppna programmet EIS spektrum analysator24 under resultat bearbetning visas i figur 4. En EEG som brukade passa spektrumet byggs manuellt i det övre högra sub-fönstret. De beräkna EEG parametrarna (motstånd R1 och R2, kapacitans C1 och diffusion impedans parametern W1) visas i en tabell i det vänstra övre sub-fönstret. Diagrammet i nedre vänster sub-fönster visar montering av experimentella resultat (röda punkter) med teoretiskt beräknade data tomten (gröna linjen).
Flera olika EEG kan passa experimentella spektrum beroende på de processer som äger rum på elektrod ytan och deras priser (figur 5). Det enklaste halv-oändliga Warburg elementet kan användas som ingen snedvridning lösning (t.ex. rotera av elektroden blandning) och ingen elektrod beläggning att begränsa spridningen. Vid avsevärt snabbt elektrokemiska reaktioner, motståndet R3 (figur 5A) var tillräckligt hög för att försummas jämfört med andra parallella grenar av EEG (figur 5B). Dessutom när kostnad överföring (R2) är betydligt högre än diffusion, kostnad överföring steget blir att begränsa och en ännu enklare EEG (bild 5C) beskriver systemet.
Serie resistorn R1 är alltid närvarande i EEG. Det motsvarar till det yttre motståndet inklusive kopplingar och lösning, utom elektrod-surface gränssnittet. Kondensatorn C1 karakteriserar ett dubbelt lager bildas på gränssnittet elektrod. Grenen inklusive motstånd och Warburg element diffusion impedans (figur 5A) motsvarar med en snabb elektrokemisk process inklusive två stadier: kinetic och diffusion, respektive. Det tredje motståndet motsvarar en långsammare elektrokemisk process som äger rum på elektrod ytan och innebär lösningsmedel eller molekyler som har genomgått snabb oxidation eller reduktion. I vissa fall var parametrar, R3 och W1 omöjligt att uppskatta. Sedan kan de vara ansedd som frånvarande och inte beaktas som figur 5B och 5 C -show.
Även om EIS ger en uppskattning av flera parametrar, är målelementet som anses i detta arbete kostnad överföring motståndet R2 vanligtvis tilldelas som Rct i litteratur17,18,19, som står i parallell till kondensatorn och i serien till Warburg element. Sitt beroende av spänning visas i figur 6.
Enligt teorin av elektrokemiska kinetik (Protocol, steg 5.2) är kostnad överföring motstånd direkt relaterad till elektrokemiska normalskattesatsen konstant. Trots att matchningen mellan experimentell och teoretisk resultat var inte perfekt, det får uppskattning av värdet på konstanten elektrokemiska normalskattesatsen och definierade värdet av equilibriumen potentiella av maxläge.
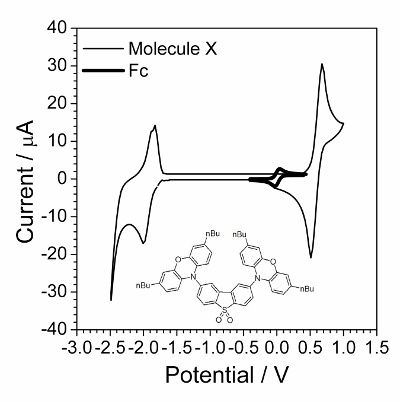
Figur 1 : Cykliska voltamogrammen av undersökta förening överlappas av cykliska voltamogrammen i närvaro av liten mängd Ferrocen. Lösning: 1,0 mol∙L−1 Bu4NBF4 och 0,01 mol∙L−1 X i diklormetan. Struktur av sammansatta X (2,8-bis(3,7-dibutyl-10H-phenoxazin-10-yl) dibenso [b, d] tiopen-S, S-koldioxid) visas i infällt. Klicka här för att se en större version av denna siffra.

Figur 2 : Experimentell setup styra registrering av 20 spektra inom intervallet spänning från 0,6 till 0,8 V i frekvensområdet 10 kHz till 100 Hz med 20 poäng för varje decennium. Ejag, Ef- inledande och avslutande potentialer respektive N - antal steg, ts- väntetid före varje mätning, dt - rekord tidsintervall, fjag, ff- inledande och avslutande frekvens, ND- antal frekvens punkter i ett spektrum, Ven- ac amplitud, pw - del av tid när det gäller en punkt registrering används för att växla till en annan frekvens, Nen- antal mätningar på en frekvens, E utbud, jag spänner, bandbredd - tekniska parametrar. Klicka här för att se en större version av denna siffra.

Figur 3 : Skanna skärmen under impedans spectra registrering. Övre höger sub-fönster: trappa beroendet av elektrod potential på tid. Övre vänster sub-fönster: Nyquist tomten, imaginära impedans (ordinate), riktiga impedans (abciss). Nedre vänster sub-fönster: Bode tomt, impedans modul (vänster skala), fasförskjutning (höger skala), frekvens (horisontell skala). Klicka här för att se en större version av denna siffra.

Figur 4 : «EIS spektrumanalysator» programfönstret under resultat bearbetning. Övre vänster sub-fönster: parameter värden tabell: C1 - kapacitans, R1, R2 - motstånd, W1 - Warburg element; nedre vänster sub-fönster: experimental (gröna punkter) och teoretisk modell (röda linjen) spektra; övre höger sub-fönster: motsvarande elektriska krets; nedre höger sub-fönster: beräknat statistik för montering. Klicka här för att se en större version av denna siffra.

Figur 5 : Motsvarande elektriska kretsar funnit för att passa impedans spektra av redox processer på elektrod ytan. (A) - vändbar elektrokemisk process åtföljas av parallella oåterkalleliga process, (B) - vändbar elektrokemisk process, (C) - elektrokemisk process med kinetic begränsning scenen. Klicka här för att se en större version av denna siffra.

Figur 6 : Inverterade värden kostnadsfritt överföra resistens beräknad från EIS kontra elektrod potential. Linjen illustrerar teoretiskt förväntade beroende enligt formel (2).
Discussion
Denna del av arbetet kommer att ägnas åt en förklaring valt experimentella betingelser och diskussion av möjliga tillämpningar av metoden presenteras.
Analys av impedans spektrum kan utföras av olika program. Här diskuteras de grundläggande rekommendationerna för EEG-analys-metod. Man behöver veta att det finns många montering algoritmer och olika sätt att fel uppskattning. Vi presenterar ett exempel med öppen access-programmet utvecklats av A. Bondarenko och G. Ragoisha24 (figur 4).
Exakt uppskattning av Rct -värde var huvudsyftet med arbetet. En av anledningarna till valet av de experimentella förhållandena var en avsikt att dölja effekterna av diffusion. Således hade lösning koncentrationen vara så hög som möjligt. Samtidigt förvärva experimentella resultat visas här, var koncentrationen begränsad på grund av ekonomiska skäl. Frekvensområdet 10 kHz till 100 Hz valdes för att eliminera effekten av diffusion samt. Diffusion impedans är omvänt proportionell mot frekvensen medan motstånd inte är beroende av frekvensen. Effekten av motstånd i den högfrekventa delen av spektrumet var högre än i den lågfrekventa delen. Spectra registrerades inte på frekvenser lägre än 100 Hz eftersom dessa data skulle vara värdelös för motstånd beräkning. Alla elektrokemiska resultaten i vattenbaserade lösningsmedel presenteras kontra Ferrocen-oxiderat / Ferrocen tillsammans jämvikt potentiella. Av denna anledning utförs steg 2.3-2.5.
Vi ansåg EIS för att organiska molekyler karakterisering. Analys av andra EEG-parametrar och deras potentiella beroenden i perspektiv kan leda till uppenbarelsen av andra effekter och elektrokemisk karaktärisering av föreningar i lösning. Uppskattning av redox konstanter är användbar för att beskriva kineticsen av minskning av elektroaktiva föreningar eller oxidation och förutsäga material beteende i oxiderande eller minska medium.
Disclosures
Författarna har något att avslöja.
Acknowledgments
Författarna tacksamt erkänna finansiellt stöd till ”Excilight” projekt ”givare-Acceptor Light Emitting Exciplexes som material för lätt-till-skräddare ultraeffektiv OLED Lightning” (H2020-behöriga myndigheters-ITN-2015/674990) finansieras av Marie Skłodowska-Curie Åtgärder inom ramprogrammet för forskning och innovationer ”Horisont 2020”.
Materials
| Name | Company | Catalog Number | Comments |
| Potentiostat | BioLogic | SP-150 | |
| Platinum disc electrode | eDAQ | ET075 | 1 mm diameter |
| Platinum wire | − | − | counter electrode |
| Silver wire | − | − | silver electrode |
| Electrochemical cell | eDAQ | ET080 | 3 mL volume |
| Polishing cloth | eDAQ | ET030 | |
| Alumina slurry | eDAQ | ET033 | 0.05 µm |
| Butane torch | Portasol | Mini-Torch/Heat Gun | |
| Dichloromethane (DCM) | Sigma-Aldrich | 106048 | |
| Tetrabutylammonium tetrafluoroborate (Bu4NBF4) | Sigma-Aldrich | 86896 |
References
- Cunningham, A. J., Underwood, A. L. Cyclic Voltammetry of the Pyridine Nucleotides and a Series of Nicotinamide Model Compounds. Biochemistry. 6, 266-271 (1967).
- Laba, K., et al. Diquinoline derivatives as materials for potential optoelectronic applications. J Phys Chem C. 119, 13129-13137 (2015).
- Data, P., Lapkowski, M., Motyka, M., Suwinski, J. Electrochemistry and spectroelectrochemistry of a novel selenophene-based monomer. Electrochim Acta. 59, 567-572 (2012).
- Laba, K., et al. Electrochemically induced synthesis of poly(2,6-carbazole). Macromol Rapid Commun. 36, 1749-1755 (2015).
- Data, P., Lapkowski, M., Motyka, M., Suwinski, J. Influence of alkyl chain on electrochemical and spectroscopic properties of polyselenophenes. Electrochim Acta. 87, 438-449 (2013).
- Data, P., Lapkowski, M., Motyka, M., Suwinski, J. Influence of heteroaryl group on electrochemical and spectroscopic properties of conjugated polymers. Electrochim Acta. 83, 271-282 (2012).
- Gora, M., et al. EPR and UV-vis spectroelectrochemical studies of diketopyrrolopyrroles disubstituted with alkylated thiophenes. Synth Met. 216, 75-82 (2016).
- Pluczyk, S., Zassowski, P., Quinton, C., Audebert, P., Alain-Rizzo, V., Lapkowski, M. Unusual Electrochemical Properties of the Electropolymerized Thin Layer Based on a s-Tetrazine-Triphenylamine Monomer. J Phys Chem C. 120, 4382-4391 (2016).
- Data, P., Motyka, M., Lapkowski, M., Suwinski, J., Monkman, A. Spectroelectrochemical Analysis of Charge Carries as a Way of Improving Poly(p-phenylene) Based Electrochromic Windows. J Phys Chem C. 119, 20188-20200 (2015).
- Enengl, S., et al. Spectroscopic characterization of charge carriers of the organic semiconductor quinacridone compared with pentacene during redox reactions. J Mater Chem C. 4, 10265-10278 (2016).
- Piwowar, K., Blacha-Grzechnik, A., Turczyn, R., Zak, J. Electropolymerized phenothiazines for the photochemical generation of singlet oxygen. Electrochim Acta. 141, 182-188 (2014).
- Blacha-Grzechnik, A., Turczyn, R., Burek, M., Zak, J. In situ Raman spectroscopic studies on potential-induced structural changes in polyaniline thin films synthesized via surface-initiated electropolymerization on covalently modified gold surface. Vib Spectrosc. 71, 30-36 (2014).
- Blacha-Grzechnik, A., et al. Phenothiazines grafted on the electrode surface from diazonium salts as molecular layers for photochemical generation of singlet oxygen. Electrochim Acta. 182, 1085-1092 (2015).
- Data, P., et al. Evidence for Solid State Electrochemical Degradation Within a Small Molecule OLED. Electrochim Acta. 184, 86-93 (2015).
- Data, P., et al. Electrochemically Induced Synthesis of Triphenylamine-based Polyhydrazones. Electrochim Acta. 230, 10-21 (2017).
- Data, P., et al. Kesterite Inorganic-Organic Heterojunction for Solution Processable Solar Cells. Electrochim Acta. 201, 78-85 (2016).
- Barsoukov, E., Macdonald, J. R. Impedance Spectroscopy: Theory, Experiment, and Applications. , Wiley. (2005).
- Orazem, M. E., Tribollet, B. Electrochemical Impedance Spectroscopy. , Wiley. (2008).
- Lasia, A. Electrochemical Impedance Spectroscopy and its Applications. , Springer. (2014).
- Bard, A. J., Faulkner, L. R. Electrochemical Methods: Fundamentals and Applications. , Wiley. (2013).
- Scholz, F. Electroanalytical methods: Guide to Experiment and Application. , Springer. (2010).
- Conway, B. E., Bockris, J. O. 'M., White, R. E. Modern Aspects of Electrochemistry. 32, Kluwer Academic Publishers. (2002).
- Encyclopedia of Electrochemistry: V. 3. Instrumentation and Electroanalytical Chemistry. Bard, A. J., Starttman, M., Unwin, P. R. , Wiley. (2003).
- EIS spectrum analyser software. , Available from: http://www.abc.chemistry.bsu.by/vi/analyser (2017).



 (1)
(1) (2)
(2)