Summary
Elektrokemiske impedans spektroskopi (EIS) af arter, der undergår reversible oxidation eller reduktion af løsning blev anvendt til bestemmelse af sats konstanter af oxidation eller reduktion.
Abstract
Elektrokemiske impedans spektroskopi (EIS) blev brugt til avancerede karakterisering af organiske electroactive forbindelser sammen med cyklisk voltammetry (CV). For hurtig reversible elektrokemiske processer påvirket nuværende overvejende af satsen for diffusion, som er den langsomste og begrænsende fase. EIS er en kraftfuld teknik, der tillader særskilt analyse af stadier af gratis overførsel, som har forskellige AC frekvenskarakteristik. Kapacitet af metoden blev brugt til at udvinde værdi af afgift overførsel modstand, der præger satsen for opladning udveksling på grænsefladen elektrode-løsning. Anvendelsen af denne teknik er bred, fra biokemi op til økologisk elektronik. I dette arbejde præsenterer vi metoden til analyse af organiske forbindelser af optoelektroniske applikationer.
Introduction
Redox er electroactive sammensatte en vigtig parameter, der kendetegner dens evne til at undergå oxidation eller reduktion af processer og forudsige funktionsmåden i overværelse af stærkt oxiderende eller reduktionsmiddel eller under anvendte potentiale. De fleste af de elektrokemiske teknikker er dog kun kunnet kvalitativt beskrive kinetik af redox-processen. Blandt forskellige elektrokemiske teknikker anvendes for redox aktive forbindelser, er karakterisering cyklisk voltammetry (CV) den mest fremherskende metode til hurtig og tilstrækkelig elektrokemiske karakterisering af forskellige opløselige arter1, 2,3. CV teknik har bredt programmer, f.eks., energi niveauer skøn4,5,6, afgift luftfartsselskaber analyse understøttes af spectroscopies7,8, 9 , 10, op til overfladen ændringer11,12,13. Ligesom hver metode, CV er ikke perfekt og for at øge anvendelsen og kvaliteten af resultaterne, i forbindelse med en anden spektroskopisk teknik er vigtigt. Vi præsentere allerede flere undersøgelser hvor elektrokemiske impedans spektroskopi (EIS) teknik var ansat14,15,16 , men i dette arbejde, vi har til formål at vise trin for trin hvordan man kan styrke CV teknik af EIS.
EIS outputsignal består af to parametre: reelle og imaginære dele af impedans som funktion af frekvensen17,18,19,20. Det sætter estimering af flere parametre er ansvarlig for beregning overførsel gennem grænsefladen elektrode-løsning: dobbelt lag kapacitans, løsning modstand, gratis overførsel modstand, diffusion impedans og andre parametre afhængigt af systemet undersøgt. Opkræve overførsel modstand var genstand for stor opmærksomhed, da denne parameter er direkte relateret til redox konstanten. Selvom oxidation og reduktion sats konstanter er anslået i løsning, kan de generelt kendetegner evne af et sammensat afgift udveksling. EIS anses for at være en avanceret elektrokemiske teknik kræver dyb matematisk forståelse. Dens vigtigste principper beskrives i moderne elektrokemi litteratur17,18,19,20,21,22,23.
Protocol
1. grundlæggende forberedelse af et elektrokemisk eksperiment
- Forbered 4 mL af en arbejdsgruppe løsning der indeholder 0,1 mol∙L1 Bu4NBF4 og 0.001 mol∙L1 undersøgt organisk forbindelse ved at tilføje beregnede beløb af solid pulvere til 4 mL dichlormethan i et lille fartøj eller et reagensglas. Med 2,8-bis(3,7-dibutyl-10H-phenoxazin-10-yl) dibenzo [b, d] thiophen-S, S-dioxid (molar masse 802 g∙mol1), veje 3.208 mg af dette stof og 0.1645 g af Bu4NBF4.
- Fyld en 3 mL elektrokemiske celler med 2 mL af opløsning ved hjælp af en pipette. Den resterende del af løsningen vil være behov for senere for impedans måling og gengiver resultaterne.
- Polsk en 1 mm diameter platin arbejder disken elektrode (WE) for 30 s ved hjælp af en polering klud fugtet af flere dråber af alumina gylle. Gnid den flade del af disc elektrode med et stykke stof monteret på en immobile støtte (f.eks. petriskål) ved at anvende moderat pres.
- Skyl elektrode med destilleret vand tre gange for at fjerne alumina partikler.
- Bind en counter elektrode (CE, platin wire) i en butan brænder flamme. Omhyggeligt lagt platin wiren i en flamme for mindre end 1 s og fjerne hurtigt når det begynder at rødme for at undgå smelter.
Bemærk: CE areal er ikke fastlagt men skal være meget højere end arbejde elektrode areal. I dette tilfælde impedans af arbejdende elektrode grænseflade ville have den store indvirkning på det samlede system impedans og ville tillade udelukke counter elektrode impedans fra overvejelse.- Bind en referenceelektrode (RE, sølv wire) i butan brænder flamme på samme måde.
- Læg alle tre elektroder (arbejde, counter og reference) ind i en celle, undgå gensidige kontakt og oprette forbindelse til de tilsvarende potentiostat kabler mærket som vi, CE og RE. Indsæt en gas levere rør forbundet med argon gasflaske for yderligere deaeration.
- Åbner gas ventil og deaerate løsning af boblende argon gennem opløsningen i 20 min. tæt gas ventil før måling.
2. foreløbig karakterisering af cyklisk Voltammetry (CVA)
- Registrere CVA af brugsopløsning inden for en potentiel spænder fra −2.0 V til +2.0 V og scan rate 100 mV∙s1.
- Start programmet cyklisk voltammetry i potentiostat software.
- Vælg 0,0 V som potentielle startværdi, −2.0 V som minimal potentielle, +2.0 V som maksimal scanning potentiale, 100 mV∙s1 som afsøgning hastighed. Andre parametre er valgfri.
- Klik på knappen Start.
NOTE: Et typisk voltamogram er præsenteret i figur 1.
- Bestemme den potentielle værdi fra CVA opnået. Bemærk de potentielle værdier, når maxima positive (anodisk peak) og negative (katodisk peak) nuværende vises og beregne den gennemsnitlige værdi.
- Tilføje 10 mg af ferrocene af spatel til fungerende løsning og deaerate det af argon boblende i 5 min. Dette er nødvendigt for at blande og komplet opløsningen af ferrocene tilføjet.
Bemærk: Ferrocene beløb er ikke præcise. Dog ville tilføjer mindre end 1 mg eller mere end 20 mg komplicere estimering af ligevægt potentielle. - Registrere CVA af brugsopløsning inden for den potentielle spænder fra −1.0 V til + 1,0 V og scan rate 100 mV∙s1. En lille Vendbar top af ferrocene vises, som vist i figur 1.
- Bestemme den potentielle værdi af ferrocene Vendbar oxidation fra CVA opnået. Bemærk de potentielle værdier, når maxima positive (anodisk peak) og negative (katodisk peak) nuværende vises og beregne den gennemsnitlige værdi.
- Sætte en anden del af en opløsning fremstillet ved trin 1.1 ind i cellen og rense elektroderne ved at gentage proceduren beskrevet i 1.2-1.7.
3. registrering af impedans spektrum
Bemærk: Et eksempel på opsætning i software er vist i figur 2. enhver anden software eller andre enhed kan også bruges. Men arrangementet setup kan variere i forskellige software, selv om hovedprincipperne forbliver den samme. Bruge EIS i en trappe-mode, dvs potentiostatic spektre registreres automatisk efter hinanden.
- I softwaren, vælge en potentiel række 0,2 V dækker den vendbare top i CVA. Eksempel: En reversibel oxidation peak blev opdaget på CV på 0.7 V. Det potentielle område for CV bør derefter fra 0,6 V til 0,8 V. Spektrene vil være registreret med tilvækst af 0,01 V, dvs på 0,61 V, 0,62 V, osv.
- Registrere EIS automatisk måling procedure under følgende betingelser rådgivet.
- Angiv følgende input værdier: indledende potentielle 0,6 V; afslutte potentielle 0,8 V; potentielle tilvækst: 0,01 V; Frekvensområde: fra 10 kHz gennem 100 Hz; antallet af frekvenser i logaritmisk skala: 20; vente på et tidspunkt mellem spektre: 5 s, ac spænding amplitude 10 mV, minimal 2 foranstaltninger pr. frekvens.
- Klik på knappen Start.
Bemærk: I så fald 21 spektre, hver indeholdende 41 frekvens punkter vil blive opnået. Den typiske sæt af automatisk registrerede spectra er præsenteret i figur 3.
4. analyse af impedans spektrum
- Start programmet EIS spektrumanalysatoren.
- Download spektret ved at vælge fil | Åben.
- I den øverste højre sub rude konstruere en EEC ved hjælp af venstre/højre museklik vælger serie eller parallel forbindelse og nødvendigt element fra kontekstmenuen: C - kondensator, R - modstand, W - Warburg element. Starter fra den enkleste kredsløb (figur 5c).
- Vælg oprindelige minimale og maksimale værdier for parametre af venstre-mus-klikke tabelceller og indtaste værdier: C1 - fra 1∙10-7 til 1∙10-8, R1 - fra 2000 til 100, R2 - fra 1000 til 100, Aw - fra 50000 til 10000.
- Passer til model ved at vælge Model | Passer til. Gentag denne procedure flere gange (normalt omkring 5 gange) indtil de beregnede værdier ikke længere ændre. Parameterværdier er vist i en tabel i den øverste venstre sub vindue.
- Kontrollere parameter fejl vist i den sidste kolonne i tabellen. Hvis en fejl af en parameter overstiger 100%, det betyder, at parameteren ikke er nødvendigt for et kredsløb. I dette tilfælde kan du prøve en anden tilsvarende kredsløb.
Bemærk: Hvis man forsøger at passe en eksperimentel spektrum svarende til den simpelt kredsløb (figur 5c) af en mere kompliceret kredsløb (figur 5en), så fejl af unødvendige yderligere parametre W og R3 ville være betydeligt høj. - Kontroller værdierne af r2(parametrisk) og r2(amplitude) præsenteres i det nederste højre underordnede vindue. Hvis de overskrider grænsen 1∙10−2, Gentag procedurer 4.2−4.5 ved hjælp af en anden tilsvarende elektriske kredsløb (EØF) (figur 5).
- Gentag proceduren 4.1-4.7 for alle spektre registreret
- For hvert spektrum analyseret, nedskrive den beregnede værdi af afgift overførsel modstand og den tilsvarende potentiale, at spektret var registreret på.
5. beregning af Redox sats konstanter
- Sætte værdierne for den anslåede inverse afgift overførsel modstand versus potentiale. En typisk potentielle plot af inverse afgift overførsel modstand for den reversible proces er præsenteret i figur 6.
- Åbn et tomt ark af regneark software.
- Manuelt indtaste værdier af potentialer og tilsvarende værdier af omvendt betalingspligt overførsel modstand i kolonne A og B.
- Vælg rækken A1:B21, og vælg Indsæt | Graf | Pegede af mus klikke på i menuen.
- Afbilde værdier af en teoretisk funktion beregnes af formel (1) på den samme plot. Bruger konstantværdier: F = 96485 C∙mol1, c0 = 0,01 mol∙1, z = 1, R = 8.314 J∙mol1∙K1, α = 0,5, T - omgivende temperatur. Bruge den tidligere anslåede værdi (3.1) E0.
 (1)
(1) (2)
(2)
hvor Rct1 er inverse værdi af afgift overførsel modstand normaliseret af areal; z- antal elektroner overført i ét trin (accepteret at være lig 1); F- Faraday konstant; c 0- koncentration af undersøgte sammensatte; Α - charge overførsel koefficient (accepteret at være lig 0,5); E- elektrode potentiale; parameter θ blev indført for at forenkle den endelige formel vedrørende E og Rct.- Kopier den første kolonne af værdier (mulige værdier) i det samme ark i kolonne D.
- Angiv de konstante værdier af F, c0, z, R, α, T, E0, k0 hyret ovenfor ind celler C1:C8. Brug værdier E0 = 0, k0 = 1∙10−5.
- Indtast formlen (2) for at beregne θ i celle E1: = EXP($C$1*$C$3/($C$4*$C$6)*(D1-$C$7)).
- Kopiere formlen til cellerne E2:E21 ved at vælge E1, klikke på Kopier, vælge vifte E2:E21 og klikke på Indsæt.
- Indtaste formel (1) i celle F1: = $C$8*$C$1^2*$C$3^2/($C$4*$C$6)*$C$2*E1^(1-$C$5)/(1+E1).
- Kopiere formlen til cellerne F2:F21 ved at vælge F1, klikke på Kopier, vælge vifte F2:F21 og klikke på Indsæt.
- Venstre klik på grafen bygget på trin 5.1, vælge Vælg data, derefter Tilføj og tilføje nye datasæt ved at angive, at indtaste D1:D21 som x rækkevidde og F1:F21 som y område.
Bemærk: To grafer: eksperimenterende og simuleret automatisk markeret med forskellige farver vises på en koordinere plot.
- Optimere funktionen teoretiske (1) for at fir eksperimentelle data ved varierende værdier af ligevægt potentielle (E0) og standardsatsen konstant (k0), som parameteren target.
Bemærk: Ændre værdier i celler C7 (E0) og C8 (k0) ville omgående forårsage ændring af simulerede grafen.- Ændre værdierne i cellerne C7 og C8 manuelt for at opnå ligestilling mellem eksperimentelle og simuleret graf.
Bemærk: Ændring af E0 flytter bell-lignende kurve langs x -aksen. Ændring af k0 bestemmer højden af den bell-lignende kurve. Varierende de to eneste parametre kan således bruges til at finde en teoretisk model svarer til eksperimentelle resultater (figur 6). Parameter α (1) Kontroller symmetri af teoretisk peak. Men i rigtige systemer asymmetri kan være forårsaget af forekomsten af side-processen ikke af α. Da det påvirker k0 resultatværdien anbefaler vi ikke at manipulere α værdi og overlade det til lige 0,5.
- Ændre værdierne i cellerne C7 og C8 manuelt for at opnå ligestilling mellem eksperimentelle og simuleret graf.
Representative Results
Det første trin er cyklisk voltammetry karakterisering præsenteret i figur 1. Anvendelse af EIS var vellykket, når forbindelser undergik den hurtigt reversible elektrokemisk proces. Sådan adfærd ofte ikke er blevet overholdt for organiske forbindelser men organiske forbindelser, som besidder electroconductivity i en solid state fandtes for at være en god model for elektrokemisk kinetisk undersøgelse. En sådan organisk forbindelse er vist i indsatser af figur 1.
Registrering af impedans spectra blev udført ud fra eksperimentelle konfigurationen (figur 2), og typisk resulterende rådata er vist i figur 3. Analyse af impedans spectra blev udført ved hjælp af speciel software24. Vinduet af programmet open access EIS spektrum analysator24 under resultater behandling er vist i figur 4. En EEC bruges til at passe spektret er bygget manuelt i vinduet højre øvre sub. De beregnede EEC parametre (resistenser R1 og R2, kapacitans C1 og diffusion impedans parameter W1) er vist i en tabel i venstre øverste underordnede vindue. Grafen i nederste venstre sub vindue illustrerer montering af eksperimentelle resultater (røde punkter) med teoretisk beregnede data plot (grøn linje).
Flere forskellige EEC kan passe eksperimentelle spektrum afhængigt af de processer, der finder sted på elektrode overflade og deres priser (figur 5). Den enkleste semi-uendelig Warburg element kan bruges, da der ikke er nogen fordrejning af løsning (f.eks. rotering af elektrode blanding) og ingen elektrode coating begrænse udbredelsen. I tilfælde af betydelig hurtigt elektrokemiske reaktioner, modstand R3 (figur 5A) var høj nok til at blive forsømt i forhold til andre parallelle grene af EØF (figur 5B). Desuden når afgift overførsel (R2) er betydeligt højere end diffusion, gratis overførsel skridt bliver begrænsende og en endnu enklere EØF (figur 5C) beskriver systemet.
Serien modstand R1 er altid til stede i EØF. Det svarer til den eksterne modstand herunder stik og løsning, undtagen elektrode-overflade interface. Kondensator C1 kendetegner et dobbelt lag dannet på grænsefladen elektrode. Den gren, herunder modstand og Warburg element diffusion impedans (figur 5A) svarer til en hurtig elektrokemisk proces, herunder to etaper: kinetic og diffusion, henholdsvis. Den tredje modstand svarer til en langsommere elektrokemisk proces, der finder sted på elektrode overflade og indebærer opløsningsmiddel eller molekyler, der har undergået en hurtig oxidation eller reduktion. I nogle tilfælde var parametre, R3 og W1 umuligt at anslå. Derefter kan de betragtes som fraværende og ikke tages i betragtning som figur 5B og 5 C Vis.
Selvom EIS giver en vurdering af flere parametre, er målet element, anses i dette arbejde gratis overførsel modstand R2 normalt tildelt som Rct i litteratur17,18,19, der står i parallel til kondensatoren og i serien til Warburg element. Dens afhængighed af spænding er vist i figur 6.
Ifølge teorien om elektrokemiske kinetik (protokol, trin 5.2), er gratis overførsel modstand direkte relateret til den elektrokemiske standardsats konstant. Selvom matching mellem eksperimentelle og teoretiske resultater var ikke ideel, det tilladt skøn over værdien af konstanten elektrokemiske standardsats og defineret værdi af ligevægt potentielle maksimale holdning.
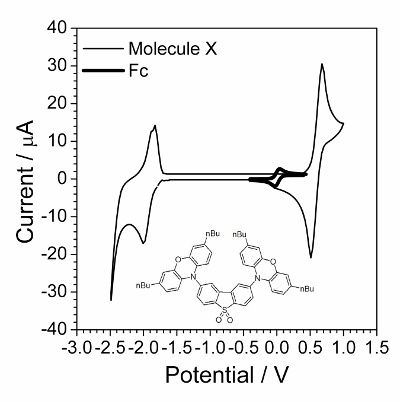
Figur 1 : Cyklisk voltamogram af undersøgte sammensatte overlappes af cyklisk voltamogram i tilstedeværelsen af små beløb af ferrocene. Løsning: 1,0 mol∙L1 Bu4NBF4 og 0,01 mol∙L1 X i dichlormethan. Struktur af sammensatte X (2,8-bis(3,7-dibutyl-10H-phenoxazin-10-yl) dibenzo [b, d] thiophen-S, S-kuldioxid) er vist i indsatsen. Venligst klik her for at se en større version af dette tal.

Figur 2 : Eksperimentel opsætning kontrollere registrering af 20 spectra inden for spændingsområde fra 0,6 til 0,8 V i frekvensområdet fra 10 kHz til 100 Hz med 20 point for hvert tiår. Ejeg, Ef- indledende og afsluttende potentialer henholdsvis N - antal trin, ts- ventetid før hver måling, dt - rekordtid interval, fjeg, ff- indledende og afsluttende frekvens, ND- antal frekvens punkter i et spektrum, Ven- ac amplitude, pw - del af tid i forhold til et punkt registrering bruges til at skifte til en anden frekvens, Net- antal målinger på en frekvens, E range, jeg spænder, båndbredde - tekniske parametre. Venligst klik her for at se en større version af dette tal.

Figur 3 : Scanning af skærmen under impedans spectra registreringen. Øverste højre underordnede vindue: trappe afhængighed af elektrode potentielle på tid. Øverste venstre sub vindue: Nyquist plot, imaginære impedans (ordinat), reel impedans (abciss). Nederste venstre sub vindue: Bode plot, impedans modul (venstre skala), faseskift (højre skala), frekvens (vandrette skala). Venligst klik her for at se en større version af dette tal.

Figur 4 : «EIS Spectrum analyzer» programvinduet under resultater forarbejdning. Øverste venstre sub vindue: parameter værdier tabel: C1 - kapacitans, R1, R2 - resistenser, W1 - Warburg element; nederste venstre sub vindue: eksperimenterende (grønne point) og teoretiske model (rød linje) spectra; øverste højre underordnede vindue: tilsvarende elektrisk kredsløb; nederste højre underordnede vindue: beregnet statistikker for montering. Venligst klik her for at se en større version af dette tal.

Figur 5 : Tilsvarende elektriske kredsløb fundet til at passe impedans spektre af redox processer på elektrode overflade. (A) - Vendbar elektrokemisk proces ledsages af parallelle irreversibel proces, (B) - Vendbar elektrokemisk proces, (C) - elektrokemisk proces med kinetic begrænsning fase. Venligst klik her for at se en større version af dette tal.

Figur 6 : Inverse værdier vederlagsfrit overføre modstand anslået fra EIS versus elektrode potentiale. Linjen skildrer teoretisk forudsagte afhængighed efter formel (2).
Discussion
Denne del af arbejdet vil blive afsat til en forklaring af valgte forsøgsbetingelser og diskussion af mulige anvendelser af metoden præsenteret.
Analyse af impedans spektrum kan udføres af forskellige software. Her drøftes de grundlæggende henstillinger for EØF-analysemetode. Man skal vide, at der er talrige montering algoritmer og forskellige måder at fejl skøn. Vi præsenterer et eksempel på brug af open access software udviklet af A. Bondarenko og G. Ragoisha24 (figur 4).
Nøjagtige skøn over Rct værdi var hovedformålet med arbejdet. En af årsagerne til valget af de eksperimentelle betingelser var en hensigt om at skjule betydning af diffusion. Opløsningens koncentration skulle således være så højt som muligt. Samtidig med at erhverve de eksperimentelle resultater vist her, var koncentrationen begrænset på grund af økonomiske årsager. Vifte af frekvenser fra 10 kHz til 100 Hz blev valgt til at eliminere effekten af diffusion så godt. Diffusion impedans er omvendt proportional med frekvensen, mens modstand ikke er afhængig af frekvensen. Effekten af modstand i den højfrekvente del af spektret var højere end i lavfrekvente del. Spektre var ikke registreret på de frekvenser, der er lavere end 100 Hz, fordi disse data ville være ubrugelig for modstand beregning. Alle de elektrokemiske resultaterne i ikke-vandigt opløsningsmiddel præsenteres versus ferrocene-oxideret / ferrocene kombineret ligevægt potentielle. Af denne grund udføre trin 2,3-2,5.
Vi fandt EIS ansøgning til organiske molekyler karakterisering. Analyse af andre EEC parametre og deres potentielle afhængigheder i perspektiv kan føre til åbenbaring af andre effekter og elektrokemiske karakterisering af forbindelser i løsning. Estimering af redox sats konstanter er nyttige til at beskrive kinetik af electroactive sammensatte reduktion eller oxidation og forudsige materielle adfærd i oxiderende eller reducere medium.
Disclosures
Forfatterne har ikke noget at oplyse.
Acknowledgments
Forfatterne parlamentsarbejdet økonomisk støtte fra "Excilight" projekt "Donor-Acceptor Light Emitting Exciplexes som materialer til Easy-til-skræddersy ultraeffektive OLED lyn" (H2020-MSCA-ITN-2015/674990) finansieret af Marie Skłodowska-Curie Aktioner inden for rammeprogrammet for forskning og innovation "Horisont 2020".
Materials
| Name | Company | Catalog Number | Comments |
| Potentiostat | BioLogic | SP-150 | |
| Platinum disc electrode | eDAQ | ET075 | 1 mm diameter |
| Platinum wire | − | − | counter electrode |
| Silver wire | − | − | silver electrode |
| Electrochemical cell | eDAQ | ET080 | 3 mL volume |
| Polishing cloth | eDAQ | ET030 | |
| Alumina slurry | eDAQ | ET033 | 0.05 µm |
| Butane torch | Portasol | Mini-Torch/Heat Gun | |
| Dichloromethane (DCM) | Sigma-Aldrich | 106048 | |
| Tetrabutylammonium tetrafluoroborate (Bu4NBF4) | Sigma-Aldrich | 86896 |
References
- Cunningham, A. J., Underwood, A. L. Cyclic Voltammetry of the Pyridine Nucleotides and a Series of Nicotinamide Model Compounds. Biochemistry. 6, 266-271 (1967).
- Laba, K., et al. Diquinoline derivatives as materials for potential optoelectronic applications. J Phys Chem C. 119, 13129-13137 (2015).
- Data, P., Lapkowski, M., Motyka, M., Suwinski, J. Electrochemistry and spectroelectrochemistry of a novel selenophene-based monomer. Electrochim Acta. 59, 567-572 (2012).
- Laba, K., et al. Electrochemically induced synthesis of poly(2,6-carbazole). Macromol Rapid Commun. 36, 1749-1755 (2015).
- Data, P., Lapkowski, M., Motyka, M., Suwinski, J. Influence of alkyl chain on electrochemical and spectroscopic properties of polyselenophenes. Electrochim Acta. 87, 438-449 (2013).
- Data, P., Lapkowski, M., Motyka, M., Suwinski, J. Influence of heteroaryl group on electrochemical and spectroscopic properties of conjugated polymers. Electrochim Acta. 83, 271-282 (2012).
- Gora, M., et al. EPR and UV-vis spectroelectrochemical studies of diketopyrrolopyrroles disubstituted with alkylated thiophenes. Synth Met. 216, 75-82 (2016).
- Pluczyk, S., Zassowski, P., Quinton, C., Audebert, P., Alain-Rizzo, V., Lapkowski, M. Unusual Electrochemical Properties of the Electropolymerized Thin Layer Based on a s-Tetrazine-Triphenylamine Monomer. J Phys Chem C. 120, 4382-4391 (2016).
- Data, P., Motyka, M., Lapkowski, M., Suwinski, J., Monkman, A. Spectroelectrochemical Analysis of Charge Carries as a Way of Improving Poly(p-phenylene) Based Electrochromic Windows. J Phys Chem C. 119, 20188-20200 (2015).
- Enengl, S., et al. Spectroscopic characterization of charge carriers of the organic semiconductor quinacridone compared with pentacene during redox reactions. J Mater Chem C. 4, 10265-10278 (2016).
- Piwowar, K., Blacha-Grzechnik, A., Turczyn, R., Zak, J. Electropolymerized phenothiazines for the photochemical generation of singlet oxygen. Electrochim Acta. 141, 182-188 (2014).
- Blacha-Grzechnik, A., Turczyn, R., Burek, M., Zak, J. In situ Raman spectroscopic studies on potential-induced structural changes in polyaniline thin films synthesized via surface-initiated electropolymerization on covalently modified gold surface. Vib Spectrosc. 71, 30-36 (2014).
- Blacha-Grzechnik, A., et al. Phenothiazines grafted on the electrode surface from diazonium salts as molecular layers for photochemical generation of singlet oxygen. Electrochim Acta. 182, 1085-1092 (2015).
- Data, P., et al. Evidence for Solid State Electrochemical Degradation Within a Small Molecule OLED. Electrochim Acta. 184, 86-93 (2015).
- Data, P., et al. Electrochemically Induced Synthesis of Triphenylamine-based Polyhydrazones. Electrochim Acta. 230, 10-21 (2017).
- Data, P., et al. Kesterite Inorganic-Organic Heterojunction for Solution Processable Solar Cells. Electrochim Acta. 201, 78-85 (2016).
- Barsoukov, E., Macdonald, J. R. Impedance Spectroscopy: Theory, Experiment, and Applications. , Wiley. (2005).
- Orazem, M. E., Tribollet, B. Electrochemical Impedance Spectroscopy. , Wiley. (2008).
- Lasia, A. Electrochemical Impedance Spectroscopy and its Applications. , Springer. (2014).
- Bard, A. J., Faulkner, L. R. Electrochemical Methods: Fundamentals and Applications. , Wiley. (2013).
- Scholz, F. Electroanalytical methods: Guide to Experiment and Application. , Springer. (2010).
- Conway, B. E., Bockris, J. O. 'M., White, R. E. Modern Aspects of Electrochemistry. 32, Kluwer Academic Publishers. (2002).
- Encyclopedia of Electrochemistry: V. 3. Instrumentation and Electroanalytical Chemistry. Bard, A. J., Starttman, M., Unwin, P. R. , Wiley. (2003).
- EIS spectrum analyser software. , Available from: http://www.abc.chemistry.bsu.by/vi/analyser (2017).



 (1)
(1) (2)
(2)