Summary
Elektrochemische impedantie spectroscopie (EIS) van soorten die ondergaan omkeerbare oxidatie of reductie in oplossing werd gebruikt voor de bepaling van de snelheidsconstanten oxidatie of reductie.
Abstract
Elektrochemische impedantie spectroscopie (EIS) werd gebruikt voor geavanceerde karakterisering van biologische electroactive verbindingen samen met cyclische voltammetrie (CV). In het geval van snel omkeerbare elektrochemische processen, wordt huidige voornamelijk beïnvloed door het tarief van diffusie, dat de traagste en beperkend fase is. EIS is een krachtige techniek waarmee afzonderlijke analyse van stadia van gratis overdracht die verschillende AC frequentiebereik. Het vermogen van de methode werd gebruikt om de waarde van gratis overdracht weerstand, die het tempo van de uitwisseling van de heffing op de elektrode-oplossing-interface kenmerkt te halen. De toepassing van deze techniek is breed, van biochemie tot organische elektronica. In dit werk presenteren we de methode voor de analyse van organische stoffen van opto-elektronische toepassingen.
Introduction
Redox tarief van de electroactive verbinding is een belangrijke parameter karakteriseren van haar vermogen om oxidatie of reductie processen ondergaan en voorspellen van het gedrag in het bijzijn van sterk oxiderende of reductoren of onder toegepaste potentieel. Toch, allermeest naar de elektrochemische technieken kunnen alleen kwalitatief beschrijven de kinetiek van de redox-proces. Onder verschillende elektrochemische technieken gebruikt voor redox-actieve verbindingen, is karakterisering cyclische voltammetrie (CV) de meest gangbare methode voor snelle en voldoende elektrochemische karakterisatie van verschillende oplosbare soorten1, 2,3. De CV-techniek heeft brede toepassingen, bijvoorbeeldenergieniveaus schattingen4,5,6, de lading dragers analyse ondersteund door spectroscopies7,8, 9 , 10tot12,13van de11,van de oppervlakte wijzigingen. Net als bij elke methode, CV is niet perfect en vergroten de toepasbaarheid en kwaliteit van resultaten, de verbinding met een andere spectroscopische techniek is belangrijk. Al presenteren wij verschillende onderzoeken waar de elektrochemische impedantie spectroscopie (EIS) techniek was werknemer14,15,16 , maar in dit werk, willen we stap voor stap tonen hoe te versterken de CV techniek door EIS.
Het uitgangssignaal van de EIS bestaat uit twee parameters: reële en imaginaire delen van impedantie als functies van frequentie17,18,19,20. Hierdoor schatting van verschillende parameters die verantwoordelijk is voor de gratis overdracht via de interface van de elektrode-oplossing: dubbele laag precisiecapaciteit, oplossing weerstand, gratis overdracht weerstand, diffusie impedantie en andere parameters afhankelijk van systeem onderzocht. Gratis overdracht weerstand was een object van hoge aandacht omdat deze parameter is direct gerelateerd aan de redox constant. Hoewel oxidatie en reductie snelheidsconstanten worden geschat in oplossing, kunnen zij in het algemeen de mogelijkheid van een stof voor gratis uitwisseling karakteriseren. EIS wordt beschouwd als een geavanceerde elektrochemische techniek vereisen diep wiskundig inzicht. Haar belangrijkste beginselen worden beschreven in moderne elektrochemie literatuur17,18,19,20,21,22,23.
Protocol
1. fundamentele voorbereiding van een elektrochemische Experiment
- Bereiden van 4 mL van een werkende oplossing met 0,1 mol∙L−1 Bu4NBF4 en 0,001 mol∙L−1 onderzocht organische verbinding door het toevoegen van berekende bedragen van solide poeders in 4 mL dichloormethaan in een klein schip of een reageerbuis. Weeg met 2,8-bis(3,7-dibutyl-10H-phenoxazin-10-yl) dibenzo [b, d] thiofeen-S, S-dioxide (molmassa 802 g∙mol−1), 3.208 mg van dit samengestelde en 0.1645 Bu4NBF4g.
- Vul een 3 mL elektrochemische cel met 2 mL van de oplossing met behulp van een precisiepipet. Het resterende deel van de oplossing zal moeten later voor impedantie meting en de resultaten weergeven.
- Pools een 1 mm diameter platina werkende schijf elektrode (WE) voor 30 s met een polijst doek bevochtigd door enkele druppels van aluminiumoxide drijfmest. Wrijf het platte oppervlak van de schijf-elektrode met een stuk doek gemonteerd op een immobiele ondersteuning (bijvoorbeeld petrischaal) door toepassing van matige druk uitoefent.
- Spoel de elektrode met gedestilleerd water driemaal om aluminiumoxide deeltjes te verwijderen.
- Ontharden van een teller-elektrode (CE, platina-draad) in een vlam van de brander butaan. De platina-draad zorgvuldig te zetten in een vlam voor minder dan 1 s en wanneer het begint roodheid Voorkom smelten snel te verwijderen.
Opmerking: De CE-oppervlakte is niet bepaald, maar moet veel hoger zijn dan de oppervlakte van de werken-elektrode. In dit geval impedantie van werkende elektrode interface zou de grote invloed hebben op de totale systeem impedantie en zou toestaan met uitzondering van teller elektrode impedantie van overweging.- Ontharden van een referentie-elektrode (RE, zilver draad) in butaan brander vlam op dezelfde manier.
- Zet alle drie elektroden (werken, teller en referentie) in een cel vermijden van wederzijdse contact en verbinden met de corresponderende potentiostaat kabels gemarkeerd als wij, CE en RE. Plaats een buis verbonden met argon gasfles voor verdere Luchtafscheiding leveren gas.
- Open de klep van gas en deaerate oplossing door borrelende argon via de oplossing voor 20 min. dicht de gas klep voor meting.
2. voorlopig karakterisering door cyclische voltammetrie (CVA)
- Registreer de CVA van de werkoplossing in een potentieel bereik van −2.0 V tot +2.0 V en scannen tarief 100 mV∙s−1.
- Start het programma cyclische voltammetrie in de potentiostaat-software.
- Kies 0.0 V als potentiële beginwaarde, −2.0 V als minimale potentiële, +2.0 V als maximale potentieel, 100 mV∙s−1 als scannen tarief scannen. Andere parameters zijn optioneel.
- Klik op de knop Start.
Opmerking: Een typische voltammogram is opgenomen in afbeelding 1.
- Bepaal de potentiële waarde van het CVA verkregen. Opmerking de mogelijke waarden wanneer maxima van positief (anodic piek) en negatieve (kathodische piek) huidige verschijnen en is de gemiddelde waarde berekenen.
- Voeg 10 mg van ferroceen door spatel in de werkoplossing en het deaerate door argon doorgeven voor 5 min. Dit is noodzakelijk voor het mengen en volledige ontbinding van de ferroceen toegevoegd.
Nota: Het bedrag van ferroceen is niet nauwkeurig. Echter zou minder dan 1 mg of meer dan 20 mg toevoegen compliceren schatting van de potentiële evenwicht. - Registreer de CVA van de werkoplossing binnen de potentiële variëren van −1.0 V tot + 1,0 V en scannen tarief 100 mV∙s−1. Een kleine omkeerbare piek van ferroceen zal verschijnen zoals afgebeeld in Figuur 1.
- Bepaal de potentiële waarde van ferroceen omkeerbare oxidatie van de verkregen CVA. Opmerking de mogelijke waarden wanneer maxima van positief (anodic piek) en negatieve (kathodische piek) huidige verschijnen en is de gemiddelde waarde berekenen.
- Zet een ander deel van de oplossing bereid bij stap 1.1 in de cel en schoon de elektroden door het herhalen van de in 1.2-1.7 beschreven procedure.
3. registratie van impedantie Spectrum
Opmerking: Een voorbeeld voor de setup in software wordt weergegeven in Figuur 2; enige andere software of apparaat kan ook worden gebruikt. De setup-regeling kan echter verschillen in verschillende software, hoewel de belangrijkste principes hetzelfde blijven. Gebruik de EIS in de modus van een trap, d.w.z. potentiostatic spectra automatisch achter elkaar worden geregistreerd.
- Kies een potentieel bereik van 0,2 V die betrekking hebben op de omkeerbare piek in CVA in de software. Voorbeeld: Een omkeerbare oxidatie piek is aangetroffen op CV op 0,7 V. Het mogelijke bereik voor CV moet vervolgens van 0,6 V 0,8 V. De spectra zal worden geregistreerd met de toename van 0,01 V, d.w.z. op 0.61 V, 0.62 V, enz.
- Registreer de EIS voor een automatische meetprocedure onder volgende voorwaarden geadviseerd.
- Voer de volgende input waarden: eerste potentiële 0,6 V; voltooien van potentiële 0,8 V; potentiële toename: 0.01 V; Frequentiebereik: vanaf 10 kHz door 100 Hz; het aantal frequenties in logaritmische schaal: 20; wachten op een tijd tussen de spectra: 5 s, ac spanning amplitude 10 mV, minimaal 2 maatregelen per frequentie.
- Klik op de knop Start.
Opmerking: In dat geval 21 spectra, elk met 41 frequentie punten zal worden verkregen. De typische set automatisch geregistreerde spectra wordt gepresenteerd in Figuur 3.
4. analyse van impedantie Spectrum
- Start het programma EIS spectrum analysator.
- Het downloaden van het spectrum door te kiezen voor bestand | Open.
- In de rechter boven sub-venster een EEG te construeren met behulp van de links/rechts muisklik serie of parallel verbinding en noodzakelijk element te kiezen in het contextmenu: C - condensator, R - weerstand, W - Warburg-element. Start vanaf het eenvoudigste circuit (Figuur 5c).
- Initiële minimale en maximale waarden voor parameters door tabelcellen links-muis te klikken en invoeren waarden kiezen: C1 - van 1∙10-7 naar 1∙10-8, R1 - van 2000 tot 100, R2 - van 1000 tot 100, Aw - van 50000 tot 10000.
- Het model passen door te kiezen voor Model | Past. Herhaal de procedure meerdere malen (meestal ongeveer 5 keer) totdat de berekende waarden niet meer wijzigen. Parameterwaarden worden weergegeven in een tabel in het bovenste linker sub-venster.
- Controleer de parameter foutmeldingen in de laatste kolom van de tabel. Als een fout van een parameter groter is dan 100%, dat betekent dat de parameter niet nodig voor een circuit is. Probeer in dat geval een ander gelijkwaardig circuit.
Opmerking: Als men probeert te passen een experimentele spectrum dat overeenkomt met de eenvoudige schakeling (Figuur 5c) door een ingewikkelder circuit (Figuur 5een), dan fouten van geen onnodige extra parameters W en R3 zou aanzienlijk hoog. - Controleer de waarden van r2(parametrische) en r2(amplitude) gepresenteerd in de lagere juiste sub-venster. Als ze groter zijn dan de limiet 1∙10−2, herhaalt u de procedures 4.2−4.5 met behulp van een andere gelijkwaardige elektrische circuit (EEG) (Figuur 5).
- Herhaal de procedure 4.1-4.7 voor alle de spectra geregistreerd
- Voor elke spectrum geanalyseerd, noteer de berekende waarde van gratis overdracht weerstand en de bijbehorende mogelijkheden die het spectrum is geregistreerd.
5. berekening van de snelheidsconstanten Redox
- Zet de waarden van de geschatte omgekeerde heffing overdracht weerstand tegenover potentieel. Een typische potentiële plot van de omgekeerde heffing overdracht weerstand voor het omkeerbaar proces is voorgesteld in Figuur 6.
- Open een leeg blad van spreadsheet-software.
- Handmatig invoeren van de waarden van het potentieel en de bijhorende waarden van verlegging overdracht weerstand in de kolommen A en B.
- Selecteer het bereik A1:B21 en kies invoegen | Grafiek | Wees met de muis op te klikken in het menu taak.
- Uitzetten van de waarden van een theoretische functie berekend met de formule (1) op hetzelfde terrein. Constante waarden gebruikt: F = 96485 C∙mol−1, c0 = 0,01 mol∙−1, z = 1, R = 8.314 J∙mol−1∙K−1, α = 0,5, T - omgevingstemperatuur. Gebruik de eerder geraamde waarde E-0(3.1).
 (1)
(1) (2)
(2)
waar Rct−1 is inverse waarde van gratis overdracht weerstand genormaliseerd door de oppervlakte; z- aantal elektronen overgebracht in één stap (aanvaard wordt gelijk 1); F- constante van Faraday; c 0- concentratie van de onderzochte stof; Α - gratis overdracht coëfficiënt (aanvaard wordt gelijk 0,5); E- elektrode potentiële; parameter θ werd ingevoerd om de definitieve formule E en Rctbetreffende vereenvoudigen.- De eerste kolom met waarden (mogelijke waarden) kopiëren in hetzelfde blad in kolom D.
- Voer de constante waarden van F, c0, z, R, α, T, E0 k0 meldde boven in cellen C1:C8. Gebruik waarden E0 = 0, k0 = 1∙10−5.
- Invoeren van de formule (2) voor het berekenen van θ in cel E1: = EXP($C$1*$C$3/($C$4*$C$6)*(D1-$C$7)).
- Kopieert de formule naar cellen E2:E21 door E1 selecteren klikken, kopiëren, selecteren van reeks E2:E21 en te klikken op Plakken.
- Formule (1) invoeren in cel F1: = $C$8*$C$1^2*$C$3^2/($C$4*$C$6)*$C$2*E1^(1-$C$5)/(1+E1).
- Kopieert de formule naar cellen F2:F21 door F1 selecteren klikken, kopiëren, selecteren van reeks F2:F21 en te klikken op Plakken.
- Klik met de linkermuisknop op de grafiek gebouwd bij stap 5.1, kies Kies gegevens, dan toevoegen en nieuwe gegevensset toevoegen door te geven D1:D21 als x-bereik en F1:F21 als y bereik invoeren.
Opmerking: Twee grafieken: experimentele en gesimuleerde automatisch gemarkeerd door verschillende tekstkleuren eruit zullen zien op een coördinaat perceel.
- Optimaliseer de theoretische functie (1) om experimentele gegevens van de spar door verschillende waarden van evenwicht potentiële (E0) en standaardtarief constante (k0), wordt de parameter target.
Opmerking: Wijzigen van de waarden in de cellen C7 (E0) en C8 (k0) zou onmiddellijk leiden tot verandering van de gesimuleerde grafiek.- Waarden in de cellen C7 en C8 handmatig wijzigen om gelijkheid tussen experimentele en gesimuleerde grafiek te bereiken.
Opmerking: Verandering van E0 beweegt de bell-achtige curve langs de x -as. Verandering van k0 bepaalt de hoogte van de bell-achtige curve. Dus, variërend van de twee enige parameters kan worden gebruikt om te vinden van een theoretisch model dat overeenkomt met de experimentele resultaten (Figuur 6). Met de parameter α (1) besturingselementen symmetrie van theoretische piek. Echter, in echte systemen asymmetrie kan worden veroorzaakt door de aanwezigheid van kant-proces in plaats van α. Aangezien het resulterende k0 waarde beïnvloedt raden wij niet te manipuleren α waarde en laat het gelijk aan 0,5.
- Waarden in de cellen C7 en C8 handmatig wijzigen om gelijkheid tussen experimentele en gesimuleerde grafiek te bereiken.
Representative Results
De eerste stap is cyclische voltammetrie karakterisering gepresenteerd in Figuur 1. Toepassing van EIS was succesvol wanneer verbindingen onderging het snel omkeerbare elektrochemische proces. Dergelijk gedrag is vaak niet waargenomen voor organische verbindingen maar organische verbindingen die electroconductivity in een vaste toestand in het bezit bleek te zijn een goed model voor elektrochemische kinetisch onderzoek. Één dergelijke organische verbinding wordt weergegeven in de inzet van Figuur 1.
Registratie van impedantie spectra werd uitgevoerd volgens de experimentele opzet (Figuur 2) en typische ruwe resulterende gegevens zijn afgebeeld in Figuur 3. Analyse van impedantie spectra werd uitgevoerd met behulp van speciale software24. Het venster van het programma van de open access EIS Spectrum analysator24 tijdens resultaten verwerking wordt weergegeven in Figuur 4. Een EEG gebruikt om aan te passen van het spectrum is handmatig gebouwd in de rechter boven sub-venster. De berekende parameters van de EEG (weerstanden R1 en R2, precisiecapaciteit C1 en diffusie impedantie parameter W1) worden weergegeven in een tabel in de linker bovenste sub-venster. De grafiek in het lagere linker sub-venster illustreert montage van experimentele resultaten (rode punten) met de theoretisch berekende gegevens plot (groene lijn).
Verscheidene verschillende EEG kan passen experimentele spectrum afhankelijk van de processen die op het oppervlak van de elektrode en hun tarieven (Figuur 5 plaatsvinden). De eenvoudigste semi-oneindige Warburg element kan gebruikt worden als niet verstoring van oplossing leidt (bijvoorbeeld roteren van het mengen van de elektrode) en geen coating van de elektrode beperking van de verspreiding. In het geval van aanzienlijk snel elektrochemische reacties, weerstand R3 (Figuur 5A) was hoog genoeg te verwaarlozen in vergelijking met andere parallelle vertakkingen van de EEG (Figuur 5B). Bovendien, wanneer overdrachtssnelheid lading (R2) beduidend hoger dan de verspreiding is, de gratis overdracht stap wordt beperken en een nog eenvoudiger EEG (Figuur 5C) beschrijft het systeem.
De serie weerstand R1 is altijd aanwezig in EEG. Het komt overeen met de externe weerstand met inbegrip van de verbindingslijnen en oplossing, met uitzondering van de elektrode-oppervlak interface. Condensator C1 kenmerkt een dubbele laag gevormd op het raakvlak van de elektrode. De tak met inbegrip van de weerstand en Warburg element diffusie impedantie (Figuur 5A) komt overeen met een snel elektrochemische proces met inbegrip van twee fasen: kinetische en diffusie, respectievelijk. De derde weerstand komt overeen met een langzamer elektrochemische proces dat plaatsvindt op het oppervlak van de elektrode en omvat oplosmiddel of moleculen die snelle oxidatie of reductie hebben ondergaan. In sommige gevallen waren de parameters, R3 en W1 onmogelijk te schatten. Ze kunnen worden beschouwd als afwezig is en geen rekening zoals blijkt uit figuur 5B en 5 C .
Hoewel EIS een schatting van verschillende parameters biedt, is het doelelement dat wordt beschouwd als in dit werk gratis overdracht weerstand R2 meestal toegewezen als Rct in literatuur17,18,19, die staat parallel aan de condensator en in serie aan Warburg element. De afhankelijkheid van spanning wordt getoond in Figuur 6.
Volgens de theorie van elektrochemische kinetiek (Protocol, stap 5.2), is gratis overdracht weerstand direct gerelateerd aan de constante elektrochemische standaardtarief. Hoewel matching tussen experimentele en theoretische resultaten was niet ideaal, schatting van de waarde van de constante elektrochemische standaardtarief toegestaan en de waarde van potentiële evenwicht door maximale positie gedefinieerd.
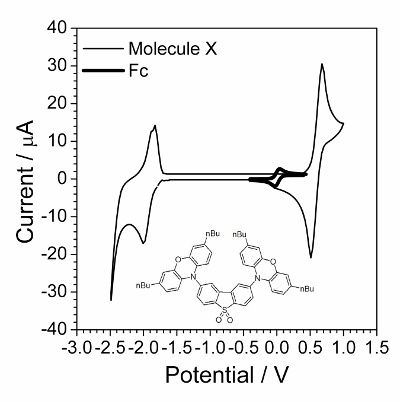
Figuur 1 : Cyclische voltammogram van onderzochte stof overlapt door cyclische voltammogram in aanwezigheid van een kleine hoeveelheid van ferroceen. Oplossing: 1.0 mol∙L−1 Bu4NBF4 en 0,01 mol∙L−1 X in dichloormethaan. Structuur van samengestelde X (2,8-bis(3,7-dibutyl-10H-phenoxazin-10-yl) dibenzo [b, d] thiofeen-S, S-kooldioxide) wordt weergegeven in de inzet. Klik hier voor een grotere versie van dit cijfer.

Figuur 2 : Experimentele opzet beheren registratie van 20 spectra binnen het spanningsbereik van 0,6 tot 0,8 V in het frequentiebereik van 10 kHz tot 100 Hz met 20 punten voor elk decennium. Ei, Ef- eerste en laatste potentieel respectievelijk N - aantal stappen, ts- wachttijd vóór elke meting, dt - record tijdsinterval, fik, ff- eerste en laatste frequentie, N-D- nummer van frequentie punten in een spectrum Veen- ac amplitude, pw - deel van tijd met betrekking tot een punt registratie gebruikt om te schakelen naar een andere frequentie, Neen- aantal metingen op één frequentie, E-range, I reeks, bandbreedte - technische parameters. Klik hier voor een grotere versie van dit cijfer.

Figuur 3 : Scannen van scherm tijdens de registratie van de spectra van de impedantie. Bovenste juiste sub-venster: afhankelijkheid van de trap van elektrode potentiële op tijd. Bovenste links sub-venster: Nyquist-plot, denkbeeldige impedantie (coördinatie), echte impedantie (abciss). Lagere links sub-venster: Bode-plot, faseverschuiving (juiste schaal), impedantie module (links) en frequentie (horizontale schaal). Klik hier voor een grotere versie van dit cijfer.

Figuur 4 : «EIS Spectrum-analyzer» programmavenster tijdens resultaten verwerken. Bovenste links sub-venster: parameter waarden tabel: C1 - capaciteit, R1, R2 - weerstanden, W1 - Warburg element; lagere links sub-venster: experimentele (groene punten) en theoretisch model (rode lijn) spectra; bovenste juiste sub-venster: gelijkwaardig elektrisch circuit; lagere juiste sub-venster: Statistieken over montage berekend. Klik hier voor een grotere versie van dit cijfer.

Figuur 5 : Gelijkwaardig contactstoppen gevonden aan de impedantie spectra van redox processen op het oppervlak van de elektrode. (A) - omkeerbare elektrochemische proces begeleid door parallelle onomkeerbaar proces, (B) - omkeerbare elektrochemische proces, (C) - elektrochemische proces met het stadium van de kinetische beperking. Klik hier voor een grotere versie van dit cijfer.

Figuur 6 : Inverse waarden kosteloos overdracht van resistentie geschatte vanuit EIS versus elektrode potentieel. De lijn toont theoretisch voorspelde afhankelijkheid volgens formule (2).
Discussion
Dit deel van het werk zal worden besteed aan een stemverklaring gekozen proefomstandigheden en bespreking van de mogelijke toepassingen van de methode gepresenteerd.
Analyse van impedantie spectrum kan worden uitgevoerd door verschillende software. De fundamentele aanbevelingen voor EEG-analysemethode worden hier besproken. Men moet weten dat er talrijke montage algoritmen en verschillende manieren van fout schatting. Presenteren we een voorbeeld van het gebruik van open access-software ontwikkeld door A. Bondarenko en G. Ragoisha24 (Figuur 4).
Exacte schatting van de waarde van Rct was de belangrijkste doelstelling van het werk. Een van de redenen voor de keuze van de experimentele omstandigheden was een bedoeling te verhullen van het effect van diffusie. De concentratie van de oplossing moest dus, zo hoog mogelijk. Tijdens het verwerven van de experimentele resultaten die hier worden weergegeven, was de concentratie beperkt vanwege economische redenen. Het bereik van frequenties van 10 kHz tot 100 Hz werd gekozen om te elimineren van het effect van diffusie zo goed. Diffusie impedantie is omgekeerd evenredig met de frequentie terwijl weerstand niet afhankelijk van de frequentie is. Het effect van de weerstand in de hoge-frequentie-deel van het spectrum was hoger dan in het deel van de lage frequentie. Spectra werden niet geregistreerd op de frequenties lager dan 100 Hz, omdat deze gegevens zou nutteloos voor de berekening van de weerstand. Alle de elektrochemische resultaten verkregen in niet-waterige oplosmiddelen worden gepresenteerd ten opzichte van ferroceen geoxideerd / ferroceen combinatie evenwicht potentiële. Om deze reden, worden stappen 2.3-2.5 uitgevoerd.
We hebben overwogen EIS toepassing op karakterisering van organische moleculen. Analyse van andere EEG-parameters en hun mogelijke afhankelijkheden in perspectief kan leiden tot de openbaring van andere effecten en elektrochemische karakterisering van stoffen in oplossing. Schatting van de snelheidsconstanten redox is nuttig voor het beschrijven van de kinetiek van electroactive samengestelde verlaging of oxidatie en voorspellen van materiaalgedrag in oxiderende of vermindering van medium.
Disclosures
De auteurs hebben niets te onthullen.
Acknowledgments
De auteurs erkennen dankbaar de financiële steun van "Excilight" project "Donor-Acceptor Light Emitting Exciplexes als materialen voor Easy-te-op-maat ultra-efficiënte OLED Lightning" (H2020-MSCA-ITN-2015/674990) gefinancierd door Marie Skłodowska-Curie Acties binnen het kaderprogramma voor onderzoek en innovatie "Horizon 2020".
Materials
| Name | Company | Catalog Number | Comments |
| Potentiostat | BioLogic | SP-150 | |
| Platinum disc electrode | eDAQ | ET075 | 1 mm diameter |
| Platinum wire | − | − | counter electrode |
| Silver wire | − | − | silver electrode |
| Electrochemical cell | eDAQ | ET080 | 3 mL volume |
| Polishing cloth | eDAQ | ET030 | |
| Alumina slurry | eDAQ | ET033 | 0.05 µm |
| Butane torch | Portasol | Mini-Torch/Heat Gun | |
| Dichloromethane (DCM) | Sigma-Aldrich | 106048 | |
| Tetrabutylammonium tetrafluoroborate (Bu4NBF4) | Sigma-Aldrich | 86896 |
References
- Cunningham, A. J., Underwood, A. L. Cyclic Voltammetry of the Pyridine Nucleotides and a Series of Nicotinamide Model Compounds. Biochemistry. 6, 266-271 (1967).
- Laba, K., et al. Diquinoline derivatives as materials for potential optoelectronic applications. J Phys Chem C. 119, 13129-13137 (2015).
- Data, P., Lapkowski, M., Motyka, M., Suwinski, J. Electrochemistry and spectroelectrochemistry of a novel selenophene-based monomer. Electrochim Acta. 59, 567-572 (2012).
- Laba, K., et al. Electrochemically induced synthesis of poly(2,6-carbazole). Macromol Rapid Commun. 36, 1749-1755 (2015).
- Data, P., Lapkowski, M., Motyka, M., Suwinski, J. Influence of alkyl chain on electrochemical and spectroscopic properties of polyselenophenes. Electrochim Acta. 87, 438-449 (2013).
- Data, P., Lapkowski, M., Motyka, M., Suwinski, J. Influence of heteroaryl group on electrochemical and spectroscopic properties of conjugated polymers. Electrochim Acta. 83, 271-282 (2012).
- Gora, M., et al. EPR and UV-vis spectroelectrochemical studies of diketopyrrolopyrroles disubstituted with alkylated thiophenes. Synth Met. 216, 75-82 (2016).
- Pluczyk, S., Zassowski, P., Quinton, C., Audebert, P., Alain-Rizzo, V., Lapkowski, M. Unusual Electrochemical Properties of the Electropolymerized Thin Layer Based on a s-Tetrazine-Triphenylamine Monomer. J Phys Chem C. 120, 4382-4391 (2016).
- Data, P., Motyka, M., Lapkowski, M., Suwinski, J., Monkman, A. Spectroelectrochemical Analysis of Charge Carries as a Way of Improving Poly(p-phenylene) Based Electrochromic Windows. J Phys Chem C. 119, 20188-20200 (2015).
- Enengl, S., et al. Spectroscopic characterization of charge carriers of the organic semiconductor quinacridone compared with pentacene during redox reactions. J Mater Chem C. 4, 10265-10278 (2016).
- Piwowar, K., Blacha-Grzechnik, A., Turczyn, R., Zak, J. Electropolymerized phenothiazines for the photochemical generation of singlet oxygen. Electrochim Acta. 141, 182-188 (2014).
- Blacha-Grzechnik, A., Turczyn, R., Burek, M., Zak, J. In situ Raman spectroscopic studies on potential-induced structural changes in polyaniline thin films synthesized via surface-initiated electropolymerization on covalently modified gold surface. Vib Spectrosc. 71, 30-36 (2014).
- Blacha-Grzechnik, A., et al. Phenothiazines grafted on the electrode surface from diazonium salts as molecular layers for photochemical generation of singlet oxygen. Electrochim Acta. 182, 1085-1092 (2015).
- Data, P., et al. Evidence for Solid State Electrochemical Degradation Within a Small Molecule OLED. Electrochim Acta. 184, 86-93 (2015).
- Data, P., et al. Electrochemically Induced Synthesis of Triphenylamine-based Polyhydrazones. Electrochim Acta. 230, 10-21 (2017).
- Data, P., et al. Kesterite Inorganic-Organic Heterojunction for Solution Processable Solar Cells. Electrochim Acta. 201, 78-85 (2016).
- Barsoukov, E., Macdonald, J. R. Impedance Spectroscopy: Theory, Experiment, and Applications. , Wiley. (2005).
- Orazem, M. E., Tribollet, B. Electrochemical Impedance Spectroscopy. , Wiley. (2008).
- Lasia, A. Electrochemical Impedance Spectroscopy and its Applications. , Springer. (2014).
- Bard, A. J., Faulkner, L. R. Electrochemical Methods: Fundamentals and Applications. , Wiley. (2013).
- Scholz, F. Electroanalytical methods: Guide to Experiment and Application. , Springer. (2010).
- Conway, B. E., Bockris, J. O. 'M., White, R. E. Modern Aspects of Electrochemistry. 32, Kluwer Academic Publishers. (2002).
- Encyclopedia of Electrochemistry: V. 3. Instrumentation and Electroanalytical Chemistry. Bard, A. J., Starttman, M., Unwin, P. R. , Wiley. (2003).
- EIS spectrum analyser software. , Available from: http://www.abc.chemistry.bsu.by/vi/analyser (2017).



 (1)
(1) (2)
(2)