Summary
Elektrochemische Impedanz Spektroskopie (EIS) von Arten, die eine reversible Oxidation oder Reduktion in Lösung durchlaufen wurde zur Bestimmung der Geschwindigkeitskonstanten der Oxidation oder Reduktion verwendet.
Abstract
Elektrochemische Impedanz Spektroskopie (EIS) diente für fortgeschrittene Charakterisierung organischer Elektroaktive Substanzen zusammen mit zyklischer Voltammetrie (CV). Bei schnell reversible elektrochemische Prozesse ist Strom überwiegend durch die Rate der Diffusion, betroffen ist die langsamste und begrenzende Bühne. EIS ist eine leistungsstarke Technik, die separate Analyse der Phasen der Ladungstransfer ermöglicht es, die verschiedenen AC Frequenzgang haben. Die Fähigkeit der Methode wurde verwendet, um den Wert der Ladung Übergangswiderstand, kennzeichnet die Rate der LADUNGSAUSTAUSCH auf der Elektrode-Solution-Schnittstelle zu extrahieren. Die Anwendung dieser Technik ist breit und von Biochemie bis zur organischen Elektronik. In dieser Arbeit präsentieren wir die Methode der Analyse organischer Verbindungen für optoelektronische Anwendungen.
Introduction
Redox-Rate der Elektroaktive Verbindung ist ein wichtiger Parameter charakterisieren seine Fähigkeit, Oxidation oder Reduktion Prozesse durchlaufen und sein Verhalten in Gegenwart von starken Oxidations- oder Reduktionsmittel oder unter angewandter Potenzial vorherzusagen. Die meisten elektrochemischen Techniken sind jedoch nur in der Lage, die Kinetik der Redox-Prozess qualitativ zu beschreiben. Unter verschiedenen elektrochemischen Techniken für Redox Wirkstoffe eingesetzt ist Charakterisierung zyklischer Voltammetrie (CV) die vorherrschende Methode für schnelle und ausreichende elektrochemische Charakterisierung von verschiedenen löslichen Arten1, 2,3. Die CV-Technik hat breite Anwendungen, z.B., Energieniveaus Schätzungen4,5,6, die kostenlos-Träger-Analyse unterstützt durch Spectroscopies7,8, 9 , 10, bis Oberflächenmodifikationen11,12,13. Wie jede Methode CV ist nicht perfekt und um die Anwendbarkeit und die Qualität der Ergebnisse zu erhöhen, die Verbindung mit einem anderen spektroskopischen Technik ist wichtig. Wir bereits stellen mehrere Untersuchungen wo war die elektrochemische Impedanz Spektroskopie (EIS) Technik beschäftigt14,15,16 , aber in dieser Arbeit wollten wir Schritt für Schritt zeigen, wie man stärken die CV-Technik durch EIS.
Das EIS-Ausgangssignal besteht aus zwei Parametern: Teile von Real- und Imaginärteil der Impedanz als Funktion der Frequenz17,18,19,20. Es ermöglicht Abschätzung der mehrere Parameter verantwortlich für Ladungstransfer durch die Elektrode-Solution-Schnittstelle: Doppel-Schicht Kapazität, Lösung Widerstand, kostenlos Übergangswiderstand, Verbreitung Impedanz und anderen Parametern abhängig vom System untersucht. Kostenlos Übergangswiderstand war ein Gegenstand der hohe Aufmerksamkeit, da dieser Parameter die Redox-Geschwindigkeitskonstante direktem Zusammenhang steht. Obwohl Oxidation und Reduktion Geschwindigkeitskonstanten in Lösung geschätzt sind, können sie in der Regel die Möglichkeit einer Verbindung für LADUNGSAUSTAUSCH charakterisieren. EIS wird als eine fortgeschrittene elektrochemische Technik erfordern tiefgreifendes mathematisches Verständnis. Die wichtigsten Grundsätze sind in modernen Elektrochemie Literatur17,18,19,20,21,22,23beschrieben.
Protocol
1. grundlegende Vorbereitung eines elektrochemischen Versuchs
- Bereiten Sie eine funktionierende Lösung mit 0,1 Mol∙L−1 Bu4NBF4 4 mL und 0,001 Mol∙L−1 organische Verbindung, die durch Zugabe von berechneten Beträge von soliden Pulvern in 4 mL Dichlormethan in ein kleines Schiff oder ein Reagenzglas untersucht. Wiegen Sie mit 2,8-bis(3,7-dibutyl-10H-phenoxazin-10-yl) Dibenzo [b, d] Thiophen-S, S-Kohlendioxid (molare Masse 802 G∙mol−1) 3,208 mg dieser Verbindung und 0,1645 g Bu4NBF4.
- Füllen Sie eine elektrochemische Zelle 3 mL mit 2 mL der Lösung mit einer Pipette. Der restliche Teil der Lösung benötigt werden später für die Impedanzmessung und die Ergebnisse zu reproduzieren.
- Polnischen ein 1 mm Durchmesser Platin CD Arbeitselektrode (WE) für 30 s mit einem Poliertuch durch einige Tropfen Alumina Gülle befeuchtet. Reiben Sie die Fläche der CD-Elektrode mit einem Stück Stoff durch mäßigen Druck auf eine immobile Unterstützung (z.B. Petrischale) montiert.
- Spülen Sie die Elektrode mit destilliertem Wasser dreimal Aluminiumoxid Partikel zu entfernen.
- Glühen Sie eine Gegenelektrode (CE, Platindraht) in eine Butan-Brenner-Flamme. Setzen Sie sorgfältig die Platindraht in eine Flamme für weniger als 1 s und schnell zu entfernen, wenn es beginnt, Rötung um schmelzen zu vermeiden.
Hinweis: Die CE-Oberfläche ist nicht vorgeschrieben aber muss viel höher sein als die Fläche an der Arbeitselektrode. In diesem Fall Impedanz der Elektrode Benutzeroberfläche hätte erhebliche Auswirkungen auf das Gesamtsystem Impedanz und Zähler Elektrode Impedanz von der Betrachtung mit Ausnahme zulassen würde.- Tempern Sie Referenzelektrode (RE, Silberdraht) im Butan brennerflamme in gleicher Weise.
- Legen Sie alle drei Elektroden (Arbeits-, Zähler und Referenz) in eine Zelle, die Vermeidung von gegenseitigen Kontakt und schließen Sie an die entsprechenden potentiostaten Kabel gekennzeichnet als wir, CE und RE. Legen Sie eine Gas Schlauch verbunden mit Argon-Gas-Flasche für weitere Entgasung zu liefern.
- Öffnen Sie das Gasventil und Entlüften Sie Lösung von sprudelnden Argon durch die Lösung für 20 min. in der Nähe das Gasventil vor der Messung.
2. vorläufige Charakterisierung durch zyklische Voltammetrie (CVA)
- Registrieren den CVA die Arbeitslösung in einem möglichen Bereich von −2.0 V bis + 2,0 V und scan-Rate 100 mV∙s−1.
- Starten Sie das Programm zyklischer Voltammetrie in der potentiostaten Software.
- Wählen Sie 0,0 V als potenzielle Anfangswert, −2.0 V als minimal mögliche, + 2,0 V als maximale Scan-Potenzial, 100 mV∙s−1 als Scan-Rate. Andere Parameter sind optional.
- Klicken Sie auf die Schaltfläche starten.
Hinweis: Eine typische Voltammogram ist in Abbildung 1dargestellt.
- Bestimmen Sie den potenziellen Wert aus den CVA erhalten. Beachten Sie die möglichen Werte, wenn Maxima positiv (anodischen Peak) und negativ (kathodische Peak) erscheinen und berechnen Sie den Mittelwert.
- Fügen Sie 10 mg von Ferrocen von Spachtel in die Arbeitslösung und durch Argon für 5 min sprudeln entlüften. Dies ist notwendig für das Mischen und vollständige Auflösung der das Ferrocen hinzugefügt.
Hinweis: Die Menge Ferrocen ist nicht präzise. Allerdings würde das Hinzufügen von weniger als 1 mg oder mehr als 20 mg Abschätzung der potenziellen Gleichgewicht erschweren. - Registrieren den CVA die Arbeitslösung im möglichen Bereich von −1.0 V bis + 1,0 V und scan-Rate 100 mV∙s−1. Eine kleine reversible Spitze des Ferrocen wird angezeigt, wie in Abbildung 1dargestellt.
- Bestimmen Sie den potenziellen Wert des Ferrocen reversible Oxidation von den CVA erhalten. Beachten Sie die möglichen Werte, wenn Maxima positiv (anodischen Peak) und negativ (kathodische Peak) erscheinen und berechnen Sie den Mittelwert.
- Setzen Sie ein weiterer Teil der Lösung vorbereitet bei Schritt 1.1 in die Zelle und reinigen Sie die Elektroden in 1,2 bis 1,7 beschriebene Verfahren wiederholen.
3. die Anmeldung des Impedanz-Spektrums
Hinweis: Ein Beispiel für die Einstellung in der Software ist in Abbildung 2dargestellt; keine andere Software oder Gerät kann auch verwendet werden. Die Setup-Anordnung kann jedoch in verschiedene Software abweichen, obwohl die wichtigsten Grundsätze gleich bleiben. Das EIS in einem Treppenhaus-Modus verwenden, d. h. potentiostatischer Spektren werden automatisch nacheinander registriert.
- Wählen Sie in der Software ein Potentialbereich von 0,2 V für die reversible Spitze im CVA. Beispiel: Eine reversible Oxidation Spitze wurde auf CV bei 0,7 V erkannt. Dann sollte der mögliche Bereich für CV von 0,6 V bis 0,8 V. Die Spektren werden registriert mit der Schrittweite von 0,01 V, d. h. bei 0,61 V, 0,62 V, etc..
- Registrieren Sie das EIS automatische Messverfahren unter folgenden Bedingungen empfohlen.
- Geben Sie die folgenden Eingabewerte: erste potenzielle 0,6 V; Beenden Sie potenzielle 0,8 V; mögliche Erhöhung: 0,01 V; Frequenzbereich: von 10 kHz bis 100 Hz; die Anzahl der Frequenzen im logarithmischen Maßstab: 20; warten Sie eine Zeit zwischen den Spektren: 5 s, Ac Spannung Amplitude 10 mV, minimal 2 Messbecher pro Frequenz.
- Klicken Sie auf die Schaltfläche starten.
Hinweis: In diesem Fall 21 Spektren jeweils 41 Frequenz Punkte erhält man. Der typische Satz automatisch registrierten Spektren wird in Abbildung 3dargestellt.
4. Analyse der Impedanz-Spektrum
- Starten Sie das Programm EIS Spektrum Analysator.
- Das Spektrum durch die Wahl Datei herunterladen | Offene.
- Im rechten oberen Fenster "Sub" erstellen eine EEC mit Links/rechts-Mausklick seriell oder Parallel Anschluss und notwendiges Element aus dem Kontextmenü wählen: C - Kondensator, R - Widerstand, W - Warburg-Element. Die einfachste Schaltung (Abbildung 5c) beginnen.
- Wählen Sie erste minimale und maximale Werte für Parameter durch linken Mausklick Tabellenzellen und Eingabe Werte: C1 - 1∙10-7 bis 1∙10-8, R1 - von 2000 bis 100, R2 - von 1000 bis 100, Aw - von 50000 bis 10000.
- Passen Sie das Modell durch die Wahl Modell | Passen. Wiederholen Sie den Vorgang mehrmals (in der Regel ca. 5 mal), bis die berechneten Werte nicht mehr ändern. Parameterwerte werden in einer Tabelle in der oberen linken Teilfenster angezeigt.
- Überprüfen Sie in der letzten Spalte der Tabelle angezeigten Parameterfehler. Wenn ein Fehler eines Parameters von mehr 100 als % bedeutet, dass die Parameter nicht für eine Schaltung erforderlich ist. Versuchen Sie in diesem Fall ein anderes Ersatzschaltbild.
Hinweis: Wenn man versucht, eine experimentelle Spektrum entspricht die einfache Schaltung (Abbildung 5c) durch eine komplizierte Schaltung (Abbildung 5eine) passen, dann Fehler unnötiger zusätzlicher Parameter W und R3 erheblich wäre hoch. - Überprüfen Sie die Werte von R2(parametrische) und R-2(Amplitude) in der unteren rechten Unterfenster vorgestellt. Überschreiten sie Grenzen 1∙10−2, wiederholen Sie das Verfahren 4.2−4.5 mit einem anderen elektrischen Ersatzschaltbild (EWG) (Abbildung 5).
- Wiederholen Sie den Vorgang 4.1-4.7 für alle Spektren registriert
- Notieren Sie für jedes Spektrum analysiert den berechneten Wert der Ladung Übergangswiderstand und das entsprechende Potenzial, dem das Spektrum an registriert wurde.
5. Berechnung der Redox-Geschwindigkeitskonstanten
- Setzen Sie die Werte für die geschätzte inverse kostenlos Übergangswiderstand versus Potenzial. Ein typisches potenziellen Plot der Übergangswiderstand inverse kostenlos für den reversiblen Prozess ist in Abbildung 6dargestellt.
- Öffnen Sie ein leeres Blatt Tabellenkalkulations-Software.
- Geben Sie manuell die Werte von Potentialen und entsprechenden Werte des reverse-Charge-Transfer-Widerstand in Spalten A und B.
- Wählen Sie den Bereich A1:B21 und Einfügen | Grafik | Spitz durch Mausklick in die Task-Menü.
- Zeichnen Sie die Werte einer theoretischen Funktion berechnet nach der Formel (1) auf dem gleichen Grundstück. Verwenden Sie Konstante Werten: F = 96485 C∙mol−1, c0 = 0,01 Mol∙−1, Z = 1, R = 8.314 J∙mol−1∙K−1, α = 0,5 T - Umgebungstemperatur. Verwenden Sie die zuvor geschätzten Wert E0(3.1).
 (1)
(1) (2)
(2)
wo ist Rct−1 Umkehrwert der Ladung Übergangswiderstand durch Fläche normiert; Z- Anzahl der Elektronen in einem Schritt übertragen (entgegengenommen gleich 1); F- Faraday-Konstante; c 0- Konzentration der untersuchten Substanz; Α - Charge-Transfer-Koeffizient (akzeptiert gleich 0,5); E- Elektrode Potenzial; Parameters θ wurde eingeführt, um die endgültige Formel im Zusammenhang mit E und Rctzu vereinfachen.- Kopieren Sie die erste Spalte von Werten (mögliche Werte) in demselben Blatt in Spalte D.
- Geben Sie die Konstante Werte von F, c0, Z, R, α, T, E0, k0 eingetragen oben in Zellen C1:C8. Verwendung Werte E0 = 0, k0 = 1∙10-5.
- Geben Sie die Formel (2) zur Berechnung der θ in Zelle E1: = EXP($C$1*$C$3/($C$4*$C$6)*(D1-$C$7)).
- Kopieren Sie die Formel in Zellen E2:E21 E1 auswählen, indem Kopieren, Bereich E2:E21 auszuwählen und klicken auf Einfügen.
- Geben Sie die Formel (1) in Zelle F1: = $C$8*$C$1^2*$C$3^2/($C$4*$C$6)*$C$2*E1^(1-$C$5)/(1+E1).
- Kopieren Sie die Formel in Zellen F2:F21 F1 auswählen, indem Kopieren, Bereich F2:F21 auszuwählen und klicken auf Einfügen.
- Klicken Sie Links auf die Grafik am Schritt 5.1 gebaut, wählen Sie Wählen Sie Daten, dann Hinzufügen und neue Datensatz durch Eingabe von D1:D21 als x-Reihe und F1:F21 als y-Bereich angeben.
Hinweis: Zwei Diagramme: experimentelle und simulierten automatisch markiert durch verschiedene Farben erscheint auf einem Grundstück koordinieren.
- Die theoretische Funktion (1) um Tanne experimentellen Daten von unterschiedlichen Werten des Gleichgewichts potenzielle (E0) und der standard Rate konstant (k0), wird der Target-Parameter zu optimieren.
Hinweis: Ändern der Werte in Zellen C7 (E0) und C8 (k0) würde sofort bewirken die simulierte Kurve.- Ändern Sie Werte in Zellen C7 und C8 zur Erreichung der Gleichstellung von experimentellen und simulierten Diagramm manuell.
Hinweis: Änderung der E0 bewegt sich die glockenartige Kurve entlang der x-Achse . Änderung der k0 steuert die Höhe der glockenartigen Kurve. So kann unterschiedlich diese beiden einzigen Parameter verwendet werden, ein theoretisches Modell entsprechend Versuchsergebnisse (Abbildung 6) zu finden. Parameter α (1) Steuerelemente Symmetrie des theoretischen Peak. Jedoch kann in realen Systemen Asymmetrie durch das Auftreten von Seite-Prozess nicht durch α verursacht werden. Da es k0 Ergebniswert beeinflusst empfehlen wir nicht zu manipulieren α-Wert und lassen Sie es gleich 0,5.
- Ändern Sie Werte in Zellen C7 und C8 zur Erreichung der Gleichstellung von experimentellen und simulierten Diagramm manuell.
Representative Results
Der erste Schritt ist zyklischer Voltammetrie Charakterisierung in Abbildung 1dargestellt. Anwendung von EIS war erfolgreich, wenn Verbindungen schnell reversiblen elektrochemischen Prozess unterzogen. Ein solches Verhalten war oft nicht beachtet, für organische Verbindungen, sondern organische Verbindungen, die Leitfähigkeit in einen festen Zustand besitzen wurde festgestellt, dass eine gute Probe für elektrochemische kinetische Untersuchung werden. Eine solche organische Verbindung ist in den Einschub der Abbildung 1dargestellt.
Registrierung der Impedanz Spektren erfolgte nach der Versuchsanordnung (Abbildung 2), und typische resultierende Rohdaten sind in Abbildung 3dargestellt. Analyse der Impedanz Spektren erfolgte mit Spezialsoftware24. Das Fenster des open-Access-Programms EIS Spektrum Analysator24 während Ergebnisse Verarbeitung ist in Abbildung 4dargestellt. Eine EEC verwendet, um das Spektrum passen ist manuell im rechten oberen Fenster "Sub" gebaut. Die berechneten EEC-Parameter (Widerstände R1 und R2, Kapazität C1 und Verbreitung Impedanz-Parameter W1) werden in einer Tabelle in der linken oberen Teilfenster angezeigt. Die Grafik im unteren linken Teilfenster zeigt Einbau von experimentellen Ergebnissen (rote Punkte) mit der theoretisch berechneten Daten Handlung (grüne Linie).
Mehrere verschiedene EEC passt möglicherweise experimentelle Spektrum abhängig von den Prozessen, die auf der Elektrodenoberfläche und ihre Preise (Abbildung 5) stattfinden. Die einfachste Semi-infiniten Warburg-Element kann verwendet werden, da es keine Verzerrung der Lösung (z. B. rotierende Elektrode mischen) und keine Begrenzung der Verbreitung elektrodenumhüllung. Im Falle erheblich schnell elektrochemische Reaktionen, Widerstand R3 (Abb. 5A) war hoch genug, um im Vergleich zu anderen parallelen Zweigen der EWG (Abb. 5B) vernachlässigt werden. Darüber hinaus Wenn Ladungstransfer (R2) deutlich höher als Diffusion beträgt, kostenlos Transfer Schritt wird zu begrenzen und eine noch einfachere EWG (Abbildung 5C) beschreibt das System.
Der Vorwiderstand R1 ist immer präsent in der EWG. Es entspricht den externen Widerstand einschließlich Stecker und Lösung, außer Elektrodenoberfläche Schnittstelle. Kondensator C1 charakterisiert eine Doppelschicht an der Elektrode Schnittstelle gebildet. Die Niederlassung einschließlich Widerstand und Warburg Element Verbreitung Impedanz (Abb. 5A) entspricht einer schnell elektrochemischen Prozess, einschließlich zwei Phasen: kinetische und Diffusion, beziehungsweise. Der dritte Widerstand entspricht ein langsamer elektrochemischen Prozess, der findet auf der Elektrodenoberfläche und beinhaltet Lösungsmittel oder Moleküle, die schnelle Oxidation oder Reduktion unterzogen wurden. In einigen Fällen wurden Parameter, R3 und W1 unmöglich abzuschätzen. Dann könnten sie als nicht vorhanden angesehen und als Abbildung 5 b und 5 C -Show nicht berücksichtigt.
Obwohl EIS eine Schätzung von mehreren Parametern darstellt, ist das Target-Element in diesem Werk gilt kostenfrei Transfer Widerstand R2 in der Regel als Rct in Literatur17,18,19zugeordnet, dem steht der Kondensator parallel und in Serie Warburg-Element. Die Abhängigkeit der Spannung ist in Abbildung 6dargestellt.
Nach der Theorie der elektrochemischen Kinetik (Protokoll, Schritt 5.2) ist kostenlos Übergangswiderstand der standard elektrochemische Geschwindigkeitskonstante direkt verwandt. Obwohl zwischen experimentellen und theoretischen passende Ergebnisse war nicht ideal, es erlaubt die Schätzung des Wertes der elektrochemischen Normalsatz Konstante und definiert den Wert der potenziellen Gleichgewicht durch maximale Position.
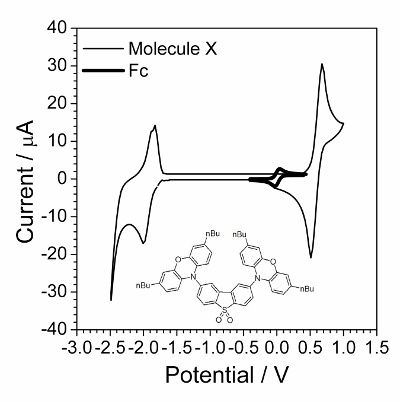
Abbildung 1 : Zyklische Voltammogram untersuchten Verbindung von zyklischen Voltammogram in kleinen Mengen von Ferrocen überlappt. Lösung: 1,0 Mol∙L−1 Bu4NBF4 und 0,01 Mol∙L−1 X in Dichlormethan. Struktur von zusammengesetzten X (2,8-bis(3,7-dibutyl-10H-phenoxazin-10-yl) Dibenzo [b, d] Thiophen-S, S-Kohlendioxid) wird im Einschub angezeigt. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2 : Versuchsaufbau controlling Registrierung von 20 Spektren im Spannungsbereich von 0,6 bis 0,8 V im Frequenzbereich von 10 kHz bis 100 Hz mit 20 Punkte für jedes Jahrzehnt. Eich, Ef- Anfangs- und Endwert Potentiale bzw. N - Anzahl der Schritte, ts- Wartezeit vor jeder Messung, dt - Rekordzeit Intervall, fich, ff- erste und letzte Frequenz, ND- Frequenz Punkte in einem Spektrum, Vein- Ac Amplitude, Pw - Teil Zeit in Bezug auf einen Punkt Registrierung verwendet, um auf eine andere Frequenz, Nein- Anzahl der Messungen bei einer Frequenz, E Palette wechseln ich reichen, Bandbreite - technische Parameter. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 3 : Der Bildschirm während der Impedanz Spektren Registrierung scannen. Oberen rechten Teilfenster: Treppe Abhängigkeit von der Elektrode mögliche Zeit. Oberen linken Teilfenster: Ortskurve, imaginäre Impedanz (Ordinate), echte Impedanz (Abciss). Unteren linken Teilfenster: Bode Plot, Impedanz-Modul (linke Skala), Phasenverschiebung (rechte Skala), Frequenz (horizontale Skalierung). Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 4 : «EIS Spectrum Analyzer» Programmfenster während Ergebnisse Verarbeitung. Oberen linken Teilfenster: Parameter-Werte-Tabelle: C1 - Kapazität, R1, R2 - Widerstände, W1 - Warburg-Element; unteren linken Teilfenster: experimentelle (grüne Punkte) und theoretisches Modell (rote Linie) Spektren; oberen rechten Teilfenster: elektrische Ersatzschaltbild; unteren rechten Teilfenster: Statistiken des Formstücks berechnet. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 5 : Entsprechende elektrische Schaltungen gefunden um die Impedanz-Spektren von redoxprozessen auf der Elektrodenoberfläche passen. (A) - reversible elektrochemische Prozess begleitet von parallelen irreversibler Prozess, (B) - reversible elektrochemische Prozess, (C) - elektrochemischen Prozess mit kinetischen Einschränkung Bühne. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 6 : Inverse Werte unentgeltlich übertragen Widerstand gegen Elektrode Potenzial von EIS geschätzt. Die Linie zeigt theoretisch vorhergesagten Abhängigkeit nach Formel (2).
Discussion
Dieser Teil der Arbeit wird eine Erklärung des gewählten Versuchsbedingungen und Diskussion über mögliche Anwendungen der vorgestellten Methode gewidmet.
Analyse der Impedanz Spektrum kann von verschiedenen Software durchgeführt werden. Hier werden die grundsätzlichen Empfehlungen für EEC-Analyse-Methode besprochen. Man muss wissen, dass es zahlreiche passende Algorithmen und verschiedene Möglichkeiten der Fehlerschätzung. Wir präsentieren Ihnen ein Beispiel der Verwendung von open-Access-Software, entwickelt von A. Bondarenko und G. Ragoisha24 (Abbildung 4).
Genaue Schätzung der R-ct -Wert war das Hauptziel der Arbeit. Einer der Gründe für die Wahl der Versuchsbedingungen wurde eine Absicht, die Auswirkungen der Diffusion zu verbergen. So mussten die Lösungskonzentration so hoch wie möglich sein. Beim Erwerb der hier gezeigten Versuchsergebnisse, beschränkte sich die Konzentration aus wirtschaftlichen Gründen. Der Frequenzbereich von 10 kHz bis 100 Hz wurde gewählt, um den Effekt der Diffusion sowie zu eliminieren. Diffusion-Impedanz ist umgekehrt proportional zur Frequenz, Widerstand ist zwar nicht abhängig von der Frequenz. Die Wirkung des Widerstands in der Hochfrequenz-Teil des Spektrums war höher als im niederfrequenten Bereich. Spektren wurden bei den Frequenzen unter 100 Hz nicht registriert, da diese Daten für die Berechnung der Widerstand nutzlos wäre. Die elektrochemische Ergebnisse in nichtwässrigen Lösungsmittel sind im Vergleich zu Ferrocen oxidiert präsentiert / Ferrocen Gleichgewicht potenzielle gekoppelt. Aus diesem Grund werden Schritte 2,3 bis 2,5 durchgeführt.
Wir betrachteten EIS Anwendung zur Charakterisierung organischer Moleküle. Analyse der anderen EEC-Parameter und deren möglichen Abhängigkeiten in Perspektive führen zu die Offenbarung des anderen Effekten und elektrochemische Charakterisierung von Verbindungen in Lösung. Schätzung der Redox-Geschwindigkeitskonstanten eignet sich für die Kinetik der Elektroaktive zusammengesetzte Reduktion oder Oxidation Beschreibung und Vorhersage Materialverhalten in oxidierende oder Medium zu reduzieren.
Disclosures
Die Autoren haben nichts preisgeben.
Acknowledgments
Die Autoren dankbar anerkennen die finanzielle Unterstützung der "Excilight" Projekt "Donor-Akzeptor Light Emitting Exciplexes als Material für die Easy-Schneider Hocheffiziente OLED-Lightning" (H2020-MSCA-ITN-2015/674990) finanziert durch Marie Skłodowska-Curie Aktionen innerhalb des Rahmenprogramms für Forschung und Innovation "Horizon 2020".
Materials
| Name | Company | Catalog Number | Comments |
| Potentiostat | BioLogic | SP-150 | |
| Platinum disc electrode | eDAQ | ET075 | 1 mm diameter |
| Platinum wire | − | − | counter electrode |
| Silver wire | − | − | silver electrode |
| Electrochemical cell | eDAQ | ET080 | 3 mL volume |
| Polishing cloth | eDAQ | ET030 | |
| Alumina slurry | eDAQ | ET033 | 0.05 µm |
| Butane torch | Portasol | Mini-Torch/Heat Gun | |
| Dichloromethane (DCM) | Sigma-Aldrich | 106048 | |
| Tetrabutylammonium tetrafluoroborate (Bu4NBF4) | Sigma-Aldrich | 86896 |
References
- Cunningham, A. J., Underwood, A. L. Cyclic Voltammetry of the Pyridine Nucleotides and a Series of Nicotinamide Model Compounds. Biochemistry. 6, 266-271 (1967).
- Laba, K., et al. Diquinoline derivatives as materials for potential optoelectronic applications. J Phys Chem C. 119, 13129-13137 (2015).
- Data, P., Lapkowski, M., Motyka, M., Suwinski, J. Electrochemistry and spectroelectrochemistry of a novel selenophene-based monomer. Electrochim Acta. 59, 567-572 (2012).
- Laba, K., et al. Electrochemically induced synthesis of poly(2,6-carbazole). Macromol Rapid Commun. 36, 1749-1755 (2015).
- Data, P., Lapkowski, M., Motyka, M., Suwinski, J. Influence of alkyl chain on electrochemical and spectroscopic properties of polyselenophenes. Electrochim Acta. 87, 438-449 (2013).
- Data, P., Lapkowski, M., Motyka, M., Suwinski, J. Influence of heteroaryl group on electrochemical and spectroscopic properties of conjugated polymers. Electrochim Acta. 83, 271-282 (2012).
- Gora, M., et al. EPR and UV-vis spectroelectrochemical studies of diketopyrrolopyrroles disubstituted with alkylated thiophenes. Synth Met. 216, 75-82 (2016).
- Pluczyk, S., Zassowski, P., Quinton, C., Audebert, P., Alain-Rizzo, V., Lapkowski, M. Unusual Electrochemical Properties of the Electropolymerized Thin Layer Based on a s-Tetrazine-Triphenylamine Monomer. J Phys Chem C. 120, 4382-4391 (2016).
- Data, P., Motyka, M., Lapkowski, M., Suwinski, J., Monkman, A. Spectroelectrochemical Analysis of Charge Carries as a Way of Improving Poly(p-phenylene) Based Electrochromic Windows. J Phys Chem C. 119, 20188-20200 (2015).
- Enengl, S., et al. Spectroscopic characterization of charge carriers of the organic semiconductor quinacridone compared with pentacene during redox reactions. J Mater Chem C. 4, 10265-10278 (2016).
- Piwowar, K., Blacha-Grzechnik, A., Turczyn, R., Zak, J. Electropolymerized phenothiazines for the photochemical generation of singlet oxygen. Electrochim Acta. 141, 182-188 (2014).
- Blacha-Grzechnik, A., Turczyn, R., Burek, M., Zak, J. In situ Raman spectroscopic studies on potential-induced structural changes in polyaniline thin films synthesized via surface-initiated electropolymerization on covalently modified gold surface. Vib Spectrosc. 71, 30-36 (2014).
- Blacha-Grzechnik, A., et al. Phenothiazines grafted on the electrode surface from diazonium salts as molecular layers for photochemical generation of singlet oxygen. Electrochim Acta. 182, 1085-1092 (2015).
- Data, P., et al. Evidence for Solid State Electrochemical Degradation Within a Small Molecule OLED. Electrochim Acta. 184, 86-93 (2015).
- Data, P., et al. Electrochemically Induced Synthesis of Triphenylamine-based Polyhydrazones. Electrochim Acta. 230, 10-21 (2017).
- Data, P., et al. Kesterite Inorganic-Organic Heterojunction for Solution Processable Solar Cells. Electrochim Acta. 201, 78-85 (2016).
- Barsoukov, E., Macdonald, J. R. Impedance Spectroscopy: Theory, Experiment, and Applications. , Wiley. (2005).
- Orazem, M. E., Tribollet, B. Electrochemical Impedance Spectroscopy. , Wiley. (2008).
- Lasia, A. Electrochemical Impedance Spectroscopy and its Applications. , Springer. (2014).
- Bard, A. J., Faulkner, L. R. Electrochemical Methods: Fundamentals and Applications. , Wiley. (2013).
- Scholz, F. Electroanalytical methods: Guide to Experiment and Application. , Springer. (2010).
- Conway, B. E., Bockris, J. O. 'M., White, R. E. Modern Aspects of Electrochemistry. 32, Kluwer Academic Publishers. (2002).
- Encyclopedia of Electrochemistry: V. 3. Instrumentation and Electroanalytical Chemistry. Bard, A. J., Starttman, M., Unwin, P. R. , Wiley. (2003).
- EIS spectrum analyser software. , Available from: http://www.abc.chemistry.bsu.by/vi/analyser (2017).



 (1)
(1) (2)
(2)